治疗与溶酶体贮积病相关的神经系统症状的方法
1.本发明涉及使用式(i)的奎宁环化合物(任选地与酶替代疗法组合)治疗或预防与例如溶酶体贮积病相关的特定症状和障碍的方法。所述方法增强受试者脑内的神经元连接性,增加脑组织体积或预防或延迟受试者的脑组织体积损失。本发明还涉及监测神经系统障碍的进展或消退或评估与溶酶体贮积病相关的神经系统障碍的发作的方法,其中测量了受试者的脑组织体积。
背景技术:
2.溶酶体贮积病
3.溶酶体贮积病(lsd)是一组由溶酶体功能缺陷引起的约50种罕见遗传代谢疾病。通常,患有lsd的患者由于负责代谢底物的酶缺乏或缺陷或者由于适当酶功能所必需的酶激活剂的缺乏而在溶酶体中积累了有害水平的底物(即贮积的物质)。大多数lsd是由通常参与脂质或糖蛋白代谢的酶的单个酶缺陷或缺乏引起的。一些更常见的lsd包括戈谢病(gaucher disease)、法布里病(fabry disease)和尼曼-皮克病(niemann-pick disease)(c型)。戈谢病、法布里病和尼曼-皮克病是鞘脂类代谢障碍的例子。这些疾病中的每一种都与直接或间接由潜在的遗传缺陷引起的一群症状相关。结果,通常难以预测与每种疾病相关的哪种症状或障碍可以用不同的治疗方法有效地治疗。在几种lsd中常见的症状包括眼扫视运动的改变、认知功能障碍和步态障碍(诸如共济失调)。这些症状在戈谢病(例如3型)和尼曼-皮克病(c型)中尤其常见。
4.戈谢病(gd)是一种罕见的常染色体隐性的溶酶体贮积病。gd患者具有在编码葡糖苷酰鞘氨醇酶(gc)(也称为β葡糖脑苷脂酶)的gba1基因中的突变。该酶负责将鞘糖脂分解成其组分,诸如将葡糖神经酰胺(glc;也称为葡糖脑苷脂)分解为葡萄糖和神经酰胺。单核细胞和巨噬细胞具有特别高含量的含有glc的溶酶体,并且在gd患者中,这些细胞变得肿大并积累了毒性浓度的glc。这些所谓的“戈谢细胞”累积在几个器官中,包括骨骼、骨髓、脾脏、肝脏、肺和脑。从系统上讲,这会导致脾肿大、肝肿大、贫血、血小板减少症、白细胞减少症、骨质减少症、骨坏死和其他病理异常。
5.戈谢病有三种亚型,它们在发作年龄、严重程度和神经系统表现的存在方面有所不同。1型戈谢病(gd-1)(非神经病变型gd)是最常见的形式,诊断时年龄中值为28岁,并且预期寿命轻微缩短。在gd-1中,gc酶保留了一些功能,并且没有神经系统受累。2型gd(gd-2)是急性神经病变型gd,在婴儿期间诊断,有严重的神经系统受累,并且通常在出生后的头两年内死亡。与gd-1相比,2型患者的gc酶功能受损更加严重。3型gd(gd-3)是慢性神经病变型gd,在儿童期间诊断,神经系统受累逐渐恶化,并且预期寿命通常不超过30岁。gd-3的症状包括脾脏和肝脏异常、疲劳、出血、癫痫发作和核上凝视麻痹。gd-3患者的神经系统表现在疾病过程中逐渐发展。更使人虚弱的特征之一是凝视麻痹,这是控制眼扫视运动的神经元通路的缺陷。在疾病的早期阶段期间,水平扫视会减慢。疾病进展为完全水平扫视麻痹伴有不同程度的垂直扫视麻痹。gd-3患者中的vor也可能受损。所述疾病的这些特征对gd-3患者的生活质量具有深远的影响,并且可能阻碍教育和就业前景。
6.gd-1和gd-3的现有治疗仅限于使用伊米苷酶(imiglucerase)、维拉苷酶(velaglucerase)或他利苷酶(taliglucerase)的重组酶替代疗法(ert)、以及使用麦格司他(miglustat)或依利格鲁司他(eliglustat)的底物减少疗法(srt)。参见例如lunawati l.bennett和chris fellner,pharmacotherapy of gaucher disease:current and future options,p&t 43(5):274-280,309(2018)。伊米苷酶(主要治疗方案)是人gc的重组版本,由中国仓鼠卵巢细胞制成,并且每1-2周通过缓慢静脉内注射(通常在1-2小时内)施用。其已经于1998年在美国上市。维拉苷酶是另一种重组人gc类似物,这种类似物在纤维肉瘤细胞系中制成,并且其于2010年获得fda批准。他利苷酶类似,使用遗传修饰的胡萝卜植物根细胞制成,并且自2012年以来已获批准。这些治疗全部都需要在医院或其他医疗环境中进行iv施用,并且重组酶不能穿过血脑屏障,因此不能治疗gd的神经系统症状。因此,虽然这些ert方案已证明对治疗gd-1患者有效,但在gd-3患者中,它们仅对治疗所述疾病的非神经系统症状有效。
7.底物减少疗法是治疗gd的替代性方法。该疗法的目标是通过抑制负责合成glc的酶来减少glc的积累。葡糖神经酰胺合酶(gcs)(也称为udp-葡萄糖神经酰胺合酶)是催化神经酰胺的初始糖基化步骤形成葡糖神经酰胺的酶。
8.gcs抑制剂已被提议用于治疗多种疾病,包括糖脂贮积病和溶酶体贮积病(包括戈谢病)。参见例如wo 2005/068426(actelion pharm.有限公司)。麦格司他(zavesca)是一种亚氨基葡萄糖gcs抑制剂。其是一种n-烷基化的亚氨基糖并且充当gcs的可逆竞争性抑制剂,在酶的活性位点中结合。虽然其是为了治疗gd、gd-2和gd-3的神经病变形式而开发的,但fda仅批准其用于治疗患有轻度至中度gd-1的患者,并且仅作为二线疗法(患者必须不能接受ert治疗)。尽管麦格司他确实会穿过血脑屏障,但在临床试验中,发现其在治疗gd-3的神经系统表现方面无效。依利格鲁司他也是gcs抑制剂,并且其是神经酰胺的类似物。它仅被fda批准用于治疗gd-1患者的全身性症状。
9.尼曼-皮克病c型(npc)也是一种溶酶体贮积病。尽管其原因与戈谢病非常不同,但在一些方面净结果是相似的。npc是由npc1或npc2基因的突变引起的。npc1是一种膜蛋白,其介导将胆固醇细胞内运输到溶酶体后目的地。具体而言,npc1与npc2协同起作用以促进胆固醇从内体/溶酶体区室中流出。已经从晚期内体/溶酶体的腔中的低密度脂蛋白释放的未酯化胆固醇被npc2转移到npc1的胆固醇结合口袋。大约95%的npc患者具有npc1的突变,而其余的大多数具有npc2的突变。这种破坏的胆固醇运输的影响之一是胆固醇和鞘糖脂(包括glc)在肝脏、脾脏和脑细胞中的积累。npc(如同gd-3一样)的标志之一是核上凝视麻痹的进行性发展,包括水平和垂直的扫视麻痹。
10.通常与扫视凝视麻痹相关的另一组疾病和障碍包括gm2-神经节苷脂贮积病(诸如泰-萨克斯病(tay sachs disease)、sandhoff病和ab变体gm2神经节苷脂贮积病)。
11.与戈谢病类似,gm2神经节苷脂贮积病是以鞘糖脂代谢中的遗传缺陷为标志的溶酶体贮积病。gm2神经节苷脂贮积病以负责将gm2分解为gm3的酶即己糖胺酶a和/或其辅因子gm2激活剂蛋白的缺陷为标志。gm2和gm3是相关的神经节苷脂,它们是同一代谢途径的一部分,在该代谢途径中葡糖神经酰胺被降解为神经酰胺。因此,gm3是通过逐步过程制成的,该过程从将神经酰胺转化为葡糖神经酰胺(通过glc)开始,随后转化为半乳糖基-葡糖神经酰胺,随后转化为gm3(n-乙酰基-a-神经酰胺基-半乳糖基-葡糖神经酰胺),随后转化为gm2
(n-乙酰基-半乳糖基n-乙酰基-a-神经酰胺基-半乳糖基-葡糖神经酰胺)。因此,gm2的病理性积累是gm2神经节苷脂贮积病的标志,因此可以通过gcs抑制剂来改善,所述gcs抑制剂抑制葡糖神经酰胺的早期合成步骤。
12.本文所述的奎宁环化合物具有作为酶即葡糖神经酰胺合酶(gcs)抑制剂的活性。已经披露这些化合物通常可用于治疗溶酶体贮积病(诸如法布里病、戈谢病和尼曼-皮克病)。参见例如wo 2012/129084和u.s.2016/0361301。
13.本领域中确实需要开发可有效减轻或管理与戈谢病3型相关的神经系统症状的治疗剂。
技术实现要素:
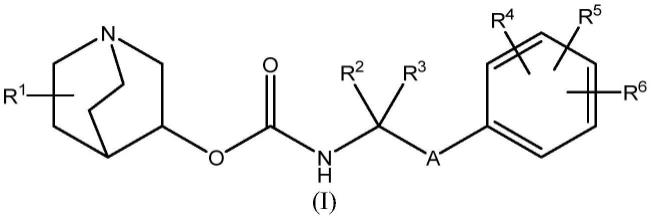
14.本发明涉及一种根据式(i)的奎宁环化合物(化合物1),
[0015][0016]
或其药学上可接受的盐或前药,其中:
[0017]
r1选自氢、卤素(例如,氟)、氰基、硝基、羟基、硫代、氨基、c
1-6-烷基(例如,甲基或乙基)、c
2-6-烯基、c
2-6-炔基、c
1-6-烷氧基、c
2-6-烯氧基和c
2-6-炔氧基,其中所述烷基、烯基、炔基、烷氧基、烯氧基或炔氧基任选地被选自卤素、氰基、硝基、羟基、硫代和氨基的一个或多个(例如,1、2或3个)基团取代;
[0018]
r2和r3独立地选自c
1-3-烷基,所述烷基任选地被一个或多个(例如,1、2或3个)卤素取代,或者r2和r3一起形成环丙基或环丁基基团,所述环丙基或环丁基基团任选地被一个或多个(例如,1或2个)卤素取代;
[0019]
r4、r5和r6各自独立地选自氢、卤素、硝基、羟基、硫代、氨基、c
1-6-烷基和c
1-6-烷氧基,其中所述烷基或烷氧基任选地被选自卤素、羟基、氰基和c
1-6-烷氧基的一个或多个(例如,1、2或3个)基团取代;并且
[0020]
a是5元或6元芳基或杂芳基基团,所述芳基或杂芳基任选地被独立选自卤素、羟基、硫代、氨基、硝基、c
1-6
烷氧基和c
1-6
烷基的1、2或3个基团取代。
[0021]
在第一个方面,本技术提供了一种治疗或预防受试者(诸如有需要的受试者)的与溶酶体贮积病相关的认知功能障碍和/或步态异常(包括共济失调)的方法,所述方法包括向所述受试者施用有效量的如本文所述的奎宁环化合物,例如根据式(i)的化合物。在其他方面,本技术还提供了本文所述的奎宁环化合物用于治疗或预防与溶酶体贮积病相关的认知功能障碍和/或步态异常(包括共济失调)和/或用于制造治疗或预防与溶酶体贮积病相关的认知功能障碍和/或步态异常(包括共济失调)的药物的用途。
[0022]
在第二个方面,本技术提供了一种增强受试者(诸如有需要的受试者)的脑内神经元连接性的方法,所述方法包括向所述受试者施用有效量的如本文所述的奎宁环化合物,例如根据式(i)的化合物。在其他方面,本技术还提供了本文所述的奎宁环化合物用于增强
受试者脑内的神经元连接性和/或用于制造增强受试者脑内的神经元连接性的药物的用途。
[0023]
在第三个方面,本技术提供了一种增加受试者(诸如有需要的受试者)的脑组织体积或预防或延迟脑组织体积损失的方法,所述方法包括向所述受试者施用有效量的如本文所述的奎宁环化合物,例如根据式(i)的化合物。在其他方面,本技术还提供了本文所述的奎宁环化合物用于增加有需要的受试者的脑组织体积或预防或延迟脑组织体积损失和/或用于制造增加有需要的受试者的脑组织体积或预防或延迟脑组织体积损失的药物的用途。
[0024]
在第四个方面,本技术提供了一种监测与受试者的溶酶体贮积病相关的神经系统障碍的进展或消退的方法,其中所述受试者正在接受治疗,所述治疗包括向所述受试者施用有效量的如本文所述的奎宁环化合物,例如式(i)的化合物;所述方法包括例如使用容积磁共振成像(vmri)测量在治疗过程中的一个时间段内受试者的脑组织体积,并且评估该时间段内的脑组织体积的任何变化的程度。
[0025]
在第五个方面,本技术提供了一种评估有风险患上所述神经系统障碍的受试者的与溶酶体贮积病相关的神经系统障碍的发作的方法,所述方法包括:a)测量受试者的脑组织体积(例如,使用vmri)并且与参考标准进行比较以评估脑组织体积是否低于所述参考标准;和b)在步骤(a)中鉴定出的脑组织体积低于所述参考标准的情况下,鉴定所述神经系统障碍的发作;所述方法任选地还包括:c)通过向所述受试者施用有效量的如本文所述的奎宁环化合物(例如式(i)的化合物)或其药学上可接受的盐或前药来开始所述受试者的治疗。
[0026]
本文所公开的化合物、组合物和方法的另外的特征和优点从以下详细描述中将变得清楚。
具体实施方式
[0027]
尽管本公开文本的特定的实施方案现在将参考制备和方案进行描述,但是应当理解,此类实施方案仅通过举例的方式,并且仅对可以代表本公开文本原理的应用的许多可能的特定实施方案中的少量进行说明。考虑到本公开文本的益处,多种变化和修饰对于本领域技术人员来说将是显而易见的,并且如在所附权利要求中进一步定义的,所述多种变化和修饰被认为是在本公开文本的精神和范围内。
[0028]
定义
[0029]
除非另外定义,否则本文所用的全部技术和科学术语具有与本公开文本所属领域的普通技术人员通常所理解的相同的意义。尽管在本发明的实施和测试中可以使用任何与本文所述的那些相似或等同的方法和材料,但现在描述示例性的方法、装置和材料。本文所引用的所有技术和专利出版物均都通过引用以其整体并入本文。本文的任何内容都不应解释为承认本发明因在先发明而无权早于此类披露内容。
[0030]
除非另有指示,否则本公开文本的实践将采用组织培养、免疫学、分子生物学、微生物学、细胞生物学和重组dna的常规技术,这些在本领域的技能之内。
[0031]
所有数字标记,例如,ph、温度、时间、浓度、分子量(包括范围)都是近似值,其在适当的情况下改变( )或(-)0.1或1.0的增量。应理解,尽管不总是明确说明,所有数字标记前面具有术语“约”。还应理解,尽管不总是明确说明,本文所述的试剂仅是示例性的并且此类
试剂的等效物是本领域已知的。
[0032]
如本文所用,术语“任选地取代”意在等同于短语“未取代或取代”。
[0033]
如本文所用,短语“在治疗或预防
……
的方法中”(诸如在短语“在治疗或预防疼痛的方法中”中)意在等同于短语“在治疗或预防
……
中”(诸如在短语“在治疗或预防疼痛中”中)。
[0034]
除非上下文另有明确指示,如说明书和权利要求中所用,单数形式“一个/一种(a/an)”以及“所述(the)”包括复数指示物。例如,术语“细胞”包括多个细胞,包括其混合物。除非具体说明或从上下文明显看出,如本文所用,术语“或”应理解为包含在内。术语“包括”在本文中用于意指短语“包括但不限于”并且可与其互换使用。
[0035]
如本文所用,术语“包含”(“comprising”或“comprise”)旨在表示组合物和方法包括所列举的元素,但不排除其他元素。当用于定义组合物和方法时,“基本上由
……
组成”应意指排除对所陈述目的的组合具有任何重要意义的其他元素。因此,如本文所定义的基本上由元素组成的组合物将不排除来自分离和纯化方法的微量污染物和药学上可接受的载体(诸如磷酸盐缓冲盐水)、防腐剂等。“由
……
组成”将意指排除超过微量的其他成分的元素以及用于施用本发明的组合物的实质方法步骤或产生组合物或实现预期结果的过程步骤。由这些过渡术语中的每一个定义的实施方案都在本发明的范围内。本文中术语“包含”的使用旨在涵盖“基本上由
……
组成”和“由
……
组成”。
[0036]“受试者”、“个体”或“患者”在本文中可互换使用,并且是指脊椎动物,诸如哺乳动物。哺乳动物包括但不限于鼠、大鼠、兔、猿、牛、绵羊、猪、犬科动物、猫科动物、农场动物、运动动物、宠物、马、灵长类动物和人。在一个实施方案中,所述哺乳动物包括马、狗和猫。在一些实施方案中,哺乳动物是人,例如,患有特定疾病或障碍(诸如戈谢病(例如gd-3)或尼曼-皮克病c型)的人。
[0037]“施用”在本文中被定义为以导致药剂存在于受试者体内的方式向所述受试者提供所述药剂或含有所述药剂的组合物的手段。这种施用可以通过任何途径,包括但不限于口服、透皮(例如,阴道、直肠、口腔粘膜)、通过注射(例如,皮下、静脉内、肠胃外、腹膜内进入cns)或通过吸入(例如,口服或经鼻)。当然,通过适合于每种施用途径的形式给予药物制剂。
[0038]
疾病的“治疗”(“treating”或“treatment”)通常包括:(1)抑制疾病,即阻止或减少疾病或其临床症状的发展;和/或(2)缓解疾病,即引起疾病或其临床症状的消退。
[0039]
如本文所述,“治疗”(“treating”和“treatment”)还是指疾病的认知功能障碍和/或步态异常的逆转或此类症状的稳定。这是因为本文所述的疾病和障碍是进行性障碍—在没有治疗的情况下,患者的病症将继续恶化。例如,在疾病过程的早期,患者可能患有轻度认知功能障碍和/或步态异常,但是随着疾病进展,患者可能发展出更严重的症状。因此,治疗既包括这种进行性恶化的减缓(例如,稳定),也包括这种进行性恶化的逆转(例如,改善)。
[0040]
疾病的“预防”(“preventing”或“prevention”)通常包括使疾病的临床症状在可能易感染疾病但尚未经历或显示疾病症状的患者中不发展。
[0041]
如本文所述,“预防”(“preventing”或“prevention”)还包括预防疑似患有或诊断为患有本文所述的疾病或障碍的患者中的认知功能障碍和/或步态异常的发展。由于本文
所述的疾病和障碍是进行性障碍,因此随着疾病进展,不同的体征和症状可能会逐渐表现出来。因此,例如,患者可以在认知功能障碍和/或步态异常开始发展之前诊断出患有gd-3或npc。在这样的患者中,本文所述的治疗方法可能有效地防止认知功能障碍和/或步态异常发展。
[0042]
术语“麻痹”是“瘫痪”的同义词,并且包括一个或多个骨骼肌运动功能的任何程度的损失。如本文所述,术语“麻痹”因此包含完全麻痹(即完全瘫痪)以及部分麻痹(即部分瘫痪)两者。完全麻痹意指肌肉或肌肉群(例如眼外肌肉)失去了收缩的能力。因此,受累的一只眼睛或两只眼睛可能无法运动。部分麻痹可能表现为对运动的抑制、运动减缓或运动的其他缺陷。这些可能包括运动范围的损失。如应用于扫视,这可以包括对启动扫视(例如,响应于刺激)的抑制、扫视频率的变化、扫视峰值速度的变化、扫视幅度的变化、扫视之间潜伏期的变化和/或保持凝视或转移凝视能力的损失。如本文所述,在一些实施方案中,麻痹包括眼肌麻痹和/或眼肌瘫痪。因此,该术语包括眼外肌肉的无力和瘫痪两者。眼外肌肉包括眼睛的上直肌、下直肌、内直肌、外直肌、下斜肌和上斜肌中的任何一种或多种。无力和/或瘫痪可能包括水平运动、垂直运动或旋转运动中的一个或多个。
[0043]
与术语“治疗”相关的术语“患有”是指被诊断为患有疾病的患者或个体。与术语“预防”相关的术语“患有”是指易感染疾病的患者或个体。由于其家族谱系中的疾病史或由于存在与疾病相关的基因突变,患者也可能被称为“有风险患上”疾病。处于疾病风险中的患者尚未发展出所述疾病的全部或一些特征性病理。
[0044]
与增加脑组织体积的方法有关的术语“增加”是指增加至少一个(优选多个)单个脑组织区域的体积,并且通常伴随着全脑组织体积(即受试者脑组织的总体积)的增加。
[0045]“有效量”或“治疗有效量”是足以产生有益或期望结果的量。有效量可以在一次或多次施用、应用或剂量中施用。这种递送取决于许多变量,包括单独剂量单位所使用的时间段、治疗剂的生物利用度和施用途径。然而,应当理解,本发明的治疗剂对于任何特定受试者的特定剂量水平取决于多种因素,包括例如所使用的特定化合物的活性、受试者的年龄、体重、一般健康状况、性别和饮食、施用时间、排泄率、药物组合以及所治疗的特定障碍的严重程度和施用形式。通常可以对治疗剂量进行滴定以优化安全性和功效。典型地,来自体外和/或体内测试的剂量-效应关系最初可以提供对于患者施用的适当剂量的有用指导。通常,人们希望施用的化合物的量可有效地达到这样的血清水平,所述血清水平与所发现的在体外有效的浓度相称。这些参数的确定完全在本领域的技术范围内。这些考虑因素以及有效的配制品和施用程序在本领域中是熟知的,并在标准教科书中进行了描述。与该定义一致,如本文所用,术语“治疗有效量”是离体、体外或体内足以治疗(例如改善)与本文(例如,在方法1以及下列等等中的任一种)所述的疾病或障碍相关的一种或多种症状的量。
[0046]
如本文所用,术语“药学上可接受的赋形剂”涵盖任何标准药物赋形剂,包括载体如磷酸盐缓冲盐水溶液、水和乳液(诸如油/水或水/油乳液)以及各种类型的润湿剂。药物组合物还可以包含稳定剂和防腐剂。关于载体、稳定剂和佐剂的例子,参见remington's pharmaceutical sciences(第20版,mack publishing co.2000)。
[0047]
如本文所用,术语“前药”意指母体药物分子的药理学衍生物,其需要在生物体内自发或酶促地进行生物转化以释放活性药物。例如,前药是本文所述的奎宁环化合物的变体或衍生物,所述变体或衍生物具有在某些代谢条件下可切割的基团,其在被切割时变成
本文所述的奎宁环化合物,例如,式(i)的化合物。然后,当此类前药经历在生理条件下的溶剂分解或经历酶促降解时,则它们在体内具有药物活性。本文的前药化合物可以被称为单、双、三重的等,这取决于在生物体内释放活性药物所需的生物转化步骤的数量以及以前体类型形式存在的官能团的数量。前药形式通常在哺乳动物生物体中提供溶解度、组织相容性或延迟释放的优势。
[0048]
本领域通常已知的前药包括熟知的酸衍生物,例如像由酸化合物与合适的醇反应制备的酯、由酸化合物与胺反应制备的酰胺、以及碱性基团反应以形成酰化的碱衍生物。其他前药衍生物可以与本文公开的其他特征组合以增加生物利用度。因此,本领域技术人员将理解,本发明公开的某些具有例如游离氨基或羟基基团的化合物可以转化为前药。前药包括具有氨基酸残基或两个或更多个(例如,两个、三个或四个)氨基酸残基的多肽链的化合物,所述氨基酸残基通过肽键与本发明公开的化合物的游离氨基、羟基或羧酸基团共价连接。所述氨基酸残基包括通常由三个字母符号指定的20种天然存在的氨基酸,并且还包括4-羟脯氨酸、羟赖氨酸、锁链赖氨酸(demosine)、异锁链赖氨酸、3-甲基组氨酸、正缬氨酸(norvalin)、β-丙氨酸、γ-氨基丁酸、瓜氨酸、同型半胱氨酸、同型丝氨酸、鸟氨酸和甲硫氨酸砜。前药还包括具有与本文公开的以上任何取代基共价键合的碳酸酯、氨基甲酸酯、酰胺或烷基酯部分的化合物。
[0049]
如本文所用,术语“药学上可接受的盐”意指当前公开的化合物的药学上可接受的酸加成盐或药学上可接受的碱加成盐,所述盐可以被施用而不产生任何一种或多种实质性不希望的生物作用或不产生与可能含有它的药物组合物的任何其他组分的任何一种或多种有害相互作用。
[0050]
如本文所用,术语“c
1-6-烷基”意指基本上由1至6个碳原子和相应数量的氢原子组成的饱和直链或支链自由基。示例性的c
1-6-烷基基团包括甲基、乙基、正丙基、异丙基、正丁基和异丁基。考虑到本公开文本的有益效果,其他c
1-6-烷基基团对于本领域技术人员来说将是显而易见的。术语“c
1-3-烷基”、“c
1-4-烷基”等具有等同的含义,即基本上由1至3个(或4个)碳原子和相应数量的氢原子组成的饱和直链或支链自由基。
[0051]
如本文所用,术语“c
2-6-烯基”意指基本上由2至6个碳原子和相应数量的氢原子组成的不饱和直链或支链自由基,所述自由基包含至少一个碳-碳双键。示例性的c
2-6-烯基基团包括乙烯基、丙-1-烯基、丙-2-烯基、异丙烯基、丁-1-烯基、2-甲基-丙-1-烯基和2-甲基-丙-2-烯基。考虑到本公开文本的有益效果,其他c
2-6-烯基基团对于本领域技术人员来说将是显而易见的。
[0052]
如本文所用,术语“c
2-6-炔基”意指基本上由2至6个碳原子和相应数量的氢原子组成的不饱和直链或支链自由基,所述自由基包含至少一个碳-碳三键。示例性的c
2-6-炔基基团包括乙炔基、丙-1-炔基、丙-2-炔基、丁-1-炔基和3-甲基-丁-1-炔基。考虑到本公开文本的有益效果,其他c
2-6-炔基基基团对于本领域技术人员来说将是显而易见的。
[0053]
如本文所用,术语“c
1-6-烷氧基”意指基本上由1至6个碳原子(和相应数量的氢原子)和氧原子组成的饱和直链或支链自由基。c
1-6-烷氧基基团经由氧原子附接。示例性的c
1-6-烷氧基基团包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基和异丁氧基。考虑到本公开文本的益处,其他c
1-6-烷氧基基团对于本领域技术人员来说将是显而易见的。术语“c
1-3-烷氧基”、“c
1-4-烷氧基”等具有等同的含义,即基本上由1至3个(或4个)碳原子(和相
应数量的氢原子)和氧原子组成的饱和直链或支链自由基,其中所述基团经由氧原子附接。
[0054]
如本文所用,术语“c
2-6-烯氧基”意指基本上由2至6个碳原子(和相应数量的氢原子)和氧原子组成的不饱和直链或支链自由基,所述自由基包含至少一个碳-碳双键。c
2-6-烯氧基基团经由氧原子附接。示例性的c
2-6-烯氧基基团是乙烯氧基;考虑到本公开文本的益处,其他的对于本领域技术人员来说将是显而易见的。
[0055]
如本文所用,术语“c
2-6-炔氧基”意指基本上由2至6个碳原子(和相应数量的氢原子)和氧原子组成的不饱和直链或支链自由基,所述自由基包含至少一个碳-碳三键。c
2-6-烯氧基基团经由氧原子附接。示例性的c
2-6-烯氧基基团是乙炔氧基;考虑到本公开文本的有益效果,其他的对于本领域技术人员来说将是显而易见的。
[0056]
如本文所用,术语“杂芳基”意指具有形成环的5或6个原子(即环原子)的芳族自由基,其中1至5个环原子是碳并且剩余的1至5个环原子(即一个或多个杂环原子)独立地选自氮、硫和氧。示例性的5元杂芳基基团包括呋喃基、噻吩基、噻唑基(例如噻唑-2-基)、吡唑基、异噻唑基、噁唑基、异噁唑基、吡咯基、三唑基、咪唑基、噁二唑基和噻二唑基。示例性的6-元杂芳基基团包括吡啶基、嘧啶基、吡嗪基、哒嗪基、1,2,4-三嗪基、苯并噁唑基、苯并异噻唑基、苯并异噁唑基和苯并咪唑基。其他杂芳基基团对于本领域技术人员来说将是显而易见的。通常,杂芳基基团典型地经由碳原子附接至主要结构。然而,本领域技术人员将意识到某些其他原子(例如,杂环原子)可以附接至主结构。
[0057]
如本文所用,术语“芳基”意指具有形成环的5或6个原子(即环原子)的芳族自由基,其中所有环原子都是碳。示例性的芳基是苯基基团。
[0058]
如本文所用,术语“脂肪族”意指含有碳和氢原子例如含有1至9个碳原子的非芳族化合物。脂肪族化合物可以是直链或支链的,可以含有一个或多个环结构,并且可以含有一个或多个碳-碳双键(条件是所述化合物不含有具有芳族特征的不饱和环结构)。脂肪族化合物的例子包括乙烷、丙烯、环丁烷和环己二烯。
[0059]
如本文所用,术语“卤基”和“卤素”意指氟、氯、溴或碘。这些术语可互换使用,并且可以指卤素自由基基团或卤素原子本身。在本公开文本中使用此术语的上下文的情况下本领域技术人员将能够容易地确定其身份。
[0060]
如本文所用,术语“氰基”意指具有经由三键与氮原子连接的碳原子的自由基。氰基自由基经由其碳原子附接。
[0061]
如本文所用,术语“硝基”意指经由其氮原子附接的-no2自由基。
[0062]
如本文所用,术语“羟基”(“hydroxy”和“hydroxyl”)意指经由其氧原子附接的-oh自由基。术语“硫代”意指经由其硫原子附接的-sh自由基。
[0063]
如本文所用,术语“氨基”意指具有氮原子和1或2个氢原子的自由基。因此,术语“氨基”通常是指伯胺和仲胺。在这方面,如本文所用,叔胺由通式rr'n-表示,其中r和r'是可以相同或可以不相同的碳自由基。然而,术语“氨基”通常可以在本文中用于描述伯胺、仲胺、或叔胺,并且在本公开文本中使用此术语的上下文的情况下本领域技术人员将能够容易地确定所述氨基的身份。
[0064]
如本文所用,术语“氧代”意指经由双键附接的氧自由基。当与该氧键合的原子是碳原子时,所述键是碳-氧双键,其可以表示为-(c=o)-,并且可以称为酮。
[0065]
在本文对变量的任何定义中的化学基团列表的引用包括该变量作为任何单个基
团或所列基团的组合的定义。本文中对于变量或方面的实施方案的引用包括作为任何单个实施方案或与任何其他实施方案或其部分的组合的该实施方案。
[0066]
本文提供的任何组合物或方法可以与本文提供的任何其他组合物和方法中的一种或多种组合。
[0067]
本文使用以下缩写:
[0068]
br
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
广泛信号
[0069]
cdi
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
羰基二咪唑
[0070]
cns
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
中枢神经系统
[0071]
csf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
脑脊液
[0072]dꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
双峰
[0073]
dd
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
双二重峰
[0074]
dme
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲氧基乙烷
[0075]
dmso-d6
ꢀꢀꢀꢀꢀ
二甲基亚砜-d6
[0076]
dmf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
二甲基甲酰胺
[0077]
dna
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
脱氧核糖核酸
[0078]
edta
ꢀꢀꢀꢀꢀꢀꢀꢀ
乙二胺四乙酸
[0079]
etmgbr
ꢀꢀꢀꢀꢀꢀ
乙基溴化镁
[0080]
etoac
ꢀꢀꢀꢀꢀꢀꢀ
乙酸乙酯
[0081]
gl1
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
葡糖神经酰胺(glccer)
[0082]
gm3
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
单唾液酸二己糖神经节苷脂
[0083]
hplc
ꢀꢀꢀꢀꢀꢀꢀꢀ
高压/高效液相色谱
[0084]
hsa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
人血清白蛋白
[0085]
ipa
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
异丙醇
[0086]jꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
耦合常数
[0087]
lcms
ꢀꢀꢀꢀꢀꢀꢀꢀ
液相色谱质谱法
[0088]mꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
多重峰
[0089]
ppm
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
百万分率
[0090]
rha
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
重组人白蛋白
[0091]sꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
单峰
[0092]
tbme
ꢀꢀꢀꢀꢀꢀꢀꢀ
叔丁基甲基醚
[0093]
thf
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
四氢呋喃
[0094]
tris
ꢀꢀꢀꢀꢀꢀꢀꢀ
三(羟基甲基)氨基甲烷
[0095]
tween20
ꢀꢀꢀꢀꢀ
聚山梨酯20
[0096]
tween80
ꢀꢀꢀꢀꢀ
聚山梨酯80
[0097]
vor
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
前庭-眼反射
[0098]
uplcms
ꢀꢀꢀꢀꢀꢀ
超高效液相色谱质谱法
[0099]
化合物
[0100]
本公开文本涉及奎宁环化合物,其用于跟治疗或预防本文所讨论的疾病和障碍有关的治疗方法。在其所有各个方面,本发明涉及一种根据式(i)的奎宁环化合物(化合物1),
[0101][0102][0103]
或其药学上可接受的盐或前药,其中:
[0104]
r1选自氢、卤素(例如,氟)、氰基、硝基、羟基、硫代、氨基、c
1-6-烷基(例如,甲基或乙基)、c
2-6-烯基、c
2-6-炔基、c
1-6-烷氧基、c
2-6-烯氧基和c
2-6-炔氧基,其中所述烷基、烯基、炔基、烷氧基、烯氧基或炔氧基任选地被选自卤素、氰基、硝基、羟基、硫代或氨基的一个或多个(例如,1、2或3个)基团取代;
[0105]
r2和r3独立地选自c
1-3-烷基,所述烷基任选地被一个或多个(例如,1、2或3个)卤素取代,或者r2和r3一起形成环丙基或环丁基基团,所述环丙基或环丁基基团任选地被一个或多个(例如,1或2个)卤素取代;
[0106]
r4、r5和r6各自独立地选自氢、卤素、硝基、羟基、硫代、氨基、c
1-6-烷基和c
1-6-烷氧基,其中所述烷基或烷氧基任选地被选自卤素、羟基、氰基和c
1-6-烷氧基的一个或多个(例如,1、2或3个)基团取代;并且
[0107]
a是5元或6元芳基或杂芳基基团(例如,苯基或噻唑基),所述芳基或杂芳基任选地被独立选自卤素、羟基、硫代、氨基、硝基、c
1-6
烷氧基和c
1-6
烷基的1、2或3个基团取代。
[0108]
在本公开文本的任何方面的另外实施方案中,本公开文本还涉及如下化合物:
[0109]
1.1化合物1,其中r1选自氢、卤素、氰基、硝基、羟基、硫代、氨基、c
1-6-烷基和c
1-6-烷氧基,其中所述烷基或烷氧基任选地被选自卤素、氰基、硝基、羟基、硫代和氨基的一个或多个(例如,1、2或3个)基团取代;
[0110]
1.2化合物1,其中r1选自氢、卤素、c
1-6-烷基和c
1-6-烷氧基,其中所述烷基或烷氧基任选地被选自卤素、氰基、硝基、羟基、硫代和氨基的一个或多个(例如,1、2或3个)基团取代;
[0111]
1.3化合物1,其中r1选自氢、卤素、c
1-4-烷基和c
1-4-烷氧基,其中所述烷基或烷氧基任选地被选自卤素、氰基、硝基、羟基、硫代和氨基的一个或多个(例如,1、2或3个)基团取代;
[0112]
1.4化合物1,其中r1选自氢、卤素、c
1-4-烷基和c
1-4-烷氧基,其中所述烷基或烷氧基任选地被选自氰基、硝基、羟基、硫代和氨基的一个或多个(例如,1、2或3个、或者1或2个)基团取代;
[0113]
1.5化合物1,其中r1选自氢、卤素和c
1-4-烷基,其中所述烷基任选地被选自卤素、羟基、硫代和氨基的一个或多个(例如,1或2个)基团取代;
[0114]
1.6化合物1,其中r1选自氢、氟、甲基和乙基,其中所述甲基或乙基被选自卤素、羟基、硫代和氨基的1或2个基团取代;
[0115]
1.7化合物1,其中r1选自氢和甲基,其中所述甲基任选地被1或2个卤素取代;
[0116]
1.8化合物1,其中r1是氢;
[0117]
1.9化合物1或1.1-1.8中的任一种,其中r1不附接至奎宁环部分的氮原子;
[0118]
1.10化合物1或1.1-1.9中的任一种,其中r2和r3各自独立地是c
1-3-烷基,所述烷基任选地被一个或多个(例如,1、2或3个)卤素取代;
[0119]
1.11化合物1.10,其中r2和r3各自独立地是甲基或乙基,所述甲基或乙基任选地被1或2个卤素取代;
[0120]
1.12化合物1.10,其中r2和r3各自独立地选自甲基和乙基,所述甲基和乙基任选地被一个或多个氟(例如,1、2、3或4个氟)取代;
[0121]
1.13化合物1.10,其中r2和r3各自独立地是被0、1、2或3个氟取代的甲基;
[0122]
1.14化合物1.10,其中r2和r3各自均是甲基或三氟甲基;
[0123]
1.15化合物1.10,r2和r3各自均是甲基;
[0124]
1.16化合物1或1.1-1.9中的任一种,其中r2和r3一起形成环丙基或环丁基基团,所述环丙基或环丁基基团任选地被一个或多个(例如,1或2个)卤素取代;
[0125]
1.17化合物1.16,其中r2和r3一起形成环丙基基团;
[0126]
1.18化合物1或1.1-1.9中的任一种,其中r2和r3各自均是甲基或者r2和r3一起形成环丙基基团;
[0127]
1.19化合物1或1.1-1.9中的任一种,其中r4、r5和r6各自独立地选自氢、卤素、c
1-6-烷基和c
1-6-烷氧基,其中所述烷基或烷氧基任选地被选自卤素、羟基、氰基和c
1-6-烷氧基的一个或多个(例如,1、2或3个)基团取代;
[0128]
1.20化合物1或1.1-1.9中的任一种,其中r4、r5和r6各自独立地选自氢、卤素、c
1-3-烷基和c
1-3-烷氧基,其中所述烷基或烷氧基任选地被选自卤素、羟基、氰基和c
1-3-烷氧基的一个或多个(例如,1、2或3个)基团取代;
[0129]
1.21化合物1.19,其中r4、r5和r6各自独立地选自氢、卤素、c
1-3-烷基和c
1-3-烷氧基,其中所述烷基或烷氧基任选地被选自卤素、氰基和c
1-3-烷氧基的一个或多个(例如,1、2或3个)基团取代;
[0130]
1.22化合物1.19,其中r4、r5和r6各自独立地选自氢、卤素、c
1-3-烷基和c
1-3-烷氧基,其中所述烷基或烷氧基任选地被选自卤素和c
1-3-烷氧基的一个或多个(例如,1、2或3个)基团取代;
[0131]
1.23化合物1.19,其中r4、r5和r6各自独立地选自卤素、c
1-3-烷基和c
1-3-烷氧基,其中所述烷基或烷氧基任选地被选自卤素和c
1-3-烷氧基的一个或多个(例如,1、2或3个)基团取代;
[0132]
1.24化合物1或1.19-1.23中的任一种,其中r4选自氢、卤素、c
1-3-烷基和c
1-3-烷氧基,其中所述烷基或烷氧基任选地被选自卤素和c
1-3-烷氧基的一个或多个(例如,1、2或3个)基团取代;
[0133]
1.25化合物1.24,其中r4选自卤素(例如,氟)、c
1-3-烷基(例如,甲基)和c
1-3-烷氧基(例如,甲氧基或乙氧基),其中所述烷基或烷氧基任选地被选自卤素和c
1-3-烷氧基(例如,甲氧基或乙氧基)的一个或多个(例如,1、2或3个)基团取代;
[0134]
1.26化合物1.25,其中r4选自卤素(例如,氟)和c
1-3-烷氧基(例如,甲氧基或乙氧基),其中所述烷氧基任选地被选自卤素和c
1-3-烷氧基(例如,甲氧基或乙氧基)的一个或多个(例如,1、2或3个)基团取代;
[0135]
1.27化合物1.26,其中r4是氟或c
1-3-烷氧基(例如,乙氧基),所述烷氧基任选地被选自卤素和c
1-3-烷氧基(例如,甲氧基)的一个或多个(例如,1、2或3个)基团取代;
[0136]
1.28化合物1.26,其中r4是氟或任选地被一个或多个(例如,1、2或3个)c
1-3-烷氧基(例如,甲氧基)取代的乙氧基;
[0137]
1.29化合物1或1.19-1.28中的任一种,其中r6是氢;
[0138]
1.30化合物1或1.19-1.28中的任一种,其中r5和r6各自均是氢;
[0139]
1.31化合物1或1.19-1.28中的任一种,r5和r6各自均是氢,并且r4是氟或c
1-3-烷氧基(例如,乙氧基),所述烷氧基任选地被选自卤素和c
1-3-烷氧基(例如,甲氧基)的一个或多个(例如,1、2或3个)基团取代;
[0140]
1.32化合物1.31,其中r5和r6各自均是氢,并且r4是氟或任选地被一个或多个(例如,1、2或3个)c
1-3-烷氧基(例如,甲氧基)取代的乙氧基;
[0141]
1.33化合物1.32,其中r5和r6各自均是氢,并且r4是氟或被甲氧基取代的乙氧基(例如,2-甲氧基乙氧基);
[0142]
1.34化合物1.32,其中r4是氟或2-甲氧基乙氧基;
[0143]
1.35化合物1或1.1-1.34中的任一种,其中r4、r5和r6中的至少一个不是氢;
[0144]
1.36化合物1或1.1-1.35中的任一种,其中r6是氢,并且r4和r5位于它们所附接的苯环的2、4或6位(即a取代基的邻位或对位);
[0145]
1.37化合物1或1.1-1.35中的任一种,其中r6是氢,并且r4和r5独立地位于它们所附接的苯环的2和3位(即相邻的邻位和间位)、3和4位(即相邻的间位和对位)或3和5位(即间位)(相对于a取代基);
[0146]
1.38化合物1或1.1-1.35中的任一种,其中r6是氢,并且r4和r5位于它们所附接的苯环的3和5位(即间位)(相对于a取代基);
[0147]
1.39化合物1或1.1-1.35中的任一种,其中r5和r6是氢,并且r4位于其所附接的苯环的2、3或4位(例如,a取代基的邻位、间位或对位);
[0148]
1.40化合物1或1.1-1.35中的任一种,其中r5和r6是氢,并且r4位于其所附接的苯环的2或4位(例如,a取代基的邻位或对位);
[0149]
1.41化合物1或1.1-1.35中的任一种,其中r5和r6是氢,并且r4位于其所附接的苯环的4位(例如,a取代基的对位);
[0150]
1.42化合物1或1.1-1.35中的任一种,其中r4、r5和r6都不是氢,并且r4、r5和r6中的每一个独立地位于其所附接的苯环的2、4或6位(即a取代基的邻位或对位);
[0151]
1.43化合物1或1.1-1.42中的任一种,其中r4位于其所附接的苯环的4位(即a取代基的对位);
[0152]
1.44化合物1或1.1-1.43中的任一种,其中a是6元芳基、5元杂芳基基团(例如,在杂芳基环中含有独立地选自n、o和s的1、2或3个杂原子)或6元杂芳基基团(例如,在杂芳基环中含有1、2或3个氮原子);
[0153]
1.45化合物1.44,其中a是6元芳基基团或5元杂芳基基团(例如,在杂芳基环中含有独立地选自n、o和s的1、2或3个杂原子),任选地其中5元杂芳基基团含有选自n和s的1或2个杂原子(例如,一个n和/或一个s);
[0154]
1.46化合物1.44或1.45,其中a选自苯基、呋喃基、噻吩基、噻唑基、吡唑基、异噻唑
基、噁唑基、异噁唑基、吡咯基、三唑基、咪唑基、噁二唑基和噻二唑基;
[0155]
1.47化合物1.46,其中a选自苯基、噻吩基、噻唑基、吡咯基和咪唑基;
[0156]
1.48化合物1.46,其中a选自苯基和噻唑基,例如2-噻唑-4-基或4-噻唑-2-基;
[0157]
1.49化合物1或1.1-1.48中的任一种,其中a是未取代的;
[0158]
1.50化合物1或1.1-1.48中的任一种,其中a被独立地选自卤素、羟基、硫代、氨基、硝基、c
1-6
烷氧基和c
1-6
烷基(例如,甲基)的一个或多个(例如,1、2或3个)基团取代;
[0159]
1.51化合物1.50,其中a是被一个卤素(例如,氟)或c
1-6
烷基(例如,甲基)取代的噻唑基;
[0160]
1.52化合物1.50,其中a是被独立地选自卤素(例如,氟)和c
1-6
烷基(例如,甲基)的1、2或3个基团取代的苯基;
[0161]
1.53化合物1.52,其中a是被1或2个氟或甲基基团取代的苯基;
[0162]
1.54化合物1或1.1-1.53中的任一种,其中附接至a取代基的两个基团(即苯环(-(c6h2r4r5r6))和-c(r2r3)-基团)被定位成彼此呈1,2-、1,3-或1,4-关系(即邻位、间位或对位);
[0163]
1.55化合物1.54,其中附接至a取代基的两个基团被定位成彼此呈1,3-关系(即间位);
[0164]
1.56化合物1.54,其中附接至a取代基的两个基团被定位成彼此呈1,4-关系(即对位);
[0165]
1.57化合物1.54至1.56中的任一种,其中a取代基是5元杂芳基基团,并且附接至a取代基的两个基团中的至少一个(即苯环(-(c6h2r4r5r6))或-c(r2r3)-基团)附接至杂芳基环的碳原子,任选地其中这两个基团都附接至杂芳基环的碳原子;
[0166]
1.58化合物1或1.1-1.57中的任一种,其中式(i)的化合物可以由以下子结构中的任何一种或多种表示:
[0167]
[0168][0169]
1.59化合物1或1.1-1.58中的任一种,其中式(i)的化合物或式(ii)至(xii)中任一者的化合物具有(s)构型;
[0170]
1.60化合物1或1.1-1.58中的任一种,其中式(i)的化合物或式(ii)至(xii)中任一者的化合物具有(r)构型;
[0171]
1.61化合物1或1.1-1.60中的任一种,其中式(i)的化合物或式(ii)至(xii)中任一者的化合物具有至少90%,例如至少92%、93%、94%、95%、96%、97%、98%、99%、99.5%或99.9%的对映体过量(例如,(s)构型的);
[0172]
1.62化合物1或1.1-1.58中的任一种,其中式(i)的化合物或式(ii)至(xii)中任一者的化合物是外消旋的(即大约50:50比率的对映体),或者是一些其他比率(例如,小于50:50或大于50:50)的对映体的混合物;
[0173]
1.63化合物1或1.1-1.62中的任一种,其中式(i)的化合物选自:
[0174]
[0175]
1.64化合物1或1.1-1.63中的任一种,其中所述化合物选自奎宁环-3-基(2-(4'-氟-[1,1'-联苯]-3-基)丙-2-基)氨基甲酸酯、(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯和(s)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯;
[0176]
1.65化合物1或1.1-1.63中的任一种,其中所述化合物是奎宁环-3-基(2-(4'-氟-[1,1'-联苯]-3-基)丙-2-基)氨基甲酸酯;
[0177]
1.66化合物1或1.1-1.63中的任一种,其中所述化合物是奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯,例如(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯;
[0178]
1.67化合物1或1.1-1.66中的任一种,其中式(i)的化合物或式(ii)至(xii)中任一者的化合物呈游离碱形式;
[0179]
1.68化合物1或1.1-1.66中的任一种,其中式(i)的化合物或式(ii)至(xii)中任一者的化合物呈药物学上可接受的盐形式;
[0180]
1.69化合物1.68,其中所述盐形式是酸加成盐形式;
[0181]
1.70化合物1.69,其中所述酸加成盐形式是选自以下的盐:盐酸盐、氢溴酸盐、氢碘化物、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸性磷酸盐、乙酸盐、乳酸、柠檬酸盐、酸性柠檬酸盐、酒石酸盐、琥珀酸盐、羟基琥珀酸盐、苹果酸盐、马来酸盐、富马酸盐、葡糖酸盐、糖酸盐、苯甲酸盐、甲磺酸盐和帕莫酸盐(pamoate);
[0182]
1.71化合物1.70,其中所述酸加成盐形式选自盐酸盐、羟基琥珀酸盐(例如,2-羟基琥珀酸盐)和苹果酸盐;
[0183]
1.72化合物1.68,其中所述盐形式是碱加成盐形式;
[0184]
1.73化合物1或1.1-1.72中的任一种,其中所述化合物是呈苹果酸盐形式的(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯;
[0185]
1.74化合物1或1.1-1.73中的任一种,其中式(i)的化合物或式(ii)至(xii)中任一者的化合物呈如本文所述的前药的形式;
[0186]
1.75化合物1或1.1-1.74中的任一种,其中式(i)的化合物或式(ii)至(xii)中任一者的化合物呈水合物、溶剂化物和/或多晶型物的形式。
[0187]
盐
[0188]
在自然界中为碱性的本发明公开的化合物(例如,化合物1或1.1-1.75中的任一种)通常能够与各种无机酸和/或有机酸形成多种不同的盐。虽然此类盐对于施用至动物和人而言通常是药学上可接受的,但在实践中往往希望首先从反应混合物分离化合物为药学上不可接受的盐,然后通过用碱性试剂处理简单地将后者转化回为游离碱化合物,并随后将游离碱转化为药学上可接受的酸加成盐。可以使用常规技术容易地制备碱化合物的酸加成盐,例如通过在水性溶剂介质中或在合适的有机溶剂(例如像甲醇或乙醇)中用基本上等同的量的所选择的矿物酸或有机酸处理碱化合物。小心蒸发溶剂后,获得所需的固体盐。本发明公开的带正电荷的化合物(例如,含有季铵)还可以与各种无机酸和/或有机酸的阴离子组分形成盐。
[0189]
可用于制备奎宁环化合物的药学上可接受的盐的酸是可以形成无毒酸加成盐的那些,所述无毒酸加成盐是例如含有药理学上可接受的阴离子的盐,诸如氯化物、溴化物、
碘化物、硝酸盐、硫酸盐或硫酸氢盐、磷酸盐或酸性磷酸盐、乙酸盐、乳酸盐、柠檬酸盐或酸性柠檬酸盐、酒石酸盐或酒石酸氢盐、琥珀酸盐、苹果酸盐、马来酸盐、富马酸盐、葡糖酸盐、糖酸盐、苯甲酸盐、甲磺酸盐和帕莫酸盐[即1,1'-亚甲基-双-(2-羟基-3-萘甲酸盐)]盐。
[0190]
本发明公开的在自然界中为酸性的化合物(例如,含有硫醇部分的化合物)通常能够与各种无机碱和/或有机碱形成多种不同的盐。虽然此类盐对于施用至动物和人而言通常是药学上可接受的,但在实践中往往希望首先从反应混合物分离化合物为药学上不可接受的盐,然后通过用酸性试剂处理简单地将后者转化回为游离酸化合物,并随后将游离酸转化为药学上可接受的碱加成盐。可以使用常规技术容易地制备这些碱加成盐,例如通过用含有所需的药理学上可接受的阳离子的水溶液处理相应的酸性化合物,然后将所得溶液例如在减压下蒸发至干。可替代地,也可以通过以下方法来制备它们:将酸性化合物的低级烷醇溶液和所需的碱金属醇盐混合在一起,然后以与之前相同的方式将所得溶液蒸发至干。在任何一种情况下,为了确保反应的完成和所需固体盐的最大产物产率,都可以使用化学计量量的试剂。
[0191]
可用于制备奎宁环化合物的药学上可接受的碱加成盐的碱是可形成无毒碱加成盐的那些,所述无毒碱加成盐是例如含有药理学上可接受的阳离子(诸如碱金属阳离子(例如,钾和钠)、碱土金属阳离子(例如,钙和镁))的盐、铵盐或其他水溶性胺加成盐(诸如n-甲基葡糖胺(葡甲胺)、低级烷醇铵和其他此类有机胺碱)。
[0192]
在一个实施方案中,所述药学上可接受的盐是琥珀酸盐。在另一个实施方案中,所述药学上可接受的盐是2-羟基琥珀酸盐,例如(s)-2-羟基琥珀酸盐。在另一个实施方案中,所述药学上可接受的盐是盐酸盐(即具有hcl的盐)。在另一个实施方案中,所述药学上可接受的盐是苹果酸盐。
[0193]
前药
[0194]
本公开文本还包括化合物1和1.1-1.75的前药。本文公开的药学上可接受的前药是奎宁环化合物的衍生物,其可以在体内转化为本文所述的奎宁环化合物。本身可能具有一些活性的前药在它们经历例如生理条件下的溶剂分解或经历酶促降解时在体内变得具有药学活性。基于本公开文本,用于制备如本文所述的化合物的前药的方法对于本领域技术人员而言将是清楚的。
[0195]
在一个实施方案中,所述奎宁环化合物的氨基甲酸酯部分被修饰。例如,可以通过添加水和/或一种或两种脂肪族醇来修饰奎宁环化合物的氨基甲酸酯部分。在这种情况下,氨基甲酸酯部分的碳-氧双键采用的是可被认为是半缩醛或缩醛官能团的官能团。在一个实施方案中,可以通过添加脂肪族二醇(诸如1,2-乙二醇)来修饰奎宁环化合物的氨基甲酸酯部分。
[0196]
在一个实施方案中,所述奎宁环化合物上的羟基、硫代或氨基基团中的一个或多个被修饰。例如,所述奎宁环化合物上的羟基、硫代和/或氨基基团中的一个或多个可以被修饰以形成酸衍生物,例如酯、硫酯(或硫醇酯)和/或酰胺。所述酸衍生物可以例如通过使包含一个或多个羟基、硫代或氨基基团的奎宁环化合物与乙酰化剂反应而形成。乙酰化剂的例子包括酸酐(诸如乙酸酐)、酸性氯化物(诸如苄基氯)和二碳酸酯(诸如二碳酸二叔丁酯)。
[0197]
立体化学
[0198]
本公开文本还包括化合物1和1.1-1.75的立体异构体和立体异构体的混合物。本发明公开的化合物的立体异构体(例如,顺式和反式异构体)和所有光学异构体(例如,r-和s-对映体)以及此类异构体的外消旋、非对映和其他混合物都在本公开文本的范围内。
[0199]
在一个实施方案中,如本文所定义的奎宁环化合物的奎宁环-3-基基团具有r-构型。因此,所述奎宁环化合物可以选自式(ia)至(xiia)的化合物:
[0200]
(ia)
[0201]
(iia)
[0202]
(iiia)
[0203]
(iva)
[0204]
(va)
[0205]
(via)
[0206]
(viia)
[0207]
(viiia)
[0208]
(ixa)
[0209]
(xa)
[0210]
(xia)
[0211]
(xiia)及其药学上可接受的盐和前药。
[0212]
在另一个实施方案中,如本文所定义的奎宁环化合物的奎宁环-3-基基团具有s-构型。因此,所述奎宁环化合物可以选自式(ib)至(xiib)的化合物:
[0213]
(ib)
[0214]
(iib)
[0215]
(iiib)
[0216]
(ivb)
[0217]
(vb)
[0218]
(vib)
[0219]
(viib)
[0220]
(viiib)
[0221]
(ixb)
[0222]
(xb)
[0223]
(xib)
[0224]
(xiib)及其药学上可接受的盐和前药。
[0225]
在一个实施方案中,所述奎宁环化合物是式(xb)的化合物或其药学上可接受的盐或前药。在另一个实施方案中,所述奎宁环化合物是式(xiib)的化合物或其药学上可接受的盐或前药。
[0226]
在一个实施方案中,如本文所定义的奎宁环化合物的奎宁环-3-基基团存在于具有r-和s-构型的异构体的混合物中。例如,所述奎宁环化合物可以是选自以下项的化合物的混合物:式(ia)和(ib)、(iia)和(iib)、(iiia)和(iiib)、(iva)和(ivb)、(va)和(vb)、(via)和(vib)、(viia)和(viib)、(viiia)和(viiib)、(ixa)和(ixb)、(xa)和(xb)、(xia)和(xib)、以及(xiia)和(xiib)的化合物及其药学上可接受的盐和前药。在一个实施方案中,所述奎宁环化合物以外消旋混合物的形式存在,例如奎宁环-3-基基团的r-和s-异构体以大约相等的量存在。在另一个实施方案中,所述奎宁环化合物以具有r-和s-构型的异构体的混合物存在,其中所述r-和s-异构体以不同的量存在。在一个实施方案中,所述s-异构体以至少约5%、10%、25%、40%、70%、80%、90%、95%、97%、98%或99%(例如,约100%)的对映体过量存在。在另一个实施方案中,所述r-异构体以至少约5%、10%、25%、40%、70%、80%、90%、95%、97%、98%或99%(例如,约100%)的对映体过量存在。
[0227]
基于本公开文本,用于制备对映体富集和/或对映体纯的奎宁环化合物的方法对于本领域技术人员将是清楚的。
[0228]
本发明公开的化合物可以以若干种互变异构体形式存在,包括烯醇和亚胺形式、以及酮和烯胺形式以及几何异构体及其混合物。互变异构体以溶液中互变异构体集合的混合物形式存在。在固体形式中,通常一种互变异构体占主导地位。即使可以描述一种互变异构体,但所有互变异构体都在本公开文本的范围内。
[0229]
阻转异构体也在本公开文本的范围内。阻转异构体是指可以分离为旋转受限异构体的化合物。
[0230]
其他形式
[0231]
本公开文本还包括化合物1和1.1-1.75的水合物、溶剂化物和多晶型物。本文所述的奎宁环化合物的药学上可接受的水合物、溶剂化物和多晶型物在本公开文本的范围内。
如本文所述的奎宁环化合物可以呈无定形的形式和/或一种或多种结晶形式。
[0232]
同位素标记的化合物也在本公开文本的范围内。如本文所用,“同位素标记的化合物”是指包括各自如本文所述的其药学盐和前药在内的本发明公开的化合物,其中一个或多个原子被原子质量或质量数不同于通常在自然界中发现的原子质量或质量数的原子替代。可以掺入本发明公开的化合物中的同位素的例子包括氢、碳、氮、氧、磷、氟和氯的同位素,分别诸如2h、3h、
13
c、
14
c、
15
n、
18
o、
17
o、
31
p、
32
p、
35
s、
18
f和
36
cl。
[0233]
医学适应症
[0234]
本文所述的奎宁环化合物和含有所述奎宁环化合物的药物组合物可用于疗法中,特别是在例如患有诸如戈谢病等疾病的患者中的神经系统障碍(包括痴呆和步态障碍)的治疗性治疗中。有待于根据本文所述的方法进行治疗的受试者包括脊椎动物,如哺乳动物。在特定实施方案中,所述哺乳动物是人患者。
[0235]
如上所讨论,糖原贮积症的标志之一是各种糖脂或鞘糖脂在身体细胞中的异常积累。这种积累既是可观察到的疾病症状和体征的原因,也是证明疾病存在和/或进展的诊断标志物。如本文所用,关于在血浆、皮肤或其他软组织中的gl-3、gl-1和其他生物标志物的测量的短语“明显积累”意指在所述化合物的最大正常浓度之上积累了超过25%。在一些实施方案中,“明显积累”意指在所述化合物的最大正常浓度之上超过50%。
[0236]
在第一个方面,本发明提供了一种治疗或预防受试者(诸如有需要的受试者)的与溶酶体贮积病相关的认知功能障碍和/或步态异常(包括共济失调)的方法(方法1),所述方法包括向所述受试者施用有效量的如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种)。还提供了如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种),其用于治疗或预防有需要的受试者的与溶酶体贮积病相关的认知功能障碍和/或步态异常的方法中,例如用于方法1或1.1-1.64中的任一种中。还提供了如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种)在制造用于治疗或预防有需要的受试者的与溶酶体贮积病相关的认知功能障碍和/或步态异常(包括共济失调)的方法中的药物中的用途,例如在制造用于方法1或1.1-1.64中任一项中的药物中的用途。
[0237]
在方法1的特定进一步实施方案中,本公开文本提供:
[0238]
1.1.方法1,其中所述方法包括向所述受试者施用有效量的根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1中的任一种或1.1至1.75中的任一种;
[0239]
1.2.方法1,其中所述方法包括向所述受试者施用有效量的化合物1或者化合物1.1至1.75中的任何一种或多种;
[0240]
1.3.方法1或1.1-1.2中的任一种,其中所述方法包括向所述受试者施用有效量的药物组合物,所述药物组合物包含根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1中的任一种或者1.1至1.75中的任一种;
[0241]
1.4.方法1或1.1-1.2中的任一种,其中所述方法包括向所述受试者施用有效量的药物组合物,所述药物组合物包含化合物1或者化合物1.1至1.75中的任何一种或多种;
[0242]
1.5.方法1.3或1.4,其中所述药物组合物还包含至少一种如本文所述的药学上可接受的赋形剂;
[0243]
1.6.方法1或1.1-1.5中的任一种,其中所述方法包括施用包含有效量的所述化合物或有效量的所述药物组合物的药物剂型;
[0244]
1.7.方法1.6,其中所述剂型是口服剂型(例如,药丸、胶囊、片剂、糖衣丸、粉末、颗粒、膜剂、锭剂或液体);
[0245]
1.8.方法1.7,其中所述剂型为咀嚼片;
[0246]
1.9.方法1.6,其中所述剂型是肠胃外剂型(例如,其中所述药物组合物被配制用于注射);
[0247]
1.10.方法1.9,其中所述注射是静脉内、肌内、鞘内或皮下注射,任选地是无菌注射;
[0248]
1.11.方法1.6,其中所述剂型是局部或直肠剂型;
[0249]
1.12.方法1.6,其中所述剂型是鼻内剂型(例如,气雾剂);
[0250]
1.13.方法1或1.1至1.12中的任一种,其中所述方法还包括同时施用第二活性剂,例如,如本文所述能够治疗或预防有需要的患者中的认知功能障碍和/或步态异常的第二化合物;
[0251]
1.14.方法1.13,其中将所述第二活性剂在与所述奎宁环化合物相同的药物组合物或剂型中施用;
[0252]
1.15.方法1.13或1.14,其中所述第二活性剂是gcs抑制剂(例如,麦格司他或依利格鲁司他);
[0253]
1.16.方法1或1.1-1.15中的任一种,其中所述受试者是哺乳动物;
[0254]
1.17.方法1.16,其中所述受试者是灵长类动物;
[0255]
1.18.方法1.17,其中所述受试者是人;
[0256]
1.19.方法1或1.1-1.18中的任一种,其中所述共济失调是小脑共济失调;
[0257]
1.20.方法1.19,其中所述共济失调显示选自以下的症状:步态不稳、无力、不能协同、反应时间延迟、辨时距障碍(dyschronometria)、构音困难、吞咽困难、张力减退、辨距困难、伸展不足、伸展过度、轮替动作困难、言语急促不清、声音震颤、共济失调性呼吸、姿势不稳及其组合,例如其中主要共济失调缺陷是步态不稳;
[0258]
1.21.方法1.19或1.20,其中所述受试者在根据所述方法启动疗法时在共济失调评估和评级量表(scale for assessment and rating of ataxia,sara)数值范围上具有至少0.5的基线共济失调,例如,基线sara得分为至少1、或至少2、或至少3、或至少4、或至少5、或至少10或至少20;
[0259]
1.22.方法1或1.1-1.21中的任一种,其中所述认知功能障碍是痴呆;
[0260]
1.23.方法1.22,其中所述痴呆显示出视觉搜索速度、处理扫查速度、心智灵活度和/或执行功能的缺陷的体征,例如,以tmt-a为大于30秒、或大于45秒、或大于60秒,和/或tmt-b为大于70秒、或大于90秒、或大于120秒、或大于150秒、或大于180秒作为证据;和/或其中tmt-b减去tmt-a为大于40秒、或大于60秒、或大于90秒、或大于120秒;
[0261]
1.24.方法1或1.1-1.23中的任一种,其中所述受试者患有戈谢病3型;
[0262]
1.25.方法1或1.1-1.24中的任一种,其中所述受试者患有尼曼-皮克病c型;
[0263]
1.26.方法1或1.1-1.24中的任一种,其中所述受试者患有gm2神经节苷脂贮积病(例如,泰-萨克斯病、sandhoff病或gm2神经节苷脂贮积病ab变体);
[0264]
1.27.方法1或1.1-1.24中的任一种,其中所述受试者被诊断为具有基因gba1的突变;
[0265]
1.28.方法1或1.1-1.24中的任一种,其中所述受试者被诊断为具有基因npc1和/或npc2的突变;
[0266]
1.29.方法1或1.1-1.24中的任一种,其中所述受试者被诊断为具有基因hexa(编码己糖胺酶a)的突变和/或基因hexb(编码己糖胺酶b)的突变和/或基因gm2a(编码gm2神经节苷脂激活剂蛋白)的突变;
[0267]
1.30.方法1或1.1-1.29中的任一种,其中所述受试者被诊断为患有帕金森病;
[0268]
1.31.方法1或1.1-1.30中的任一种,其中所述受试者同时接受例如使用葡糖脑苷脂酶(例如,伊米苷酶、维拉苷酶或他利苷酶)的酶替代疗法(ert)治疗,任选地其中每种这样的酶都是重组酶;
[0269]
1.32.方法1.31,其中所述受试者同时接受伊米苷酶、维拉苷酶(例如,维拉苷酶α)和他利苷酶(例如,他利苷酶α)中的一种或多种的治疗;
[0270]
1.33.方法1.32,其中所述受试者同时接受伊米苷酶的治疗;
[0271]
1.34.方法1.33,其中所述受试者以每1至3周2.5单位/kg体重至80单位/kg体重(例如每2周40至60单位/kg体重)的剂量同时接受伊米苷酶的治疗(1单位的伊米苷酶是在37℃下每分钟催化1微摩尔合成底物对硝基苯基-β-d-吡喃葡萄糖苷的水解的酶的量);
[0272]
1.35.方法1.34,其中在每次施用(例如,每1至3周,例如每2周)时所述受试者的伊米苷酶剂量在1-3小时(例如,1-2小时)的时段内作为静脉内(iv)输注施用;
[0273]
1.36.方法1或1.1-1.35中的任一项,其中在启动根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的治疗之前,已经向受试者施用了酶替代疗法(例如,伊米苷酶、维拉苷酶和/或他利苷酶);
[0274]
1.37.方法1.36,其中在开始根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种,或者化合物1或1.1至1.75中的任一种)的疗法之前(例如,至少12个月(1年)或至少18个月或至少2年或至少3年),已经向所述受试者施用了伊米苷酶疗法至少6个月。
[0275]
1.38.方法1.36或1.37,其中在开始根据式(i)的化合物或(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的疗法之前,已经向受试者以稳定的剂量施用了伊米苷酶疗法至少6个月;
[0276]
1.39.方法1或1.1-1.38中的任一种,其中所述方法还包括将所述受试者从ert疗法(例如,伊米苷酶、维拉苷酶或他利苷酶)转变为根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的治疗的步骤;
[0277]
1.40.方法1或1.1-1.39中的任一种,其中所述受试者的女性血红蛋白水平为至少11g/dl,男性血红蛋白水平为至少12g/dl;
[0278]
1.41.方法1或1.1-1.40中的任一种,其中所述受试者的血小板计数为至少100,000/立方毫米;
[0279]
1.42.方法1或1.1-1.41中的任一种,其中所述受试者的脾脏体积为小于10倍正常值(mn)和/或肝脏体积为小于1.5mn;
[0280]
1.43.方法1或1.1-1.42中的任一种,其中所述受试者被诊断为具有伴随痴呆,例如阿尔茨海默病或帕金森病;
[0281]
1.44.方法1或1.1-1.43中的任一种,其中所述受试者在进行根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)治疗的开始时,所述受试者的年龄为至少18岁(例如,年龄为18-30岁);
[0282]
1.45.方法1或1.1-1.44中的任一种,其中所述受试者的葡糖神经酰胺(gl1)浓度在脑脊液(csf)中为4.4-11.1ng/ml,在血浆中为4.9-8.3μg/ml;
[0283]
1.46.方法1或1.1-1.45中的任一种,其中所述受试者的葡萄糖基鞘氨醇(lyso-gl1)浓度在csf中为20.1-67.6pg/ml,在血浆中为8.8-159.0ng/ml;
[0284]
1.47.方法1或1.1-1.46中的任一种,其中向所述受试者施用约1mg至约150mg日剂量的根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种),例如,5至50mg、或10至40mg、或10至30mg、或10至20mg、或20至30mg、或30至40mg、或40至50mg、或5至25mg、或20至50mg、或5至15mg、或15至30mg、或约15mg、或选自2、5、15、25、50、100或150mg;
[0285]
1.48.方法1或1.1-1.47中的任一种,其中所述受试者是例如年龄为18至80岁,例如18至60岁、或18至40岁、或18至30岁或18至25岁的人成年患者;
[0286]
1.49.方法1或1.1-1.47中的任一种,其中所述受试者是例如年龄为0至18岁,例如1至15岁、或1至5岁、或5至10岁、或10至15岁或10至18岁的人儿科患者;
[0287]
1.50.方法1或1.1-1.49中的任一种,其中所述方法可有效提供sara共济失调量表降低至少0.5,例如,sara得分降低至少1、或至少2、或至少3、或至少5、或至少10;或者其中所述方法可有效将sara得分降低至0.00与3.00之间、或0.00与2.00之间、或0.00与1.50之间、或0.00与1.00之间、或0.00与0.50之间。
[0288]
1.51.方法1或1.1-1.50中的任一种,其中所述方法可有效改善认知能力或减少认知缺陷,例如,如通过以下来测量:完成接龙试验(tmt)所花费的时间(tmt-a和/或tmt-b)的减少、在tmt-a时间与tmt-b时间之间的差(tmt-a-tmt-b)的减少,例如,减少至少10%、或至少20%、或至少30%、或至少40%、或至少50%(例如,其中tmt-a减少5-20%,和/或tmt-b减少25-30%,和/或[tmt-a
–
tmt-b]减少25-30%);
[0289]
1.52.方法1或1.1-1.51中的任一种,其中所述方法导致在治疗6个月后csf中和/或血浆中的葡糖神经酰胺浓度降低至少30%,例如,至少40%、至少50%、至少60%或至少70%;
[0290]
1.53.方法1或1.1-1.52中的任一种,其中所述方法导致在治疗6个月后csf中和/或血浆中的葡萄糖基鞘氨醇浓度增加至少30%,例如,至少40%、至少50%、至少60%或至少70%;
[0291]
1.54.方法1或1.1-1.53中的任一种,其中所述方法导致在治疗6个月后神经系统疾病的改良严重程度评分工具(msst)值在统计学上或在临床上不变;
[0292]
1.55.方法1或1.1-1.54中的任一种,其中所述方法导致脑中(例如,在额叶、枕叶、顶叶或颞叶中的一个或多个中)的血流增加,例如,如通过fmri成像所示;
[0293]
1.56.方法1或1.1-1.54中的任一种,其中所述方法导致脑中(例如,在脑的后方与前方之间和/或在枕骨-顶骨结构与额叶、颞叶和/或边缘结构之间)的节点连接性增加,例如,如通过fmri成像所示;
[0294]
1.57.方法1或1.1-1.56中的任一种,其中将根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)或其药学上可接受的盐或前药通过全身施用来施用,例如经由肠胃外途径或非肠胃外途径施用;
[0295]
1.58.方法1.57,其中所述施用途径是口服(肠内);
[0296]
1.59.方法1.57,其中所述施用途径是肠胃外,例如通过注射,诸如通过静脉内注射;
[0297]
1.60.方法1或1.1-1.59中的任一种,其中将根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)或其药学上可接受的盐或前药通过局部施用(local administration)(例如通过局部施用(topical administration))来施用;
[0298]
1.61.方法1或1.1-1.60中的任一种,其中所述化合物是(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯或奎宁环-3-基(2-(4'-氟-[1,1'-联苯]-3-基)丙-2-基)氨基甲酸酯;
[0299]
1.62.方法1.61,其中所述化合物的剂量为口服施用15mg/天;
[0300]
1.63.方法1.62,其中所述化合物的剂量为单次口服剂量15mg/天;
[0301]
1.64.方法1或1.1-1.63中的任一种,其中向所述受试者施用5mg、10mg、15mg或20mg单次日剂量的所述化合物,例如任选地呈苹果酸盐酸加成盐形式的(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯。
[0302]
在本公开文本的一些实施方案中,受试者或受试者被诊断为患有特定疾病或障碍,并且还被诊断为具有特定的基因突变,例如,已知作为所讨论的疾病或障碍的原因的基因突变,但通常无法证明特定患者的疾病或障碍是由一个人已被诊断具有的特定突变所引起的。如以这种方式所用,术语“被诊断为具有特定的基因突变”意指受试者或患者已经例如通过dna或rna测序、蛋白质谱分析或其他合适的手段进行测试,并且发现其具有所讨论的突变。然而,如下面进一步讨论的,许多遗传疾病和障碍可以具有多种遗传原因(例如,突变),并且患者可能具有多个突变,在一些情况下,所述多个突变中的每一个都可能足以引起所述疾病或障碍,而没有证据证明特定的突变导致特定患者中的特定疾病或障碍。
[0303]
根据方法1以及下列等等所述的方法可能有益于已经诊断为患有溶酶体贮积病(诸如戈谢病3型或尼曼-皮克病c型)、但尚未经历与所述疾病状态相关的认知和/或共济失调症状的受试者。根据方法1以及下列等等所述的方法可能有益于由于例如受试者或受试者的家庭谱系的已知引起溶酶体贮积病(诸如戈谢病3型或尼曼-皮克病c型)的突变而有风险患上这种疾病的受试者。因此,在本文所述的方法的一些实施方案中,所述受试者已经被诊断为有风险患上所述疾病或障碍,并且所述方法预防或延迟了所述受试者的所述疾病或障碍的认知和/或共济失调症状的发作和/或发展。在一些实施方案中,所述受试者已经被诊断为由于具有如本文所述的基因突变而有风险患上所述疾病或障碍。
[0304]
在第二个方面,本发明提供了一种增强受试者(诸如有需要的受试者)脑内的神经元连接性的方法(方法2),所述方法包括向所述受试者施用有效量的如本文所述的奎宁环
化合物,例如根据式(i)的化合物或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种。还提供了如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种),其用于增强受试者脑内的神经元连接性,例如用于方法2或2.1-2.67中的任一种中。还提供了如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种)在制造用于增强受试者脑内的神经元连接性的药物中的用途,例如在制造用于方法2或2.1-2.67中的药物中的用途。
[0305]
在方法2的特定进一步实施方案中,本公开文本提供:
[0306]
2.1.方法2,其中所述方法包括向所述受试者施用有效量的根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种;
[0307]
2.2.方法2,其中所述方法包括向所述受试者施用有效量的化合物1或者化合物1.1至1.75中的任何一种或多种;
[0308]
2.3.方法2或2.1-2.2中的任一种,其中所述方法包括向所述受试者施用有效量的药物组合物,所述药物组合物包含根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1中的任一种或者1.1至1.75中的任一种;
[0309]
2.4.方法2或2.1-2.2中的任一种,其中所述方法包括向所述受试者施用有效量的药物组合物,所述药物组合物包含化合物1或者化合物1.1至1.75中的任何一种或多种;
[0310]
2.5.方法2.3或2.4,其中所述药物组合物还包含至少一种如本文所述的药学上可接受的赋形剂;
[0311]
2.6.方法2或2.1-2.5中的任一种,其中所述方法包括施用包含有效量的所述化合物或有效量的所述药物组合物的药物剂型;
[0312]
2.7.方法2.6,其中所述剂型是口服剂型(例如,药丸、胶囊、片剂、糖衣丸、粉末、颗粒、膜剂、锭剂或液体);
[0313]
2.8.方法2.7,其中所述剂型为咀嚼片;
[0314]
2.9.方法2.6,其中所述剂型是肠胃外剂型(例如,其中所述药物组合物被配制用于注射);
[0315]
2.10.方法2.9,其中所述注射是静脉内、肌内、鞘内或皮下注射,任选地是无菌注射;
[0316]
2.11.方法2.6,其中所述剂型是局部或直肠剂型;
[0317]
2.12.方法2.6,其中所述剂型是鼻内剂型(例如,气雾剂);
[0318]
2.13.方法2或2.1至2.12中的任一种,其中所述方法还包括同时施用第二活性剂,例如,如本文所述的能够降低有需要的患者中的葡糖神经酰胺水平的第二化合物;
[0319]
2.14.方法2.13,其中将所述第二活性剂在与所述奎宁环化合物相同的药物组合物或剂型中施用;
[0320]
2.15.方法2.13或2.14,其中所述第二活性剂是gcs抑制剂(例如,麦格司他或依利格鲁司他);
[0321]
2.16.方法2或2.1-2.15中的任一种,其中所述受试者是哺乳动物;
[0322]
2.17.方法2.16,其中所述受试者是灵长类动物;
[0323]
2.18.方法2.17,其中所述受试者是人;
[0324]
2.19.方法2或2.1-2.18中的任一种,其中所述受试者患有共济失调,例如选自以下的症状:步态不稳、无力、不能协同、反应时间延迟、辨时距障碍(dyschronometria)、构音困难、吞咽困难、张力减退、辨距困难、伸展不足、伸展过度、轮替动作困难、言语急促不清、声音震颤、共济失调性呼吸、姿势不稳、以及它们的组合,例如其中主要共济失调缺陷是步态不稳;
[0325]
2.20.方法2.19,其中所述受试者根据所述方法在启动疗法时在共济失调评估和评级量表(sara)数值范围上具有至少0.5的基线共济失调,例如,基线sara得分为至少1、或至少2、或至少3、或至少4、或至少5、或至少10、或至少20;
[0326]
2.21.方法2或2.1-2.20中的任一种,其中所述受试者具有认知功能障碍(例如,痴呆);
[0327]
2.22.方法2.21,其中所述认知功能障碍是痴呆;
[0328]
2.23.方法2.22,其中所述痴呆显示出视觉搜索速度、处理扫查速度、心智灵活度和/或执行功能的缺陷的体征,例如,以tmt-a大于30秒、或大于45秒、或大于60秒、和/或tmt-b大于70秒、或大于90秒、或大于120秒、或大于150秒、或大于180秒作为证据;和/或其中tmt-b减去tmt-a为大于40秒、或大于60秒、或大于90秒、或大于120秒;
[0329]
2.24.方法2或2.1-2.23中的任一种,其中所述受试者患有戈谢病3型;
[0330]
2.25.方法2或2.1-2.24中的任一种,其中所述受试者患有尼曼-皮克病c型;
[0331]
2.26.方法2或2.1-2.24中的任一种,其中所述受试者患有gm2神经节苷脂贮积病(例如,泰-萨克斯病、sandhoff病或gm2神经节苷脂贮积病ab变体);
[0332]
2.27.方法2或2.1-2.24中的任一种,其中所述受试者被诊断为具有基因gba1的突变;
[0333]
2.28.方法2或2.1-2.24中的任一种,其中所述受试者被诊断为具有基因npc1和/或npc2的突变;
[0334]
2.29.方法2或2.1-2.24中的任一种,其中所述受试者被诊断为具有基因hexa(编码己糖胺酶a)的突变和/或基因hexb(编码己糖胺酶b)的突变和/或基因gm2a(编码gm2神经节苷脂激活剂蛋白)的突变;
[0335]
2.30.方法2或2.1-2.29中的任一种,其中所述受试者被诊断为患有帕金森病;
[0336]
2.31.方法2或2.1-2.30中的任一种,其中所述受试者同时接受例如使用葡糖脑苷脂酶(例如,伊米苷酶、维拉苷酶或他利苷酶)的酶替代疗法(ert)治疗,任选地其中每种这样的酶都是重组酶;
[0337]
2.32.方法2.31,其中所述受试者同时接受伊米苷酶、维拉苷酶(例如,维拉苷酶α)和他利苷酶(例如,他利苷酶α)中的一种或多种的治疗;
[0338]
2.33.方法2.32,其中所述受试者同时接受伊米苷酶的治疗;
[0339]
2.34.方法2.33,其中所述受试者以每1至3周2.5单位/kg体重至80单位/kg体重(例如每2周40至60单位/kg体重)的剂量同时接受伊米苷酶的治疗(1单位的伊米苷酶是在37℃下每分钟催化1微摩尔合成底物对硝基苯基-β-d-吡喃葡萄糖苷的水解的酶的量);
[0340]
2.35.方法2.34,其中在每次施用(例如,每1至3周,例如每2周)时所述受试者的伊
米苷酶剂量在1-3小时(例如,1-2小时)的时段内作为静脉内(iv)输注施用;
[0341]
2.36.方法2或2.1-2.35中的任一项,其中在启动根据式(i)的化合物或任何(或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一种的化合物或者化合物1或1.1至1.75中的任一种)的治疗之前,已经向受试者施用了酶替代疗法(例如,伊米苷酶、维拉苷酶和/或他利苷酶);
[0342]
2.37.方法2.36,其中在开始根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的疗法之前(例如,至少12个月(1年)或至少18个月或至少2年或至少3年),已经向所述受试者施用了伊米苷酶疗法至少6个月。
[0343]
2.38.方法2.36或2.37,其中在开始根据式(i)的化合物或(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的疗法之前,已经向受试者以稳定的剂量施用了伊米苷酶疗法至少6个月;
[0344]
2.39.方法2或2.1-2.38中的任一种,其中所述方法还包括将所述受试者从ert疗法(例如,伊米苷酶、维拉苷酶或他利苷酶)转变为根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的治疗的步骤;
[0345]
2.40.方法2或2.1-2.39中的任一种,其中所述受试者的女性血红蛋白水平为至少11g/dl,男性血红蛋白水平为至少12g/dl;
[0346]
2.41.方法2或2.1-2.40中的任一种,其中所述受试者的血小板计数为至少100,000/立方毫米;
[0347]
2.42.方法2或2.1-2.41中的任一种,其中所述受试者的脾脏体积为小于10倍正常值(mn)和/或肝脏体积为小于1.5mn;
[0348]
2.43.方法2或2.1-2.42中的任一种,其中所述受试者被诊断为具有伴随痴呆,例如阿尔茨海默病或帕金森病;
[0349]
2.44.方法2或2.1-2.43中的任一种,其中所述受试者在进行根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)治疗的开始时,所述受试者的年龄为至少18岁(例如,年龄为18-30);
[0350]
2.45.方法2或2.1-2.44中的任一种,其中所述受试者的葡糖神经酰胺(gl1)浓度在脑脊液(csf)中为4.4-11.1ng/ml,在血浆中为4.9-8.3μg/ml;
[0351]
2.46.方法2或2.1-2.45中的任一种,其中所述受试者的葡萄糖基鞘氨醇(lyso-gl1)浓度在csf中为20.1-67.6pg/ml,在血浆中为8.8-159.0ng/ml;
[0352]
2.47.方法2或2.1-2.46中的任一种,其中向所述受试者施用约1mg至约150mg日剂量的根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种),例如,5至50mg、或10至40mg、或10至30mg、或10至20mg、或20至30mg、或30至40mg、或40至50mg、或5至25mg、或20至50mg、或5至15mg、或15至30mg、或约15mg,或选自2、5、15、25、50、100或150mg;
[0353]
2.48.方法2或2.1-2.47中的任一种,其中所述受试者是例如年龄为18至80岁,例如18至60岁、或18至40岁、或18至30岁、或18至25岁的人成年患者;
[0354]
2.49.方法2或2.1-2.47中的任一种,其中所述受试者是例如年龄为0至18岁,例如
administration))来施用;
[0369]
2.64.方法2或2.1-2.63中的任一种,其中所述化合物是(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯或奎宁环-3-基(2-(4'-氟-[1,1'-联苯]-3-基)丙-2-基)氨基甲酸酯;
[0370]
2.65.方法2.64,其中所述化合物的剂量为口服施用15mg/天;
[0371]
2.66.方法2.65,其中所述化合物的剂量为单次口服剂量15mg/天;
[0372]
2.67.方法2或2.1-2.66中的任一种,其中向所述受试者施用5mg、10mg、15mg或20mg单次日剂量的所述化合物,例如任选地呈苹果酸盐酸加成盐形式的(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯。
[0373]
根据方法2以及下列等等所述的方法可能有益于已经诊断为患有溶酶体贮积病(诸如戈谢病3型或尼曼-皮克病c型)、但尚未经历与所述疾病状态相关的认知和/或共济失调症状的受试者。根据方法2以及下列等等所述的方法可能有益于由于例如受试者或受试者的家庭谱系的已知引起溶酶体贮积病(诸如戈谢病3型或尼曼-皮克病c型)的突变而有患上这种疾病的风险的受试者。因此,在本文所述的方法的一些实施方案中,所述受试者已经被诊断为有风险患上所述疾病或障碍,并且所述方法预防或延迟了所述受试者的所述疾病或障碍的认知和/或共济失调症状的发作和/或发展。在一些实施方案中,所述受试者已经被诊断为由于具有如本文所述的基因突变而有风险患上所述疾病或障碍。
[0374]
在第三个方面,本发明提供了一种增加受试者(诸如有需要的受试者)的脑组织体积或预防或延迟脑组织体积损失的方法(方法3),所述方法包括向所述受试者施用有效量的如本文所述的奎宁环化合物,例如根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种。还提供了一种如本文所述的奎宁环化合物(例如根据式(i)或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种),其用于增加有需要的受试者的脑组织体积或预防或延迟脑组织体积的损失,例如用于方法3或3.1-3.65中的任一种中。还提供了如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种)在制造用于增加有需要的受试者的脑组织体积或预防或延迟脑组织体积损失的药物中的用途,例如在制造用于方法3或3.1-3.65中的药物中的用途。
[0375]
在方法3的特定进一步实施方案中,本公开文本提供:
[0376]
3.1.方法3,其中所述方法包括向所述受试者施用有效量的根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种;
[0377]
3.2.方法3,其中所述方法包括向所述受试者施用有效量的化合物1或者化合物1.1至1.75中的任何一种或多种;
[0378]
3.3.方法3或3.1-3.2中的任一种,其中所述方法包括向所述受试者施用有效量的药物组合物,所述药物组合物包含根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1中的任一种或者1.1至1.75中的任一种;
[0379]
3.4.方法3或3.1-3.3中的任一种,其中所述方法包括向所述受试者施用有效量的药物组合物,所述药物组合物包含化合物1或者化合物1.1至1.75中的任何一种或多种;
[0380]
3.5.方法3.3或3.4,其中所述药物组合物还包含至少一种如本文所述的药学上可接受的赋形剂;
[0381]
3.6.方法3或3.1-3.5中的任一种,其中所述方法包括施用包含有效量的所述化合物或有效量的所述药物组合物的药物剂型;
[0382]
3.7.方法3.6,其中所述剂型是口服剂型(例如,药丸、胶囊、片剂、糖衣丸、粉末、颗粒、膜剂、锭剂或液体);
[0383]
3.8.方法3.7,其中所述剂型为咀嚼片;
[0384]
3.9.方法3.6,其中所述剂型是肠胃外剂型(例如,其中所述药物组合物被配制用于注射);
[0385]
3.10.方法3.9,其中所述注射是静脉内、肌内、鞘内或皮下注射,任选地是无菌注射;
[0386]
3.11.方法3.6,其中所述剂型是局部或直肠剂型;
[0387]
3.12.方法3.6,其中所述剂型是鼻内剂型(例如,气雾剂);
[0388]
3.13.方法3或3.1至3.12中的任一种,其中所述方法还包括同时施用第二活性剂,例如,如本文所述的能够降低有需要的患者中的葡糖神经酰胺水平的第二化合物;
[0389]
3.14.方法3.13,其中将所述第二活性剂在与所述奎宁环化合物相同的药物组合物或剂型中施用;
[0390]
3.15.方法3.13或3.14,其中所述第二活性剂是gcs抑制剂(例如,麦格司他或依利格鲁司他);
[0391]
3.16.方法3或3.1-3.15中的任一种,其中所述受试者是哺乳动物;
[0392]
3.17.方法3.16,其中所述受试者是灵长类动物;
[0393]
3.18.方法3.17,其中所述受试者是人;
[0394]
3.19.方法3或3.1-3.18中的任一种,其中所述受试者患有共济失调,例如选自以下的症状:步态不稳、无力、不能协同、反应时间延迟、辨时距障碍(dyschronometria)、构音困难、吞咽困难、张力减退、辨距困难、伸展不足、伸展过度、轮替动作困难、言语急促不清、声音震颤、共济失调性呼吸、姿势不稳、以及它们的组合,例如其中主要共济失调缺陷是步态不稳;
[0395]
3.20.方法3.19,其中所述受试者根据所述方法在启动疗法时在共济失调评估和评级量表(sara)数值范围上具有至少0.5的基线共济失调,例如,基线sara得分为至少1、或至少2、或至少3、或至少4、或至少5、或至少10、或至少20;
[0396]
3.21.方法3或3.1-3.20中的任一种,其中所述受试者具有认知功能障碍(例如,痴呆);
[0397]
3.22.方法3.21,其中所述认知功能障碍是痴呆;
[0398]
3.23.方法3.22,其中所述痴呆显示出视觉搜索速度、处理扫查速度、心智灵活度和/或执行功能的缺陷的体征,例如,以tmt-a为大于30秒、或大于45秒、或大于60秒,和/或tmt-b为大于70秒、或大于90秒、或大于120秒、或大于150秒、或大于180秒作为证据;和/或其中tmt-b减去tmt-a为大于40秒、或大于60秒、或大于90秒、或大于120秒;
[0399]
3.24.方法3或3.1-3.23中的任一种,其中所述受试者患有戈谢病3型;
[0400]
3.25.方法3或3.1-3.24中的任一种,其中所述受试者患有尼曼-皮克病c型;
[0401]
3.26.方法3或3.1-3.24中的任一种,其中所述受试者患有gm2神经节苷脂贮积病(例如,泰-萨克斯病、sandhoff病或gm2神经节苷脂贮积病ab变体);
[0402]
3.27.方法3或3.1-3.24中的任一种,其中所述受试者被诊断为具有基因gba1的突变;
[0403]
3.28.方法3或3.1-3.24中的任一种,其中所述受试者被诊断为具有基因npc1和/或npc2的突变;
[0404]
3.29.方法3或3.1-3.24中的任一种,其中所述受试者被诊断为具有基因hexa(编码己糖胺酶a)的突变和/或基因hexb(编码己糖胺酶b)的突变和/或基因gm2a(编码gm2神经节苷脂激活剂蛋白)的突变;
[0405]
3.30.方法3或3.1-3.29中的任一种,其中所述受试者被诊断为患有阿尔茨海默病或帕金森病;
[0406]
3.31.方法3或3.1-3.30中的任一种,其中所述受试者同时接受例如使用葡糖脑苷脂酶(例如,伊米苷酶、维拉苷酶或他利苷酶)的酶替代疗法(ert)治疗,任选地其中每种这样的酶都是重组酶;
[0407]
3.32.方法3.31,其中所述受试者同时接受伊米苷酶、维拉苷酶(例如,维拉苷酶α)和他利苷酶(例如,他利苷酶α)中的一种或多种的治疗;
[0408]
3.33.方法3.32,其中所述受试者同时接受伊米苷酶的治疗;
[0409]
3.34.方法3.33,其中所述受试者以每1至3周2.5单位/kg体重至80单位/kg体重(例如每2周40至60单位/kg体重)的剂量同时接受伊米苷酶的治疗(1单位的伊米苷酶是在37℃下每分钟催化1微摩尔合成底物对硝基苯基-β-d-吡喃葡萄糖苷的水解的酶的量);
[0410]
3.35.方法3.34,其中在每次施用(例如,每1至3周,例如每2周)时所述受试者的伊米苷酶剂量在1-3小时(例如,1-2小时)的时段内作为静脉内(iv)输注施用;
[0411]
3.36.方法3或3.1-3.35中的任一项,其中在启动根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的治疗之前,已经向受试者施用了酶替代疗法(例如,伊米苷酶、维拉苷酶和/或他利苷酶);
[0412]
3.37.方法3.36,其中在开始根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的疗法之前(例如,至少12个月(1年)或至少18个月或至少2年或至少3年),已经向所述受试者施用了伊米苷酶疗法至少6个月。
[0413]
3.38.方法3.36或3.37,其中在开始根据式(i)的化合物或(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的疗法之前,已经向受试者以稳定的剂量施用了伊米苷酶疗法至少6个月;
[0414]
3.39.方法3或3.1-3.38中的任一种,其中所述方法还包括将所述受试者从ert疗法(例如,伊米苷酶、维拉苷酶或他利苷酶)转变为根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的治疗的步骤;
[0415]
3.40.方法3或3.1-3.39中的任一种,其中所述受试者的女性血红蛋白水平为至少11g/dl,男性血红蛋白水平为至少12g/dl;
[0416]
3.41.方法3或3.1-3.40中的任一种,其中所述受试者的血小板计数为至少100,
000/立方毫米;
[0417]
3.42.方法3或3.1-3.41中的任一种,其中所述受试者的脾脏体积为小于10倍正常值(mn)和/或肝脏体积为小于1.5mn;
[0418]
3.43.方法3或3.1-3.42中的任一种,其中所述受试者被诊断为具有伴随痴呆,例如阿尔茨海默病或帕金森病;
[0419]
3.44.方法3或3.1-3.43中的任一种,其中所述受试者在进行根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)治疗的开始时,所述受试者的年龄为至少18岁(例如,年龄为18-30);
[0420]
3.45.方法3或3.1-3.44中的任一种,其中所述受试者的葡糖神经酰胺(gl1)浓度在脑脊液(csf)中为4.4-11.1ng/ml,在血浆中为4.9-8.3μg/ml;
[0421]
3.46.方法3或3.1-3.45中的任一种,其中所述受试者的葡萄糖基鞘氨醇(lyso-gl1)浓度在csf中为20.1-67.6pg/ml,在血浆中为8.8-159.0ng/ml;
[0422]
3.47.方法3或3.1-3.46中的任一种,其中向所述受试者施用约1mg至约150mg日剂量的根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种),例如,5至50mg、或10至40mg、或10至30mg、或10至20mg、或20至30mg、或30至40mg、或40至50mg、或5至25mg、或20至50mg、或5至15mg、或15至30mg、或约15mg、或选自2、5、15、25、50、100或150mg;
[0423]
3.48.方法3或3.1-3.47中的任一种,其中所述受试者是例如年龄为18至80岁,例如18至60岁、或18至40岁、或18至30岁、或18至25岁的人成年患者;
[0424]
3.49.方法3或3.1-3.47中的任一种,其中所述受试者是例如年龄为0至18岁,例如1至15岁、或1至5岁、或5至10岁、或10至15岁、或10至18岁的人儿科患者;
[0425]
3.50.方法3或3.1-3.49中的任一种,其中所述方法导致在选自以下的一个或多个脑区域中的脑组织体积的增加或脑组织体积损失的预防或延迟:右横核、左壳核、左内嗅皮层、右壳核、右中央后小叶、左距状旁(pericalcarine)、右杏仁核、左楔叶和左舌回(left lingual),例如,如使用容积磁共振成像(vmri)测量的。
[0426]
3.51.方法3或3.1-3.50中的任一种,其中所述方法导致在与执行功能相关的一个或多个脑区域中的脑组织体积增加。
[0427]
3.52.方法3.50或3.51,其中在所述一个或多个脑区域中的脑组织体积的增加伴随着在所述一个或多个脑区域内神经元连接性的增强,例如,如使用功能磁共振成像(fmri)所示的。
[0428]
3.53.方法3或3.1-3.52中的任一种,其中所述方法导致全脑组织体积的增加。
[0429]
3.54.方法3或3.1-3.53中的任一种,其中脑组织体积的增加为在任何一个或多个脑区域中至少5mm3,例如在任何一个或多个脑区域中至少10mm3、至少15mm3、至少20mm3、至少30mm3、至少50mm3、至少70mm3或至少90mm3,和/或在任何一个或多个脑区域中至多100mm3或至多150mm3。
[0430]
3.55.方法3或3.1-3.54中的任一种,其中全脑组织体积的增加为至少5mm3,例如,至少30mm3、至少60mm3、至少90mm3、至少120mm3、至少为150mm3、至少200mm3或至少250mm3,和/或至多400mm3或至多500mm3全脑体积。
[0431]
3.56.方法3或3.1-3.55中的任一种,其中脑组织体积的增加为与初始脑组织体积
相比在任何一个或多个脑区域中至少0.1%,例如从0.1%至10.0%,例如在任何一个或多个脑区域中,至少0.50%、0.75%、1.0%、2.0%或5.0%。
[0432]
3.57.方法3或3.1-3.56中的任一种,其中全脑组织体积的增加为与初始全脑组织体积相比至少0.05%,例如从0.05%至0.30%,例如至少0.10%、0.15%、0.20%或0.25%。
[0433]
3.58.方法3或3.1-3.57中的任一种,其中将根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一者或者化合物1或1.1至1.75中的任一种)或其药学上可接受的盐或前药通过全身施用来施用,例如经由肠胃外途径或非肠胃外途径施用;
[0434]
3.59.方法3.58,其中所述施用途径是口服(肠内);
[0435]
3.60.方法3.58,其中所述施用途径是肠胃外,例如通过注射,诸如通过静脉内注射;
[0436]
3.61.方法3或3.1-3.57中的任一种,其中将根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一者或者化合物1或1.1至1.75中的任一种)或其药学上可接受的盐或前药通过局部施用(local administration)(例如通过局部施用(topical administration))来施用;
[0437]
3.62.方法3或3.1-3.61中的任一种,其中所述化合物是(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯或奎宁环-3-基(2-(4'-氟-[1,1'-联苯]-3-基)丙-2-基)氨基甲酸酯;
[0438]
3.63.方法3.62,其中所述化合物的剂量为口服施用15mg/天;
[0439]
3.64.方法3.63,其中所述化合物的剂量为单次口服剂量15mg/天;
[0440]
3.65.方法3或3.1-3.61中的任一种,其中向所述受试者施用5mg、10mg、15mg或20mg单次日剂量的所述化合物,例如(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯,任选地呈苹果酸盐酸加成盐形式。
[0441]
根据方法3以及下列等等所述的方法可能有益于已经诊断为患有溶酶体贮积病诸如戈谢病3型或尼曼-皮克病c型、但尚未经历与所述疾病状态相关的认知和/或共济失调症状的受试者。根据方法3以及下列等等所述的方法可能有益于由于例如受试者或受试者的家庭谱系的已知引起溶酶体贮积病诸如戈谢病3型或尼曼-皮克病c型的突变而有患上这种疾病的风险的受试者。因此,在本文所述的方法的一些实施方案中,所述受试者已经被诊断为有风险患上所述疾病或障碍,并且所述方法预防或延迟了所述受试者的所述疾病或障碍的认知和/或共济失调症状的发作和/或发展。在一些实施方案中,所述受试者已经被诊断为由于具有如本文所述的基因突变而有风险患上所述疾病或障碍。
[0442]
根据方法3以及下列等等的方法涉及增加脑组织体积,并且对可能在组织体积方面有益地增加的可能的脑区域没有特别的限制。脑的相关区域可能例如包括右壳核、右中央后小叶、右杏仁核、右舌回、左楔叶、左舌回、右上颞叶、右外侧眶额叶、左距状旁小叶、左横断面颞叶、右颞极、右横核、左壳核、左内嗅皮层、右苍白球、左横核、左颞极、右内嗅皮层、左尾状核、右额极、右岛盖部小叶、右横断面颞叶、右海马体、左中央旁小叶、左上顶叶、左梭状小叶、左颞上沟后坡(left bankssts)、右中央旁小叶、右内侧颞叶、左尾侧中额叶、右嘴侧前扣带回叶、左三角部小叶、左中央旁小叶、左眶部小叶、左中颞叶、左地峡扣带回叶、右尾侧中额叶、右全颞叶、左下颞叶、右侧顶叶、右侧枕叶、左缘上叶、左全颞叶、右嘴侧中额叶、左嘴侧中额叶、左内侧颞叶和左上额叶或其任何组合。由于根据方法3以及下列等等所
述的方法在至少一些实施方案中表现出最大的相对体积增益的特定脑区域包括:右横核、左壳核、左内嗅皮层、右壳核、右中央后小叶、左距状旁、右杏仁核、左楔叶和左舌回。
[0443]
监测和评估方法
[0444]
在第四个方面,本发明提供了一种监测与受试者的溶酶体贮积病相关的神经系统障碍的进展或消退的方法(方法4),其中所述受试者正在接受治疗,所述治疗包括向所述受试者的施用有效量的如本文所述的奎宁环化合物,例如根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种;所述方法包括例如使用容积磁共振成像(vmri)测量在治疗过程中的一段时间内受试者的脑组织体积,并且评估所述时间段内的脑组织体积的任何变化的程度,并且任选地还包括通过向所述受试者施用有效量的如本文所述的奎宁环化合物(例如根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种)来开始或调整所述受试者的治疗。如将理解的,为了评估由于治疗引起的脑组织体积的任何变化的程度,例如,可以在开始上述治疗时或者在开始治疗后不久(例如1至14天)和在持续治疗过程中在指定治疗时间段结束时或间歇地/常规地(例如,每周、每月、每2、3、4、6、9、12个月等)进行脑组织体积的测量,以评估和重新评估治疗过程中脑体积的任何变化的程度。在受试者已经接受治疗的一个时间段内积累与受试者状况有关的比较结果可以允许提高确定受试者状况以及疾病症状的进展/消退的准确性。
[0445]
在方法4的特定进一步实施方案中,本公开文本提供:
[0446]
4.1.方法4,其中所述治疗包括向所述受试者施用有效量的根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种;
[0447]
4.2.方法4,其中所述治疗包括向所述受试者施用有效量的化合物1或者化合物1.1至1.75中的任何一种或多种;
[0448]
4.3.方法4或4.1-4.2中的任一种,其中所述治疗包括向所述受试者施用有效量的药物组合物,所述药物组合物包含根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1中的任一种或者1.1至1.75中的任一种;
[0449]
4.4.方法4或4.1-4.2中的任一种,其中所述治疗包括向所述受试者施用有效量的药物组合物,所述药物组合物包含化合物1或者化合物1.1至1.75中的任何一种或多种;
[0450]
4.5.方法4.3或4.4,其中所述药物组合物还包含至少一种如本文所述的药学上可接受的赋形剂;
[0451]
4.6.方法4或4.1-4.5中的任一种,其中所述治疗包括施用包含有效量的所述化合物或有效量的所述药物组合物的药物剂型;
[0452]
4.7.方法4.6,其中所述剂型是口服剂型(例如,药丸、胶囊、片剂、糖衣丸、粉末、颗粒、膜剂、锭剂或液体);
[0453]
4.8.方法4.7,其中所述剂型为咀嚼片;
[0454]
4.9.方法4.6,其中所述剂型是肠胃外剂型(例如,其中所述药物组合物被配制用于注射);
[0455]
4.10.方法4.9,其中所述注射是静脉内、肌内、鞘内或皮下注射,任选地是无菌注射;
[0456]
4.11.方法4.6,其中所述剂型是局部或直肠剂型;
[0457]
4.12.方法4.6,其中所述剂型是鼻内剂型(例如,气雾剂);
[0458]
4.13.方法4或4.1至4.12中的任一种,其中所述治疗还包括同时施用第二活性剂,例如,如本文所述的能够降低有需要的患者中的葡糖神经酰胺水平的第二化合物;
[0459]
4.14.方法4.13,其中将所述第二活性剂在与所述奎宁环化合物相同的药物组合物或剂型中施用;
[0460]
4.15.方法4.13或4.14,其中所述第二活性剂是gcs抑制剂(例如,麦格司他或依利格鲁司他);
[0461]
4.16.方法4或4.1-4.15中的任一种,其中所述受试者是哺乳动物;
[0462]
4.17.方法4.16,其中所述受试者是灵长类动物;
[0463]
4.18.方法4.17,其中所述受试者是人;
[0464]
4.19.方法4或4.1-4.18中的任一种,其中所述受试者患有共济失调,例如选自以下的症状:步态不稳、无力、不能协同、反应时间延迟、辨时距障碍(dyschronometria)、构音困难、吞咽困难、张力减退、辨距困难、伸展不足、伸展过度、轮替动作困难、言语急促不清、声音震颤、共济失调性呼吸、姿势不稳、以及它们的组合,例如其中主要共济失调缺陷是步态不稳;
[0465]
4.20.方法4.19,其中所述受试者根据所述方法在启动疗法时在共济失调评估和评级量表(sara)数值范围上具有至少0.5的基线共济失调,例如,基线sara得分为至少1、或至少2、或至少3、或至少4、或至少5、或至少10、或至少20;
[0466]
4.21.方法4或4.1-4.20中的任一种,其中所述受试者具有认知功能障碍(例如,痴呆);
[0467]
4.22.方法4.21,其中所述认知功能障碍是痴呆;
[0468]
4.23.方法4.22,其中所述痴呆显示出视觉搜索速度、处理扫查速度、心智灵活度和/或执行功能的缺陷的体征,例如,以tmt-a为大于30秒、或大于45秒、或大于60秒、和/或tmt-b为大于70秒、或大于90秒、或大于120秒、或大于150秒、或大于180秒作为证据;和/或其中tmt-b减去tmt-a为大于40秒、或大于60秒、或大于90秒、或大于120秒;
[0469]
4.24.方法4或4.1-4.23中的任一种,其中所述受试者患有戈谢病3型;
[0470]
4.25.方法4或4.1-4.24中的任一种,其中所述受试者患有尼曼-皮克病c型;
[0471]
4.26.方法4或4.1-4.24中的任一种,其中所述受试者患有gm2神经节苷脂贮积病(例如,泰-萨克斯病、sandhoff病或gm2神经节苷脂贮积病ab变体);
[0472]
4.27.方法5或4.1-4.24中的任一种,其中所述受试者被诊断为具有基因gba1的突变;
[0473]
4.28.方法5或4.1-4.24中的任一种,其中所述受试者被诊断为具有基因npc1和/或npc2的突变;
[0474]
4.29.方法5或4.1-4.24中的任一种,其中所述受试者被诊断为具有基因hexa(编码己糖胺酶a)的突变和/或基因hexb(编码己糖胺酶b)的突变和/或基因gm2a(编码gm2神经节苷脂激活剂蛋白)的突变;
[0475]
4.30.方法4或4.1-4.29中的任一种,其中所述受试者被诊断为患有阿尔茨海默病或帕金森病;
[0476]
4.31.方法4或4.1-4.30中的任一种,其中所述受试者同时接受例如使用葡糖脑苷脂酶(例如,伊米苷酶、维拉苷酶或他利苷酶)的酶替代疗法(ert)治疗,任选地其中每种这样的酶都是重组酶;
[0477]
4.32.方法4.31,其中所述受试者同时接受伊米苷酶、维拉苷酶(例如,维拉苷酶α)和他利苷酶(例如,他利苷酶α)中的一种或多种的治疗;
[0478]
4.33.方法4.32,其中所述受试者同时接受伊米苷酶的治疗;
[0479]
4.34.方法4.33,其中所述受试者以每1至3周2.5单位/kg体重至80单位/kg体重(例如每2周40至60单位/kg体重)的剂量同时接受伊米苷酶的治疗(1单位的伊米苷酶是在37℃下每分钟催化1微摩尔合成底物对硝基苯基-β-d-吡喃葡萄糖苷的水解的酶的量);
[0480]
4.35.方法4.34,其中在每次施用(例如,每1至3周,例如每2周)时所述受试者的伊米苷酶剂量在1-3小时(例如,1-2小时)的时段内作为静脉内(iv)输注施用;
[0481]
4.36.方法4或4.1-4.35中的任一项,其中在启动根据式(i)的化合物或任何(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的治疗之前,已经向受试者施用了酶替代疗法(例如,伊米苷酶、维拉苷酶和/或他利苷酶);
[0482]
4.37.方法4.36,其中在开始根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的疗法之前(例如,至少12个月(1年)或至少18个月或至少2年或至少3年),已经向所述受试者施用了伊米苷酶疗法至少6个月;
[0483]
4.38.方法4.36或4.37,其中在开始根据式(i)的化合物或(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的疗法之前,已经向受试者以稳定的剂量施用了伊米苷酶疗法至少6个月;
[0484]
4.39.方法4或4.1-4.38中的任一种,其中所述方法还包括将所述受试者从ert疗法(例如,伊米苷酶、维拉苷酶或他利苷酶)转变为根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的治疗的步骤;
[0485]
4.40.方法4或4.1-4.39中的任一种,其中所述受试者的女性血红蛋白水平为至少11g/dl,男性血红蛋白水平为至少12g/dl;
[0486]
4.41.方法4或4.1-4.40中的任一种,其中所述受试者的血小板计数为至少100,000/立方毫米;
[0487]
4.42.方法4或4.1-4.41中的任一种,其中所述受试者的脾脏体积为小于10倍正常值(mn)和/或肝脏体积为小于1.5mn;
[0488]
4.43.方法4或4.1-4.42中的任一种,其中所述受试者被诊断为具有伴随痴呆,例如阿尔茨海默病或帕金森病;
[0489]
4.44.方法4或4.1-4.43中的任一种,其中所述受试者在进行根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)治疗的开始时,所述受试者的年龄为至少18岁(例如,年龄为18-30);
[0490]
4.45.方法4或4.1-4.44中的任一种,其中所述受试者的葡糖神经酰胺(gl1)浓度在脑脊液(csf)中为4.4-11.1ng/ml,在血浆中为4.9-8.3μg/ml;
[0491]
4.46.方法4或4.1-4.45中的任一种,其中所述受试者的葡萄糖基鞘氨醇(lyso-gl1)浓度在csf中为20.1-67.6pg/ml,在血浆中为8.8-159.0ng/ml;
[0492]
4.47.方法4或4.1-4.46中的任一种,其中向所述受试者施用约1mg至约150mg日剂量的根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种),例如,5至50mg、或10至40mg、或10至30mg、或10至20mg、或20至30mg、或30至40mg、或40至50mg、或5至25mg、或20至50mg、或5至15mg、或15至30mg、或约15mg、或选自2、5、15、25、50、100或150mg;
[0493]
4.48.方法4或4.1-4.47中的任一种,其中所述受试者是例如年龄为18至80岁,例如18至60岁、或18至40岁、或18至30岁、或18至25岁的人成年患者;
[0494]
4.49.方法4或4.1-4.47中的任一种,其中所述受试者是例如年龄为0至18岁,例如1至15岁、或1至5岁、或5至10岁、或10至15岁、或10至18岁的人儿科患者;
[0495]
4.50.方法4或4.1-4.49中的任一种,其中所述受试者接受治疗过程并且监测脑体积的上述时间段为3个月至24个月,例如3个月至12个月、3个月至6个月、6个月至24个月、6个月至18个月、6个月至12个月、12个月至24个月或12个月至18个月;
[0496]
4.51.方法4或4.1-4.50中的任一种,其中在所述时间段内测量受试者的脑组织体积是通过脑正电子发射断层扫描(pet)或通过容积磁共振成像(vmri)进行的;
[0497]
4.52.方法4.51,其中将受试者的脑组织体积测量了多次,在治疗过程内间歇地或常规地,例如,每周、每月,每2、3、4、6、9、12个月等;
[0498]
4.53.方法4或4.1-4.52中的任一种,其中如果在所述时间段内观察到全脑体积减少或没有增加,则所述方法还包括通过增加在治疗期间向受试者施用的式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的剂量改良治疗,并且重新评估在用增加的剂量进行改良治疗的过程中的另外一个时间段之后脑组织体积的任何变化的程度;
[0499]
4.54.方法4或4.1-4.53中的任一种,其中如果在上述时间段内观察到以下脑区域中的三个或更多个脑区域中体积减少或没有增加:右横核区域、左壳核、左内嗅皮层、右壳核、右中央后小叶、左距状旁、右杏仁核、左楔叶和左舌回,则所述方法还包括通过增加向受试者施用的、在治疗期间向受试者施用的式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一者或者化合物1或1.1至1.75中的任一种)的剂量改良治疗,并且重新评估在用增加的剂量进行改良治疗的过程中的另外一个时间段之后脑组织体积的任何变化的程度;
[0500]
4.55.方法4或4.1-4.54中的任一种,其中所述治疗导致在所述时间段内在选自以下的一个或多个脑区域中的脑组织体积的增加或脑组织体积损失的预防或延迟:右横核、左壳核、左内嗅皮层、右壳核、右中央后小叶、左距状旁、右杏仁核、左楔叶和左舌回;
[0501]
4.56.方法4或4.1-4.55中的任一种,其中所述治疗导致在与执行功能相关的一个或多个脑区域中的脑体积增加;
[0502]
4.57.方法4.55或4.56,其中在所述一个或多个脑区域中的脑体积的增加伴随着在所述一个或多个脑区域内神经元连接性的增强,例如,如使用功能磁共振成像(fmri)所示的;
[0503]
4.58.方法4或4.1-4.57中的任一种,其中所述治疗导致全脑组织体积的增加;
[0504]
4.59.方法4或4.55-4.58中的任一种,其中脑组织体积的增加为在任何一个或多个脑区域中至少5mm3,例如在任何一个或多个脑区域中至少10mm3、至少15mm3、至少20mm3、至少30mm3、至少50mm3、至少70mm3或至少90mm3,和/或在任何一个或多个脑区域中至多100mm3或至多150mm3。
[0505]
4.60.方法4或4.55-4.59中的任一种,其中全脑组织体积的增加为至少5mm3,例如,至少30mm3、至少60mm3、至少90mm3、至少120mm3、至少为150mm3、至少200mm3或至少250mm3,和/或至多400mm3或至多500mm3全脑体积。
[0506]
4.61.方法4或4.55-4.60中的任一种,其中脑组织体积的增加为与初始脑组织体积相比在任何一个或多个脑区域中至少0.1%,例如从0.1%至10.0%,例如在任何一个或多个脑区域中,至少0.50%、0.75%、1.0%、2.0%或5.0%。
[0507]
4.62.方法4或4.55-4.61中的任一种,其中全脑组织体积的增加为与初始全脑组织体积相比至少0.05%,例如从0.05%至0.30%,例如至少0.10%、0.15%、0.20%或0.25%。
[0508]
4.63.方法4或4.1-4.62中的任一种,其中将根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)或其药学上可接受的盐或前药通过全身施用来施用,例如经由肠胃外途径或非肠胃外途径施用;
[0509]
4.64.方法4.63,其中所述施用途径是口服(肠内);
[0510]
4.65.方法4.63,其中所述施用途径是肠胃外,例如通过注射,诸如通过静脉内注射;
[0511]
4.66.方法4或4.1-4.63中的任一种,其中将根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)或其药学上可接受的盐或前药通过局部施用(local administration)(例如通过局部施用(topical administration))来施用;
[0512]
4.67.方法4或4.1-4.67中的任一种,其中所述化合物是(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯或奎宁环-3-基(2-(4'-氟-[1,1'-联苯]-3-基)丙-2-基)氨基甲酸酯;
[0513]
4.68.方法4.63,其中所述化合物的剂量为口服施用15mg/天;
[0514]
4.69.方法4.63,其中所述化合物的剂量为单次口服剂量15mg/天;
[0515]
4.70.方法4或4.1-4.67中的任一种,其中向所述受试者施用5mg、10mg、15mg或20mg单次日剂量的所述化合物,例如任选地呈苹果酸盐酸加成盐形式的(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯。
[0516]
根据方法4以及下列等等所述的方法在特定的实施方案中可以使用如本文所述的容积磁共振成像(vmri)进行。如本文所述,还可以使用分析工具来协助评估vmri数据,包括例如基于张量的形态计量学(tbm)。
[0517]
将理解的是,在一些实施方案中,可替代地,方法4以及下列等等可以被视为治疗或预防有需要的受试者(例如,患者)的与溶酶体贮积病相关的神经系统障碍的方法,所述方法包括监测与溶酶体贮积病相关的神经系统障碍的进展或消退,其中所述受试者正在接受治疗,所述治疗包括向所述受试者施用有效量的如本文所述的奎宁环化合物,例如根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1
至1.75中的任一种,并且其中所述方法包括以下步骤:例如使用vmri测量在治疗过程中的一个时间段内受试者的脑组织体积,评估所述时间段内脑组织体积的任何变化的程度,并且相应地调整治疗方法的参数。
[0518]
在第五个方面,本发明提供了一种评估与溶酶体贮积病相关的神经系统障碍在有风险患上所述神经系统障碍的受试者的发作的方法(方法5),所述方法包括:a)测量受试者的脑组织体积(例如,使用vmri)并且与参考标准进行比较以评估脑组织体积是否低于所述参考标准;和b)在步骤(a)中鉴定出的脑组织体积低于所述参考标准的情况下,鉴定所述神经系统障碍的发作;所述方法任选地还包括:c)通过向所述受试者施用有效量的如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种)来开始所述受试者的治疗。如将理解的,通过测量受试者的脑组织体积并与参考标准进行比较,有可能确定患有溶酶体贮积病和有风险患上与溶酶体贮积病相关的神经系统障碍的受试者是否已达到例如用式(i)的化合物进行治疗可能特别有益的疾病进展阶段。
[0519]
可以基于健康(无痴呆)人群数据(从已发表的来源获取或获得)确定参考标准脑组织体积(全脑组织体积和/或单个脑组织区域体积),从而允许基于受试者的年龄和性别将年龄和性别特异性标准体积数据用作参考标准。这允许有意义的比较,此后基于受试者的脑组织体积低于脑组织的各个区域中的参考标准的程度和/或基于全脑组织体积来评估受试者的疾病进展,由其可以确定与受试者的溶酶体贮积病相关的神经系统障碍的发作。
[0520]
在方法5的特定进一步实施方案中,本公开文本提供:
[0521]
5.1.方法5,其中所述受试者患有戈谢病3型;
[0522]
5.2.方法5,其中所述受试者患有尼曼-皮克病c型;
[0523]
5.3.方法5,其中所述受试者患有gm2神经节苷脂贮积病(例如,泰-萨克斯病、sandhoff病或gm2神经节苷脂贮积病ab变体);
[0524]
5.4.方法5或5.1-5.3中的任一种,其中所述受试者被诊断为具有基因gba1的突变;
[0525]
5.5.方法5或5.1-5.3中的任一种,其中所述受试者被诊断为具有基因npc1和/或npc2的突变;
[0526]
5.6.方法5或5.1-5.3中的任一种,其中所述受试者被诊断为具有基因hexa(编码己糖胺酶a)的突变和/或基因hexb(编码己糖胺酶b)的突变和/或基因gm2a(编码gm2神经节苷脂激活剂蛋白)的突变;
[0527]
5.7.方法5或5.1-5.6中的任一种,其中所述受试者被诊断为患有阿尔茨海默病或帕金森病;
[0528]
5.8.方法5或5.1-5.7中的任一种,其中所述受试者接受例如使用葡糖脑苷脂酶(例如,伊米苷酶、维拉苷酶或他利苷酶)的酶替代疗法(ert)治疗,任选地其中每种这样的酶都是重组酶;
[0529]
5.9.方法5.8,其中所述受试者接受伊米苷酶、维拉苷酶(例如,维拉苷酶α)和他利苷酶(例如,他利苷酶α)中的一种或多种的治疗;
[0530]
5.10.方法5.9,其中所述受试者同时接受伊米苷酶的治疗;
[0531]
5.11.方法5.10,其中所述受试者以每1至3周2.5单位/kg体重至80单位/kg体重
(例如每2周40至60单位/kg体重)的剂量接受伊米苷酶的治疗(1单位的伊米苷酶是在37℃下每分钟催化1微摩尔合成底物对硝基苯基-β-d-吡喃葡萄糖苷的水解的酶的量);
[0532]
5.12.方法5.11,其中在每次施用时(例如,每1至3周,例如每2周)所述受试者的伊米苷酶剂量在1-3小时(例如,1-2小时)的时段内作为静脉内(iv)输注施用;
[0533]
5.13.方法5或5.1-5.12中的任一项,其中在启动根据式(i)的化合物或任何(或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一种的化合物或者化合物1或1.1至1.75中的任一种)的任何任选治疗之前,已经向受试者施用了酶替代疗法(例如,伊米苷酶、维拉苷酶和/或他利苷酶);
[0534]
5.14.方法5.13,其中在开始根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的任选疗法之前(例如,至少12个月(1年)或至少18个月或至少2年或至少3年),已经向所述受试者施用了伊米苷酶疗法至少6个月。
[0535]
5.15.方法5.13或5.14,其中在开始根据式(i)的化合物或(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的任选疗法之前,已经向受试者以稳定的剂量施用了伊米苷酶疗法至少6个月;
[0536]
5.16.方法5或5.1-5.15中的任一种,其中所述方法还包括将所述受试者从ert疗法(例如,伊米苷酶、维拉苷酶或他利苷酶)转变为根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)的任选治疗的步骤;
[0537]
5.17.方法5或5.1-5.16中的任一种,其中所述受试者的女性血红蛋白水平为至少11g/dl,男性血红蛋白水平为至少12g/dl;
[0538]
5.18.方法5或5.1-5.17中的任一种,其中所述受试者的血小板计数为至少100,000/立方毫米;
[0539]
5.19.方法5或5.1-5.18中的任一种,其中所述受试者的脾脏体积为小于10倍正常值(mn)和/或肝脏体积为小于1.5mn;
[0540]
5.20.方法5或5.1-5.19中的任一种,其中所述受试者被诊断为具有伴随痴呆,例如阿尔茨海默病或帕金森病;
[0541]
5.21.方法5或5.1-5.20中的任一种,其中所述受试者在进行根据式(i)的化合物(或(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中的任一种或者化合物1或1.1至1.75中的任一种)治疗的开始时,所述受试者的年龄为至少18岁(例如,年龄为18-30);
[0542]
5.22.方法5或5.1-5.21中的任一种,其中所述受试者的葡糖神经酰胺(gl1)浓度在脑脊液(csf)中为4.4-11.1ng/ml,在血浆中为4.9-8.3μg/ml;
[0543]
5.23.方法5或5.1-5.22中的任一种,其中所述受试者的葡萄糖基鞘氨醇(lyso-gl1)浓度在csf中为20.1-67.6pg/ml,在血浆中为8.8-159.0ng/ml;
[0544]
5.24.方法5或5.1-5.23中的任一种,其中所述受试者是例如年龄为18至80岁,例如18至60岁、或18至40岁、或18至30岁、或18至25岁的人成年患者;
[0545]
5.25.方法5或5.1-5.23中的任一种,其中所述受试者是例如年龄为0至18岁,例如1至15岁、或1至5岁、或5至10岁、或10至15岁、或10至18岁的人儿科患者;
[0546]
5.26.方法5或5.1-5.25中的任一种,其中测量受试者的脑组织体积是通过脑正电
子发射断层扫描(pet)或通过容积磁共振成像(vmri)进行的;
[0547]
5.27.方法5或5.1-5.26中的任一种,其中发现所述受试者的脑组织体积低于参考标准;
[0548]
5.28.方法5.28,其中与参考标准的比较表明,所述受试者在选自以下的一个或多个脑区域中的脑组织体积较低:右横核、左壳核、左内嗅皮层、右壳核、右中央后小叶、左距状旁、右杏仁核、左楔叶和左舌回;
[0549]
5.29.方法5.27或5.28,其中与参考标准的比较表明,所述受试者在与执行功能相关的一个或多个脑区域中的脑组织体积较低;
[0550]
5.30.如5.27至5.29中任一者所述的方法,其中与参考标准的比较表明,所述受试者在评估存在神经元连接性损失的一个或多个脑区域中的脑组织体积较低,例如,如使用功能磁共振成像(fmri)所示;
[0551]
5.31.如5.27至5.30中任一者所述的方法,其中与参考标准的比较表明受试者的全脑组织体积较低;
[0552]
5.32.如5.27至5.31中任一者所述的方法,其中所述方法还包括通过向所述受试者施用有效量的如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种)来开始所述受试者的治疗;
[0553]
5.33.方法5.32,其中所述方法还包括通过向所述受试者施用有效量的根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种来开始所述受试者的治疗;
[0554]
5.34.方法5.32或5.33,其中所述方法还包括通过向所述受试者施用有效量的化合物1或化合物1.1至1.75中的任何一种或多种来开始所述受试者的治疗;
[0555]
5.35.方法5.32-5.34,其中所述治疗包括向所述受试者施用有效量的药物组合物,所述药物组合物包含根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1中的任一种或者1.1至1.75中的任一种;
[0556]
5.36.方法5.32-5.35,其中所述治疗包括向所述受试者施用有效量的药物组合物,所述药物组合物包含化合物1或者化合物1.1至1.75中的任何一种或多种;
[0557]
5.37.方法5.35或5.36,其中所述药物组合物还包含至少一种如本文所述的药学上可接受的赋形剂;
[0558]
5.38.方法5.32-5.37,其中所述方法还包括通过施用包含有效量的化合物或有效量的药物组合物的药物剂型来开始所述受试者的治疗;
[0559]
5.39.方法5.38,其中所述剂型是口服剂型(例如,药丸、胶囊、片剂、糖衣丸、粉末、颗粒、膜剂、锭剂或液体);
[0560]
5.40.方法5.39,其中所述剂型为咀嚼片;
[0561]
5.41.方法5.38,其中所述剂型是肠胃外剂型(例如,其中所述药物组合物被配制用于注射);
[0562]
5.42.方法5.41,其中所述注射是静脉内、肌内、鞘内或皮下注射,任选地是无菌注射;
[0563]
5.43.方法5.38,其中所述剂型是局部或直肠剂型;
[0564]
5.44.方法5.38,其中所述剂型是鼻内剂型(例如,气雾剂);
[0565]
5.45.方法5.32-5.44,其中所述治疗还包括同时施用第二活性剂,例如,如本文所述的能够降低有需要的患者中的葡糖神经酰胺水平的第二化合物;
[0566]
5.46.方法5.45,其中将所述第二活性剂在与所述奎宁环化合物相同的药物组合物或剂型中施用;
[0567]
5.47.方法5.45或5.46,其中所述第二活性剂是gcs抑制剂(例如,麦格司他或依利格鲁司他);
[0568]
5.48.如5.32-5.47中任一者所述的方法,其中所述化合物是(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯或奎宁环-3-基(2-(4'-氟-[1,1'-联苯]-3-基)丙-2-基)氨基甲酸酯;
[0569]
5.49.方法5.48,其中所述化合物的剂量为口服施用15mg/天;
[0570]
5.50.方法5.49,其中所述化合物的剂量为单次口服剂量15mg/天;
[0571]
5.51.如5.32-5.48中任一者所述的方法,其中向所述受试者施用5mg、10mg、15mg或20mg单次日剂量的所述化合物,例如任选地呈苹果酸盐酸加成盐形式的(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯;
[0572]
5.52.如5.32-5.51中任一者所述的方法,其中在开始根据式(i)的化合物的治疗之后将受试者的脑组织体积测量多次,间歇地或常规地,例如,每周、每月、每2、3、4、6、9、12个月等,以评估脑组织体积的变化;
[0573]
5.53.方法5或5.1-5.52中的任一种,其中所述受试者是哺乳动物;
[0574]
5.54.方法5.53,其中所述受试者是灵长类动物;
[0575]
5.55.方法5.54,其中所述受试者是人。
[0576]
将理解的是,在一些实施方案中,可替代地,方法5以及下列等等可以被视为治疗或预防有需要和有风险患上所述神经系统障碍的受试者(例如,患者)的与溶酶体贮积病相关的神经系统障碍的方法,所述方法包括评估与溶酶体贮积病相关的神经系统障碍的发作,并且其中所述方法包括以下步骤:a)测量受试者的脑组织体积(例如,使用vmri)并且与参考标准进行比较以评估脑组织体积是否低于所述参考标准;b)在步骤(a)中鉴定出的脑组织体积低于所述参考标准的情况下,鉴定所述神经系统障碍的发作;和c)通过向所述受试者施用有效量的如本文所述的奎宁环化合物(例如,根据式(i)或式(ii)-(xii)、(ia)-(xiia)或(ib)-(xiib)中任一者的化合物或者化合物1或1.1至1.75中的任一种)来开始所述受试者的治疗。在实施方案中,c)中的治疗可以用本文所述的方法1、方法2和方法3中的任一种来实现。
[0577]
本文所述的所有方法(例如,方法1、方法2、方法3、方法4、方法5以及上文所述的那些方法的任何实施方案)都可以用于符合以下标准中的一个或多个或全部的受试者中:
[0578]
a)年龄为18岁或以上;
[0579]
b)具有戈谢病的临床诊断,例如,已经被诊断为患有或被确定有风险患上戈谢病(例如,戈谢病3型)。可以通过本文所述的任何评估(例如借助于具有如本文所述的基因突变)进行诊断;
[0580]
c)具有记录在案的酸性β葡萄糖苷酶活性的缺乏;
[0581]
d)在开始治疗之前已经接受至少3年的ert治疗,诸如用伊米苷酶(cerezyme)以稳
定的每月剂量治疗至少6个月;
[0582]
e)女性的血红蛋白水平≥11.0g/dl,男性的血红蛋白水平≥12.0g/dl;
[0583]
f)血小板计数≥100 000/mm3;
[0584]
g)脾脏体积《10倍正常值(mn)或完全脾切除术(前提是脾切除术发生在随机分组前》3年);
[0585]
h)肝脏体积《1.5mn;
[0586]
i)在开始治疗前三个月或一年内没有骨危象,也没有症状性骨病(诸如归因于骨坏死和/或病理性骨折的骨痛);
[0587]
j)有除肌阵挛性癫痫发作之外的癫痫发作史;
[0588]
k)具有戈谢病3型,其特征在于由水平扫视异常表征的动眼运用不能(核上凝视麻痹);和
[0589]
l)在开始治疗时具有轻度神经系统受累或中度神经系统受累,如使用改良严重程度评分工具(msst;davies等人,2011)测量的。
[0590]
在本文所述的方法1的实施方案中或在本文所述的方法1的特定子实施方案中,受试者符合全部标准(a)至(l)。在本文所述的方法2的实施方案中或在本文所述的方法2的特定子实施方案中,受试者符合全部标准(a)至(l)。在本文所述的方法3的实施方案中或在本文所述的方法3的特定子实施方案中,受试者符合全部标准(a)至(l)。在本文所述的方法4的实施方案中或在本文所述的方法4的特定子实施方案中,受试者符合全部标准(a)至(l)。在本文所述的方法5的实施方案中或在本文所述的方法5的特定子实施方案中,受试者符合全部标准(a)至(l)。
[0591]
在另外的实施方案中,受试者是成年患者或年龄≥12岁的儿科患者。在实施方案中,受试者是患有戈谢病3型(如例如通过满足上述标准b)和/或k)确认的)并且通过ert(例如用于全身性病症的伊米苷酶(cerezyme))稳定的成年患者或年龄≥12岁的儿科患者。例如,全身性病症可能例如通过全身性疾病的标志物的存在表征,所述全身性疾病的标志物诸如与以下相关的那些:i)脾脏和肝脏体积(例如,如通过磁共振成像(mri)测量的);ii)血小板计数;和iii)血红蛋白水平。在一些实施方案中,患有戈谢病3型的受试者已经接受ert治疗(例如,使用伊米苷酶(cerezyme))至少3年,和/或已经达到以下gd治疗目标:满足上述标准e)至i)中的一个或多个或全部。
[0592]
在特定的实施方案中,本发明提供了15mg/天单次口服剂量的任选地呈苹果酸盐酸加成盐形式的(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯,其在患有戈谢病3型(例如通过满足上述标准b)和/或k)确认的)、通过ert(例如用于全身性病症(诸如上文所定义的)的伊米苷酶(cerezyme))稳定的受试者中用于本文所定义的方法(例如,方法1、方法2、方法3、方法4、方法5,以及上文所述方法的任何实施方案)中,其中所述受试者是成年患者或年龄≥12岁的儿科患者。
[0593]
对如分别在方法1、方法2、方法3和方法4中所述的认知功能障碍和/或神经元连接性和/或脑组织体积和/或神经系统障碍消退的积极作用可以理解为对cns表现的治疗。因此,在特定的实施方案中,本发明提供了15mg/天单次口服剂量的任选地呈苹果酸盐酸加成盐形式的(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯,其在患有戈谢病3型(例如通过满足上述标准b)和/或k)确认的)、通过ert(例如用于全身性病症(诸
如上文所定义的)的伊米苷酶(cerezyme))稳定的受试者中用于治疗cns表现,其中所述受试者是成年患者或年龄≥12岁的儿科患者。
[0594]
在每种本文所述方法(例如,方法1、方法2、方法3、方法4、方法5以及上文所述方法的任何实施方案)的实施方案中,待治疗的受试者不同时接受cyp3a诱导剂(例如,强cyp3a诱导剂(诸如利福平)或中等cyp3a诱导剂(诸如苯巴比妥或依法韦仑))的治疗。在实施方案中,所述受试者不服用鉴定为强或中等cyp3a诱导剂的饮食补充剂。
[0595]
在一个实施方案中,本发明提供了15mg/天单次口服剂量的任选地呈苹果酸盐酸加成盐形式的(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯,其在患有戈谢病3型(例如通过满足上述标准b)和/或k)确认的)、通过ert(例如用于全身性病症(诸如上文所定义的)的伊米苷酶(cerezyme))稳定的受试者中用于治疗cns表现,其中所述受试者是成年患者或年龄≥12岁的儿科患者,并且其中待治疗的受试者不同时接受cyp3a诱导剂(例如,强cyp3a诱导剂(诸如利福平)或中等cyp3a诱导剂(诸如苯巴比妥或依法韦仑))的治疗。在实施方案中,所述受试者不服用鉴定为强或中等cyp3a诱导剂的饮食补充剂。
[0596]
所有本文所述的方法(例如,方法1、方法2、方法3、方法4、方法5以及上文所述的那些方法的任何实施方案)可能被认为不适合某些患者组,例如患有某些先前存在的病症的那些患者,具有某些药物的当前或过去治疗的那些患者以及具有治疗史(诸如手术治疗)的那些患者,如本文所评估和描述的。处方医师将有资格决定受试者的特定病症和/或当前或过去的药物是否会影响其接受根据本文所公开方法的治疗方法的适用性。
[0597]
在实施方案中,将要通过本文所述的方法(例如,方法1、方法2、方法3、方法4、方法5以及上文所述的那些方法的任何实施方案)治疗的受试者不包括符合以下标准中的一个或多个或全部的那些受试者:
[0598]
1)在治疗开始前6个月内已经接受针对戈谢病的底物减少疗法或分子伴侣疗法;
[0599]
2)在治疗开始前3年内已经进行部分或完全脾切除术;
[0600]
3)是输血依赖的;
[0601]
4)已经有既往食管静脉曲张或肝脏梗塞或者当前肝酶(丙氨酸氨基转移酶[alt]/天冬氨酸氨基转移酶[ast])或总胆红素》2倍正常上限,除非患者具有吉尔伯特综合征的诊断;
[0602]
5)除戈谢病之外,还患有临床意义的疾病,包括心血管疾病(先天性心脏缺陷、冠状动脉疾病、瓣膜疾病或左侧心力衰竭;临床意义的心律不齐或传导缺陷)、肝病、胃肠道疾病、肺病、神经系统疾病、内分泌疾病、代谢疾病(例如,低钾血症、低镁血症)或精神病、其他医学病症或可能排除参与的严重并发病;
[0603]
6)具有肾功能不全,如由估计的肾小球过滤率《30ml/min/1.73m2所定义;
[0604]
7)除了基底细胞癌之外,有癌症史;
[0605]
8)有肌阵挛性癫痫发作;
[0606]
9)怀孕或泌乳;
[0607]
10)具有根据世界卫生组织(who)分级的大于晶状体周长四分之一的皮质性白内障(皮质性白内障2级)或大于2mm的后囊下白内障(后囊下白内障2级)。
[0608]
11)需要使用侵袭性通气支持;
[0609]
12)需要使用非侵袭性呼吸机支持,同时每天醒着超过12小时;
[0610]
13)目前接受潜在的致白内障药物(皮质类固醇,用于皮肤病学的补骨脂素与紫外线疗法[puva]、典型的抗精神病药和青光眼药物)或任何可能使白内障患者视力恶化的药物(例如,α肾上腺素能青光眼药物);
[0611]
14)在治疗开始之前从筛查的15天或5个半衰期(以较长的为准)内施用强的或中等cyp3a诱导剂或抑制剂,或者在治疗开始72小时内食用葡萄柚、葡萄柚汁或含有葡萄柚的制品;
[0612]
15)在治疗期间计划进行住院治疗,包括选择性外科手术;和
[0613]
16)具有主要器官移植(例如,骨髓或肝脏)。
[0614]
药物组合物
[0615]
本公开文本还提供了包含至少一种如本文所述的奎宁环化合物和至少一种药学上可接受的赋形剂的药物组合物,例如其用于根据本文公开的方法中。所述药学上可接受的赋形剂可以是本领域已知的任何这种赋形剂,包括在例如remington's pharmaceutical sciences,mack publishing co.(a.r.gennaro编辑1985)中所述的那些。可以通过本领域已知的常规手段制备本发明公开的化合物的药物组合物,包括例如将至少一种本发明公开的化合物与药学上可接受的赋形剂混合。
[0616]
因此,在一个方面,本公开文本提供了一种包含如本文所述的奎宁环化合物和药学上可接受的赋形剂的药物剂型,其中所述剂型被配置成在施用时(例如,在口服施用时)提供足以治疗疾病或障碍的所述化合物的量,如在本文所述的任何方法(例如方法1以及下列等等、方法2以及下列等等、方法3以及下列等等、方法4以及下列等等或方法5以及下列等等)中所提供的。
[0617]
本发明的药物组合物或剂型可以包含药剂和另一种载体,例如惰性或活性的化合物或组合物,诸如可检测药剂、标签、佐剂、稀释剂、粘合剂、稳定剂、缓冲液、盐、亲脂性溶剂、防腐剂、佐剂等。载体还包括药物赋形剂和添加剂,例如蛋白质、肽、氨基酸、脂质和碳水化合物(例如糖,包括单糖、二糖、三糖、四糖和寡糖;衍生糖,诸如糖醇、醛糖酸、酯化糖等;和多糖或糖聚合物),其可以单独或组合存在,包括单独或按重量或体积计以1%至99.99%组合。示例性的蛋白质赋形剂包括血清白蛋白,如人血清白蛋白(hsa)、重组人白蛋白(rha)、明胶、酪蛋白等。也可以以缓冲能力起作用的代表性氨基酸/抗体组分包括丙氨酸、甘氨酸、精氨酸、甜菜碱、组氨酸、谷氨酸、天冬氨酸、半胱氨酸、赖氨酸、亮氨酸、异亮氨酸、缬氨酸、甲硫氨酸、苯丙氨酸、阿斯巴甜等。碳水化合物赋形剂也预期在本发明的范围内,所述碳水化合物赋形剂的例子包括但不限于单糖,诸如果糖、麦芽糖、半乳糖、葡萄糖、d-甘露糖、山梨糖等;二糖,诸如乳糖、蔗糖、海藻糖、纤维二糖等;多糖,诸如棉子糖、松三糖、麦芽糊精、葡聚糖、淀粉等;以及糖醇,诸如甘露糖醇、木糖醇、麦芽糖醇、乳糖醇、木糖醇、山梨糖醇(葡萄糖醇)和肌醇。
[0618]
可以使用的载体包括缓冲液或ph调节剂;典型地,所述缓冲液是由有机酸或碱制备的盐。代表性缓冲液包括有机酸盐,诸如柠檬酸、抗坏血酸、葡萄糖酸、碳酸、酒石酸、琥珀酸、乙酸或邻苯二甲酸的盐;tris、氨基丁三醇盐酸盐或磷酸盐缓冲液。另外的载体包括聚合物赋形剂/添加剂,诸如聚乙烯吡咯烷酮、ficoll(一种聚合糖)、dextrate(例如,环糊精,诸如2-羟丙基-β-环糊精)、聚乙二醇、调味剂、抗菌剂、甜味剂、抗氧化剂、抗静电剂、表面活
性剂(例如,聚山梨醇酯,诸如“tween 20”和“tween 80”)、脂质(例如,磷脂质、脂肪酸)、类固醇(例如,胆固醇)和螯合剂(例如,edta)。
[0619]
本公开文本还提供了药物组合物和包含所述组合物的试剂盒,所述组合物含有至少一种如本文所述的奎宁环化合物和至少一种其他药学活性剂。这些药物组合物和试剂盒可以适合于允许同时、随后和/或单独施用所述奎宁环化合物和所述其他活性剂。例如,所述奎宁环化合物和所述其他活性剂可以被配制在单独剂型中,例如在单独片剂、胶囊、冻干物或液体中,或者它们可以被配制在同一剂型中,例如在同一片剂、胶囊、冻干物或液体中。在所述奎宁环化合物和所述其他活性剂被配制在同一剂型中的情况下,所述奎宁环化合物和所述其他活性剂可以基本上以混合物的形式存在,例如在片剂的核心内,或者它们可以基本上以所述剂型的离散区域的形式存在,例如在同一片剂的单独层中。在一个实施方案中,所述药物剂型包含另外的药剂,所述另外的药剂能够例如在患有、诊断为患有或易患上如本文所述的溶酶体贮积病(诸如戈谢病3型或尼曼-皮克病c型)的患者中治疗或预防认知功能障碍和/或步态异常。
[0620]
在另一个方面,本公开文本提供了一种药物组合物,所述药物组合物包含:(i)如本文所述的奎宁环化合物;(ii)其他活性剂;和(iii)药学上可接受的赋形剂。在一个实施方案中,所述另外的药剂是能够例如在患有、诊断为患有或易患上如本文所述的溶酶体贮积病(诸如戈谢病3型或尼曼-皮克病c型)的患者中治疗或预防认知功能障碍和/或步态异常的药剂。在一个实施方案中,所述另外的药剂当口服施用于受试者时能够例如在患有、诊断为患有或易患上如本文所述的溶酶体贮积病(诸如戈谢病3型或尼曼-皮克病c型)的患者中治疗或预防步态障碍(例如,共济失调)或痴呆。
[0621]
本发明公开的奎宁环化合物和药物组合物可以用于动物或人。因此,本发明公开的化合物可以被配制为用于口服、口腔、肠胃外(例如静脉内、肌内或皮下)、外用、直肠或鼻内施用或者呈适合于通过吸入或吹入施用的形式的药物组合物。在特定实施方案中,所述奎宁环化合物或药物组合物被配制用于全身施用,例如经由非肠胃外途径。在一个实施方案中,所述奎宁环化合物或药物组合物被配制用于例如以固体形式口服施用。例如,在gibaldi's drug delivery systems in pharmaceutical care(第1版,american society of health-system pharmacists 2007)中描述了此类施用模式和制备合适的药物组合物的方法。
[0622]
可以使用例如用于提供所需的释放曲线的不同比例的羟丙基甲基纤维素、其他聚合物基质、脂质体和/或微球配制所述药物组合物以便提供其中活性成分的缓慢、延长或控制释放。所述药物组合物还可以任选地含有遮光剂,并且可以具有如下组成,其仅或优先地在胃肠道的特定部分中释放一种或多种活性成分,任选地以延迟的方式,例如通过使用肠溶衣。包埋组合物的例子包括聚合物质和蜡。所述活性成分也可以是微囊化形式,如果合适的话,其具有本领域熟知的一种或多种药学上可接受的载体、赋形剂或稀释剂(参见例如,remington's)。本发明公开的化合物可以根据本领域普通技术人员熟知的方法被配制用于持续递送。此类配制品的例子可在美国专利3,119,742;3,492,397;3,538,214;4,060,598;和4,173,626中找到。
[0623]
在用于口服施用的固体剂型(例如,胶囊、片剂、丸剂、糖衣丸、粉末、颗粒等)中,所述活性成分与一种或多种药学上可接受的载体、赋形剂或稀释剂(诸如柠檬酸钠或磷酸二
钙)和/或任何以下项混合:(1)填充剂或增量剂,诸如淀粉、乳糖、蔗糖、葡萄糖、甘露糖醇、微晶纤维素、磷酸钙和/或硅酸;(2)粘合剂,例如像羧甲基纤维素、藻酸盐、明胶、预胶化玉米淀粉、聚乙烯吡咯烷酮、羟丙基甲基纤维素、蔗糖和/或阿拉伯树胶;(3)保湿剂,诸如甘油;(4)崩解剂,诸如琼脂、碳酸钙、羟基乙酸淀粉钠、马铃薯或木薯淀粉、藻酸、某些硅酸盐和碳酸钠;(5)溶液阻滞剂,诸如石蜡;(6)吸收促进剂,诸如季铵化合物;(7)润湿剂,例如像十二烷基硫酸钠、乙酰醇和单硬脂酸甘油酯;(8)吸收剂,诸如高岭土和膨润土;(9)润滑剂,诸如滑石、二氧化硅、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠及其混合物;以及(10)着色剂。在胶囊、片剂和丸剂的情况下,所述药物组合物还可以包含缓冲剂。也可以使用软和硬填充明胶胶囊中的填充剂和赋形剂如(乳糖或奶糖)以及高分子量聚乙二醇等制备相似类型的固体组合物。
[0624]
可以通过压缩或模制(任选地与一种或多种辅助成分一起)来制造片剂。可以使用粘合剂(例如,明胶或羟丙基甲基纤维素)、润滑剂、惰性稀释剂、防腐剂、崩解剂(例如,羟基乙酸淀粉钠或交联羧甲基纤维素钠)、表面活性剂和/或分散剂来制备压缩片剂。可以通过在合适的机器中模制用惰性液体稀释剂润湿的粉末状活性成分的混合物来制备模制片剂。可以任选地用包衣和外壳(诸如肠溶衣和本领域熟知的其他包衣)来刻痕或制备片剂和其他固体剂型(诸如糖衣丸、胶囊、丸剂和颗粒)。
[0625]
在实施方案中,将所述药物组合物以液体形式口服施用。活性成分的用于口服的液体剂型包括药学上可接受的乳液、微乳液、溶液、悬浮液、糖浆和酏剂。用于口服施用的液体制剂可以作为干产物呈现,以供在使用前用水或其他合适的媒介物构造。除了活性成分之外,液体剂型可以含有在本领域中常用的惰性稀释剂,例如像水或其他溶剂、增溶剂和乳化剂,诸如乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇、苯甲酸苄酯、丙二醇、1,3-丁二醇、油类(例如,棉籽油、花生油、玉米油、胚芽油、橄榄油、蓖麻油和芝麻油)、甘油、四氢糠醇、聚乙二醇和山梨聚糖的脂肪酸酯类以及它们的混合物。除了惰性稀释剂之外,所述液体药物组合物还可以包含佐剂,诸如润湿剂、乳化剂和悬浮剂、甜味剂、调味剂、着色剂、芳香剂和防腐剂等。除了一种或多种活性成分之外,悬浮液还可以含有悬浮剂,诸如但不限于乙氧基化异硬脂醇、聚氧乙烯山梨糖醇和脱水山梨糖醇酯、微晶纤维素、偏氢氧化铝、膨润土、琼脂和黄芪胶及其混合物。可以通过常规手段用一种或多种药学上可接受的添加剂诸如悬浮剂(例如,山梨糖醇糖浆、甲基纤维素或氢化食用脂肪);乳化剂(例如,卵磷脂或阿拉伯树胶);非水性媒介物(例如,杏仁油、油性酯或乙醇);和/或防腐剂(例如,对羟基苯甲酸甲酯或对羟基苯甲酸丙酯或山梨酸)来制备合适的液体制剂。也可以以推注、药糖剂或糊剂的形式施用一种或多种活性成分。
[0626]
对于口腔施用,所述组合物可以采取以常规手段配制的片剂或锭剂的形式。
[0627]
在实施方案中,通过非口服方式如通过外用施用、透皮施用、注射等施用所述药物组合物。在相关实施方案中,通过注射、输注或植入(例如,静脉内、肌内、动脉内、皮下等)肠胃外施用所述药物组合物。
[0628]
本发明公开的化合物可以被配制用于通过注射(包括使用常规导管插入技术)或输注进行肠胃外施用。用于注射的配制品可以以具有防腐剂的单位剂型呈现(例如,在安瓿或多剂量容器中)。所述组合物可以采取如在油性或水性媒介物中的悬浮液、溶液或乳液的形式,并且可以含有配制剂,如本领域技术人员认可的悬浮剂、稳定剂和/或分散剂。可替代
地,所述活性成分可以呈粉末形式,以供在使用前用合适的媒介物(例如无菌无热原水)重构。
[0629]
可以将所述药物组合物直接施用至中枢神经系统。因此,在某些实施方案中,将所述组合物直接施用至中枢神经系统以避开血脑屏障。在一些实施方案中,可以经由直接脊髓注射施用所述组合物。在实施方案中,通过鞘内注射施用所述组合物。在一些实施方案中,经由脑室内注射施用所述组合物。在实施方案中,将所述组合物施用至大脑侧脑室中。在实施方案中,将所述组合物施用至两个大脑侧脑室中。在另外的实施方案中,经由海马内注射施用所述组合物。可以在一次注射或多次注射中施用所述组合物。在其他实施方案中,将所述组合物施用至多于一个位置(例如,施用至中枢神经系统中的两个部位)。
[0630]
所述药物组合物可以呈无菌注射剂的形式。可以将所述药物组合物通过例如通过保留细菌的过滤器过滤或通过掺入呈无菌固体组合物的形式的灭菌剂来灭菌,所述灭菌剂可以紧接在使用前溶解于无菌水或一些其他无菌可注射介质中。为了制备这种组合物,将活性成分溶解或悬浮在肠胃外可接受的液体媒介物中。示例性的媒介物和溶剂包括但不限于水、通过添加适量的盐酸、氢氧化钠或合适的缓冲液调节至合适ph的水、1,3-丁二醇、林格氏液和等渗氯化钠溶液。所述药物组合物还可以含有一种或多种防腐剂,例如对羟基苯甲酸甲酯、对羟基苯甲酸乙酯或对羟基苯甲酸正丙酯。为了提高溶解度,可以添加溶解增强剂或增溶剂,或者所述溶剂可以含有10%-60%w/w的丙二醇等。
[0631]
所述药物组合物可以含有一种或多种药学上可接受的无菌等渗水溶液或非水溶液、分散液、悬浮液或乳液或可在使用前重构成无菌可注射溶液或分散液的无菌粉末。此类药物组合物可以含有抗氧化剂;缓冲液;抑菌剂;溶质,其使配制品与预期接受者的血液等渗;悬浮剂;增稠剂;防腐剂;等等。
[0632]
可以用于本发明的药物组合物中的合适的水性和非水性载体的例子包括水、乙醇、多元醇(诸如甘油、丙二醇、聚乙二醇等)及其合适的混合物、植物油(诸如橄榄油)以及可注射的有机酯(诸如油酸乙酯)。可以例如通过使用包衣材料(诸如卵磷脂)、在分散液的情况下通过维持所要求的粒度以及通过使用表面活性剂来维持适当流动性。在一些实施方案中,为了延长活性成分的作用,期望减缓来自皮下或肌内注射的化合物的吸收。这可以通过使用水溶性差的结晶或无定形材料的液体悬浮液来实现。那么活性成分的吸收速率取决于其溶解速率,所述溶解速率又可以取决于晶体粒度和晶型。可替代地,通过将化合物溶解或悬浮在油性媒介物中来实现肠胃外施用的活性成分的延迟吸收。另外,可以通过包含延迟吸收的药剂(诸如单硬脂酸铝和明胶)来实现可注射药物形式的延迟吸收。
[0633]
控制释放的肠胃外组合物可以呈水性悬浮液、微球、微胶囊、磁性微球、油溶液、油悬浮液、乳液的形式,或者可以将所述活性成分掺入一种或多种生物相容性载体、脂质体、纳米颗粒、植入物或输注装置中。用于制备微球和/或微胶囊的材料包括但不限于可生物降解/可生物消化的聚合物,诸如聚乳酸羟基乙酸(polyglactin)、聚-(氰基丙烯酸异丁酯)、聚(2-羟乙基-l-谷氨酰胺)和聚(乳酸)。当配制控制释放的肠胃外配制品时,可以使用的生物相容性载体包括碳水化合物(诸如葡聚糖)、蛋白质(诸如白蛋白、脂蛋白或抗体)。用于植入物的材料可以是不可生物降解的(例如,聚二甲基硅氧烷)或可生物降解的(例如像聚(己内酯)、聚(乳酸)、聚(乙醇酸)或聚(原酸酯))。
[0634]
对于外用施用,本发明公开的化合物可以被配制为软膏或乳膏。本发明公开的化
合物也可以被配制成直肠组合物,诸如栓剂或保留灌肠剂,例如含有常规栓剂基质(诸如可可脂或其他甘油酯)。
[0635]
对于鼻内施用或通过吸入施用,本发明公开的化合物可以方便地以溶液或悬浮液的形式从由患者挤压或泵送的泵喷雾容器递送,或者作为气雾剂喷雾在使用合适的推进剂(例如,二氯二氟甲烷、三氯氟甲烷、二氯四氟乙烷、二氧化碳或其他合适的气体)的情况下从加压容器或雾化器提供。在加压气雾剂的情况下,剂量单位可以通过提供递送计量量的阀来确定。所述加压容器或雾化器可以含有本发明公开的化合物的溶液或悬浮液。用于吸入器或吹入器的胶囊和筒(例如,由明胶制成)可以被配制为含有本发明公开的化合物和合适的粉末基质(诸如乳糖或淀粉)的粉末混合物。
[0636]
通常,将本文所述的药剂和组合物以足以治疗或预防有需要的受试者的认知功能障碍和/或步态异常的有效量或量施用。典型地,可以基于例如年龄、身体状况、体重、性别、饮食、施用时间和其他临床因素在该范围内调整剂量。有效量的确定完全在本领域技术人员的能力之内。
[0637]
已经在本文中进行了一般性描述,提供了以下非限制性实施例和附图以进一步说明本发明,其中:
[0638]
图1是示出了根据本文实施例5的vmri测量和tbm分析确定的对于a组患者用式(i)的化合物治疗52周后平均全脑体积(wbv)的变化和对于患者5的wbv变化的图。
[0639]
实施例
[0640]
化学合成的一般程序
[0641]
一般程序a:用三光气形成氨基甲酸酯
[0642]
在室温下向盐酸胺(1当量)和三乙胺(3-4当量)在thf(浓度为约0.2m)中的悬浮液中添加三光气(0.35当量)。将反应混合物搅拌10min,并添加少量醚(1-2ml)。过滤掉三乙铵盐以提供异氰酸盐在thf/醚中的透明溶液。
[0643]
在室温下向醇(1.5当量)在thf(浓度为约0.2m)中的溶液中添加nah[60%,油](1.5当量)。将反应混合物搅拌15min,并逐滴添加上述溶液(在thf/醚中的异氰酸盐)。在标准处理中,用盐水淬灭反应。将溶液用etoac萃取,并且将有机层经na2so4干燥,过滤并浓缩。将粗物质在combiflash(sio2筒,chcl3和在meoh中的2n nh3)上纯化以提供相应的氨基甲酸酯。
[0644]
一般程序b:用有机铈烷基化
[0645]
将cecl3(4当量)在thf(浓度为约0.2m)中的悬浮液在室温下搅拌1h。将悬浮液冷却至-78℃,并逐滴添加meli/醚[1.6m](4当量)。使有机铈络合物形成1h的时间,并逐滴添加腈(1当量)在thf(浓度为2.0m)中的溶液。将反应混合物升温至室温并搅拌18h。将溶液冷却至0℃,用水(约1ml)淬灭,接着添加50%氢氧化铵水溶液(约3ml),直至沉淀形成并沉降到烧瓶底部。将混合物通过硅藻土垫过滤并浓缩。用hcl/二噁烷[4.0m]溶液处理粗物质。将中间体芳基丙-2-胺盐酸盐在醚中研制,并将其原样用于下一步骤。可替代地,将粗游离碱胺在combiflash(sio2筒,chcl3和在meoh中的2n nh3)上纯化以提供相应的芳基丙胺。
[0646]
一般程序c:铃木偶联(suzuki coupling)
[0647]
向芳基卤(1当量)在dme/水[4:1](浓度为约0.2m)混合物中的溶液中添加硼酸(2当量)、钯催化剂(0.1-0.25当量)和碳酸钠(2当量)。将反应混合物在150℃下微波处理
25min。通过硅藻土塞过滤并浓缩后,将粗产物在combiflash(sio2筒,chcl3和在meoh中的2n nh3)上纯化以提供相应的偶联加合物。
[0648]
可替代地:向芳基卤(1当量)在甲苯/水[20:1](浓度为约0.2m)混合物中的溶液中添加硼酸(1.3-2.5当量)、钯催化剂(0.05-0.15当量)、三环己基膦(0.15-0.45当量)和磷酸钾(5当量)。将反应混合物在150℃下微波处理25min。通过硅藻土塞过滤并浓缩后,将粗产物在combiflash(sio2筒,chcl3和在meoh中的2n nh3)上纯化以提供相应的偶联加合物。
[0649]
一般程序d:环丙烷化
[0650]
向在-70℃下搅拌的芳基腈(1当量)和ti(oi-pr)4(1.7当量)的混合物中逐滴添加etmgbr[在醚中3.0m](1.1当量)。将反应混合物升温至25℃并搅拌1h。在25℃下向上述混合物中逐滴添加bf3·
et20(3当量)。添加后,将混合物再搅拌2h,然后用hcl溶液[2m]淬灭。然后通过添加naoh水溶液[2m]将所得溶液碱化。用乙醚萃取有机物质。合并有机层,经na2so4干燥,过滤并浓缩。通过硅胶柱色谱(用石油醚/etoac:10/1至1/1洗脱)纯化粗物质得到相应的1-芳基-环丙胺。
[0651]
一般程序e:使用铃木条件的联芳偶联
[0652]
向芳基卤组分(1当量)在5:1(v/v)二噁烷/水(约0.15m)或5:1(v/v)n,n-二甲基甲酰胺(约0.15m)中的搅拌溶液中添加芳基硼酸酯或芳基硼酸组分(1-1.5当量)、碳酸钠(2-3当量)和[1,1'-双(二苯基膦基)二茂铁]二氯化钯(ii)(0.05当量)。将混合物加热(90℃)过夜,然后通过硅藻土塞过滤。将硅藻土用乙酸乙酯冲洗,并将合并的滤液用盐水洗涤,干燥(na2so4)并浓缩。将残余物通过快速色谱在二氧化硅上纯化。
[0653]
一般程序f:使用经由混合酸酐/柯提斯重排路线产生的异氰酸酯形成氨基甲酸酯
[0654]
向羧酸组分(1当量)在四氢呋喃(约0.1m)中的搅拌溶液中添加三乙胺(2当量)。将反应冷却(0℃)并用氯甲酸异丁酯(1.5当量)处理。在0℃下1小时后,添加叠氮化钠(2当量)在水(约1m)中的溶液,将反应升温至室温。搅拌过夜后,将反应用水稀释并用乙酸乙酯萃取。将合并的萃取物用碳酸氢钠水溶液和盐水洗涤,干燥(na2so4)并浓缩。将粗酰基叠氮化物经由与甲苯共蒸发进一步干燥,然后溶于甲苯(约0.1m)中。将搅拌的溶液回流2-2.5小时,冷却并用醇组分(1.25-2当量)处理。将反应在回流下加热过夜,然后浓缩。将残余物溶于乙酸乙酯或氯仿中,并用碳酸钠水溶液洗涤,(na2so4)并浓缩。使用氯仿/甲醇(极性较小的氨基甲酸酯)或氯仿/甲醇/氨(极性较大的氨基甲酸酯)溶剂梯度通过快速色谱在二氧化硅上纯化粗产物。
[0655]
实施例1:奎宁环化合物的合成
[0656]
1-氮杂双环[2.2.2]辛-3-基[2-(4'-氟联苯-3-基)丙-2-基]氨基甲酸酯(化合物1)
[0657]
使用一般程序c、1-氮杂双环[2.2.2]辛-3-基[2-(3-溴苯基)丙-2-基]氨基甲酸酯(600mg,1.63mmol)、4-氟苯基硼酸(457mg,3.27mmol)和乙酸钯(ii)得到呈白色固体的标题化合物(373mg;60%)。1h nmr(400mhz,cdcl3)δ7.56(s,1h),7.52(dd,j=5.4,8.4hz,2h),7.42-7.38(m,3h),7.12(m,2h),5.18(5,1h),4.62(s,1h),2.66(m,6h),1.72(s,6h),2.01-0.83(m,5h)ppm。
13
c nmr(100mhz,cdcl3)δ125.0,124.0,123.8,116.0,116.0,71.3,55.9,55.5,47.6,46.7,29.6,25.6,24.8,19.8ppm。纯度:98.0%uplcms(210nm);保留时间:0.95min;(m 1)382.9。c
23h27
fn2o2·
0.37(chcl3)的分析计算值:c,65.86;h,6.47;n,6.57。
实测值:c,65.85;h,6.69;n,6.49。
[0658]
(s)-奎宁环-3-基2-(2-(4-氟苯基)噻唑-4-基)丙-2-基氨基甲酸酯(化合物2)
[0659]
向4-氟硫代苯甲酰胺(8.94g,57.6mmol)在乙醇(70ml)中的搅拌溶液中添加4-氯乙酰乙酸乙酯(7.8ml,58mmol)。将反应在回流下加热4小时,添加4-氯乙酰乙酸乙酯(1.0ml,7.4mmol)的等分试样进行处理,并且回流另外3.5小时。然后将反应浓缩并将残余物在乙酸乙酯(200ml)与nahco3水溶液(200ml)之间分配。将有机层与水层的反萃取物(乙酸乙酯,1x约75ml)合并,干燥(na2so4)并且浓缩。将所得的琥珀色油使用己烷/乙酸乙酯梯度通过快速色谱纯化以提供呈低熔点的几乎无色的固体的2-(2-(4-氟苯基)噻唑-4-基)乙酸乙酯(13.58g,89%)。
[0660]
向2-(2-(4-氟苯基)噻唑-4-基)乙酸乙酯(6.28g,23.7mmol)在dmf(50ml)中的搅拌溶液中添加氢化钠[在矿物油中的60%分散液](2.84g,71.0mmol)。将泡沫状混合物搅拌15分钟,然后在冰浴中冷却并添加碘甲烷(4.4ml,71mmol)。将反应搅拌过夜,使冷却浴缓慢升温至室温。然后将混合物浓缩,并将残余物在乙酸乙酯(80ml)与水(200ml)之间分配。将有机层用第二部分的水(1x200ml)洗涤,干燥(na2so4)并浓缩。将所得的琥珀色油使用己烷/乙酸乙酯梯度通过快速色谱纯化以提供呈无色油的2-(2-(4-氟苯基)噻唑-4-基)-2-甲基丙酸乙酯(4.57g,66%)。
[0661]
向2-(2-(4-氟苯基)噻唑-4-基)-2-甲基丙酸乙酯(4.56g,15.5mmol)在1:1:1thf/乙醇/水(45ml)中的搅拌溶液中添加氢氧化锂一水合物(2.93g,69.8mmol)。将反应搅拌过夜,浓缩并再溶解于水(175ml)中。将溶液用醚(1x100ml)洗涤,通过添加1.0n hcl(80ml)酸化,并用乙酸乙酯(2x70ml)萃取。将合并的萃取物干燥(na2so4)并浓缩以得到呈白色固体的2-(2-(4-氟苯基)噻唑-4-基)-2-甲基丙酸(4.04g,98%)。将该物质用于下一步骤而无需纯化。
[0662]
向2-(2-(4-氟苯基)噻唑-4-基)-2-甲基丙酸(4.02g,15.2mmol)在thf(100ml)中的搅拌并冷却(0℃)的溶液中添加三甲胺(4.2ml,30mmol),接着添加氯甲酸异丁酯(3.0ml,23mmol)。将反应再冷搅拌1小时,然后添加叠氮化钠(1.98g,30.5mmol)在水(20ml)中的溶液。将反应搅拌过夜,使冷却浴缓慢升温至室温。将混合物用水(100ml)稀释并用乙酸乙酯(2x60ml)萃取。将合并的萃取物用nahco3水溶液(1x150ml)和盐水(1x100ml)洗涤,干燥(na2so4)并浓缩。在与甲苯(2x50ml)共蒸发后,将所得的白色固体溶于甲苯(100ml)中并回流4小时。然后添加(s)-3-奎宁环醇(3.87g,30.4mmol)并继续回流过夜。将反应浓缩并将残余物在乙酸乙酯(100ml)与nahco3水溶液(150ml)之间分配。将有机层用水(1x150ml)洗涤,干燥(na2so4)并浓缩。将所得的灰白色固体使用氯仿/甲醇/氨梯度通过快速色谱纯化以提供呈白色固体的标题化合物(4.34g,73%)。1h nmr(400mhz,cdcl3)δ7.96-7.88(m,2h),7.16-7.04(m,3h),5.55(br s,1h),4.69-4.62(m,1h),3.24-3.11(m,1h),3.00-2.50(m,5h),2.01-1.26(m,11h)ppm。
13
c nmr(400mhz,cdcl3)δ166.4,165.1,163.8(d,j=250.3hz),162.9,155.0,130.1(d,j=3.3hz),128.4(d,j=8.5hz),115.9(d,j=22.3hz),112.5,71.2,55.7,54.2,47.5,46.5,28.0,25.5,24.7,19.6ppm。纯度:100%uplcms(210nm和254nm);保留时间0.83min;(m 1)390。
[0663]
(s)-奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯(化合物3)
[0664]
使用一般程序e和反应输入物2-(4-溴苯基)-2-甲基丙酸乙酯和4-(2-甲氧基乙氧基)苯基硼酸,制备呈灰白色固体的2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯]-4-基)-2-甲基丙酸乙酯。向该化合物(3.01g,8.78mmol)在1:1:1(v/v)四氢呋喃/乙醇/水(45ml)中的搅拌溶液中添加氢氧化锂一水合物(1.47g,61.4mmol)。将混合物加热回流过夜,然后浓缩。将残余物溶解在水中,用1n盐酸(65ml)处理并用乙酸乙酯萃取。将合并的有机层用盐水洗涤,干燥(na2so4)并浓缩以提供呈白色固体的2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯]-4-基)-2-甲基丙酸(2.75g,100%)。按照一般程序f使该中间体和(s)-奎宁环-3-醇反应以产生呈无色玻璃状固体的标题化合物。1h nmr(400mhz,dmso-d6)δ7.62-7.29(m,7h),7.01(d,j=8.9hz,2h),4.47-4.37(m,1h),4.17-4.08(m,2h),3.72-3.62(m,2h),3.32(s,3h),3.09-2.25(m,6h),2.05-1.18(m,11h)ppm。
13
c nmr(100mhz,dmso-d6)δ157.9,154.5,146.7,137.4,132.5,127.5,125.7,125.2,114.8,70.4,70.0,66.9,58.2,55.4,54.2,46.9,45.9,29.4,25.3,24.2,19.2ppm。纯度:100%,100%(210和254nm)uplcms;保留时间:0.87min;(m h
)439.5。
[0665]
1-氮杂双环[2.2.2]辛-3-基[2-(联苯-3-基)丙-2-基]氨基甲酸酯(化合物4)
[0666]
使用一般程序c、1-氮杂双环[2.2.2]辛-3-基[2-(3-溴苯基)丙-2-基]氨基甲酸酯(600mg,1.63mmol)、苯基硼酸(398mg,3.27mmol)和乙酸钯(ii)得到呈白色固体的标题化合物(379mg,64%)。1h nmr(400mhz,cdcl3)δ7.61(s,1h),7.56(d,j=7.4hz,2h),7.50-7.38(m,4h),7.34(m,2h),5.16(s,1h),4.63(s,1h),3.39-2.09(m,6h),1.72(s,6h),2.02-0.73(m,5h)ppm。
13
c nmr(100mhz,cdcl3)δ154.8,147.8,141.6,129.0,129.0,128.6,127.5,125.8,125.0,124.0,71.6,71.3,55.9,55.5,47.6,46.8,31.5,30.2,30.0,29.5,25.6,24.8,19.8ppm。纯度:99%uplcms(210nm);保留时间0.84min;(m 1)365.0。c
23h28
n2o2·
0.29(chcl3)的分析计算值:c,70.02;h,7.14;n,7.01。实测值:c,70.02;h,7.37;n,6.84。
[0667]
(s)-奎宁环-3-基2-(联苯-4-基)丙-2-基氨基甲酸酯(化合物5)
[0668]
使用一般程序b将溴苯甲腈(2.00g,11.0mmol)转化为呈棕色油的相应的2-(4-溴苯基)丙-2-胺(1.20g,51%)。
[0669]
使用一般程序a、2-(4-溴苯基)丙-2-胺(1.0g,4.7mmol)和(s)-奎宁环-3-醇得到(s)-奎宁环-3-基2-(4-溴苯基)丙-2-基氨基甲酸酯(1.0g,58%)。
[0670]
使用一般程序c、上述溴化物(200mg,0.540mmol)、苯基硼酸(133mg,1.10mmol)和[pdcl2(pddf)]ch2cl2得到呈白色固体的标题化合物(70mg,35%)。1h nmr(500mhz,cdcl3)δ7.60-7.53(m,4h),7.47(d,j=8.5hz,2h),7.42(t,j=7.5hz,2h),7.33(t,j=7.5hz,1h),5.26(br s,1h),4.64(m,1h),3.33-3.15(m,1h),3.10-2.45(m,5h),2.40-1.80(m,2h),1.78-1.58(m,7h),1.55-1.33(m,2h)ppm。
13
c nmr(125mhz,cdcl3)δ154.5,146.1,140.8,139.5,128.7,127.2,127.1,127.1,125.2,70.9,55.5,55.1,47.4,46.4,31.1,29.5,25.3,24.5,19.5ppm。纯度:100%lcms(214nm和254nm);保留时间:1.56min;(m 1)365。
[0671]
奎宁环-3-基1-(联苯-4-基)环丙基氨基甲酸酯(化合物6)
[0672]
使用一般程序d,将溴苯甲腈(3.00g,16.5mmol)转化为呈黄色固体的相应1-(4-溴苯基)环丙胺(1.80g,51%)。
[0673]
使用一般程序a、1-(4-溴苯基)环丙胺(1.0g,4.7mmol)和奎宁环-3-醇得到呈白色半固体的奎宁环-3-基1-(4-溴苯基)环丙基-氨基甲酸酯(1.3g,75%)。
[0674]
使用一般程序c、上述氨基甲酸酯(400mg,1.12mmol)、苯基硼酸(267mg,2.22mmol)和[pdcl2(pddf)]ch2cl2得到呈粘性油的标题化合物(100mg,25%)。1h nmr(500mhz,cdcl3)δ7.47(d,j=7.5hz,2h),7.43(d,j=8.0hz,2h),7.33(t,j=7.5hz,2h),7.26-7.15(m,3h),5.93(br s,0.6h),5.89(br s,0.4h),4.67(m,1h),3.20-3.06(m,1h),2.88-2.42(m,5h),1.98-1.08(m,9h)ppm。
13
c nmr(125mhz,cdcl3)δ155.0,141.0,139.7,138.2,127.7,126.1,126.0,124.8,124.1,70.0,54.5,46.3,45.4,34.1,24.3,23.2,18.3,17.0ppm。纯度:100%lcmc(214nm和254nm);保留时间:1.52min;(m 1)363。
[0675]
(s)-奎宁环-3-基1-(4'-氟联苯-4-基)环丙基氨基甲酸酯(化合物7)
[0676]
使用一般程序c、(s)-奎宁环-3-基1-(4-溴苯基)环丙基氨基甲酸酯、4-f-苯基硼酸和[pdcl2(pddf)]ch2cl2得到呈白色固体的标题化合物(45%)。1h nmr(500mhz,dmso-d6)δ8.06-7.83(d,1h),7.69-7.66(m,2h),7.59-7.55(m,2h),7.29-7.22(m,4h),4.56-4.54(m,1h),3.13-2.32(m,6h),1.91-1.19(m,9h)ppm。
13
c nmr(125mhz,dmso-d6)δ163.2,161.2,156.4,143.7,136.9,128.9,128.8,126.8,125.6,116.2,116.0,70.7,55.8,47.4,46.4,34.8,25.7,24.6,19.6,18.7,18.6ppm。纯度:》97%lcms(214nm和254nm);保留时间1.96min;(m 1)381.2。
[0677]
(s)-1-氮杂双环[2.2.2]辛-3-基[1-(2',4'-二氟联苯-4-基)环丙基]氨基甲酸酯(化合物8)
[0678]
使用一般程序c、(s)-奎宁环-3-基1-(4-溴苯基)环丙基氨基甲酸酯(0.446g,1.22mmol)、2,4-二氟苯基硼酸(0.386g,2.44mmol)和pd(oac)2(0.015g,0.067mmol)得到呈棕褐色固体的标题化合物(0.111g,23%)。1h nmr(cdcl3)δ7.43(dd,j=8.4,1.6hz,2h),7.40-7.33(m,1h),7.31(d,j=7.7hz,2h),6.99-6.81(m,2h),5.54(d,j=48.0hz,1h),4.82-4.65(m,1h),3.30-3.07(m,1h),2.98-2.44(m,5h),1.97(d,j=32.7hz,1h),1.83(d,j=10.3hz,1h),1.64(s,1h),1.52(s,1h),1.39(s,1h),1.31(d,j=6.8hz,4h)ppm。
13
c nmr主要的旋转异构体(cdcl3)δ162.2(dd,j=12.8,249.1hz),159.8(dd,j=11.8,251.0hz),156.9,156.0,142.6,133.1,131.3(m),128.9,125.6,124.9,111.5(dd,j=3.9,21.2hz)104.4(dd,j=25.2,29.4hz),72.1,71.6,55.7,47.4,46.5,35.7,35.3,25.5,24.6,24.4,19.5,18.1ppm。纯度:lcms》99.3%(214nm和254nm);保留时间:0.90min;(m 1)399.0。
[0679]
1-氮杂双环[2.2.2]辛-3-基[1-(4'-甲氧基联苯-4-基)环丙基]氨基甲酸酯(化合物9)
[0680]
使用一般程序c、奎宁环-3-基1-(4-溴苯基)环丙基氨基甲酸酯(0.485g,1.33mmol)、4-甲氧基苯基硼酸(0.404g,2.66mmol)和pd(oac)2(0.016g,0.071mmol)得到呈灰色固体的标题化合物(0.337mg,65%)。1h nmr(cdcl3)δ7.48(dd,j=8.6,5.5hz,4h),7.29(d,j=7.6hz,2h),6.96(d,j=8.8hz,2h),5.58(d,j=48.7hz,1h),4.83-4.63(m,1h),3.84(s,3h),3.20(dd,j=24.0,15.5hz,1h),2.97-2.42(m,5h),1.97(d,j=30.9hz,1h),1.81(s,1h),1.75-1.33(m,3h),1.28(d,j=6.8hz,4h)ppm。
13
c nmr主要的旋转异构体(cdcl3)δ159.1,156.0,141.4,139.0,133.4,128.0,126.7,125.9,114.2,71.5,55.7,55.3,47.4,46.5,35.3,25.5,24.6,19.6,17.8ppm。纯度:lcms》97.1%(214nm和254nm);保留时间:0.88min;(m 1)393.4。
[0681]
奎宁环-3-基2-(5-(4-氟苯基)噻吩-3-基)丙-2-基氨基甲酸酯(化合物10)
[0682]
向5-溴噻吩-3-甲酸乙酯(13.30g,56.57mmol)在thf(100ml)中的搅拌并冷却(0℃)的溶液中经20分钟逐滴添加甲基溴化镁在乙醚[3.0m](55.0ml,165mmol)中的溶液。2小时后,将反应溶液浓缩。将残余物溶于nh4cl水溶液(200ml)中并用乙酸乙酯(2x100ml)萃取。将合并的萃取物干燥(na2so4)并浓缩。将所得的琥珀色油使用己烷/乙酸乙酯梯度通过快速色谱纯化,提供呈淡琥珀色油的2-(5-溴噻吩-3-基)丙-2-醇(8.05g,64%)。
[0683]
向2-(5-溴噻吩-3-基)丙-2-醇(8.03g,36.3mmol)在二氯甲烷(80ml)中的搅拌溶液中添加叠氮化钠(7.08g,109mmol),接着添加三氟乙酸(8.0ml;经5-6分钟逐滴添加)。将增稠的悬浮液搅拌1.5小时,然后用水(350ml)稀释并用乙酸乙酯(1x200ml)萃取。将有机层用nahco3水溶液(1x250ml)洗涤,干燥(na2so4)并浓缩以提供粗叠氮化物产物。向该物质在thf(160ml)中的搅拌溶液中添加水(11ml),接着添加三苯基膦(23.8g,90.7mmol)。将反应搅拌2天,然后浓缩。将所得残余物溶于乙酸乙酯(250ml)中,并用1n hcl水溶液(4x75ml)萃取。将合并的萃取物用浓缩的nh4oh碱化,并用乙酸乙酯(2x100ml)萃取。将这些萃取物依次干燥(na2so4)并浓缩。将所得的琥珀色油使用二氯甲烷/甲醇/氨梯度通过快速色谱纯化以提供呈粘性琥珀色油的2-(5-溴噻吩-3-基)丙-2-胺和三苯基氧化膦(约70/30比率)的混合物(1.32g,17%)。
[0684]
向3-奎宁环醇(3.00g,23.6mmol)在thf(100ml)中的搅拌溶液中添加4-硝基苯基氯甲酸酯(5.94g,29.5)。搅拌4小时后,将沉淀物过滤出,用thf冲洗,并在操作室真空下在釉料(frit)上风干。将滤饼溶解于乙酸乙酯(150ml)中,并用nahco3水溶液(1x150ml)和水(2x150ml)洗涤。将有机层干燥(na2so4)并浓缩以提供粗产物4-硝基苯基奎宁环-3-基碳酸盐,将所述粗产物用于下一步骤而无需纯化。
[0685]
向2-(5-溴噻吩-3-基)丙-2-胺(0.366g,1.66mmol)在thf(10ml)中的搅拌溶液中添加4-硝基苯基奎宁环-3-基碳酸酯(0.571g,1.95mmol)和一些4-(二甲基氨基)吡啶颗粒。将混合物回流过夜,浓缩并在乙酸乙酯(50ml)与nahco3水溶液(50ml)之间分配。将有机层再次用nahco3水溶液(1x50ml)洗涤,干燥(na2so4)并浓缩。将所得的黄不溜秋的胶状物使用氯仿/甲醇/氨梯度通过快速色谱纯化以提供呈灰白色固体的奎宁环-3-基(1-(5-溴噻吩-3-基)环丙基)氨基甲酸酯(0.305g,49%)。
[0686]
使用一般程序c、奎宁环-3-基(1-(5-溴噻吩-3-基)环丙基)氨基甲酸酯(0.227g,0.742mmol)、4-氟苯基硼酸(0.208g,1.49mmol)、三环己基膦(0.021g,0.075mmol)、磷酸钾(0.866,4.08mmol)和乙酸钯(8.0mg,36μmol)得到呈灰色固体的标题化合物(0.142g,49%)。1h nmr(400mhz,cdcl3)δ7.60-7.45(m,2h),7.24-7.19(m,1h),7.10-6.97(m,3h),5.23(br s,1h),4.72-4.61(m,1h),3.30-3.04(m,1h),3.03-2.25(m,5h),2.09-1.02(m,11h)ppm。
13
c nmr(400mhz,cdcl3)δ162.3(d,j=247.1hz),154.5,149.8,143.6,130.7,127.4(d,j=8.1hz),121.8,118.9,115.8(d,j=21.6hz),70.8,55.5,53.4,47.3,46.4,29.0,25.4,24.4,19.4ppm。纯度:95.8%uplcms(210nm和254nm);保留时间:0.90min;(m 1)389。
[0687]
(s)-奎宁环-3-基2-(3-(4-氟苯基)异噻唑-5-基)丙-2-基氨基甲酸酯(化合物11)
[0688]
向2-(3-(4-氟苯基)异噻唑-5-基)丙-2-胺(1.21g,5.12mmol)在甲苯中的搅拌溶液中添加光气在甲苯[约1.9m](10.8ml,20.5mmol)中的溶液。将反应在回流下加热两个小时,然后浓缩。将残余物与甲苯(2x15ml)共蒸发以提供呈金色油的粗异氰酸酯中间体。将该
物质溶于甲苯(10ml)中并用(s)-3-奎宁环醇(0.749g,5.89mmol)处理。将反应在回流下加热过夜并浓缩。将残余物使用氯仿/甲醇/氨梯度通过快速色谱纯化以提供呈白色固体的标题化合物(0.971g,49%)。1h nmr(400mhz,dmso-d6)δ8.09-8.00(m,2h),7.87(br s,1h),7.75(s,1h),7.35-7.25(m,2h),4.54-4.45(m,1h),3.14-2.92(m,1h),2.87-2.17(m,5h),1.98-0.98(m,11h)ppm。
13
c nmr(400mhz,dmso-d6)δ180.1,165.6,162.6(d,j=246.4hz),154.7,131.2(d,j=3.0hz),128.7(d,j=8.4hz),118.2,115.7(d,j=21.8hz),70.6,55.3,52.8,46.9,45.9,29.9,25.2,24.2,19.2ppm。纯度:100%uplcms(210nm和254nm);保留时间:0.82min;(m 1)390。
[0689]
(s)-奎宁环-3-基2-(4-(4-氟苯基)噻唑-2-基)丙-2-基氨基甲酸酯(化合物12)
[0690]
向3-氨基-3-硫酮丙酸乙酯(20.00g,135.9mmol)在乙醇(120ml)中的搅拌溶液中添加2-溴-4'-氟苯乙酮(29.49g,135.9mmol)。将混合物回流1小时,浓缩并在乙酸乙酯(300ml)与nahco3水溶液(400ml)之间分配。将有机层与水层的反萃取物(乙酸乙酯,1x约100ml)合并,干燥(na2so4)并且浓缩。将所得的浅棕色固体使用己烷/乙酸乙酯梯度通过快速色谱纯化以提供呈灰白色固体的2-(4-(4-氟苯基)噻唑-2-基)乙酸乙酯(29.92g,83%)。
[0691]
向2-(4-(4-氟苯基)噻唑-2-基)乙酸乙酯(10.00g,37.69mmol)在thf(250ml)中的搅拌并冷却(-78℃)的溶液中经15分钟逐滴添加叔-丁醇钾在thf[1.0m](136ml,136mmol)中的溶液,接着添加18-冠醚-6(1.6ml,7.5mmol)。在-78℃下另外30分钟后,经5分钟逐滴添加碘甲烷(8.5ml)。将反应再冷搅拌2小时,然后倒入水(450ml)中并用乙酸乙酯(2x150ml)萃取。将合并的萃取物用盐水(1x200ml)洗涤,干燥(na2so4)并浓缩。将所得的棕色油使用己烷/乙酸乙酯梯度通过快速色谱纯化以提供呈淡琥珀色油的2-(4-(4-氟苯基)噻唑-2-基)-2-甲基丙酸乙酯(8.64g,78%)。
[0692]
向2-(4-(4-氟苯基)噻唑-2-基)-2-甲基丙酸乙酯(0.900g,3.07mmol)在1:1:1thf/乙醇/水(15ml)中的搅拌溶液中添加氢氧化锂一水合物(0.451g,10.7mmol)。搅拌过夜后,将反应浓缩并重新溶解在水(80ml)中。将溶液用醚(1x50ml)洗涤,通过添加1n hcl(15ml)酸化,并用乙酸乙酯(2x50ml)萃取。将合并的萃取物干燥(na2so4)并浓缩以得到作为淡金色固体的2-(4-(4-氟苯基)噻唑-2-基)-2-甲基丙酸(0.808g,99%)。
[0693]
向2-(4-(4-氟苯基)噻唑-2-基)-2-甲基丙酸(0.784g,2.96mmol)在thf(25ml)中的搅拌并冷却(0℃)的溶液中添加三乙胺(0.82ml,5.9mmol),接着添加氯甲酸异丁酯(0.58ml,4.4mmol)。将反应再冷搅拌1小时,然后添加叠氮化钠(0.385g,5.92mmol)在水(7ml)中的溶液。将反应搅拌过夜,使冷却浴缓慢升温至室温。将混合物用水(100ml)稀释并用乙酸乙酯(2x60ml)萃取。将合并的萃取物用nahco3水溶液(1x150ml)和盐水(1x100ml)洗涤,干燥(na2so4)并浓缩。在与甲苯(2x30ml)共蒸发后,将所得的灰白色固体溶于甲苯(25ml)中并回流4小时。然后添加(s)-3-奎宁环醇(0.753g,5.92mmol)并继续回流3小时。将反应浓缩并将残余物使用氯仿/甲醇/氨梯度通过快速色谱纯化以提供呈白色固体的标题化合物(0.793g,69%)。1h nmr(400mhz,cdcl3)δ7.90-7.81(m,2h),7.32(s,1h),7.14-7.05(m,2h),5.76(br s,1h),4.72-4.65(m,1h),3.26-3.10(m,1h),3.03-2.37(m,5h),2.05-1.23(m,11h)ppm。
13
c nmr(400mhz,cdcl3)δ177.6,162.6(d,j=248.4hz),154.8,153.6,130.8(d,j=3.2hz),128.1(d,j=8.1hz),115.9(d,j=21.7hz),112.2,71.6,55.7,47.4,46.5,29.1,25.4,24.7,19.6ppm。纯度:100%uplcms(210nm和254nm);保留时间:0.82min;
(m 1)390。
[0694]
奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯(化合物13)
[0695]
使用一般程序f和反应输入物2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯]-4-基)-2-甲基丙酸(如在实施例3中所述制备的)和奎宁环-3-醇,产生呈无色玻璃状固体的标题化合物(23%)。nmr数据与实施例3的数据相匹配。纯度:100%,99.1%(210和254nm)uplcms;保留时间:0.87min;(m h
)439.0。
[0696]
(s)-奎宁环-3-基(2-(3'-(2-甲氧基乙氧基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯(化合物14)
[0697]
将4-(2-甲氧基乙氧基)苯基硼酸更换为3-(2-甲氧基乙氧基)苯基硼酸,使用实施例3中概述的反应顺序来制备2-(3'-(2-甲氧基乙氧基)-[1,1'-联苯]-4-基)-2-甲基丙酸。按照一般程序f使该中间体和奎宁环-3-醇反应以产生呈玻璃状无色固体的标题化合物。1h nmr(400mhz,dmso-d6)δ7.63-7.31(m,6h),7.24-7.10(m,2h),6.92(dd,j=8.2,1.9hz,1h),4.51-4.34(m,1h),4.21-4.08(m,2h),3.72-3.64(m,2h),3.32(s,3h),3.09-2.26(m,5h),2.04-1.22(m,9h)ppm。
13
c nmr(100mhz,dmso-d6)δ158.9,154.6,147.6,141.5,137.6,129.9,126.3,125.2,118.9,113.2,112.5,70.4,70.0,66.9,58.2,55.4,54.2,46.9,45.9,29.4,25.3,24.2,19.2ppm。纯度:100%,100%(210和254nm)uplcms;保留时间:0.91min;15(m h
)439.4。
[0698]
奎宁环-3-基(2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯]-3-基)丙-2-基)氨基甲酸酯(化合物15)
[0699]
将2-(4-溴苯基)-2-甲基丙酸乙酯更换为2-(3-溴苯基)-2-甲基丙酸乙酯,使用实施例3中概述的反应顺序来制备2-(4'-(2-甲氧基乙氧基)-[1,1'-联苯]-3-基)-2-甲基丙酸。按照一般程序f使该中间体和奎宁环-3-醇反应以产生作为黄色固体的标题化合物。1h nmr(400mhz,dmso-d6)δ7.62-7.20(m,7h),7.03(d,j=8.7hz,2h),4.48-4.35(m,2h),4.18-4.08(m,2h),3.72-3.62(m,2h),3.32(s,3h),3.10-2.19(m,6h),2.10-1.10(m,11h)ppm。
13
c nmr(100mhz,dmso-d6)δ158.0,154.6,148.8,139.5,133.1,128.5,127.7,123.8,123.2,122.7,114.8,70.4,69.9,67.0,58.2,55.3,54.5,47.0,45.9,29.4,25.3,24.2,19.2ppm。纯度:97.4%,94.6%(210和254nm)uplcms;保留时间:0.88min;(m h
)439.3。
[0700]
奎宁环-3-基(2-(4'-(3-甲氧基丙氧基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯(化合物16)
[0701]
向4-碘苯酚(10.05g,45.68mmol)在乙腈(100ml)中的搅拌溶液中添加碳酸钾(6.95g,50.2mmol)和1-氯-3-甲氧基丙烷(6.4ml,57.1mmol)。将混合物加热回流过夜,然后浓缩。将残余物溶于水中并用乙酸乙酯萃取。将合并的提取物用碳酸氢钠水溶液洗涤,干燥(na2so4)并浓缩。将粗物质使用己烷/乙酸乙酯洗脱液通过快速色谱在二氧化硅上纯化以提供呈无色油的1-碘-4-(3-甲氧基丙氧基)苯(4.39g,33%)。按照一般程序e使该中间体和2-甲基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)丙酸乙酯反应,产生2-(4'-(3-甲氧基丙氧基)-[1,1'-联苯]-4-基)-2-甲基丙酸乙酯。向该化合物(0.693g,1.94mmol)在1:1:1(v/v)四氢呋喃/乙醇/水(10ml)中的搅拌溶液中添加氢氧化锂一水合物(0.326g,7.77mmol)。将混合物加热回流过夜,然后浓缩。将残余物溶解在水中,用1n盐酸
(10ml)处理并用乙酸乙酯萃取。将合并的有机层用盐水洗涤,干燥(na2so4)并浓缩以提供呈蜡状灰白色固体的2-(4'-(3-甲氧基乙氧基)-[1,1'-联苯]-4-基)-2-甲基丙酸(0.630g,99%)。按照一般程序f使该中间体和奎宁环-3-醇反应,产生呈玻璃状无色固体的标题化合物(62%)。1h nmr(400mhz,dmso-d6)δ7.61-7.29(m,7h),7.00(d,j=8.8hz,2h),4.47-4.36(m,1h),4.05(t,j=6.4hz,2h),3.48(t,j=6.3hz,2h),3.26(s,3h),3.10-2.25(m,6h),2.04-1.74(m,4h),1.65-1.23(m,9h)ppm。
13
c nmr(100mhz,dmso-d6)δ158.0,154.5,146.7,137.4,132.4,127.5,125.7,125.2,114.8,69.9,68.5,64.6,57.9,55.4,54.2,46.9,46.0,29.4,29.0,25.2,24.1,19.2ppm。纯度:97.7%,98.2%(210和254nm)uplcms;保留时间:0.96min;(m h
)453.5。
[0702]
奎宁环-3-基(2-(4'-(羟甲基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯(化合物17)
[0703]
使用一般程序e和反应输入物2-(4-溴苯基)-2-甲基丙酸乙酯和4-甲酰基苯基硼酸,制备呈淡琥珀固体的2-(4'-甲酰基-[1,1'-联苯]-4-基)-2-甲基丙酸乙酯。按照一般程序f使该中间体和奎宁环-3-醇反应以产生呈泡沫状黄色固体的奎宁环-3-基(2-(4'-甲酰基-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯。向该物质(0.755g,1.92mmol)在2:1(v/v)四氢呋喃/乙醇(15ml)中的搅拌溶液中添加硼氢化钠(0.073g,1.93mmol)。45分钟后,将反应用水稀释并用氯仿萃取。将合并的萃取物干燥(na2so4)并在二氧化硅上浓缩。使用氯仿/甲醇/氨洗脱液在二氧化硅上的快速色谱提供呈白色固体的标题化合物(0.323g,43%)。1h nmr(400mhz,dmso-d6)δ7.66-7.29(m,9h),5.18(t,j=5.7hz,1h),4.53(d,j=5.7hz,2h),4.46-4.37(m,1h),3.11-2.19(m,6h),2.11-1.10(m,11h)ppm。
13
c nmr(100mhz,dmso-d6)δ154.7,147.3,141.5,138.4,137.7,127.0,126.2,126.1,125.3,70.0,62.6,55.4,54.2,46.9,45.9,29.4,25.3,24.2,19.2ppm。纯度:97.5%,99.1%(210和254nm)uplcms;保留时间:0.73min;(m h
)395。
[0704]
奎宁环-3-基(2-(4'-(2-羟乙基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯(化合物18)
[0705]
使用一般程序e和反应输入物1-(2-(苄氧基)乙基)-4-溴苯和2-甲基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯基)丙酸乙酯,制备呈无色胶状物的2-(4'-(2-(苄氧基)乙基)-[1,1'-联苯]-4-基)-2-甲基丙酸乙酯。向该化合物(1.34g,3.33mmol)在1:1:1(v/v)四氢呋喃/乙醇/水(18ml)中的搅拌溶液中添加氢氧化锂一水合物(0.698g,16.6mmol)。在回流下加热过夜后,将反应浓缩并在水与乙醚之间分配。将所得的乳液用0.2n氢氧化钠水溶液(5x50ml)反复萃取。每次去除水层的透明部分。然后将合并的水层用1.0n盐酸(80ml)处理,并将所得的白色固体悬浮液用乙酸乙酯萃取。将合并的有机层干燥(na2so4)并浓缩,提供呈白色固体的2-(4'-(2-(苄氧基)乙基)-[1,1'-联苯]-4-基)-2-甲基丙酸(1.20g,96%)。按照一般程序f使该化合物和奎宁环-3-醇反应,产生奎宁环-3-基(2-(4'-(2-苄氧基乙基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯。向该物质(0.435g,0.806mmol)在甲醇中的搅拌溶液中添加1.0n盐酸(1ml)和10%碳载钯(50%水;0.087g)。将混合物在真空与氮气吹扫之间循环若干次,在最后一次抽空后再充满氢气。1.25小时后,将反应通过硅藻土过滤并浓缩。将残余物溶于碳酸钠水溶液中,并用4:1(v/v)氯仿/异丙醇萃取。将合并的萃取物干燥(na2so4)并在二氧化硅上浓缩。使用氯仿/甲醇/氨梯度在二氧化硅
上的快速色谱提供呈无色固体的纯化的标题化合物。1h nmr(400mhz,dmso-d6)δ7.85-7.63(m,1h),7.63-7.19(m,8h),4.78-4.62(m,2h),3.71-2.78(m,8h),2.76(t,j=6.8hz,2h),2.26-1.96(m,2h),1.96-1.40(m,9h)ppm。
13
c nmr(100mhz,dmso-d6)δ153.8,146.8,138.7,137.9,137.6,129.4,126.3,126.1,125.3,66.2,62.1,54.4,52.8,45.4,44.5,38.6,29.5,29.2,24.0,19.9,16.6ppm。纯度:100%,100%(210和254nm)uplcms;保留时间:0.75min;(m h
)409。
[0706]
奎宁环-3-基(2-(2-(4-(3-甲氧基丙氧基)苯基)噻唑-4-基)丙-2-基)氨基甲酸酯(化合物19)
[0707]
向4-甲氧基硫代苯甲酰胺(9.99g,59.7mmol)在乙醇(75ml)中的搅拌悬浮液中添加4-氯乙酰乙酸乙酯(8.1ml,60mmol)。将混合物在回流下加热4小时,然后冷却,添加另外的4-氯乙酰乙酸乙酯(0.81ml,6.0mmol)并返回至回流。再加热4小时后,将反应浓缩并在乙酸乙酯与碳酸氢钠水溶液之间分配。将有机层与另外的乙酸乙酯萃取物合并,干燥(na2so4)并浓缩。将粗产物使用己烷/乙酸乙酯梯度通过快速色谱在二氧化硅上纯化,提供呈淡琥珀色油的2-(2-(4-甲氧基苯基)噻唑-4-基)乙酸乙酯(14.51g,87%)。向该化合物(14.48g,52.2mmol)在n,n-二甲基甲酰胺(125ml)中的搅拌溶液中经15分钟分批添加氢化钠(在矿物油中的60%分散液;6.27g,157mmol)。将所得的红色悬浮液冷却(0℃)并用碘甲烷(9.80ml,157mmol)经10分钟逐滴处理。去除冷却浴,将反应搅拌4小时,然后浓缩并将残余物在乙酸乙酯与水之间分配。将有机层用水再洗涤两次,干燥(na2so4)并浓缩。将残余物使用己烷/乙酸乙酯梯度通过快速色谱在二氧化硅上纯化,提供呈淡琥珀色油的2-(2-(4-甲氧基苯基)噻唑-4-基)-2-甲基丙酸乙酯(14.12g,89%)。向该中间体(14.12g,46.24mmol)在二氯甲烷(250ml)中的搅拌溶液中经5分钟逐滴添加三溴化硼(11.0ml,116mmol)。搅拌过夜后,通过缓慢添加甲醇(约20ml)将反应淬灭,然后浓缩。将残余物溶于甲醇(250ml)和浓硫酸(7.0ml)中。将搅拌的溶液在回流下加热2小时,浓缩并在乙酸乙酯与碳酸氢钠水溶液之间分配。将有机层与水层的第二乙酸乙酯萃取物合并,干燥(na2so4)并浓缩,提供呈白色固体的2-(2-(4-羟基苯基)噻唑-4-基)-2-甲基丙酸甲酯(12.56g,98%)。向1-溴-3-甲氧基丙烷(1.66g,10.8mmol)在丙酮(30ml)中的搅拌溶液中添加苯酚中间体(2.00g,7.21mmol)和碳酸钾(1.25g,9.04mmol)。将混合物在回流下加热过夜,过滤并浓缩。使用己烷/乙酸乙酯梯度通过快速色谱在二氧化硅上纯化残余物以提供呈淡琥珀色胶状物的2-(2-(4-(3-甲氧基丙氧基)苯基)噻唑-4-基)-2-甲基丙酸甲酯(2.47g,98%)。向该化合物(2.45g,7.01mmol)在1:1:1(v/v)四氢呋喃/乙醇/水(45ml)中的搅拌溶液中添加氢氧化锂一水合物(1.47g,35.0mmol)。搅拌过夜后,将反应浓缩并在水与乙醚之间分配。将水层用1.0n盐酸(40ml)处理,并用乙酸乙酯萃取。将合并的萃取物干燥(na2so4)并浓缩,提供呈白色固体的2-(2-(4-(3-甲氧基丙氧基)苯基)噻唑-4-基)-2-甲基丙酸(2.19g,40 93%)。根据一般程序f使该化合物和奎宁环-3-醇反应,产生呈软的淡琥珀色固体的标题化合物。1h nmr(400mhz,dmso-d6)δ7.82(d,j=8.9hz,2h),7.36(br s,1h),7.24(br s,1h),7.03(d,j=8.9hz,2h),4.49-4.41(m,1h),4.07(t,j=6.4hz,2h),3.48(t,j=6.4hz,2h),3.26(s,3h),3.09-2.26(m,6h),2.02-1.91(m,2h),1.91-1.03(m,11h)ppm。
13
c nmr(100mhz,dmso-d6)δ165.8,162.4,160.0,154.6,127.5,126.1,114.9,112.1,70.1,68.4,64.8,57.9,55.4,53.5,46.9,45.9,28.9,28.3,25.2,24.2,19.2ppm。纯度:100%,100%(210和254nm)uplcms;保留时间:
0.87min;(m h
)460。
[0708]
奎宁环-3-基(2-(2-(4-(2-甲氧基乙氧基)苯基)噻唑-4-基)丙-2-基)氨基甲酸酯(化合物20)
[0709]
向2-溴乙基甲基醚(1.88g,13.5mmol)在丙酮中的搅拌溶液中添加2-(2-(4-羟基苯基)噻唑-4-基)-2-甲基丙酸甲酯(如实施例19中所述的制备,2.00g,7.21mmol)和碳酸钾(1.56g,11.3mmol)。在回流下加热过夜后,将混合物用另外的2-溴乙基甲基醚(1.88g,13.5mmol)和碳酸钾(1.56g,11.3mmol)处理。将反应在回流下加热第二晚,过滤并浓缩。将残余物使用己烷/乙酸乙酯梯度通过快速色谱在二氧化硅上纯化,提供呈白色固体的2-(2-(4-(2-甲氧基乙氧基)苯基)噻唑-4-基)-2-甲基丙酸甲酯(2.71g,90%)。向该化合物(2.71g,8.08mmol)在1:1:1(v/v)四氢呋喃/乙醇/水(50ml)中的搅拌溶液中添加氢氧化锂一水合物(1.70g,40.5mmol)。搅拌过夜后,将反应浓缩并在水与乙醚之间分配。将水层用1.0n盐酸(41ml)处理,并用乙酸乙酯萃取。将合并的萃取物干燥(na2so4)并浓缩,提供呈白色固体(2.57g,99%)的2-(2-(4-(2-甲氧基乙氧基)苯基)噻唑-4-基)-2-甲基丙酸。根据一般程序f使该化合物和奎宁环-3-醇反应,产生呈淡琥珀色固体的标题化合物。1h nmr(400mhz,dmso-d6)δ7.82(d,j=8.8hz,2h),7.36(br s,1h),7.24(br s,1h),7.04(d,j=8.8hz,2h),4.49-4.41(m,1h),4.19-4.12(m,2h),3.71-3.65(m,2h),3.32(s,3h),3.11-2.87(m,1h),2.86-2.19(m,5h),1.92-1.16(m,11h)ppm。
13
c nmr(100mhz,dmso-d6)δ165.7,162.9,159.9,154.6,127.5,126.2,114.9,112.2,70.3,70.1,67.1,58.2,55.4,53.5,46.9,45.9,28.3,25.2,24.3,19.2ppm。纯度:100%,100%(210和254nm)uplcms;保留时间:0.85min;(m h
)446。
[0710]
奎宁环-3-基2-(5-(4-(2-甲氧基乙氧基)苯基)吡啶-2-基)丙-2-基氨基甲酸酯(化合物21)
[0711]
使用一般程序e和反应输入物5-溴吡啶-2-甲腈和2-(4-(2-甲氧基乙氧基)苯基)-4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷制备5-(4-(2-甲氧基乙氧基)苯基)吡啶-2-甲腈。将三氯化铈(8.05g,21.6mmol)装入烧瓶中,并在真空下通过加热(170℃)干燥3小时。将固体溶于四氢呋喃(20ml)中并剧烈搅拌30分钟。将悬浮液冷却至-78℃,并用3.0m的甲基锂在乙醚(7.2ml,21.6mmol)中的溶液逐滴处理。添加后,将反应在-78℃下搅拌1小时,然后添加上述芳基硼酸酯(1.83g,7.20mmol)在四氢呋喃(20ml)中的溶液。将混合物在-78℃下维持2小时,然后使其升温至室温。此时,通过添加氢氧化铵水溶液(10ml)将反应淬灭,并通过硅藻土塞过滤。将滤液用乙酸乙酯萃取,并将合并的萃取物用盐水洗涤,干燥(na2so4)并浓缩。将残余物使用乙酸乙酯洗脱液通过快速色谱在二氧化硅上纯化,提供呈黄色固体的2-(5-(4-(2-甲氧基乙氧基)苯基)吡啶-2-基)丙-2-胺(0.800g,39%)。向该中间体(0.500g,1.75mmol)在水(10ml)和浓盐酸(0.44ml)中的搅拌悬浮液中添加甲苯(10ml)。将该混合物冷却(0℃)并同时用三光气(0.776g,2.62mmol)在甲苯(10ml)中的溶液和碳酸氢钠(2.2g,26mmol)在水(20ml)中的溶液处理1小时。添加后,将反应再搅拌30分钟,然后去除上层甲苯层并干燥(na2so4)。同时,将奎宁环-3-醇(0.445g,3.64mmol)在四氢呋喃(10ml)中的搅拌溶液用氢化钠(在矿物油中的60%分散液;0.154g,3.85mmol)处理。将该混合物搅拌5分钟,然后添加粗异氰酸酯在甲苯中的溶液。将反应搅拌10分钟,通过添加盐水(5ml)淬灭,并用乙酸乙酯萃取。将合并的萃取物干燥(na2so4)并浓缩。将残余物通过快速色谱在反相二氧化硅
上纯化,提供呈浅黄色固体的标题化合物(0.100g,13%)。1h nmr(500mhz,cdcl3)δ8.70-8.70(d,j=2.0hz,1h),7.83-7.81(m,1h),7.49-7.47(d,j=9.0hz,2h),7.45-7.43(d,j=8.0hz,1h),7.03-7.01(d,j=8.5hz,2h),6.63(br s,1h),4.68-4.66(m,1h),4.16(t,j=5.0hz,2h),3.77(t,j=5.0hz,2h),3.45(s,3h),3.19-2.70(m,6h),2.15-1.89(m,2h),1.76(s,6h),1.73-1.36(m,3h)ppm。
13
c nmr(125mhz,cdcl3)δ162.7,158.9,154.9,145.9,134.8,134.3,130.1,128.1,119.2,115.2,71.0,70.8,67.4,59.2,55.9,55.7,47.4,46.5,46.4,27.9,25.4,24.6,19.5ppm。纯度:》99%(214和254nm)lcms;保留时间:1.32min;(m h
)440.2。
[0712]
奎宁环-3-基(2-(4'-(3-氰基丙氧基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯(化合物22)
[0713]
向4-溴苯酚(17.1g,98.8mmol)在乙腈(150ml)中的搅拌溶液中添加1-溴丁基腈(12.3ml,124mmol)和碳酸钾(15.0g,109mmol)。将混合物加热至回流过夜,冷却并浓缩。将残余物溶于水中并用乙酸乙酯萃取。将合并的萃取物干燥(na2so4)并浓缩,并且将粗物质使用己烷/乙酸乙酯洗脱液通过快速色谱在二氧化硅上纯化,提供呈白色固体的4-(4-溴苯氧基)丁腈(20.8g,88%)。向该产物在n,n-二甲基甲酰胺(100ml)中的搅拌溶液中添加双(频哪醇)二硼(4.60g,18.1mmol)、乙酸钾(7.41g,75.5mmol)和[1,1'-双(二苯基膦基)二茂铁]-二氯化钯(ii)与二氯甲烷的络合物(0.616g,1.04mmol)。将混合物加热至回流过夜,然后浓缩。将残余物溶于乙酸乙酯中,用水和盐水洗涤。将有机层干燥(na2so4)并浓缩,并将粗产物使用己烷/乙酸乙酯洗脱液通过快速色谱在二氧化硅上纯化,提供呈白色固体的4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂环戊硼烷-2-基)苯氧基)丁腈(3.43g,79%)。根据一般程序e使该产物和奎宁环-3-基(2-(4-溴苯基)丙-2-基)氨基甲酸酯(通过使用一般程序f使奎宁环-3-醇和2-(4-溴苯基)丙-2-胺反应制备的)反应,产生呈白色固体的标题化合物。1h nmr(400mhz,dmso-d6)δ7.67-7.26(m,7h),7.02(d,j=8.8hz,2h),4.50-4.33(m,1h),4.08(t,j=6.0hz,2h),3.14-2.18(m,8h),2.04(quin,j=6.7hz,2h),1.94-1.70(m,11h)ppm。
13
c nmr(100mhz,dmso-d6)δ157.7,154.5,146.8,137.4,132.7,127.6,125.7,125.2,120.2,114.9,70.0,65.8,55.4,54.2,46.9,45.9,29.4,25.3,24.7,24.2,19.2,13.4ppm。纯度:100%,98.9%(210和254nm)uplcms;保留时间:0.88min;(m h
)448.6。
[0714]
奎宁环-3-基(2-(4'-(氰基甲氧基)-[1,1'-联苯]-4-基)丙-2-基)氨基甲酸酯(化合物23)
[0715]
使用一般程序e和反应输入物奎宁环-3-基(2-(4-溴苯基)丙-2-基)氨基甲酸酯(通过使用一般程序f使奎宁环-3-醇和2-(4-溴苯基)丙-2-胺反应来制备)和4-(氰基甲氧基)苯基硼酸制备呈淡琥珀色固体的标题化合物。1h nmr(400mhz,dmso-d6)δ7.65(d,j=8.2hz,2h),7.60-7.31(m,5h),7.15(d,j=8.9hz,2h),5.21(s,2h),4.53-4.30(m,1h),3.18-2.19(m,6h),2.05-1.18(m,11h)ppm。
13
c nmr(100mhz,dmso-d6)δ155.8,154.6,147.2,137.2,134.4,127.8,126.0,125.3,116.7,115.3,70.0,55.4,54.2,53.5,46.9,45.9,29.4,25.2,24.2,19.2ppm。纯度:100%,100%(210和254nm)uplcms;保留时间:0.85min;(m h
)420.3。
[0716]
实施例2:(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯游离碱的制备
[0717]
步骤1:用碘甲烷进行二甲基化
[0718][0719]
3n圆底(rb)烧瓶配备有温度计、加料漏斗和氮气入口。用氮气冲洗烧瓶,并称取叔丁醇钾(mw 112.21,75.4mmol,8.46g,4.0当量,白色粉末),并经由粉末漏斗将其添加至烧瓶,接着添加thf(60ml)。将大部分叔丁醇钾溶解以得到浑浊的溶液。将该混合物在冰水浴中冷却至0-2℃(内部温度)。在单独的烧瓶中,将起始酯(mw 265.3,18.85mmol,5.0g,1.0当量)溶解在thf(18ml 2ml作为漂洗剂)中,并转移至加料漏斗中。将该溶液经25-30min的时间逐滴添加至冷却的混合物中,在添加过程中保持内部温度低于5℃。将反应混合物冷却回0-2℃。在单独的烧瓶中,制备碘甲烷(mw 141.94,47.13mmol,6.7g,2.5当量)在thf(6ml)中的溶液,并将其转移至加料漏斗中。然后将含有碘甲烷溶液的烧瓶用thf(1.5ml)冲洗,然后将其转移至已经含有碘甲烷在thf中的透明无色溶液的加料漏斗中。将该溶液经30-40min的时间小心地逐滴添加至深棕色反应混合物中,在添加过程中始终保持内部温度低于10℃。添加完成后,将轻微混浊的混合物再搅拌1小时,在此期间内部温度降至0-5℃。在0-5℃下搅拌1小时后,通过经5-7min的时间缓慢逐滴添加5.0m hcl水溶液(8ml)将反应混合物淬灭。在此添加过程中,内部温度保持低于20℃。添加后,添加水(14ml)并将混合物搅拌2-3min。停止搅拌并使两层分离。然后将两层转移至250ml 1n rb烧瓶中,并尽可能在真空中蒸发thf以获得thf/产物和水的双相层。将两层分离。在下一个反应中使用步骤1产物的thf溶液。
[0720]
步骤2:用lioh一水合物水解乙酯
[0721][0722]
将thf中的粗酯添加至反应烧瓶中。单独地,称取lioh.h2o(mw 41.96,75.0mmol,3.15克,2.2当量)在添加了搅拌棒的100ml烧杯中。添加水(40ml)并搅拌混合物直至所有固体溶解,得到透明的无色溶液。然后将该水溶液添加至含有酯在四氢呋喃(thf)中的溶液的250ml rb烧瓶中。将冷凝器附接至烧瓶的颈部,并将氮气入口附接至冷凝器的顶部。将混合物在回流下加热16小时。16小时后,停止加热,并将混合物冷却至室温。在真空中蒸发thf以获得棕色溶液。通过hplc和lc/ms分析棕色水溶液的等分试样的完全乙酯水解。添加水(15ml),并将该碱性水溶液用tbme(2x40ml)萃取以去除叔丁酯。将碱性水溶液层在冰水浴中冷却至0-10℃,并通过在搅拌下逐滴添加浓hcl至ph为约1进行酸化。向酸性水溶液中的该胶状固体中添加tbme(60ml),并摇动混合物,然后剧烈搅拌以将所有酸溶解至tbme层中。将两层转移至分液漏斗中,然后分离出tbme层。用tbme(40ml)重新萃取淡黄色酸性水溶液,分离tbme层并与先前的tbme层合并。丢弃酸性水层。将合并的tbme层经无水na2so4干燥,过
滤并在真空中蒸发以去除tbme,并获得呈橙色/深黄色油的粗酸,在高真空下固化为黄不溜秋的固体。将粗酸称重,并通过将其在庚烷/tbme(3:1,5ml/g粗品)中加热而结晶以得到呈黄色固体的酸。
[0723]
步骤3:用nh2oh.hcl形成异羟肟酸
[0724][0725]
称取羧酸(mw 265.3,18.85mmol,5.0g,1.0当量)并在氮气下转移至25ml 1n rb烧瓶中。添加thf(5.0ml),并且酸容易地溶解得到透明的深黄色至棕色溶液。将溶液在冰浴中冷却至0-2℃(浴温),并经10-15分钟的时间分批缓慢添加n,n'-羰基二咪唑(cdi;mw 162.15,20.74mmol,3.36g,1.1当量)。去除冰浴,并将溶液在室温下搅拌1h。搅拌1h后,将溶液再次在冰水浴中冷却至0-2℃(浴温)。将盐酸羟胺(nh2oh.hcl;mw 69.49,37.7mmol,2.62g,2.0当量)作为固体分批经3-5分钟缓慢添加,因为这种添加是放热的。添加完成后,将水(1.0ml)经2分钟的时间逐滴添加至非均相混合物中,并将反应混合物在冰水浴中在0-10℃下搅拌5分钟。去除冷却浴,并将反应混合物在室温下在氮气下搅拌过夜20-22h。当所有nh2oh.hcl溶解时,溶液变得透明。20-22h后,通过高压液相色谱(hplc)分析反应混合物的等分试样。然后在真空中蒸发thf,并将残余物溶于二氯甲烷(120ml)和水(60ml)中。将混合物转移至分液漏斗中,在其中摇动并使两层分离。丢弃水层,并用1n盐酸盐(hcl;60ml)洗涤二氯甲烷层。丢弃酸层。将二氯甲烷层经无水na2so4干燥,过滤并在真空中蒸发溶剂,获得呈淡黄色固体的粗异羟肟酸,将其在高真空下干燥过夜。
[0726]
步骤3续:将异羟肟酸转化为环状中间体(未分离)
[0727][0728]
将粗异羟肟酸(mw 280.32,5.1g)转移至具有氮气入口的250ml 1n rb烧瓶中。添加搅拌棒,接着添加乙腈(50ml)。固体不溶于乙腈。将黄色非均相混合物在氮气下搅拌2-3分钟,并在室温下一次性添加cdi(mw 162.15,20.74mmol,3.36g,1.1当量)。未观察到放热。固体立即溶解,并且将透明黄色溶液在室温下搅拌2-2.5h。2-2.5h后,通过hplc和lc/ms分析等分试样,其显示异羟肟酸转化为所需的环状中间体。
[0729]
然后在真空中蒸发乙腈,得到呈红色稠油的粗环状中间体。将油溶于甲苯(60ml)中,并将红色混合物加热至回流2小时,在此期间环状中间体释放co2并重排成异氰酸酯(见下文)。
2-基)氨基甲酸酯的结晶盐。
[0738]
例如,将(s)-奎宁环-3-基(2-(2-(4-氟苯基)噻唑-4-基)丙-2-基)氨基甲酸酯(约50mmol)在室温下溶解在ipa(140ml)中并过滤。将滤液添加至配备有顶置搅拌器和氮气进/出口的1l rb烧瓶中。将左旋苹果酸(约50mmol)在室温下溶解在ipa(100 30ml)中并过滤。将滤液添加至上述1升烧瓶中。将所得的溶液在室温下(有或没有引晶)在氮气下搅拌4至24小时。在此时间段内形成晶体。通过过滤收集产物并将其用少量ipa(30ml)洗涤。将结晶固体在55℃下在真空烘箱中干燥72小时以产生所需的苹果酸盐。
[0739]
其他盐的晶型(例如与琥珀酸或hcl的酸加成盐)可以以类似的方式来制备。
[0740]
实施例4:体外gcs抑制(化合物2和类似物)
[0741]
可以用一种或多种测定来测量葡糖神经酰胺合酶活性的抑制。第一种测定是通过hplc直接测量神经酰胺向葡糖神经酰胺的转化的微粒体测定。微粒体是微粒体测定中葡糖神经酰胺合酶活性的来源。第二种测定是基于细胞的表型测定,其通过抗体介导的免疫荧光来监测下游脂质gm3的细胞表面表达。下面提供了具体方案。
[0742]
葡糖神经酰胺合酶活性微粒体测定:
[0743]
一种使用微粒体作为葡糖神经酰胺合酶活性的来源的酶测定。荧光神经酰胺底物作为与白蛋白的复合物被递送至膜结合酶。反应后,通过具有荧光检测的反相hplc分离并定量神经酰胺和葡糖神经酰胺。使用荧光标记的底物和作为葡糖神经酰胺合酶的来源的微粒体来评估酶活性。将c
6-nbd-神经酰胺与白蛋白复合用于递送至根据以下所述的程序分离的微粒体。原液中c
6-nbd-神经酰胺的终浓度为0.5mm;bsa的终浓度为0.5mm。底物和产物(葡糖神经酰胺)的分离和定量通过具有荧光检测的反相hplc来实现。
[0744]
从a375人黑色素瘤细胞制备微粒体
[0745]
从a375人黑色素瘤细胞分离微粒体。通过胰蛋白酶消化收获八百万至一千万个细胞,并将其用冰冷pbs洗涤。将细胞重悬于含有蛋白酶抑制剂的冰冷裂解缓冲液中。使用探针超声波仪在冰上对细胞裂解物进行超声处理。超声处理后,通过在4℃下以10,000g离心10分钟,将细胞裂解物与碎片。移取上清液,并通过在4℃下以100,000g另外离心1小时来澄清。然后将沉淀物重悬于裂解缓冲液中,等分并在使用前在-80℃下储存。
[0746]
葡糖神经酰胺合酶测定
[0747]
为了确定葡糖神经酰胺合酶的抑制,将其km的2倍的底物(荧光神经酰胺和udp-葡萄糖分别为3μμ和4μμ)和微粒体(1:50稀释度)1:1合并,并在室温下在黑暗中在平板摇床上孵育1小时。通过添加150μl的在50%异丙醇水溶液中的100μm c
8-神经酰胺来终止反应;在hplc(具有荧光检测器)上分析10μl最终混合物。流动相是1%甲酸添加至81%甲醇/19%水中,其流速为0.5ml/min。在λ
ex
=470nm和λ
em
=530nm的情况下检测荧光。在这些条件下,nbd-c
6-glucer具有约1.7min的保留时间,并且在约2.1min后从柱洗脱nbd-c
6-cer。两个峰彼此分开并与基线分开,并且通过hplc软件自动积分。底物到产物的转化百分比用作抑制剂测试的读数。
[0748]
gm3荧光连接的免疫吸附测定(flisa):
[0749]
这是一种表型分析,其测量在采用测试化合物治疗后b16小鼠黑色素瘤或c32人黑色素瘤细胞中的gm3表达。细胞表面gm3表达通过抗体介导的荧光来测定。
[0750]
将化合物在介质中稀释并铺板于384孔板中的dmso中。分别以每孔20,000个细胞/
ml和62,500个细胞/ml的密度测定b16和c32细胞。每个滴定曲线含有10个点,在每次测试运行时一式两份对其进行测定。将板在37℃、5%co2下孵育48小时,然后用tbs洗涤一次。将抗gm3抗体添加至每个孔中,然后将板在室温下再孵育1小时。随后将板洗涤两次,并用标记的二抗再孵育一个小时。在最终孵育后,将板洗涤两次,并且在荧光读取器上检测λ
ex
=d640/20nm和λ
em
=657nm处的荧光。
[0751]
测定结果
[0752]
这些测定中某些示例性化合物的单独测定结果呈现在下表中。微粒体测定的结果表示为“gcs ic
50”,其表示引起葡糖神经酰胺合酶活性的50%抑制的化合物浓度。对于b16测定和c32测定,基于细胞的测定的结果分别表示为“gm3 b16 ic
50”或“gm3 c32 ic
50”。这些值表示引起细胞表面gm3表达的50%抑制的化合物浓度。
[0753][0754][0755]
这些比较结果证明,根据本公开文本的化合物具有与gcs的抑制剂可比较的体外活性,并且因此预期显示出类似的体内益处。
[0756]
实施例5:化合物2在gd-3患者中的临床研究
[0757]
启动了一项针对与伊米苷酶组合的化合物2在用伊米苷酶稳定的患有戈谢病3型的成年患者中的安全性、耐受性、药代动力学、药效学和探索性功效的为期156周的多部分、开放标签的跨国研究(称为leap或leap2it试验)。将化合物2以15mg/天(作为游离碱的量测量的)的单次日剂量以苹果酸盐形式(左旋苹果酸)口服施用。终点评估与安全性、csf生物标志物、药代动力学/药效学、全身性疾病以及神经成像和神经系统功能(cns/神经系统表
现)有关。
[0758]
所述研究中包括了年龄为18岁或以上的患者,所述患者具有gd3的临床诊断并且有记录在案的酸性β-葡萄糖苷酶活性的缺乏,在登记之前已经接受ert治疗至少3年和稳定每月剂量的伊米苷酶(cerezyme)治疗至少6个月。患者必须达到以下gd治疗目标:女性血红蛋白水平≥11.0g/dl,男性血红蛋白水平≥12.0g/dl;血小板计数≥100 000/mm3;脾脏体积《10倍正常值(mn)或完全脾切除术(前提是脾切除术发生在随机分组前》3年);肝脏体积《1.5mn;以及在前一年内没有骨危象,也没有症状性骨病(诸如归因于骨坏死和/或病理性骨折的骨痛)。患者必须患有gd3,其特征在于由水平扫视异常表征的动眼运用不能(核上凝视麻痹)。
[0759]
(a)52周的中期分析(n=6)
[0760]
当6位患者完成了52周的(1)在每位患者既定方案下的伊米苷酶(来自sanofi genzyme的cerezyme)和(2)以15mg/天的单次剂量口服施用的化合物2的同时治疗时进行中期分析。在研究期间,评估患者的安全性和耐受性、csf和血浆生物标志物(葡糖神经酰胺,gl-1;葡萄糖基鞘氨醇,lyso-gl1)、药代动力学、全身性疾病标志物(通过磁共振成像(mri)测量的脾脏和肝脏体积、血小板计数、血红蛋白水平)、间质性肺病的指标(高分辨率肺计算机断层扫描(ct))和水平扫视眼运动。此外,在gd3患者的csf中定量了探索性生物标志物:神经酰胺(gl-1的前体)、壳丙糖酶(chito)、gm3和gpnmb。使用sara量表测量共济失调的症状,使用接龙试验测量神经系统症状,并使用功能性mri来评估脑中的神经连接性。
[0761]
在基线时,五位患者具有轻度神经系统受累,一位具有中度神经系统受累,如使用改良严重程度评分工具(msst;参见例如davies等人,j inherit metab dis.(2011)34(5),第1053-1059页)测量的。
[0762]
对化合物2的血浆和csf浓度的分析表明,化合物2在所有患者中都有效地穿过血脑屏障。然而,发现患者5在第26周时在血浆和csf中具有约50%更低的化合物2浓度,在第52周时浓度不可检测到。据信,这是由于依从性或给药错误所致,因此,在不包括患者5的第26周和第52周数据的情况下重复分析。数据支持以下结论:在第4周时或之前在血浆和csf中达到化合物2的稳态浓度:
[0763]
血浆中的化合物2第1天(n=6)auc0–
24
,ng
·
h/ml(平均值
±
sd)729
±
205c
max
,ng/ml(平均值
±
sd)49.1
±
17.3t
max
,h(中值)2.00
[0764]
[0765]
在52周时,数据还表明gd-3的血浆和csf生物标志物的持续显著改善。在所有六位gd3患者中,血浆和csf gl-1和lyso-gl-1浓度如下:
[0766][0767]
因此,在52周时与基线相比,血浆和csf浓度已经如下改变:
[0768] lyso-gl-1(变化%)gl-1(变化%)血浆浓度
–
56.7%
–
71.6%csf浓度
–
55.9%
–
55.4%
[0769]
此外,在gd3患者的csf中定量了探索性生物标志物:神经酰胺(gl-1的前体)、壳丙糖酶(chito;已知在gd患者中升高的酶)、gm3(已知在gd患者中升高的鞘糖脂标志物)和gpnmb(糖蛋白非转移性黑色素瘤蛋白b,报告为神经病性gd3的生物标志物)。在治疗52周之后,神经酰胺、chito或gpnmb的csf浓度未观察到显著变化。六位患者中有四位在基线时在csf中具有可测量的gm3浓度,并且发现这些患者中的每一位在4周、26周和52周时在csf中的gm3都不可检测到。
[0770]
此外,在52周时,6位患者中有5位表现出共济失调的改善。在基线时和在整个研究中共济失调的程度通过共济失调评估和评级量表(sara;schmitz-h
ü
bsch等人[2006])评估,所述共济失调评估和评级量表在0-40的数值范围内评估小脑共济失调的八个不同属性。所述八个属性是步态、站姿、就坐、言语错乱、追指(finger chase)、鼻指(nose-finger)测试、快速交替手运动和脚跟-胫骨滑动。以下图表中提供了所有六位患者的sara共济失调评分结果:
[0771][0772][0773]
如表中所示,六位患者中有五位在基线时有轻度共济失调,平均累积sara得分为2.8(sd=1.2)。在基线时最常见的缺陷是步态障碍。排除患者5,因为该患者的化合物2暴露水平低并且患者的实质正常的基线共济失调得分(仅0.5),然后5位患者中有4位在第52周时表现出共济失调的改善(平均改善=
–
0.9;sd=3.2)。患者4表现出共济失调得分增加,在基线时的得分为3和在第52周时为7.5。应当指出的是,这种明显的恶化几乎完全由“站姿”得分参数的变化驱动(在基线和第26周时的站姿得分=1;在第52周时的得分为=5),并且患者抱怨在检查时左膝疼痛。此外,受试者在检查前他的左大脚趾损伤;该损伤在检查后11天被认为已消退。排除患者4的这些异常效应,化合物2的治疗导致到第26周平均sara得分
显著下降,到第52周其进一步略有改善。
[0774]
接龙试验(tmt)用于评估患者的认知功能。tmt是使用最广泛的神经心理学测试之一,并且包括在大多数测试组中。tmt是评估一般智力和认知功能障碍的诊断工具(tombaugh等人[2004];cavaco等人[2013])。在tmt(tmt-a)的a部分中,要求受试者按上升顺序连接一组数字(试验a)。该任务是视觉搜索以及一般视觉和运动处理速度的组合。b部分(tmt-b)提出了一个在数字和字母之间交替的序列(试验b)。在将两个类别以上升但交替的顺序连接时,受试者必须在两个类别之间进行积极切换。因此,该任务被认为包括执行功能组分,因为受试者必须在连接符号的同时在类别之间积极切换(macpherson等人[2017])。
[0775]
tmt-a主要评估感知和精神运动速度。tmt-b评估更具体的心理灵活度和转移能力。tmt-b减去tmt-a得分用于去除归因于tmt-a的书写运动和视觉扫描组分的差异。这个派生的得分反映了tmt-b的独特任务要求。
[0776]
在对年龄为18-89岁的社区居住个体中的tmt-a和tmt-b标准数据(n=911)的研究中,在18-24岁年龄组(n=155)中的平均(sd)值为22.9s(6.9)(对于tmt-a)和49s(12.7)(对于tmt-b)(tombaugh等人[2004])。相比之下,对于研究中的患者完成试验a和试验b所花费的平均时间分别为67.8s(sd=60.3s)和193.8s(sd=197.0)。在基线时,完成试验b所花费的时间减去完成试验a所花费的时间的平均差异为126.0s(sd=142.9s)。这表明该研究中的gd-3患者在基线时表现出一定程度的认知功能障碍。
[0777]
在第52周,完成试验a所花费的平均时间段为56.5s(sd=55.2s),并且完成试验b所花费的平均时间段为122.7s(sd=91.8s)。六位患者中有四位表现出完成试验a所花费的时间减少,而六位患者中有六位表现出完成试验b所花费的时间减少。因为患者5的化合物2暴露水平低而排除该患者,五位患者中有四位表现出tmt-a减少,而五位患者中有五位表现出tmt-b减少。
[0778]
在第52周,6位患者中有5位表现出(tmt-b-tmt-a)时间减少。个体结果如下表所示。
[0779][0780]
在52周时,完成试验b所花费的时间减去完成试验a所花费的时间的平均差异为66.2s(sd=54.3)。排除患者5,五位患者中有四位表现出在第52周时试验b减去试验a有所改善,平均改善为
–
71.4s(
–
31.6%)(sd 99.3s(37.6%))。
[0781]
使用功能磁共振成像(fmri)进一步评估神经学功能。患者2由于在第52周环节未收集fmri数据而被排除。在基线筛查、第26周和第52周访问时,进行了静息态fmri筛查环节。将四名受试者(患者1、3、4和5)的连接性估计值作为“依从”组进入二级分析。如上所述,患者5由于可能不依从研究药物而被分离。如别处所述进行分析(smith等人[2009])。
[0782]
发现依从的受试者表明,与不依从的受试者相比在更广泛分布的脑区域集合之间具有增强的连接性,其中在后方与前方之间的强度增加是最突出的特征。在解剖学水平上,依从的受试者表明枕骨-顶骨结构与额叶、颞叶和/或边缘靶标之间的连接具有广泛和强烈的增强。患者5的连接性变化更为适中,并且限制于空间近端结构内。在功能水平上,在除患者5以外的每名受试者中都看到在默认模式与内侧前额网络之间的连接性增强。这表明在这些不同网络中的信号变得更加连贯,使得脑活动可以在认知储备(后)和高阶执行功能(前)之间更有效地传递。静息态网络(rsn)2和3(“认知-语言-正确拼字”和“认知-空间”)到rsn 8和9(执行和左额顶骨)的一致性互反映射也很明显。对于患者5连接性变化的空间分布更加聚焦得多,主要反映了内侧前额和额顶骨网络之间的重叠。两种观点都表明,完全依从治疗方案的患者在脑的后方和前方之间发展了更大的连贯性,使得整个脑变得适于有效的信息传递。显而易见,患者5的连接性改变出现在前脑区域的较窄集合内并且代表了治疗益处的较不全面的证据。
[0783]
结果总结在下表中。对脑的不同解剖区域之间的连接性进行空间分析,以定义回归的逐体素(voxelwise)平均强度的相关系数。结果表明,患者1、3、4和6的默认模式(静息)网络与执行功能网络之间的连接性增加,但在患者5中有所下降。
[0784][0785]
(b)52周的中期分析(n=11)
[0786]
当11位患者达到52周里程碑时,进行了另外的中期分析。该分析的结果证实了在先前的中期分析中获得的观察结果。
[0787]
在第二次中期分析中的11位患者包括7名男性和4名女性。8位患者对于β半乳糖苷酶基因的p.leu483pro(又称l444p)突变是纯合的,2位患者是p.phe523ile/p.leu483pro变体的复合杂合子,还有一位患者是p.asp448his/p.arg502cys变体的复合杂合子。在基线时11位患者中有九位具有轻度共济失调,主要患有步态障碍。两位被认为不具有共济失调或具有非常轻度的共济失调。所有11位患者都继续研究。没有报告重大不良事件,最常见的事件是轻度头痛和背痛,并且这些事件被确定可能与csf采样的腰椎穿刺术干预有关。
[0788]
如上文所述测量了化合物2的血浆和csf浓度。如先前所观察的,一位患者(患者5)是异常值,表现出非常低的血浆和csf化合物2水平。数据继续支持以下结论:在第4周时或之前在血浆和csf中达到化合物2的稳态浓度:
[0789]
血浆中的化合物2第1天(n=11)auc0–
24
,ng
·
h/ml(平均值
±
sd)851
±
282c
max
,ng/ml(平均值
±
sd)58.1
±
26.4t
max
,h(中值)2.00
[0790]
在下面图表中,将患者5排除在平均(n=10)值之外。
[0791]
[0792][0793]
一位患者(患者1)也在52周测量开始时经历了血浆和csf化合物浓度的显著下降,并且这被追踪到可能是在研究的第39周至第51周用cyp3a4诱导剂共同治疗的结果。由于怀疑化合物2是cyp3a底物,因此预计与cyp3a诱导剂的伴随施用会导致全身性暴露量降低。
[0794]
在52周时,数据还表明gd3的血浆和csf生物标志物的持续显著改善,但患者5除外。化合物2暴露量的初始证据与csf和血浆中lyso-gl1和gl1的降低相关。随后,化合物2暴露水平降低与csf和血浆中lyso-gl1和gl1两者的增加对应。在第52周时,患者5的csf lyso-gl1浓度高于定量上限(uloq;》100pg/ml),因此使用精确的uloq值估算了csf lyso-gl1的生物标志物结果。因此,在患者5中发现,与基线相比,在第52周时csf lyso-gl1和gl1分别增加了约313%和37%,并且与基线相比,在第52周时血浆lyso-gl1和gl1的水平分别增加了约43%和14%。其他研究受试者的平均结果如下(n=10;排除患者5):
[0795][0796]
因此,在52周时与基线相比,血浆和csf浓度已经如下改变(n=10;排除患者5):
[0797] lyso-gl-1(变化%)gl-1(变化%)csf浓度
–
68%
±
17.2%
–
79%
±
12.1%血浆浓度
–
53%
±
13.5%
–
77%
±
11.7%
[0798]
以下图表中提供了五位新患者的sara共济失调评分结果:
[0799]
sara累积得分在筛查时第26周第52周患者75.57.55.0患者82.00.50患者90.00.00.0患者102.02.01.0患者113.03.02.0
[0800]
如表中所示,排除在基线时未患有共济失调的患者9,4位患者中有4位在第52周时表现出共济失调改善。患者7表现出共济失调评分短暂增加,其到第52周时消退。
[0801]
为了进一步证明共济失调的改善,在筛查时以及第26周和第52周时间点试图沿直线行走时为两位患者录制录像带。视频证据的比较表明,与基线相比,两位患者均表现出更稳定、更协调和更快的步态、为了获得支撑而对附近墙壁的触碰较少和较少的回避。
[0802]
下面图表中示出了新患者的tmt时间安排。
[0803][0804]
在52周时,三位新患者显示出未明确临床意义的(tmt-b-tmt-a)时间的很小增加,而两位新患者显示出(tmt-b-tmt-a)时间有所减少,一位患者显示出极大的减少(下降92%)。
[0805]
如上所述,使用功能磁共振成像(fmri)进一步评估了新患者的神经系统功能。fmri结果继续表明,具有足够化合物2暴露量的患者在脑的后方与前方之间发展出更大的连贯性,使得整个脑变得适于有效的信息传递。显而易见,没有足够化合物2暴露量的单个患者(患者5)的连接性改变出现在前脑区域的较窄集合内,并且代表了治疗益处的较不全面的证据。在与执行功能相关的区域中看到这种增强的连接性。静息态功能mri表明在默认模式与内侧前额网络之间的连接性增强,这表明在这些不同网络中的信号传导变得更加连贯,使得脑活动可以在认知储备(后)和高阶执行功能(前)之间更有效地传递。
[0806]
特别地,结果显示在rsn 1、2和3(感知-视觉、认知-语言-正确拼字和认知空间)与rsn 6、7和8(感觉运动、听觉和执行控制)之间的连接性增强;在解剖学水平上,存在在枕骨-顶骨结构与额叶、颞叶和/或边缘靶标之间连接的广泛和强烈的增强。该数据表明在戈谢病中认为被破坏的感觉、运动和小脑网络中最突出的功能连接性增加。
[0807]
在下表中总结了所有患者的rsn 3和6(不包括rsn 4和8)在基线和52周之间的相关系数的变化(如上所述,患者2由于缺乏数据而被排除)。
[0808][0809]
发现在52周时与gsf中的gl-1浓度相比sara和tmt结果的统计分析提供了良好的治疗相关性。对于sara结果,其中较低的得分表明治疗改善,11位患者中有8位显示csf gl-1(ng/ml)的降低与sara得分(-5至5)之间存在正相关。对于tmt,同样其中较短(试验b减去试验a)时间表示治疗改善,11位患者中有6位显示csf gl-1(ng/ml)的降低与tmt时间(秒)之间存在正相关。
[0810]
(c)另外的52周中期分析(n=9)
[0811]
使用容积磁共振成像(vmri)进一步评估神经系统功能。在基线筛查环节时和在八位患者(“a组”)和一位另外分离的患者(患者5)的治疗方案的52周之后收集vmri数据。a组对应于上述十一位患者,排除患者5和两位其他缺乏可分析vmri数据的患者。由于在52周之后化合物2的血浆和csf浓度低于lloq,表明未能遵守治疗方案,患者5被分离开来。
[0812]
获得了vmri数据,并随后使用freesurfer解剖分割和基于张量的形态计量学(tbm)分析周期进行了分析。freesurfer是开放源软件包,其用于分析和可视化由计算神经成像实验室(laboratory for computational neuroimaging)开发的结构和功能神经成像
数据。tbm分析(也称为雅可比(jacobian)积分)包括使用非线性对称log-demons变形技术使用强交叉关联度量确保转化的可逆性(对称过程),估计通过在一对mr扫描(基线和随访)之间应用对称可变形配准技术所产生的变形场内捕获的体积变化。然后,通过计算其雅可比矩阵的行列式来分析变形场,这是局部体积变化的量度。在感兴趣区域上对行列式进行积分提供了该脑区域体积随时间的变化率的估计。
[0813]
整个流程(overall pipeline)将基线(bl)和随访(fu)图像作为输入,并由以下步骤组成:
[0814]
1.预处理和格式变换;
[0815]
2.使用freesurfer对基线(bl)和随访(fu)进行分割;
[0816]
3.fu和bl到中介空间的多分辨率刚性和仿射配准;
[0817]
4.fu与bl之间的对称可变形非线性配准;
[0818]
5.雅可比图像计算;
[0819]
6.逐体素体积变化计算;
[0820]
7.逐区域体积变化积分;和
[0821]
8.为研究指定的感兴趣区域的变化的输出。
[0822]
因此,tbm是鉴定与将图像与常见解剖模板对准的非线性变形场梯度的区域结构差异的一种图像分析技术。tbm是用于分析脑vmri数据的著名工具,并且关于该技术在此背景下的应用的进一步讨论例如在以下文献中有提供:john ashburner和karl j friston.,human brain function,第二版,学术出版社2004,第6.3章第1节,第8至13页,isbn:9780080472959;moo k chung.,computational neuroanatomy,world scientific 2012,第3章,第49至68页,isbn:9789814472814.doi.org/10.1142/8036;以及thomson等人,ann n y acad sci.2007年2月;1097:183
–
214.doi:10.1196/annals.1379.017。
[0823]
收集了全脑组织的vmri数据,并且分析能够定量脑组织各个区域的体积变化。a组的结果表明,在上面概述的治疗方案的52周后,脑的许多单个区域中的脑组织体积增加,导致全脑体积增加。如通过上文讨论的fmri所确定,还发现体积增加的脑区域与表现出神经元连接性增加的区域重叠。患者5的结果相反,显示了脑萎缩的证据和全脑体积减少的证据。
[0824]
在52周的治疗之后,a组显示出在至少以下脑区域中的平均体积增加:右横核区域、左壳核、左内嗅皮层、右壳核、右中央后小叶、左距状旁小叶、右杏仁核、左楔叶和左舌回,以及平均全脑体积的增加。这些结果如下表所示。
[0825][0826]
还发现,在a组中,治疗方案导致了全脑组织体积的总体增加,然而患者5相反地经历了全脑体积的减少,从图1可以看出。未成功经历治疗方案的患者5表现出相对严重的全脑体积减少以及大多数上述单个脑区域的体积减少。这些结果表明,治疗方案不仅增加了a组的脑组织体积,而且还预防和/或延迟了由于gd3疾病进展而导致a组脑组织体积的潜在损失,如患者5所表现的。
[0827]
实施例6:化合物2在健康人志愿者中的药代动力学
[0828]
进行两项1期临床研究以评估在存在和不存在食物的情况下,在健康人志愿者中化合物2的药代动力学、药效学、安全性和耐受性。化合物2也称为文鲁司他(venglutat)。
[0829]
研究1
[0830]
研究1是在健康成年男性志愿者中的2部分单中心试验。部分1是针对安全性、耐受性和pk的化合物2的双盲、随机化、安慰剂对照的依序递增单剂量研究。部分2是在有和没有高脂肪餐食的情况下针对pk的化合物2的开放标签、单群组、随机化、2序列、2阶段、2治疗交叉研究。
[0831]
研究的部分1登记并随机分组55名健康男性(安慰剂,n=14;2、5、15、25、50和100mg剂量,各剂量n=6;150mg剂量,n=5)。八名健康男性参加部分2。
[0832]
在部分1中,在禁食至少10小时后的第一天早晨将受试者随机分组以接受2、5、15、25、50、100或150mg的化合物2(左旋苹果酸盐形式,即以左旋苹果酸盐形式表达)或匹配的安慰剂。在部分2中,将受试者随机分组以在禁食的同时(施用前禁食至少10小时且施用后禁食4小时)或标准化高脂肪早餐(约815kcal)后30分钟接受5mg化合物2的单次口服剂量。在7天的清除期之后,使参与者交换为另一种条件。
[0833]
在研究1的部分1中,在研究药物施用时(0小时)以及给药后0.5、1、2、3、4、5、6、8、10、12、16、24、48、72和96小时进行血液采样用于分析化合物2的血浆浓度。从研究药物施用前2小时开始直到之后48小时,收集尿液样品以分析化合物2浓度。
[0834]
在研究1的部分2中,在给药后0、0.5、1、2、3、4、5、6、8、10、12、16、24和48小时,针对化合物2的血浆浓度进行血液采样。
[0835]
从部分1发现,在单次口服剂量2至150mg剂量的化合物2后,最大血浆浓度(c
max
)发生在血浆浓度开始以指数方式下降之前的3-5.5小时的中值时间,其中几何平均t
1/2
为28.9小时。在整个剂量范围内,暴露量接近于与剂量成比例增加:75倍剂量增加导致几何平均cmax
、auc
最后
和auc
inf
值分别为97.3倍、89.2倍和85.9倍增加。pk结果如下表所示(auc=时间浓度曲线下面积,到最后可测量浓度或外推至无穷大;t
1/2
=终末半衰期;cl/f=表观血浆总清除率;cv=变异系数;sd=标准差;t
max
=到c
max
的时间;vss/f=稳态下的表观分布体积):
[0836][0837][0838]
从部分2发现,与空腹条件相比,与高脂肪餐食一起施用5mg剂量对化合物2暴露量没有影响。无论进食还是禁食,中值t
max
为6.00小时。对于c
max
和auc
最后
的进食/禁食几何平均比率分别为0.92和0.91。受试者内可变性(即进食与禁食)占总受试者可变性的不到一半。
[0839]
研究2
[0840]
研究2是在健康成年男性和女性志愿者中的化合物2的安全性、耐受性、pk和药效
学的单中心、双盲、随机化、安慰剂对照、依序递增重复剂量研究。
[0841]
所述研究登记并随机分组36名健康成人(19名男性和17名女性)(每组n=9)。将受试者随机化以在至少10小时禁食后接受每天一次剂量为5、10或20mg的化合物2(以左旋苹果酸盐形式的5mg胶囊提供)或安慰剂,持续14天。
[0842]
针对化合物2的血浆浓度如下进行血液采样:第1天,给药后0、0.5、1、2、3、4、5、6、8、10、12和16小时;在第2-5、8、11和13天,在0小时;在第14天,在给药后0.5、1、2、3、4、5、6、8、10和12小时;在第15-17天,分别在第14天给药后24、48和72小时。在第1天(给药后0小时)收集尿液样品以及在第14天从给药后0-24小时连续收集尿液样品以分析化合物2浓度。药效学终点(血浆gl-1、gl-3和gm3浓度)在如下时间点进行评估:第1-5、8、11、13和14天,在给药后0小时;以及在第15天,在第14天给药后24小时。
[0843]
发现在每天一次接受5、10或20mg化合物2持续14天的受试者中,血浆c
max
发生在第1和14天给药后2-5小时的中值时间。c
谷
值在第5天后达到平稳状态。在5-20mg的剂量范围内,化合物2暴露量接近于与剂量成比例增加:这种4倍剂量增加导致在第14天几何平均c
max
和auc
0-24
值分别增加3.76倍和3.69倍。下表中总结了来自研究2的pk结果:
[0844][0845][0846]
14次化合物2的每日一次剂量后,其24小时不变的尿排泄分数(平均fe0–
24
)在26.3%与33.1%之间的范围内,没有任何明显的剂量相关性。平均cl
r(0-24)
在1.49l/h与2.07l/h之间的范围内,其比观察到的血浆cl/f低约3.18-3.86倍。
[0847]
安慰剂接受者中的血浆gl-1、gl-3和gm3始终保持与基线类似,然而血浆gl-1和gm3水平在3个化合物2剂量组中从基线呈时间和剂量依赖性下降,如下表所示(在重复递增剂量研究中在第15天对葡糖神经酰胺(gl-1)、三已糖神经酰胺(gl-3)和gm3神经节苷脂(gm3)的治疗比率的点估计):
[0848][0849]
对gl-1的最大持续影响发生在5和10mg组中的第11天以及20mg组中的第8天。在相应的5、10和20mg组中,在第15天相比于基线的平均计算gl-1减少为41.9%、69.6%和74.6%。在基线处1名5mg化合物2接受者中以及在第15天分别在5、10和20mg组中的3、5和9名受试者中,gl-1值低于定量下限(lloq)。
[0850]
从第13天开始,所有化合物2剂量组中均出现最大持续gm3下降。对于5、10和20mg剂量组,平均第15天血浆gm3水平分别为基线的42.7%、49.4%和57.8%。分别在10和20mg剂量组中的1和2名受试者中,gm3在第15天低于lloq。
[0851]
在所有化合物2剂量组中,血浆gl-3也随时间降低,但相对于lloq的可变和低的基线gl-3值限制了平均计算gl-3降低。在安慰剂、5、10和20mg剂量组中,在基线处分别在1、3、1和6名受试者中以及在第15天分别在4、9、7和9名受试者中gl-3值低于lloq。
[0852]
在5、10和20mg剂量组(分别为19.0、47.5和69.9ng/ml)中,归因于化合物2c
谷
的相比于基线的平均估计血浆gl-1降低(90%ci)分别为67.0%(54.4%-79.7%)、74.4%(63.7%-85.2%)和76.3%(64.8%-87.8%)。
[0853]
结论
[0854]
在这些研究中,当以范围为2-150mg的单次剂量或以范围为5-20mg的重复每日一次剂量持续14天时,健康受试者中的化合物2暴露量(c
max
和auc)接近于与剂量成比例。与禁食相比,高脂肪餐食对接受过单次5mg剂量的受试者中的暴露量没有影响。在5-20mg的重复每日一次剂量的情况下,在5天内达到稳定状态;年龄和性别均不影响积累。在药效学上,重复每日一次剂量的化合物2以时间和剂量依赖性方式降低gl-1和gm3的血浆浓度,这与化合物2介导的gcs抑制一致,但基线gl-3水平太低而不能用作药效学生物标志物。剂量依赖性gl-1降低证实了化合物2的预期作用机制:抑制通过gcs从神经酰胺形成gl-1。
[0855]
在所有研究中,通过监测治疗期间出现的不良事件(teae)(包括严重不良事件[sae])、ecg监测、实验值和身体检查一直到研究药物最后一次剂量后10天来评估安全性特征。
[0856]
在任何研究中,没有死亡、sae、严重teae或teae导致的研究中止。
[0857]
在任何研究中均未报告临床相关的血液学或生化异常。在任何研究中,生命体征未显示出与基线相比的相关变化。在单次递增剂量和食物影响研究中,ecg参数未显示出相
关变化;在多重递增剂量研究中,在任何剂量的化合物2的接受者中,ecg参数相比于平均基线与安慰剂无统计学上的显著变化。应理解,虽然已经结合以上实施方案对本发明进行了描述,但前面的描述和实施例旨在说明而非限制本发明的范围。在本发明的范围内的其他方面、优点和修改对于本发明所属领域的技术人员将是清楚的。
[0858]
另外,当本发明的特征或方面以马库什组(markush group)描述时,本领域技术人员将意识到本发明还由此以马库什组的任何单独的成员或成员子组描述。
[0859]
本文提及的所有出版物、专利申请、专利和其他参考文献均通过引用以其整体明确地并入,其程度如同通过引用单独并入。在矛盾的情况下,将以包括定义在内的本说明书为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。