一种同时制备多种病毒rna片段用作核酸检测阳性对照的方法
技术领域
1.本发明属于分子生物学和核酸检测技术领域,具体涉及一种同时制备多种病毒rna片段用作核酸检测阳性对照的方法。
背景技术:
2.荧光定量pcr技术具有简便、快捷、灵敏度高、特异性好等优点,因此基于荧光定量pcr技术的多种病原体核酸检测方法以及试剂盒,如雨后春笋般不断出现,现已成为临床使用最为广泛的病原体分子诊断技术。
3.病毒是一种个体微小,结构简单,只含一种核酸(dna或rna),必须在活细胞内寄生并以复制方式增殖的非细胞型生物。病毒感染性疾病在临床非常常见。病毒可通过消化道、呼吸道、皮肤、生殖道、血液、胎盘侵入人体,引起胃肠道、呼吸道、泌尿生殖、甚至全身性感染。对于病毒性疾病诊断的“金标准”是分离培养,但由于该病原体活细胞寄生的特点使临床难易对其分离培养;免疫学检测技术已广泛应用于临床病原体检测中,但其对特异性单克隆抗体准确识别的严格要求以及多数体系缺少集成性等限制了诊断的快速与高通量。荧光定量pcr检测平台是目前技术最为成熟的开放平台,建设和使用成本也相对较低,因此是目前病毒检测新试剂研发的重点。
4.无论是单重还是多重荧光定量pcr方法的建立还是试剂盒的研发,都需要做到检测的准确性,即要有质量控制,将阳性对照和阴性对照与待测标本同时进行检测,以排除假阴性和假阳性结果。
5.目前,用于rna病毒核酸检测试剂盒的阳性对照有三类:第一,重组质粒dna,优点是稳定性好,构建较简单,成本低,因此常常作为核酸检测的阳性对照,缺点是由于是dna,因此无法监控核酸逆转录过程;第二,假病毒 rna,通过化学合成的方法获取目的病毒基因并克隆构建至逆转录病毒载体,在细胞内制备出假病毒。假病毒是理想的rna病毒核酸检测试剂的阳性对照物质,优点是可以全程监控rna逆转录和扩增各步骤,缺点是假病毒构建操作繁琐、费时费力且成本高;第三,含有病毒目标基因的体外转录rna片段,其优点是可以全程监控rna逆转录和扩增各步骤,操作简单,成本低,缺点就是不如上述两类阳性对照物质稳定。
6.所谓体外转录技术是在体外无细胞系统中,用dna作为模板,模仿体内转录过程后生成rna。目前,实现体外转录很多是构建或购买含有t7、t3或 sp6 rna聚合酶启动子的质粒载体,操作复杂、成本较高,且不能实现同时制备多种ran片段。
技术实现要素:
7.基于此,本发明提供一种同时制备多种病毒rna片段用作核酸检测阳性对照的方法,旨在建立一种操作简便、成本低廉、无需构建逆转录病毒载体、且同时获得多种病原体ran片段作为核酸检测阳性对照的方法。
8.一种同时制备多种病毒rna片段用作核酸检测阳性对照的方法,包括以下步骤:
9.体外合成多种待检测病毒的保守区核苷酸序列,将各序列分别插入到质粒载体中,获得含有病毒保守序列的重组质粒,作为后续pcr的模板;
10.以多种待检测病毒的保守序列作为靶序列设计用于pcr扩增的特异性引物对;
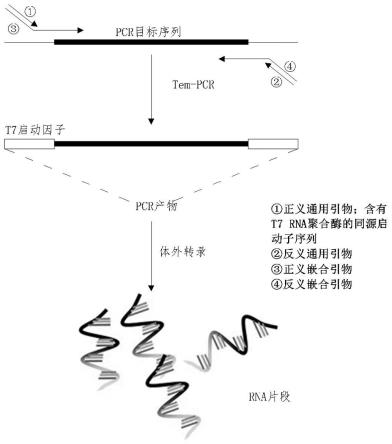
11.设计并合成一对非特异性通用引物,并保证该非特异性通用引物对与待测病毒无同源性,非特异性通用引物的正义引物为含有t7 rna聚合酶的同源启动子序列,即5'-taatacgactcactataggg-3';
12.合成多种待检测病毒的嵌合引物对;
13.以重组质粒为模板,采用tem-pcr技术,将多对嵌合引物和一对通用引物进行病毒核酸的扩增,获得pcr产物;
14.以上述pcr产物作为体外转录模板,将dna转录为rna;
15.将rna储存在-20℃~-70℃备用。
16.具体的,所述多种待检测病毒包括:a组轮状病毒、诺如病毒gi型、诺如病毒gii型、星状病毒和札如病毒。
17.所述质粒载体包括puc57载体。
18.具体的,所述非特异性通用引物的反义引物序列为seq id no.1。
19.具体的,还包括对转录本进行纯化的步骤,以便除掉模板、核苷酸和蛋白质。
20.具体的,所述嵌合引物是将非特异性通用引物的正义引物和反义引物分别与所述病毒的特异性引物对中的正义引物和反义引物的5’端相连,形成碱基数目为35~40nt的长引物。
21.具体的,每一对嵌合引物5’端都带有一个能被通用引物识别的标签序列,所有正义嵌合引物的5’端的标签序列为含有t7 rna聚合酶的同源启动子序列。
22.具体的,扩增后tem-pcr的主要成分包括pcr mix buffer、通用引物对、多种待检测病毒的嵌合引物对,多种病毒的重组质粒和ddh2o;所述pcr mix buffer为2
×
pcr mix buffer或10
×
pcr mix buffer。
23.具体的,所述嵌合引物和通用引物的摩尔浓度比为1:2~5。
24.具体的,所述嵌合引物和通用引物的摩尔浓度比为1:5。
25.具体的,所述tem-pcr的扩增条件为:
26.第一步:94℃30s,55~58℃15s,72℃60s,扩增反应15个循环;
27.第二步:94℃30s,72℃90s,扩增反应6个循环;
28.第三步:94℃20s,46℃20s,72℃20s,扩增反应35个循环。
29.具体的,所述pcr产物体外转录含有:
30.20μl体外转录体系中含有:5x transcriptaid reaction buffer 4μl、 atp/ctp/gtp/utp mix 8μl或transcriptaid enzyme mix 2μl;
31.pcr产物或胶回收产物2μl;
32.depc处理水2μl;
33.反应条件:37℃孵育2小时。
34.具体的,所述a组轮状病毒的嵌合引物对:正义引物序列为seq id no.2,反义引物序列为seq id no.3。
35.具体的,所述诺如病毒gi型的嵌合引物对:正义引物的序列为seq idno.4,反义引物序列为seq id no.5。
36.具体的,所述诺如病毒gii型的嵌合引物对:正义引物序列为seq id no.6;反义引物序列为seq id no.7。
37.具体的,所述星状病毒的嵌合引物对:正义引物序列为seq id no.8反义引物序列为seq id no.9。
38.具体的,所述札如病毒的嵌合引物对:正义引物序列为seq id no.10,反义引物序列为seq id no.11。
39.本发明基于tem-pcr技术与体外转录技术,建立了一种同时制备多种病毒 rna片段用作核酸检测阳性对照的方法,具有以下明显的优点:
40.(1)通用性强:只需根据待检测的目标病毒的保守序列设计特异性引物对,其余的步骤和条件基本不变即可制备rna病毒核酸检测的阳性对照,且该类阳性对照可监控逆转录和pcr扩增过程。
41.(2)操作简便:pcr以及体外转录均是非常成熟的技术,整个过程无复杂的设计和操作,且无特殊试剂和仪器要求。
42.(3)成本较低:从dna模板的制备,到pcr反应再到体外转录,均有较多的商品化试剂供选择,因此成本可控,性价比高。
43.(4)高通量:首先,通过tem-pcr可同时获得多个目标病毒的pcr产物。 tem-pcr其独特之处在于嵌合引物的浓度极低,用在pcr的最初几个循环中富集目标序列,通用引物的浓度高可实现产物的指数扩增,这样克服传统多重 pcr的扩增性不均一的问题。利用tem-pcr,不同病毒的核酸片段都能被良好得扩增。再则,本发明所用的tem-pcr的正义通用引物的5’端含有t7 rna 聚合酶的同源启动子序列,因此所得到的多重pcr产物均有t7 rna聚合酶的同源启动子序列,待转录序列位于启动子下游,经体外转录后可实现同时制备多种病毒rna片段的目的。
附图说明
44.图1是本发明的原理示意图;
45.图2是本发明实施例中tem-pcr扩增产物电泳图谱;m:50bp dna ladder
ꢀꢀ
marker,从上到下条带大小依次是500bp、400bp、300bp、250bp、200bp、150bp、 100bp、以及50bp;泳道1至5依次是:a组轮状病毒(229bp)、诺如病毒gi 型(246bp)、诺如病毒gii型(288bp)、星状病毒(291bp)、札如病毒(263bp);
46.图3a本发明实施例中a组轮状病毒、诺如病毒gi型、诺如病毒gii型的扩增曲线图;图3b本发明实施例中星状病毒、札如病毒的扩增曲线图。
具体实施方式
47.以下结合实施例对本发明作进一步说明,实施例是用于说明本发明,而不是用于限制本发明的范围。本领域技术人员可以确定本发明的基本特征,并且在不偏离本发明精神和范围的情况下,可以对本发明做出各种修改和改变,以使其使用各种用途和条件。下述实施例中所使用的实验原料如无特殊说明,均可通过商业途径得到。
48.实施例1:
49.本实施例制备星状病毒、札如病毒等两种病毒的rna片段。
50.包括以下步骤:
51.(1)合成2种病毒的保守序列的dna片段,并将各自的片段插入puc57 质粒中。质粒经酶切、测序鉴定所含有的目标序列正确无误后,将获得的含病毒保守序列的重组质粒作为后续tem-pcr反应的模板。
52.(2)tem-pcr多种引物的设计和合成
53.1)病毒特异性引物的设计:根据文献报道,确定待检测目标病毒的扩增靶基因,在genbank数据库中下载各种病毒的靶基因序列,将不同型别或来源的同种病毒的靶基因序列导入dnaman 9软件进行核苷酸序列的一致性比对,确定一致性高的局域作为保守序列。病毒的保守序列导入primerpremier 6软件进行引物的设计。设计的引物以及扩增产物均通过blast验证。
54.2)通用引物的设计与合成:
55.设计并合成一对与待测病毒无同源性的通用引物,其中的正义引物为含有 t7 rna聚合酶的同源启动子序列:5'-taatacgactcactataggg-3',反义引物的核苷酸序列是:5'-ccttagaagtccaccaat-3'(seq id no.1)。
56.3)嵌合引物的合成:嵌合引物的序列如表1所示,其中横线表示5’端的通用引物序列。
57.表1 tem-pcr所用嵌合引物的核苷酸序列
[0058][0059]
(3)tem-pcr
[0060]
1)tem-pcr反应体系:经前期优化反应,最终确定最优的反应体系,如表 2所示。tem-pcr中要求在反应体系中嵌合引物的浓度低,通用引物的浓度高,嵌合引物和通用引物的摩尔浓度比为1:5。
[0061]
表2 tem-pcr反应体系
[0062][0063][0064]
2)pcr反应:将上述反应体系的反应管放入pcr仪中,pcr反应条件设置如下:第一步:94℃30s,55~58℃15s,72℃60s,15个循环;第二步:94℃ 30s,72℃90s,6个循环;第三步:94℃20s,46℃20s,72℃20s,pcr扩增反应35个循环。
[0065]
3)扩增产物电泳:反应结束后经2%琼脂糖凝胶电泳查看扩增效果。图2 是5种腹泻相关病毒tem-pcr扩增结果。
[0066]
(4)体外转录
[0067]
可以以tem-pcr产物直接作为体外转录模板。若有扩增产物不纯的情况,建议先纯化产物后再进行体外转录。
[0068]
1)体外转录体系:
[0069]
表3体外转录体系
[0070]
成分加样量(μl)depc处理水25xtranscriptaidreactionbuffer4atp/ctp/gtp/utpmix*8pcr产物4transcriptaidenzymemix2共计20
[0071]
2)体外转录条件:37℃孵育2小时。
[0072]
3)为了除掉模板、核苷酸和蛋白质可选地,可对转录本进行纯化。
[0073]
(5)体外转录rna的应用
[0074]
将体外转录的rna作为阳性对照品进行一步法逆转录实时荧光定量pcr 检测5种腹泻相关病毒。
[0075]
图3b显示,以上2种病毒的阳性对照均能被良好得扩增。
[0076]
实施例2:
[0077]
本实施例制备a组轮状病毒、诺如病毒gi型、诺如病毒gii型三种病毒的rna片段。
[0078]
包括以下步骤:
[0079]
(1)合成3种病毒的保守序列的dna片段,并将各自的片段插入puc57 质粒中。质粒经酶切、测序鉴定所含有的目标序列正确无误后,将获得的含病毒保守序列的重组质粒作为后续tem-pcr反应的模板。
[0080]
(2)tem-pcr多种引物的设计和合成
[0081]
1)病毒特异性引物的设计:根据文献报道,确定待检测目标病毒的扩增靶基因,在genbank数据库中下载各种病毒的靶基因序列,将不同型别或来源的同种病毒的靶基因序列导入dnaman 9软件进行核苷酸序列的一致性比对,确定一致性高的局域作为保守序列。病毒的保守序列导入primerpremier 6软件进行引物的设计。设计的引物以及扩增产物均通过blast验证。
[0082]
2)通用引物的设计与合成:
[0083]
设计并合成一对与待测病毒无同源性的通用引物,其中的正义引物为含有 t7 rna聚合酶的同源启动子序列:5'-taatacgactcactataggg-3',反义引物的核苷酸序列是:5'-ccttagaagtccaccaat-3'(seq id no.1)。
[0084]
3)嵌合引物的合成:嵌合引物的序列如表4示,其中横线表示5’端的通用引物序列。
[0085]
表4 tem-pcr所用嵌合引物的核苷酸序列
[0086][0087][0088]
(3)tem-pcr
[0089]
1)tem-pcr反应体系:经前期优化反应,最终确定最优的反应体系,如表 5示。tem-pcr中要求在反应体系中嵌合引物的浓度低,通用引物的浓度高,嵌合引物和通用引物的摩尔浓度比为1:5。
[0090]
表5 em-pcr反应体系
[0091]
成分加样量(μl)终浓度(nm)ddh2o补足至20 2
×
pcrmixbuffer101
×
pcrmixbuffer通用引物对(5μm)1.6400a组轮状病毒引物对(2μm)0.880诺如病毒gi型嵌合引物对(2μm)0.880
诺如病毒gii型嵌合引物对(2μm)0.8803种病毒的重组质粒模板1.5(各0.5) 共计20 [0092]
2)pcr反应:将上述反应体系的反应管放入pcr仪中,pcr反应条件设置如下:第一步:94℃30s,55~58℃15s,72℃60s,15个循环;第二步:94℃ 30s,72℃90s,6个循环;第三步:94℃20s,46℃20s,72℃20s,pcr扩增反应35个循环。
[0093]
3)扩增产物电泳:反应结束后经2%琼脂糖凝胶电泳查看扩增效果。
[0094]
(4)体外转录
[0095]
可以以tem-pcr产物直接作为体外转录模板。若有扩增产物不纯的情况,建议先纯化产物后再进行体外转录。
[0096]
1)体外转录体系:
[0097]
表6外转录体系
[0098]
成分加样量(μl)depc处理水25xtranscriptaidreactionbuffer4atp/ctp/gtp/utpmix*8pcr产物4transcriptaidenzymemix2共计20
[0099]
2)体外转录条件:37℃孵育2小时。
[0100]
3)为了除掉模板、核苷酸和蛋白质可选地,可对转录本进行纯化。
[0101]
(5)体外转录rna的应用
[0102]
将体外转录的rna作为阳性对照品进行一步法逆转录实时荧光定量pcr 检测5种腹泻相关病毒。
[0103]
图3a显示,以上3种病毒的阳性对照均能被良好得扩增。
[0104]
实施例3:
[0105]
本实施例制备a组轮状病毒、诺如病毒gi型、诺如病毒gii型、星状病毒、札如病毒五种病毒的rna片段。
[0106]
包括以下步骤:
[0107]
(1)合成5种病毒的保守序列的dna片段,并将各自的片段插入puc57 质粒中。质粒经酶切、测序鉴定所含有的目标序列正确无误后,将获得的含病毒保守序列的重组质粒作为后续tem-pcr反应的模板。
[0108]
(2)tem-pcr多种引物的设计和合成
[0109]
1)病毒特异性引物的设计:根据文献报道,确定待检测目标病毒的扩增靶基因,在genbank数据库中下载各种病毒的靶基因序列,将不同型别或来源的同种病毒的靶基因序列导入dnaman 9软件进行核苷酸序列的一致性比对,确定一致性高的局域作为保守序列。病毒的保守序列导入primerpremier 6软件进行引物的设计。设计的引物以及扩增产物均通过blast验证。
[0110]
2)通用引物的设计与合成:
[0111]
设计并合成一对与待测病毒无同源性的通用引物,其中的正义引物为含有 t7 rna聚合酶的同源启动子序列:5'-taatacgactcactataggg-3',反义引物的核苷酸序列是:5'-ccttagaagtccaccaat-3'(seq id no.1)。
[0112]
3)嵌合引物的合成:嵌合引物的序列如表7示,其中横线表示5’端的通用引物序列。
[0113]
表7 tem-pcr所用嵌合引物的核苷酸序列
[0114][0115]
(3)tem-pcr
[0116]
1)tem-pcr反应体系:经前期优化反应,最终确定最优的反应体系,如表 8。tem-pcr中要求在反应体系中嵌合引物的浓度低,通用引物的浓度高,嵌合引物和通用引物的摩尔浓度比为1:5。
[0117]
表8 m-pcr反应体系
[0118]
成分加样量(μl)终浓度(nm)ddh2o补足至20 2
×
pcrmixbuffer101
×
pcrmixbuffer通用引物对(5μm)1.6400a组轮状病毒嵌合引物对(2μm)0.880
诺如病毒gi型嵌合引物对(2μm)0.880诺如病毒gii型嵌合引物对(2μm)0.880星状病毒嵌合引物对(2μm)0.880札如病毒嵌合引物对(2μm)0.8805种病毒的重组质粒模板3(各0.5) 共计20 [0119]
2)pcr反应:将上述反应体系的反应管放入pcr仪中,pcr反应条件设置如下:第一步:94℃30s,55~58℃15s,72℃60s,15个循环;第二步:94℃ 30s,72℃90s,6个循环;第三步:94℃20s,46℃20s,72℃20s,pcr扩增反应35个循环。
[0120]
3)扩增产物电泳:反应结束后经2%琼脂糖凝胶电泳查看扩增效果。图2 是5种腹泻相关病毒tem-pcr扩增结果。
[0121]
(4)体外转录
[0122]
可以以tem-pcr产物直接作为体外转录模板。若有扩增产物不纯的情况,建议先纯化产物后再进行体外转录。
[0123]
1)体外转录体系:
[0124]
表9转录体系
[0125][0126][0127]
2)体外转录条件:37℃孵育2小时。
[0128]
3)为了除掉模板、核苷酸和蛋白质可选地,可对转录本进行纯化。
[0129]
(5)体外转录rna的应用
[0130]
将体外转录的rna作为阳性对照品进行一步法逆转录实时荧光定量pcr 检测5种腹泻相关病毒。
[0131]
图3a和3b显示,5种病毒的阳性对照均能被良好得扩增。
[0132]
实施例4:
[0133]
本实施例诺如病毒gi型、诺如病毒gii型、星状病毒、札如病毒四种病毒的rna片段。
[0134]
包括以下步骤:
[0135]
(1)合成4种病毒的保守序列的dna片段,并将各自的片段插入puc57 质粒中。质粒经酶切、测序鉴定所含有的目标序列正确无误后,将获得的含病毒保守序列的重组质粒作为后续tem-pcr反应的模板。
[0136]
(2)tem-pcr多种引物的设计和合成
[0137]
1)病毒特异性引物的设计:根据文献报道,确定待检测目标病毒的扩增靶基因,在genbank数据库中下载各种病毒的靶基因序列,将不同型别或来源的同种病毒的靶基因序列导入dnaman 9软件进行核苷酸序列的一致性比对,确定一致性高的局域作为保守序列。病毒的保守序列导入primerpremier 6软件进行引物的设计。设计的引物以及扩增产物均通过blast验证。2)通用引物的设计与合成:
[0138]
设计并合成一对与待测病毒无同源性的通用引物,其中的正义引物为含有 t7 rna聚合酶的同源启动子序列:5'-taatacgactcactataggg-3',反义引物的核苷酸序列是:5'-ccttagaagtccaccaat-3'(seq id no.1)。
[0139]
3)嵌合引物的合成:嵌合引物的序列如表10示,其中横线表示5’端的通用引物序列。
[0140]
表10 2em-pcr所用嵌合引物的核苷酸序列
[0141][0142]
(3)tem-pcr
[0143]
1)tem-pcr反应体系:经前期优化反应,最终确定最优的反应体系,如表 13示。tem-pcr中要求在反应体系中嵌合引物的浓度低,通用引物的浓度高,嵌合引物和通用引物的摩尔浓度比为1:5。
[0144]
表11 em-pcr反应体系
[0145][0146][0147]
2)pcr反应:将上述反应体系的反应管放入pcr仪中,pcr反应条件设置如下:第一步:94℃30s,55~58℃15s,72℃60s,15个循环;第二步:94℃ 30s,72℃90s,6个循环;第三步:94℃20s,46℃20s,72℃20s,pcr扩增反应35个循环。
[0148]
3)扩增产物电泳:反应结束后经2%琼脂糖凝胶电泳查看扩增效果。图2 是5种腹泻相关病毒tem-pcr扩增结果。
[0149]
(4)体外转录
[0150]
可以以tem-pcr产物直接作为体外转录模板。若有扩增产物不纯的情况,建议先纯化产物后再进行体外转录。
[0151]
1)体外转录体系:
[0152]
表12转录体系
[0153]
成分加样量(μl)depc处理水25xtranscriptaidreactionbuffer4atp/ctp/gtp/utpmix*8pcr产物4transcriptaidenzymemix2共计20
[0154]
2)体外转录条件:37℃孵育2小时。
[0155]
3)为了除掉模板、核苷酸和蛋白质可选地,可对转录本进行纯化。
[0156]
(5)体外转录rna的应用
[0157]
将体外转录的rna作为阳性对照品进行一步法逆转录实时荧光定量pcr 检测4种腹泻相关病毒。
[0158]
图3a和3b显示,4种病毒的阳性对照均能被良好得扩增。
[0159]
以上实施例仅描述了制备含有星状病毒、札如病毒;a组轮状病毒、诺如病毒gi型、诺如病毒gii型;a组轮状病毒、诺如病毒gi型、诺如病毒gii 型、星状病毒、札如病毒;诺如病毒gi型、诺如病毒gii型、星状病毒、札如病毒rna片段的过程,但本发明所述的多种病毒
并不限于上述五种病毒rna 片段的制备。
[0160]
以上所述,仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到变化或替换,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。