1.本发明属于生物医学技术领域,具体涉及一种眼内注射物,其包含外泌体以及可生物降解的聚合物共混物基质。
背景技术:
2.视网膜缺血再灌注损伤(retinal ischemia reperfusion injury,riri)是临床多种眼科疾病共同的病理损伤过程,与糖尿病性视网膜病变、青光眼、视网膜中央动脉阻塞等造成缺血的视网膜病变相关,最终可导致不可逆的视力损害和视力丧失。目前临床治疗仍然以保守治疗为主,尚无有效的措施。
3.近年来,研究人员探索了在眼科应用细胞疗法的可能性。有文献报道称,玻璃体腔注射骨髓间充质干细胞可减少小鼠riri模型中视网膜细胞的死亡,并已被用于治疗临床患者的难治性黄斑裂孔。尽管取得了一些积极的治疗效果,但基于细胞的疗法在眼科的应用遇到了一系列的问题。从医学的角度来看,病理微环境对治疗性细胞的功能有严重的负面影响。低氧张力、高氧化应激和营养剥夺可导致治疗性细胞存活率低,使治疗效果有限。也有报道称干细胞会不可控的转化为不良的细胞,如转化为肌成纤维细胞,这也可能产生不佳的治疗效果甚至副作用。在临床转化方面,治疗性细胞需要很长时间来分离和生长,而不能作为现成的产品进行潜在的应用,可用于急性环境下,这限制了这些基于细胞的技术的临床可行性。
4.目前来看,视网膜缺血再灌注疾病的治疗现状是缺少一种既能克服细胞治疗弊端,又能兼顾细胞治疗优势的药物。本发明恰能弥补上述不足。
技术实现要素:
5.本发明的目的在于提供一种基于微囊的眼内注射物及其制备方法。
6.为实现本发明的目的,提供以下技术方案:
7.一种基于微囊的眼内注射物,是由外泌体和大孔微球制成的封口微囊;所述外泌体装载于所述大孔微球的内部,所述大孔微球由疏水聚合物和两亲嵌段共聚物制备而成,所述大孔微球的表面具有开孔、内部具有贯穿孔道;所述微囊的平均粒径是10-100μm。
8.优选的,所述外泌体为间充质干细胞来源的外泌体或调节性t细胞(treg)来源的外泌体。
9.进一步的,间充质干细胞来源于骨髓间充质干细胞,具体如小鼠骨髓间充质干细胞。调节性t细胞(treg)具体如小鼠脾脏调节性t细胞。
10.根据本发明的一个具体实施例,来源于骨髓间充质干细胞的外泌体(mexo),呈杯托状,粒径约为120nm,且mexo的标志蛋白alix、tsg101和cd63阳性。
11.具体的,原代间充质干细胞的提取和mexo的富集方法如下:从小鼠骨髓来源的有核细胞中提取和纯化骨髓间充质干细胞(mscs),收集mscs的培养基上清,以超速离心法富集mexo。
12.优选的,所述微囊的平均粒径是10-30μm。
13.优选的,所述大孔微球由plga和pela制成;其中,plga和pela质量比为9:1。
14.所述plga的分子量为21kda;所述pela的分子量为40kda。
15.本发明提供的基于微囊的眼内注射物的制备方法,包括下述步骤:先由疏水聚合物和两亲嵌段共聚物的共混物制备大孔微球;然后使大孔微球与含外泌体的溶液混合,接着使装载有外泌体溶液的大孔微球封口,得到装载有外泌体的封口微囊,即所述的基于微囊的眼内注射物。
16.进一步的,所述大孔微球采用双乳液和溶剂萃取法制备。
17.进一步的,所述大孔微球由plga和pela制成。
18.经过探索,所述大孔微球封口的条件为39-42℃孵育2-6h,最优条件为39℃孵育4h。该条件以尽可能温和的条件封口,最大程度避免高温引起的外泌体蛋白成分变性。
19.所述基于微囊的眼内注射物的制备方法,具体包括以下步骤:
20.(1)配制油相,所述油相为疏水聚合物和两亲嵌段共聚物的共混物的溶液,其中溶剂为有机溶剂;配制内水相溶液和外水相溶液,外水相添加表面活性剂;
21.(2)将内水相分散到油相当中,形成油包水初乳液;再将初乳液分散到外水相中,形成水包油包水复乳液;
22.(3)利用溶剂去除法,使油相固化,得到具有贯穿孔道的大孔微球;
23.(4)将开孔微球与含外泌体的溶液混合,外泌体从大孔微球的表面进入内部的空腔中,得到装载有外泌体的大孔微球;
24.(5)将所述装载有外泌体的大孔微球封口,得到装载有外泌体的封口微囊。
25.步骤(1)中优选的,所述油相为plga和pela的共混物的溶液;其中,plga和pela质量比为9:1。
26.所述plga的分子量为21kda;所述pela的分子量为40kda。
27.优选的,所述有机溶剂可为乙酸乙酯。
28.步骤(3)中所述溶剂去除法为溶剂萃取。
29.步骤(3)中所述固化过程中,内水相与外水相融合,形成贯穿孔。步骤(3)所述的具有内外贯穿孔道的大孔微球,为多孔结构。在本发明优选的实施方式中,本发明所述大孔微球为表面多孔微球。
30.根据本发明的一个具体实施例,所述大孔微球的制备方法如下:用超声法(120w)将0.5ml 0.5%的氯化钠与2ml含有150mg化合物(plga和pela,质量比为9:1)的乙酸乙酯在冰浴中混合12s;在9000rpm下均质120s后,将混合物加入到15ml 1.5%的聚乙烯醇(pva 217)水溶液中,均质2-3min后得到乳液。将制备的乳液用垂直混悬仪以45rpm垂直悬浮预固化25min,然后将预固化后的乳液加入到500ml去离子水中,通过100rpm磁搅拌固化10min,得到具有贯穿孔道的开孔微球。用不同大小的不锈钢筛网筛选粒径分布在10-30μm的微球,更有利于眼内注射。
31.本发明还提供了上述基于微囊的眼内注射物的应用。
32.本发明所提供的基于微囊的眼内注射物的应用是其在制备具有视网膜缺血再灌注损伤治疗作用的产品中的应用。
33.本发明还保护一种具有视网膜缺血再灌注损伤治疗作用的产品。
34.所述产品,包括本发明所述的基于微囊的眼内注射物。
35.本发明中所述的产品可为药物或药物制剂。
36.与现有技术相比,本发明具有如下有益效果:
37.本发明提供了一种基于微囊的眼内注射物,所述注射物由mscs外泌体和大孔微球混合而成,具有在眼内缓慢、持续地释放mexo的功能。该体系通过玻璃体腔注射后,可以沉降在玻璃体下部,并且在玻璃体中持续地释放治疗性外泌体,达成治疗效果,且疗效优于临床常用药物。旨在弥补目前临床玻璃体视网膜疾病治疗的不足。
附图说明
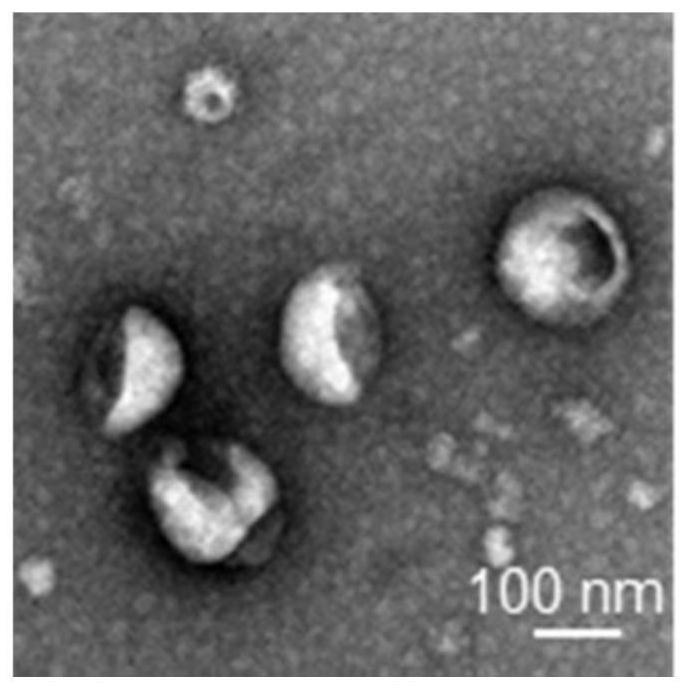
38.图1为实施例1中mexo的透射电子显微镜(tem)图。
39.图2为实施例1中纳米颗粒跟踪分析仪测量mexo粒径和电势的统计图。
40.图3为实施例1中蛋白质印迹法分析mexo的标志蛋白。
41.图4为实施例2中微球愈合前的扫描电子显微镜(sem)图。
42.图5为实施例2中微球内部结构的sem图。
43.图6为实施例2中制备的装载外泌体的封口微球的激光共聚焦图。
44.图7位实施例2中制备的装载外泌体的封口微球的装载率。
45.图8为实施例2中封口微球的sem图。
46.图9为实施例2中封口微球内部结构的sem图。
47.图10位实施例3中riri模型小鼠的小动物成像图像。
48.图11为实施例3中riri模型小鼠的眼底相。
49.图12为实施例3中riri模型小鼠离体眼球的小动物成像图。
50.图13为实施例4中光学相干断层扫描血管成像技术(oct)观察riri模型小鼠的视网膜全层和神经节细胞层厚度。
51.图14为实施例4中视网膜电图(erg)观察riri模型小鼠视觉功能。
52.图15为实施例4中riri模型小鼠心、肝、脾、肺和肾的切片he染色。
53.图16为实施例4中接触式眼压测量仪检测riri模型小鼠眼压。
54.图17为实施例4中静脉采血检测riri模型小鼠的血常规。
55.图18为实施例5中trexo的tem图。
56.图19为实例例5中纳米颗粒跟踪分析仪测量trexo粒径和电势的统计图。
57.图20为实施例5蛋白质印迹法分析trexo的标志蛋白。
58.图21为实施例5中制备的装载trexo的封口微球的激光共聚焦图。
59.图22为实施例5中pmu模型小鼠眼内液中炎症细胞因子的含量。
60.图23为实施例5中pmu模型小鼠治疗后视网膜h&e切片。
61.图24为实施例5中pmu模型小鼠心、肝、脾、肺和肾的切片h&e染色。
62.图25为实施例5中接触式眼压测量仪检测pmu模型小鼠眼压。
63.图26为实施例5中静脉采血检测pmu模型小鼠的血常规。
具体实施方式
64.下面结合具体实施例对本发明作进一步阐述,但本发明并不限于以下实施例。所
述方法如无特别说明均为常规方法。所述原材料如无特别说明均能从公开商业途径获得。
65.下述实施例中所述plga的分子量为21kda;所述pela的分子量为40kda;plga和pela质量比为9:1。
66.实施例1、原代骨髓间充质干细胞细胞的体外扩增和mexo的富集
67.(1)从小鼠骨髓来源的全核细胞中提取和纯化间充质干细胞(mscs)。72h后去除非贴壁细胞,贴壁细胞在添加2mm l-谷氨酰胺和55mm 2-巯基乙醇的mem-a培养基(含有10%无外泌体的胎牛血清、1%青链霉素)中培养。细胞培养物在5%二氧化碳培养箱中培养。
68.(2)收集7-14天的细胞培养基上清,以300g离心15min以除去杂质;然后以10,000g离心15min以去除细胞碎片;以100,000g离心120min,弃上清,收集沉淀,然后重悬于pbs中,得到mexo溶液。利用透射电子显微镜(tem)观察其形貌,纳米颗粒跟踪分析(nta)测量其粒径和电势分布,蛋白质印迹法测定其外泌体特征蛋白表达。
69.结果见图1-3。由图可知,mexo呈杯托状,粒径约为120nm,且mexo的标志蛋白alix、tsg101和cd63阳性。
70.实施例2、装载外泌体的封口微囊的制作(记作mexocap)
71.(1)微囊采用双乳液和溶剂萃取法制备。用超声法(120w)将0.5ml 0.5%的氯化钠与2ml含有150mg化合物(plga和pela)的乙酸乙酯在冰浴中混合12s。在9000rpm下均质120s后,将混合物加入到15ml质量体积浓度为1.5%的聚乙烯醇(pva 217)水溶液中,均质120s后得到乳液。将制备的乳液用垂直混悬仪以45rpm垂直悬浮预固化25min,然后将预固化后的乳液加入到500ml去离子水中,通过100rpm磁搅拌固化10min,得到具有贯穿孔道的开孔微球。用不同大小的不锈钢筛网筛选粒径分布在10-30μm的微球,更有利于眼内注射。
72.(2)吸取上述微球悬液50μl(含微球约50μg),滴在锡箔纸上,置于室温晾干。用导电胶将含有样品的锡箔纸粘贴在制样台上,喷金后用sem观察微球表面形貌。
73.如图4所示,表面孔径在3-4μm,具有表面开口的结构,微球的平均粒径在25μm。同时为了观察微球内部的结构,用超薄刀片将晾干后的微球切碎。然后将样品粘附在导电胶上喷金,用sem观察。如图5所示,微球内部同样具有内部多孔且相互贯穿的结构,内部孔径在4-5μm左右。
74.(3)吸取1ml步骤(1)制备的干重为30mg开口微球悬液于1.5ml的离心管中,离心去掉上清,加入500μl 20mg/ml的外泌体溶液与微球共混,置于垂直混悬仪上混悬4h(300rpm),使外泌体利用微球贯穿的孔道充分进入微球空腔内部。分别在恒温箱中以39℃-42℃孵育2h-6h,探索温度最低、时间最短的愈合方式。即能在不影响微球形貌的同时使微球封口,且不影响外泌体的功能。之后将垂直混悬仪和微球放在39℃恒温箱中升温封口,过程中混悬速度为100rpm,保证微球在整个升温过程中受热均匀,同时不会发生沉降,反应4h后封口完成,离心(500g,5min)去掉上清,得到装载外泌体的封口微囊。利用共聚焦显微镜观察微囊对外泌体的装载情况,结果如图6所示。由图6可知,在激光共聚焦图像中,天蓝色代表微球骨架,黄色代表外泌体。在2d扫描模式下,可以看到天蓝色的微球骨架,其中包含许多圆形腔室,同时,黄色的外泌体充满微球的腔室。装载率如图7所示。
75.(4)吸取含外泌体的封口微囊悬液50μl,滴在锡箔纸上,置于室温晾干。用导电胶将含有样品的锡箔纸粘贴在制样台上,喷金后用sem观察微囊表面形貌。如图8所示,表面多孔完全封闭,形成封口微囊。同时为了观察封口微囊内部的结构,用超薄刀片将晾干后的微
囊切碎。然后将样品粘附在导电胶上喷金,用sem观察。如图9所示,微囊内部虽然依然具有内部多孔的结构,且孔径在4-5μm左右,但是内部贯穿的多孔结构变成了封闭且独立的多孔结构。
76.实施例3、微球在小鼠眼内的滞留和分布
77.(1)c57bl/6小鼠采用0.5%戊巴比妥(0.1ml/10g
·
bw)腹腔注射麻醉,1%复方托匹卡胺滴眼液扩瞳。随后,经玻璃体腔注射途径给药且全程仅给药一次,用hamilton’s微量注射器分别将mexo、mscs和mexocap注入玻璃体腔内(单次玻璃体腔注射量为5μg mexo/眼、4
×
106个mscs/眼、装载在50μg微球里的5μg mexo/眼),每组采用6只小鼠的6只眼。
78.(2)在玻璃体腔注射后的第0、3、7、14、21、28和35天麻醉小鼠,使用小动物成像系统进行成像,结果如图10所示,将外泌体封装在微球内后,其眼内滞留时间显著延长。在玻璃体腔注射后的第三天,常规麻醉散瞳后使用眼底照相机拍摄眼底相。结果如图11所示。后以颈椎脱臼法处死小鼠,使用镊子夹住视神经,“托”起眼球,离断视神经,从而完整取出眼球。将眼球立即放置在培养皿中,在小动物成像系统中观察mexo、mscs和mexocap在眼内的分布情况。如图12所示,少量残留的mexo均匀分布在视网膜前区,mscs分布在晶状体后表面,这可能是由于mscs的贴壁特性。而mexocap主要分布在玻璃体腔下部,其释放的mexo分布在视网膜前区。结果证明:mexocap在玻璃体腔注射后沉降在玻璃体腔下部,并不影响光路。
79.实施例4、riri模型小鼠体内效果和安全性验证
80.(1)构建视网膜缺血再灌注损伤(riri)小鼠模型。c57bl/6小鼠采用0.5%戊巴比妥(0.1ml/10g
·
bw)腹腔注射麻醉,1%复方托匹卡胺滴眼液扩瞳。将装有100ml无菌生理盐水的输液瓶与一次性无菌胰岛素注射器通过输液器相连,排尽输液器内的空气。待瞳孔散大后,手持针头平行于小鼠身体纵轴沿颞侧角膜缘进针。用胶布固定好针头后,打开输液器水闸,缓慢升高输液瓶,使其最终距离小鼠的高度为150cm,这个高度所形成的眼压为110mmhg。输液瓶升高后,可以观察到小鼠虹膜和眼底变苍白,表明视网膜缺血形成。缺血1h后,降低输液瓶高度,拔出针头,此时虹膜与眼底血流恢复,即视网膜再灌注形成。
81.(2)造模1天后,经玻璃体腔注射途径给药且仅给药一次。在用0.5%戊巴比妥(0.1ml/10g
·
bw)腹腔注射麻醉riri模型小鼠后,用hamilton’s微量注射器分别将pbs、mexo、mscs、mexocap和ngf(鼠神经生长因子)注入玻璃体腔内(单次玻璃体腔注射量为2μl pbs/眼、5μg mexo/眼、4
×
106个mscs/眼、装载在50μg微球里的5μg mexo/眼、3μg ngf/眼),每个给药组采用6只小鼠的6只眼。
82.(3)给药28天后,riri模型小鼠采用0.5%戊巴比妥(0.1ml/10g
·
bw)腹腔注射麻醉,1%复方托匹卡胺滴眼液散瞳,行oct和erg检查。见图13、14。结果显示:mexocap治疗组视网膜全层和神经节细胞层的厚度减少最轻,视网膜电图a波和b波幅值的降低最小。将小鼠颈椎脱臼处死后,摘除眼球,包埋固定后做3-4μm/片的石蜡切片,结果显示:mexocap治疗组的内核层和外核层的核层数减少最轻,且效果优于临床常用的神经生长因子。
83.(4)给药28天,将riri模型小鼠麻醉后,使用小动物眼压测量仪检测其眼压,见图16。结果显示:mexocap治疗不会对眼压造成影响。取小鼠静脉血检测riri模型小鼠的血常规,见图17,结果显示血常规没有明显变化。随后将riri模型小鼠处死,取其内脏(心、肝、脾、肺、肾),固定,石蜡包埋后制作3-4μm/片的切片,苏木精和伊红(h&e)染色,使用光学显
微镜观察,见图15。结果显示:mexocap治疗后内脏未见明显异常。
84.实施例5、提取treg细胞外泌体
85.从小鼠脾脏研磨液中获得细胞悬液后,使用美天旎cd4
cd25
调节性t细胞分离试剂盒,按说明书操作,获得treg细胞。使用去外泌体血清配制的x-vivo完全培养基(含10%去外泌体血清和1%双抗)培养treg细胞,传代后培养48h并收集细胞上清。以300g离心15min以除去杂质;然后以10,000g离心15min以去除细胞碎片;以100,000g离心120min,弃上清,收集沉淀,然后重悬于pbs中,得到trexo溶液。利用tem观察其形貌,nta测量其粒径和电势分布,蛋白质印迹法测定其外泌体特征蛋白表达。
86.结果见图18-20。由图可知,trexo呈杯托状,粒径约为120nm,且trexo的标志蛋白alix、tsg101、cd63、ctla-4和il-10阳性。
87.实施例6、装载treg细胞外泌体的封口微囊的制作(记作trexocap)。
88.按照实施例2中步骤(1)的方法制备开口微球。
89.吸取1ml的干重为30mg开口微球悬液于1.5ml的离心管中,离心去掉上清,加入500μl 20mg/ml的外泌体溶液与微球共混,置于垂直混悬仪上混悬4h(300rpm),使外泌体利用微球贯穿的孔道充分进入微球空腔内部。分别在恒温箱中以39℃-42℃孵育2h-6h,探索温度最低、时间最短的愈合方式。即能在不影响微球形貌的同时使微球封口,且不影响外泌体的功能。之后将垂直混悬仪和微球放在39℃恒温箱中升温封口,过程中混悬速度为100rpm,保证微球在整个升温过程中受热均匀,同时不会发生沉降,反应4h后封口完成,离心(500g,5min)去掉上清,得到装载外泌体的封口微囊。利用共聚焦显微镜观察微囊对外泌体的装载情况,结果如图21所示。由图21可知,在激光共聚焦图像中,天蓝色代表微球骨架,粉红色代表外泌体。在2d扫描模式下,可以看到天蓝色的微球骨架,其中包含许多圆形腔室,同时,粉红色的外泌体充满微球的腔室。
90.实施例7:pmu模型小鼠体内效果及安全性验证
91.(1)构建pmu小鼠模型。c57bl/6小鼠采用0.5%戊巴比妥(0.1ml/10g
·
bw)腹腔注射麻醉,1%复方托匹卡胺滴眼液扩瞳。于第-9天,予小鼠皮下注射100μg溶解在0.1ml不完全弗氏佐剂的灭活的结核分枝杆菌h37ra抗原。7天后,常规麻醉小鼠后,右眼滴表面麻醉剂(盐酸奥布卡因滴眼液)及散瞳剂(复方托吡卡胺滴眼液),随后每只小鼠右眼玻璃体内注射3μg溶解在1μl pbs缓冲液中的结核分枝杆菌抗原h37ra。2天后给药。
92.(2)造模后,经玻璃体腔注射途径给药且仅给药一次。在用0.5%戊巴比妥(0.1ml/10g
·
bw)腹腔注射麻醉pmu模型小鼠后,用hamilton’s微量注射器分别将pbs、trexo、treg细胞、trexocap和ta(曲安奈德)注入玻璃体腔内(单次玻璃体腔注射量为2μl pbs/眼、5μg trexo/眼、4
×
106个treg细胞/眼、装载在50μg微球里的5μg trexo/眼、80μg ta/眼),每个给药组采用6只小鼠的6只眼。
93.(3)给药28天后,pmu模型小鼠采用0.5%戊巴比妥(0.1ml/10g
·
bw)腹腔注射麻醉,1%复方托匹卡胺滴眼液扩瞳,取小鼠前房水收集眼内液,见图22,结果显示,trexocap组小鼠眼内液中炎症细胞因子(il-1β、il-6、il-8和tnf)含量最低。将小鼠颈椎脱臼处死后,摘除眼球,包埋固定后做3-4μm/片的石蜡切片,如图23,结果显示:trexocap治疗组的小鼠,其玻璃体和视网膜炎症细胞浸润程度最低,且效果优于临床常用的激素类药物曲安奈德。
94.(4)给药28天,将pmu模型小鼠麻醉后,使用小动物眼压测量仪检测其眼压,见图24。结果显示:trexocap治疗不会对眼压造成影响。取小鼠静脉血进行pmu模型小鼠的血常规检测,见图25,结果显示血常规没有明显变化。随后将pmu模型小鼠处死,取其内脏(心、肝、脾、肺、肾),固定,石蜡包埋后制作3-4μm/片的切片,苏木精和伊红(he)染色,使用光学显微镜观察,见图26。结果显示:trexocap治疗后内脏未见明显异常。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
