一种组织ph变化血清标志物及应用
技术领域
1.本发明属于生物医药研究领域,具体涉及一种组织ph变化血清标志物及应用。
背景技术:
2.legumain(lgmn)是发现于溶酶体中的一种天冬酰胺内肽酶(asparaginyl endopeptidase or aep)(ec 3.4.22.34)。它属于半胱胺酸蛋白酶c13家族。aep底物的p1位置为天冬酰胺特异性。legumain是以前体合成的,其摩尔分子量约为56kda。legumain前体的n端和c端都有前肽。legumain前体在核糖体合成后被运输到溶酶体中,并在其酸性环境中发生连续自活化成为成熟的aep,其摩尔分子量约为35kda。因此,legumain具有ph响应性,并且其ph依赖的活化与其在sds-page上从56kda条带转化为35kda条带相吻合。
3.legumain高表达于多种正常组织和器官中。在血液和免疫系统中,legumain高表达于cd8 t细胞、外周单核细胞、血小板、淋巴结、扁桃体、骨髓间充质干细胞;在神经系统中,legumain高表于大脑皮层;在肌骨胳系统中,legumain高表达于心脏和骨骼;在内脏中,legumain高表达于口腔上皮细胞、食管、胃肠道各部、肝脏、肾脏、脾脏、脂肪;在分泌器官中,legumain高表达于唾液腺、甲状腺、肾上腺、乳腺、胰腺、胰岛、胆囊、前裂腺、膀胱、皮肤、虹毛囊、胎盘;在生殖系统中,legumain高表达于子宫、卵巢、睾丸。legumain高表达于多种人类实体瘤中,如结直肠癌,乳腺癌,前裂腺癌,胃癌、卵巢癌等。legumain也高表于急性淋巴母细胞性白血病。此外,legumain还高表于其他病变组织如动脉粥样硬化的斑块及周边组织。legumain不仅表达于细胞溶酶体、胞质及细胞核中,而且能分泌到细胞外,进而能在血液中被检测到并与某些疾病预后相关。
4.众多研究表明,肿瘤的酸性微环境是肿瘤的一个基本特征。肿瘤在酸性微环境中增殖而不在中性或偏碱性的微环境中生长。肿瘤的酸性微环境是肿瘤进展的一个主要决定因素。此外,肿瘤的酸性微环境是肿瘤耐药性的重要机制。肿瘤的酸性微环境还能促进肿瘤免疫逃逸。此外,炎症性疾病也与组织酸性ph相关;反之,酸性ph被证明会促进炎症。因此可以说,组织酸性微环境与大多数慢性、退行性疾病相关。
5.但组织微环境的酸碱性变化难以测量,也就无法测量特别是治疗后组织微环境酸碱性变化。
技术实现要素:
6.为了克服现有技术中所存在的问题,本发明的目的在于提供一种组织ph变化血清标志物及应用。
7.为了实现上述目的以及其他相关目的,本发明采用如下技术方案:
8.本发明的第一方面,提供legumain作为生物标志物在制备或筛选组织ph检测试剂中的用途。
9.具体地,所述legumain又称为lgmn或aep。所述legumain的中文名字是天冬酰胺内肽酶。所述legumain的genebank登录号是nc_000014,基因号是5641。
10.进一步地,所述生物标志物是指血清生物标志物。
11.进一步地,所述组织ph检测试剂用于检测组织ph水平或变化。
12.进一步地,所述组织ph检测试剂用于疾病的判断、治疗方案的选择、和/或预后评估。
13.进一步地,所述疾病选自肿瘤。
14.进一步地,所述肿瘤选自乳腺癌、胃癌、结肠癌、卵巢癌、胰腺癌、前列腺癌、黑色素瘤、胶质母细胞瘤、成骨肉瘤。
15.进一步地,所述治疗选自化疗、热疗或热化疗。
16.进一步地,所述检测试剂以legumain作为检测对象。
17.进一步地,所述胃癌检测试剂中,含有legumain作为标准品或阳性对照。
18.所述标准品或阳性对照,用于检测样本组织中的legumain含量。
19.将legumain作为生物标志物用于筛选组织ph检测试剂,是指将legumain作为靶标应用于组织ph检测试剂的筛选。在一优选例中,基于所述的legumain,筛选特异性识别legumain的试剂,从而作为检测样本组织ph水平的试剂。
20.在一实施方式中,基于所述的legumain,筛选特异性识别legumain的抗体,从而作为从而作为检测组织ph检测试剂。
21.本发明的第二方面,提供特异性识别legumain的试剂在制备组织ph检测试剂中的用途。
22.进一步地,所述检测试剂以legumain作为检测对象。
23.在一实施方式中,所述特异性识别legumain的试剂选自特异性识别legumain的抗体。
24.所述抗体包括单克隆抗体和多克隆抗体。
25.本发明的第二方面,提供一种组织ph检测试剂盒,包括组织ph检测试剂。
26.进一步地,所述试剂盒以legumain作为生物标志物。
27.进一步地,所述生物标志物是指血清生物标志物。
28.进一步地,所述组织ph检测试剂是指肿瘤组织ph检测试剂。
29.进一步地,所述组织ph检测试剂用于检测组织ph水平或变化。
30.进一步地,所述组织选自肿瘤组织。
31.进一步地,所述检测试剂以legumain作为检测对象。
32.在一实施方式中,所述特异性识别legumain的试剂选自特异性识别legumain的抗体。
33.所述抗体包括单克隆抗体和多克隆抗体。
34.在一优选例中,特异性识别legumain的抗体包括用于检测legumain的第一抗体和用于检测所述第一抗体的第二抗体。
35.进一步地,所述第二抗体为荧光分子标记的第二抗体。
36.在一优选例中,所述的试剂盒中还包括免疫荧光染色技术常用的试剂,免疫荧光染色技术常用的试剂包括:福尔马林固定液、石蜡、二甲苯、柠檬酸钠、封闭液中的一种或多种。
37.在一优选例中,所述试剂盒还包括阳性对照、阴性对照。所述阳性对照包括
legumain。所述阴性对照包括ddh2o。
38.进一步地,所述组织ph检测试剂盒用于疾病的判断、治疗方案的选择、和/或预后评估。
39.进一步地,所述疾病选自肿瘤。
40.进一步地,所述治疗选自化疗、热疗或热化疗。
41.在本发明的第四方面,提供了一种检测组织ph的方法,包括检测样本组织中legumain的水平。
42.与现有技术相比,本发明具有如下有益效果:
43.本发明经过广泛而深入的研究,首次发现,aep可以作为全身治疗/局部治疗后,病理病变后组织ph升高的血清标志物,进而作为治疗,疾病预后标志物。在此基础上,本发明提供一种全新的用于检测组织ph的方法及检测试剂,具有广阔的临床应用前景。
附图说明
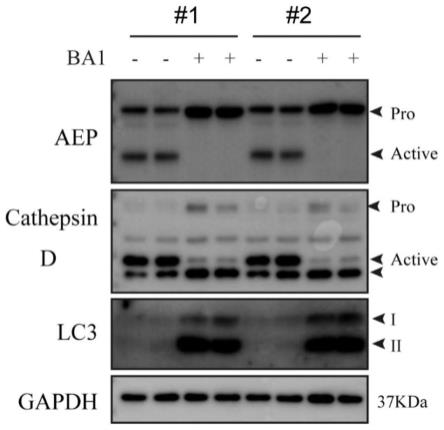
44.图1:抑制质子泵v-atpase功能导致多种溶酶体蛋白酶活化减少。
45.图2:药物化疗、热疗或联合治疗特异性减少legumain活化,其中图2a,legumain活化减少与药物剂量负相关。图2b,legumain活化减少与热疗温度负相关。图2c,热化疗联合治疗(水浴,43)℃减少legumain活化。图2d,热化疗联合治疗(微波,38-43℃)减少legumain活化。
46.图3:热疗改变质子泵v-atpase组装从而导致溶酶体ph升高,图3a,热疗改变质子泵v-atpase组装;图3b,热疗导致细胞中溶酶体ph升高。
47.图4:免疫荧光可检测热化疗对legumain活化的影响,图4a,热疗减少legumain活化可通过抗-legumain免疫荧光检测;图4b,可定量分析热疗组与对照组细胞中抗-legumain免疫荧光染色后平均荧光强度;图4c,免疫荧光结果显示热疗温度与legumain减少(活化)正相关。图4d,免疫荧光结果显示热疗时间与legumain减少(活化)正相关;图4e,免疫荧光结果显示热化疗联合治疗减少legumain(活化)。
48.图5:细胞凋亡蛋白caspase-3活化与legumain活化负相关。
49.图6:患者血清与正常自愿者血清中legumain水平具有显著差异。
50.图7:热化疗后血液中legumain含量降低。
具体实施方式
51.在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
52.当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实
现本发明。
53.除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecular cloning:a laboratory manual,second edition,cold spring harbor laboratory press,1989and third edition,2001;ausubel等,current protocols in molecular biology,john wiley&sons,new york,1987and periodic updates;the series methods in enzymology,academic press,san diego;wolffe,chromatin structure and function,third edition,academic press,san diego,1998;methods in enzymology,vol.304,chromatin(p.m.wassarman and a.p.wolffe,eds.),academic press,san diego,1999;和methods in molecular biology,vol.119,chromatin protocols(p.b.becker,ed.)humana press,totowa,1999等。
54.实施例1
55.1.1、试验目的
56.考察热化疗细胞中legumain活化变化。
57.1.2、试验方法
58.(1)细胞培养
59.乳腺癌细胞系mda-mb-231,用含10%fbs,1%p/s的dmem,在5%co2,90%湿度培养箱中37℃培养。
60.抑制细胞溶酶体质子泵:为了抑制细胞溶酶体质子泵v-atpase活性,细胞培养基中加入100nm ba1,培养过夜。
61.细胞化疗:细胞培养基中加入10μg/ml顺铂(cddp),培养过夜。
62.细胞热疗:细胞放入42℃或43℃水浴锅中热疗1小时,放回细胞培养箱中继续培养3小时。微波热疗时,细胞放入915hz细胞热疗仪中热疗1小时,温度范围从38℃-43℃。
63.细胞热化疗:细胞化疗过夜,然后热疗1小时,放回细胞培养箱中继续培养3小时。为了抑制化疗/热化疗引起的细胞凋亡,在化疗过程同时加入10nm qvd抑制caspase-3活性。
64.(2)免疫印迹
65.胰酶消化收集经过热疗、化疗或热化疗作用后的细胞。通过细胞裂解液裂解细胞。收集细胞裂解液上清,测定蛋白浓度。具体地,通过sds-page分离细胞蛋白,免疫印迹法检测检测自噬相关蛋白的表达情况。
66.一抗及稀释倍数为:
67.goat-anti-legumain(1:1000)(novus bio.),
68.rabbit-anti-lc3(1:4000)(novus bio.),
69.mouse-anti-cathepsin d(1:3000)(sigma),
70.rabbit-anti-cathepsin b(1:1000)(santa cruz),
71.rabbit-anti-v0a1(1:2000)(sigma),
72.mouse-anti-v1c1(1:1000)(santa cruz),
73.rabbit-anti-caspase-3(1:3000)(cst),
74.rabbit-anti-caspase-8(1:2000)(r&d)。
75.二抗及稀释倍数为:hrp-conjugated-goat-anti-rabbit-igg(h l)(1:10000)(thermo)。
76.免疫印迹通过ecl显影。
77.(3)免疫荧光
78.细胞经热疗或热化疗后,用4%pfa固定30分钟。固定的细胞以100ng/ml digitonin打孔后,用1%bsa封闭半小时。
79.用一抗goat-anti-legumain(1:400)在4℃孵育过夜。
80.pbst洗三次。
81.用二抗alexa555-donkey-anti-goat(1:300)在室温孵育3小时。
82.pbst洗三次。
83.dapi复染细胞核。封片。
84.confocal显微镜下观察结果。
85.(4)溶酶体ph值测定
86.细胞用2μmlysosensor标记30分钟。胰酶消化收集细胞。为绘制标准曲线,细胞重悬于ph标准溶液中(ph 4,4.5,5,5.5,6,6.5,7),其中含2μm monesin.在酶标仪上,以em490固定,ex280-450激发光扫描.以ph值为横坐标,ex354/446比值为纵坐标,绘制标准曲线。
87.热疗后的细胞,按上述方法,在细胞培养基中测定ex354/446比值,将其代入标准曲线,计算得到细胞溶酶体ph值。
88.1.3、试验结论
89.(1)抑制质子泵v-atpase功能导致细胞内多种溶酶体蛋白酶legumian等活化减少。如图1所示,乳腺癌细胞系mda-mb-231,用100nm ba1抑制质子泵v-atpase过夜或dmso对照处理过夜(n=2)。收集细胞,免疫印迹分析细胞中溶酶体蛋白酶legumian,cathepsin d活化及lc3-ii蛋白积累情况。结果表明,以抑制剂完全抑制质子泵v-atpase功能,导致细胞溶酶体ph升高,从而造成蛋白酶包括legumian,cathepsin d活化减少,自噬相关蛋白lc3-ii大量积累。#1和#2是两次生物学重复。
90.(2)药物化疗、热疗或联合治疗会特异性减少legumain活化(图2)。如图2a所示,mda-mb-231细胞,用不同剂量顺铂(cddp)处理过夜(n=2)。收集细胞,免疫印迹分析细胞中legumain活化情况。结果显示,legumain活化减少与药物剂量负相关。如图2b所示,mda-mb-231细胞用不同温度热疗(微波,39-43℃)1小时。3小时后,收集细胞,免疫印迹分析细胞中legumain,cathepisn d,cathepsin b活化及lc3-ii积累情况。结果显示,legumain活化减少与热疗温度负相关。如图2c所示,mda-mb-231细胞,用cddp化疗(10μg/ml)过夜,热疗(水浴)1小时或联合治疗(n=2)。3小时后,收集细胞,免疫印迹分析细胞中legumain活化及lc3-ii积累情况。结果显示,热化疗联合治疗(水浴,43℃)会减少legumain活化。如图2d,mda-mb-231细胞,用cddp化疗(10μg/ml)过夜,热疗(微波)1小时或联合治疗(n=2)。收集细胞,免疫印迹分析细胞中legumain,cathepisn d,cathepsin b活化及lc3-ii积累情况。结果显示,热化疗联合治疗(微波,38-43℃)会减少legumain活化。
91.(3)热疗改变质子泵v-atpase组装从而导致溶酶体ph升高(图3)。如图3a,mda-mb-231细胞,43℃热疗1小时。3小时后,收集细胞,分离细胞组分为膜质(me)与胞质(ce)。免疫
印迹分析v-atpase亚基v0a1与v1c1的表达及在me与ce中的分配情况。lc3对为上样对照。n=2。结果表明,热疗改变质子泵v-atpase组装。如图3b,mda-mb-231细胞,43℃热疗1小时。3小时后,用1μmlysosensor标记细胞。通过细胞中lysosensor在350nm及540nm处发射光的比值,定量测定细胞中溶酶体的ph值。**,p《0.01,t-test.n=3。结果表明,热疗导致细胞中溶酶体ph升高。热疗改变了溶酶体膜上v-atpase组装,造成溶酶体ph值升高(约0.5ph单位)。热疗造成的溶酶体ph升高要弱于抑制剂抑制v-atpase造成的溶酶体ph升高。
92.(4)免疫荧光可检测热化疗对legumain活化的影响。如图4a,mda-mb-231细胞,43℃水浴热疗1小时。3小时后,固定细胞,抗-legumain(r&d,#)免疫荧光染色,激光共聚焦显微镜观察结果。结果表明,热疗减少legumain活化可通过抗-legumain免疫荧光检测。如图4b,可定量分析热疗组与对照组细胞中抗-legumain免疫荧光染色后平均荧光强度(n=50个细胞)。***,p《0.001,t-test。如图4c,mda-mb-231细胞,42℃或43℃水浴热疗1小时。免疫荧光染色及激光共聚焦显微镜观察如图4a。免疫荧光结果表明,热疗温度与legumain减少(活化)正相关。如图4d,mda-mb-231细胞,43℃水浴热疗1小时或2小时。免疫荧光染色及激光共聚焦显微镜观察如图4a。免疫荧光结果表明,热疗时间与legumain减少(活化)正相关。如图4e,mda-mb-231细胞,cddp化疗(10μg/ml)过夜,43℃水浴热疗1小时。免疫荧光染色及激光共聚焦显微镜观察如图4a。免疫荧光结果表明,热化疗联合治疗减少legumain(活化)。
93.(5)细胞凋亡蛋白caspase-3活化与legumain活化负相关。如图5所示,mda-mb-231细胞,用cddp化疗(10μg/ml)过夜,同时加入10μm caspase-3抑制剂qvd或dmso对照。热疗(微波)1小时或联合治疗(n=2)。3小时后,收集细胞,免疫印迹分析细胞中legumain,caspase-3及caspase-8蛋白表达及活化。结果表明,细胞凋亡蛋白caspase-3活化与legumain活化负相关。
94.实施例2
95.2.1、试验目的
96.考察legumain作为热化疗患者ph血清生物标志物的应用。
97.2.2、试验方法
98.(1)elisa测定血清legumain
99.肿瘤患者签署知情同意书后,采5ml外周血。健康自愿者,采采5ml外周血。分离血清。通过夹心elisa法测定legumain。
100.(2)统计分析
101.肿瘤患者与健康自愿者血清中legumain水平差异通过anova统计分析。p《0.05为有显著差异。
102.2.3试验结论
103.检测癌症患者血清中legumain,收集结肠癌患者血清(n=10例)及胃癌患者血清(n=10例),以及正常自愿者血清(n=5例)。通过elisa检测血清中legumain水平,并通过anova统计分析,如图6所示,发现患者血清与正常自愿者血清中legumain水平具有显著差异,p=0.0283。
104.检测结肠癌患者热化疗后血液中legumain含量。热化疗的具体方法是:通过微波热疗仪(915mhz)对准病人肿瘤部位或全身加热一小时,期间通过测量肛温控制热疗功率。结肠癌患者(n=2)在热疗前后血清中legumain含量变化通过elisa测定。结果表明,热化疗
后血液中legumain含量降低。结果如图7所示。结肠癌患者(n=2)在热疗前后血清中legumain含量变化通过elisa测定。结果表明,热化疗后血液中legumain含量降低。
105.综上所述,热化疗造成组织细胞溶酶体ph升高,减少legumain活化。legumain活化又与细胞凋亡蛋白caspase-3活化互相关。legumain活化减少可通过组织/细胞免疫染色、血清elisa检测legumain。
106.因此,legumain不仅是组织ph变化血清标志物,还是治疗(化疗、热疗、热化疗)后细胞凋亡的间接指标。
107.以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
