导致进行性家族性肝内胆汁淤积症ⅰ型的atp8b1基因突变体、蛋白和应用
技术领域
1.本发明属于生物医药技术领域,具体涉及导致进行性家族性肝内胆汁淤积症ⅰ型的atp8b1基 因突变体、蛋白和应用。
背景技术:
2.进行性家族性肝内胆汁淤积症(progressive familial intrahepatic cholestasis,pfic)是一种常染 色体隐性遗传性疾病。因基因突变导致胆汁排泌障碍,发生肝内胆汁淤积,最终可发展为肝衰竭。 根据其致病基因不同,该疾病分为3型,包括pfic
‑ⅰ
型、pfic
‑ⅱ
型和pfic
‑ⅲ
型。
3.pfic
‑ⅰ
型又称byler氏病,由atp8b1基因突变引起,atp8b1位于常染色体18q21.31,基因 全长15.7kb,包含28个外显子和27个内含子,编码1146个氨基酸,组成p型atp酶-fic1蛋白。 fic1蛋白位于肝细胞胆小管膜和胆管细胞顶端膜等处;作为一种氨基磷脂易位酶,fic1蛋白负责 把磷脂酰丝氨酸从生物膜外层转移到内层,从而维持膜两侧脂质分布的不对称性,维持毛细胆管膜 双分子层内膜高浓度的氨基磷脂,其功能异常可间接干扰胆管胆汁酸分泌。
4.黄疸和皮肤瘙痒是pfic典型的临床表现,通常在1岁之前发病,平均发病年龄是3月龄。其 他有身材矮小、青春期发育落后等发育迟缓表现,胆囊结石,脂肪吸收障碍所致的脂肪泻,肝脾肿 大以及脂溶性维生素缺乏所致佝偻病、骨龄延迟、干眼症、凝血障碍和神经肌肉病变等症状。患儿 亦可以出现视觉及听力异常,出现烦躁、嗜睡及注意力不集中等改变。晚期可出现门静脉高压症和 肝脏肿瘤等。三种pfic临床表现各有其特点,水样腹泻是pfic
‑ⅰ
型常见肝外表现,此外有胰腺 炎和听力减退等表现。
5.基因突变是导致进行性家族性肝内胆汁淤积症ⅰ型发生发展的重要遗传基础,atp8b1基因突 变呈世界性分布,不同种族、甚至不同患者之间其突变类型也不相同,目前已报道的突变类型超过 几十种。在我国低谷氨酰转肽酶进行性胆汁淤积患者中也已检测到atp8b1基因突变,突变类型大 多与西方人群不同,其中p209t/ivs6 5g》t连锁突变是我国pfic-1患者中的热点突变类型。
6.因基因诊断是确诊进行性家族性肝内胆汁淤积症ⅰ型的金标准,临床上需要针对不同突变建立 相应的检测技术并用于明确病因和疾病诊断。
技术实现要素:
7.本发明的目的在于提供导致进行性家族性肝内胆汁淤积症ⅰ型的atp8b1基因突变体、蛋白和 应用。本发明发现了新的atp8b1基因突变体,可作为进行性家族性肝内胆汁淤积症ⅰ型的筛查的 候选筛查位点,制备分子遗传学及诊断试剂盒。
8.本发明提供了一种atp8b1基因突变体,所述atp8b1基因突变体为复合杂合突变,所述复合 杂合突变包括c.2113g》a和exon24-28del。
9.本发明还提供了上述技术方案所述的atp8b1基因突变体编码的蛋白,所述蛋白上包括 p.a705t的突变。
10.本发明还提供了用于检测上述技术方案所述的atp8b1基因突变体或蛋白的试剂在下述ⅰ~
ⅲꢀ
至少一种中的应用;
[0011]ⅰ:制备进行性家族性肝内胆汁淤积症ⅰ型分子遗传学检测试剂盒;
[0012]ⅱ:制备进行性家族性肝内胆汁淤积症ⅰ型产前诊断试剂盒;
[0013]ⅲ:制备辅助防治进行性家族性肝内胆汁淤积症ⅰ型的试剂盒。
[0014]
本发明还提供了一种用于检测上述技术方案所述的atp8b1基因突变体或蛋白的试剂,所述试 剂包括抗体、探针、引物对和质谱检测试剂中的至少一种。
[0015]
本发明还提供了一种用于检测上述技术方案所述的atp8b1基因突变体的引物组,所述引物组 包括检测c.2113g》a的引物对a和检测exon24-28del的引物对b~f;
[0016]
所述引物组a的上游引物atp8b1-19f的核苷酸序列如seq id no.1所示,下游引物 atp8b1-19r的核苷酸序列如seq id no.2所示;
[0017]
所述引物组b的上游引物atp8b1-24f的核苷酸序列如seq id no.33所示,下游引物 atp8b1-24r的核苷酸序列如seq id no.34所示;
[0018]
所述引物组c的上游引物atp8b1-25f的核苷酸序列如seq id no.53所示,下游引物 atp8b1-25r的核苷酸序列如seq id no.54所示;
[0019]
所述引物组d的上游引物atp8b1-26f的核苷酸序列如seq id no.73所示,下游引物 atp8b1-26r的核苷酸序列如seq id no.74所示;
[0020]
所述引物组e的上游引物atp8b1-27f的核苷酸序列如seq id no.93所示,下游引物 atp8b1-27r的核苷酸序列如seq id no.94所示;
[0021]
所述引物组f的上游引物atp8b1-28f的核苷酸序列如seq id no.113所示,下游引物 atp8b1-28r的核苷酸序列如seq id no.114所示。
[0022]
本发明还提供了一种用于检测进行性家族性肝内胆汁淤积症ⅰ型的试剂盒,包括上述技术方案 所述的试剂或引物组。
[0023]
优选的,所述试剂盒包括分子遗传学诊断试剂盒、产前基因诊断试剂盒或辅助防治家族性高胆 固醇血症试剂盒。
[0024]
优选的,所述试剂盒中还包括测序引物和pcr扩增所需要的试剂。
[0025]
优选的,所述pcr扩增所需要的试剂包括dntp,pcr缓冲液,镁离子和tap聚合酶中的一种 或多种。
[0026]
本发明还提供了上述技术方案所述的试剂、引物组或试剂盒在下述ⅰ~ⅲ至少一种中的应用;
[0027]ⅰ:制备进行性家族性肝内胆汁淤积症ⅰ型分子遗传学检测试剂盒;
[0028]ⅱ:制备进行性家族性肝内胆汁淤积症ⅰ型产前诊断试剂盒;
[0029]ⅲ:制备辅助防治进行性家族性肝内胆汁淤积症ⅰ型的试剂盒。
[0030]
有益效果:
[0031]
本发明提供了一种atp8b1基因突变体,所述atp8b1基因突变体包括复合杂合突变,所述复 合杂合突变包括c.2113g》a和exon24-28del。上述复合杂合突变为尚未公开的突变位点,与进行性 家族性肝内胆汁淤积症ⅰ型具有密切关系,可作为进行性家族性肝内
胆汁淤积症ⅰ型筛查的候选位 点,进而将其应用到制备进行性家族性肝内胆汁淤积症ⅰ型诊断或筛查试剂盒中,快速有效地预测 或诊断进行性家族性肝内胆汁淤积症ⅰ型,为进行性家族性肝内胆汁淤积症ⅰ型患者的治疗提供全 新的理论依据。
附图说明
[0032]
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附 图作简单地介绍。
[0033]
图1为进行性家族性肝内胆汁淤积症ⅰ型家系遗传图谱,其中,表示男性携带者,表示女 性携带者,
●
表示女性患者,
◇
表示胎儿,
↗
表示先证者;
[0034]
图2为显示利用sanger测序检测atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点基因 型的结果图,其中,a:家系中正常个体;b、c和d:家系中c.2113g》a杂合子突变(测序图中 箭头所指为突变发生位置);
[0035]
图3为利用定量pcr检测atp8b1:nm_005603.4:exon24-28del位点基因型的结果图,其中, 家系中父亲和女儿的24号和28号外显子拷贝数判定为“1”,缺失了1个拷贝,即为杂合子突变; 家系中母亲和胎儿的24号和28号外显子拷贝数判定为“2”,基因位点拷贝没有缺失,即为正常 个体;
[0036]
图4为利用定量pcr检测atp8b1:nm_005603.4:exon24-28del位点基因型的结果图,其中, 家系中父亲和女儿的25号、26号和27号外显子拷贝数判定为“1”,缺失了1个拷贝,即为杂合 子;家系中母亲和胎儿的25号、26号和27号外显子拷贝数判定为“2”,基因位点拷贝没有缺失, 即为正常个体;
[0037]
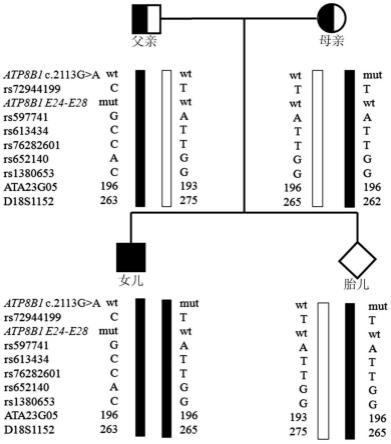
图5为str单体型分析结果,利用毛细管电泳或测序技术检测 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t和exon24-28del位点附近8个str(rs72944199、 rs597741、rs613434、rs76282601、rs652140、rs1380653、ata23g05、d18s1152),其中父亲携带 atp8b1:nm_005603.4:exon24-28del位点突变杂合子与单体型“c/g/c/c/a/c/196/263”连锁,母亲 携带atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点突变杂合子与单体型是
ꢀ“
t/a/t/t/g/g/196/262”连锁,女儿同时遗传了父亲和母亲携带突变的单体型,胎儿则只遗传了母 亲携带突变的单体型;
[0038]
图6为rs72944199检测结果,其中,父亲的基因型是“c/t”,母亲的基因型是“t/t”,女 儿的基因型是“c/t”,胎儿的基因型是“t/t”;
[0039]
图7为rs597741检测结果,其中,父亲的基因型是“g/a”,母亲的基因型是“a/a”,女儿 的基因型是“g/a”,胎儿的基因型是“a/a”;
[0040]
图8为rs613434检测结果,其中,父亲的基因型是“t/c”,母亲的基因型是“t/t”,女儿 的基因型是“t/c”,胎儿的基因型是“t/t”;
[0041]
图9为rs76282601检测结果,其中,父亲的基因型是“c/t”,母亲的基因型是“t/t”,女 儿的基因型是“c/t”,胎儿的基因型是“t/t”;
[0042]
图10为rs652140检测结果,其中,父亲的基因型是“g/a”,母亲的基因型是“g/g”,女儿 的基因型是“g/a”,胎儿的基因型是“g/g”;
[0043]
图11为rs1380653检测结果,其中,父亲的基因型是“g/c”,母亲的基因型是“g/g”,女 儿的基因型是“g/c”,胎儿的基因型是“g/g”;
[0044]
图12为ata23g05检测结果,其中,父亲的基因型是“193/196”,母亲的基因型是“196/196”, 女儿的基因型是“196/196”,胎儿的基因型是“193/196”;
[0045]
图13为d18s1152检测结果,其中,父亲的基因型是“263/275”,母亲的基因型是“262/265”, 女儿的基因型是“263/265”,胎儿的基因型是“265/275”;
[0046]
图14显示进行性家族性肝内胆汁淤积症ⅰ型家系遗传图谱,其中,表示男性携带者,表 示女性携带者,
■
表示男性患者,
◇
表示胎儿,
↗
表示先证者;
[0047]
图15为利用试剂盒检测atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点基因型的结果 图,其中,b:家系中正常个体;a和c:家系中c.2113g》a杂合突变(测序图中箭头所指为突变 发生位置);
[0048]
图16为利用试剂盒检测atp8b1:nm_005603.4:exon24-28del位点基因型的结果图,其中,家 系中先证者母亲的24号-28号外显子拷贝数判定为“1”,缺失了1个拷贝,即为杂合突变;家系 中父亲和胎儿的24号-28号外显子拷贝数判定为“2”,基因位点拷贝没有缺失,即为野生型。
具体实施方式
[0049]
本发明提供了一种atp8b1基因突变体,所述atp8b1基因突变体为复合杂合突变,所述复合 杂合突变包括c.2113g》a和exon24-28del。
[0050]
本发明针对自行收集的一例家族性肝内胆汁淤积症ⅰ型家系(包括先证者、先证者父母和未出 生的弟弟或妹妹)通过全外显子测序、家系分析联合sanger测序和定量pcr的验证的方法对上述 家系进行致病变异检测和验证。在atp8b1基因上确定了1个新的复合杂合突变,即位于第19号 外显子上第2113位核苷酸上的c.2113g》a和位于第24~28号外显子上的缺失突变。本发明首次发 现了atp8b1基因上的包括c.2113g》a突变和exon24-28del突变的复合杂合突变,并确认了此复合 杂合突变与家族性肝内胆汁淤积症ⅰ型的密切联系,可用于家族性肝内胆汁淤积症ⅰ型的分子遗传 学研究,家族性肝内胆汁淤积症ⅰ型相关疾病的诊断,可有效区分家族性肝内胆汁淤积症ⅰ型患者、 携带者和正常人群,此复合杂合突变可以作为诊断进行性家族性肝内胆汁淤积症ⅰ型的生物标志物 或药物靶点。
[0051]
本发明所述野生型atp8b1基因的cdna序列参见genbank登录号为nm_005603.4,本发明 所述c.2113g》a突变指野生型atp8b1基因的第19号外显子的第2113位核苷酸由g突变为a, 来源于父源18号染色体;所述exon24-28del突变指野生型atp8b1基因的第24~28号外显子缺失, 来源于母源18号染色体;二者形成本发明中的atp8b1基因突变体。
[0052]
本发明还提供了上述技术方案所述的atp8b1基因突变体编码的蛋白,所述蛋白上包括 p.a705t的突变。本发明所述蛋白是野生型atp8b1基因cdna编码的蛋白第705位丙氨酸突变为 苏氨酸,即所述蛋白具有p.a705t的突变,所述突变是由于c.2113g》a错义突变而引起的。
[0053]
本发明还提供了用于检测上述技术方案所述的atp8b1基因突变体或蛋白的试剂的应用:制备 进行性家族性肝内胆汁淤积症ⅰ型分子遗传学检测试剂盒;制备进行性家族性肝内胆汁淤积症ⅰ型 产前诊断试剂盒或制备辅助防治进行性家族性肝内胆汁淤积症ⅰ型的试剂盒。
[0054]
本发明还提供了一种用于检测上述技术方案所述的atp8b1基因突变体或蛋白的
试剂,所述试 剂包括抗体、探针、引物组和质谱检测试剂中的至少一种,更优选为引物组。
[0055]
本发明还提供了一种用于检测上述技术方案所述的atp8b1基因突变体的引物组,所述引物组 包括检测c.2113g》a的引物对a和检测exon24-28del的引物对b~f;所述引物组a的上游引物 atp8b1-19f的核苷酸序列如seq id no.1所示,下游引物atp8b1-19r的核苷酸序列如seq idno.2所示;所述引物组b的上游引物atp8b1-24f的核苷酸序列如seq id no.33所示,下游引物 atp8b1-24r的核苷酸序列如seq id no.34所示;所述引物组c的上游引物atp8b1-25f的核苷 酸序列如seq id no.53所示,下游引物atp8b1-25r的核苷酸序列如seq id no.54所示;所述引 物组d的上游引物atp8b1-26f的核苷酸序列如seq id no.73所示,下游引物atp8b1-26r的核 苷酸序列如seq id no.74所示;所述引物组e的上游引物atp8b1-27f的核苷酸序列如seq idno.93所示,下游引物atp8b1-27r的核苷酸序列如seq id no.94所示;所述引物组f的上游引 物atp8b1-28f的核苷酸序列如seq id no.113所示,下游引物atp8b1-28r的核苷酸序列如seqid no.114所示。
[0056]
本发明还提供了一种用于检测进行性家族性肝内胆汁淤积症ⅰ型的试剂盒,包括上述技术方案 所述的试剂或引物组。本发明所述试剂盒优选包括分子遗传学诊断试剂盒、产前基因诊断试剂盒或 辅助防治家族性高胆固醇血症试剂盒。本发明所述试剂盒中优选还包括测序引物和pcr扩增所需 要的试剂。本发明所述pcr扩增所需要的试剂优选包括但不限于dntp,pcr缓冲液,镁离子和 tap聚合酶。本发明在具体实施过程中,可根据实际需要,常规选择其他试剂。本发明对所述pcr 扩增所需要的试剂没有特殊限定,采用本领域中常规pcr扩增试剂即可。本发明所述测序引物优 选为巢式引物,所述巢式引物优选包括两组引物,第一组引物优选为扩增引物,所述扩增引物优选 与上述atp8b1基因突变体的引物组保持一致;第二组引物优选为依据第一组引物的扩增产物进行 设计得到的引物。
[0057]
本发明还提供了上述技术方案所述的试剂、引物组或试剂盒在下述ⅰ~ⅲ至少一种中的应用;
ꢀⅰ
:制备进行性家族性肝内胆汁淤积症ⅰ型分子遗传学检测试剂盒;ⅱ:制备进行性家族性肝内胆 汁淤积症ⅰ型产前诊断试剂盒;ⅲ:制备辅助防治进行性家族性肝内胆汁淤积症ⅰ型的试剂盒。
[0058]
本发明还提供了一种诊断进行性家族性肝内胆汁淤积症ⅰ型的方法,包括检测 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点的基因型和exon24-28del位点的拷贝数,如 果atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点的基因型和exon24-28del位点的拷贝数是
ꢀ“
g/a”和“1”,则判断存在复合杂合突变,则诊断受试个体为进行性家族性肝内胆汁淤积症ⅰ型 患者;如果atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点的基因型和exon24-28del位点的 拷贝数是“g/a”和“2”,则判断存在单个杂合突变,则诊断受试个体为携带者;如果 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点的基因型和exon24-28del位点的拷贝数是
ꢀ“
g/g”和“1”,同样判断存在单个杂合突变,并诊断受试个体为携带者;如果 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点的基因型和exon24-28del位点的拷贝数是
ꢀ“
g/g”和“2”,则判断为野生型,则诊断受试个体为正常。本发明对所述基因型和拷贝数的测定 方法没有特殊限定,采用本领域中常规测定方法即可。
[0059]
为了进一步说明本发明,下面结合附图和实施例对本发明提供的技术方案进行详细地描述,但 不能将它们理解为对本发明保护范围的限定。
[0060]
在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术
人员所通常理 解的含义。并且,本文中所用的分子遗传学、核酸化学和分子生物学相关术语和实验室操作步骤均 为相应领域内的广泛使用的术语和常规步骤。同时,为了更好地理解本发明,下面提供相关术语的 定义和解释。
[0061]
文中术语“诊断”包括疾病风险的预测、疾病发病与否的诊断、还包括对疾病预后的评估。
[0062]
文中术语“突变”是指野生型的多核苷酸序列发生改变,成为变异体,变异体可以是天然发生 的或非天然发生的。
[0063]
文中术语“产前诊断”是指是在遗传咨询的基础上,主要通过遗传学检测和影像学检查,对高 风险胎儿进行明确诊断,通过对患胎的选择性流产达到胎儿选择的目的,从而降低出生缺陷率,提 高优生质量和人口素质。
[0064]
在本发明中,“引物”指用于在pcr反应中扩增靶标核酸的多核苷酸片段,其通常为寡核苷 酸,例如含有至少5个碱基,例如5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、 20、21、22、23、24、25个或者更多个碱基的多核苷酸片段。引物不必与待扩增的目的基因或其互 补链完全互补,只要其能够特异性扩增目的基因。如本文中所使用的,
[0065]
术语“特异性扩增”是指引物能够通过pcr反应扩增目的基因,而不扩增其他基因。例如, 特异性扩增atp8b1基因是指,在pcr反应中引物只扩增atp8b1基因,而不扩增其他基因。
[0066]
实施例1样本获取
[0067]
发明人发现了一个进行性家族性肝内胆汁淤积症ⅰ型家系(简称1号家系),该1号家系部分 成员的临床信息见表1。图1显示了atp8b1基因突变1号家系图谱,其中,表示男性携带者, 表示女性携带者,
●
表示女性患者,
◇
表示胎儿,
↗
表示先证者。
[0068]
1.诊断标准:
[0069]
可参照《罕见病诊疗指南》2019年版:
[0070]
主要表现:进行性加重的黄疸;胆汁淤积所致的高直接胆红素血症具有反复发作性。突出的、 特征性的瘙痒因为胆盐在体内的蓄积所致,与黄疸的程度相一致,可以不严重也可随着黄疸程度改 变消长。瘙痒可以使患儿非常痛苦,而且对治疗反应不佳。喂养困难,脂肪吸收障碍所致的脂肪泻, 体重增长和发育缓慢,95%以上患儿身材矮小。粪便恶臭而色淡。
[0071]
继发表现:包括脂溶性维生素缺乏症:维生素d和钙离子吸收受损造成的佝偻病,骨龄延迟; 脂溶性维生素a吸收障碍导致的干眼症及其他视觉问题;维生素k吸收障碍所致的凝血酶原时间 延长;维生素e吸收障碍所致的神经肌肉病变,此外亦可并发肝肿瘤,胰腺功能不全,胆囊结石, 肝纤维化门脉高压症(包括腹水,静脉曲张破裂出血),心血管疾病等。大多数患者有肝大,如果 有明显脾大时,说明进展的肝纤维化或肝硬化;约1/3患者合并有胆结石;部分患者有长期哮喘样 疾病;反复流鼻血而不伴血小板减少和凝血性疾病,其原因可能是由于循环中的高浓度胆盐所致。 此病患者不伴有黄色瘤。
[0072]
体征:(1)巩膜、皮肤黄染;(2)皮肤抓伤;(3)肝大、脾大;(4)身高体重增长缓慢; (5)鼻衄、牙龈出血或皮肤黏膜的出血点、甚或危及生命的大出血;(6)步态不稳;(7)视觉 听力异常;(8)精神状态改变:烦躁、嗜睡、注意力不集中;(9)青春期延迟性发育落后。
[0073]
实验室检查:(1)血清胆红素水平上升,直接或结合胆红素水平上升。(2)血清总胆
汁酸的 浓度上升10~20倍。(3)胆汁中胆酸浓度下降,特别是脱氧胆酸浓度降低。(4)用分光镜对血清 和尿的胆汁酸定性分析被用来排除先天性胆汁酸合成障碍。(5)血清总胆固醇水平在一个正常范 围之内,高密度脂蛋白水平正常或者是稍低。(6)血清碱性磷酸酶水平有所上升。(7)血清5
‑ꢀ
核苷酸酶的水平升高。(8)在低γ-ggt型pfic中血清γ-ggt水平在正常范围内或者相对低一些; 当受到微粒体诱导剂的影响时患者的γ-ggt水平也许会高于100iu/l。而在高γ-ggt型pfic中ggt 一般会升高3~10倍。(9)尿胆红素阳性,尿胆原阴性。(10)粪便中脂肪含量有所上升。
[0074]
影像学研究:对于pfic的诊断尚缺乏特异性的影像学检查手段。b超、ct等判断有无肝内外 胆管扩张,核素扫描可以查看有多少胆汁从肝内排出。
[0075]
表1进行性家族性肝内胆汁淤积症ⅰ型1号家系成员的临床信息
[0076][0077]
先证者(女儿)腹部彩超示肝回声增粗,胆囊稍小,肝脏硬度值:12.2kpa,甲胎蛋白12.22ng/ml, 肝功能示:总胆固醇5.7μmol/l,甘油三酯3.67mmol/l,肌酐41μmol/l,ggt 35u/l,碱性磷酸 酶657u/l,总胆汁酸434.5μmol/l,总胆红素229.6μmol/l,直接胆红素192.2μmol/l。
[0078]
如图1所示,编号采用ⅰ(第一代)、ⅱ(第二代)。
[0079]
家系人员ⅰ1、ⅰ2、ⅱ1外周血dna用于检测,ⅱ2羊水dna用于检测。
[0080]
实施例2外显子测序
[0081]
1、仪器设备如表2所示。
[0082]
表2仪器设备一览表
[0083][0084][0085]
2、试剂耗材
[0086]
人类全外显子测序试剂盒(agilent)、dna 1000试剂盒(agilent)、96孔板(axygen)、不 同型号枪头(axygen)、200μl离心管(eppendorf)、1.5ml离心管(eppendorf)、毛细管电泳 缓冲液(thermo)、测序标准物(thermo)、无水乙醇(thermo)、bigdye ter分钟ator v3.1 (thermo)、外周血gdna提取试剂盒(tiangen)、琼脂糖(tiangen)、eb染液(amresco)。
[0087]
3、试剂配方
[0088]5×
tbe电泳液贮存液按照表3配制。
[0089]
表3 5
×
tbe电泳液配方
[0090]
试剂体积/重量tris5.4g硼酸750mgedta(ph 8.0,0.5mol/l)2mlddh2o90ml
[0091]
用ddh2o将最终体积调整为100ml。0.5
×
tbe电泳液工作液,用ddh2o稀释10倍即可。
[0092]
10
×
红细胞裂解液按照表4配制。
[0093]
表4 10
×
红细胞裂解液配方
[0094]
试剂体积/重量
nh4cl82.9gkhco310.0gedta0.37g加dh2o至1000ml
[0095]
高压灭菌,4℃保存。
[0096]1×
细胞核裂解液按照表5配制。
[0097]
表5 1
×
细胞核裂解液配方
[0098]
试剂体积/重量2m tris-hcl,ph8.20.5ml4m nacl10.0ml2mm edta0.4ml
[0099]
4.实验步骤
[0100]
签署知情同意书后,采集家系中ⅰ1、ⅰ2、ⅱ1成员的外周血3~5ml以及ⅱ2成员羊水5~10ml 作为研究样品。
[0101]
4.1样本dna提取
[0102]
1)如为肝素抗凝外周血样本,则将外周血3-5ml装入15ml离心管中,加2-3倍体积的1
×
红 细胞裂解液,混匀,冰上静置30分钟,直至溶液变透明。如为羊水样本则直接进入下一步。
[0103]
2)4℃,3000转/分离心10分钟,小心去上清液。沉淀中加1ml 1
×
细胞核裂解液,混匀,再 加2ml 1
×
细胞核裂解液和150μl 20%sds,摇匀,至出现粘稠透明状。加10μl 20mg/ml蛋白酶k, 摇匀。37℃消化6小时以上或过夜。
[0104]
3)加等体积饱和酚,轻摇混匀,室温3000转/分离心10分钟。
[0105]
4)小心移上清至另一离心管,加等体积酚/氯仿(1:1v/v)混匀,室温3000转/分离心10分钟。
[0106]
5)小心移上清,若上清不清亮透明,则用等体积氯仿再抽提一次。
[0107]
6)将上清移入另一离心管中,加二倍体积无水乙醇,摇匀,见白色絮状dna。用火焰灭菌的 玻璃钩针将dna钩出,70%乙醇洗二次,室温干燥5分钟,再将dna溶于200μl 1
×
te中,转鼓 溶解过夜。紫外测od值。
[0108]
7)te溶解的dna,在4℃下可保存一年,如要求长期保存,则需加2倍体积无水乙醇置-70℃ 保存。
[0109]
4.2外显子测序
[0110]
1)取2μg dna,机械打断,使片段大小在200bp左右,切胶回收150-250bp片段;
[0111]
2)dna片段做末端修复和3’末端加a;
[0112]
3)连接测序接头,对连接产物进行纯化,再行pcr扩增,扩增产物纯化;
[0113]
4)agilent试剂盒探针加入纯化后的扩增产物进行杂交捕获,杂交产物经洗脱回收后做pcr扩 增,再行最终产物回收,取小样行琼脂糖凝胶电泳进行质控分析;
[0114]
5)nextseq500测序仪测序和数据分析。
[0115]
4.3结果
[0116]
最终得到具有致病意义的基因复合杂合突变atp8b1:nm_005603.4:exon19:
c.2113g》a:p.a705t 和exon24-28del;其中exon19:c.2113g》a的突变可能导致所编码的蛋白质第705位氨基酸残基由丙 氨酸变为苏氨酸,exon24-28del的突变可导致所编码的蛋白质功能异常。在家系患者个体中 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t和exon24-28del位点的基因型是“c.2113g》a”
ꢀ“
exon24-28del”复合杂合突变,在atp8b1家系携带者个体中两位点的基因型是“a/t; exon24-28/exon24-28”或“a/a;exon24-28del/exon24-28”单个杂合突变,在atp8b1家系正常个 体中两位点的基因型是“g/g;exon24-28/exon24-28”。
[0117]
实施例3sanger测序验证
[0118]
对于外显子组测序结果进一步利用sanger测序法,对 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点进行验证。分别对实施例1中的4名家系人 员和100名家系外正常人进行atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点基因型检测。
[0119]
具体方法步骤如下:
[0120]
1、dna提取
[0121]
按照实施例2的方法提基因组dna。
[0122]
2、候选引物设计、验证及优选
[0123]
2.1候选引物设计参考人类基因组序列数据库hg19/build36.3,引物序列由上海生工生物技术公 司合成。
[0124]
2.2针对c.2113g》a位点分别设计15对候选引物(见表6),并利用pcr实验来验证和评价 各对候选引物的优劣情况。
[0125]
表6 c.2113g》a位点候选引物基本情况和验证实验结果一览表
[0126]
[0127][0128]
注:正常pcr扩增结果电泳后只有一条特异性条带,若出现引物二聚体条带、非特异产物条 带均是引物异常反应的结果;目标引物尽可能避免这类情况,并避免发夹结构、二聚体等异常情况。
[0129]
2.3候选引物pcr验证反应
[0130]
按照表7中的反应体系进行pcr并保持反应体系在冰上;每对引物设置8个反应测试管(表7 中序号1至8)。
[0131]
表7引物检测pcr反应体系
[0132]
[0133][0134]
反应条件:将上述测试反应管放入pcr仪,执行以下反应程序:
[0135]
第一步:95℃预变性5分钟;
[0136]
第二步:30个循环(95℃变性30秒
→
tm退火30秒
→
72℃延伸60秒);(根据表6-1和6-2 中各引物tm值设置pcr扩增参数,如为双引物则取tm平均值)。
[0137]
第三步:72℃延伸7分钟;
[0138]
第四步:4℃直至取样时。
[0139]
2.4候选引物pcr结果进行琼脂糖凝胶电泳检测,以评估引物反应的有效性、特异性:
[0140]
1)用胶带将洗净干燥的凝胶成样器两端封好,置于一水平台面上,在成样器的一端约1cm处 放置梳子。
[0141]
2)称量2g琼脂粉末于一锥形瓶中,加入100ml 0.5
×
tbe电泳缓冲液,摇匀后置微波炉或电 炉上(加石棉网)加热,沸腾后取出摇匀,再加热,直至凝胶完全熔解,取出室温冷却。
[0142]
3)待凝胶冷却至50℃左右,倒入封好的凝胶成样器,使厚度在5mm左右。
[0143]
4)凝胶凝固拆除胶带,将凝胶与成样器一起放入电泳槽中。
[0144]
5)加入电泳缓冲液,使液面高于胶面1-2mm,向上拔出梳子;用微量移液器将样品和dna 大小标准品分别与载样液混匀后,加入各加样孔内,由于载样液中蔗糖比重较大,dna沉入孔底。
[0145]
6)盖上电泳槽,接通电源,调至适当电压,开始电泳。根据载样液中溴酚蓝的指示,判断样 品的大概位置,决定是否终止电泳。
[0146]
7)切断电源,取出凝胶,放入0.5g/ml的eb水溶液中染色10-15分钟。
[0147]
8)将凝胶放到透射式紫外照射仪下观察结果,波长254nm,并用加红色滤色片的相机照相或 用凝胶扫描系统记录电泳结果。
[0148]
2.5结果评价:
[0149]
1)如果7号管仅出现一条明亮清晰目的条带,无其它条带,则判断该对引物和发应体系有效 性好和特异性强;
[0150]
2)如果7号管没有出现目的条带,则判断该对引物和反应体系无效;
[0151]
3)如果7号管出现目的条带外的引物引物二聚体带,并在2、3、4、5、6号部分管中也同样 出现引物二聚体带,则判断该对引物和反应体系有效性差;
[0152]
4)如果7号管出现目的条带外的非特异性带,并在5、6号部分管中也同样出现非特异性带, 则判断该对引物和反应体系特异性差;
[0153]
5)如果7号管出现目的条带外的引物二聚体和非特异性带,并在2、3、4、5、6号部分管中 也同样出现引物二聚体和非特异性带,则判断该对引物和反应体系有效性和特异性差。
[0154]
2.6根据表6验证测试后统计的结果,选择其中最优一对(表6中1号)作为突变家系检测用 引物,引物序列如下所示:
[0155]
针对atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点的引物序列如下所示:
[0156]
atp8b1-19f:5
’‑
tggtttacggtttatgtc-3’(seq id no.1),
[0157]
atp8b1-19r:5
’‑
tgaaaagtctgaggaggt-3’(seq id no.2)。
[0158]
3、1号家系人员和100名家系外人员突变位点pcr扩增
[0159]
按照表8中的反应体系进行pcr并保持反应体系在冰上。
[0160]
表8突变位点pcr反应体系
[0161]
试剂体积10
×
pcr缓冲液2.0μl10mmol/l dntps0.4μl100ng/μl atp8b1-19f0.5μl100ng/μlatp8b1-19r0.5μl100ng/μl抽提dna1.0μl5u/μl taq酶0.2μlddh2o15.4μl
[0162]
反应条件:将反应体系放入pcr仪,执行以下反应程序:
[0163]
第一步:95℃预变性5分钟;第二步:30个循环(95℃变性30秒
→
50℃退火30秒
→
72℃延伸 60秒);第三步:72℃,7分钟;第四步:4℃直至取样时。
[0164]
4、琼脂糖凝胶电泳检测
[0165]
参照上述2.4步骤。
[0166]
5、pcr产物酶解法纯化:5μlpcr产物中分别加入0.5μl核酸外切酶i(exo i),1μl碱性磷 酸酶(aip),37℃消化15分钟,85℃使酶失活15分钟。
[0167]
6、bigdye反应
[0168]
bigdye反应体系见表9。
[0169]
表9 bigdye反应体系
[0170][0171][0172]
测序pcr循环条件:
[0173]
第一步:96℃,1分钟;第二步:33个循环(96℃,30秒
→
55℃,15秒
→
60℃,4分钟);第 三步:4℃直至取样时。
[0174]
7、bigdye反应产物纯化:
[0175]
1)每管加入1μl 125mm edta(ph8.0),加到管底,再加入1μl 3mol/lnaac(ph5.2);
[0176]
2)加入70μl 70%酒精,震荡混匀4次,室温放置15分钟;
[0177]
3)3000g,4℃离心30分钟;马上倒置96孔板,185g离心1分钟;
[0178]
4)室温放置5分钟,让残余的酒精在室温挥发干,加入10μlhi-di甲酰胺溶解dna,96℃变 性4分钟,迅速置冰上4分钟,上机测序。
[0179]
8、测序
[0180]
将纯化后的bigdye反应产物进行dna测序,测序引物则在上述pcr优选引物的基础上设计 巢式引物(第二组引物是在第一组引物(优选引物)扩增得到的产物序列范围内设计的)作为测序 引物,针atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点的测序引物序列如下所示: 5
’‑
agcagcaaccaggatgta-3’(seq id no.31),5
’‑
ctccagtaagcacccaga-3’(seq idno.32)。
[0181]
9、结果分析
[0182]
sanger测序结果显示,家系中1名患者atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点 基因型是“g/a”;家系中1名正常个体和100个无血缘关系的正常对照的 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点基因型是“g/g”。图2测序图中箭头所指 位置显示b层、c层和d层显示家系个体atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点 基因型是“g/a”杂合突变,图2中a层显示家系中个体 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点基因型是“g/g”野生型。100个无血缘关 系的正常对照结果图与图2中的a图相似,因图片内容相似且繁多,不再重复提供。
[0183]
实施例4荧光定量pcr验证
[0184]
对于外显子组测序结果进一步利用定量pcr法,对atp8b1:nm_005603.4:exon24-28del位点进 行验证。分别对实施例1中的4名家系人员和100名家系外正常人进行 atp8b1:nm_005603.4:exon24-28del位点基因型检测。
[0185]
具体方法步骤如下:
[0186]
1、dna提取:按照实施例1的方法提基因组dna;
[0187]
2、引物设计:引物设计参考人类基因组序列数据库hg19/build36.3,引物序列由上海生工生物 技术公司合成,并完成荧光集团标记。
[0188]
2.2针对exon24、25、26、27、28、23位点分别设计10对候选引物(见表10-1~10-6),并利 用pcr实验来验证和评价各对候选引物的优劣情况。
[0189]
表10-1 exon24候选引物基本情况和验证实验结果一览表
[0190][0191]
[0192][0193]
表10-2 exon25候选引物基本情况和验证实验结果一览表
[0194]
[0195][0196]
表10-3 exon26候选引物基本情况和验证实验结果一览表
[0197]
[0198][0199]
表10-4 exon27候选引物基本情况和验证实验结果一览表
[0200]
[0201][0202]
表10-5 exon28候选引物基本情况和验证实验结果一览表
[0203]
[0204]
[0205][0206]
表10-6 exon23候选引物基本情况和验证实验结果一览表
[0207]
[0208][0209]
注:引物设计原则同实施例3,其pcr扩增产物长度为50-150bp;
[0210]
2.3候选引物pcr验证和测试参考实施例3。
[0211]
2.4根据表10-1~10-6验证测试后统计的结果,选择其中最优一对作为突变家系检测用引物,引 物序列如下所示:针对atp8b1:nm_005603.4exon24del位点的引物序列的上下游引物(atp8b1-24 f/r)分别如下seq id no.33和seq id no.34所示;针对atp8b1:nm_005603.4exon25del位点 的引物序列的上下游引物(atp8b1-25f/r)分别如下seq id no.53和seq id no.54所示;针对 atp8b1:nm_005603.4exon26del位点的上下游引物(atp8b1-26f/r)分别如下seq id no.73和seq id no.74所示;针对atp8b1:nm_005603.4exon27del位点的上下游引物(atp8b1-27f/r)分 别如下seq id no.93和seq id no.94所示;针对atp8b1:nm_005603.4exon28del位点的上下 游引物(atp8b1-28f/r)分别如下seq id no.113和seq id no.114所示;针对atp8b1:nm_00 5603.4exon23对照组(control)位点的引物序列的上下游引物(atp8b1-23f/r)如seq id no.13 3和seq id no.134所示。
[0212]
3、荧光定量pcr
[0213]
按照11中的反应体系进行pcr并保持反应体系在冰上。
[0214]
表11荧光定量pcr反应体系
[0215]
试剂体积syrb@realtime pcr master mix12.5μl100ng/μl atp8b1-24f/25f/26f/27f/28f/23f/内参引物f*0.5μl100ng/μl atp8b1-24r/25r/26r/27r/28r/23r/内参引物r*0.5μl100ng/μl抽提dna1.0μlddh2o10.5μl
[0216]
*gapdh内参引物f的序列为:5
’‑
aagaaggtggtgaagcag-3’(seq id no.153);*gapdh 内参引物r的序列为:5
’‑
gtcaaaggtggaggagtg-3’(seq id no.154)
[0217]
反应条件:将反应体系放入pcr仪,执行以下反应程序:
[0218]
对于exon24del位点、exon25del位点、exon26del位点、exon27del位点、exon28del位点和exon23 的反应程序均为:第一步:94℃,1分钟;第二步:40个循环(94℃,30秒
→
50℃,30秒
→
72℃, 30秒);第三步:72℃,5分钟;
[0219]
第四步:4℃直至取样时,每次循环,检测一次荧光信号,绘制扩增曲线。
[0220]
4、计算ct值和dna相对定量。
[0221]
基于
△△
ct法计算exon24-28的拷贝数。
[0222]
阈值循环数(threshold cycle)即ct值,荧光信号达到荧光阈值时pcr循环数。荧光pcr仪 软件通常将第3-15个循环的荧光值设为基线。阈值一般是基线的标准偏差的10倍。dna模板的 ct值与该dna模板的起始拷贝数的对数存在线性关系,起始dna模板量浓度越高,ct值越小; 起始dna模板量浓度越低,ct值越大。pcr循环在到达ct值所在的循环数时,刚刚进入真正的 指数扩增期(对数期),此时微小误差尚未放大,ct值的重现性较好,即相同含量的初始模板,得 到的ct值是相对稳定的。
[0223]
一般情况下每个循环数增加的产物的量应该是按指数增加,用数学共识来表达即是(1 e)^ct, e就是扩增系数,或者是扩增的效率。一般情况下扩增效率设为1,也就是每个循环增加一倍。即: pcr扩增产物量=起始dna模板量
×
(1 e)^ct;由于这里把e默认为1;则,pcr扩增产物量= 起始dna模板量
×
2^ct;则,起始dna模板量=pcr扩增产物量/(2^ct);即,起始dna模板 量=pcr扩增产物量
×
2^(-ct)。当pcr扩增产物量达到同一水平时对应的ct值不同,其原因在 于起始dna模板量不同;而当样本和内参基因的pcr扩增产物量相同时,如果要算出它们对应起 始模板量的比值差,就需要进行除法计算;由,待检基因dna模板量=pcr扩增产物量
×
2^(-ct 待检);内参基因dna模板量=pcr扩增产物量
×
2^(-ct内参);则,r=待检基因dna模板量/ 内参基因dna模板量=pcr扩增产物量
×
2^(-ct待检)/pcr扩增产物量
×
2^(-ct内参);则,r=2^ ((-ct待检)-(-ct内参))=2^(
‑△
ct)。对上面推导得到的所有样本组的2^(
‑△
ct),均除 以control组的2^(
‑△
ct),即可得到2^(
‑△△
ct)。本实施例需要检测exon24、25、26、27、 28的是否缺失(拷贝数),以没有缺失的exon23作为control组,以exon24、25、26、27、28为 实验组。选择gapdh基因作为内参基因,进行qpcr实验,然后根据
△△
ct计算exon24、25、26、 27、28的拷贝数。
[0224]
5、结果分析。
[0225]
荧光定量pcr结果显示,家系中患者atp8b1:nm_005603.4:exon24-28del位点拷贝数是“1”; 家系中正常个体100个无血缘关系的正常对照的atp8b1:nm_005603.4:exon24-28del位点的拷贝数 是“2”。图3显示atp8b1:nm_005603.4:exon24-28del位点基因型的结果图。其中,家系中父亲 和女儿的24号和28号外显子拷贝数判定为“1”,表明24号和28号外显子只有1个拷贝,缺失 了1个拷贝,即为杂合突变;家系中母亲和胎儿的24号和28号外显子拷贝数判定为“2”,表明 24号和28号外显子只有完整的2个拷贝,不存在缺失,即为正常个体。图4显示 atp8b1:nm_005603.4:exon24-28del位点基因型的结果图。其中,家系中父亲和女儿的25号、26 号和27号外显子拷贝数判定为“1”,表明25号、26号和27号外显子只有1个拷贝,缺失了1 个拷贝,即为杂合突变;家系中母亲和胎儿的25号、26号和27号外显子拷贝数判定为“2”,表 明25号、26号和27号外显子只有完整的2个拷贝,不存在缺失,即为正常个体。
[0226]
实施例5 str连锁分析
[0227]
基因组dna中存在一类串联重复序列,其串联重复单位(核心序列)数目在人群中存在较大 差异,具有高度多态性,称为可变串联重复序列(vn-tr)。其中重复单位长度为2bp~6bp的重复 序列称为微卫星序列,也叫短串联重复序列(short tandem repeat,str)。绝大多数str位于非编 码区,极少数在编码区域。基因组中str约有一半具有遗传多态性,为亲子鉴定提供了高信息基 因座的丰富来源。
[0228]
连锁分析原理:不同个体中,str核心序列的重复次数不同。根据子代的两条dna一条来自 父方,一条来自母方,其子代某一特定dna分子上str核心序列重复次数必定与父母相同。我们 使用atp8b1基因及其基因组位置附近的8个str位点(rs72944199、rs597741、rs613434、 rs76282601、rs652140、rs1380653、ata23g05、d18s1152)对家系成员和胎儿分别进行pcr,对 于某个特定的str位点,根据pcr的结果来判断胚胎遗传了母亲/父亲的其中str,然后综合分析 所有8个str位点,来确定其18号染色体的来源。
[0229]
本实施例对家系人员ⅰ1、ⅰ2、ⅱ1和ⅱ2进行str连锁分析。
[0230]
具体方法步骤如下:
[0231]
1、dna提取
[0232]
按照实施例2的方法提基因组dna。
[0233]
2、pcr反应
[0234]
引物序列由上海生工生物技术公司合成,并完成荧光集团标记。
[0235]
配制下述pcr反应体系。
[0236]
表12 str引物序列表
[0237][0238][0239]
由于引物带荧光,因此整个反应过程需要避光。
[0240]
表13 pcr体系组成表
[0241]
试剂体积ex-taq premix10μla引物(100ng/μl)-f0.3μlb引物(100ng/μl)-r0.3μldna模板(30ng/μl)1μlddh2o至终体积20.0μl
[0242]
为实现上述pcr反应体系,先配置引物混合物,组成如下表。
[0243]
表14 str引物混合比列表
[0244][0245]
将a和b组混合引物充分混匀后,再加入100μl ex-taq premix、10μlddh2o,再次混匀后分 装出10份19μl体系溶液,每管分别加入家系人员1μldna样本,并设置对照管,即完成表12 的pcr体系。
[0246]
pcr扩增条件:第一步:95℃预变性4分钟;第二步:10个循环(95℃变性30s
→
60℃退火 30s
→
72℃延伸35s);第三步:25个循环(95℃变性30s、52℃退火30s,72℃延伸35s:第四步: 72℃充分延伸30s,4℃保存。
[0247]
4、扩增产物毛细管电泳分离str片段,设备检测并数据化
[0248]
经测序仪分析荧光信号,并形成数据。
[0249]
5、结果分析
[0250]
使用genemarker软件进行分析。
[0251]
图3-图9str连锁分析结果显示,8个str(rs72944199、rs597741、rs613434、rs76282601、 rs652140、rs1380653、ata23g05、d18s1152)在先证者父亲(ⅰ1)和母亲(ⅰ)的染色体中连 锁存在4种单体型,分别是:单体型a:“c/g/c/c/a/c/196/263”;单体型b:“t/a/t/t/g/g/193/275”; 单体型c:“t/a/t/t/g/g/196/265”;单体型d:“t/a/t/t/g/g/196/262”。
[0252]
其中单体型a与atp8b1:nm_005603.4:exon24018del突变连锁。
[0253]
其中单体型d与atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t突变连锁。
[0254]
先证者(ⅱ1)是单体型a和d;
[0255]
先证者(ⅱ1)具有单体型a和d,可判断其具有 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t和exon24-28de复合杂合突变,即为患者。
[0256]
胎儿(ⅱ2)具有单体型b和d,可判断其只具有 atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t单个杂合突变,即为携带者。出生后随访情况表 明,该个体未见相关表型。
[0257]
实施例6进行性家族性肝内胆汁淤积症ⅰ型诊断试剂盒
[0258]
1、试剂盒组成:
[0259]
1)扩增引物:如实施例3和实施例4所示;2)缓冲液(具体为:10
×
pcr缓冲液:500mmol/lkcl,100mmol/l tris.hcl(ph8.3),15mmol/l mgcl2);3)taq酶;4)dntps;5)atp8b1:c.2113g》a 和exon24-28del阳性突变参考品dna,该参考品为一段双链dna,c.2113g》a的阳性参考品具体 序列如seq id no.171所示,exon24-28del的阳性参考品具体序列如seq id no.172所示;6)测 序引物:如实施例3步骤8所示。
[0260]
2、使用方法:
[0261]
应用于2号家系检测。
[0262]
表15进行性家族性肝内胆汁淤积症ⅰ型2号家系成员的临床信息
[0263][0264]
家系图谱如图14所示,编号采用ⅰ(第一代)、ⅱ(第二代)。
[0265]
家系人员ⅰ1、ⅰ2外周血dna用于检测,ⅱ2羊水dna用于试剂盒检测。
[0266]
针对atp8b1:c.2113g》a
[0267]
1)基因组dna提取:提取样本基因组dna;2)先采用上述pcr扩增引物、taq酶、缓冲液 (具体为:10
×
pcr缓冲液:500mmol/l kcl,100mmol/l tris.hcl(ph8.3),15mmol/l mgcl2)、 dntps、样本基因组dna等进行pcr扩增反应;3)对pcr扩增产物进行纯化;4)采用上述测序 引物对纯化的pcr产物进行bigdye反应;5)对biydye反应产物纯化;6)对biydye反应产物测 序,测序序列与正常序列相比较。
[0268]
针对atp8b1:exon24-28del
[0269]
1)基因组dna提取:提取样本基因组dna;2)先采用上述荧光pcr扩增引物、样本基因 组dna等配置扩增体系;3)进行荧光pcr扩增反应,检测荧光信号,绘制扩增曲线;
[0270]
4)计算
△△
ct值和dna相对定量。
[0271]
利用试剂盒检测结果显示胎儿atp8b1:nm_005603.4:exon19:c.2113g》a:p.a705t位点基因型 的结果同其父亲,为c.2113g》a杂合突变(见图15);胎儿atp8b1:nm_005603.4:exon24-28del 位点外显子拷贝数判定为“2”,基因位点拷贝没有缺失,即为野生型(见图16)。综合检测结果 考虑胎儿为携带者,遗传咨询建议先证者继续妊娠;出生后随访结果表明,该个体没有家族性肝内 胆汁淤积症表型。
[0272]
由以上实施例可以得出,本发明发现了新的atp8b1复合杂合突变体,且确认了新突变体与家 族性肝内胆汁淤积症ⅰ型的发病密切相关,所述致病突变体可用于家族性肝内胆汁淤积症ⅰ型的分 子诊断及与相关疾病的鉴别诊断。
[0273]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实 施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保 护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。