1.本发明涉及动物源生物活性肽的制备筛选技术领域,特别涉及高 通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽的方法。
背景技术:
2.胶原蛋白是皮肤结构蛋白的一种,所以外部补充胶原蛋白及其降 解产物对皮肤健康发挥着不可替代的作用。目前,对胶原蛋白肽的抗 氧化活性、血管紧张素转换酶抑制活性、抗肿瘤活性和抗菌活性等功 能活性进行了研究。最近的研究表明,许多活性肽含有一些疏水氨基 酸、不带电极性氨基酸、芳香氨基酸等,具有抑制黑色素产生的能力。
3.草鱼是我国产量最高的淡水鱼品种,2020年养殖产量超557万 吨,但在加工过程中鱼鳞的利用率不高,而鱼鳞中含有丰富的胶原蛋 白,是蛋白胶的优质资源。鱼鳞作为鱼类加工的副产物,往往被丢弃。 因此通过生物酶解技术,制备具有抗酪氨酸酶活性肽,可以有效提高 鱼鳞的资源利用。
4.由于酶水解的复杂性,其中含有数以千计的多肽和数量众多的具 有相同分子量或电荷数的多肽,传统的分离和纯化方法面临着分离纯 化困难、时间长、无活性等问题。由于选择较高酪氨酸酶抑制活性的 组分进行纯化的过程是逐步进行的,某些酪氨酸酶抑制肽不可避免地 会被省略,导致最终遗漏了活性较高的肽。因此,如何快速有效地获 得酪氨酸酶抑制肽仍然是一个复杂的问题。
技术实现要素:
5.本发明的目的在于至少解决现有技术中存在的技术问题之一,提 供高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽的方法,将生物亲和超 滤结合质谱技术筛选酪氨酸酶抑制肽,减少了分离纯化步骤和筛选过 程中酶和样品的用量,提高了制备效率。
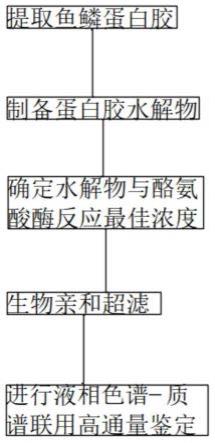
6.本发明还提供具有上述高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑 制肽的方法,包括以下步骤:
7.s1.提取鱼鳞蛋白胶
8.用组织粉碎机将洗净后的草鱼鱼鳞进行搅打,去除表面的羟基磷 灰石等灰银色物质,冲洗干净后加入盐酸溶液浸泡脱钙一段时间,期 间每隔20min搅动1min,浸泡后用流水洗至中性,将处理后的鱼鳞 加适量纯净水进行恒温水浴一段时间,过滤得到蛋白胶液进行浓缩、 冷冻干燥处理;
9.s2.制备蛋白胶水解物
10.取干燥的草鱼鱼鳞蛋白胶,根据其质量比加入适量的蛋白酶,在 恒温下酶解反应一段时间后沸水浴灭酶处理,然后离心取上清液并脱 盐冻干,即得到草鱼鱼鳞蛋白胶酶解粉;
11.s3.确定水解物与酪氨酸酶反应最佳浓度
12.将上述蛋白胶酶解粉配制成不同浓度的溶液后测定酪氨酸酶抑 制活性,以酪氨
酸酶抑制活性基本保持不变时的浓度为最佳浓度;
13.s4.生物亲和超滤
14.将酪氨酸酶与最佳浓度的蛋白胶水解物溶液共同孵育,在孵育一 段时间后进行超滤离心,利用乙腈对所述离心的截留物进行洗脱,收 集洗脱液后干燥得到多肽;
15.s5.进行液相色谱-质谱联用高通量鉴定
16.在活性酪氨酸酶结合的多肽中扣除无活性酪氨酸酶结合的多肽, 进一步筛选条件为:选择分子量小于1000da的多肽序列、同时满足 对酪氨酸酶抑制有贡献的氨基酸占比大于60%,得到所述酪氨酸酶抑 制肽。
17.根据本发明所述的高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽 的方法,所述s1中草鱼鱼鳞与盐酸溶液的质量比为1:10-20,所述 盐酸溶液的浓度为0.2-0.8mol/l,盐酸溶液浸泡脱钙时间为 40-90min,所述草鱼鱼鳞与纯净水的质量比为1:1-5,水浴温度为 60-90℃,水浴时间为1.5-2.5h。
18.根据本发明所述的高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽 的方法,所述s2中蛋白酶为碱性蛋白酶、胃蛋白酶、胰蛋白酶、风 味蛋白酶、中性蛋白酶中的任意一种或多种混合,所述蛋白酶的添加 量为0.5-3%,所述反应温度为30-60℃,所述反应时间为1~5h。
19.根据本发明所述的高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽 的方法,所述s4中酪氨酸酶与蛋白胶水解物溶液的体积比为1:1-3; 所述酪氨酸酶浓度为5-15u/ml;所述孵育温度为37℃,孵育时间为 1-2h。
20.根据本发明所述的高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽 的方法,所述s4超滤离心的步骤:
21.1)利用分子量为10kda的超滤离心管,超滤离心3次,移除滤 液后利用体积百分含量为70%的乙腈溶液重悬;
22.2)重悬后的溶液再孵育后离心,分别收集结合活性酪氨酸酶和 结合灭活酪氨酸酶的两种多肽样品。
23.根据本发明所述的高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽 的方法,所述s5中得到酪氨酸酶抑制肽后,还包括在体外测定酪氨 酸酶抑制活性。
24.根据本发明所述的高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽 的方法,所述s5中液相色谱-质谱联用高通量鉴定方法中,质谱设置 参数为:正离子扫描模式;ms:质荷比扫描范围为200~1500;分辨 率为70000;根据一级质谱分析的信号强度选择前20个肽进行碎裂, 碎裂模式为hcd,能量为27%;用xcalibur软件分析母离子图,用peaksstudio7.0软件对denovo进行测序,得到肽的氨基酸序列。分 别对比结合活性酪氨酸酶和结合灭活酪氨酸酶的两种样品的差异性, 选择结合活性酪氨酸酶的样品中特有的肽为具有潜在酪氨酸酶抑制 活性的肽。
25.有益效果
26.本发明提供了一种高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽 的方法。具备以下有益效果:
27.1、本发明,将生物亲和超滤结合质谱技术筛选酪氨酸酶抑制肽, 减少了分离纯化步骤和筛选过程中酶和样品的用量,提高了制备效率。
28.2、本发明,以加工副产物鱼鳞为原料制备具有酪氨酸酶酶抑制 活性的生物活性多肽,促进了水产品加工副产物的高值化利用。
29.3、本发明基于小分子肽和大分子酶之间的相互作用进行纯化目 标肽段,使获得的肽段具有更高的纯度和准确度。
附图说明
30.下面结合附图和实施例对本发明进一步地说明;
31.图1为本发明的流程结构图;
32.图2为本发明的水解物(a)和超滤组分(b)的酪氨酸酶活性, pat(c)和pit(d)的总离子色谱图(tic)图;
33.图3为本发明的6条合成肽的二级质谱图;
34.图4为本发明的ftgml对斑马鱼头部黑色素的影响示意图。
具体实施方式
35.本部分将详细描述本发明的具体实施例,使人能够直观地、形象 地理解本发明的每个技术特征和整体技术方案,但其不能理解为对本 发明保护范围的限制。
36.本发明实施例高通量快速筛选鱼鳞蛋白胶酪氨酸酶抑制肽的方 法,其包括
37.s1.鱼鳞蛋白胶的提取
38.用组织粉碎机将洗净后的草鱼鱼鳞进行搅打,去除表面的羟基磷 灰石等灰银色物质,冲洗干净后按质量比1:15加入0.5mol/lhcl溶 液浸泡脱钙1h,期间每隔20min搅动1min,浸泡后用流水洗至中性, 将处理后的鱼鳞按质量比1:3加入纯净水进行80℃水浴2h,过滤得 到蛋白胶液进行浓缩、冷冻干燥处理。
39.s2.制备蛋白胶水解物
40.取干燥的草鱼鱼鳞蛋白胶1.25g,溶于10ml水中,调节ph至9, 碱性蛋白酶(北京索莱宝科技有限公司)添加量为1%,水解温度60℃, 水解时间2h,水解结束后沸水浴灭酶,抽滤离心取上清液脱盐干燥, 之后进行模拟消化。
41.制备模拟胃液:0.2gnacl溶于70ml水,用12mol/lhcl调节ph 值至1.2。然后向溶液中加入0.06g胃蛋白酶(北京索莱宝科技有限 公司),用超纯水调节体积至100ml;制备模拟肠液:将0.7gkh2po4溶解在19ml的0.2mol/lnaoh中,将ph值调整到7.5,然后加入0.12g 胰蛋白酶。最后用超纯水将体积调整到100ml;将3g上述酶解粉溶 于25ml胃液中,在37℃下孵育60min。然后用1mol/lnahco3将胃消 化液的ph值调至6.5。然后将25ml肠液加入到胃消化液(ph=6.5) 中,在37℃下培养60min。孵化后,用1mol/lhcl将消化液的ph值 调至3.0,真空冷冻干燥后即得到草鱼鱼鳞蛋白胶酶解粉。
42.s3,确定水解物与酪氨酸酶反应最佳浓度
43.将上述蛋白胶酶解粉配制成不同浓度的溶液后测定酪氨酸酶抑 制活性,得出最佳结合浓度为5mg/ml(如图2中a所示)。
44.s4.生物亲和超滤
45.将酪氨酸酶(10u/ml)与最佳浓度的蛋白胶水解物溶液按照体积 比2:1混合后在37℃下孵育1h,同时以灭活的酪氨酸酶作为对照进 行同样操作。选择分子量为10kda的超
滤离心管,超滤离心3次(每 次4000rpm,20min),每次离心结束后使用移液枪吸打,以防滤膜 被堵,离心结束后移除滤液。往超滤离心管中加入70%的乙腈,反复 吸打后孵育10min,再次进行离心(4000rpm,20min),离心3次。 分别收集结合活性酪氨酸酶(pat)和结合灭活酪氨酸酶(pit)的两 种洗脱的样品,除盐后比较0.5mg/ml的pat、pit和水解物的酪氨酸 酶抑制活性(如图2中b所示),其中pat的抑制率最高,为74.92%, 而pit和水解物的相应抑制率分别为51.37%和62.58%,这表明生物 亲和超滤是一种有效的酪氨酸酶抑制肽的筛选方法。
46.s5.进行液相色谱-质谱联用高通量鉴定序列
47.液相色谱柱:acclaimrpepmaprslc(50μm
×
150mm,c18,2μ m,);上样量为5μl;流动相a:0.1%甲酸水溶液,流动相b: 0.1%甲酸乙腈溶液;柱流量为220nl/min;梯度洗脱条件如下:0-2 分钟,4-12%流动相b;2-25分钟,12-22%流动相b;25-32分钟,22-32% 流动相b;32-37分钟,32-75%流动相b;37-40分钟,75%流动相b。 质谱设置参数为:正离子扫描模式;ms:质荷比扫描范围为200~1500; 分辨率为70000;根据一级质谱分析的信号强度选择前20个肽进行 碎裂,碎裂模式为hcd,能量为27%;用xcalibur软件分析母离子图, 用peaksstudio7.0软件对denovo进行测序,结果如图2中c所示及 图2中d所示。分别对比结合活性酪氨酸酶和结合灭活酪氨酸酶的两 种样品的差异性,选择结合活性酪氨酸酶的样品中特有的肽为具有潜 在酪氨酸酶抑制活性的肽。在活性酪氨酸酶结合的多肽中扣除无活性 酪氨酸酶结合的多肽,进一步筛选条件为:选择分子量小于1000da 的多肽序列、同时满足对酪氨酸酶抑制有贡献的氨基酸如缬氨酸、丙 氨酸、亮氨酸、异亮氨酸、精氨酸、苯丙氨酸、半胱氨酸、色氨酸、 苏氨酸占比大于60%,得到所述酪氨酸酶抑制肽,如表1。
48.表1.pat特异性肽
[0049][0050][0051]
注:以上肽段的分子质量均小于或等于1000da。标记为*表示酪 氨酸酶抑制的贡献氨基酸比例大于等于60%。
[0052]
(6)根据s5得到所述标记为*的六条肽段(图2)进行体外合 成,体外测定酪氨酸酶抑制活性(表2)。由于肽laglvgpa的体外 溶解度较差,无法在后续应用中得到更好的利用,所以没有进一步研 究。因此,对其余5条多肽进行了体外酪氨酸酶抑制活性测定。肽 ftgml显示出最高的酪氨酸酶抑制活性,ic50值为1.89mmol/l。
[0053]
表2.肽的酪氨酸酶抑制活性
[0054][0055]
实施例2
[0056]
实施例1得到的肽段ftgml在斑马鱼中降低黑色素的效果。
[0057]
斑马鱼在鱼水中饲养(在1l反渗透水中加入200mg速溶海盐, 其条件为:电导率为450-550μs/cm,ph值为6.5-8.5,水硬度为 50-100mg/lcaco3),温度为28℃。野生型ab品系斑马鱼通过自然 交配成对繁殖。使用受精后6小时(6hpf)的斑马鱼评估美白、抑制 酪氨酸酶活性和抑制黑色素的效果。
[0058]
a.最大耐受浓度测定(mtc)
[0059]
随机选择野生型ab株斑马鱼(6hpf),转移到6孔板,每孔30 条斑马鱼。在每个孔中分别给予3ml不同浓度的肽溶液,不加肽的孔 被设定为正常对照组。在28℃条件下,48h后观察斑马鱼的死亡情况, mtc被定义为没有观察到死亡的最大浓度。
[0060]
表3.ftgml对斑马鱼美白模型胚胎死亡率的影响(n=30)
[0061][0062]
评估了不同浓度(62.5、125、250、500、1000和2000μg/ml) 的ftgml对斑马鱼死亡率的影响(表3)。浓度为2000μg/ml时, 斑马鱼的发育明显延迟,死亡率为100%。然而,当浓度低于250μg/ml 时,斑马鱼发育正常。因此,选择62.5、125和250μg/ml的ftgml 作为后续实验浓度范围。
[0063]
b.美白效果的测定
[0064]
随机选取6hpf野生型ab品系斑马鱼,每孔(实验组)30尾。 分别水溶给予不同浓度的肽溶液,阳性对照熊果苷3000μg/ml浓度, 同时设置正常对照组,每孔容量为3ml。28℃处理48h,从每个孔中 随机选择10条斑马鱼,在解剖显微镜下观察,并用电荷耦合器件(ccd) 相机拍照。使用imagej1.8.0图像处理软件对斑马鱼头部的总黑色素 光密度进行分析和计数,并以黑色像素数表示,以评价美白效果(图 3)。
[0065]
c.酪氨酸酶抑制能力的测定
[0066]
随机选取6hpf野生型ab品系斑马鱼,每孔(实验组)30尾。 分别水溶给予不同浓度的肽溶液,阳性对照熊果苷3000μg/ml浓度, 同时设置正常对照组,每孔容量为3ml。平行三
个孔。多巴胺氧化法 采用如下方法:将各实验组收集的斑马鱼磨碎,用300μl细胞裂解 液(ripa)(含1g/l苯甲磺酰氟)裂解2min,然后在14000
×
g离 心5min。上清液为斑马鱼粗制的酪氨酸酶提取液。将粗酪氨酸酶提 取液稀释至蛋白质浓度为2.5mg/l(通过使用bca试剂盒测定),与 l-dopa以1:1的体积比结合,然后转移到96孔板中,在37℃下孵育 60min。测定a475来评估该肽对斑马鱼体内酪氨酸酶活性的抑制能力。
[0067]
d.黑色素抑制能力的测定
[0068]
将从各实验组收集的斑马鱼磨碎,用100μlripa(含0.1μg苯 甲基磺酰氟)裂解2min,混合物在14000
×
g下离心10min,分离含 有黑色素蛋白的沉淀物。将沉淀物溶解在1ml1mol/lnaoh中,并在 60℃的水浴中加热至溶解。用酶标仪测量a405,以量化斑马鱼体内 黑色素的含量,并评估该肽对斑马鱼体内黑色素的抑制能力。
[0069]
表4.ftgml美白功效评价实验结果
[0070][0071]
与正常对照组相比,*p《0.05,**p《0.01,***p《0.001。
[0072]
与对照组相比,用ftgml处理的斑马鱼的黑色素生长有不同程度 的下降。随着ftgml浓度的增加,黑色素的总量首先减少,随后增加 (表4)。当斑马鱼被125μg/mlftgml处理后,其黑色素水平下降 到对照组的76.6%(p《0.001)。此外,为了验证ftgml是否影响斑 马鱼的酪氨酸酶活性,本研究测量了斑马鱼发育48h后的酪氨酸酶活 性,结果见表4。低浓度组斑马鱼的酪氨酸酶活性与对照组无明显差 异(p》0.05)。随着ftgml浓度的增加,酪氨酸酶的活性先下降后上 升。中等浓度(125μg/ml)组的数值最低(p<0.01),相对酪氨酸 酶抑制率(与空白组之比)为78.43%。在此浓度下,ftgml具有良好 的抑制酪氨酸酶的活性。斑马鱼的黑色素含量和酪氨酸酶的活性呈现 相同的趋势。中等浓度组(125μg/ml)的黑色素含量下降到对照组 的62.4%(p《0.001)。表4显示了不同浓度的多肽ftgml对斑马鱼 黑色素蛋白含量的影响,其变化趋势与酪氨酸酶活性相同,125μg/ml 组的黑色素蛋白含量最低(15.6
±
0.1μg/ml),总之,中等浓度 (125μg/ml)可以有效地抑制斑马鱼黑色素的合成。
[0073]
上面结合附图对本发明实施例作了详细说明,但是本发明不限于 上述实施例,在所述技术领域普通技术人员所具备的知识范围内,还 可以在不脱离本发明宗旨的前提下作出各种变化。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。