1.本发明属于金属离子成像技术领域,涉及一种基于化学修饰后的脱氧核酶10-23检测活细胞内镁离子的方法,尤其涉及一种经过化学修饰后活性大幅提升且对镁离子更加灵敏的脱氧核酶应用于细胞内源性镁离子成像的方法。
背景技术:
2.镁离子是细胞内含量最多的二价金属阳离子,与许多生理过程息息相关。比如作为许多酶的辅因子参与体内的化学反应、作为atp的辅因子参与能量代谢、维持细胞膜的稳定等。此外,有研究表明镁离子的含量也与免疫反应、一些疾病的形成密切相关。因此,对细胞内镁离子进行检测与成像领域一直是研究的热点。但是,由于镁离子在细胞内多与相关的蛋白质结合,真正以游离形式存在的镁离子浓度更低(~1mm),其检测与成像也面临着挑战。目前测定细胞内游离镁离子的方法大多会对细胞产生一定的损伤与破坏,不能实现无损的活细胞成像,如离子选择性电极法。
3.脱氧核酶是一类通过体外筛选方式获得的具有催化能力的dna,如脱氧核酶10-23,能够在有特定二价金属离子(如镁离子)存在的条件下催化rna底物发生切割反应,这一过程更加温和低毒,加上脱氧核酶本身的生物相容性以及低免疫原性,使其具备可应用于镁离子成像的潜力。但由于脱氧核酶的不稳定性以及其对镁离子的响应能力不够灵敏,需要在较高浓度的镁离子条件下才能催化反应的发生,因此其在镁离子成像领域的发展受限。针对这一问题,本发明提出了一种基于化学修饰后的脱氧核酶(10-23)成像活细胞内镁离子的方法。
技术实现要素:
4.针对上述问题,本发明提供了一种基于化学修饰的脱氧核酶(10-23)成像活细胞内镁离子的方法,尤其涉及一种经过化学修饰后活性大幅提升且对镁离子更加灵敏的脱氧核酶应用于细胞内源性镁离子成像的方法。
5.本发明的技术方案是:本发明所述的一种基于化学修饰的脱氧核酶成像细胞内镁离子的方法,其具体操作步骤如下:
6.步骤(1)、利用糖苷酶和氧胺化合物修饰dna的方法对脱氧核酶10-23进行化学修饰,通过对其催化环上不同位点引入不同化学修饰筛选获得催化活性提升最高的脱氧核酶10-23(cabn);
7.步骤(2)、对化学修饰后活性提升的脱氧核酶10-23(cabn)进行生物化学表征;
8.步骤(3)、将化学修饰的脱氧核酶10-23(cabn)构建为响应镁离子的荧光传感器;
9.步骤(4)、在体外缓冲液中对所构建的荧光传感器的性能进行表征,包括灵敏度以及特异性;
10.步骤(5)、将上述荧光传感器应用于活细胞中进行细胞内镁离子的成像。
11.进一步的,在步骤(1)中,所述获得催化活性提升最高的脱氧核酶10-23的具体过
程包括:
12.首先,利用固相合成的方法,在脱氧核酶10-23催化环中不同的位点引入非典型碱基(次黄嘌呤与尿嘧啶);
13.接着,加入烷化腺嘌呤dna糖苷酶或尿嘧啶dna糖苷酶与dna双链或单链在对应的缓冲液中反应,移除非典型碱基,产生缺碱基位点;
14.再接着,利用乙醇沉淀的方法分离糖苷酶与dna单链或双链,于相应缓冲溶液中加入带有不同官能团的氧胺化合物进行反应,在缺碱基位点上引入对应的化学修饰;
15.然后,通过乙醇沉淀或3k超滤管除盐的方法对修饰后的单链进行纯化或者将带有生物素标记dna双链使用链霉亲和素分离方法得到带有修饰的dna单链;
16.最后,将上述得到的带有化学修饰的脱氧核酶10-23在相同的条件下(ph 7.5,1mm mg
2
)进行活性测试,筛选获得催化活性提升最多的脱氧核酶进行后续荧光传感器的构建;
17.其中,筛选得到催化活性提升最多的脱氧核酶为:同时在催化环的8号位点修饰羧基(ca)以及12号位点修饰苯环(bn)的双修饰脱氧核酶10-23(cabn)。
18.进一步的,在步骤(2)中,所述对化学修饰后活性提升的脱氧核酶10-23(cabn)进行生物化学表征的具体过程包括:
19.首先,在单翻转条件下测试了上述双修饰脱氧核酶10-23(cabn)的一级反应速率常数;
20.接着,在多翻转条件下测试了双修饰脱氧核酶10-23(cabn)的米氏常数与催化常数;
21.最后,在反应溶液中添加不同浓度的镁离子,测试了双修饰脱氧核酶对镁离子的浓度响应。
22.进一步的,在步骤(3)中,所述通过化学修饰的脱氧核酶10-23构建为响应镁离子的荧光传感器的具体过程包括:
23.首先,利用固相合成的方法在脱氧核酶所对应rna底物的5'端和3’端分别修饰上荧光基团6-羧基荧光素(fam)以及相应的猝灭基团bhq-1;
24.然后,在纯水中同时加入上述底物与双修饰脱氧核酶(二者比例为1:1),置于pcr仪上进行退火(85℃5min,4℃5min,7℃1min),得到能够响应镁离子的荧光传感器;
25.将这个荧光传感器与缓冲溶液一起孵育,当溶液中存在镁离子时,脱氧核酶切割rna底物,使得荧光基团与猝灭基团分离,荧光信号增强;当溶液中不存在镁离子时,荧光信号强度稳定。
26.进一步的,在步骤(4)中,所述在体外缓冲液中对所构建的荧光传感器的性能进行表征的具体过程包括:
27.首先,在反应缓冲液中分别加入了几种存在于细胞中的二价金属离子,浓度选择了其各自在细胞内的生理浓度;在相同条件下利用酶标仪通过荧光强度的变化测试了双修饰脱氧核酶对底物的切割效率,以说明其对镁离子的选择性;
28.接着,利用酶标仪测试不同浓度镁离子条件下传感器荧光信号的强度。当镁离子浓度小于2mm时,反应体系的荧光信号强度与镁离子浓度呈现线性关系,跟据3σ/斜率的公式计算出其检测限为0.03mm。
29.进一步的,在步骤(5)中,所述将上述荧光传感器应用于活细胞中进行细胞内镁离
子的成像的具体过程包括:
30.首先,利用转染试剂lipofectamine 3000将所构建的荧光传感器包载后转染至细胞内部;
31.接着,将转染后的细胞置于细胞培养箱中37℃培养4h;
32.最后,在细胞固定后,利用激光扫描共聚焦显微镜对细胞进行成像;
33.其性能表现如下:该荧光传感器可以实现对细胞内源性镁离子的成像。
34.本发明的有益效果是:通过对脱氧核酶10-23催化环部分进行不同位点以及不同官能团的化学修饰,最终得到了催化活性大幅提升的双修饰脱氧核酶(cabn);该酶对镁离子有较高的特异性,能够在更短的时间内响应更低浓度的镁离子;将其构建为荧光传感器后,不仅在体外缓冲液中实现了对不同镁离子浓度的梯度响应,检测限达到0.03mm;在转染进细胞后也成功实现了对细胞内源性镁离子的成像;这一发明为生物传感领域,尤其是细胞内镁离子成像领域提供了一个良好应用前景的分子工具。
附图说明
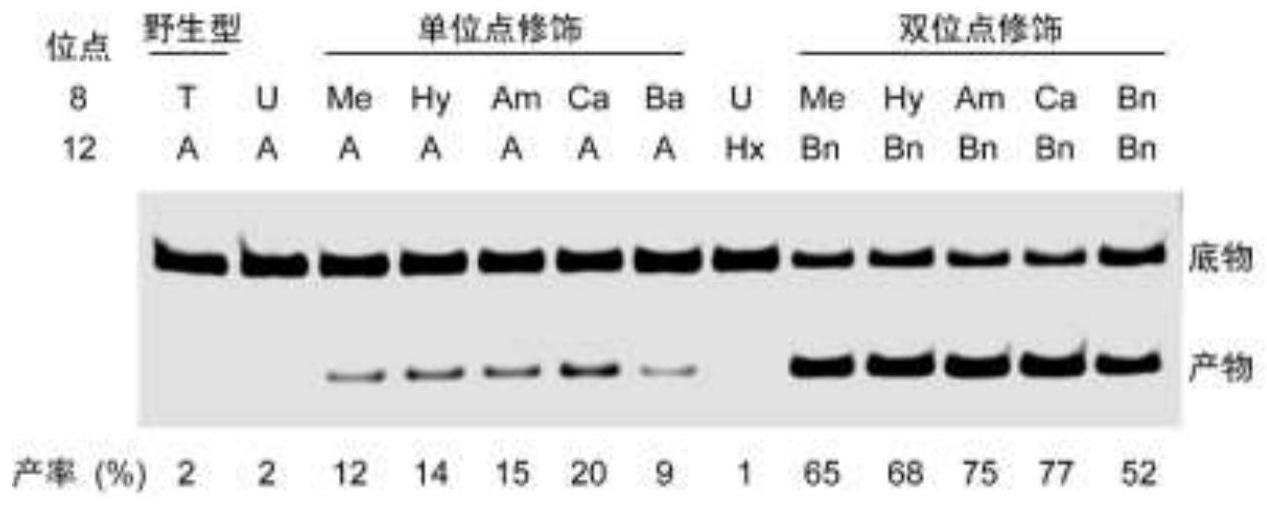
35.图1为本发明中对经过不同化学修饰后的脱氧核酶10-23的活性测试示意图;
36.图2为对本发明中筛选获得的双修饰脱氧核酶10-23(cabn)进行生物化学表征的结果对比图;
37.图3为本发明中构建的镁离子荧光传感器的设计示意图;
38.图4为本发明构建的镁离子荧光传感器体外性能表征结果对比图;
39.图5为本发明基于化学修饰后的脱氧核酶10-23(cabn)实现活细胞内源性镁离子成像的结果。
具体实施方式
40.为了更清楚地说明本发明的技术方案,下面结合附图对本发明的技术方案做进一步的详细说明:
41.实施例1如图一所示筛选获得化学修饰后催化活性提升最高的脱氧核酶10-23(cabn):
42.1、利用糖苷酶和氧胺化合物修饰dna的方法(具体过程参照已发表专利:cn 112920247 a)在脱氧核酶10-23催化环中不同的位点引入不同的化学修饰;
43.2、将上述得到的不同化学修饰后的脱氧核酶10-23溶解于纯水后分别加入ep管中。随后,加入嵌合了两个rna的dna底物,使得酶和底物的比例为40:1(终浓度分别为2mm和50nm);置于pcr仪上退火(85℃下5min,直接冷却到4℃孵育5min,再恢复至37℃保持1min);
44.3、加入含有镁离子的反应缓冲液(1mm mgcl2,20mm tris-hcl,100mm nacl,ph 7.5),在37℃下反应20s后加入2倍体积的终止缓冲液(7m尿素,20mm edta,ph 8.0)停止反应;
45.4、使用20%的变性聚丙烯酰胺凝胶电泳对上述反应进行表征,在3000v,100w的条件下电泳1h后用odyssey clx双色红外激光成像系统成像(700nm激发通道);
46.5、跟据产物与底物条带的灰度值计算出反应产率,以此比较不同化学修饰脱氧核酶的催化活性;
47.6、最终,确定了在催化环8号位点修饰羧基、12号位点修饰苯环的双修饰10-23(cabn)具有最高的催化活性;在单翻转条件下它的一级反应速率常数是未修饰脱氧核酶10-23的800倍。
48.实施例2本发明所构建的镁离子荧光传感器用于细胞内镁离子成像的流程:
49.1、构建基于cabn的镁离子荧光传感器:
50.1.1、合成使用到的序列:带有非典型碱基的脱氧核酶10-23dna序列:5
’‑
agggttgaggctagcuacahxcgatcatctgt-3’;带有生物素修饰的互补链序列:5
’‑
biotin-tttaactctgatcgttgtagctagcc-3’;带有荧光基团与猝灭基团的底物:5
’‑
fam-acagatgargrucaaccct-bhq-1-3’;
51.1.2、跟据已发表的专利“一种利用糖苷酶和氧胺化合物修饰dna的方法(具体过程参照已发表专利)”,利用烷化腺嘌呤dna糖苷酶和尿嘧啶dna糖苷酶联合氧胺化合物分别在脱氧核酶10-23的催化环8号位点引入羧基修饰、12号位点引入苯环修饰。获得双修饰脱氧核酶10-23(cabn);
52.1.3、在ep管中以1:1的比例加入上述制得的双修饰脱氧核酶10-23(cabn)以及底物(100pmol),混匀后置于pcr仪上退火(85℃下5min,直接冷却到4℃孵育5min,再恢复至37℃保持1min);
53.2、所构建镁离子荧光传感器的体外性能表征:
54.2.1、特异性测定:将上述构建的镁离子传感器置于含不同二价金属离子的反应缓冲液中(二价金属离子的浓度选择了各自在细胞内的生理浓度),在37℃条件下反应2min;利用酶标仪,在484nm的激发波长下,采集525nm处发射光的强度;如图4所示;
55.2.2、灵敏度测定、在荧光传感器体系中加入含有不同浓度镁离子的的反应缓冲液,于37℃条件下反应2min;随后,在460nm的激发波长下,利用酶标仪扫描采集荧光光谱,发射波长为500-650nm;结果如图4所示;
56.3、所构建镁离子荧光传感器的细胞内成像:
57.3.1、hela细胞培养。hela细胞在添加10%胎牛血清(fbs)、100u/ml青霉素、100mg/ml链霉素和2.5μg/ml四环素的dmem培养基中培养,置于37℃,含有5%co2的湿化培养箱中培养;共聚焦成像前,细胞被铺在35mm玻璃底培养皿中生长24h,此时视野中的细胞达到60-70%融合;
58.3.2、将100pmol的传感器和3μl的lipofectamine 3000分别在opti-mem培养基中于室温下孵育5min,然后将二者混合于室温下孵育10min。将该混合物加入到pbs中与细胞共孵育4h;
59.3.3、孵育4h后,用2.5ng/ml的hoechst 33258细胞核染色剂于37℃下染色8min;接着,用pbs小心清洗几次;进一步,在37℃下用4%多聚甲醛处理细胞15min,使细胞固定;最后,用pbs替换4%多聚甲醛;
60.在40
×
的分辨率下使用olympus激光扫描共聚焦显微镜拍摄上述处理后的细胞;在405nm的激发光下,于430-470nm范围内测量了hoechst 3325的荧光发射;在488nm的激发光下,于500-600nm处收集fam的荧光;结果如图5所示。
61.最后,应当理解的是,本发明中所述实施例仅用以说明本发明实施例的原则;其他的变形也可能属于本发明的范围;因此,作为示例而非限制,本发明实施例的替代配置可视
为与本发明的教导一致;相应地,本发明的实施例不限于本发明明确介绍和描述的实施例。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。