1.本发明属于高分子材料合成技术领域,特别涉及一种利用氮烷有机锌配合物催化环酯开环聚合的方法。
背景技术:
2.随着科学技术的发展,高分子材料已经渗透到国民经济和人们生活的各个方面,所产生的废弃物也与日俱增,产生大量堆积,白色污染逐渐笼罩全球,这些塑料废弃物主要来自生活垃圾、农业薄膜、包装材料、医药工程等诸多领域。大多数合成的高分子材料耐腐蚀性好,不易分解,废弃材料难以处理,目前我国对于废弃聚合的处理主要是回收再利用,但其效果并不好。因此,在不降低人们生活质量和生活便利性的前提下,生物可降解材料的重要性便尤为突出,生物可降解聚酯作为生物可降解材料的重要一类,现已被人们广泛认识。生物可降解聚酯可以在特定的条件下,通过分子内的不稳定键的断裂而分解,最终转化为二氧化碳和水,回归大自然。
3.目前,使用最多的生物可降解聚酯主要有聚己内酯(pcl)、聚丙交酯(pla)、聚乙交酯(pga)等,以及他们的共聚物等,这些生物可降解聚酯可以广泛的应用于医药工程、建筑工程、农业工程以及人们的日常生活,尤其在医药工程中的使用尤为突出,其可以作为药物载体,起到药物的缓释作用,还可以作为手术缝合线和手术支架,避免病人的二次手术痛苦。
4.生物可降解聚酯的主要制备方式为环酯的开环聚合,该反应过程中主要使用金属有机配合物作为催化剂,醇盐和酚盐的添加在一定程度上能够提高催化活性。近年来,研究较为广泛的为金属配合物体系。其中,锡金属配合物催化体系是目前催化活性最好的体系,但是锡金属在地壳中的含量仅0.004%,使用成本较高,且锡金属具有一定的细胞毒性,其催化得到的生物可降解聚酯使用时会有很大的限制。
5.锌是参与人体新陈代谢的元素之一,且在自然界中属于常见金属,获取成本低,价格低廉。近年来以锌配合物催化环酯开环聚合的研究较多,但目前新催化剂的催化活性均较弱,且在空气中的稳定性差,储存和运输困难。为了满足高分子材料的大规模生产,并且能够制备生物安全性高、分子量较高且分子量分布较窄的生物可降解材料,急需研究和开发工艺简单、可实现工业化生产的聚酯聚合方法,制备得到生物安全性高、性能好的生物可降解聚酯。
技术实现要素:
6.为了解决上述问题,本发明中提供了一种生物可降解聚酯的制备方法,利用氮烷有机锌配合物催化环酯单体开环聚合,并且配合使用有机硅胺锂或有机硅胺锌作为引发剂,小分子醇类作为共引发剂,使得该方法能够进行批量制备,通过工艺控制,得到的聚酯分子量分布窄,根据应用方向,有效控制聚合物的分子量,催化剂催化活性好和生物安全性高,易于存储和使用,该方法在其工业应用上具有良好的推广前景,从而完成本发明。
7.本发明第一方面的目的在于提供一种生物可降解聚酯的制备方法,所述方法以氮烷有机锌配合物作为催化剂催化环酯开环聚合。所述聚酯选自己内酯、丙交酯和乙交酯中的一种或几种的聚合物。
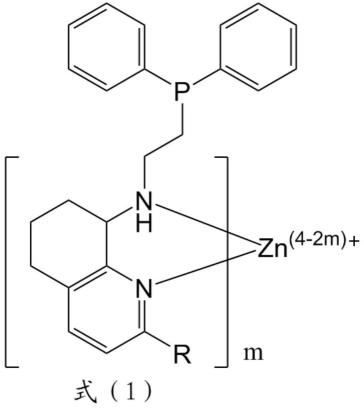
8.所述氮烷有机锌配合物包含氢化喹啉单元和仲胺基,优选地,所述配合物还包含芳香膦基团。
9.所述方法具体包括以下步骤:
10.步骤1、制备氮烷有机锌配合物;
11.步骤2、将环酯单体加入到含有氮烷有机锌配合物和引发剂的溶剂中,加热反应,得到反应液;
12.步骤3、后处理反应液,得到聚酯。
13.步骤2中,
14.所述环酯单体选自己内酯、丙交酯和乙交酯中的一种或几种,优选为己内酯,更优选为ε-己内酯。
15.所述引发剂选自硅胺基锂和硅胺基锌中的一种或几种,优选选自硅胺基锂中的一种或几种,更优选为双三甲基硅基胺基锂。
16.优选地,所述方法中,还加入共引发剂,所述共引发剂选自醇类,优选为甲醇、乙醇、异丙醇、正丁醇和苄醇中的一种或几种,更优选为苄醇。
17.本发明第二方面的目的在于提供一种用于催化环酯开环聚合的催化剂组合物,所述组合物包括所述氮烷有机锌配合物和一种或几种锌或锂的有机硅胺基化合物。优选地,还包括醇类化合物,其选自甲醇、乙醇、异丙醇、正丁醇和苄醇中的一种或几种,更优选为苄醇。
18.在本发明的一种优选实施方式中,所述催化剂组合物包括氮烷有机锌配合物、有机硅胺基锂化合物和苄醇。优选地,所述氮烷有机锌配合物选自c1-c5,所述有机硅胺基锂为双三甲基硅基胺基锂。
19.本发明提供的聚酯的制备方法具有以下有益效果:
20.(1)本发明中聚酯制备方法以氮烷有机锌配合物为催化剂,具有非常高的活性,能够批量催化环酯开环聚合,毒性低,生物安全性好,不会影响后续聚酯在生物医学领域中的应用。
21.(2)该聚合方法聚合条件温和可控,能够通过调控聚合条件,从而调控聚合产物的分子量,从而实现针对其用途,制备具有针对性性质的聚酯。
22.(3)利用本发明中的氮烷有机锌配合物作为催化剂使用量少,能够实现规模化聚合,满足工业生产的需求。并且,聚合工艺简单易行,容易控制,对于设备要求低,能够有效降低生产成本。
23.(4)本发明中氮烷有机锌配合物制备方法简单,易于合成,并且通过控制反应条件能够有效控制反应物高转化率转化,得到的配合物活性均一,在空气中或潮湿环境下稳定性好,便于储存运输及后续的催化应用。
具体实施方式
24.下面通过具体实施方式对本发明进行详细说明,本发明的特点和优点将随着这些
说明而变得更为清楚、明确。
25.本发明第一方面提供了一种生物可降解聚酯的制备方法,所述方法以氮烷有机锌配合物作为催化剂催化环酯开环聚合。所述聚酯选自己内酯、丙交酯和乙交酯中的一种或几种的聚合物,优选为聚己内酯,更优选为聚ε-己内酯。
26.所述氮烷有机锌配合物包含氢化喹啉单元和仲胺基,优选地,所述配合物还包含芳香膦基团。
27.所述氮烷有机锌配合物为具有如式(1)结构的配合物:
[0028][0029]
其中,
[0030]
r选自氢、烷基、卤代基或芳香基,优选选自氢、c
1-c5的烷基、氟取代基、氯取代基、溴取代基、苯基、烷基苯基、烷氧基苯基,更优选为氢、甲基、异丙基、氯取代基或苯基;
[0031]
r0为芳香膦基团,优选为苯基膦基或二苯基膦基,更优选为二苯基膦基;
[0032]
n为1-6,优选为2-4,更优选为2或3;
[0033]
x为使配合物呈电中性的阴离子,如氯离子、溴离子、硝酸根离子、醋酸根离子等,优选为氯离子。
[0034]
优选地,所述氮烷有机锌配合物为:
[0035]
c1:r为氢(h),r0为二苯基膦基,n为2,x为氯离子(n-(2-(二苯基膦基)乙基)-5,6,7,8-四氢喹啉-8-胺氯化锌);
[0036]
c2:r为甲基(me),r0为二苯基膦基,n为2,x为氯离子(n-(2-(二苯基膦基)乙基)-2-甲基-5,6,7,8-四氢喹啉-8-胺氯化锌);
[0037]
c3:r为异丙基(ipr),r0为二苯基膦基,n为2,x为氯离子(n-(2-(二苯基膦基)乙基)-2-异丙基-5,6,7,8-四氢喹啉-8-胺氯化锌);
[0038]
c4:r为氯(cl),r0为二苯基膦基,n为2,x为氯离子(n-(2-(二苯基膦基)乙基)-2-氯-5,6,7,8-四氢喹啉-8-胺氯化锌);或
[0039]
c5:r为苯基(ph),r0为二苯基膦基,n为2,x为氯离子(n-(2-(二苯基膦基)乙基)-2-苯基-5,6,7,8-四氢喹啉-8-胺氯化锌)。
[0040]
所述方法具体包括以下步骤:
[0041]
步骤1、制备氮烷有机锌配合物。
[0042]
所述氮烷有机锌配合物由配体化合物与锌盐反应制备得到,所述配体化合物为包含氢化喹啉单元和仲胺基,优选地,所述配体化合物还包含芳香膦基团,所述锌盐为可电离锌盐。
[0043]
具体包括以下步骤:
[0044]
步骤1-1、配置配体化合物溶液与锌盐溶液。
[0045]
所述配体化合物为包含氢化喹啉单元和仲胺基的氮烷;优选地,还包含芳香膦基团,其优选为苯基膦基或二苯基膦基,更优选为二苯基膦基。
[0046]
优选地,所述配体化合物具有以下结构:
[0047][0048]
其中,r、r0和n如式(1)中r、r0和n所述。
[0049]
所述锌盐为可电离锌盐,选自氯化锌、硝酸锌、溴化锌、醋酸锌等,如氯化锌。
[0050]
配置溶液的溶剂选自水、醇类溶剂和醚类溶剂中的一种或几种,优选为水、甲醇、乙醇、异丙醇和乙醚中一种或几种,更优选为乙醇。
[0051]
所述配体化合物溶液的浓度为0.05-0.7mol/l,优选为0.15-0.5mol/l,更优选为0.25-0.35mol/l。所述锌盐溶液浓度为0.15-1.40mol/l,优选为0.35-1.00mol/l,更优选为0.55-0.70mol/l。
[0052]
在本发明的一种优选实施方式中,所述配体化合物由包括氢化喹啉酮类化合物与芳香膦基烷胺类化合物的原料反应制备得到。
[0053]
所述氢化喹啉酮类化合物为二氢化喹啉-8-酮或具有2位取代基的二氢化喹啉-8-酮,所述取代基选自氢、烷基、卤代基或芳香基,优选选自氢、c
1-c5的烷基、氟取代基、氯取代基、溴取代基、苯基、烷基苯基或烷氧基苯基,更优选为氢、甲基、异丙基、氯取代基或苯基。优选地,所述氢化喹啉酮类化合物为6,7-二氢-5h-8-喹啉酮、2-甲基-6,7-二氢-5h-8-喹啉酮、2-异丙基-6,7-二氢-5h-8-喹啉酮、2-氯-6,7-二氢-5h-8-喹啉酮或2-苯基-6,7-二氢-5h-8-喹啉酮。
[0054]
所述芳香膦基烷胺类化合物选自具有芳香膦端基的烷胺,优选为具有苯基膦端基或二苯基膦端基的烷胺,如2-二苯基膦基乙胺、二苯基膦基甲胺、3-二苯基膦基丙胺。
[0055]
所述氢化喹啉酮类化合物与芳香膦基烷胺类化合物在催化剂存在下,在溶剂中进行胺化反应。本发明中不对催化剂做具体限定,能够用于酮类胺化催化即可,如硼氢化钠、三乙酰基硼氢化钠、氰基硼氢化钠、硼烷(2-甲基吡啶硼烷)、锡烷等。所述溶剂选自卤代烃溶剂、醇类溶剂,如甲醇、二氯乙烷等。所述反应在保护气氛下反应,如氮气气氛。
[0056]
步骤1-2、将锌盐溶液加入到配体化合物溶液中,搅拌反应,得到反应液。
[0057]
所述方法中,将锌盐溶液缓慢加入到配体化合物溶液中,优选为滴加。
[0058]
所述配体化合物与锌盐的摩尔比为1:(0.6-1.6),优选为1:(0.8-1.4),更优选为1:(1.0-1.2),如1:1,其中,锌盐的摩尔量以其中锌的摩尔量计。在反应过程中,使锌盐溶液缓慢加入到配体化合物溶液中,使锌盐与配体化合物充分反应,在本发明中,优选使锌盐与配体化合物进行等摩尔量反应,避免反应结束后过量的配体或锌盐难以除去,影响后续反应进行。
[0059]
所述反应温度为15-38℃,优选为20-30℃;反应时间为6-18h,优选为10-14h。
[0060]
步骤3、后处理反应液,得到氮烷有机锌配合物。
[0061]
反应结束后,过滤反应液,优选地,过滤温度低于20℃,洗涤得到的沉淀物,所述洗
涤液为冷的溶剂,干燥沉淀物,得到氮烷有机锌配合物。
[0062]
步骤2、将环酯单体加入到含有氮烷有机锌配合物和引发剂的溶剂中,加热反应,得到反应液。
[0063]
所述环酯单体选自己内酯、丙交酯和乙交酯中的一种或几种,优选为己内酯,更优选为ε-己内酯。
[0064]
所述引发剂选自硅胺基锂和硅胺基锌中的一种或几种,优选选自硅胺基锂中的一种或几种,更优选为双三甲基硅基胺基锂。
[0065]
本发明中的引发剂在引发聚合单体的同时,可以活化催化剂,活化后的氮烷有机锌配合物的配位能够以更高的活性使环酯单体开环,降低开环聚合的条件要求,避免聚合过程中小分子的副产物生成,能够获得分子量高且分布窄的聚合物。
[0066]
优选地,所述方法中,还加入共引发剂,所述共引发剂选自醇类,优选为甲醇、乙醇、异丙醇、正丁醇和苄醇中的一种或几种,更优选为苄醇。
[0067]
所述方法中,在保护气体气氛下,将催化剂和引发剂加入到反应溶剂中,搅拌陈化后,再加入环酯单体,优选地,还加入共引发剂,保温反应。在陈化过程中,引发剂能够使催化剂得到有效活化,提高催化剂的活性。
[0068]
所述反应溶剂为芳香类溶剂和烷烃类溶剂中的一种或几种,优选为甲苯、二甲苯、正己烷、正庚烷、辛烷、3-甲基戊烷中的一种或几种,优选为甲苯或正己烷。
[0069]
所述催化剂与引发剂的摩尔比为1:(0.1-5),优选为1:(1-3.5),更优选为1:(1.8-2.2)。所述催化剂的摩尔量以其中锌元素的摩尔量计。
[0070]
所述陈化为催化剂和引发剂在反应溶剂中陈化,使催化剂得到有效活化。所述陈化温度为15-35℃,优选为20-30℃;陈化时间为0.1-2h,优选为0.5-1h,如0.5h。
[0071]
所述环酯单体选自己内酯、丙交酯或乙交酯,优选为己内酯,更优选为ε-己内酯。
[0072]
所述环酯单体与催化剂的摩尔比为(200-12000):1,优选为(350-10000):1,更优选为(500-8000):1。
[0073]
所述环酯单体与溶剂的摩尔体积比为(2-120)mmol:(0.4-8)ml,优选为(3.5-100)mmol:(0.6-5)ml,更优选为(5-80)mmol:(0.8-3.5)ml。
[0074]
所述催化剂与共引发剂的摩尔比为1:(0.1-10),优选为1:(0.5-6),更优选为1:(1-2),如1:1。所述催化剂的摩尔量以其中锌元素的摩尔量计。
[0075]
所述反应温度为15-60℃,优选为35-50℃,如40℃、50℃;所述反应时间为2-30min,优选为8-16min,如10min。
[0076]
步骤3、后处理反应液,得到聚酯。
[0077]
反应结束后,加入冷的析出溶剂,使产物析出,过滤干燥后,得到聚酯。所述析出溶剂选自醇类溶剂,优选为甲醇、乙醇和丙醇中的一种或几种,更优选为甲醇。
[0078]
本发明中的聚酯的制备方法用于己内酯开环聚合时,能够在10min内,完成8000倍于催化剂摩尔量的ε-己内酯单体聚合,分子量最高能达到9.66
×
104,分子量分布指数最低可以达到1.07,单体转换率最高能达到99%以上。
[0079]
本发明第二方面提供了一种用于催化环酯开环聚合的催化剂组合物,所述组合物包括所述氮烷有机锌配合物和一种或几种锌或锂的有机硅胺化合物。优选地,还包括醇类化合物,其选自甲醇、乙醇、异丙醇、正丁醇和苄醇中的一种或几种,更优选为苄醇。
[0080]
在本发明的一种优选实施方式中,所述催化剂组合物包括氮烷有机锌配合物、有机硅胺锂和苄醇。优选地,所述氮烷有机锌配合物选自c1-c5,所述有机硅胺锂为双三甲基硅基胺基锂。
[0081]
c1:n-(2-(二苯基膦基)乙基)-5,6,7,8-四氢喹啉-8-胺氯化锌;
[0082]
c2:n-(2-(二苯基膦基)乙基)-2-甲基-5,6,7,8-四氢喹啉-8-胺氯化锌;
[0083]
c3:n-(2-(二苯基膦基)乙基)-2-异丙基-5,6,7,8-四氢喹啉-8-胺氯化锌;
[0084]
c4:n-(2-(二苯基膦基)乙基)-2-氯-5,6,7,8-四氢喹啉-8-胺氯化锌;
[0085]
c5:n-(2-(二苯基膦基)乙基)-2-苯基-5,6,7,8-四氢喹啉-8-胺氯化锌。
[0086]
本发明中提供的氮烷有机锌配合物作为环酯开环聚合催化剂具有非常高的催化活性,在聚合反应中锌配合物和共引发剂的作用,能够可控聚合得到聚酯,尤其是聚已内脂的聚合,聚合反应条件温和,操作简单。得到的聚酯分子量可控,分子量分布窄,避免催化剂残留导致的毒性,因此,可以实现聚酯的性能可控,拓展其在生物医学等领域的应用,满足生产和使用要求。
[0087]
实施例
[0088]
本发明中,甲苯溶剂在钠中回流48小时蒸出;四氢呋喃经分子筛浸泡48h后,金属钠回流后蒸出;二氯甲烷经氢化钙浸泡48h后,回流后蒸出;正己烷经分子筛浸泡48h后,金属钠回流48h后蒸出;己内酯在氢化钙中干燥12小时,减压蒸馏。
[0089]
实施例1
[0090]
在的史莱克瓶中,加入10mmol 2-二苯基膦基乙胺和12mmol 6,7-二氢-5h-喹啉-8-酮,然后加入20mmol三乙酰基硼氢化钠,将反应体系置换为氮气氛围,加入100ml干燥的1,2-二氯乙烷,在室温下搅拌6小时,反应体系中白色固体逐渐消失。反应结束后用饱和碳酸氢钠溶液淬灭,分离出有机层,将水层用乙酸乙酯萃取三次,所得到的有机层合并,旋转蒸发除去溶剂,所得到的粗产物用石油醚和乙酸乙酯经氧化铝柱色谱进行分离提纯(石油醚和乙酸乙酯体积比为10:1),得到n-(2-(二苯基膦基)乙基)-5,6,7,8-四氢喹啉-8-胺。
[0091]
将4mmol的(n-(2-(二苯基膦基)乙基)-5,6,7,8-四氢喹啉-8-胺)溶于12ml乙醇中,得到配体化合物溶液。将4mmol的zncl2溶于的6ml乙醇,然后将其逐滴加入到配体化合物溶液中,在室温下搅拌12小时,过滤。用冷乙醇洗涤产物三次,置于真空干燥箱中干燥12小时,所得氮烷有机锌配合物c1,产率为84.6%。
[0092]
核磁表征数据如下:
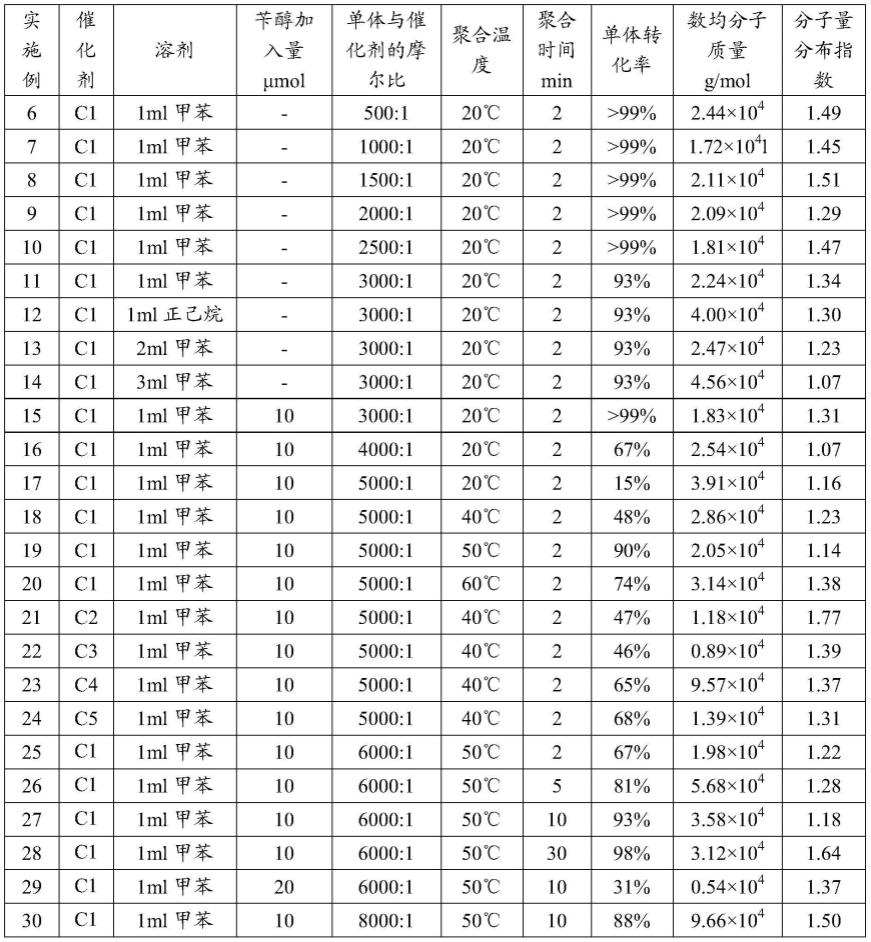
[0093]1h nmr(c3d7no,300mhz):δppm 8.53-8.51(d,j=4.5hz,1h,py),7.95-7.62(d,j=7.5hz,1h,ch),7.62-7.41(m,12h,ph py),4.08(s,1h,ch),3.23(br,s,1h,ch),3.06-2.75(m,4h,ch2),2.53-2.50(d,j=8.4,2h,ch2),2.07-2.01(d,j=15.3,1h,ch),1.90-1.73(m,2h,ch2)。
[0094]
13
c nmr(c3d7no,75mhz):δ154.69,145.46,141.30,138.14,137.11,135.30,132.98,132.79,132.56,132.37,129.17,128.98,128.85,128.81,128.79,128.75,124.55。
[0095]
31
p nmr(c3d7no
,
162mhz):δ-21.62。
[0096]
实施例2
[0097]
按照实施例1中的方法制备n-(2-(二苯基膦基)乙基)-2-甲基-5,6,7,8-四氢喹啉-8-胺,区别仅在于:用2-甲基-6,7-二氢-5h-喹啉-8-酮代替6,7-二氢-5h-喹啉-8-酮。
[0098]
按照实施例1中的方法制备氮烷有机锌配合物c2,区别仅在于:用n-(2-(二苯基膦基)乙基)-2-甲基-5,6,7,8-四氢喹啉-8-胺)替换n-(2-(二苯基膦基)乙基)-5,6,7,8-四氢喹啉-8-胺,产率68.4%。
[0099]
实施例3
[0100]
按照实施例1中的方法制备n-(2-(二苯基膦基)乙基)-2-异丙基-5,6,7,8-四氢喹啉-8-胺,区别仅在于:2-异丙基-6,7-二氢-5h-喹啉-8-酮代替6,7-二氢-5h-喹啉-8-酮。
[0101]
按照实施例1中的方法制备氮烷有机锌配合物c3,区别仅在于:用n-(2-(二苯基膦基)乙基)-2-异丙基-5,6,7,8-四氢喹啉-8-胺替换n-(2-(二苯基膦基)乙基)-5,6,7,8-四氢喹啉-8-胺,产率74.9%。
[0102]
实施例4
[0103]
按照实施例1中的方法制备2-(二苯基膦基)乙基)-2-氯-5,6,7,8-四氢喹啉-8-胺,区别仅在于:2-氯-6,7-二氢-5h-喹啉-8-酮代替6,7-二氢-5h-喹啉-8-酮。
[0104]
按照实施例1中的方法制备氮烷有机锌配合物c4,区别仅在于:用2-(二苯基膦基)乙基)-2-氯-5,6,7,8-四氢喹啉-8-胺替换n-(2-(二苯基膦基)乙基)-5,6,7,8-四氢喹啉-8-胺,产率75.4%。
[0105]
实施例5
[0106]
按照实施例1中的方法制备n-(2-(二苯基膦基)乙基)-2-苯基-5,6,7,8-四氢喹啉-8-胺,区别仅在于:用2-苯基-6,7-二氢-5h-喹啉-8-酮代替6,7-二氢-5h-喹啉-8-酮。
[0107]
按照实施例1中的方法制备氮烷有机锌配合物c5,区别仅在于:用n-(2-(二苯基膦基)乙基)-2-苯基-5,6,7,8-四氢喹啉-8-胺替换n-(2-(二苯基膦基)乙基)-5,6,7,8-四氢喹啉-8-胺,产率73.6%。
[0108]
实施例6
[0109]
在氮气气氛手套箱中,将10μmol的c1和1ml甲苯加入到100ml的史莱克瓶中,摇晃片刻,然后加入1m的双三甲基硅基胺基锂的四氢呋喃溶液(其中双三甲基硅基胺基锂含量为20μmol),将催化剂混合物在室温下搅拌30min进行陈化。
[0110]
在氮气氛围下将0.570g(约5mmol)的ε-己内酯加入到催化剂溶液中,在20℃反应2min,反应结束后直接取反应液检测己内酯单体转化率,然后将冷甲醇加入到反应容器中搅拌得到白色固体,过滤、在真空干燥箱中干燥24小时,收集产物聚己内酯。通过1h nmr检测己内酯单体转化率》99%,通过gpc(凝胶渗透色谱)检测得聚己内酯的数均分子质量为2.44
×
104g/mol,分子量分布指数为1.49。
[0111]
实施例7
[0112]
按照实施例6中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为1.14g(约10mmol)。聚己内酯的数均分子量为1.72
×
104g/mol,分子量分布指数为1.45。单体转化率为》99%。
[0113]
实施例8
[0114]
按照实施例6中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为1.71g(约15mmol)。聚己内酯的数均分子量为2.11
×
104g/mol,分子量分布指数为1.51。单体转化率为》99%。
[0115]
实施例9
[0116]
按照实施例6中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为2.28g(约20mmol)。聚己内酯的数均分子量为2.09
×
104g/mol,分子量分布指数为1.29。单体转化率为》99%。
[0117]
实施例10
[0118]
按照实施例6中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为2.85g(约25mmol)。聚己内酯的数均分子量为1.81
×
104g/mol,分子量分布指数为1.47。单体转化率》99%。
[0119]
实施例11
[0120]
按照实施例6中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为2.42g(约30mmol)。聚己内酯的数均分子量为2.24
×
104g/mol,分子量分布指数为1.34。单体转化率为93%。
[0121]
实施例12
[0122]
按照实施例11中的制备方法制备聚己内酯,区别仅在于:将1ml甲苯替换为1ml正己烷。聚己内酯的数均分子量为4
×
104g/mol,分子量分布指数为1.30。单体转化率为93%。
[0123]
实施例13
[0124]
按照实施例11中的制备方法制备聚己内酯,区别仅在于:将甲苯的加入量为2ml。聚己内酯的数均分子量为2.47
×
104g/mol,分子量分布指数为1.23。单体转化率为93%。
[0125]
实施例14
[0126]
按照实施例11中的制备方法制备聚己内酯,区别仅在于:将甲苯的加入量为3ml。聚己内酯的数均分子量为4.56
×
104g/mol,分子量分布指数为1.07。单体转化率为93%。
[0127]
实施例15
[0128]
按照实施例11中的制备方法制备聚己内酯,区别仅在于:在加入ε-己内酯后,再加入0.1ml苄醇的甲苯溶液(浓度为0.1mmol/ml)。聚己内酯的数均分子量为1.83
×
104g/mol,分子量分布指数为1.31。单体转化率》99%。
[0129]
实施例16
[0130]
按照实施例15中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为4.45g(40mmol)。聚己内酯的数均分子量为2.54
×
104g/mol,分子量分布指数为1.07。单体转化率67%。
[0131]
实施例17
[0132]
按照实施例15中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为5.70g(50mmol)。聚己内酯的数均分子量为3.91
×
104g/mol,分子量分布指数为1.16。单体转化率15%。
[0133]
实施例18
[0134]
按照实施例17中的制备方法制备聚己内酯,区别仅在于:反应温度为40℃。聚己内酯的数均分子量为2.86
×
104g/mol,分子量分布指数为1.23。单体转化率48%。
[0135]
实施例19
[0136]
按照实施例17中的制备方法制备聚己内酯,区别仅在于:反应温度为50℃。聚己内酯的数均分子量为2.05
×
104g/mol,分子量分布指数为1.14。单体转化率90%。
[0137]
实施例20
[0138]
按照实施例17中的制备方法制备聚己内酯,区别仅在于:反应温度为60℃。聚己内酯的数均分子量为3.14
×
104g/mol,分子量分布指数为1.38。单体转化率74%。
[0139]
实施例21
[0140]
按照实施例18中的制备方法制备聚己内酯,区别仅在于:将催化剂c1替换为催化剂c2。聚己内酯的数均分子量为1.18
×
104g/mol,分子量分布指数为1.77。单体转化率47%。
[0141]
实施例22
[0142]
按照实施例18中的制备方法制备聚己内酯,区别仅在于:将催化剂c1替换为催化剂c3。聚己内酯的数均分子量为0.89
×
104g/mol,分子量分布指数为1.39。单体转化率46%。
[0143]
实施例23
[0144]
按照实施例18中的制备方法制备聚己内酯,区别仅在于:将催化剂c1替换为催化剂c4。聚己内酯的数均分子量为9.57
×
104g/mol,分子量分布指数为1.37。单体转化率65%。
[0145]
实施例24
[0146]
按照实施例18中的制备方法制备聚己内酯,区别仅在于:将催化剂c1替换为催化剂c5。聚己内酯的数均分子量为1.39
×
104g/mol,分子量分布指数为1.31。单体转化率68%。
[0147]
实施例25
[0148]
按照实施例19中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为6.84g(60mmol)。聚己内酯的数均分子量为1.98
×
104g/mol,分子量分布指数为1.22。单体转化率67%。
[0149]
实施例26
[0150]
按照实施例25中的制备方法制备聚己内酯,区别仅在于:聚合反应时间为5min。聚己内酯的数均分子量为5.68
×
104g/mol,分子量分布指数为1.28。单体转化率81%。
[0151]
实施例27
[0152]
按照实施例25中的制备方法制备聚己内酯,区别仅在于:聚合反应时间为10min。聚己内酯的数均分子量为3.58
×
104g/mol,分子量分布指数为1.18。单体转化率93%。
[0153]
实施例28
[0154]
按照实施例25中的制备方法制备聚己内酯,区别仅在于:聚合反应时间为30min。聚己内酯的数均分子量为3.12
×
104g/mol,分子量分布指数为1.64。单体转化率98%。
[0155]
实施例29
[0156]
按照实施例27中的制备方法制备聚己内酯,区别仅在于:在加入ε-己内酯后,再加入0.2ml苄醇的甲苯溶液(浓度为0.1mmol/ml)。聚己内酯的数均分子量为0.54
×
104g/mol,分子量分布指数为1.37。单体转化率31%。
[0157]
实施例30
[0158]
按照实施例27中的制备方法制备聚己内酯,区别仅在于:ε-己内酯的加入量为9.12g(80mmol)。聚己内酯的数均分子量为9.66
×
104g/mol,分子量分布指数为1.50。单体转化率88%。
[0159]
实施例31
[0160]
在氮气气氛的手套箱中,将锌配合物10μmol的c1和40μl 0.5m的三甲基硅甲基锂的四氢呋喃溶液(20μmol)加入到100ml的schlenk瓶中,加入1ml甲苯作为溶剂,使其在室温下陈化0.5小时。
[0161]
然后加入5.70g的ε-己内酯(约50mmol),并将反应容器置于50℃的水浴锅中反应10min,反应结束后加入甲醇终止反应并使聚合物析出,过滤后,在真空干燥箱中干燥24小时得到白色的聚己内酯,ε-己内酯的单体转化率32%。gpc(凝胶渗透色谱)测定聚己内酯的数均分子量为2.27
×
104g/mol,分子量分布指数为1.21。
[0162]
将实施例6-实施例30的制备条件及测试结果汇总见表1。
[0163]
表1:实施例6-实施例30制备条件及测试结果
[0164][0165]
根据表1中的数据可知:
[0166]
(1)根据实施例6-11可知,在其他条件不变的情况下,增加单体己内酯的用量,其数均分子量变化不大,分子量分布指数略有变窄。
[0167]
(2)根据实施例11和12可知,利用正己烷作为反应溶剂,相比于甲苯,数均分子量变大。
[0168]
(3)根据实施例11和实施例13、14可知,增加反应溶剂的用量,数均分子量变大,分子量分布指数变窄。
[0169]
(4)根据实施例15-17可知,加入共引发剂苄醇以后,继续增大单体的用量,数均分子量有所增大,分子量分布指数变窄,但是单体转换率大幅下降。
[0170]
(5)根据实施例17-20可知,加入共引发剂后,升高聚合温度有利于提高单体转化率。
[0171]
(6)根据实施例18和实施例21-24可知,在相同的聚合条件下,氮烷有机锌配合物c2和c3作为聚合催化剂时,得到聚己内酯数均分子量较小,分子量分布指数较宽,尤其是c2;氮烷有机锌配合物c4和c5作为聚合催化剂时,单体转化率较高,能够得到分子量较高的聚己内酯,尤其是c4,分子量分布指数也较窄。
[0172]
(7)根据实施例25-28可知,增加聚合时间有利于提高单体转化率,同时,分子量先是快速增大,然后稍有下降,当聚合时间达到30min后,分子量分布指数变宽。
[0173]
(8)根据实施例27和29可知,单纯增加共引发剂的使用量,会使单体转化率大幅下降,数均分子量变小,分子量分布指数变宽。
[0174]
(9)根据实施例27和30可知,继续增加单体用量,数均分子量变大,分子量分布指数略有变宽,单体转化率略有下降。
[0175]
对比例
[0176]
对比例1
[0177]
按照实施例11中的制备方法制备聚己内酯,区别仅在于:将1ml甲苯替换为1ml二氯甲烷。未检测到聚己内酯的生成。
[0178]
对比例2
[0179]
按照实施例11中的制备方法制备聚己内酯,区别仅在于:将1ml甲苯替换为1ml四氢呋喃。未检测到聚己内酯的生成。
[0180]
对比例3
[0181]
按照实施例11中的制备方法制备聚己内酯,区别仅在于:甲苯的加入量为4ml。在2min的聚合时间下,未检测到聚己内酯的生成。
[0182]
以上结合具体实施方式和/或范例性实例对本发明进行了详细说明,不过这些说明并不能理解为对本发明的限制。本领域技术人员理解,在不偏离本发明精神和范围的情况下,可以对本发明技术方案及其实施方式进行多种等价替换、修饰或改进,这些均落入本发明的范围内。本发明的保护范围以所附权利要求为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。