1.本发明属于药物制剂技术领域,具体涉及一种稳定的阿法骨化醇水基溶液制剂及其制备方法。
背景技术:
2.阿法骨化醇是维生素d的活性代谢产物,在调节钙平衡和骨骼代谢中起重要作用。阿法骨化醇可通过肝脏中的25-羟化酶激活,并在全身和成骨细胞中发挥维生素d作用。它在肠、骨、甲状旁腺、肌肉和大脑中发挥独特的多效作用。阿法骨化醇可以增加小肠和肾小管对钙的重新收,抑制甲状旁腺增生,减少甲状旁腺素合成与释放,抑制骨吸收;还可增加转化生长因子和胰岛素样生长因子的合成,促进胶原和骨基质蛋白合成;另外,该药物还能调节肌肉钙代谢,促进肌细胞分化,增强肌肉力量,增加神经肌肉协调性,减少跌倒倾向。基于这些药理机制,目前阿法骨化醇主要用于改善维生素d代谢异常所致的症状(如低钙血症、抽搐、骨痛及骨损害),还可用于骨质疏松症。
3.阿法骨化醇是强效药用物质,但水溶性差。上市的阿法骨化醇软胶囊使用植物油对阿法骨化醇进行溶解,构成了软胶囊的内容物。上市的阿法骨化醇滴剂,使用乙醇和15-羟基硬脂酸聚乙二醇酯对阿法骨化醇进行增溶。上市的阿法骨化醇注射剂也加入了乙醇和聚乙二醇对阿法骨化醇进行增溶。一般来说,使用一定量的植物油、乙醇和聚乙二醇等辅料对阿法骨化醇溶解或增溶,作为制剂使用来说没有问题,但在某些情况下,这些制剂对特定的使用对象不适宜。例如,以阿法骨化醇软胶囊治疗骨质疏松症时,其适用对象主要是老年患者,但许多老年患者同时患有高血脂症或动脉粥样硬化症,不宜过多服用植物油。以阿法骨化醇滴剂治疗营养和吸收障碍引起的佝偻病和骨软化症时,其适用对象主要是婴幼儿,而一些婴幼儿无法接受阿法骨化醇滴剂中乙醇对口腔粘膜产生的刺激作用。因此,开发一种水基的阿法骨化醇溶液制剂,具有一定的临床需求。
4.专利cn102781425a公开了用于治疗皮肤疾病或病症的药物组合物,该药物组合物含有溶解于三组分表面活性剂-溶剂混合物中的作为活性成分的维生素d衍生物或类似物。该专利使用大量有机溶剂和表面活性剂增加维生素d衍生物或类似物的溶解度,从而应用于皮肤给药。专利cn 103110598a公开了一种具有溶出迅速,吸收快,生物利用度高,稳定性好,服用方便等优点阿法骨化醇分散片及其制备方法,其所述阿法骨化醇分散片包括:阿法骨化醇包合物和制剂辅料;其中,阿法骨化醇包合物由阿法骨化醇与2,6-二甲基-β-环糊精按照4∶1-0.5∶3的摩尔比例包合得到。该专利使用的主要辅料2,6-二甲基-β-环糊精尚未作为药用辅料获得批准,其毒性有待进一步研究,且未知包合物稳定性如何。专利cn103127015b公开了一种阿法骨化醇滴丸及其制备方法。所述滴丸包括阿法骨化醇包合物,基质和稳定剂。其中,阿法骨化醇包合物包括活性成分和包合材料,所述包合材料为α-环糊精,β-环糊精,羟基β-环糊精。由于该发明主要目的是将阿法骨化醇的环糊精包合物制成滴丸,因此其并未提及阿法骨化醇的包合物能否在水中以较长时间稳定存在,也未提及γ-环糊精是否可能的对阿法骨化醇的包合作用。
技术实现要素:
5.发明目的:本发明要解决的技术问题是如何提高水难溶性药物阿法骨化醇的溶解度,并利用天然(非化学修饰)的环糊精制成稳定的包合物,使其能长期稳定存在于水溶液中,便于特定人群使用。
6.为解决上述技术问题,本发明提供了如下的技术方案:
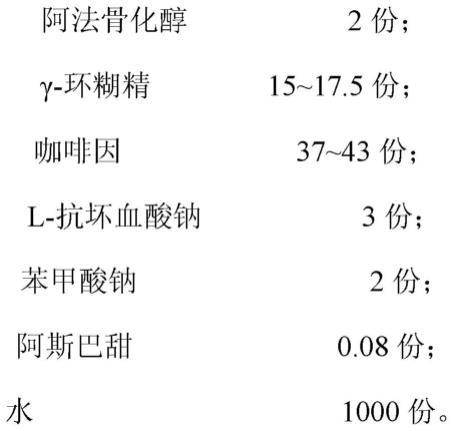
7.一种稳定的阿法骨化醇水基溶液制剂,所述的稳定的阿法骨化醇水基溶液制剂包括以下重量配比的组分:
[0008][0009]
申请人在研究中发现,天然环糊精α-环糊精对阿法骨化醇的包合作用较弱,不能通过加入α-环糊精实现对阿法骨化醇的增溶作用。天然环糊精β-环糊精本身的溶解度较差,其虽可能对阿法骨化醇形成一定的包合物,但均以沉淀状态存在,无法形成均一、澄明的溶液状态。与之相比,被列入药用辅料的半合成类的环糊精羟丙基-β-环糊精对阿法骨化醇呈现较好的增溶作用,形成的阿法骨化醇的羟丙基-β-环糊精溶液能够在1周内稳定地以澄明状态存在,但1周后逐渐出现肉眼可见的沉淀。尚未被列入药用辅料的半合成类的环糊精2,6-二甲基-β-环糊精对阿法骨化醇也能呈现较好的增溶作用,但其问题与阿法骨化醇的羟丙基-β-环糊精溶液类似,均不能长期稳定地以溶液形式存放。
[0010]
被列入药用辅料的天然环糊精γ-环糊精对阿法骨化醇的有一定的包合作用,但包合效率不高。申请人惊喜地发现,当在γ-环糊精对阿法骨化醇的包合过程中加入一定量的咖啡因,可以显著促进包合效率。其具体的表现是,用γ-环糊精对阿法骨化醇进行常规包合时,采用搅拌或者均质等手段,均不能在短期内将阿法骨化醇包入该环糊精中,溶液不完全澄清;但加入咖啡因后,采用均质方法,阿法骨化醇很容易进入γ-环糊精腔内,形成稳定澄清的溶液,且该溶液至少在6个月内在避光条件下能够保持澄清状态,显示其具备高度的物理稳定性。咖啡因促进阿法骨化醇进入γ-环糊精腔内的具体机制尚不得而知,申请人猜测,可能是阿法骨化醇与咖啡因形成了某种形式的相互作用,以一种超分子形式整体进入了γ-环糊精腔内。另外,从比例上来看,很有可能是2个γ-环糊精在咖啡因配合下,包合1个阿法骨化醇分子。
[0011]
申请人还尝试将咖啡因更换为其他物质以促进阿法骨化醇进入环糊精内腔行为。在申请人所尝试的小分子化合物中,例如水杨酸、对乙酰氨基酚、咖啡酸、苹果酸、蔗糖、葡
萄糖、茶碱、己酮可可碱、绿原酸、表儿茶素等物质中,其促进阿法骨化醇进入γ-环糊精腔内的作用均远不如咖啡因,甚至部分化合物对该入腔行为有反作用。
[0012]
申请人还尝试将咖啡因加入到阿法骨化醇与羟丙基-β-环糊精的包合物中,以及加入到阿法骨化醇与2,6-二甲基-β-环糊精的包合物中,设想加入咖啡因后可能会促进阿法骨化醇与这两种环糊精构成的包合物的物理稳定性,延长其稳定放置时间。遗憾的是,与申请人的设想相反,加入的咖啡因反而以竞争分子的形式排斥阿法骨化醇进入这两种环糊精形成包合物。另外,任何比例的咖啡因同样不能促进天然环糊精α-环糊精对阿法骨化醇的包合作用。因此,加入一定比例的咖啡因能够促进γ-环糊精对阿法骨化醇的包合作用,是偶然发现的,且具有特异性。
[0013]
作为本发明的较优选的方案,所述的稳定的阿法骨化醇水基溶液制剂包括以下重量配比的组分:
[0014][0015]
作为本发明的最优选的方案,所述的稳定的阿法骨化醇水基溶液制剂包括以下重量配比的组分:
[0016][0017]
作为优选的技术方案,所述的稳定的阿法骨化醇水基溶液制剂的制备方法,包括如下步骤:
[0018]
(1)将全量的阿法骨化醇和全量的γ-环糊精混合,加入50份水,常温下研磨打浆,
升温至60℃,形成混合物i;
[0019]
(2)将全量的咖啡因溶于50份水中,升温至60℃,形成混合物ii;
[0020]
(3)将混合物i和混合物ii在高速剪切条件下混合,并迅速注入高压均质机中,在80mpa压力下连续均质6次,降温至室温,形成混合物iii;
[0021]
(4)将全量的l-抗坏血酸钠、苯甲酸钠和阿斯巴甜室温下溶于50份水中,形成混合物iv;
[0022]
(5)将混合物iii和混合物iv混合,搅拌均匀,加入余量的水,封装,即得。
[0023]
作为优选的技术方案,所述的阿法骨化醇制剂,能改善阿法骨化醇的水溶解度,相比于未经过加工的阿法骨化醇增加10倍以上。
[0024]
作为优选的技术方案,所述的阿法骨化醇制剂,制剂在避光保存条件下可在常温下稳定贮存6个月以上。
[0025]
本发明的有益效果:天然环糊精γ-环糊精对阿法骨化醇有一定的包合作用,但包合效率不高。研究发现,当在γ-环糊精对阿法骨化醇的包合过程中加入一定量的咖啡因,采用均质方法,阿法骨化醇很容易进入γ-环糊精腔内,可以显著促进包合效率。该过程形成稳定澄清的溶液,且该溶液至少在6个月内在避光条件下能够保持澄清状态,显示其具备高度的物理稳定性。本方面所述的方法可以用来制备不含植物油和其他有机溶剂的阿法骨化醇口服溶液,便于特定人群使用。
附图说明
[0026]
图1为本发明的阿法骨化醇的分子结构示意图。
具体实施方式
[0027]
现在结合附图对本发明作进一步详细的说明。以下对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
[0028]
实施例1:阿法骨化醇溶液
[0029]
如图1所示,本实施例所述阿法骨化醇溶液,按以下处方制备而成:
[0030][0031]
该阿法骨化醇溶液的制备方法,包括如下步骤:
[0032]
(1)将全量的阿法骨化醇和全量的γ-环糊精混合,加入50份水,常温下研磨打浆,升温至60℃,形成混合物i;
[0033]
(2)将全量的咖啡因溶于50份水中,升温至60℃,形成混合物ii;
[0034]
(3)将混合物i和混合物ii在高速剪切条件下混合,并迅速注入高压均质机中,在80mpa压力下连续均质6次,降温至室温,形成混合物iii;
[0035]
(4)将全量的l-抗坏血酸钠、苯甲酸钠和阿斯巴甜室温下溶于50份水中,形成混合物iv;
[0036]
(5)将混合物iii和混合物iv混合,搅拌均匀,加入余量的水,封装,即得。
[0037]
实施例2:阿法骨化醇溶液
[0038]
如图1所示,本实施例所述阿法骨化醇溶液,按以下处方制备而成:
[0039]
表1阿法骨化醇溶液的配置表
[0040][0041]
该阿法骨化醇溶液的制备方法,同实施例1的制备方法。
[0042]
制备完毕后,静置1小时,观察溶液状态。结果可见,所有处方制备得到的溶液内部存在悬浮状态的极细的小颗粒,溶液底部存在尚未溶解的白色小颗粒。该结果说明,没有咖啡因参加的情况下,单纯用γ-环糊精对阿法骨化醇进行包合,包合效率低。
[0043]
实施例3:阿法骨化醇溶液
[0044]
如图1所示,本实施例所述阿法骨化醇溶液,按以下处方制备而成:
[0045]
表2阿法骨化醇溶液的配置表
[0046]
处方1处方2处方3处方4处方5处方6阿法骨化醇2份2份2份2份2份2份γ-环糊精10份12份14份16份18份20份咖啡因45份45份45份45份45份45份l-抗坏血酸钠3份3份3份3份3份3份苯甲酸钠2份2份2份2份2份2份阿斯巴甜0.08份0.08份0.08份0.08份0.08份0.08份
水1000份1000份1000份1000份1000份1000份
[0047]
该阿法骨化醇溶液的制备方法,同实施例1的制备方法。
[0048]
制备完毕后,静置1小时,观察溶液状态。结果可见,处方1和处方2制备得到的溶液内部存在悬浮状态的极细的小颗粒,溶液底部存在尚未溶解的白色小颗粒。其余溶液均为澄清溶液。这说明,处方1和处方2的γ-环糊精加入量仍不足以将阿法骨化醇完全包合,而其他处方提供了足量的γ-环糊精,并在咖啡因的协助下,成功将阿法骨化醇包入环糊精腔内。
[0049]
实施例4:阿法骨化醇溶液
[0050]
如图1所示,本实施例所述阿法骨化醇溶液,按以下处方制备而成:
[0051]
表3阿法骨化醇溶液的配置表
[0052][0053][0054]
该阿法骨化醇溶液的制备方法,同实施例1的制备方法。
[0055]
制备完毕后,避光静置,分别在0、1、4、12、24周观察溶液状态。结果可见下表。
[0056]
表4阿法骨化醇溶液的配置表
[0057] 处方1处方2处方3处方4处方5处方60周√√√√√√1周√√√√√√1个月√√√√√√3个月√√√√√√6个月
××
√√√√
[0058]
注:“√”表示澄清,
“×”
表示浑浊或者在溶液底部有细小颗粒。
[0059]
由上表结果可见,处方1和处方2可以成功地将阿法骨化醇包合进入γ-环糊精,也可以在3个月以内保持稳定,但在6个月的稳定性实验中,在溶液底部显示出现细小颗粒,这说明这两种处方所构建的包合物体系尚不是最稳定的。其他处方所得的阿法骨化醇环糊精溶液均能在6个月显示较好的稳定性。
[0060]
实施例5:阿法骨化醇溶液
[0061]
如图1所示,本实施例所述的阿法骨化醇溶液,按以下处方制备而成:
[0062]
表5阿法骨化醇溶液的配置表
[0063][0064][0065]
该阿法骨化醇溶液的制备方法,同实施例1的制备方法。
[0066]
制备完毕后,避光静置,分别在0、1、4、12、24周观察溶液状态。结果可见下表。
[0067]
表6阿法骨化醇溶液的配置表
[0068]
处方1处方2处方3处方4处方5处方60周√√√√√√1周√√√√√√1个月√√√√√√3个月√√√√√√6个月
×××
√√√
[0069]
注:“√”表示澄清,
“×”
表示浑浊或者在溶液底部有细小颗粒。
[0070]
由上表结果可见,降低咖啡因的处方量后,由处方1、处方2和处方3制备得到的阿法骨化醇环糊精溶液可以在3个月以内保持稳定,但在6个月的稳定性实验中,在溶液底部显示出现细小颗粒。其他处方所得的阿法骨化醇环糊精溶液均能在6个月显示较好的稳定性。考虑到既要用最少量的环糊精辅料达成增溶目的,又要使得溶液保持至少6个月的物理稳定,申请人将阿法骨化醇、γ-环糊精和咖啡因的最优比例定为2∶16.5∶40。
[0071]
实验例1:高温加速稳定性实验
[0072]
1.1试验样品:样品1为本发明实施例1制备的阿法骨化醇溶液;对照品1为根据专利cn 103110598a第[0018]项所述“当阿法骨化醇与2,6-二甲基-β-环糊精按照1∶0.8的摩尔比进行包合时,阿法骨化醇在水中的溶解性能最好,相比于其他摩尔配比具有显著性差异”制备得到的阿法骨化醇环糊精包合物(阿法骨化醇:2,6-二甲基-β-环糊精的摩尔比为1∶0.8);对照品2为专利cn103127015b中按照实施例1制备的阿法骨化醇环糊精包合物(阿法骨化醇:羟丙基-β-环糊精为2∶3)。
[0073]
1.2试验方法:60℃条件下放置1周,分别于0、1、3和7天观察溶液状态。样品涡旋,取样1ml,离心,取上清液。上清液中的阿法骨化醇含量基于2020版中国药典(第二部)第696页阿法骨化醇软胶囊含量测定方法进行适当改动后测定。
[0074]
1.3试验条件:避光操作。色谱条件:用硅胶为填充剂;以石油醚(60~90℃)-乙酸乙酯-四氢呋喃(2∶1∶1)为流动相;检测波长为265nm。理论板数按阿法骨化醇峰计算不低于
2500。测定法:取样品溶液各1ml,冻干,加流动相溶解并定量稀释制成每1ml中含阿法骨化醇1μg的溶液(理论量),过滤,续滤液作为供试品溶液,精密量取20μl注入液相色谱仪,记录色谱图;另取阿法骨化醇对照品适量,精密稳定,加流动相溶解并定量稀释制成每1ml中含1μg的溶液,同法测定。按外标法以峰面积计算,即得。
[0075]
1.4试验结果:见下表。
[0076]
表7各样品中阿法骨化醇含量占标示量的百分比(平均值,%)
[0077][0078][0079]
结果可见,3种样品在加速实验中的表现差异较大。样品1在为期1周的高温加速实验中,一直处于澄清状态,涡旋后取样,离心,并未在离心管底部出现沉淀,上清液含量测定显示阿法骨化醇含量为标示量的97.3%。与之对比,对照品1和对照品2在为期1周的高温加速实验中,均在溶液底部产生了细小颗粒,涡旋后取样,离心,在离心管底部发现沉淀,上清液含量测定显示阿法骨化醇含量为标示量的57.4%和46.0%,显示大量阿法骨化醇已脱离了相应的环糊精包合体系,形成了沉淀。
[0080]
该实验例显示了按照本发明实施例1制备的阿法骨化醇环糊精包合物溶液既能够对难溶性的阿法骨化醇增溶,又能在一定条件下延长其物理稳定性,具有较高的专利价值。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。