1.本发明涉及一种在胰岛移植期间具有保护作用的组合物。更具体来说,本发明涉及一种用于保护胰岛移植的组合物,其包含下式1的化合物或其可药用盐,可以在胰岛移植期间提供针对氧化应激和炎症的保护作用:
2.[式1]
[0003][0004]
其中n、x、r1、r2、r3、r4、r5和r6与本文所定义的相同。
背景技术:
[0005]
近年来迅速增加的1型糖尿病或长期2型糖尿病,由于胰腺β-细胞的破坏而高度依赖胰岛素,并且危及生命的低血糖和糖尿病并发症的发生率高。胰岛移植是指对脑死亡者捐献的胰腺进行生物化学处理以分离出纯胰岛,然后施用到接受者的手术。手术的目的是允许糖尿病患者在不给药胰岛素的情况下正常控制血糖。移植的胰岛分泌胰岛素,允许接受者无需给药胰岛素即可过上正常生活。
[0006]
同种异体胰岛移植一直是一种用于在伴有低血糖意识受损的1型糖尿病患者中消除严重低血糖并实现正常血糖的有希望的策略。然而,在围移植(peri-transplant)期间移植的胰岛物质的大量损失仍然是广泛临床使用的重要障碍。
[0007]
在围移植期间,缺氧/复氧诱导的损伤和损伤相关分子模式(damp)例如高迁移率族蛋白1(hmgb1)的释放,已越来越被接受是先天免疫和促炎性细胞因子产生的强力激活物。与作为细胞死亡的非炎性甚至是抗炎性模式的细胞凋亡(apoptosis)相反,坏死性凋亡(necroptosis)或坏死(necrosis)具有高度免疫原性。从坏死细胞释放的damp和在坏死性凋亡过程中核苷酸结合性寡聚化结构域(nod)样受体蛋白3(nlrp3)炎性体的细胞内在激活两者,至少部分是造成这种免疫原性的原因。
[0008]
诱导线粒体通透性转换孔(mptp)开放的线粒体活性氧(ros)的产生,是促进坏死性凋亡和坏死过程的关键因素之一。在移植的胰岛中,线粒体ros在坏死性凋亡和坏死中的作用可能是至关重要的,这是因为已知由于抗氧化酶基因例如过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶的低表达,β-细胞对氧化应激高度敏感。因此,在胰岛移植和缺氧/复氧诱导的损伤的各种不同过程期间产生的氧化应激,可能在显著的β-细胞损伤和移植胰岛的大量损失中发挥重要作用。在这种情况下,在少数研究中使用了各种抗氧化剂针对氧化损伤为胰岛提供可能的保护作用,导致在体外胰岛存活率和胰岛素分泌的增强,并改善胰岛移植程序。然而,这些方法的临床转化需要更强的功效和临床级材料的可用性。此
外,在以前的研究中,线粒体ros的产生并不是一个具体靶点,这些研究主要集中在减少细胞凋亡。
技术实现要素:
[0009]
技术问题
[0010]
因此,本发明的技术问题是提供一种可以在胰岛移植时有效保护胰岛的组合物。
[0011]
技术解决方案
[0012]
为了实现上述目的,本发明提供了一种用于保护胰岛移植的组合物,其包含下式1的化合物或其可药用盐作为活性成分:
[0013]
[式1]
[0014][0015]
其中
[0016]
n是0或1;
[0017]
x是c或n,前提是当x是n时n是0,并且当x是c时n是1;
[0018]
r1是氢或c
1-c6烷基;
[0019]
r2是苯基或吡啶;
[0020]
r3是氢、卤素或c
1-c6烷基;
[0021]
r4是氢、卤素、2-羧基-吡咯烷-1-基、吡咯烷-1-基、4-乙酸-1,3-噻唑啉-2-基、-ch
2-(1,1-二氧代-硫代吗啉-4-基)或-ch
2-(2-氧代哌嗪-4-基);
[0022]
r5是氢、c
1-c6烷基或c
3-c6环烷基;并且
[0023]
r6是-d-w-r7,其中d是环戊基、环己基、吡咯烷、四氢吡喃、四氢呋喃或哌啶;w是直接连键、-so
2-、-co-或-c(o)o-;并且r7是氢、羟基或c
1-c6烷基。
[0024]
在根据本发明的一个实施方式中,所述式1的化合物可以是下式2的(四氢吡喃-4-基)-[2-苯基-5-(1,1-二氧代-硫代吗啉-4-基)甲基-1h-吲哚-7-基]胺:
[0025][0026]
在根据本发明的另一个实施方式中,所述可药用盐可以包括从下述酸形成的酸加成盐:无机酸例如盐酸、硫酸、硝酸、磷酸、氢溴酸和氢碘酸;有机酸例如酒石酸、甲酸、柠檬酸、乙酸、三氯乙酸、三氟乙酸、葡萄糖酸、苯甲酸、乳酸、延胡索酸、马来酸和水杨酸;或磺酸例如甲磺酸、乙磺酸、苯磺酸和对甲苯磺酸,它们形成包括可药用阴离子的无毒性酸加成
盐。此外,所述可药用盐可以包括可药用碱加成盐,例如与碱金属或碱土金属例如锂、钠、钾、钙和镁的盐;与氨基酸例如赖氨酸、精氨酸和瓜氨酸的盐;以及有机盐例如二环己基胺、n-甲基-d-葡萄糖胺、三(羟基甲基)甲基胺、二乙醇胺、胆碱和三乙胺,但不限于此。根据本发明的式1的化合物可以通过常规方法转变成它们的盐,并且所述盐的制备可以由本领域技术人员在式1的结构的基础上容易地进行,不需单独解释。
[0027]
胰岛移植是一种仅从胰腺分离产生胰岛素的胰岛细胞并将其移植到接受者中的手术,并且是细胞疗法的代表性实例而不是实体器官移植。
[0028]
然而,β-细胞由于它们的抗氧化防御系统弱,因此容易受到氧化应激影响。在胰岛分离期间,包括低温、机械胁迫和暴露到胶原酶在内的各种不同因素导致产生氧化应激并最终引发细胞死亡。在胰岛移植和血管再生过程中氧和营养物的低可用性下,在胰岛中发生凋亡、自噬、坏死和坏死性凋亡。尽管与坏死相反,凋亡通常不涉及炎性反应,但胰岛中由缺氧引起的原发性凋亡可能诱导免疫激活,呈递未切割的半胱天冬酶-9和半胱天冬酶-3而不是它们的切割形式。这表明主要的细胞死亡过程朝向诱导损伤相关分子模式(damp)释放的坏死而不是继发性凋亡。damp是从细胞内空间释放的分子例如hmgb1、dsdna和尿酸,主要被参与先天免疫系统的toll样受体(tlr)识别。由于damp在缺氧和再灌注损伤期间作为由坏死和坏死性凋亡引起的细胞死亡的结果而被释放并导致胰岛移植失败中的炎性级联,因此抑制坏死和坏死性凋亡而不是凋亡或自噬,可能是在胰岛移植期间减少damp释放和相关免疫应答的优选策略。
[0029]
hmgb1在细胞死亡期间由受损或坏死的细胞分泌并充当damp信号和促炎性细胞因子,并与各种不同炎性疾病的发病机理相关。也已知几种炎性细胞因子例如il-1β、ifn-γ和tnf-α负责通过包括ros形成和jnk激活以及nf-κb易位在内的一系列细胞内信号传导途径来诱导β-细胞功能障碍和凋亡。nf-κb是一种控制nadph氧化酶的转录因子,导致氧化应激的产生。促炎性细胞因子的协同作用诱导诱导型一氧化氮合酶(inos)的表达和inos活性的阻断,或者在体外条件下产胰岛素的细胞系中锰超氧化物歧化酶(mnsod)表达的提高减弱了细胞因子诱导的nf-κb活化。
[0030]
由于安全性法规,为了避免使用动物产品,在临床同种异体门静脉内胰岛移植之前,通常将分离的人类胰岛在血清剥夺培养条件下培养。在血清剥夺条件下的胰岛培养期间,胰岛被进一步暴露到培养基中的多样化应激,包括营养物的剥夺、各种不同促炎性细胞因子、来自于外分泌胰腺的酶和充足氧合的剥夺,并且这些应激对β-细胞有害,诱导过量ros的积累。此外据认为,胰岛淀粉样多肽(iapp)的毒性是2型糖尿病中β-细胞的量逐渐减少和胰岛纤维化的原因,并且在血糖正常的条件下血清剥夺培养唤起毒性hiapp寡聚物的积累。il-1/il-1受体轴的抑制可以减弱由血清剥夺培养引起的炎性反应和胰岛的功能损伤,但il-1阻断不能减弱血清剥夺培养期间毒性寡聚物的积累。
[0031]
当在分离胰岛的同时进行处理时,根据本发明的式1的化合物可以通过减少氧化应激和活性氧(ros)的量来保护胰岛。
[0032]
此外,当在分离的胰岛的血清剥夺培养期间进行处理时,根据本发明的式1的化合物由于强大的线粒体活性氧(ros)清除活性,降低了c-jun n-端激酶、hmgb1(高迁移率族蛋白-1)和促炎性细胞因子(例如白介素-1β、白介素-6和肿瘤坏死因子(tnf)-α)的表达,并且减少了淀粉样蛋白和毒性iapp(胰岛淀粉样多肽)寡聚物的积累。
[0033]
当在胰岛分离或分离的胰岛的血清剥夺培养期间进行处理时,根据本发明的式1的化合物通过如上所述的作用机制有效地保护胰岛,从而显著提高胰岛移植后的糖尿病逆转率。
[0034]
在根据本发明的另一个实施方式中,如果需要的话,本发明的组合物可以进一步包含可药用载体。当在本文中使用时,术语“载体”是指便于化合物在细胞或组织中的给药的材料,并且对其没有特别限制。
[0035]
有利效果
[0036]
本发明的组合物可以通过对胰岛细胞提供出色的保护作用,显著提高胰岛移植的成功率。
附图说明
[0037]
图1示出了在分离期间化合物1对分离的hiapp
/-小鼠胰岛的体外存活率、功能和促炎性细胞因子表达的影响的评估结果。
[0038]
图2示出了在分离期间化合物1对分离的c57bl/6小鼠胰岛的体外存活率、功能和促炎性细胞因子表达的影响的评估结果。
[0039]
图3示出了分离期间化合物1对hiapp
/-小鼠胰岛的移植后体内结果的影响的评估结果。
[0040]
图4示出了在血清剥夺培养期间化合物1对rinm5f细胞和hiapp
/-小鼠胰岛的细胞存活率和其中的ros的影响的评估结果。
[0041]
图5示出了在血清剥夺培养期间化合物1对非人类灵长动物(nhp)胰岛的细胞存活率和其中的ros的影响的评估结果。
[0042]
图6示出了在血清剥夺培养期间化合物1对分离的hiapp
/-小鼠胰岛的体外存活率、功能、促炎性细胞因子表达和寡聚物积累的影响的评估结果。
[0043]
图7示出了在血清剥夺培养期间化合物1对hiapp
/-小鼠胰岛的移植后体内结果的影响的评估结果。
具体实施方式
[0044]
在下文中,将通过制备例和实施例更详细地描述本发明。然而,这些实施例仅仅是说明性的,本发明的范围不限于此。
[0045]
i.实验材料和方法
[0046]
1.化合物
[0047]
(四氢吡喃-4-基)-[2-苯基-5-(1,1-二氧代-硫代吗啉-4-基)甲基-1h-吲哚-7-基]胺(在后文中被称为“化合物1”)按照国际公开号wo2009/025478a1的实施例36中描述的方法来制备。
[0048]
2.实验动物和细胞系
[0049]
胰岛从杂合人类胰岛淀粉样多肽转基因(hiapp
/-)fvb/n小鼠(jackson laboratory,bar harbor,me,usa)、c58bl/6小鼠(orientbio,sungnam,korea)和食蟹猴(macaca fascicularis;orientbio,sungnam,korea)分离。对于另外的体外研究来说,将大鼠胰岛素瘤细胞(rinm5f细胞)在叔丁基过氧化氢(tbhp)暴露或血清剥夺条件下培养期间
用或不用化合物1处理。将rinm5f细胞悬浮在含有100iu/ml青霉素和100μg/ml链霉素的dmem培养基(gibco,grand island,ny,usa)中,并在37℃和完全加湿的5%co2气氛中培养。本研究中的所有实验方案均经三星生物医学研究所机构动物护理和使用委员会(iacuc)批准。
[0050]
3.胰岛分离
[0051]
小鼠胰岛如以前所述从10至12周龄hiapp
/-和c57bl/6小鼠分离。简单来说,将含有或不含20μm化合物1的hank缓冲盐水溶液(hbss,sigma-aldrich,st.louis,mo,usa)中的0.8mg/ml胶原酶p(roche,indianapolis,in,usa)注入到总胆管中用于小鼠胰腺消化。使用ficoll(biochrom,berlin,germany)梯度从所述消化的胰腺纯化胰岛,并用1
×
hbss清洗几次。将分离的胰岛在10ml rpmi 1640(gibco,grand island,ny,usa)中自由漂浮培养。在离体和体内研究之前,将所述培养基用10%热失活fbs(胎牛血清)增补,在37℃和5%co2下温育。
[0052]
4.非人类灵长动物胰岛分离
[0053]
将剖离的非人类灵长动物(nhp)胰腺用冷的liberase mtf c/t溶液(4ml/g胰腺;roche)进行胆管内注射。消化和分离使用如前所述的ricordi自动分离技术来进行。在体外和体内研究之前,将所有分离的nhp胰岛在增补有10%热失活猪血清的cmrl培养基中,在37℃和5%co2温育下培养。
[0054]
5.分离的胰岛的血清剥夺离体培养
[0055]
将纯化的hiapp
/-fvb/n和c57bl/6j小鼠胰岛悬浮在含有100iu/ml青霉素和100μg/ml链霉素的rpmi 1640(gibco,grand island,ny,usa)中,并在37℃和完全加湿的5%co2气氛中培养。将纯化的nhp胰岛悬浮在含有100iu/ml青霉素和100μg/ml链霉素的cmrl1066培养基(corning life sciences,tewksbury,ma;目录号99-663-cv)中,并在37℃和完全加湿的5%co2气氛中培养。在鼠类胰岛的离体培养期间,为使用hiapp
/-fvb/n和c57bl/6j小鼠胰岛的实验指定了三个实验组:增补有10%fbs的培养基(tissue culture biologicals,los alamitos,ca,usa;目录号101;fbs组),增补有0.625%牛血清白蛋白的培养基(qbiogene,carlsbad,ca,usa;目录号bsa003;bsa组),和增补有0、0.1、1、10和20μm化合物1加上0.625%bsa的培养基(bsa 化合物1组)。在使用nhp胰岛的实验中,培养基增补有10%fbs(fbs组)和0-20μm化合物1加上0.625%人血清白蛋白(hsa;greencross,yongin,korea),以确定血清剥夺培养期间用于处理的化合物1的最佳浓度。此外,培养基被增补有10%fbs(fbs组)、20μm化合物1加上10%fbs(fbs 化合物1组)、0.625%人血清白蛋白(hsa;greencross,yongin,korea;hsa组)或20μm化合物1加上0.625%hsa(hsa 化合物1组)。
[0056]
6.通过alamar蓝测定法评估胰岛存活率
[0057]
胰岛的存活率使用alamar蓝染色,按照制造商的方案(invitrogen,grand island,ny,usa)进行评估。简单来说,将从hiapp
/-小鼠分离的胰岛以每孔100个胰岛当量(ie)的密度在24孔板中,用含有10%fbs和0.625%bsa并含有或不含化合物1的rpmi 1640培养。在1天和3天后,直接向每个孔添加10
×
alamar蓝溶液,并将胰岛在避光条件下在37℃温育4小时。使用glomax-multi plus检测系统(promega,fitchburg,wi,usa)在570/585nm(激发/发射)处测量每个孔的荧光强度,并将值针对空白进行归一化。
[0058]
7.吖啶橙/碘化丙啶(ao/pi)测定法
[0059]
在分离和培养后胰岛的存活率使用在吖啶橙(0.67μmol/l)和碘化丙啶(75μmol/l)(ao/pi)染色中的双重荧光来评估,以同时可视化活的和死的胰岛细胞。使用荧光显微镜(nikon eclipse 80i,tokyo,japan)进行荧光成像,并使用nis-element ar 3.0(nikon)对活细胞和死细胞区域进行定量。胰岛存活率(%)被计算为活胰岛细胞/总胰岛细胞
×
100。
[0060]
8.atp测定法
[0061]
胰岛的atp含量通过发光法来测定。将样品与首先在咪唑缓冲液(100mm,ph 7.75)中重构的200μl可商购的含有萤火虫萤光素酶和萤光素的冻干atp监测试剂(atp生物发光测定试剂盒cls ii,roche diagnostics)混合。在照度计(lkb 1250照度计)中测量发射的光。样品中的腺嘌呤核苷酸含量在校正对照(无胰岛或细胞)后确定,并参照以与样品相同的方式处理的atp标准品来计算。
[0062]
9.基于荧光的细胞内自由基检测和脂质过氧化
[0063]
在胰岛分离后和分离的胰岛的离体培养后马上确定hiapp
/-小鼠胰岛中的氧化应激水平。胰岛的氧化应激使用基于荧光的细胞内ros检测法并通过估算脂质过氧化的副产物丙二醛(mda)的浓度来定量。总ros、超氧化物离子和一氧化氮的形成使用活性氧检测试剂盒(enz-51011,enzo life sciences,farmingdale,new york,usa)来确定。ros含量通过dhr123荧光的水平来度量。所述试剂盒按照制造商的方案使用。
[0064]
10.葡萄糖刺激的胰岛素分泌(gsis)测定法
[0065]
在人工挑选并用pbs清洗后,将胰岛接种在直径12-mm的插板孔(merck millipore,billerica,ma,usa)中,每孔10个胰岛,并与kreb-ringer缓冲液(krb:129mm nacl,4.8mm kcl,2.5mm cacl2,1.2mm kh2po4,5mm nahco3,10mm hepes和0.2%bsa)中的60mg/dl葡萄糖在37℃温育90min。在清洗后,将胰岛与300mg/dl葡萄糖-krb温育1小时,然后与60mg/dl葡萄糖-krb继续温育1小时。通过elisa(alpco,salem,nh,usa)和多重化试剂盒(merck millipore)分别测量由小鼠胰岛释放到上清液中的胰岛素。
[0066]
11.rna分离和cdna合成
[0067]
将收获的胰岛用500μl trizol(life technologies,grand island,ny,usa)处理,然后添加100μl氯仿。在4℃温育5分钟后,将所述混合物以12,000rpm离心15分钟,并添加250μl异丙醇以沉淀总rna。将rna沉淀物用75%乙醇洗涤,并用无rna酶水(welgene,daegu,south korea)将rna从沉淀物上洗脱。通过nanodrop(thermo scientific,wilmington,de,usa)和琼脂糖凝胶电泳评估rna纯度。以260/230和260/280的光密度(od)之比计,rna的纯度在1.9至2.0的范围内。使用superscript
tm ii反转录系统(life technologies),按照制造商的方案将总rna反转录,以定量基因的表达。
[0068]
12.实时定量反转录(qrt)-pcr
[0069]
实时qrt-pcr使用基因特异性引物对(表1)来进行。将扩增的pcr产物归一化到从同一样品扩增的β-肌动蛋白pcr产物。将pcr产物在1%琼脂糖凝胶上分离,并使用gel doctm xr仪器(bio-rad,hercules,ca,usa)获得图像。为了定量基因的表达水平,使用sybr预混物试剂盒(takara bio inc.,tokyo,japan)和abi prism 7000(applied biosystems,foster city,ca,usa),按照制造商的方案进行实时pcr。
[0070]
[表1]
[0071][0072]
il-1β:白介素-1β;il-6:白介素-6;tnf-α:肿瘤坏死因子-α;
[0073]
hmgb1:高迁移率族蛋白1
[0074]
13.hiapp
/-胰岛的体内胰岛功能
[0075]
使用边缘块肾包膜下胰岛移植模型来评估hiapp
/-小鼠的体内胰岛功能。为了诱导糖尿病,将180mg/kg链脲佐菌素(stz,sigma-aldrich)给药到8至10周龄hiapp-/-fvb/n小鼠。当两次连续的血糖水平读数高于300mg/dl时,小鼠被认为患有糖尿病。将等量(每位接受者400ieq)的从hiapp
/-小鼠分离的胰岛分配到下述两组:增补有0.625%bsa(bsa组)和0.625%bsa加上化合物1(bsa 化合物1组)的培养基,以评估在离体培养期间化合物1对胰岛质量和功能的综合影响。在培养72小时后,将胰岛移植到糖尿病hiapp-/-小鼠的肾包膜下空间中。使用ricordi算法,通过根据直径对胰岛进行分类,来计算ie数。在胰岛移植后,前2周每周3次,最后2周每周2次测量非空腹血糖水平。
[0076]
14.组织学分析
[0077]
移植后4周,取出小鼠肾上的移植部位并包埋在石蜡中。下面简要解释免疫组织化学染色。在脱石蜡后,将4-μm组织切片用多克隆豚鼠抗胰岛素(1:1000,a0546,dako,denmark)、胰高血糖素(1:500,ab92517,abcam,united kingdom)和淀粉样蛋白(1:2500,#44
–
344,invitrogen)抗体染色。使用具有
×
10/22数值孔径和
×
40/0.75数值孔径物镜的olympus bx40光学显微镜(olympus,japan)观察染色的载片。使用数码相机(olympus dp50)采集照片图像,并使用image-pro plus 5.1软件进行分析。
[0078]
对于dab标记的β-细胞的定量来说,将所有载片在vectra 3.0自动定量病理学成像系统上以10
×
成像,并使用inform软件(均来自于perkin-elmer,waltham,ma,usa)进行分析。对移植的肾组织切片进行扫描以获取图像,然后为了设置移植组织分割,通过实例学习界面检查移植胰岛细胞的大量代表性区域和将要排除在分析之外的区域例如肾组织。对于β-细胞分割来说,使用光谱库来鉴定移植组织内苏木精染色的细胞核和dab染色的细胞质(β-细胞)。使用这些训练集,验证了仅用于鉴定移植组织中dab染色的细胞的算法。分析所有捕获的10
×
图像,并对dab染色的移植β-细胞进行计数。
[0079]
15.hiapp寡聚物积累的评估
[0080]
hiapp寡聚物的积累使用用a11 ab(抗寡聚物抗体,invitrogen)和胰岛素抗体(dako)染色的hiapp
/-小鼠胰岛切片来评估。将胰岛用10%正常驴血清阻断,并与兔抗寡聚
物第一抗体(1:100)温育。将胰岛清洗,并与cy3偶联的抗兔第二抗体温育1小时。在清洗后,将切片用豚鼠抗胰岛素第一抗体(1:500;dako)、然后用alexa fluor 488抗豚鼠第二抗体(1:200;jackson immunoresearch laboratories)染色。在用4’,6-二脒基-2-苯基吲哚(dapi)复染后,将切片装片。为了定量每个胰岛的hiapp寡聚物的积累,使用共聚焦显微镜确定总dapi 胰岛细胞中a11染色的细胞的比例。
[0081]
16.淀粉样蛋白积累的评估
[0082]
将肾包膜下的胰岛移植物的切片,在0.5%硫代黄素s染色(sigma)后检查胰岛淀粉样蛋白,并使用豚鼠抗胰岛素抗体(1:500;dako,carpenteria,ca)然后是cy3偶联的抗豚鼠第二抗体(1:200;jackson immunoresearch laboratories,west grove,pa)进行胰岛素免疫染色以检查β-细胞。在用dapi染色后将切片装片。为了定量每个切片的淀粉样蛋白积累,使用共聚焦显微镜确定总胰岛移植物部位(绿色 红色 蓝色部分)中硫代黄素s染色的细胞(绿色)的百分比例。图的原始放大倍数是100
×
。
[0083]
17.统计分析
[0084]
视情况而定,结果被表示为平均值
±
标准偏差(sd)或中位数和四分位间距。视情况而定,连续变量使用学生t-检验、单向方差分析(anova)或mann
–
whitney u检验来比较。纵向数据使用graphpad prism 5(graphpad software,la jolla,ca,usa)通过双向anova和bonferroni事后检验来分析。p值《0.05被接受为比较具有统计显著性。
[0085]
ii.结果
[0086]
1.在胰岛分离期间针对氧化应激和促炎性反应的保护作用
[0087]
为了评估在胰岛分离期间化合物1的作用,在增补和未增补20μm化合物1的情况下通过胶原酶从hiapp
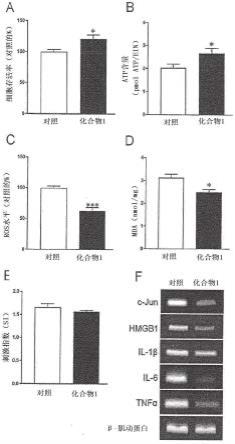
/-fvb/n小鼠分离胰岛。与未处理组相比,在化合物1处理组中通过alamar蓝测定法评估的相对离体细胞存活率显著提高(图1a)。此外,与化合物1未处理组相比,在胰岛分离期间化合物1处理呈现出显著升高的atp水平(图1b)。此外,与未用化合物1处理的对照胰岛相比,用化合物1处理的胰岛中ros含量和氧化应激水平明显降低(图1c和1d)。在葡萄糖刺激的胰岛素分泌(gsis)测定法中获得的呈现了体外胰岛功能的刺激指数,在两个组之间显示出可比的值(图1e)。接下来,我们还检查了在增补和未增补化合物1的分离后,培养基中c-jun n-端激酶和高迁移率族蛋白-1(hmgb1)以及包括白介素(il)-1β、il-6和肿瘤坏死因子(tnf)-α在内的促炎性细胞因子的转录表达。与未处理组相比,在化合物1处理组中这些转录表达水平显著降低(图1f)。这些结果在野生型c57bl/6小鼠胰岛中得到重复(图2)。
[0088]
2.对改善移植后结果的作用
[0089]
为了检查胰岛分离期间增补化合物1的体内作用,将在增补或未增补化合物1的情况下分离的胰岛的边缘块移植到链脲佐菌素(stz)诱导的糖尿病hiapp-/-fvb/n小鼠的肾包膜下空间中(图3a)。与未处理组相比,化合物1处理组的移植后葡萄糖水平明显更低,并且在化合物1处理组中移植的肾的移除证实了高血糖症的重新获得(图3b)。与对照组相比,化合物1组在糖尿病逆转率和腹膜内葡萄糖耐量试验(ipgtt)期间的葡萄糖水平方面表现出更好的移植后结果(图3c、3d和3e)。与对照组相比,化合物1组在移植组织中呈现出更大比例的胰岛素阳性区域(图3f)。
[0090]
3.在血清剥夺培养期间hiapp
/-转基因小鼠和nhp胰岛的保护
[0091]
我们检查了在血清剥夺条件下化合物1的增补对叔丁基过氧化氢(tbhp)暴露或胰岛培养的影响。尽管暴露到tbhp的rinm5f细胞表现出ldh释放和ros形成,但在增补化合物1后细胞毒性和ros含量显著降低(图4a和4b)。大鼠胰岛素瘤细胞(rinm5f细胞)和来自于hiapp
/-fvb/n小鼠的胰岛的相对细胞存活率从0.1μm至20μm通过剂量依赖性方式显著改善血清剥夺诱导的细胞毒性(图4c和4d)。在rinm5f细胞和来自于hiapp
/-fvb/n小鼠的胰岛中,在血清剥夺培养条件下用化合物1增补培养基也从0.1μm至20μm通过剂量依赖性方式减少血清剥夺诱导的ros(图4e和4f)。在nhp胰岛中观察到相似的结果(图5a、5b和5c)。
[0092]
图6a示出了通过ao/pi染色评估的在增补或不增补化合物1的血清剥夺培养期间hiapp
/-fvb/n小鼠胰岛的细胞存活率。与fbs处理的胰岛相比,使用bsa培养72小时的胰岛经历了更多的细胞死亡,显示出红色pi阳性细胞的阳性率和受损的细胞存活率被化合物1的增补显著改善(图6a和6b)。与bsa组中相比,在bsa 化合物1组中离体培养1天和3天后tnf-α、il-1β、il-6、c-jun和hmgb1的转录本水平显著减弱(图6c和6d)。为了评估胰岛的功能,在来自于hiapp
/-小鼠的胰岛中,当在血清剥夺培养条件下向培养基添加化合物1时观察到显著提高的刺激指数(图6e)。在血清剥夺培养条件下在含有和不含化合物1的培养基中培养72小时后,与bsa组相比,在bsa 化合物1组中hiapp
/-胰岛中hiapp寡聚物的积累比例显著降低(图6f)。
[0093]
4.移植后血糖结果和移植胰岛淀粉样蛋白积累的改善
[0094]
我们调查了在血清剥夺培养期间用化合物1增补培养基是否在体内小鼠模型中改善移植后结果。将来自于hiapp
/-fvb/n小鼠的胰岛的边缘块在增补和不增补化合物1的情况下培养72小时,并移植到stz诱导的糖尿病hiapp-/-fvb/n小鼠的肾下包膜下(图7a)。化合物1组表现出明显更好的移植后结果,包括移植后葡萄糖水平、糖尿病逆转率以及ipgtt期间的葡萄糖水平和葡萄糖的auc(图7b、7c、7d和7e)。在化合物1组中,移植组织中的胰岛素阳性区域大于对照组中的比例(图7f)。此外,与对照组相比,来自于化合物1组的胰岛移植物切片中淀粉样蛋白的积累比例显著降低(图7g)。
[0095]
iii.讨论
[0096]
在胰岛分离期间化合物1的增补导致体外胰岛细胞存活率的提高以及氧化应激、活性氧(ros)含量和c-jun、hmgb1和促炎性细胞因子表达的减弱。此外,体内研究证实了通过在胰岛分离期间用化合物1处理改进了移植后结果。
[0097]
此外,化合物1针对血清剥夺诱导的体外胰岛存活率的损害提供保护。更重要的是,在血清剥夺培养期间用化合物1增补培养基显著减少了淀粉样蛋白以及毒性iapp寡聚物的积累,并改善体内胰岛移植物功能。
[0098]
从这些结果,可以确认在胰岛移植过程中在胰岛分离以及血清剥夺培养期间增补化合物1具有有利的效果。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。