1.本发明涉及蛋白质组学技术领域,具体而言,涉及一种富集和测试酪氨酸磷酸化肽段的方法。
背景技术:
2.生物体主要用磷酸化修饰作为一种开关来控制重要蛋白的活性,负责重要细胞功能的蛋白质分别使用激酶诱导的磷酸化和磷酸酶诱导的去磷酸化来激活和失活。位点特异性磷酸化会导致蛋白质的构象或结合特性发生变化,这些蛋白质控制其细胞功能的基本特征,例如酶活性、亚细胞定位或稳定性。到目前为止,磷酸化位点或磷酸酶的一些突变已被认为是导致癌症的原因和结果。蛋白激酶是阻断磷酸化和治疗癌症的最有前途的靶点。不仅是肿瘤领域,在免疫系统疾病和神经退行性疾病中也起到重要的作用。所以蛋白质磷酸化层次上的检测显得尤其重要。
3.传统的的磷酸化肽段富集方法有western blot,固定金属离子亲和色谱(immobilized metal affinity chromatography,imac),金属氧化物亲和色谱(metal oxide affinity chromatography,moac),以及免疫共沉淀方法(co-immunoprecipitation,co-ip)等。western blot制备特异性磷酸化抗体较难,而且对于可鉴定的特异性位点的个数有很大的限制,除此之外,鉴定结果会受样品处理过程以及在凝胶电泳中上样的误差影响。固定金属离子亲和色谱等方法的分离柱效较低,在处理前需对样本进行脱盐,进一步加重了损失,导致鉴定数目降低,通量也有限。免疫共沉淀方法专用特异性抗体较昂贵,只能鉴定已知磷酸化蛋白,而且对于低丰度的磷酸化蛋白结果不好。
4.基于sh2超亲体(sh2-superbinder)的磷酸化蛋白质组学技术是通过对sh2结构域进行选择性突变,导致对磷酸化酪氨酸的捕获力提升1000倍,并且具有特异性。但是以往提出的基于sh2-superbinder的酪氨酸磷酸化富集方法结果重现性以及富集效率并不理想。
技术实现要素:
5.本发明的第一目的在于提供一种富集酪氨酸磷酸化肽段的方法,包括:
6.a)将肽段混合样品与偶联有sh2-superbinder的固相共孵育以使得其中的酪氨酸磷酸化肽段与固相结合;
7.其中,孵育体系中添加有蛋白酶抑制剂,所述蛋白酶抑制剂选自pmsf、aprotinin以及aebsf中的一种或多种;
8.b)清洗所述固相,并将所述酪氨酸磷酸化肽段从所述固相上分离。
9.本发明的第二目的在于提供一种测试酪氨酸磷酸化肽段的方法,包括:
10.采用如上所述的方法富集酪氨酸磷酸化肽段;和
11.鉴定分离的酪氨酸磷酸化肽段。
12.现有技术中,基于sh2-superbinder的酪氨酸磷酸化肽段检测技术并不额外添加蛋白酶抑制剂。发明人意外的发现,在sh2-superbinder富集酪氨酸磷酸化肽段时,添加特
定的蛋白酶抑制剂,能有效提升磷酸化酪氨酸肽段鉴定数,提高检测的通量和准确性。
附图说明
13.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
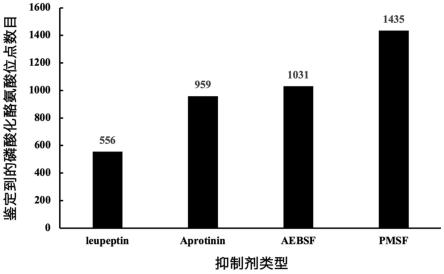
14.图1为本发明一个实施例所提供的不同蛋白酶抑制剂鉴定的ptyr数目。
具体实施方式
15.现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
16.除非另有说明,用于披露本发明的所有术语(包括技术和科学术语)的意义与本发明所属领域普通技术人员所通常理解的相同。通过进一步的指导,随后的定义用于更好地理解本发明的教导。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
17.本文所使用的术语“和/或”、“或/和”、“及/或”的选择范围包括两个或两个以上相关所列项目中任一个项目,也包括相关所列项目的任意的和所有的组合,所述任意的和所有的组合包括任意的两个相关所列项目、任意的更多个相关所列项目、或者全部相关所列项目的组合。需要说明的是,当用至少两个选自“和/或”、“或/和”、“及/或”的连词组合连接至少三个项目时,应当理解,在本技术中,该技术方案毫无疑问地包括均用“逻辑与”连接的技术方案,还毫无疑问地包括均用“逻辑或”连接的技术方案。比如,“a及/或b”包括a、b和a b三种并列方案。又比如,“a,及/或,b,及/或,c,及/或,d”的技术方案,包括a、b、c、d中任一项(也即均用“逻辑或”连接的技术方案),也包括a、b、c、d的任意的和所有的组合,也即包括a、b、c、d中任两项或任三项的组合,还包括a、b、c、d的四项组合(也即均用“逻辑与”连接的技术方案)。
18.本发明中所使用的术语“含有”、“包含”和“包括”是同义词,其是包容性或开放式的,不排除额外的、未被引述的成员、元素或方法步骤。
19.本发明中用端点表示的数值范围包括该范围内所包含的所有数值及分数,以及所引述的端点。
20.本发明中涉及浓度数值,其含义包括在一定范围内的波动。比如,可以在相应的精度范围内波动。比如2%,可以允许
±
0.1%范围内波动。对于数值较大或无需过于精细控制的数值,还允许其含义包括更大波动。比如100mm,可以允许
±
1%、
±
2%、
±
5%等范围内的波动。涉及分子量,允许其含义包括
±
10%的波动。
21.本发明中,涉及“多个”、“多种”等描述,如无特别限定,指在数量上指大于等于2。
22.本发明中,以开放式描述的技术特征中,包括所列举特征组成的封闭式技术方案,也包括包含所列举特征的开放式技术方案。
23.本发明中,“优选”、“更好”、“更佳”、“为宜”仅为描述效果更好的实施方式或实施例,应当理解,并不构成对本发明保护范围的限制。本发明中,“可选地”、“可选的”、“可选”,指可有可无,也即指选自“有”或“无”两种并列方案中的任一种。如果一个技术方案中出现多处“可选”,如无特别说明,且无矛盾之处或相互制约关系,则每项“可选”各自独立。
24.本文所用术语“肽”或“多肽”定义为氨基酸残基链,其通过肽键结合并且通常具有限定序列。本文所用术语“肽”或“多肽”可以(但不必然)指不具有任何n末端和/或c末端氨基酸残基的氨基酸残基链。也就是,本文所用“肽”或“多肽”可以指嵌入更长氨基酸链的氨基酸链。本文所用术语“肽”包括术语“多肽”、“肽”和“蛋白质”。
[0025]“肽段混合样品”指包含多种如上所定义的肽的混合物。其来源可以是需要获得蛋白质酪氨酸磷酸化的概况的任何样品,所述蛋白质酪氨酸磷酸化的概况包括蛋白质激酶活性或免疫受体磷酸酪氨酸信号传导的概况。因此,样品可以是包含生物材料的任何样品,并且其包含或怀疑包含活性蛋白质激酶或由活性蛋白质激酶修饰的肽(如含ptyr的肽),包括在激酶(如激酶活化环)内,在磷酸酶调节区内,在itrm内,和在激酶和磷酸酶下游靶标内。样品可以包括但不限于:建立的细胞系;细胞培养物,包括原代细胞培养物;生物流体,如血清、血浆、尿或血液;组织样品;或组织提取物。样品可以是人或非人源的,或者可以包含人或非人蛋白质激酶活性或人或非人的含ptyr的肽。肽段混合样品可通过公知的方法获得,例如将蛋白质通过酶(如胰酶等)酶解后所得产物。
[0026]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。除非和本技术的发明目的和/或技术方案相冲突,否则,本发明涉及的引用文献以全部内容、全部目的被引用。本发明中涉及引用文献时,相关技术特征、术语、名词、短语等在引用文献中的定义也一并被引用。本发明中涉及引用文献时,被引用的相关技术特征的举例、优选方式也可作为参考纳入本技术中,但以能够实施本发明为限。应当理解,当引用内容与本技术中的描述相冲突时,以本技术为准或者适应性地根据本技术的描述进行修正。
[0027]
本发明涉及一种富集酪氨酸磷酸化肽段的方法,包括:
[0028]
a)将肽段混合样品与偶联有sh2-superbinder的固相共孵育以使得其中的酪氨酸磷酸化肽段与固相结合;
[0029]
其中,孵育体系中添加有蛋白酶抑制剂,所述蛋白酶抑制剂选自pmsf、aprotinin以及aebsf中的一种或多种;
[0030]
b)清洗所述固相,并将所述酪氨酸磷酸化肽段从所述固相上分离。
[0031]
传统的磷酸化酪氨酸富集方法与其他富集方法(比如western blot,imac,moac,ip)相比,本身可鉴定到的磷酸化酪氨酸数目有着数量级的差别,尤其基于质谱dda模式的采集,使偶然性增加,所以往往会使得本领域技术人员忽略未去除的酶(如胰蛋白酶等)对鉴定数量的影响。经发明人分析,本发明的原理很可能是蛋白酶抑制剂有效的抑制了传统流程中残留胰蛋白酶,进而在富集过程中可保护连接在固相上的sh2-superbinder蛋白不被胰蛋白酶切掉,增加了磷酸化酪氨酸肽段的结合点个数,提高富集效率,进一步提升了不同实验批次的可重复性。
[0032]
本发明中,“sh2-superbinder”亦称之为“sh2超结合体”或“sh2超亲体”,现有技术中已知的sh2-superbinder均可以用于本发明。其可以是哺乳动物sh2结构域的变体,并且
可以是src、grb2或fyn sh2结构域的变体。sh2超结合体可以是三突变型sh2变体,或者可以是四突变型sh2变体。sh2-superbinder可以被修饰,例如带有标签蛋白等。sh2超结合体可以包含于融合蛋白内,所述融合蛋白包含一个或多个其他sh2超结合体。在一些实施方式中,sh2-superbinder包括来自人蛋白质src、grb2和fyn的单、双、三或四突变型sh2结构域。sh2-superbinder可以包括美国专利申请号14/388,592中所鉴定的其他变体sh2结构域,所述美国专利申请通过引用全部纳入本文。
[0033]
在一些实施方式中,所述蛋白酶抑制剂为1mm~5mm的pmsf,也可以选择2mm、3mm、4mm。
[0034]
在一些实施方式中,所述蛋白酶抑制剂为0.5μg/ml~2μg/ml的aprotinin,也可以选择1μg/ml、1.5μg/ml。
[0035]
在一些实施方式中,所述蛋白酶抑制剂为0.5mg/ml~2mg/ml的aebsf,也可以选择1mg/ml、1.5mg/ml。
[0036]
若非特别说明,蛋白酶抑制剂的浓度均指其工作浓度。
[0037]
在一些实施方式中,所述肽段混合样品经过酪氨酸磷酸酶抑制剂预处理。酪氨酸磷酸酶抑制剂优选为过矾酸钠。
[0038]
本发明所用术语“固相”指代并且包括能够结合本文所公开的亲和力试剂的任何支持物。熟知的支持物或运载体包括玻璃、聚苯乙烯、聚丙烯、聚乙烯、葡聚糖、尼龙、淀粉酶、天然和改性纤维素、琼脂糖、聚丙烯酰胺和磁铁矿。支持物材料实际上可以具有任何结构构造,只要偶联的亲和力试剂能够结合肽和/或蛋白质。因此,支持物构造可以是球形的,如珠,或圆柱形,如在试管的内表面中,或杆的外表面。或者,该表面可以是平面,例如片层,测试条等。固体支持物可以是琼脂糖或聚苯乙烯珠。本领域技术人员将知晓用于结合亲和力试剂的许多其它合适的运载体,或将能够采用常规实验确定此类载体。在一些实施方式中,所述固相为琼脂糖微球。微球的粒径范围优选为0.1μm~1mm,例如0.1μm、0.5μm、1μm、2μm、5μm、10μm、20μm、50μm、100μm、500μm、700μm。
[0039]
在一些实施方式中,所述将所述酪氨酸磷酸化肽段从所述固相上分离所用洗脱液为0.3v/v%~0.7v/v%的三氟乙酸溶液,例如0.4v/v%、0.5v/v%、0.6v/v%的三氟乙酸溶液。
[0040]
在一些实施方式中,步骤b)中,所述清洗包括使用200mm~300mm钠离子清洗的步骤;优选钠离子以氯化钠的形式添加。
[0041]
在一些实施方式中,其还包括脱盐步骤。
[0042]
在一些实施方式中,所述脱盐采用十八烷基的强疏水作用进行处理脱盐。具体可以采用c18脱盐柱/板。
[0043]
根据本发明的再一方面,还涉及一种测试酪氨酸磷酸化肽段的方法,包括:
[0044]
采用如上所述的方法富集酪氨酸磷酸化肽段;和
[0045]
鉴定分离的酪氨酸磷酸化肽段。
[0046]
在一些实施方式中,所述的方法还包括对所述分离的酪氨酸磷酸化肽段定量。
[0047]
在一些实施方式中,所述鉴定或所述定量的方法包括质谱技术。
[0048]
质谱技术可以包括例如多重反应监测(mrm)、选择性反应监测(srm)或平行反应监测(prm)技术。
[0049]
下面将结合实施例对本发明的实施方案进行详细描述。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,优先参考本发明中给出的指引,还可以按照本领域的实验手册或常规条件,还可以参考本领域已知的其它实验方法,或者按照制造厂商所建议的条件。
[0050]
下述的具体实施例中,涉及原料组分的量度参数,如无特别说明,可能存在称量精度范围内的细微偏差。涉及温度和时间参数,允许仪器测试精度或操作精度导致的可接受的偏差。
[0051]
实施例中所采用的实验材料如下:
[0052]
试剂:
[0053]
a.100mm苯甲基磺酰氟(pmsf,工作浓度2mm,溶于异丙醇),厂家:碧云天beyotime
[0054]
b.iap buffer(自配试剂,配方为:ph 7.6,50mm tris-hcl,50mm nacl,10mm nah2po4)
[0055]
c.50mm碳酸氢铵水溶液
[0056]
d.0.5%三氟乙酸
[0057]
e.乙腈
[0058]
f.0.1%甲酸水溶液
[0059]
g.50%乙腈,0.1%甲酸水溶液
[0060]
h.高盐清洗液(自配试剂,配方为:ph 7.6,50mm tris-hcl,250mm nacl)
[0061]
仪器/耗材:
[0062]
四维混合仪(其林贝尔),移液器(eppendorf),离心机(eppendorf),真空浓缩仪(eppendorf),c18脱盐柱子(waters)
[0063]
实施例1
[0064]
本实施例提供了对来源于人肿瘤细胞的多肽进行磷酸化酪氨酸富集的案例。
[0065]
实验样本:所检测的对象为过矾酸钠处理10分钟的人源h520肿瘤细胞多肽,所述人源h520肿瘤细胞多肽根据基于sh2-superbinder的酪氨酸磷酸化富集方法中的前处理操作所得。
[0066]
取200μg过矾酸钠处理10分钟的人源h520肿瘤细胞多肽,然后按照如下技术方案进行磷酸化酪氨酸富集。浓度测定所用试剂盒为thermo公司的bca试剂盒,货号为23225。
[0067]
1)向准备好的200μg多肽干粉中加入735μl iap溶解多肽干粉,低速涡旋,超声仪30min,使多肽完全溶解。
[0068]
2)在超声溶解样本的时候清洗制备好的带有sh2-superbinder蛋白琼脂糖微球agarose beads,将原保存管中的beads制备成40%混悬液,按样本所需取beads(n 1),1500g离心5min离心去上清。
[0069]
3)加入1ml iap缓冲液清洗,翻转混匀2分钟,1500g离心5min,弃上清,清洗三次。
[0070]
4)用iap将beads重新制备成40%混悬液,吹吸混匀。
[0071]
5)每个样本中加入15μl 100mm pmsf。
[0072]
6)吸取150μl带有sh2-superbinder蛋白琼脂糖微球agarose beads(40%混悬液)加入到样品中,室温翻转混匀1小时。
[0073]
7)离心机rcf模式下,数字1500g离心5分钟,弃上清。
[0074]
8)向底部beads沉淀中加入1ml高盐清洗液,室温翻转混匀2分钟,离心机rcf模式下,数字1500g离心5分钟,弃上清。
[0075]
9)重复步骤8)一次。
[0076]
10)加入1ml 50mm碳酸氢铵水溶液,室温翻转混匀2分钟,离心机rcf模式下,数字1500g离心5分钟,弃上清。
[0077]
11)重复步骤10)一次。
[0078]
12)洗脱:加入200μl 0.5%三氟乙酸,孵育5min,离心机rcf模式下,数字1500g离心5分钟,转移上清至新管,标记清楚,此步骤重复3次。
[0079]
13)准备c18脱盐柱。
[0080]
14)向c18脱盐柱中加入100μl乙腈,离心机rcf模式下,数字1500g离心1分钟,倾倒掉滤液
[0081]
15)向c18脱盐柱中加入100μl 50%乙腈(0.1%甲酸水溶液),离心机rcf模式下,数字3000g离心1分钟,倾倒掉滤液
[0082]
16)向c18脱盐柱中加入100μl 0.1%甲酸水溶液,离心机rcf模式下,数字3000g离心1分钟,倾倒掉滤液
[0083]
17)向c18脱盐柱中加入步骤12)中的洗脱后样本,离心机rcf模式下,数字1500g离心3分钟,倾倒掉滤液
[0084]
18)向c18脱盐柱中加入100μl 0.1%甲酸水溶液,离心机rcf模式下,数字3000g离心1分钟,倾倒掉滤液
[0085]
19)洗脱:向c18脱盐柱中加入100μl 50%乙腈(0.1%甲酸水溶液),离心机rcf模式下,数字1500g离心3分钟,倾倒掉滤液
[0086]
20)将样本开盖放入真空浓缩仪中,设置界面:v-aq,45℃,进行浓缩
[0087]
21)将得到的肽段溶液抽干,复溶后按照实施例二的方法进行液相联用串联质谱进行dda检测(lc-ms/ms),即可得到鉴定和定量结果。
[0088]
实施例2
[0089]
本实施例进一步提供了一种对于经过磷酸化酪氨酸富集后的肽段进行定量检测的方法。以实施例1所富集到的肽段干粉为例,按照如下方法进行检测:
[0090]
所得到的肽段使用液相联用串联质谱进行检测,其中液相色谱仪采用的是thermo ultimate 3000系列型号,质谱仪是thermo scientific公司orbitrap exploris 480型号。
[0091]
做3个技术重复,每个重复注射1针,每针跑2个小时,总检测时长为6小时。
[0092]
质谱主要参数为:
[0093]
离子源电压设置为2.1kv;一级质谱扫描范围400~1200m/z;分辨率设置为60,000;二级质谱dda采集模式循环时间为3s。离子碎裂模式为高能碰撞解离模式(hcd),碎片离子在orbitrap中进行检测。动态排除时间设定为30s。agc设置为:一级3e6,二级1e5。
[0094]
质谱数据分析所用软件为proteome discoverer 2.5,搜索鉴定主要参数:数据库为swissprot的homo蛋白数据库;一级质谱质量误差范围10ppm;二级质谱质量误差范围0.02da;固定修饰为“carbamidomethyl(c)”;可变修饰为“oxidation(m),acetyl(n-terminus),phosphorylation(y)”,酶切方式trypsin,最大允许漏切数为2。
[0095]
实施例3
[0096]
在癌症磷酸化蛋白质组学研究领域中,磷酸化酪氨酸鉴定数目的提升是整个组学的基础,例如通过提高鉴定数目,可以在靶点发现、靶点鉴定、药物重定位、生物标志物发现等方面全面助力精准医疗的新药研发。所以针对磷酸化酪氨酸富集方法的改进对于整个磷酸化蛋白组学具有很重要的意义。
[0097]
因此,发明人在实验过程中,研究了不同的蛋白酶抑制剂对于磷酸化酪氨酸肽段鉴定数的影响。具体实验过程按照与实施例一相同的方法进行操作,区别仅在于,通过调整富集过程中不同的蛋白酶抑制剂,同时统计肽段鉴定数。
[0098]
分组如下:
[0099]
对照组
[0100]
与实施例1相比,区别在于,没有添加蛋白酶抑制剂,使用传统的富集方法进行富集。然后按照实施例二相同的方法,对提取的肽段进行鉴定。
[0101]
结果表明(如表1),磷酸化酪氨酸肽段鉴定数为859。
[0102]
实验组
[0103]
实验组1-1
[0104]
与实施例1相比,区别在于,所用到的蛋白酶抑制剂为:亮抑蛋白酶肽(leupeptin,工作浓度0.5μg/ml,溶于水),厂家:selleck.cn。然后按照实施例二相同的方法,对提取的肽段进行鉴定。
[0105]
实验组1-2
[0106]
与实施例1相比,区别在于,所用到的蛋白酶抑制剂为:胰蛋白酶抑制剂(aprotinin,工作浓度1μg/ml,溶于水),厂家:sigma。然后按照实施例二相同的方法,对提取的肽段进行鉴定。
[0107]
实验组1-3
[0108]
与实施例1相比,区别在于,所用到的蛋白酶抑制剂为:氨基乙基苯磺酰氟(aebsf,1mg/ml,溶于水),厂家:罗氏roche,sc。然后按照实施例2相同的方法,对提取的肽段进行鉴定。
[0109]
对实施例1的样本与实验组1进行检测的结果如表1所示:
[0110][0111][0112]
表1中,磷酸化酪氨酸肽段数量指的是通过两种富集方法,鉴定出来的分子量不同的含有磷酸化酪氨酸的多肽的数量。磷酸化酪氨酸位点数目指的是通过两种富集方法,鉴定出来的不同位置的磷酸化酪氨酸的个数。同表1的结果可以看出,通过本发明实施例的方法鉴定的磷酸化酪氨酸肽段数量为1435,磷酸化酪氨酸位点数目为1094,用时6小时。而且操作简易,在相同的进样时间内,所得磷酸化酪氨酸肽段鉴定效果至少提升了60%。
[0113]
对各组样本进行检测的结果如图1所示。其中,leupeptin效果较差,甚至相比对照
组还略有降低。aprotinin、aebsf和pmsf表现较好。aprotinin属于酶类物质,溶于水中,不能反复冻融;aebsf毒性较pmsf低,但对于磷酸化肽段鉴定数目的提高幅度并不显著;整体而言,使用100mm苯甲基磺酰氟(pmsf,工作浓度2mm,溶于异丙醇,厂家:碧云天beyotime)蛋白酶抑制剂,鉴定到的磷酸化酪氨酸肽段鉴定数目是最多的,效果最好。
[0114]
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准,说明书及附图可以用于解释权利要求的内容。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。