1.本发明涉及生态毒理学技术领域,特别涉及一种海洋贻贝消化腺组织病理损伤的定量方法。
背景技术:
2.贻贝广泛分布在从淡水到海洋,从浅海到深海的各种生境。贻贝进行滤食活动,代谢率低,对污染物具有很强的富集能力,可以较好的反映水体的污染情况,因此被认为是海洋中理想的环境检测生物之一,其组织病理变化也可以指示生物损害与海洋环境健康状况。
3.贻贝组织病理指标是一类对外源胁迫敏感和可靠的生物标志。目前,贻贝组织病理指标应用较多的为组织定性和半定量指标,它们虽能显示生物组织的结构变化,但是由于是对病理图像的主观评价,容易产生误差,可信度不高。组织病理的定量指标能够给出具体的量化数据,受主观经验干扰少,是对病理图像的客观评价。
4.但目前关于贻贝的定量指标的研究少且不全面,其中已报道的相关研究中存在以下不足:利用消化腺管腔面积、周长等定量指标对贻贝进行健康评估,其在定量过程中需要临摹消化管,而在实际工作中,每个生物样本需要统计上百个消化管,工作量巨大、耗时长、不便于推广。
技术实现要素:
5.本发明的目的在于提供一种海洋贻贝消化腺组织病理损伤的定量方法,避免人为操作造成的结构损伤并且可以得出具体的、受主观经验干扰少得量化数据,对贻贝组织病理图像客观评价,可信度高,较好反映贻贝消化腺的损伤程度,进而评估贻贝的健康状态,暗示周围环境对于贻贝带来影响;此外该方法与贻贝组织健康状态直接相关,并容易测量,便于推广,客观评价病理图像,应用价值高。
6.本发明解决其技术问题所采用的技术方案是:一种海洋贻贝消化腺组织病理损伤的定量方法,包括以下步骤:(1)组织切片:按照标准贻贝组织生理切片操作进行,包括:贻贝的培养,贻贝组织解剖与固定,组织脱水与透明化,组织包埋与透明化,切片、摊片与烤片,he染色与封片,最终获得切片;(2)显微观察:用光学显微镜使用100
×
和400
×
两个不同倍数观察每张切片,检查合格后,对每张切片随机拍照获取至少100个消化腺细胞照片,获得消化腺数字图像,用于后续组织病理学分析;检查合格即检查在切片过程中没有出现明显气泡、折叠及其他问题(3)定量指标:以海洋贻贝消化腺管腔壁厚度作为海洋贻贝消化腺组织病理损伤定量检测指标,以正常海洋贻贝消化腺数字图像作为对照组进行定量测定,定量测定的方法为:将消化腺数字图像导入到图像软件处理,在图像软件中测量消化管壁厚,获得每张切
32
‰
的人工海水中驯化培养,使其适应实验室培养条件,每天更换人工海水,换水一小时后喂食足够量的球等鞭金藻(isochrysis galbana)。
18.优选地,实验室培养条件为:溶解氧:80%左右,ph:7.8左右,温度:15℃左右,培养光暗比为12h:12h。
19.(2)组织解剖与固定:首先解剖海洋贻贝,获得3-4 mm大小的贻贝消化腺组织样品,放入包埋盒中开展铺开,再将其浸泡再10%福尔马林溶液中进行固定超过48小时,甲醛能与蛋白质氨基结合,使蛋白质凝固,从而保证组织细胞维持原本形态结构。
20.(3)脱水与透明化:借助不同浓度的乙醇处理,对固定的组织样本进行脱水;再使用透明剂二甲苯处理置换出组织内的乙醇,因为二甲苯处理后的组织块呈半透明状,因此二甲苯置换乙醇的过程称为透明化。
21.优选地,所述不同浓度乙醇处理条件为:在70%乙醇溶液中浸泡过夜;将其转移至90%乙醇溶液中浸泡2h;再转移至无水乙醇溶液中浸泡2h;再转移至新无水乙醇溶液中浸泡2h;最后转移至新无水乙醇溶液中浸泡过夜。
22.更优选地,所述二甲苯处理条件为:在二甲苯中浸泡1h;将其转移至新二甲苯中浸泡0.5h;再将其转移至新二甲苯中浸泡0.5h。
23.(4)浸泡与包埋:组织经过透明后,需要在石蜡液体中浸渍处理,使石蜡完全置换出组织内的二甲苯后方可进行包埋。在进行石蜡包埋时,先将熔化的石蜡倒入包埋模具中,随后夹起浸蜡后的组织块平整放置于包埋模具底部的中央位置。将模具放置在冷冻台,加速石蜡凝固,完成包埋。
24.优选的,所述石蜡液体浸渍处理条件为:在65℃石蜡液体中浸渍1h;然后将其转移至65℃石蜡液体中浸渍0.5h。
25.(5)切片、摊片与烤片:使用切片机将组织石蜡块切成8 μm的切片。用镊子轻轻夹住组织切片,平铺于45℃水面,待切片完全展开后用提前标记好的载玻片将其尽量放在载玻片中央处捞起。斜置载玻片,使水分充分流下后在65℃下进行烤片,直至石蜡熔化,组织牢固附着于载玻片上。
26.(6)he染色和封片:he染色主要步骤包括脱蜡、至水、苏木精染色、分化反蓝、伊红染色、脱水和透明化。
27.(6-1)脱蜡:将(5)中固着组织的载玻片在二甲苯中浸泡2min,然后转移至新二甲苯中浸泡2min,洗脱组织切片中的石蜡。
28.(6-2)至水:将(6-1)中处理好的固着组织的载玻片通过梯度乙醇处理,使水分进入组织。
29.优选的,所述梯度乙醇处理方法为:在无水乙醇中浸泡2min;将其转移至新无水乙醇中浸泡2min;将其转移至90%乙醇中浸泡2min;再将其转移至70%乙醇中浸泡2min,最后将其转移至50%乙醇中浸泡25min。
30.(6-3)苏木精染色:将(6-2)中处理好的固着组织的载玻片在苏木精中浸泡,对组织中的核酸等噬碱性物质进行染色,之后将其在纯水中浸泡5min,洗去载玻片上多余的染料。
31.(6-4)分化反蓝:将组织切片在1%醋酸乙醇中浸泡2s,洗去细胞质中多余的苏木精染料,再在纯水中浸泡2min洗去醋酸,中止分化;将其在25%氨水中浸泡5s进行反蓝,再将其
在纯水中浸泡2min以洗去氨水便于后续染色。
32.(6-5)伊红染色:将组织切片浸泡在伊红染料中染色60s,随后用将其在纯水中浸泡5min洗去多余的伊红染料。
33.(6-6)脱水:将组织切片通过梯度乙醇处理,对组织进行脱水。
34.优选的,所述梯度乙醇处理方法为:在90%乙醇中浸泡5s;将其转移至无水乙醇中浸泡2min;再将其转移至新无水乙醇中浸泡2min。
35.(6-7)透明化:将组织切片在二甲苯中浸泡2min;再将其转移至新二甲苯中浸泡2min,使组织透明。染色完成后使用封固剂进行封片,将组织切片制成永久装片用于后续显微观察(7)显微观察:组织病理样品制作完成后,用光学显微镜进行观察,一个处理组3个生物样品,对于每个生物样品的消化腺组织制作3张组织切片,每张切片随机拍照获取至少100个消化腺组织结构的图像,用于后续组织病理学分析。
36.(8)定量指标:将消化腺显微图片导入到图像软件image j中,转化图片格式为灰度8 bit并调整图片对比度及明暗程度使组织结构清楚,使用image j直线工具划线测量,在消化管壁上均匀选取5处位置进行划线测量;每次划线测量的结果对应一个厚度值,每张切片获得500个测量值,每个处理组共得到4500个数据;使用spss(v20.0,ibm)对测得的原始数据进行统计分析。
37.以下为实施例:提供了两个实施例及相应图表,实施例1和2分别是本方法在苯并芘处理和聚乙烯微塑料处理条件下贻贝消化腺组织病理损伤的量化,通过对比可知本发明的定量方法在评估贻贝组织损伤方面具有有效性。
38.实施例1本发明提供的贻贝组织病理损伤定量方法,对苯并芘处理及对照组海洋贻贝进行如下处理:(1)贻贝的培养:将9只地中海贻贝(mytilus galloprovincialis)置于盐度为30-32
‰
的人工海水中驯化培养,使其适应实验室培养条件(溶解氧:80%左右,ph:7.8左右,温度:15℃左右,培养光暗比为12h:12h),每天更换人工海水,换水一小时后喂食足够量的球等鞭金藻(isochrysis galbana),培养两周。然后将其随机分成三组,对照组在实验室培养条件中继续培养6天;实验组在5.6 μg/l 苯并芘人工海水溶液中,其他条件与对照组相同情况下培养6天,其中苯并芘先溶解在dmso中,再加入体系;dmso组为在人工海水中加入体积比为0.005%的dmso,其他条件与对照组相同情况下培养6天。
39.(2)组织解剖与固定:采集步骤(1)中9只贻贝样品并解剖,分别获得3-4 mm大小的贻贝消化腺组织样品,放入包埋盒中开展铺开,再将其浸泡再10%福尔马林溶液中进行固定超过48小时,甲醛能与蛋白质氨基结合,使蛋白质凝固,从而保证组织细胞维持原本形态结构。
40.(3)脱水与透明化:借助不同浓度的乙醇处理,对固定的组织样本进行脱水;再使用透明剂二甲苯处理置换出组织内的乙醇,因为二甲苯处理后的组织块呈半透明状,因此二甲苯置换乙醇的过程称为透明化。
41.不同浓度乙醇处理条件为:在70%乙醇溶液中浸泡过夜;将其转移至90%乙醇溶液
中浸泡2h;再转移至无水乙醇溶液中浸泡2h;再转移至新无水乙醇溶液中浸泡2h;最后转移至新无水乙醇溶液中浸泡过夜。
42.二甲苯处理条件为:在二甲苯中浸泡1h;将其转移至新二甲苯中浸泡0.5h;再将其转移至新二甲苯中浸泡0.5h。
43.(4)浸泡与包埋:组织经过透明后,需要再石蜡液体中浸渍处理,使石蜡完全置换出组织内的二甲苯后方可进行包埋。在进行石蜡包埋时,先将熔化的石蜡倒入包埋模具中,随后夹起浸蜡后的组织块平整放置于包埋模具底部的中央位置。将模具放置在冷冻台,加速石蜡凝固,完成包埋。
44.石蜡液体浸渍处理条件为:在65℃石蜡液体中浸渍1h;然后将其转移至65℃石蜡液体中浸渍0.5h。
45.(5)切片、摊片与烤片:使用切片机将组织石蜡块切成8 μm的切片。用镊子轻轻夹住组织切片,平铺于45℃水面,待切片完全展开后用提前标记好的载玻片将其尽量放在载玻片中央处捞起。斜置载玻片,使水分充分流下后在65℃下进行烤片,直至石蜡熔化,组织牢固附着于载玻片上。
46.(6)he染色和封片:he染色主要步骤包括脱蜡、至水、苏木精染色、分化反蓝、伊红染色、脱水和透明化。
47.(6-1)脱蜡:将(5)中固着组织的载玻片在二甲苯中浸泡2min,然后转移至新二甲苯中浸泡2min,洗脱组织切片中的石蜡。
48.(6-2)至水:将(6-1)中处理好的固着组织的载玻片通过梯度乙醇处理,使水分进入组织。
49.梯度乙醇处理方法为:在无水乙醇中浸泡2min;将其转移至新无水乙醇中浸泡2min;将其转移至90%乙醇中浸泡2min;再将其转移至70%乙醇中浸泡2min,最后将其转移至50%乙醇中浸泡25min。
50.(6-3)苏木精染色:将(6-2)中处理好的固着组织的载玻片在苏木精中浸泡,对组织中的核酸等噬碱性物质进行染色,之后将其在纯水中浸泡5min,洗去载玻片上多余的染料。
51.(6-4)分化反蓝:将组织切片在1%醋酸乙醇中浸泡2s,洗去细胞质中多余的苏木精染料,再在纯水中浸泡2min洗去醋酸,中止分化;将其在25%氨水中浸泡5s进行反蓝,再将其在纯水中浸泡2min以洗去氨水便于后续染色。
52.(6-5)伊红染色:将组织切片浸泡在伊红染料中染色60s,随后用将其在纯水中浸泡5min洗去多余的伊红染料。
53.(6-6)脱水:将组织切片通过梯度乙醇处理,对组织进行脱水。
54.梯度乙醇处理方法为:在90%乙醇中浸泡5s;将其转移至无水乙醇中浸泡2min;再将其转移至新无水乙醇中浸泡2min。
55.(6-7)透明化:将组织切片在二甲苯中浸泡2min;再将其转移至新二甲苯中浸泡2min,使组织透明。
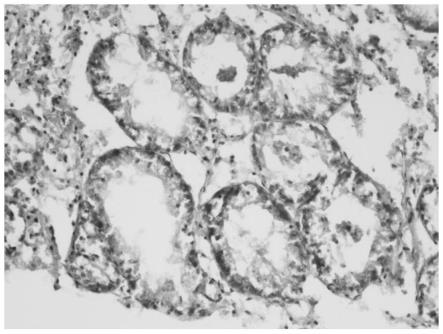
56.染色完成后使用封固剂进行封片,将组织切片制成永久装片用于后续显微观察(7)显微观察:组织病理样品制作完成后,用光学显微镜进行观察,9个生物样品,对于每个生物样品的消化腺组织制作3张组织切片,每张切片随机拍照获取至少100个消化
腺组织结构的图像(图1),用于后续组织病理学分析。
57.(8)定量指标:将消化腺显微图片(分辨率100像素/英寸)导入到图像软件image j中,转化图片格式为灰度8 bit并调整图片对比度及明暗程度使组织结构清楚(图2),使用image j直线工具划线测量,在消化管壁上均匀选取5处位置进行划线测量(图3);每次划线测量的结果对应一个厚度值,每张切片获得500个测量值,每个处理组共得到4500个数据;使用spss(v20.0,ibm)对测得的原始数据进行统计分析。
58.定量结果为正常条件下贻贝消化腺中消化管壁厚度为12 μm左右,dmso组与对照组无显著性差异。苯并芘处理组贻贝消化腺管壁厚度不到10 μm,与对照组存在极显著差异。与定性指标中经苯并芘处理后,贻贝消化腺管上皮萎缩和坏死等现象相吻合。可明显通过本发明定量方法,显示海洋贻贝消化腺组织对于苯并芘暴露的响应(图4)。
59.实施例2本发明提供的贻贝组织病理损伤定量方法,对聚乙烯微塑料处理及对照组海洋贻贝进行如下处理:(1)贻贝的培养:将9只地中海贻贝(mytilus galloprovincialis)置于盐度为30-32
‰
的人工海水中驯化培养,使其适应实验室培养条件(溶解氧:80%左右,ph:7.8左右,温度:15℃左右,培养光暗比为12h:12h),每天更换人工海水,换水一小时后喂食足够量的球等鞭金藻(isochrysis galbana),培养两周。然后将其随机分成三组,对照组在实验室培养条件中继续培养6天;溶剂对照组在人工海水中加入体积比为0.005%的dmso,其他条件与对照组相同情况下培养6天;实验组在200 μg/l 聚乙烯微塑料人工海水溶液中,其他条件与实验组相同情况下培养6天。
60.(2)组织解剖与固定:采集步骤(1)中9只贻贝样品并解剖,分别获得3-4 mm大小的贻贝消化腺组织样品,放入包埋盒中开展铺开,再将其浸泡再10%福尔马林溶液中进行固定超过48小时,甲醛能与蛋白质氨基结合,使蛋白质凝固,从而保证组织细胞维持原本形态结构。
61.(3)脱水与透明化:借助不同浓度的乙醇处理,对固定的组织样本进行脱水;再使用透明剂二甲苯处理置换出组织内的乙醇,因为二甲苯处理后的组织块呈半透明状,因此二甲苯置换乙醇的过程称为透明化。
62.不同浓度乙醇处理条件为:在70%乙醇溶液中浸泡过夜;将其转移至90%乙醇溶液中浸泡2h;再转移至无水乙醇溶液中浸泡2h;再转移至新无水乙醇溶液中浸泡2h;最后转移至新无水乙醇溶液中浸泡过夜。
63.二甲苯处理条件为:在二甲苯中浸泡1h;将其转移至新二甲苯中浸泡0.5h;再将其转移至新二甲苯中浸泡0.5h。
64.(4)浸泡与包埋:组织经过透明后,需要再石蜡液体中浸渍处理,使石蜡完全置换出组织内的二甲苯后方可进行包埋。在进行石蜡包埋时,先将熔化的石蜡倒入包埋模具中,随后夹起浸蜡后的组织块平整放置于包埋模具底部的中央位置。将模具放置在冷冻台,加速石蜡凝固,完成包埋。
65.石蜡液体浸渍处理条件为:在65℃石蜡液体中浸渍1h;然后将其转移至65℃石蜡液体中浸渍0.5h。
66.(5)切片、摊片与烤片:使用切片机将组织石蜡块切成8 μm的切片。用镊子轻轻夹
住组织切片,平铺于45℃水面,待切片完全展开后用提前标记好的载玻片将其尽量放在载玻片中央处捞起。斜置载玻片,使水分充分流下后在65℃下进行烤片,直至石蜡熔化,组织牢固附着于载玻片上。
67.(6)he染色和封片:he染色主要步骤包括脱蜡、至水、苏木精染色、分化反蓝、伊红染色、脱水和透明化。
68.(6-1)脱蜡:将(5)中固着组织的载玻片在二甲苯中浸泡2min,然后转移至新二甲苯中浸泡2min,洗脱组织切片中的石蜡。
69.(6-2)至水:将(6-1)中处理好的固着组织的载玻片通过梯度乙醇处理,使水分进入组织。
70.梯度乙醇处理方法为:在无水乙醇中浸泡2min;将其转移至新无水乙醇中浸泡2min;将其转移至90%乙醇中浸泡2min;再将其转移至70%乙醇中浸泡2min,最后将其转移至50%乙醇中浸泡25min。
71.(6-3)苏木精染色:将(6-2)中处理好的固着组织的载玻片在苏木精中浸泡,对组织中的核酸等噬碱性物质进行染色,之后将其在纯水中浸泡5min,洗去载玻片上多余的染料。
72.(6-4)分化反蓝:将组织切片在1%醋酸乙醇中浸泡2s,洗去细胞质中多余的苏木精染料,再在纯水中浸泡2min洗去醋酸,中止分化;将其在25%氨水中浸泡5s进行反蓝,再将其在纯水中浸泡2min以洗去氨水便于后续染色。
73.(6-5)伊红染色:将组织切片浸泡在伊红染料中染色60s,随后用将其在纯水中浸泡5min洗去多余的伊红染料。
74.(6-6)脱水:将组织切片通过梯度乙醇处理,对组织进行脱水。
75.梯度乙醇处理方法为:在90%乙醇中浸泡5s;将其转移至无水乙醇中浸泡2min;再将其转移至新无水乙醇中浸泡2min。
76.(6-7)透明化:将组织切片在二甲苯中浸泡2min;再将其转移至新二甲苯中浸泡2min,使组织透明。
77.染色完成后使用封固剂进行封片,将组织切片制成永久装片用于后续显微观察(7)显微观察:组织病理样品制作完成后,用光学显微镜进行观察,9个生物样品,对于每个生物样品的消化腺组织制作3张组织切片,每张切片随机拍照获取至少100个消化腺组织结构的图像,用于后续组织病理学分析。
78.(8)定量指标:将消化腺显微图片(分辨率150像素/英寸)导入到图像软件image j中,转化图片格式为灰度8 bit并调整图片对比度及明暗程度使组织结构清楚,使用image j直线工具划线测量,在消化管壁上均匀选取5处位置进行划线测量;每次划线测量的结果对应一个厚度值,每张切片获得500个测量值,每个处理组共得到4500个数据;使用spss(v20.0,ibm)对测得的原始数据进行统计分析。
79.定量结果为正常条件下贻贝消化腺中消化管壁厚度为12 μm左右,dmso组与对照组无显著性差异。聚乙烯微塑料处理组贻贝消化腺管壁厚度8 μm左右,与对照组存在极显著差异。与定性指标中经聚乙烯微塑料处理后,贻贝消化腺管上皮萎缩和坏死等现象相吻合。可明显通过本发明定量方法,显示海洋贻贝消化腺组织对于聚乙烯微塑料暴露的响应(图5)。
80.以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
