1.本技术涉及中药领域,具体而言,涉及一种中药组合物、提取物及其制备方法和应用、化妆品和药品。
背景技术:
2.皮肤作为人体的与外部环境紧密接触的身体器官,具有保护人体内部的功能,大致可分三种:表皮、真皮以及皮下脂肪。皮肤作为由多种功能的细胞和具有与其相匹配的物性的物质形成的复杂器官,对于真皮层而言,具有弹性的固体物质(纤维)和具有粘性的液状物质结合,因此能维持固有的皮肤弹性。因此,皮肤基于独特的物性对机械张力起反应,这被称为粘弹性。皮肤具有这种粘弹性是因为胶原蛋白纤维和弹性蛋白纤维在蛋白聚糖类的基质形成特有的三维结构。通常,随着年龄的增长,因紫外线、或公害、压力等原因会出现皮肤的功能下降和萎缩性变化,并且会出现皮肤细胞数量减少或皮肤厚度减少等现象。由于这种过程,皮肤的弹性纤维变形,导致皮肤弹性减少或皮肤松弛。胶原蛋白作为构成皮肤的主要成分,其中i型胶原蛋白占80%,ⅲ型胶原蛋白占15%。在皮肤长期暴露于紫外线的情况下,在皮肤内生成大量活性氧,由此作为基质金属蛋白酶(mmps)中的分解胶原蛋白的酶的mmp-1(matrix metalloproteinase-1)的表达或活性被促进,胶原蛋白合成降低,从而导致皮肤弹性降低并生成皱纹。
3.炎症反应作为对于物理刺激、化学刺激、细菌感染等原因的身体的防御机制中的一种,是用于去除外部物质并修复和再生受损部位的机制之一。单核细胞被细菌感染等激活,可转化为具有吞噬作用的巨噬细胞,巨噬细胞分泌no、前列腺素e2、促炎细胞因子等,从而诱导炎症,且在炎症、免疫反应中均用作重要的调节细胞,而为了实现这个过程,巨噬细胞需经过激活过程。作为革兰氏阴性菌的细胞壁结构成分中的一种且被熟知为内毒素的脂多糖(lps)是参与巨噬细胞的激活的最著名的外部因子。尤其,因如raw 264.7细胞的单核细胞或巨噬细胞分泌如tnf-α、il-6、il-1β的促炎细胞因子,而炎症部位中的lps增加。当lps刺激巨噬细胞,l-精氨酸通过被称为诱生型一氧化氮合酶(inducible nitric oxide synthase,inos)的酶转变为l-瓜氨酸的过程中,生成一氧化氮(no),从而巨噬细胞生成no。
4.哺乳动物的no由三种no合成酶(nos),即nnos(神经元型一氧化氮合酶)、enos(内皮型一氧化氮合酶)以及inos合成。其中,由nnos和enos生成的no是为了正常生物体功能而生成,其组织内的浓度保持在低的规定水平。然而,由inos生成的no因其量过多,可表现出病理性的血管扩张、细胞毒性、组织损伤等的对生物体有害的作用。另外,作为炎症因子的前列腺素e2(pge2)是通过花生四烯酸被环氧酶(coxs)催化而形成,从而诱导炎症反应,其中,上述花生四烯酸是由lps刺激使得作为细胞膜的结构成分的磷脂被磷脂酶a2(phospholipase a2)游离而成。cox分为cox-1和cox-2,cox-1在体内对血小板的形成、胃壁保护、肾功能的维持等正常生物体功能起到作用,cox-2合成作为炎症性介质的phe2。已知,phe2与促进炎症反应(疼痛、发热等)、免疫反应、以及血管新生等癌症的发生密切相关。
5.包括选择性cox-2抑制剂的非甾体类抗炎药(nsaids)具有抗炎、解热及阵痛效果,
然而,长期服用这些药物有时可导致严重的副作用,例如,与胃肠道相关的消化性溃疡出血导致的继发性贫血、血小板功能的抑制、分娩诱导的抑制、对肾脏的副作用、肝损伤、过敏反应等。
技术实现要素:
6.本技术提供了一种中药组合物、提取物及其制备方法和应用、化妆品和药品,其能够改善上述至少一个技术问题。
7.本技术的实施例是这样实现的:
8.在第一方面,本技术示例提供了一种中药组合物,其包括:连翘果、蒺藜果、刺五加、玉竹、枳实及人参。
9.在第二方面,本技术示例提供了一种提取物,其由本技术第一方面提供的中药组合物经提取制得。
10.在第三方面,本技术示例提供了上述提取物的制备方法,其是以提取剂提取本技术第一方面提供的中药组合物所得。
11.其中,提取剂选自水、c
1-c4醇水溶液中的任一种。
12.上述第一方面提供的中药组合物、第二方面提供的提取物以及第三方面提供的制备方法提取的提取物,均是利用特定的原料连翘果、蒺藜果、刺五加、玉竹、枳实及人参的互相配合,具有抑制mmp-1基因表达、促进timp-1表达、抑制活性氧生成、促进因氧化应激而减少的nqo1基因表达、抑制no生成以及抑制inos表达能力,试验显示其不仅具有抗氧化、抗皱以及抗炎的效果,同时无毒,因此可应用于药品、化妆品等领域中。
13.因此,在第四方面,本技术示例提供了上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物在制备抑制活性氧生成和/或促进nqo1基因表达恢复的制剂中的应用。
14.在第五方面,本技术示例提供了上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物在制备抑制no生成和/或抑制inos表达的制剂中的应用。
15.在第六方面,本技术示例提供了上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物在制备抗炎、抗氧化和/或抗皱的制剂中的应用,其中制剂包括化妆品和药品中的任意一种。
16.在第七方面,本技术示例提供了上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物在制备抑制mmp-1基因表达和/或促进timp-1表达的制剂中的应用。
17.在第八方面,本技术示例提供了一种化妆品,其包括上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物。
18.在第九方面,本技术示例提供了一种药品,其包括上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物。
附图说明
19.为了更清楚地说明本技术实施例的技术方案,下面将对实施例中所需要使用的附
图作简单地介绍,应当理解,以下附图仅示出了本技术的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
20.图1是提取物对hacat细胞毒性影响;
21.图2是提取物对胶原蛋白的表达量的影响;
22.图3提取物对mmp-1基因的表达的影响;
23.图4提取物对timp-1表达的影响;
24.图5是提取物对因氧化应激而产生的活性氧的影响;
25.图6是提取物对nqo1基因表达影响;
26.图7是提取物对no生成及对raw264.7细胞毒性的影响;
27.图8是提取物对inos基因表达的影响;
28.图9是提取物对cox-2基因表达的影响。
具体实施方式
29.下面将结合实施例对本技术的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本技术,而不应视为限制本技术的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
30.在第一方面,本技术提供一种中药组合物,其包括:连翘果、蒺藜果、刺五加、玉竹、枳实及人参。采用连翘果、蒺藜果、刺五加、玉竹、枳实及人参互相配合,协同增效,具有抑制mmp-1基因表达、促进timp-1表达、抑制活性氧生成、促进因氧化应激而减少的nqo1基因表达、抑制no生成以及抑制inos表达能力,其不仅具有抗炎、抗氧化及氧化后修复效果,还具有促进胶原蛋白生成等,以进行抗皱抗皮肤衰老等,因此其尤其适用于具有各种皮肤改善效果的化妆品中。
31.其中,连翘果是指木犀科金钟花(forsythia viridissima lindley)或连翘(forsythia suspensa vahl)的干燥果实。药效具有降热及解毒、消除风热、消解疖或伤口肿胀或者消肿解结的消肿散结的效果;其主要化学成分包括连翘酚、甾醇类、皂苷、齐墩果酸等。
32.蒺藜果是指蒺藜科蒺藜(tribulus terrestris l.)的果实,该药性味辛、苦,微温,其用于肝气上升引起的头晕、头痛、出现幻影、高血压、胸胁部疼痛、月经不调、乳汁分泌、乳腺炎、眼睛充血,白苔,湿疹,风疹,神经性皮炎、瘙痒。作为药理作用,已经报告了降血压、利尿、止咳、祛痰、平喘作用。
33.刺五加(eleutherococcus senticosus),在民间或中医学中用作治疗中风或虚弱体质的药物,五加皮酒对腰痛、手脚麻木、半身不遂等效果很好。
34.玉竹作为百合科植物玉竹(polygonatum odoratum var.pluriflorum)的根茎,玉竹具有强壮作用,因此用于心脏衰弱等的治疗,并且对心烦口干、糖尿病也有效。
35.枳实(ponciri fructus immaturus(kp))是芸香科枳树未熟的果实,其用于通气、健胃、利尿、祛痰、阵痛。
36.人参是人参属(panax)多年生植物,作为本技术中使用的人参具体可以举例为:高
丽参(panax ginseng)、西洋参(panax quinquefolia)、田七(panax notoginseng)、竹节参(panax japonicus)、喜马拉雅参(panaxa pseudoginseng)、越南参(panax vietnamensis)、秀丽人参(panax elegatior)、狭叶竹节参(panax wangianus)、羽叶三七(panax bipinratifidus)等。人参对提高免疫、缓解疲劳、改善血液循环、缓解更年期、提高记忆力有很好的效果,并具有多种抗癌效果。
37.可选地,中药组合物包括:100重量份的连翘果,100~150重量份的蒺藜果,75~125重量份的刺五加,100~150重量份的玉竹,25~50重量份的枳实,以及50~75重量份的人参。采用上述原料特定的范围,对于配比合理,并且在本技术提供的特定的配比下,组合物能够实现较好的协同增效作用。
38.需要说明的是,上述中药组合物可以独立使用,也可以与其他不冲突的原料或辅料配合使用,在此不做限定。
39.在第二方面,本技术提供一种提取物,其由上述中药组合物经提取制得。该提取物具有抑制mmp-1基因表达、促进timp-1表达、抑制活性氧生成、促进因氧化应激而减少的nqo1基因表达、抑制no生成以及抑制inos表达能力。
40.在第三方面,本技术提供一种上述提取物的制备方法,其以提取剂提取上述中药组合物所得。
41.其中,提取剂选自水、c
1-c4醇中的至少一种;示例性地,c
1-c4醇可选自甲醇、乙醇、丙醇、异丙醇、丁醇及异丁醇中的至少一种。
42.可选地,提取剂为乙醇水溶液。
43.可选地,乙醇水溶液中乙醇的体积分数为25-35%,例如乙醇水溶液中乙醇的体积分数为25%、30%、33%或35%等。
44.示例性地,提取包括:将待提取的原料浸渍在提取剂中进行提取,其中,提取剂的添加量为待提取的原料重量的1~40倍,具体可选为5~40倍,可选为10~30倍等,本领域技术人员可根据实际的需求进行限定。其中,提取的原料可以为中药组合物,也可以为单独的组成中药组合物的各原料药。
45.也即是,可以先将各原料按照比例配比后混合,然后一起进行提取,也可以先将各原料按照比例配比后独立进行提取,然后进行混合,在此不做限定。
46.实际提取过程中,可将待提取的原料直接浸渍在提取剂中一段时间进行提取,提取时间没有特别限制,其可根据实际需求进行选择,实际为了避免提取时间过短导致浪费,且提取时间过长导致部分成分受到影响等,因此提取时间可为10min至2d以内。
47.为了加快提取进度,提取的过程中可以辅助进行加热、超声波提取等,可选地,在本技术示出的一些可选的示例中,提取包括:采用超声波提取1.5-3h,例如1.5h、1.7h、2h、2.5h、2.7h或3h等。
48.可选地,提取后还包括浓缩,将其进行浓缩后可根据实际需求进行干燥。
49.上述提取所采用的设备可根据实际需求选择常规的提取设备、超声波破碎提取器或分级分离器,这样制备的提取物可通过热风干燥、减压干燥或冷冻干燥来去除提取剂,方便快捷。
50.需要说明的是,除了上述提取方式以外,还可通过浸渍联合色谱法等常规方法,单独使用或适当组合使用用于分离提取植物成分的公知的方法来分级提取或纯化提取物,在
此不做具体赘述。其中,色谱法可选自硅胶柱色谱法、lh-20柱色谱法、离子交换树脂色谱法、中压液相色谱法、薄层相色谱法、硅胶真空液相色谱法及高效液相色谱法中的任一种。
51.基于上述中药组合物以及提取物的效果,本技术提供上述中药组合物、上述提取物、或上述制备方法制得的提取物的具体应用。
52.具体地,在第三方面,本技术提供上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物在制备抑制活性氧生成和/或促进nqo1基因表达的制剂中的应用。
53.其中,抑制活性氧生成和/或促进nqo1基因表达不仅与抗氧化作用相关,同时紫外线、蓝光等外界条件会诱导皮肤内产生氧化压力,对于皮肤产生一定的损伤,导致皮肤弹性降低并生成皱纹,因此上述抑制活性氧生成和/或促进nqo1基因表达的制剂对损伤的皮肤也会有一定的修复以及抗衰老能力。
54.在第四方面,本技术提供上述上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物在制备抑制no生成和/或抑制inos表达的制剂中的应用。
55.其中,抑制no生成和/或抑制inos表达的制剂主要为抗炎作用。
56.在第五方面,本技术提供上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物在制备抑制mmp-1基因表达和/或促进timp-1表达的制剂中的应用。
57.其中,抑制mmp-1基因表达和/或促进timp-1表达与胶原蛋白的合成相关,抑制mmp-1基因表达和/或促进timp-1表达的制剂能够有效抗皱抗衰。
58.需要说明的是,上述制剂可以为药品、化妆品,还可以为保健品或实验用中间试剂,在此不做限定。
59.综上,基于上述中药组合物、上述提取物、或上述制备方法制得的提取物的作用,在第六方面,本技术提供上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物在在制备抗炎、抗氧化和/或抗皱的制剂中的应用,制剂包括化妆品和药品中的任意一种。
60.其中,需要说明的是,本技术中抗炎是指该制剂能够有效改善或治疗炎性疾病。
61.炎性疾病包括炎性肠疾病、炎性胶原血管疾病、肾小球性肾炎、结节病、特异反应性皮炎、视网膜炎、胃炎、肝炎、肠炎、关节炎、扁桃体炎、咽喉炎、支气管炎、肺炎、胰腺炎、膀胱炎、神经炎、败血症和肾炎中的至少一种。
62.在第七方面,本技术提供一种化妆品,其包括上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物。
63.其中,该化妆品具有对皮肤细胞抗炎、改善皱纹、抗氧化、抗衰老等多重效果。
64.可选地,提取物在化妆品中的添加量例如为0.01~5wt%,具体例如提取物在化妆品中的添加量为0.01wt%、0.1wt%、0.5wt%、1wt%、1.3wt%、1.5wt%、2wt%、2.5wt%、3wt%、3.5wt%、4wt%或5wt%等,可选地,提取物在化妆品中的添加量为0.01~3wt%。需要说明的是,此处的提取物为上述第二方面提供的提取物或第三方面提供的制备方法提取的提取物中的至少一种。
65.化妆品具体可以是精华液、乳液、乳剂、面膜、护手霜、护脚霜、润唇膏、唇膏、眼影、
眼线、眉笔、腮红、高亮、普通化妆水、化妆水、乳霜、精华素、美容香皂、柔软化妆水、药用化妆水、身体清洁剂、洁面泡沫、洁面乳、凝胶、卸妆油、清洁霜、洗发水、护发素、焗油膏、润发乳、卸妆巾或卸妆水等。
66.也即是,化妆品的剂型为糊剂、乳霜、凝胶、粉末、喷雾剂、溶液、乳状液、悬浊液、以及含有表面活性剂的清洁剂等中的任意一种。化妆品的剂型可以以本领域通常制备的任何剂型来制备。
67.其中,化妆品包含能够常规掺入化妆品的载体成分。
68.具体地,当化妆品的剂型为糊剂,乳霜或凝胶的情况下,可以使用动物纤维、植物纤维、蜡、石蜡、淀粉、黄蓍胶,纤维素衍生物、聚乙二醇、有机硅、膨润土、二氧化硅、滑石或氧化锌等作为载体成分。
69.当化妆品的剂型为粉末或喷雾剂的情况下,可以使用乳糖、滑石、二氧化硅、氢氧化铝、硅酸钙或聚酰胺粉末作为载体成分,尤其,当其为喷雾剂的情况下,还可以包括如氯氟烃、丙烷/丁烷或二甲醚等的推进剂。
70.当化妆品的剂型为溶液或乳状液的情况下,可以使用溶剂、溶剂化剂或乳化剂,例如,水、乙醇、异丙醇、碳酸乙酯、乙酸乙酯、苯甲醇,苯甲酸苄酯、丙二醇、1,3-丁二醇油、甘油脂族酯、聚乙二醇或山梨糖醇的脂肪酸酯作为载体成分。
71.当化妆品的剂型为悬浊液的情况下,可以使用如水、乙醇或丙二醇等的液状稀释剂、如乙氧基化异硬脂醇、聚氧乙烯山梨糖醇酯及聚氧乙烯山梨聚糖酯等的悬浮剂、微晶纤维素、偏氢氧化铝、膨润土、琼脂或黄蓍胶等作为载体成分。
72.当化妆品的剂型为含有表面活性剂的清洁剂的情况下,可以使用脂肪醇硫酸盐、脂肪族醇醚硫酸盐、磺基琥珀酸单酯、羟乙基磺酸盐、咪唑啉型表面活性剂、甲基牛磺酸盐、肌氨酸盐、脂肪酸酰胺醚硫酸盐、烷基酰胺基甜菜碱、脂肪醇、脂肪酸甘油酯、脂肪酸二乙醇酰胺、植物油、羊毛脂衍生物或乙氧基化甘油脂肪酸酯等作为载体成分。
73.除了上述原料以外,化妆品还可以包含具有一定护肤作用的辅助成分、以及根据实际的剂型需求能够常规掺入化妆品的化妆品用添加剂。
74.具体地,辅助成分包括但不局限于水溶性维生素及其盐或衍生物、油溶性维生素及衍生物、高分子多肽、高分子多糖、鞘脂及海藻提取物中的至少一种。
75.此处的水溶性维生素具体可包括维生素b1、维生素b2、维生素b6、吡哆醇、盐酸吡哆醇、维生素b12、泛酸、烟酸、烟酸酰胺、叶酸、维生素c以及维生素h等中的至少一种,水溶性维生素盐可包括盐酸硫胺素或抗坏血酸钠盐等,水溶性维生素衍生物可包括抗坏血酸-2-磷酸钠盐,抗坏血酸-2-磷酸镁盐等中的至少一种。水溶性维生素及其盐或衍生物可以通过例如微生物转化法、从微生物培养物中提纯的方法、酶法或化学合成法等常规方法来获得。
76.油溶性维生素具体可包括维生素a、胡萝卜素、维生素d2、维生素d3、维生素e(dl-α生育酚、d-α生育酚、d-α生育酚)等,油溶性维生素的衍生物可包括抗坏血酸棕榈酸酯、抗坏血酸硬脂酸酯、抗坏血酸二棕榈酸酯、乙酸dl-α生育酚、烟酸dl-α生育酚维生素e、dl-泛醇、d-泛醇、泛酸醇乙基醚等中的至少一种。油溶性维生素可以通过例如微生物转化法、从微生物培养物中提纯的方法、酶法或化学合成法等常规方法来获得。
77.高分子多肽可包括胶原蛋白、水解胶原蛋白、明胶,弹性蛋白、水解弹性蛋白、角蛋
白等中的至少一种。高分子多肽可以通过例如从微生物培养物中提纯的方法、酶法或化学合成法等常规方法来纯化并获得,或者通常从猪或牛等的真皮、蚕的蚕丝纤维等的天然物提纯使用。
78.高分子多糖可包括羟乙基纤维素、黄原胶、透明质酸钠、硫酸软骨素或其盐(钠盐等)等中的至少一种。其中硫酸软骨素或它们的盐等可从常规哺乳动物或鱼类提纯使用。
79.鞘脂具体可包括神经酰胺、植物鞘氨醇、神经鞘糖脂等中的至少一种。鞘脂通常可以通过常规方法从哺乳类、鱼类、贝类、酵母,植物等中提纯获得或通过化学合成法来获得。
80.海藻提取物可包括褐藻提取物、红藻提取物、绿藻提取物等中的至少一种,另外,本技术中使用的海藻提取物还包括从海藻提取物提纯的角叉菜胶、海藻酸、海藻酸钠、海藻酸钾等。海藻提取物可以通过常规方法从海藻提纯来获得。
81.化妆品用添加剂可包括油脂成分、保湿剂、软化剂、表面活性剂、有机及无机颜料、有机粉末、紫外线吸收剂、防腐剂、杀菌剂、抗氧化剂、植物提取物、ph调节剂、酒精、色素、香料、血液循环促进剂、冷却剂、止汗剂和纯净水中的至少一种,具体可根据实际的剂型需求进行选择。
82.其中,油脂成分可包括酯类油脂、烃类油脂、硅类油脂、氟类油脂、动物油脂、食物油脂等。
83.酯类油脂可以是三2-乙基己酸甘油酯、2-乙基己酸十六烷酯、肉豆蔻酸异丙酯、肉豆蔻酸丁酯、棕榈酸异丙酯、硬脂酸乙酯、棕榈酸辛酯、异硬脂酸异鲸蜡酯、硬脂酸丁酯、亚油酸乙酯、亚油酸异丙酯、油酸乙酯、肉豆蔻酸异鲸蜡酯、肉豆蔻酸异硬脂基酯、棕榈酸异硬脂基酯、肉豆蔻酸辛基十二烷酯、异硬脂酸异鲸蜡酯、癸二酸二乙酯,己二酸二异丙基酯、新戊酸异烷酯、三(辛酸,癸酸)甘油酯、三2-乙基己酸三羟甲基丙烷酯、三异硬脂酸三羟甲基丙烷酯、四2-乙基己酸季戊四醇酯、辛酸鲸蜡酯、月桂酸癸酯、月桂酸己酯、肉豆蔻酸癸酯、肉豆蔻酸肉豆蔻酯、肉豆蔻酸鲸蜡酯、硬脂酸硬脂醇酯、油酸癸酯、蓖麻油酸鲸蜡酯、月桂酸异硬脂醇酯、肉豆蔻酸异十三烷酯、棕榈酸异鲸蜡酯、硬脂酸辛酯、硬脂酸异鲸蜡酯、油酸异癸酯、油酸辛基十二烷酯,亚油酸辛基十二烷酯、异硬脂酸异丙酯、2-乙基己酸鲸蜡硬脂醇酯、2-乙基己酸硬脂醇酯、异硬脂酸己酯、二辛酸乙二醇酯、二油酸乙二醇酯、二癸酸丙二醇酯、二(辛酸,癸酸)丙二醇酯、二辛酸丙二醇酯、二癸酸新戊二醇酯、二辛酸新戊二醇酯、三辛酸甘油酯、三十一酸甘油酯、三异棕榈酸甘油酯、三异硬脂酸甘油酯、新戊酸辛基十二烷酯、辛酸异硬脂醇酯、异壬酸辛酯、新癸酸己基癸酯、新癸酸辛基十二烷酯、异硬脂酸异鲸蜡酯、异硬脂酸异硬脂醇酯、异硬脂酸辛基癸酯、聚甘油油酸酯、聚甘油异硬脂酸酯、柠檬酸三异鲸蜡酯、柠檬酸三异烷酯、柠檬酸三异辛酯、乳酸月桂酯、乳酸肉豆蔻酯、乳酸鲸蜡酯、乳酸辛基癸酯、柠檬酸三乙酯、柠檬酸乙酰三乙酯、柠檬酸乙酰三丁酯、柠檬酸三辛酯、苹果酸二异硬脂醇酯、羟基硬脂酸2-乙基己酯、琥珀酸二2-乙基己酯、己二酸二异丁酯、癸二酸二异丙酯、癸二酸二辛酯、硬脂酸胆固醇酯、异硬脂酸胆固醇酯、羟基硬脂酸胆固醇酯、油酸胆固醇酯、油酸二氢胆固醇酯、异硬脂酸植物甾醇酯、油酸植物甾醇酯、12-硬脂酰基羟基硬脂酸异鲸蜡酯、12-硬脂酰基羟基硬脂酸硬脂醇酯、或12-硬脂酰基羟基硬脂酸异硬脂醇酯等的酯基等中的一种或多种。
84.烃类油脂可包括角鲨烯、液体石蜡、α-烯烃低聚物、异链烷烃、地蜡、石蜡、液体异链烷烃、聚丁烯、微晶蜡和凡士林等中的一种或多种。
85.硅类油脂可包括聚甲基硅、甲基苯基硅、甲基环聚硅氧烷、八甲基聚硅氧烷、十甲基聚硅氧烷、十二甲基环硅氧烷、二甲基硅氧烷
·
甲基鲸蜡基氧基硅氧烷共聚物、二甲基硅氧烷
·
甲基硬脂氧基硅氧烷共聚物、烷基改性硅油和氨基改性硅油中的一种或多种。
86.氟类油脂可包括全氟聚醚。
87.动物或食物油脂可包括鳄梨油、杏仁油、橄榄油、芝麻油、米糠油、红花油、大豆油、玉米油、油菜籽油、杏仁油、棕榈仁油、棕榈油、蓖麻子油、葵花籽油、葡萄籽油、棉籽油、椰子油、夏威夷果油、小麦胚芽油、大米胚芽油、乳木果油、月见草油、澳洲坚果油、白芒花籽油、蛋黄油、牛油、马油、貂油、深海鱼油、荷荷巴油、小烛树蜡、巴西棕榈蜡,液体羊毛脂、氢化蓖麻子油等中的一种或多种。
88.保湿剂可包括水溶性低分子保湿剂、脂溶性低分子保湿剂、水溶性高分子保湿剂或脂溶性高分子保湿剂。
89.其中,水溶性低分子保湿剂可包括丝氨酸、谷氨酰胺、山梨醇、甘露醇、吡咯烷酮-羧酸钠、甘油、丙二醇、1,3-丁二醇、乙二醇、聚乙二醇b(聚合度n=2以上)、聚丙二醇(聚合度n=2以上)、聚甘油b(聚合度n=2以上)、乳酸、乳酸盐等。
90.脂溶性低分子保湿剂可包括胆固醇、胆固醇酯等。
91.水溶性高分子可包括羧乙烯聚合物、聚天冬氨酸盐、黄芪胶、黄原胶、甲基纤维素、羟甲基纤维素、羟乙基纤维素、羟丙基纤维素、羧甲基纤维素、水溶性壳多糖、壳聚糖、糊精等。
92.脂溶性高分子可包括聚乙烯吡咯烷酮
·
二十碳烯共聚物、聚乙烯吡咯烷酮
·
十六碳烯共聚物、硝酸纤维素、糊精脂肪酸酯、聚合物硅氧烷等。
93.软化剂可包括长链酰基谷氨酸胆固醇酯、羟基硬脂酸胆固醇酯、12-羟基硬脂酸、硬脂酸、松香酸、羊毛脂脂肪酸胆固醇酯等。
94.其中,表面活性剂可包括非离子表面活性剂、阴离子表面活性剂、阳离子表面活性剂,两性表面活性剂等。
95.具体地,非离子表面活性剂可包括自乳化单硬脂酸甘油酯、丙二醇脂肪酸酯、甘油脂肪酸酯、聚甘油脂肪酸酯、山梨聚糖脂肪酸酯、poe(聚氧乙烯)山梨聚糖脂肪酸酯、poe山梨醇脂肪酸酯、poe甘油脂肪酸酯、poe烷基醚、poe脂肪酸酯、poe氢化蓖麻子油、poe蓖麻子油、poe
·
pop(聚氧乙烯
·
聚氧丙烯)共聚物、poe
·
pop烷基醚、聚醚改性有机硅、月桂酸烷醇酰胺、烷基氧化胺、氢化大豆磷脂等。
96.阴离子表面活性剂可包括脂肪酸皂、α-酰基磺酸盐、烷基磺酸盐、烷基烯丙基磺酸盐、烷基萘磺酸盐、烷基硫酸盐、poe烷基醚硫酸盐、烷基酰胺硫酸盐、烷基磷酸盐、poe烷基磷酸盐、烷基酰胺磷酸盐、烷酰基烷基牛磺酸盐、n-酰基氨基酸盐、poe烷基醚羧酸盐、烷基磺基琥珀酸盐、烷基磺基乙酸钠、酰化水解胶原蛋白肽盐、全氟烷基磷酸酯等。
97.阳离子表面活性剂可包括烷基三甲基氯化铵、硬脂基三甲基氯化铵、硬脂基溴化三甲基铵、鲸蜡硬脂基三甲基氯化铵、二硬脂基二甲基氯化铵、硬脂基二甲基苄基氯化铵、二十二烷基三甲基溴化铵、苯扎氯铵、二乙氨基乙基酰胺硬脂酸酯、二甲氨基丙基酰胺硬脂酸酯、羊毛脂衍生物季铵盐等。
98.两性表面活性剂可包括羧基甜菜碱型、酰胺甜菜碱型、磺基甜菜碱型、羟基磺基甜菜碱型、酰胺磺基甜菜碱型、磷酸酯甜菜碱型、氨基羧酸盐型、咪唑啉衍生物型、酰胺胺型
等。
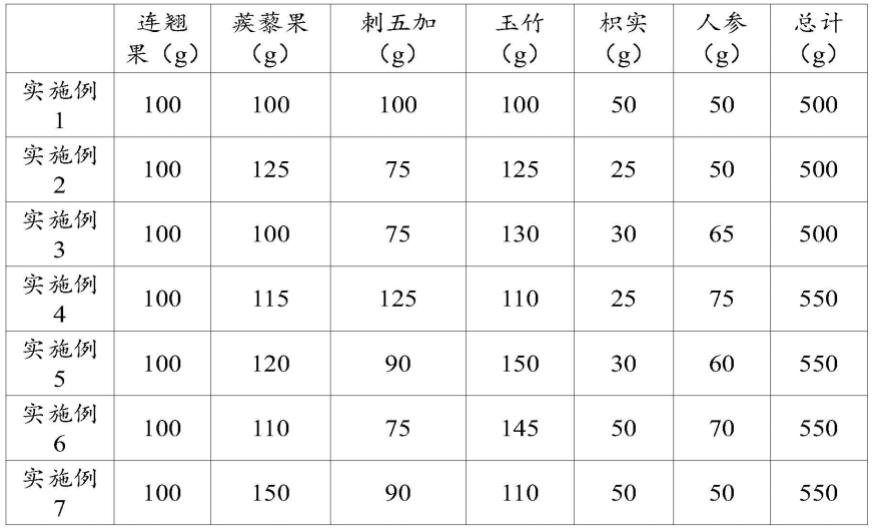
99.无机颜料可包括如硅酸、无水硅酸、硅酸镁、滑石、绢云母、云母、高岭土、三氧化二铁、粘土、膨润土、钛涂层云母、氯氧化铋、氧化锆、氧化镁、氧化锌、氧化钛、氧化铝、硫酸钙、硫酸钡、硫酸镁、碳酸钙、碳酸镁、氧化铁、群青、氧化铬、氢氧化铬、炉甘石及它们的复合体等。
100.有机颜料可包括如聚酰胺、聚酯、聚丙烯、聚苯乙烯、聚氨酯、乙烯基树脂、尿素树脂、酚醛树脂、氟树脂、硅树脂、丙烯酸树脂、三聚氰胺树脂、环氧树脂、聚碳酸酯树脂、二乙烯基苯
·
苯乙烯共聚物、蚕丝粉、纤维素、ci颜料黄、ci颜料橙等。
101.有机粉末可包括如硬脂酸钙等的金属皂;如鲸蜡基磷酸锌钠、月桂基磷酸锌、月桂基磷酸钙等的烷基磷酸金属盐;如n-月桂酰-β-丙氨酸钙,n-月桂酰-β-丙氨酸锌、n-月桂酰甘氨酸钙等的酰基氨基酸多价金属盐;如n-月桂酰牛磺酸钙、n-棕榈酰牛磺酸钙等的酰胺磺酸多价金属盐;如n-ε-月桂酰-l-赖氨酸、n-ε-棕榈酰赖氨酸、n-α-棕榈酰鸟氨酸、n-α-月桂酰精氨酸、n-α-氢化牛油脂肪酸酰基精氨酸等的n-酰基碱性氨基酸;如n-月桂酰甘氨酰甘氨酸等的n-酰基多肽;α-氨基辛酸、α-氨基月桂酸等的α-氨基脂肪酸;聚乙烯、聚丙烯、尼龙、聚甲基丙烯酸甲酯、聚苯乙烯、二乙烯基苯
·
苯乙烯共聚物、四氟乙烯等。
102.紫外线吸收剂可包括对氨基苯甲酸、对氨基苯甲酸乙酯、对氨基苯甲酸戊酯、对氨基苯甲酸辛酯、水杨酸乙二醇酯、水杨酸苯酯、水杨酸辛酯、水杨酸苄酯,水杨酸丁基苯酯、水杨酸三甲环己酯、肉桂酸苄基酯、对甲氧基肉桂酸2-乙氧基乙基酯、对甲氧基肉桂酸辛酯、二对甲氧基肉桂酸单-2-乙基己烷甘油酯、对甲氧基肉桂酸异丙酯、二异丙基二异丙基
·
肉桂酸酯混合物、尿刊酸、尿刊酸乙酯、羟基甲氧基二苯甲酮、羟基甲氧基二苯甲酮磺酸及它们的盐、二羟基甲氧基二苯甲酮、二羟基甲氧基二苯甲酮二磺酸钠、二羟基二苯甲酮、四羟基二苯甲酮、4-叔丁基-4'-甲氧基二苯甲酰甲烷、2,4,6-三苯胺基-对-(羰基-2'-乙基己基-1'-氧基)-1,3,5-三嗪、2-(2-羟基-5-甲基苯基)苯并三唑等。
103.杀菌剂可包括扁柏酚、三氯生、三氯羟基二苯醚、氯葡糖酸氯己定、苯氧乙醇、间苯二酚、异丙基甲基苯酚、甘菊蓝、水杨酸、吡啶硫酮锌、苯扎氯铵、感光素301、单硝基愈创木酸钠、十一碳烯酸等。
104.此处的抗氧化剂主要用于防止产品氧化变质,此处的抗氧化剂可包括丁基羟基茴香醚,没食子酸丙酯、山梨酸等。
105.ph调节剂可包括柠檬酸、柠檬酸钠、苹果酸、苹果酸钠、富马酸、富马酸钠、琥珀酸、琥珀酸钠、氢氧化钠、磷酸氢二钠等。
106.醇可包括鲸蜡醇等的高级醇。
107.另外,可以添加的混合成分不限于此,可以在不损害本技术的目的及效果的范围内混合上述成分中的任意一种,在此不做限定。
108.第九方面,本技术示例提供了一种药品,其包括上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物。
109.可选地,提取物在药品中的添加量例如为0.001~30wt%,具体例如提取物在药品中的添加量为0.001wt%、0.01wt%、0.1wt%、1wt%、3wt%、5wt%、8wt%、10wt%、15wt%、17wt%、20wt%、23wt%、25wt%、28wt%或30wt%等。需要说明的是,此处的提取物为上述第二方面提供的提取物或第三方面提供的制备方法提取的提取物中的至少一种。
110.由于在进行制剂化的情况下,通常使用填充剂、增量剂、结合剂、润湿剂,崩解剂和表面活性剂等稀释剂或赋形剂来调制。
111.因此,药品中除了上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物以外,还可根据实际的剂型需求包括载体、赋形剂及稀释剂,具体例如可包括:乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、木糖醇、赤藓糖醇、麦芽糖醇、淀粉、阿拉伯胶、海藻酸盐、明胶、磷酸钙、硅酸钙、纤维素、甲基纤维素、微晶纤维素、聚乙烯吡咯烷酮、水、羟基苯甲酸甲酯,羟基苯甲酸丙酯、滑石、硬脂酸镁及矿物油。
112.其中,药品的剂型可以口服剂型,也可以为非口服剂。
113.其中,口服剂型包括散剂、颗粒剂、丸剂、片剂、胶囊剂等固体制剂,这种固体制剂可通过向本技术的提取物混合如淀粉、碳酸钙、蔗糖或乳糖、明胶等的至少一种赋形剂来调制。另外,除了简单的赋形剂以外,也可使用硬脂酸镁、滑石等的润滑剂。
114.口服剂型包括悬浊液、乳化液、糖浆剂或气溶胶等液体制剂,此时其除了通常使用的水和液体石蜡等的简单稀释剂以外,还可以包括如润湿剂、甜味剂、芳香剂和保存剂等的各种赋形剂。
115.非口服剂包括外用剂、栓剂或注射剂。
116.作为栓剂的基剂,可以使用半合成脂肪酸甘油酯、聚乙二醇、吐温61、可可油脂、月桂酸甘油酯,甘油明胶等。
117.外用剂或注射剂具体包括无菌水溶液、非水溶剂,悬浮剂,乳剂,冻干制剂等。作为非水溶剂和悬浮剂,可以使用丙二醇、聚乙二醇、如橄榄油等植物油、油酸乙酯等的可注射用酯作为稀释剂。
118.上述药品的给药量根据待治疗的对象的年龄、性别、体重、待治疗的特定疾病或病理状况、疾病或病理状况的严重程度、给药途径以及开药者的判断而不同。基于这些因素的给药量的确定在本领域技术人员的认知水平内,通常给药量在0.01mg/kg/天至约2000mg/kg/天的范围内。较佳的给药量为1mg/kg/天至500mg/kg/天。给药可以为每天给药一次,也可以分几次给药。上述给药量不以任何方式限制本技术的范围。
119.本技术的药品可以通过各种途径给药至小鼠、家畜及人等的哺乳动物,可以预期所有的给药方式,例如可以通过:经口、直肠或静脉、肌肉、皮下、子宫内硬膜或脑血管内注射来给药。由于本技术的提取物几乎没有毒性和副作用,因此即使为了预防目的长时间服用,其药物也可以安全使用。
120.另外,上述第一方面提供的中药组合物、第二方面提供的提取物、或第三方面提供的制备方法提取的提取物可以用于保健功能食品中,其中提取物可以0.001重量百分比至小于100重量百分比添加到保健功能食品中。
121.上述保健功能食品包括片剂、胶囊剂、丸剂或液剂等形式,并且本技术的提取物可以添加在例如:肉类、香肠、面包、糖果类、点心类、面类、冰淇淋、乳制品、汤、饮料、口香糖、茶以及维生素复合剂等食品中。
122.以下结合实施例对本技术的一种中药组合物、提取物及其制备方法和应用、化妆品和药品作进一步的详细描述。以下实施例中,人参采用的为高丽参。
123.实施例1-7以及对比例1-7提取物的制备
124.提取方法:按照表1配置实施例1-7所示的中药组合物,按照表2配置对比例1-7所
示的中药组合物,将各中药组合物浸渍到其10倍重量的30%(v/v)的乙醇水溶液后,在室温(25℃)下,超声波处理进行提取(频率为20khz以上,提取2小时),接着,用旋转蒸发仪进行浓缩后,添加丁二醇制备成30%(v/v)的丁二醇水溶液后,用30%(v/v)的丁二醇水溶液稀释,获得1%(w/w)的固体含量的提取物溶液。
125.将获得的上述提取物溶液整体作为原料使用(此处为了便于理解,将上述提取物溶液整体作为原料a),使a在细胞培养液中以含量为0.01~3%(w/w)的添加浓度适用于以下各试验例中。
126.表1实施例1-7所示的中药组合物配比
[0127][0128]
表2对比例1-7所示的中药组合物配比
[0129][0130]
实施例8
[0131]
将实施例1中获得的1%(w/w)的固体含量的提取物溶液在水中稀释为固体含量为2.0%(w/w)的提取物水溶液,通过下表3的组成以如下制备方法制备化妆水。
[0132]
制备方法包括:依次将甘油、丁二醇、丙二醇、防腐剂添加到纯净水中,搅拌并溶解后,投入将加热到60℃左右溶解的聚氧乙烯氢化蓖麻子油,添加香料并进行溶解,之后进一
步加热混合液至60℃后,添加上述2.0%(w/w)的提取物水溶液、乙醇、三乙醇胺、色素并充分搅拌后,进行熟成。
[0133]
表3化妆水原料组成及配比
[0134]
原料重量百分比固体含量为2%(w/w)提取物水溶液2.0甘油3.0丁二醇2.0丙二醇2.0聚氧乙烯氢化蓖麻子油1.0乙醇10.0三乙醇胺0.1苯氧乙醇0.4蓝色1号0.01香料0.1纯净水至100
[0135]
实施例9
[0136]
将实施例1中提取物水溶液在水中稀释为固体含量为2.0%(w/w)的提取物水溶液,通过下表4的组成以如下制备方法制备护肤乳液。
[0137]
制备方法包括:将丙二醇、羧基聚合物、防腐剂、纯净水混合并搅拌,加热到80~85℃之间并添加到制造部后使乳化机工作,将蜂蜡、聚山梨酯60、失水山梨醇硬脂酸酯、液体石蜡、失水山梨糖醇硬脂酸酯、亲脂性单硬脂酸甘油酯、硬脂酸、硬脂酸甘油酯/peg-400硬脂酸酯、三乙醇胺加热到80~85℃之间以使其溶解后,将其投入制造部进行乳化。乳化完成后,使用搅拌机搅拌并冷却到50℃后,添加香料,继续冷却到45℃后,添加色素,继续冷却至35℃下,添加上述固体含量为2%(w/w)的提取物水溶液,最后冷却到25℃后,进行熟成。
[0138]
表4护肤乳液原料组成及配比
[0139]
原料重量百分比固体含量为2%(w/w)提取物水溶液2.0蜂蜡1.0聚山梨酯601.5失水山梨醇硬脂酸酯0.5液体石蜡10.0失水山梨糖醇硬脂酸酯1.0亲脂性单硬脂酸甘油酯0.5硬脂酸1.5硬脂酸甘油酯/peg-400硬脂酸酯1.0丙二醇3.0羧基聚合物0.1三乙醇胺0.2苯氧乙醇0.4
蓝色1号0.01香料0.1纯净水至100
[0140]
实施例10
[0141]
将实施例1中浓缩后冻干获得的提取物以2.0%(w/w)的方式在水中进行溶解后,将其作为原料,通过下表5的组成以如下制备方法制备乳霜。
[0142]
制备方法包括:将羧乙烯基聚合物、丁二醇、甘油、纯净水混合并搅拌,加热到80~85℃之间,添加到制造部后,使乳化机工作,将硬脂酸、鲸蜡醇、单硬脂酸甘油酯、聚氧乙烯山梨醇酐单硬脂酸酯、失水山梨醇倍半油酸酯、单硬脂酸甘油酯/硬脂酸甘油酯/聚氧乙烯硬脂酸酯、蜡、液体石蜡、角鲨烷、辛酸/癸酸三酸甘油酯加热到80~85℃之间以使其溶解后,加入三乙醇胺并搅拌,添加到制造部并进行乳化。乳化完成后,使用搅拌机搅拌并冷却到35℃,添加上述2%(w/w)提取物水溶液,冷却到25℃后,进行熟成。
[0143]
表5乳霜原料组成及配比
[0144]
原料含量(g)2%(w/w)提取物水溶液2.0硬脂酸2.0鲸蜡醇2.0单硬脂酸甘油酯2.0聚氧乙烯山梨醇酐单硬脂酸酯0.5失水山梨醇倍半油酸酯0.5单硬脂酸甘油酯/硬脂酸甘油酯/聚氧乙烯硬脂酸酯1.0蜡1.0液体石蜡4.0角鲨烷3.0辛酸/癸酸三酸甘油酯6.0羧乙烯基聚合物0.3丁二醇5.0甘油3.0苯氧乙醇0.4纯净水至100
[0145]
需要说明的是,以下试验例中,提取物溶液的添加浓度均是指以上述实施例1-7或对比例1-7所获得的1%(w/w)的固体含量的提取物溶液作为整体,该整体在培养液中的添加浓度。
[0146]
试验例1
[0147]
通过mtt比色法测定细胞生存率以评价各样品的细胞内毒性
[0148]
mtt比色法的原理如下:作为通过测定存活细胞的数量,mtt比色法广泛用于细胞增殖和毒性的实验方法,对于活细胞而言,线粒体内的水溶性的、且作为黄色盐的mtt可被琥珀酸脱氢酶还原为水不溶性蓝色甲瓒衍生物。所生成的甲瓒衍生物通常添加二甲基亚砜(dmso)来溶解,之后测定吸光度。
[0149]
实验方法:将hacat(人角质形成细胞系)在含有10%(v/v)的胎牛血清(fbs)、1%(v/v)的抗生素(anti-biotics)的dmem培养基,在37℃,5%的co2的条件下进行培养。
[0150]
将处于培养中的hacat细胞以1.5
×
105细胞/孔接种在24孔板,每孔接种1ml,培养24小时。将每个孔内培养基对应替换为含有如表6所示样品的无胎牛血清培养基,然后培养24小时之后,去除培养基,用0.25mg/ml的mtt溶液进行处理,并在37℃下反应4小时。之后,向去除mtt溶液的细胞添加1ml的dmso,溶解mtt甲瓒,在570nm下测定吸光度,并根据以下数学式计算细胞生存率。
[0151]
细胞生存率(%)=(样品吸光度值/对照组吸光度平均值)
×
100。
[0152]
细胞生存率的结果如表6以及图1。
[0153]
表6对hacat的细胞毒性结果
[0154][0155][0156]
根据表6以及图1的结果所示,与对照组相比,本技术提供的实施例1-7的提取物在上述添加浓度条件下都没有细胞毒性。
[0157]
也即是,上述提取物用于化妆品或药品时,没有细胞毒性。
[0158]
试验例2
[0159]
真皮成纤维细胞内胶原蛋白合成量增加效果
[0160]
1.人皮肤成纤维细胞的培养
[0161]
人皮肤成纤维细胞(human dermal fibroblast)购自promocell公司。将人皮肤成纤维细胞在dmem培养基(gibco公司)中在37℃条件培养。培养基维持至贴附的细胞达到80%的汇合时进行传代培养,期间每两天更换一次培养基,直至汇合为止。传代培养如下:用磷酸盐缓冲溶液(pbs)洗涤去除了培养液的培养瓶,用0.25%胰蛋白酶-edta(gibco brl,grand island,ny,usa)使细胞脱落后,对细胞悬浮液进行离心,之后测量细胞数量,并通过培养液以3倍进行传代培养。
[0162]
2.真皮成纤维细胞内胶原蛋白合成量增加效果
[0163]
为了确认对真皮成纤维细胞内胶原蛋白合成量产生的影响,进行了胶原蛋白测定实验。
[0164]
将传代培养后的人皮肤成纤维细胞添加到补充有10%(v/v)的胎牛血清和100u/ml的青霉素、100μg/ml的链霉素的dmem培养基,在37℃,5%的co2的条件下进行培养,培养1天后,去除培养基并经pbs冲洗,含有实施例1制得的提取物溶液的添加浓度为0.5wt%(作为处理组)培养基分别培养了24小时、48小时。用磷酸盐缓冲溶液(pbs)洗涤孔,共洗涤三次,将100μl的抗体-pod共轭溶液加入孔中,并放置1小时,接着用pbs洗涤孔三次,将100μl的底物溶液(tmb)加入孔中,并在25℃下放置30分钟。将100μl的1nh2so4加入孔中,利用酶联免疫吸附试验酶标仪在450nm的吸光度下,测定胶原蛋白的表达量。
[0165]
此时,处理组根据与dmso处理的对照组的相对吸光度差来计算胶原蛋白生成表达量,并得出了结果。将其结果示于图2。
[0166]
根据图2,可以看出,相比于对照组,无论培养24小时还是48小时,处理组的胶原蛋白表达量均显著增加。
[0167]
也即是,本技术提供的提取物具有促进胶原蛋白表达量增加的效果。
[0168]
3.真皮成纤维细胞内mmp-1表达抑制效果
[0169]
将真皮成纤维细胞接种到6孔板后,培养24小时,以使细胞贴附到板壁。去除培养基并用磷酸盐缓冲液(pbs)进行洗涤。在含有实施例1制得的提取物溶液的添加浓度分别为0(作为对照组)、0.1wt%(作为处理组)、0.5wt%(作为处理组)的培养基中,培养24小时。去除培养基后,用pbs进行洗涤。使用takara minibest通用rna提取试剂盒提取rna。每个样品使用1ug的总rna合成cdna。
[0170]
使用合成的cdna来实施了实时聚合酶链反应。具体地,使用sybr green荧光染料进行实时聚合酶链式反应的定量。人mmp-1的具体引物序列是正向引物5
’‑
ggg gag atc ggg agg aca ac-3’及反向引物5
’‑
ggg tac atc aaa gcc ccg at-3’。将磷酸甘油醛脱氢酶(gapdh)用作pcr反应的内参对照组,具体聚合酶链式反应(pcr)条件为在95℃下进行15分钟后,以在95℃下进行15秒、在60℃下进行45秒的方式共进行40个循环。将其结果示于图3。
[0171]
参照图3,可以确认发生了实施例1提供的提取物能够使引起皱纹的mmp-1基因的表达抑制,由此,可以确认实施例1中的提取物可以抑制皮肤皱纹的生成。
[0172]
4.真皮成纤维细胞内timp-1表达促进效果
[0173]
将真皮成纤维细胞接种到6孔板后,培养24小时,以使细胞贴附到板。去除培养基并用磷酸盐缓冲液(pbs)进行洗涤。在含有实施例1制得的提取物溶液的添加浓度分别为0(作为对照组)、0.1wt%(作为处理组)、0.5wt%(作为处理组)的培养基中培养24小时。去除
培养基后,用pbs进行洗涤。使用takara minibest通用rna提取试剂盒(takara minibest universal rna extraction kit)提取rna。每个样品使用1ug的总rna合成cdna。使用合成的cdna来实施了实时聚合酶链反应(real time pcr)。具体地,使用sybr green荧光染料进行实时聚合酶链式反应的定量。人timp-1的具体引物序列是正向引物5
’‑
act tcc aca ggt ccc aca ac-3’及反向引物5
’‑
aaa cag gga aac act gtg cat-3’。将磷酸甘油醛脱氢酶(gapdh)用作pcr反应的内参对照组,具体聚合酶链式反应(pcr)条件为在95℃下进行15分钟后,以在95℃下进行15分钟、在60℃下进行45秒的方式共进行40个循环。将其结果示于图4。
[0174]
参照图4,可以确认实施例1提供的提取物能够促进timp-1基因的表达,而促进基因timp-1的表达能够增加胶原蛋白的生成。
[0175]
综上,实施例1提供的提取物可以预防及改善皱纹。
[0176]
试验例3对h2o2的氧化应激的抗氧化效果
[0177]
1.在人类角质细胞的hacat细胞株中利用h2o2进行了活性氧抑制效果评价,以评价抗氧化效果。
[0178]
利用含有10%的牛血清的dmem培养基和hacat细胞株,在96孔板上每孔以3
×
104细胞/孔的浓度分别接种100μl,培养24小时后,将每个孔替换为含有表7所示的样品的无血清培养基后,培养24小时后,使用hbss进行洗涤。用20μm的h2dcfda(2',7'-dichlorodihydrofluorescein diacetate)处理培养的细胞,处理30分钟后,使用hbss(hanks'balanced salt solution)来洗涤过度染色的荧光,在板上培养h2o2处理组和未经h2o2处理组10分钟后,用hbss进行洗涤,用酶标仪(spark 10m elisa reader)在492nm下测定荧光值。去除缓冲液后,分别添加50μl的0.5%triton x-100,添加50μl的bca溶液,并使用bca蛋白质定量方法测定蛋白质的表达程度。通过之前测定的荧光值和蛋白质量,计算ros活性。结果示于表7以及图5。其中,以单独的100μm的h2o2处理的处理组的ros生成量设为100%,求出各样品对应处理组的ros生成量百分比收率,作为ros生成量。
[0179]
表7蛋白质的表达程度
[0180]
[0181][0182]
图5中(-)h2o2表示未经h2o2处理的实施例1,( )100μm h2o2表示经100μm h2o2处理的实施例1,横坐标表示添加的实施例1的提取物溶液的浓度。
[0183]
如表7及图5的结果所示,可知由于本技术的提取物具有优异的抑制因h2o2的氧化应激而产生的活性氧的抑制能力,同时根据对比例1和7,可知本技术上述原料构成的提取物具有抑制因h2o2的氧化应激而产生的活性氧能力。并且进一步地,对于因氧化应激而产生的活性氧的抑制能力,本技术实施例1-7的显著的高于对比例1-7,说明本技术采用特定的配比的原料互相协同作用佳,显著的提高其抗氧化能力。
[0184]
2.确认因h2o2的氧化应激而减少的nqo1基因表达的恢复效果
[0185]
为了评价对氧化应激的解毒效果,进行了nqo1(nad(p)h:quinone oxidoreductase 1)基因表达实验。
[0186]
将人类角质细胞(hacat)添加至含有10%(v/v)的牛血清dmem培养基,在6孔板上每孔分别以1.5
×
106细胞/孔的方式接种2ml,并培养24小时后,将每个孔替换为无血清培养基后处理如表8所示的样品,培养24小时,并且用无血清培养基替代后,处理10μm的h2o2和样品后,培养4小时。用pbs进行洗涤后,用(usa)对培养的细胞进行处理,从而进行细胞溶解(cell lysis)后,用制造商提供的方案
(protocol)分离rna。使用具有rna br分析(rna br assay)试剂盒的荧光计(fluoremeter)定量分离的rna后,合成cdna,并实施实时聚合酶链反应(real-time pcr)。cdna合成使用cdna合成试剂盒(qpcrbio cdna synthesis kit,pcrbiosystems,london,uk),并根据试剂盒的方法来进行实验。实时聚合酶链反应是使用实时聚合酶链反应试剂盒(2x qpcrbio sygreen blue mix lo-rox,pcrbiosystems,london,uk)扩增基因后,对扩增产物进行定量分析。用于pcr的nqo1、β-肌动蛋白引物(β-actin primer)是由考斯冒基因技术公司(cosmo gene tech(韩国))合成后使用。
[0187]
结果示于表8、图6。
[0188]
表8试验结果
[0189]
[0190][0191]
如表8及图6的结果所示,对于nqo1基因表达的恢复效果,本技术实施例1-7的显著的高于对比例1-7,说明本技术采用特定的配比的原料互相协同作用佳,能够显著的提高其抗nqo1基因表达的恢复效果。
[0192]
综上,本技术的提取物具有抗氧化功能。
[0193]
试验例4
[0194]
1.确认由于脂多糖(lps)的诱导而引起的炎症反应中的no生成的减少效果及细胞存活率
[0195]
利用lps对小鼠来源巨噬细胞raw264.7细胞株进行no生成抑制效果评价。具体用脂多糖(lipopolysaccharide,lps)(sigma,st.louis,mo)对作为小鼠的巨噬细胞的raw264.7细胞进行处理,测定诱生型一氧化氮合酶(inducible nitric oxide synthase,inos)活性抑制能力,以确认对人为诱导的炎症的抑制效果。
[0196]
将8
×
105raw264.7细胞悬浮在10%(v/v)的fbs-dmem(wellgin有限公司)培养基中,接种并附着于24孔细胞培养板。一天后,替换为含有0.1μg/ml的脂多糖的培养基,诱导炎症后,处理如表9所示的样品并培养24小时之后,回收上清液,在96孔板中分别添加100μ
l,添加同样的格里斯试剂(griess’reagent)(sigma,st.louis,mo),并在常温下轻摇10分钟后,在570nm下测定吸光度,将单独处理脂多糖的组的样品的no生成量设为100%,求出各样品对应处理组的no百分比收率,作为no活性。
[0197]
另外,去除样品处理培养基后,用0.25mg/ml浓度的mtt溶液进行处理,4小时后去除mtt,用dmso进行处理,并在570下nm测定吸光度,根据以下数学式计算细胞生存率,用于评价各样品对于细胞的毒性。
[0198]
得出如下表9及图7所示的结果。
[0199]
其中,细胞生存率(%)=(样品吸光度值/对照组吸光度平均值)
×
100。
[0200]
表9试验结果
[0201]
[0202][0203]
如表9和图7的结果所示,证明了本技术的提取物对于巨噬细胞raw264.7无毒性。
[0204]
并且根据表9中的对比例1至7,比较例1、7由于含有全部原料,相比于其他比较例抑制no生成能力效果佳。可知本技术上述原料构成的提取物互相配合,具有较佳的抑制no生成能力。并且进一步地,对于抑制no生成能力,本技术实施例1-7的显著的高于对比例1-7,说明本技术采用特定的配比的原料互相协同作用佳,能够显著的提高其抑制no生成能力,显著提高抗炎效果。
[0205]
2.确认由于lps诱导引起的炎症反应中的inos基因表达的抑制能力
[0206]
用脂多糖对作为小鼠的巨噬细胞的raw264.7细胞进行处理,人为增加作为炎症相关酶的inos的基因表达后,利用实时pcr方法测定基于本技术的混合提取物样品的表达抑
制。
[0207]
将2
×
106细胞悬浮在10%的fbs-dmem培养基中,接种并附着于60mm培养皿。一天后,替换为含有0.1μg/ml的脂多糖的培养基,诱导炎症后,处理如表10所示样品,并培养24小时。去除细胞的培养基,用(usa)进行处理,从而进行细胞溶解(cell lysis)后,用制造商提供的方案(protocol)分离rna。使用具有rna br assay试剂盒的荧光计(fluoremeter)定量分离的rna后,合成cdna,并实施实时聚合酶链反应(real-time pcr)。cdna合成使用cdna合成试剂盒(qpcrbio cdna synthesis kit,pcrbiosystems,london,uk),并根据试剂盒的方法来进行实验。实时聚合酶链反应是使用实时聚合酶链反应试剂盒(2x qpcrbio sygreen blue mix lo-rox,pcrbiosystems,london,uk)扩增基因后,对扩增产物进行定量分析。用于pcr的inos、磷酸甘油醛脱氢酶引物(gapdh primer)是由考斯冒基因技术公司(韩国)合成并使用。其中,以单独处理脂多糖的组的样品的inos mrna表达量设为100%,求出各样品对应处理组的inos mrna表达量百分比收率,作为inos mrna表达量。
[0208]
结果如表10以及图8所示。
[0209]
表10 inos基因表达的抑制能力试验结果
[0210][0211]
如表10和图8的结果所示,由于本技术的提取物具有优异的inos基因表达抑制效果,可以确认其具有抗炎功能。
[0212]
并且根据表10中的对比例1至比较例7,比较例1、7由于含有全部原料,相比于其他比较例inos基因表达抑制效果佳。并且进一步地,对于抑制no生成能力,本技术实施例1-7的显著的高于对比例1-7,说明本技术采用特定的配比的原料互相协同作用佳,能够显著的提高其抑制inos基因表达能力能力,显著提高抗炎效果。
[0213]
3.确认由于lps的诱导而引起的炎症反应中的cox-2基因表达抑制效果
[0214]
对作为小鼠的巨噬细胞的raw264.7细胞处理脂多糖,人为增加作为炎症相关酶的cox-2的基因表达后,利用实时pcr方法测定基于本技术的混合提取物样品的表达抑制。
[0215]
将2
×
106raw264.7细胞悬浮在10%的fbs-dmem培养基中,接种并附着于60mm培养皿。一天后,替换为含有0.1μg/ml的脂多糖的培养基,诱导炎症后,处理如表11所示样品,并培养24小时。去除细胞的培养基,用(usa)进行处理,从而进行细胞溶解(cell lysis)后,用制造商提供的方案(protocol)分离rna。使用具有rna br assay试剂盒的荧光计(fluoremeter)定量分离的rna后,合成cdna,并实施实时聚合酶链反应(real-time pcr)。cdna合成是使用cdna合成试剂盒(qpcrbio cdna synthesis kit,pcrbiosystems,london,uk),并根据试剂盒的方法来进行实验。实时聚合酶链反应是使用实时聚合酶链反应试剂盒(2x qpcrbio sygreen blue mix lo-rox,pcrbiosystems,london,uk)扩增基因后,对扩增产物进行定量分析。用于pcr的cox-2、磷酸甘油醛脱氢酶引物(gapdh primer)是由考斯冒基因技术公司(韩国)合成并使用。其中,以单独处理脂多糖的组的样品的cox-2mrna表达量设为100%,求出各样品对应处理组的cox-2mrna表达量百分比收率,作为cox-2mrna表达率。
[0216]
结果如表11以及图9所示。
[0217]
表11 cox-2基因表达抑制实验结果
[0218]
[0219]
如表11和图9的结果所示,本技术的提取物具有优异的cox-2基因表达抑制效果,可以确认其具有抗炎功能。
[0220]
并且根据表11中的对比例1至7,可知本技术上述原料构成的提取物互相配合,具有较佳的cox-2基因表达抑制作用。并且进一步地,对于抑制no生成能力,本技术实施例1-7的显著的高于对比例1-7,说明本技术采用特定的配比的原料互相协同作用佳,能够显著的提高其抑制cox-2基因表达能力,显著提高抗炎效果。
[0221]
综上,试验例4确定本技术提供的提取物具有较佳的抗炎效果。
[0222]
综上,本技术提供的中药组合物以及提取物,均是利用特定的原料连翘果、蒺藜果、刺五加、玉竹、枳实及人参的互相配合,协同增效,具有抑制mmp-1基因表达、促进timp-1表达、抑制活性氧生成、促进因氧化应激而减少的nqo1基因表达、抑制no生成以及抑制inos表达能力,其不仅具有抗氧化、抗皱以及抗炎的效果,同时无毒,因此可应用于药品、化妆品及保健品等相关领域中。
[0223]
以上仅为本技术的具体实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。