血中
β
淀粉样蛋白的免疫测定方法及用于该方法的试剂盒
技术领域
1.本发明涉及血中β淀粉样蛋白的免疫测定方法及用于该方法的试剂盒。
背景技术:
2.β淀粉样蛋白作为阿尔茨海默病的生物标志物是公知的,通过免疫测定来测定样本中的β淀粉样蛋白也是已知的(专利文献1),用于其的试剂盒也有售。市售的多种β淀粉样蛋白的免疫测定试剂盒使用脑脊液(csf)作为样本。另一方面,已知阿尔茨海默病患者的血液中也存在β淀粉样蛋白。csf的采集是侵入性的,因此若能够通过免疫学方式测定血液样本中的β淀粉样蛋白则是有利的。现有技术文献专利文献
3.专利文献1:wo 2017/179611
技术实现要素:
发明所要解决的技术问题
4.无论是csf中还是血液中,测定对象同样为β淀粉样蛋白,因此认为与csf同样地能够对血液中的β淀粉样蛋白进行免疫测定。但是,想要对血液样本中的β淀粉样蛋白进行免疫测定时,获知存在与以csf为样本时相比灵敏度降低这一问题。
5.因此,本发明的目的在于,提供能够高灵敏度地测定血液样本中的β淀粉样蛋白的免疫测定方法及用于其的试剂盒。用于解决技术问题的手段
6.本技术发明人们对血液中的β淀粉样蛋白的测定进行了深入研究,结果发现,通过在阴离子型聚合物的存在下进行血液样本中的β淀粉样蛋白与抗β淀粉样蛋白抗体或其抗原结合片段的抗原抗体反应,能够高灵敏度地测定血液样本中的β淀粉样蛋白,从而完成了本发明。
7.即,本发明提供以下方案。
8.(1)一种β淀粉样蛋白的免疫测定方法,其是对血液样本中的β淀粉样蛋白进行免疫测定的方法;所述方法中,在阴离子型聚合物的存在下进行上述免疫测定。(2)根据(1)所述的方法,其中,上述阴离子型聚合物为在侧链上具有硫酸基或磺酸基的阴离子型聚合物。(3)根据(2)所述的方法,其中,上述阴离子型聚合物为选自由硫酸葡聚糖及其盐、聚苯乙烯磺酸及其盐、以及硫酸肝素及其盐组成的组中的至少一种。(4)根据(3)所述的方法,其中,上述阴离子型聚合物为葡聚糖硫酸钠。(5)根据(1)~(4)中任一项所述的方法,其中,上述免疫测定为夹心法,所述方法包括:在上述阴离子型聚合物的存在下,使上述血液样本中的上述β淀粉样蛋白与固相化于固相的抗β淀粉样蛋白抗体或其抗原结合片段接触,测定该β淀粉样蛋白的步骤。
(6)根据(1)~(5)中任一项所述的方法,其中,上述β淀粉样蛋白为β淀粉样蛋白1-40或β淀粉样蛋白1-42。(7)一种试剂盒,其用于对血液样本中的β淀粉样蛋白进行免疫测定,包含抗β淀粉样蛋白抗体或其抗原结合片段和阴离子型聚合物。(8)根据(7)所述的试剂盒,其中,上述免疫测定为夹心法,所述试剂盒包含固相化有抗β淀粉样蛋白抗体或其抗原结合片段的固相和阴离子型聚合物。(9)根据(8)所述的试剂盒,其中,上述固相为粒子,所述试剂盒具备包含该粒子和上述阴离子型聚合物的粒子液。发明的效果
9.根据本发明的方法,能够高灵敏度地测定血液样本中的β淀粉样蛋白。
附图说明
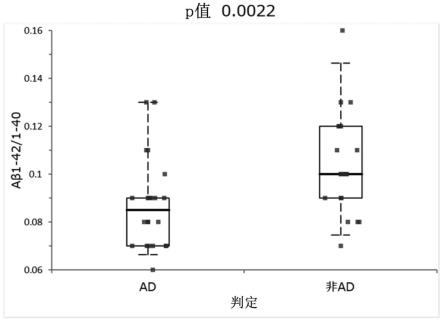
10.图1为示出下述实施例中测定的阿尔茨海默病患者和健康人的aβ
1-42
/aβ
1-40
比的图。
具体实施方式
11.供于本发明的免疫测定方法的样本为血液样本。血液样本包括全血、血清、血浆中的任一种。优选为血清或血浆。
12.如后述实施例具体记载那样,通过向血浆及缓冲液中添加纯化β淀粉样蛋白且使用免疫测定来比较所添加的β淀粉样蛋白的回收水平(计数值)的实验,通过凝胶过滤色谱发现存在洗脱到相当于分子量300~400kda的级分中的、抑制β淀粉样蛋白与抗β淀粉样蛋白抗体的反应的物质(包覆物质)。进一步研究的结果是,发现通过在阴离子型聚合物的存在下进行免疫测定的抗原抗体反应,能够减轻包覆物质所引起的结合抑制。本发明基于该新见解,最大的特征在于在阴离子型聚合物的存在下进行免疫测定。
13.作为阴离子型聚合物,优选硫酸葡聚糖、硫酸肝素、硫酸软骨素a、硫酸软骨素b及硫酸软骨素c以及这些的盐之类的在侧链中具有硫酸基的阴离子型聚合物;聚苯乙烯磺酸及其盐之类的在侧链中具有磺酸基的阴离子型聚合物;以及聚(甲基)丙烯酸及其盐之类的具有羧基的阴离子型聚合物。这些中,优选在侧链中具有硫酸基或磺酸基的阴离子型聚合物,更优选硫酸葡聚糖、聚苯乙烯磺酸及硫酸肝素以及这些的盐,特别优选硫酸葡聚糖及聚苯乙烯磺酸以及这些的盐,尤其优选硫酸葡聚糖及其盐。作为盐,可列举钠盐、钾盐等碱金属盐。这些阴离子型聚合物既可以单独使用,也可以将两种以上组合使用。
14.阴离子型聚合物的平均分子量以质均分子量计通常为1000~5000000左右、2000~4000000左右、3000~2000000左右、4000~1000000左右,优选为5000~700000左右,更优选为5000~50000左右。
15.已明确了,阴离子型聚合物能够减轻包覆物质对β淀粉样蛋白与抗β淀粉样蛋白抗体或其抗原结合片段(以下,除了从上下文看明确排除并非如此的情况以外,“抗体”这一术语表示“抗体或其抗原结合片段”)的抗原抗体反应的抑制,因此在任意免疫测定方法中均有效。即,免疫测定包括夹心法、竞争法、凝集法、免疫色谱法等,本发明包括这些免疫测定中的任一种。这些免疫测定方法本身是已知的,这里没有必要详细说明,因此分别简单进行
说明。
16.夹心法包括例如化学发光酶免疫测定法(chemiluminescent enzyme immunoassay;cleia)、酶联免疫吸附法(enzyme-linked immunosorbent assay;elisa)、放射免疫测定、电化学发光免疫测定法(electro chemiluminescence immunoassay;eclia)、荧光免疫测定法(fluorescence immunoassay;fia)等各种手法,本发明包括其中任意方法。本发明的免疫测定没有特别限定,可以为夹心法。夹心法例如包括一步夹心法和两步夹心法。
17.两步夹心法中,例如首先使固相化在固相上的抗β淀粉样蛋白抗体或要固相化于固相的抗β淀粉样蛋白抗体(固相抗体)与血液样本中的β淀粉样蛋白接触,进行固相抗体与β淀粉样蛋白的抗原抗体反应(一次反应)。在固相抗体为要固相化于固相的抗β淀粉样蛋白抗体的情况下,在一次反应后,将固相抗体固定化于固相。然后进行b/f分离。接着,使结合在固相抗体的β淀粉样蛋白与用于检测的结合有标记物质的抗β淀粉样蛋白抗体(标记抗体)接触,进行β淀粉样蛋白与标记抗体的抗原抗体反应(二次反应)。接着,进行b/f分离,检测结合在固相上的β淀粉样蛋白上结合的标记抗体的标记来源的信号,由此可以测定血液样本中的β淀粉样蛋白。b/f分离后,可以进行洗涤。
18.一步夹心法中,使固相抗体与样本中的β淀粉样蛋白与标记抗体接触,在一个工序中进行固相抗体与β淀粉样蛋白的抗原抗体反应以及β淀粉样蛋白与标记抗体的抗原抗体反应。在固相抗体为要固相化于固相的抗β淀粉样蛋白抗体的情况下,在抗原抗体反应后或在抗原抗体反应的同时,将固相抗体固定化于固相。然后,进行b/f分离,检测结合在固相上的β淀粉样蛋白上结合的标记抗体的标记来源的信号,由此可以测定血液样本中的β淀粉样蛋白。
19.直接竞争法为如下方法:将针对要测定的靶抗原(本发明中为β淀粉样蛋白)的抗体固定化(固相化)到固相上,进行用于防止非特异吸附的封闭处理(用血清白蛋白等蛋白质溶液处理固相)后,使该抗体与包含上述靶抗原的被检试样与一定量的标记抗原反应,洗涤后,对结合在固相上的标记进行定量。被检试样中的抗原与标记抗原竞争性地与抗体结合,因此被检试样中的抗原量越多则固相上结合的标记的量越少。制作各种已知浓度的抗原标准液,分别测定固相上固定化的标记量(根据标记的性质而测定吸光度、发光强度、荧光强度等,以下相同),制作横轴取抗原浓度、纵轴取标记量的标准曲线。对于未知的被检试样,测定标记量,将测得的标记量代入标准曲线,由此可以测定未知被检试样中的抗原量。直接竞争法本身在该领域中是已知的,例如记载于us20150166678a。
20.间接竞争法中,将靶抗原(本发明中为β淀粉样蛋白)固相化。接着,在进行固相的封闭处理后,将包含靶抗原的被检试样与一定量的抗靶抗原抗体混合,与上述固相化抗原反应。洗涤后对结合于固相的上述抗靶抗原抗体进行定量。其可以通过使针对上述抗靶抗原抗体的标记二抗反应、并且在洗涤后测定标记量来进行。制作各种已知浓度的抗原标准液,分别固定化于固相,测定标记量,制作标准曲线。对于未知的被检试样,测定标记量,将测得的标记量代入标准曲线,由此可以测定未知的被检试样中的抗原量。需要说明的是,也可以不使用标记二抗而使用标记一抗。间接竞争法本身在该领域中是已知的,例如记载于上述的us20150166678a。
21.上述的各种免疫测定中,化学发光酶免疫法(cleia)、化学发光免疫(clia)、酶免
疫法(eia)、放射免疫(ria)、荧光免疫(fia)为基于进行上述直接竞争法、间接竞争法、夹心法等时使用的标记的种类进行分类的免疫测定。化学发光酶免疫法(cleia)为使用酶(例如碱性磷酸酶)作为标记、使用生成化学发光性化合物的底物(例如amppd)作为底物的免疫测定。酶免疫法(eia)为使用酶(例如过氧化物酶、碱性磷酸酶、萤光素酶、β半乳糖苷酶等)作为标记的免疫测定。作为各酶的底物,使用能够通过吸光度测定等来定量的化合物。例如过氧化物酶的情况下,使用1,2-苯二胺(opd)、3,3',5,5'-四甲基联苯胺(tmb)等,碱性磷酸酶的情况下,使用对硝基苯基磷酸盐(pnpp)等,β-半乳糖苷酶的情况下,使用mg:4-甲基伞形酮基半乳糖苷、ng:硝基苯基半乳糖苷等,萤光素酶的情况下,使用萤光素等。放射免疫(ria)为使用放射性物质作为标记的方法,作为放射性物质,可列举3h、
14
c、
32
p、
35
s、
125
i等放射性元素。荧光免疫(fia)为使用荧光物质或荧光蛋白作为标记的方法,作为荧光物质或荧光蛋白,可列举荧光素、荧光素异硫氰酸酯、罗丹明、绿色荧光蛋白、红色荧光蛋白等。使用这些标记的免疫测定本身在该领域中是已知的,例如,记载于us8039223b、us20150309016a1。
22.免疫比浊法(tia)为利用下述现象的免疫测定:待测定的靶抗原(本发明中为β淀粉样蛋白)与针对该抗原的抗体结合,所生成的抗原抗体复合物会使浊度增大。向抗靶抗原抗体溶液中添加各种已知浓度的抗原,分别测定浊度,制作标准曲线。对于未知的被检试样,同样测定浊度,将测得的浊度代入标准曲线,由此可以测定未知的被检试样中的抗原量。免疫比浊法本身是已知的,例如记载于us 20140186238 a1。胶乳凝集法与免疫比浊法类似,是使用表面固定化有抗靶抗原抗体的胶乳粒子的悬浮液代替免疫比浊法中的抗体溶液的方法。免疫比浊法及胶乳凝集法本身在该领域中是已知的,例如记载于us 7820398 b。
23.免疫色谱法为在由滤纸、纤维素膜、玻璃纤维、无纺布等多孔性材料形成的基体(也称为基质、试纸条)上进行上述夹心法、竞争法的方法。例如,基于夹心法的免疫色谱法的情况下,在上述基体上设置固定化有抗靶抗原抗体的检测区,向基体添加包含靶抗原的被检试样,使展开液从上游侧开始流动而使靶抗原移动到检测区,并且固定化于检测区。用标记二抗对固定化的靶抗原进行夹心,检测被固定在检测区的标记,由此检测被检试样中的靶抗原。通过在检测区的上游侧预先形成包含标记二抗的标记区,从而将靶抗原与标记二抗的结合体固定化于检测区。在标记为酶的情况下,还在检测区的上游侧设置包含酶的底物的底物区。竞争法的情况下,例如,可以预先在检测区固定化靶抗原,并且使被检试样中的靶抗原与检测区中固定化的靶抗原进行竞争。在检测区的上游侧预先设置标记抗体区,使被检试样中的靶抗原与标记抗体反应,将未反应的标记抗体固定化于检测区,对标记进行检测或定量,由此可以检测或定量被检试样中的靶抗原。免疫色谱法本身在该领域中是已知的,例如记载于us 6210898 b。
24.上述的各种免疫测定中,从检测灵敏度及自动化的容易性的观点出发,优选夹心法,特别是化学发光酶免疫法(cleia),其是使用磁性粒子作为固相、使用酶(例如碱性磷酸酶)作为标记、使用生成化学发光性化合物的底物(例如3-(2
’‑
螺金刚烷)-4-甲氧基-4-(3
’‑
磷酰氧基)苯基-1,2-二氧杂环丁烷二钠盐(amppd))作为底物的免疫测定。
25.阴离子型聚合物存在于使血液样本中的β淀粉样蛋白与抗β淀粉样蛋白抗体接触、进行血液样本中的β淀粉样蛋白与抗β淀粉样蛋白抗体的抗原抗体反应的反应体系中。
26.例如,两步夹心法中,优选阴离子型聚合物存在于使固相抗体与样本中的β淀粉样
蛋白接触而进行固相抗体与β淀粉样蛋白的抗原抗体反应的反应体系中。一步夹心法中,优选阴离子型聚合物存在于使固相抗体与样本中的β淀粉样蛋白与标记抗体接触而进行抗原抗体反应的反应体系统中。
27.固相没有特别限定,可以使用公知的免疫测定中所用的固相。作为固相材质的具体例,可列举聚苯乙烯、聚乙烯、琼脂糖、胶乳、葡聚糖、琼脂糖、明胶、聚丙烯酰胺等,但是不限于这些。使用的固相优选抗体容易固定化于其表面,可以使测定中所形成的免疫复合体和未反应的成分容易地分离的固相。特别地,优选通常用于免疫测定法的塑料板、胶乳粒子、磁性粒子。从处理、保存及分离的容易性等观点出发,最优选使用上述材质的磁性粒子。可以利用本领域技术人员已知的常规方法进行抗体在这些固相上的固相化。抗体在固相上的固相化可以通过物理吸附进行,也可以使用共价键。关于抗体在固相上的固相化,还可以将生物素-链霉亲和素之类的亲和性物质中的一方固相化于固相,使另一方与抗体结合,将这些混合而经由亲和性物质将抗体固相化于固相。
28.标记物质也没有特别限定,可以使用公知的与免疫测定中所用的标记物质同样的标记物质。作为具体例,可列举酶、荧光物质、化学发光物质、染色物质、放射性物质等。作为酶,可以使用碱性磷酸酶(alp)、过氧化物酶、β半乳糖苷酶等公知的酶,但是不限于此。
29.β淀粉样蛋白是其前体被酶切断而生成的,根据切断酶的不同而存在多种,如由第1位~第42位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白1-42(aβ
1-42
))、由第1位~第40位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白1-40(aβ
1-40
))、由第5位~第42位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白5-42(aβ
5-42
))、由第5位~第40位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白5-40(aβ
5-40
))、由第11位~第42位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白11-42(aβ
11-42
))、由第11位~第40位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白11-40(aβ
11-40
))、由第16位~第42位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白16-42(aβ
16-42
))、由第16位~第40位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白16-40(aβ
16-40
))、由第17位~第42位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白17-42(aβ
17-42
))、由第17位~第40位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白17-40(aβ
17-40
))、由第20位~第42位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白20-42(aβ
20-42
))、由第20位~第40位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白20-40(aβ
20-40
))、由第21位~第42位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白21-42(aβ
21-42
))、由第21位~第40位的氨基酸构成的β淀粉样蛋白(β淀粉样蛋白21-40(aβ
21-40
))、由第35位~第42位的氨基酸构成的β淀粉样蛋白(称为β淀粉样蛋白35-42(aβ
35-42
))和由第35位~第40位的氨基酸构成的β淀粉样蛋白(“β淀粉样蛋白35-40(aβ
35-40
))等。将aβ
1-42
、aβ
5-42
、aβ
11-42
、aβ
16-42
、aβ
17-42
、aβ
20-42
、aβ
21-42
、aβ
35-42
统称为β淀粉样蛋白x-42。另外,将aβ
1-40
、aβ
5-40
、aβ
11-40
、aβ
16-40
、aβ
17-40
、aβ
20-40
、aβ
21-40
、aβ
35-40
统称为β淀粉样蛋白x-40。本发明在任意β淀粉样蛋白的测定中均有用,测定这些中的任一种的情况均包含在本发明的范围内,特别优选用于测定β淀粉样蛋白1-42及β淀粉样蛋白1-40。
30.抗β淀粉样蛋白抗体或其抗原结合片段只要是与β淀粉样蛋白特异性结合的抗体或其抗原结合片段即可。抗体可以为单克隆抗体,也可以为多克隆抗体。通常优选使用单克隆抗体。多克隆抗体及单克隆抗体的制作方法是已知的,因此可以使用β淀粉样蛋白抗原作为免疫原来制备抗β淀粉样蛋白抗体。“抗原结合片段”只要维持了原抗体对对应抗原的结合性(抗原抗体反应性)则可以为任意抗体片段。作为具体例,可列举fab、f(ab')2、scfv等,
但是不限于这些。众所周知,fab、f(ab')2可以通过用木瓜蛋白酶、胃蛋白酶之类的蛋白水解酶处理抗体而得到。scfv(single chain fragment of variable region,单链抗体)的制作方法也是已知的,可以按照已知的方法来制作。
31.抗β淀粉样蛋白抗体或其抗原结合片段可根据成为测定对象的β淀粉样蛋白的种类来适宜选择。这样的抗体和抗体组合是公知的,可以使用市售物质。
32.例如,在利用夹心法测定β淀粉样蛋白1-42时,可以使用与β淀粉样蛋白x-42的c末端区域特异性结合的抗体(抗aβ42抗体)和与包含β淀粉样蛋白的第1位氨基酸的n末端区域特异性结合的抗体(抗aβn末端抗体)。如上所述,这样的抗体可以使用市售的抗体,也可以利用已知方法来制造。可以使用抗aβ42抗体作为固相抗体,使用抗aβn末端抗体作为作为标记抗体;也可以反过来使用抗aβn末端抗体作为固相抗体,使用抗aβ42抗体作为标记抗体。
33.另外,利用夹心法测定β淀粉样蛋白1-40时,可以使用与β淀粉样蛋白x-40的c末端区域特异性结合的抗体(抗aβ40抗体)和与包含β淀粉样蛋白的第1位氨基酸的n末端区域特异性结合的抗体(抗aβn末端抗体)。如上所述,这些抗体可以使用市售的抗体,也可以利用已知的方法制造。可以使用抗aβ40抗体作为固相抗体,使用抗aβn末端抗体作为标记抗体;也可以反过来使用抗aβn末端抗体作为固相抗体,使用抗aβ40抗体作为标记抗体。
34.阴离子型聚合物可以另行添加到抗原抗体反应体系中,也可以预先添加到包含抗体固相化粒子等抗体固相化固相的溶液、用于稀释血液样本的样本稀释液等试剂类中。另外,也可以预先添加到血液样本中。
35.抗原抗体反应体系中的阴离子型聚合物的终浓度通常为0.01g/l~50g/l左右、0.02g/l~25g/l左右、0.03g/l~10g/l左右、0.04g/l~5g/l左右,优选为0.05g/l~2.5g/l左右。
36.免疫测定方法本身是已知的,如上所述,本发明可用于任意免疫测定方法。即,本发明的免疫测定方法除了在阴离子型聚合物的存在下进行抗原抗体反应以外,可以直接使用已知的免疫测定方法。进而,如上所述,以csf为样本的免疫测定已有实施,因此也可以直接利用该免疫测定中使用的试剂盒。
37.需要说明的是,已知与csf中同样地血液中也包含aβ
1-42
和aβ
1-40
这两者,已知对于csf中及血液中任一者而言通过获得它们的比、即aβ
1-42
/aβ
1-40
可提高诊断特异度,因此正在采用对aβ
1-42
和aβ
1-40
这两者进行定量、并计算其比值的方法。该比小于健康人的情况下,可判定为阿尔茨海默病的可能性高。通常,从采集血液样本至免疫测定的时间较长时,免疫测定的灵敏度下降,但是如下述实施例具体记载那样,还发现了如下预料之外的效果:通过在阴离子型聚合物的存在下进行抗原抗体反应,即使采集样本后经过时间较长,灵敏度也几乎不下降(即,aβ
1-42
/aβ
1-40
几乎不经时变化)。
38.本发明的试剂盒为用于进行上述的本发明的免疫测定方法的试剂盒即可,所述试剂盒至少包含抗β淀粉样蛋白抗体和阴离子型聚合物。在免疫测定为夹心法的情况下,还包含固相化有抗β淀粉样蛋白抗体的固相。在该固相为磁性粒子之类的粒子时,还包含该粒子(通常处于粒子液的形态)。可以通过使已知的β淀粉样蛋白免疫测定用试剂盒包含阴离子型聚合物,来制作本发明的试剂盒。如上所述,阴离子型聚合物既可以包含在抗β淀粉样蛋白抗体固相化粒子液、样本稀释液等试剂类中,也可以另外单独地包含在试剂盒中。实施例
39.以下基于实施例具体说明本发明。当然,本发明不受下述实施例限定。
40.<固相化粒子的制备>在10mm mes缓冲液(ph5.0)中,向磁性粒子0.01g/ml添加与β淀粉样蛋白x-42的c末端区域特异性结合的小鼠抗aβ42抗体0.2mg/ml,在25℃下一边缓慢搅拌一边温育1小时。反应后,用磁体收集磁性粒子,将粒子用洗涤液(50mm tris缓冲液、150mm nacl、2.0%bsa、ph7.2)洗涤,得到抗aβ42抗体固相化粒子。将得到的抗aβ42抗体固相化粒子悬浮于粒子稀释液(50mm tris缓冲液、1mm edta2na、0.1%nan3、2.0%bsa、ph7.2),得到抗aβ42抗体固相化粒子溶液。
41.使用与β淀粉样蛋白x-40的c末端区域特异性结合的小鼠抗aβ40抗体,同样地制备了抗aβ40抗体固相化粒子及抗aβ40抗体固相化粒子溶液。
42.<碱性磷酸酶标记抗体的制备>将脱盐碱性磷酸酶(alp)和n-(4-马来酰亚胺丁酰氧基)-琥珀酰亚胺(gmbs)(终浓度0.3mg/ml)混合,在30℃下静置1小时而进行马来酰亚胺化。接着,在偶联用反应液(100mm磷酸缓冲液、1mm edta2na、ph6.3)中,将fab’化的、与包含β淀粉样蛋白的第1位氨基酸的n末端区域特异性结合的小鼠抗aβn末端抗体和马来酰亚胺化alp以1:1的摩尔比混合,在25℃下反应1小时。使用superdex200 10/300(ge公司制)的柱色谱进行纯化,得到碱性磷酸酶标记抗体(alp标记抗体)。将alp标记抗体悬浮于标记体稀释液(50mm mes缓冲液、150mm nacl、0.3mm zncl2、1mm mgcl2、0.1%nan3、2.0%bsa、ph6.8),得到alp标记抗体溶液。
43.<β淀粉样蛋白1-42(aβ
1-42
)的测定方法>将样品50μl和抗aβ42抗体固相化粒子溶液50μl分注于反应槽,并进行搅拌。然后,在37℃下温育8分钟,使用磁场进行b/f分离及进行洗涤。再向该反应槽中分注alp标记抗体溶液50μl,搅拌后在37℃下温育8分钟,使用磁场进行b/f分离及进行洗涤。然后,向反应槽分注包含作为化学发光底物的3-(2
’‑
螺金刚烷)-4-甲氧基-4-(3
”‑
磷酰氧基)苯基-1,2-二氧杂环丁烷二钠盐(amppd)的lumipulse(注册商标)底物液(fujirebio inc.制)200μl,搅拌后在37℃温育4分钟后,用光度计测定发光量。实际测定中,利用全自动化学发光酶免疫测定系统(lumipulsel2400(fujirebio inc.制))来进行。
44.<β淀粉样蛋白1-40(aβ
1-40
)的测定方法>向样品槽分注样品30μl和抗aβ40抗体固相化粒子溶液50μl,并进行搅拌。然后,在37℃下温育8分钟,使用磁场进行b/f分离及进行洗涤。再向该反应槽中分注酶标记抗体溶液50μl,搅拌后,在37℃下温育8分钟,使用磁场进行分离及进行洗涤。然后,向反应槽中分注包含amppd的lumipulse底物液(fujirebio inc.制)200μl,搅拌后在37℃下温育4分钟后,用光度计测定发光量。实际测定中,利用全自动化学发光酶免疫测定系统(lumipulse l2400(fujirebio inc.制))进行。
45.实施例1研究了葡聚糖硫酸钠在使用血液样品的aβ
1-42
及aβ
1-40
测定中的添加效果。
46.作为样品,向aβ
1-42
及aβ
1-40
为检测限以下的血液样品(血清及edta
·
2k血浆)4.5ml中添加分别以约794pg/ml的浓度及约7744pg/ml的浓度包含aβ
1-42
抗原及aβ
1-40
抗原的脑脊液(csf)500μl,由此制备含抗原血清(serum1、serum2)及含抗原血浆(edta2k)。另外,向tris缓冲生理盐水(tbs缓冲液、ph7.4)中添加与血液样品同浓度的aβ
1-42
抗原及aβ
1-40
抗原,
由此制备含抗原tbs缓冲液(buffer)。使用制备的样品,按照上述的“aβ
1-42
的测定方法”及“aβ
1-40
的测定方法”中记载的方法分别测定aβ
1-42
及aβ
1-40
。作为葡聚糖硫酸钠,将葡聚糖硫酸钠(质均分子量5000(以下记载为“分子量5000”,其它也同样))添加到抗体固相化粒子溶液中,使其为0.5g/l,研究其的添加效果。关于抗原抗体反应体系中的葡聚糖硫酸钠的终浓度,aβ
1-42
为0.25g/l、aβ
1-40
为0.31g/l。另外,对作为空白的未添加抗原的各样品(血清、edta
·
2k血浆及tbs缓冲液)同样地进行测定,将得到的计数作为空白值。从各含抗原样品的计数中减去空白值,作为计数值。将aβ
1-42
的结果示于表1,将aβ
1-40
的结果示于表2。
47.[表1][表1]
[0048]
[表2]
[0049]
如表1所示,未添加葡聚糖硫酸钠的条件下,血清样品及血浆样品的aβ
1-42
计数值为比缓冲液样品的计数值低的值。若将缓冲液样品的计数值设为100%,则作为血清样品的血浆2的计数值大幅降低至56.9%。
[0050]
另一方面,向抗体固相化粒子溶液中添加葡聚糖硫酸钠并测定aβ
1-42
时,血清样品及血浆样品的计数值均上升,相对于缓冲液样品的计数值而言,计数值恢复到80%以上。
[0051]
另外,如表2所示,对于aβ
1-40
而言,未添加葡聚糖硫酸钠的条件下,血浆样品的aβ
1-40
计数值也为比缓冲液样品的计数值低的值。将缓冲液样品的计数值设为100%,血浆样品edta2k大幅降低至36.4%。另一方面,向抗体固相化粒子溶液中添加葡聚糖硫酸钠而测定aβ
1-40
时,血浆样品的计数值上升,相对于缓冲液样品的计数值而言,计数值恢复至90%以上。
[0052]
实施例2
研究了血液中aβ
1-42
的测定中葡聚糖硫酸钠的添加浓度。利用实施例1中记载的方法,测定含抗原血清(血浆1、血浆2)、含抗原血浆(edta2k)及含抗原tbs缓冲液(buffer)的aβ
1-42
。作为葡聚糖硫酸钠,将葡聚糖硫酸钠(分子量5000)添加到抗体固相化粒子溶液中,使其为表3的浓度(0.1g/l~5.0g/l),研究其添加效果。抗原抗体反应体系中的葡聚糖硫酸钠的终浓度为0.05g/l~2.5g/l。另外,与实施例1同样取得空白值,计算计数值。将结果示于表3。
[0053]
[表3]
[0054]
如表3所示,在所研究的葡聚糖硫酸钠的所有浓度条件下,计数值与未添加条件下的计数值相比均上升。
[0055]
实施例3~5、比较例1~3研究了各种阴离子型聚合物的添加对血液样品中的aβ测定的效果。使用在实施例1及2中在未添加葡聚糖硫酸钠条件下计数值明显下降的血清(含抗原血清、血浆2)以及含抗原tbs缓冲液(buffer),按照实施例1记载的方法测定aβ
1-42
。作为阴离子型聚合物,使用葡聚糖硫酸钠(分子量5000)(实施例3)、聚(4-苯乙烯磺酸钠)(分子量700000)(实施例4)、十二烷基硫酸钠(sds)(比较例1)、十二烷基苯磺酸钠(sdbs)(比较例2)、聚丙烯酸钠盐(分子量5100)(实施例5)、n-月桂酰基肌氨酸钠(nls)(比较例3)。将这些阴离子型聚合物以0.5g/l添加到抗体固相化粒子溶液中,研究其添加效果。另外,与实施例1同样地取得空白值,计算计数值。将结果示于表4。
[0056]
[表4]
[0057]
如表4所示,在未添加阴离子型聚合物的条件下,血清样品(血浆2)计数值与缓冲液样品的计数值相比为56.9%,与此相对地,添加作为阴离子型聚合物的葡聚糖硫酸钠(实施例3)、聚(4-苯乙烯磺酸钠)(实施例4)及聚丙烯酸钠盐(实施例5)时,计数值分别上升到82.6%、77.4%及66.9%。特别地,作为在侧链中具有硫酸基或磺酸基的阴离子型聚合物的葡聚糖硫酸钠及聚(4-苯乙烯磺酸钠)的情况下,计数值的恢复较大,表明尤其有效。另一方
面,即使添加作为在侧链中具有硫酸基的表面活性剂的sds(比较例1)、作为在侧链中具有磺酸基的表面活性剂的sdbs(比较例2)或作为在侧链中具有羧基的nls(比较例3),计数值也没有恢复。
[0058]
由此表明,向反应液中添加阴离子型聚合物具有改善测定血液样品中的β淀粉样蛋白时计数值下降的效果。另外显示,阴离子型聚合物中,特别是在侧链中具有硫酸基或磺酸基的阴离子型聚合物的改善效果大。
[0059]
实施例6研究了阴离子型聚合物的添加浓度对血液样品中的aβ测定的效果。向aβ
1-42
为检测限以下的血液样品(血清及edta
·
2k血浆)5ml中添加浓度为50000pg/ml的合成aβ
1-42
抗原50μl,由此制备含抗原血清(血浆1、血浆2)及含抗原血浆(edta2k)。另外,向tris缓冲生理盐水(tbs缓冲液、ph7.4)中添加血液样品和同浓度的合成aβ
1-42
抗原,由此制备了含抗原tbs缓冲液(buffer)。使用制备的各样品,利用实施例1中记载的方法测定aβ
1-42
。作为阴离子型聚合物,代替葡聚糖硫酸钠而添加作为在侧链中具有硫酸基的阴离子型聚合物的硫酸肝素钠(
ヘパリン
硫酸
ナトリウム
),以表5的浓度(0.5g/l、5.0g/l)添加于抗体固相化粒子溶液,研究其添加效果。抗原抗体反应体系中的硫酸肝素钠的终浓度为0.25g/l、2.5g/l。另外,与实施例1同样地取得空白值,计算计数值。将结果示于表5。
[0060]
[表5][表5]
[0061]
如表5所示,在所研究的添加硫酸肝素钠的所有浓度条件下,与未添加条件下的计数值相比,计数值均上升。
[0062]
实施例7研究了分子量各异的葡聚糖硫酸钠的添加对血液样品中的aβ测定的效果。在实施例1及2中在未添加葡聚糖硫酸钠条件下计数值下降显著的血清(血浆2)5ml中添加浓度50000pg/ml的合成aβ
1-42
抗原50μl,由此制备含抗原血清,利用实施例1中记载的方法测定aβ
1-42
。另外,向tbs缓冲液中添加与血液样品同浓度的合成aβ
1-42
抗原,由此制备含抗原tbs缓冲液(buffer),同样地测定aβ
1-42
。使用平均分子量为5000和50000的两种硫酸葡聚糖,将抗体固相化粒子溶液中的添加浓度设为7g/l。抗原抗体反应体系中的葡聚糖硫酸钠的终浓度为3.5g/l。进而,与实施例1同样地取得空白值,计算计数值。将结果示于表6。
[0063]
[表6]
[0064]
如表6所示,在未添加葡聚糖硫酸钠的条件下,血清样品(血浆2)计数值与缓冲液样品的计数值相比为66.7%,与此相对地,添加葡聚糖硫酸钠(分子量5000)、葡聚糖硫酸钠(分子量50000)时,计数值分别上升至80.9%、93.8%。
[0065]
由此表明,向反应液中添加以平均分子量5000以上的葡聚糖硫酸钠为代表的阴离子型聚合物有改善测定血液样品中β淀粉样蛋白时计数值下降的效果。
[0066]
实施例8为了研究血液样品中与缓冲液样品相比计数值下降的原因,对edta
·
2k血浆、及脑脊液(csf)用凝胶过滤柱进行了分级。条件如下。装置为akta fplc(ge healthcare制),柱为superose6 10
×
300(ge healthcare制),流速为0.3ml/分钟,缓冲液为d-pbs(-),上样量为1ml,各级分的液量为1ml。对于取得的各级分,以1000pg/ml添加aβ
1-42
抗原,由此制备样品。使用所制备的样品,按照实施例1中记载的方法测定aβ
1-42
。向抗体固相化粒子溶液中以2.5g/l添加葡聚糖硫酸钠(分子量5000),研究了其添加效果。抗原抗体反应体系中的葡聚糖硫酸钠的终浓度为1.3g/l。作为对照样品,使用以1000pg/ml添加aβ
1-42
抗原的tbs缓冲液,同样地进行测定。作为结果,将各样品的计数值相对于对照样品的计数值的比率(%)示于表7。对于分子量,在上述条件下对分子量标志物(bio-rad公司制)进行操作,制作近似式,求出各级分中的分子量。
[0067]
[表7]
[0068]
如表7所示,在edta2k血浆的情况下,确认300-400kda附近的级分在未添加葡聚糖硫酸钠的条件下计数值的比率下降到61%,而通过添加葡聚糖硫酸钠,计数值恢复至与对照样品相同程度(106%)。另一方面,在csf的情况下,任意级分中,未添加葡聚糖硫酸钠的条件下计数值与对照样品相比均不下降,未观察到计数值的比率因为是否添加葡聚糖硫酸钠而明显不同的级分。
[0069]
由此认为,使计数值下降的成分仅存在于血液样品中,通过添加阴离子型聚合物可避免该成分所带来的影响。
[0070]
实施例9研究了阴离子型聚合物在健康人来源血清样品及edta2na血浆样品中的aβ
1-42
及aβ
1-40的
测定中的影响。血液样品如下制备:分别使用真空采血管(10ml采血管、terumo制)及edta2na(7ml采血管、terumo制)来采血,在室温下静置30分钟,以1200
×
g进行10分钟离心分离,回收上清,由此而制备。
[0071]
为了评价样品保存所带来的影响,使用制备样品后于4℃保存了0天、1天、2天、及3天的样品,按照上述的“aβ
1-42
的测定方法”及“aβ
1-40
的测定方法”测定aβ
1-42
及aβ
1-40
。将作为阴离子型聚合物的葡聚糖硫酸钠(分子量5000)以0.5g/l添加到抗体固相化粒子溶液中,研究其添加效果。将测定值和各条件下相对于保存期0天的测定值的比率示于表8。关于测定值的计算方法,将合成aβ
1-42
肽和合成aβ
1-40
肽分别调整为0pg/ml、10pg/ml、100pg/ml、1000pg/ml而作为校准物。基于测定该校准物而得到的计数值制作近似式,将由各样品得到的计数值嵌入近似曲线。计算测定值。
[0072]
[表8-1]
[0073]
[表8-2]
[0074]
如表8所示,添加了葡聚糖硫酸钠的试剂的情况下,血清样本、血浆样本的计数值及测定值均上升。经时测定时,观察到测定值下降的倾向。
[0075]
β淀粉样蛋白的测定中,得到aβ
1-42
与aβ
1-40
的比并进行比较。因此,本实施例中计算了所测定的各条件下aβ
1-42
相对于aβ
1-40
的比。将结果示于表9。
[0076]
[表9]
[0077]
如表9所示,确认用未添加葡聚糖硫酸钠的试剂对血清进行测定时,aβ
1-42
/aβ
1-40
比的值经时地发生变化。但是,用添加了葡聚糖硫酸钠的试剂对血清进行测定时,确认aβ
1-42
/
aβ
1-40
比的值不会经时地变化,所得aβ
1-42
/aβ
1-40
比不受保存期的影响。
[0078]
由此可确认,添加葡聚糖硫酸钠之类的阴离子型聚合物时,不仅aβ
1-42
及aβ
1-40
的计数值上升,而且所得aβ
1-42
/aβ
1-40
比不受保存期影响。
[0079]
实施例10使用添加了葡聚糖硫酸钠的试剂测定阿尔茨海默病(ad)患者和非ad患者的血清样本中的aβ
1-42
及aβ
1-40
。
[0080]
用以下方法测定ad患者(26例)和非ad患者(22例)的血清样本中的aβ
1-42
及aβ
1-40
。首先,向反应槽中分注样品50μl和以0.5g/l添加葡聚糖硫酸钠(分子量5000)的抗体固相化粒子溶液250μl并进行搅拌。抗原抗体反应体系中的葡聚糖硫酸钠的终浓度为0.42g/l。然后,在37℃下温育8分钟,使用磁场进行分离及进行洗涤。向该反应槽进一步分注酶标记抗体溶液250μl,搅拌后在37℃下温育8分钟,使用磁场进行分离及进行洗涤。然后,向反应槽中分注包含作为化学发光底物的amppd的lumipulse(注册商标)底物液(fujirebio inc.制)200μl,搅拌后在37℃下温育4分钟后,用光度计测定发光量。实际测定中,利用全自动化学发光酶免疫测定系统(lumipulseg1200(fujirebio inc.制))来进行。将结果示于图1。使用与实施例6同样的校准物制作近似式,由样本的计数计算aβ
1-42
及aβ
1-40
的测定值。
[0081]
图1为由得到的各测定值求出的aβ
1-42
/aβ
1-40
比的箱线图。对于使用加入了葡聚糖硫酸钠的试剂测定而得的结果,ad患者的aβ
1-42
/aβ
1-40
比与非ad患者组间的aβ
1-42
/aβ
1-40
比相比值显著低(p值0.0022(wilcoxon-mann-whitney test)),确认在使用患者样本的aβ测定中向反应液添加阴离子型聚合物是有用的。
[0082]
由此表明,添加了葡聚糖硫酸钠等阴离子型聚合物的试剂对于阿尔茨海默病的诊断有用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。