1.本发明涉及金属离子检测领域。更具体地说,本发明涉及钙离子荧光指示剂的制备方法。
背景技术:
2.近年来,金属离子的识别和检测是许多重要领域(如环境、食品、药品、生物医学等)的研究课题。目前,有几种材料已被用于设计金属离子识别的传感探针,如有机染料、蛋白质、磁性纳米粒子和纳米材料。为实现金属离子的高灵敏检测,传感探针的设计至关重要,如传感材料和金属离子之间的相互作用能力的强弱、结合的速率以及稳定性等。钙离子(ca
2
)参与体内许多重要生理功能和过程,如兴奋性、神经递质释放、基因转录、细胞增殖、突触和激素分泌,从各种金属离子中选择性地快速检测ca
2
意义重大。近年来,检测钙离子的光学探针成为一个重要的研究热点,如由寡糖、肌钙蛋白、三磷酸胞苷作为配体的纳米材料被用于ca
2
的检测。然而,这些探针配体存在诸多缺点,1)容易受mg
2
的干扰以及灵敏度低(响应浓度一般在mm级别);2)基于有机染料的荧光指示剂容易发生光漂白现象,分析灵敏度和稳定性较差;3)大多数早期开发的钙离子指示探针主要在蓝色或绿色区域显示荧光,这限制了它们在生物系统和药物传递过程中的应用前景,而开发红色或近红外(nir)区域发光的钙离子荧光探针具有更加广泛的生物医药应用前景,如用于细胞成像时,可以有效避免细胞自荧光带来的干扰。
技术实现要素:
3.本发明的目的是提供钙离子荧光指示剂的制备方法,制备方法简便易行、成本低、操控性强、绿色环保,制备的钙离子荧光指示剂具有灵敏度高、抗干扰性强,同时具有红光发射特性。
4.为了实现本发明的这些目的和其它优点,提供了钙离子荧光指示剂的制备方法,包括:
5.步骤一、将882mg的bapta ester和150μl吡啶溶于3ml无水dmf,在低于0℃下缓慢滴加1.2ml pocl3,反应后溶液变为红色,取出,于室温下放置30min后,加热至60℃,反应1h,反应结束后恢复至室温,冷凝回流20h,溶液逐渐变为黄色,将反应后的混合物倒入浓度为0.5m冰的naoh溶液中,用二氯甲烷萃取三次,分离有机层,用水和饱和盐水交替冲洗合并后的有机层三次,然后除水,在正相硅胶柱上进行分离,得到cal ester;
6.步骤二、将130mg的cal ester溶于1ml二氯甲烷后,加入3ml 1m的koh无水乙醇溶液进行水解,于37℃恒温搅拌24h,用hcl调节ph,使ph在4~5范围内,静置沉淀后过滤,取滤液,用二氯甲烷萃取后,除水,得产物cal;
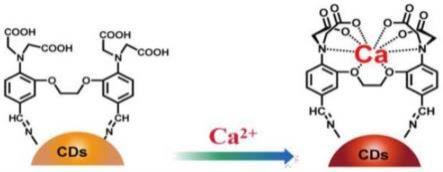
7.步骤三、称取100mg对苯二胺溶于30ml无水乙醇中,之后置于高压反应釜装置中200℃反应3h,反应结束后冷却至室温,得到暗红色的产物溶液,采用分子截流量为100-500的透析袋,透析24h,得粒度均匀的产物碳量子点(cds);
8.步骤四、取一定量cal溶解于2ml的二氯甲烷中,之后缓慢加入2ml浓度为0.5mg/ml的cds分散液,在室温条件下混合搅拌6h,反应结束后,除去溶剂ch2cl2,得到的固形物用石油醚进行多次重结晶处理,得cal@cds。
9.优选的是,所述的钙离子荧光指示剂的制备方法中,所述步骤一中在低于0℃下采用恒压滴液漏斗滴加1.2ml pocl3。
10.优选的是,所述的钙离子荧光指示剂的制备方法中,所述步骤一中用体积比为2:1的石油醚和乙酸乙酯为洗脱剂在正相硅胶柱上进行分离,得到cal ester。
11.优选的是,所述的钙离子荧光指示剂的制备方法中,所述步骤一和步骤二中均加入na2so4除水。
12.优选的是,所述的钙离子荧光指示剂的制备方法中,所述步骤四中利用旋转蒸发仪除去溶剂二氯甲烷。
13.优选的是,所述的钙离子荧光指示剂的制备方法中,所述步骤四中cal和cds的质量比为4:1。
14.本发明至少包括以下有益效果:
15.本发明制备的新型钙离子荧光指示剂具有水溶性好、线性范围宽、稳定性好、响应快、灵敏度高、特异性强等优点,对ca
2
的线性响应范围宽(10~500μm),最低检测为0.2μm,常见金属离子k
、na
、li
、rb
、ba
2
、mg
2
无干扰。同时,ca
2
与cal@cds结合可引起肉眼可见的颜色变化,使检测结果可视化。
16.本发明采用两步合成法制备了对ca
2
具有高亲和力的螯合剂cal;采用溶剂化法一步制得具有水溶性好,同时具有红光发射特性(最大发射波长610nm)且发光稳定的荧光碳量子点(cds);然后采用schiff碱反应得到对ca
2
具有高度选择性的荧光指示剂cal@cds。即首次制备得到了一种基于螯合剂cal与碳量子点cds纳米杂合材料的ca
2
荧光指示剂。
17.本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。
附图说明
18.图1是cds的透射电镜图和高分辨透射电镜图,其中,左上方为cds在可见光(左)及365nm紫外光(右)照射下的实物图;
19.图2是cds的电镜粒径分布图(n=70);
20.图3是cds的xps全扫图谱,插图为c、n、o元素结合能及原子含量比;
21.图4是高分辨xps图对应的c1s峰;
22.图5是高分辨xps图对应的n1s峰;
23.图6是高分辨xps图对应的o1s峰;
24.图7是cds在600nm发射波长下的激发光谱图;
25.图8是cds在364nm和530nm激发波长下的荧光发射光谱图;
26.图9是对苯二胺(p-pd)和cds的紫外-可见吸收光谱图;
27.图10是对苯二胺(p-pd)和cds的傅里叶变换红外光谱图;
28.图11是cal和cds以质量比为1:1制备的cal@cds荧光探针结合ca
2
后的荧光光谱图;
29.图12是cal和cds以质量比为4:1制备的cal@cds荧光探针结合ca
2
后的荧光光谱图;
30.图13是是cal和cds以质量比为40:1制备的cal@cds荧光探针结合ca
2
后的荧光光谱图;
31.图14是cal@cds和cds的荧光光谱图;
32.图15是cal@cds对不同浓度钙离子(0、10、50、100、500和1000μm)的紫外-可见吸收光谱图;
33.图16是cal@cds的红外光谱图;
34.图17是不同ph条件下,cal@cds与钙离子(浓度为1000μm)反应前后荧光信号变化趋势图;
35.图18是在ph=3.5条件下cal@cds溶液与浓度依次为0、10、100、1000μm的钙离子溶液作用的zeta电位;
36.图19是在ph=5.5条件下cal@cds溶液与浓度依次为0、10、100、1000μm的钙离子溶液作用的zeta电位;
37.图20是在ph=7.5条件下cal@cds溶液与浓度依次为0、10、100、1000μm的钙离子溶液作用的zeta电位;
38.图21是在ph=9.5条件下cal@cds溶液与浓度依次为0、10、100、1000μm的钙离子溶液作用的zeta电位;
39.图22是介质环境ph=3.5、5.5、7.5和9.5溶液中cal@cds的zeta电位图;
40.图23是cal@cds纳米探针结合ca
2
荧光变化示意图;
41.图24是加入不同浓度ca
2
(1、10、100、500和1000μm)后溶液的颜色变化实物图;
42.图25是ca
2
溶液终浓度为0、10、100、200、300、400、500和1000μm时,cal@cds纳米探针的荧光发射光谱图;
43.图26是δf/f0荧光信号变化图;
44.图27是ca
2
定量的标准工作曲线(n=3);
45.图28是k
、na
、li
、rb
、ba
2
、mg
2
和l-asp、glu对cal@cds荧光的影响图,其中ca
2
浓度为500μm,其他为5mm;
46.图29是cal@cds溶液中加入浓度依次为0、10、100、200、300、400、500和1000μm ca
2
后粒径分布图;
47.图30是cal@cds溶液中加入浓度依次为0、10、100、200、300、400、500和1000μm ca
2
后粒径变化柱状图。
具体实施方式
48.下面结合附图和实施例对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。
49.需要说明的是,下述实施方案中所述实验方法,如无特殊说明,均为常规方法,所述试剂和材料,如无特殊说明,均可从商业途径获得。
50.实施例1
51.钙离子荧光指示剂的制备方法,包括:
52.步骤一、将882mg的1,2-双(2-氨基苯氧基)乙烷-n,n,n’,n
’‑
四乙酸乙酯(bapta ester)和150μl吡啶溶于3ml无水dmf(溶剂蒸馏后加入型分子筛密封保存),在低于0℃下缓慢滴加1.2ml pocl3,反应后溶液变为红色,取出,于室温下放置30min后,加热至60℃,反应1h,采用薄层色谱法进行反应监控,反应结束后恢复至室温,冷凝回流20h,溶液逐渐变为黄色,将反应后的混合物倒入浓度为0.5m冰的naoh溶液中,用二氯甲烷萃取三次,分离有机层,用水/饱和盐水交替冲洗合并后的有机层三次,然后除水,在正相硅胶柱上进行分离,得到cal ester,cal ester的分子式为c
32h40
n2o
12
,相对分子量为644;
[0053][0054]
步骤二、将130mg cal ester溶于1ml ch2cl2后,加入3ml koh(1m,无水乙醇溶解)进行水解,于37℃恒温搅拌24h,用hcl调节ph,使ph在4~5范围内,静置沉淀后过滤,取滤液,用大量的二氯甲烷萃取后,除水,得产物cal,cal分子式为c
24h24
n2o
12
,分子结构富含羧酸基团,易于电离,cal的相对分子量为532,cal具有四元羧基结构,通过离子键和配位键作用结合ca
2
,而醛基则为化学偶联cds提供了先决条件;
[0055][0056]
步骤三、采用溶剂热法制备cds,称取100mg对苯二胺(p-pd)溶于30m无水乙醇中,之后置于高压反应釜装置中200℃反应3h,反应结束后冷却至室温,得到暗红色的产物溶液,采用分子截流量为100-500的透析袋,透析24h,得粒度均匀的产物碳量子点(cds);
[0057][0058]
步骤四、取一定量cal溶解于2ml的ch2cl2中,之后缓慢加入2ml浓度为0.5mg/ml的cds分散液,在室温条件下混合搅拌6h,反应结束后,除去溶剂ch2cl2,得到的固形物用石油醚进行多次重结晶处理,cal通过化学键连在cds表面(席夫碱反应)得cal@cds,所得产物在乙醇中透析至少12h。
[0059][0060]
在本研究中,我们提出了以bapta为母核结构单元,碳点cds为荧光发色团,制备一种新型荧光纳米探针cal@cds的简单方法,并将cal@cds作为高选择性的探针检测钙离子。首先,进行cal的制备,于dmf和三氯氧磷条件下,通过vilsmeier-haack反应,在bapta ester苯环的对位引入甲酰基(醛基可作为活性位点与后续合成的碳点进行键合),生成cal ester,产率45%;进一步在碱性环境下通过皂化反应进行充分水解,生成四羧酸产物cal,产率60%。其次,以对苯二胺为碳源,在高压反应釜中进行自聚合,纯化后得cds,cds是具有纳米尺度的荧光物质,表面涵盖丰富的氨基官能团。最后,两步产物通过schiff碱反应将cal键合于cds表面,生成新型钙螯合剂@碳点荧光指示剂(cal@cds),由于bapta母核对钙离子具有特异性螯合作用,因此制备的荧光纳米探针cal@cds对ca
2
具有选择性响应。
[0061]
所述的钙离子荧光指示剂的制备方法中,所述步骤一中在低于0℃下采用恒压滴液漏斗滴加1.2ml pocl3。
[0062]
所述的钙离子荧光指示剂的制备方法中,所述步骤一中用石油醚:乙酸乙酯=2:1(v/v)为洗脱剂在正相硅胶柱上进行分离,得到cal ester。
[0063]
所述的钙离子荧光指示剂的制备方法中,所述步骤一和步骤二中均加入na2so4干燥除水。
[0064]
所述的钙离子荧光指示剂的制备方法中,所述步骤四中利用旋转蒸发仪除去溶剂ch2cl2。
[0065]
所述的钙离子荧光指示剂的制备方法中,所述步骤四中cal和cds的质量比为4:1。
[0066]
1 cds的表征及光学性能
[0067]
1.1 cds的表征
[0068]
采用水热法,以对苯二胺(p-pd)为原料合成了cds。将透析后的cds乙醇溶液滴涂在铜网上进行透射电镜(tem)分析(如图1所示),结果表明cds是单分散的球状粒子,在nano measure软件拟合下计算得cds平均粒径为3.25nm(n=70)(如图2所示),粒径最大的为5.75nm,粒径最小的为1.35nm。由高分辨率透射电镜(hrtem)图像可知cds的晶面间距为0.20nm,与石墨烯(100)的面内晶格间距一致(如图1右边插图所示)。图1左上插图为cds在可见光照射和365nm紫外光照射下的实物图。
[0069]
cds的xps谱(如图3所示)显示了283.67、398.20和530.34ev三个峰,分别为c1s、n1s和o1s的结合能。c1s谱在283.0ev(c-c/-c-h键)、283.5ev(c-n键)、284.0ev(-c-o键)和284.6ev(-c=o键)处分别对应四个不同的峰(如图4所示)。n1s谱显示了398.0ev(吡啶氮)和398.9ev(1
°
/2
°
胺基氮)两个不同的峰(如图5所示)。o1s谱在530.2ev和531.6ev处有两个明显的峰,分别属于c=o和c-oh/c-o-c官能团(如图6所示),显示了cds表面氧官能团的形成。xps分析可对cds的内部键能结构以及表面富含的官能团进行表征,为cds的制备可调性和表面功能化性能提供了一种鉴定手段。
[0070]
1.2 cds的光学性能
[0071]
采用荧光分析法、uv-vis分析法和ftir分析法对cds的光学性能进行探讨。在乙醇溶液中,如图7中cds的激发光谱显示,cds具有双激发波长性质,两个激发波长分别为λ=364nm和λ=530nm。同时发现,530nm作为激发波长比364nm作为激发波长产生荧光峰(λ
em
=600nm)的强度大得多(如图8所示)。因此,本研究以对苯二胺为原料,溶剂热法合成的cds的最佳激发波长λ=530nm,最佳发射波长λ=600nm。uv-vis吸收光谱结果显示(如图9所示),与原料p-pd相比,cds的吸收带发生明显红移,即从p-pd的λ
max
=243nm红移至cds的286nm,而λ
max
=309nm则红移至450~550nm间的宽峰,这些电子吸收跃迁的红移表明合成的cds比p-pd具有更小的电子带隙。
[0072]
如图10所示,采用ft-ir对cds上的化学键和官能团进行了表征,与p-pd相比,cds在1352cm-1
和1065cm-1
处出现了新的特征峰,并伴随着3009cm-1
特征峰的增强,这些特征峰分别归属于c-n=伸缩带、n-h和c=c-h伸缩振动。这些特征峰的变化证明了cds的自聚合过程包含了分子分解、分子间环合以及分子间缩合等反应。以上结果表明cds具有优良的光学性能,可以发射稳定的红色荧光,表面丰富的官能团可提供大量结合位点,可作为电子受体,与电子供体结合(如前述制备的ca
2
螯合剂cal),从而构建对特定金属离子具有响应性的荧光指示剂。
[0073]
1.3 cal@cds的优化
[0074]
cal通过schiff碱共价键合于cds表面,向cds的空穴提供丰富的电子,使cal@cds的荧光强度降低,因此cal作为电子供体对于cds的稳定性和荧光起着重要作用,过量的cal(cds比例偏低时)会使荧光强度大幅度降低,当螯合ca
2
后,荧光恢复幅度较小,不利于对ca
2
的高灵敏度检测;少量的cal则削弱了对ca
2
的螯合能力。因此,选择合适的cal和cds比例制备cal@cds荧光探针对ca
2
的传感性能至关重要。
[0075]
图11-13为不同质量比制备的cal@cds的荧光光谱图,分别选择浓度为0、100、1000μm的ca
2
考察cal@cds荧光探针的最佳比例。实验发现当cal:cds=1:1时(如图11所示),在100μm浓度处荧光恢复显著,但其对ca
2
螯合数量有限。在比例cal:cds=4:1(如图12所示)条件下cal@cds对ca
2
的螯合范围增大,即响应的线性范围更为宽泛,且随着ca
2
浓度增加,荧光增幅逐渐增加。而质量比cal:cds=40:1(如图13所示)条件下,虽然能增大cal@cds对ca
2
的螯合容量,但其荧光增幅较小;这是由于cds表面存在“大量”的cal分子,产生强烈的荧光熄灭效应,结合一定量的ca
2
所产生的荧光增强难以有效消除cal对cds的淬灭作用。为兼顾cal@cds对ca
2
螯合容量和荧光信号强度变化的灵敏性,本技术最终选择cal:cds=4:1的比例进行后续的实验及分析应用。
[0076]
1.4 cal@cds的光学性能
[0077]
采用荧光分析法、uv-vis分析法和fttr分析法对cal@cds的光学性质进行进一步探讨。从图14可知,与cds相比,cal@cds的荧光发射峰发生红移,红移距离大约10nm,发射波长变为λ
em
=610nm,其原因是cal共价结合于cds表面,引入更多的π键电子,电子跃迁能量差变小。cds的荧光发射机制是由于其具有大量的可捕获电子的空穴,以及空穴产生的辐射复合作用。cds可作为强的电子受体,当大量电子供体(如本技术制备的cal)作用于cds表面,将对空穴的辐射产生影响,增加激发态电子非辐射去极化过程,有效地猝灭cds的荧光。实验也证实了这一推断,如图14所示,当cds与cal结合后,cal@cd的荧光强度降低了90%。
[0078]
根据uv-vis光谱图(如图15所示)发现随着ca
2
浓度的逐渐增加,cal@cds在243nm
处的吸收峰蓝移至231nm。当ca
2
被络合后,抑制了螯合剂即cal向cds的电子转移,从而导致荧光增强。同时,随着ca
2
浓度的增加,cal@cds在265~325nm之间的吸收值逐渐增强,而在360nm处的吸收峰强度逐渐降低,溶液颜色逐渐变浅。本技术合成的cds富含大量的胺基(nh2-)官能团,可通过席夫碱反应将带-cho基团的化合物cal键合于cds表面。因此,我们采用ft-ir光谱证实cal@cds的形成。如图16所示,羧酸根(-coo-)的特征峰表现为ν-oh在3400~2400cm-1
处强而宽的吸收峰和1727cm-1
处-c=o的伸缩振动峰;schiff碱反应形成的亚胺键通常在1590-1690cm-1
处有中等强度的吸收峰,峰形尖锐,ν-c=n-~1685cm-1
;相较于cds(图10)的ftir谱图,1145cm-1
和1001cm-1
峰大幅度降低,这是由于-nh2键发生了schiff碱反应导致其数量减少,证实了cal与cds之间的成功键合,最终形成cal@cds荧光探针。
[0079]
本技术设计合成了一种新型的纳米荧光探针cal@cds,它由两部分组成,第一部分是能够与ca
2
结合的螯合剂cal,第二部分是能够产生荧光信号的发色团cds;该荧光探针能够特异性识别ca
2
,产生荧光信号增强作用,从而构建了一种新型的ca
2
荧光传感体系。我们选择bapta作为母核结构,通过两步合成制备了ca
2
螯合剂cal,该功能分子含有4个羧基,可有效络合ca
2
,而醛基则可以与表面富含氨基的荧光碳点cds通过schiff碱反应进行键合,形成cal@cds,当与ca
2
络合后,可引起荧光变化。我们以对苯二胺为原料,采用溶剂热法一步制备红色发光荧光碳点cds(λ
em
=600nm),cds光学性质稳定,平均粒径为3.25nm,高分辨透射电镜揭示其晶面间距为0.20nm,与石墨烯(100)的面内晶格间距一致,这种纳米级别的荧光量子点表面含有大量的电子嵌合空穴,是优良的电子受体,当cal供体修饰于cds表面可引起cds荧光降低,这是由于光电子转移(photoelectron transfer,pet)效应所导致。当cal@cds与ca
2
结合后,cal分子中n原子上的孤电子参与ca
2
络合,有效抑制pet效应,从而导致荧光增强。该荧光探针专一性强,稳定性好,可为钙制剂质量监控提供高灵敏度和高选择性的荧光分析方法。
[0080]
2基于cal@cds荧光探针的钙制剂含量检测
[0081]
2.1钙离子测定条件的优化
[0082]
采用malvern动态光散射粒度仪的电位测试模式,测量在不同ph介质条件(tris-hcl缓冲液,ph=3.5、5.5、7.5、9.5)下加入不同浓度ca
2
(0、10、100、1000μm)溶液时zeta电位的变化。采用荧光光谱仪对cal@cds纳米荧光探针识别ca
2
的ph测定条件进行优化,纵坐标为加入ca
2
溶液(0和1000μm)前后荧光信号增强百分比。
[0083]
2.2钙离子测定的标准工作曲线建立
[0084]
在2ml cal@cds溶液中,分别加2ml浓度为0、1、10、100、200、300、400、500、1000μm的系列ca
2
溶液(10mm tris-hcl缓冲液,ph=9.5),混合均匀后于荧光样品池中,采用荧光光谱仪进行荧光强度的测定,设置激发波长为λ
ex
=530nm,在540~800nm范围内扫描发射光谱,得到一系列发射光谱图。以ca
2
浓度为横坐标,发射峰在λ
em
=610nm处荧光强度的增幅百分比为纵坐标,建立钙离子定量标准工作曲线,并计算相对标准偏差(rsd)和最低检测限(lod)。
[0085]
2.3干扰性实验
[0086]
为了考察cal@cds对ca
2
识别的特异性,本实验设置6种潜在的干扰性金属离子和2种干扰性生物小分子,并以ca
2
的10倍浓度进行抗干扰能力考察,干扰离子分别为k
、na
、li
、rb
、ba
2
、mg
2
,干扰分子为l-天冬氨酸(l-asp)、葡萄糖(glu)。
[0087]
2.4 cal@cds结合ca
2
后粒径分析
[0088]
采用malvern动态光散射粒度仪测试cal@cds结合ca
2
后粒径的变化,在cal@cds溶液中分别加入浓度为0、1、10、100、200、300、400、500和1000μm ca
2
溶液(10mm tris-hcl缓冲液,ph=9.5),测试前溶液用0.45μm微孔滤膜滤过。
[0089]
2.5钙制剂含量测定及回收率试验
[0090]
2.5.1碳酸钙d3片(ⅱ)
[0091]
取碳酸钙d3片(ⅱ)10片(标示量:500mg),精密称定,置研钵中充分研磨成细粉,称取药粉适量(相当于250mg钙),加10.00ml的盐酸溶解,滤过,弃去初滤液,取续滤液80μl,置于100ml量瓶中,加10mmtris-hcl缓冲液(ph=9.5)稀释至刻度,摇匀。取该溶液2ml,置10ml具塞离心管中,加入2ml的cal@cds的溶液,混匀后于室温反应5min,取反应液适量于样品池中,记录λ
em
=610nm处的荧光强度值(λ
ex
=530nm)。根据线性拟合方程,计算钙片的标示百分含量。同时,设置低、中、高三个浓度组的加标样品,考察方法的回收率试验,并计算相对标准偏差(rsd)值。
[0092]
2.5.2葡萄糖酸钙口服液
[0093]
取葡萄糖酸钙口服液10支(标示量为110mg:10ml),切开后倒入小烧杯中,混匀,用0.22μm的微孔滤膜进行过滤,精密量取滤液0.1ml,置100ml量瓶中,加10mm tris-hcl缓冲液(ph=9.5)稀释至刻度,摇匀。取该溶液2ml,置10ml具塞离心管中,加入2ml的cal@cds溶液,混匀后于室温反应5min,取反应液适量于样品池中,记录λ
em
=610nm处的荧光强度值(λ
ex
=530nm)。根据线性拟合方程,计算钙片的标示百分含量。同行,设置低、中、高三个浓度组的加标样品,考察方法的回收率试验,并计算相对标准偏差(rsd)值。
[0094]
2.5.3乳酸钙颗粒
[0095]
取乳酸钙颗粒10包(标示量:65mg),精密称定,取颗粒适量(相当于65mg钙),加50ml热水溶解,用0.22μm的微孔滤膜进行过滤,取滤液1.5ml,置100ml量瓶中,加10mm tris-hcl缓冲液(ph=9.5)稀释至刻度,摇匀。取该溶液2ml,置10ml具塞离心管中,加入2ml的cal@cds的溶液,混匀后于室温反应5min,按上述同法操作,计算即得。
[0096]
3结果与讨论
[0097]
3.1钙离子测定的条件优化
[0098]
cal@cds是以bapta作为螯合母体对ca
2
进行选择性识别,bapta具有4个羧基,可以发生四级解离,其中pka3=5.47、pka4=6.36因此在生理条件下不会质子化。相较于乙二醇双(β-氨基乙基)醚四乙酸(egta),制备的cal对ca
2
具有较高的螯合率。另外,本研究所制备的cds表面易功能化,可同时偶联多个cal,从而可以增大对ca
2
的螯合容量。本实验以质量比cal:cds=4:1制备荧光探针,我们考察了4个ph条件(分别为3.5、5.5、7.5和9.5)下,荧光探针对ca
2
络合能力以及荧光信号变化幅度,以ca
2
浓度为0和1000μm时荧光增幅的百分比作为衡量指标。如图17所示,在较高的ph条件下,荧光增强的幅度更大(如ph 9.5和7.5时,荧光信号变化值分别为144%和45%),表明碱性条件下,cal@cds对ca
2
具有更强的络合能力。因此,在后续实验中均选择ph=9.5作为定量分析的酸度条件。
[0099]
如图18-21所示为ph为3.5、5.5、7.5和9.5条件下cal@cds溶液在ca
2
终浓度依次为0、10、100和1000μm下的zeta电位变化图。结果显示,随着ca
2
浓度的增加,cal@cds的zeta电位的绝对值逐渐减小,这是由于带负电荷的cal@cds与带正电荷的ca
2
之间的静电作用,中
和cal@cds探针表面负电荷引起的。另外,随着介质ph的增大,羧酸基团去质子化程度增强,因此其电负性增强,所以较高的ph导致cal@cds具有更负的zeta电位(如图22所示)。
[0100]
3.2钙离子测定的标准工作曲线及特异性研究
[0101]
如图23所示为cal@cds纳米探针结合ca
2
后荧光变化示意图(左侧为弱荧光,右侧为强荧光)。cal@cds的荧光发射与ca
2
密切相关,未络合ca
2
时,cal@cds受pet效应呈现较低的荧光特性;络合ca
2
后,荧光增强。如图24所示,随着ca
2
浓度逐渐增大,cal@cds从橙红色变为浅褐色,因此cal@cds纳米探针对ca
2
的识别也可实现可视化检测;在365nm光激发下,肉眼可见溶液的荧光发射更加明显(由于难以获得530nm的便携式光源,所以未进行荧光实物拍摄)。
[0102]
图25和26分别为ca
2
溶液终浓度为0、10、100、200、300、400、500和1000μm时,cal@cds纳米探针的荧光发射光谱图以及δf/f0荧光信号变化图(其中,f0是cal@cds溶液的荧光强度,f是不同ca
2
浓度下cal@cds的荧光值),按以下公式计算荧光信号变化百分比δf/f0:
[0103]
δf/f0=(f-f0)/f0
×
100%
[0104]
图27为ca
2
浓度与荧光增强百分比δf/f0之间的线性关系,ca
2
浓度线性响应范围从10μm到500μm;相应地,回归方程表达为:
[0105]
y=20.89 0.2556x(r=0.994)
[0106]
其中,y为δf/f0的百分比值,x为ca
2
的浓度(μm)。该方法检测ca
2
的lod值为0.2μm,rsd低于1.2%(ca
2
浓度为300μm,n=9),可用于药物制剂中ca
2
的检测。以上结果表明,本文构建的cal@cds荧光探针可有效实现对ca
2
快速、准确的定量分析。
[0107]
进一步地,我们研究了k
、na
、li
、rb
、ba
2
、mg
2
等金属离子和l-asp、glu分子对cal@cds荧光的影响(如图28所示)。结果表明,当结合500μm ca
2
时,cal@cds的荧光增强了144%,相比之下,10倍浓度(即5mm)的k
、na
、li
、rb
、ba
2
、mg
2
、l-asp和glu对cal@cds荧光几乎不产生影响(仅10倍浓度mg
2
可产生大约17%的荧光信号变化),表明该纳米荧光探针对ca
2
具有很强的特异性。需要说明的是,选择这些潜在干扰成分的原因有两点:一是它们共存在于生理系统中(如k
、na
、mg
2
、l-asp和glu);二是k
、na
、li
、rb
、ba
2
、mg
2
与ca
2
具有相近的化学属性。与报道的ca
2
检测方法相比,我们设计制备的基于cal@cds的ca
2
检测方法,具有操作简单、成本低廉、灵敏度高、选择性好、线性响应范围宽等优点(见表1)。
[0108]
表1钙离子定量分析方法的比较
[0109]
分析方法线性范围(μm)检测限(μm)参考比色法1-500.97文献1电化学法30-4604.45文献2荧光10-4004文献3荧光3.3-2000.6文献4荧光15-3000.38文献5荧光10-5000.2本技术
[0110]
文献1 oh jinyoung,eom min sik,han min su.co-functionalization with phosphate and carboxylate on polydiacetylene for colorimetric detection of calcium ions in serum.analyst,2019,144:7064-7070.
[0111]
文献2 wu meiyan,meng shangjun,wang qian et al.nickel-cobalt oxide decorated three-dimensional graphene as an enzyme mimic for glucose and calcium detection.acs applied materials&interfaces,2015,7:21089-94.
[0112]
文献3 liu,s.,wang,h.,cheng,z.,and liu,h.hexametaphosphate capped quantum dots as fluorescent probes for detection of calcium ion and fluoride.sensors&actuators,b:chemical.2016,232,306
–
312.
[0113]
文献4 chen g,zhou z,feng h,et al.an aggregation-induced phosphorescence probe for calcium ion-specific detection and live-cell imaging in arabidopsis thaliana.chemical communications,2019,55(33):4841-4844.
[0114]
文献5 yue juan,li li,cao lei et al.two-step hydrothermal preparation of carbon dots for calcium ion detection.acs applied materials&interfaces,2019,11:44566-44572.
[0115]
3.3钙离子检测机理探讨
[0116]
本研究制备了对ca
2
具有较强结合能力以及特异性的螯合剂cal。同时制备了光致发光纳米碳点cds,该碳量子点具有发光稳定、较大的stocks位移以及尺寸可调等性质,其表面丰富的官能团可修饰多个配体(如cal),从而增强对目标分析物的有效捕获和灵敏响应。将对ca
2
具有强亲和力的cal修饰于cds表面(即形成cal@cds)后,由于pet效应导致cds的荧光显著降低,而当结合ca
2
后,pet效应被削弱使得荧光恢复,形成“信号开(signal on)”的检测模式。
[0117]
采用marvin粒度仪依次对终浓度分别为0、10、100、200、300、400、500和1000μmca
2
的cal@cds溶液的水合粒径进行测试。如图29和30所示,cal@cds随着钙离子浓度增加,平均水合粒径分别为165.2、169.0、179.0、192.4、210.9、241.7、260.2和295.3nm,即粒径呈现逐渐增大的趋势,说明cal@cds粒子间可通过钙离子识别相互进行偶联产生细微的聚集,产生类似于聚集诱导发光(aie)的效应。另外,钙离子的结合,增强了cal@cds粒子间的稳定性,减少碰撞产生的非辐射过程和减少激发态能量的消耗,同时钙离子的结合产生平面刚性结构效应,促进荧光的增强。
[0118]
3.4钙制剂含量测定及回收率试验
[0119]
为了评价该方法的实际应用能力,将所制备的cal@cds纳米荧光探针应用于钙制剂中的钙含量的测定。本实验选取三种常见的钙制剂包括碳酸钙d3片(ⅱ)、葡萄碳酸钙口服液以及乳酸钙颗粒。测定前,先对以上三种药品进行样品前处理,将处理后的试液进行稀释,使检测浓度处于定量分析的线性范围内,按建立的方法进行测定。同时,在线性范围内分别设置低、中、高三组浓度的样品,按标准加入法进行回收率试验,评价方法的准确性。如表2和表3所示,碳酸钙d3片(ⅱ)的标示百分含量在101.8%~103.1%之间,回收率95.7%~107.0%,相对标准偏差rsd不大于3.3%;复方葡萄糖酸钙口服液的标示百分含量(表4)为105.9%~109.6%,回收率98.2%~105.0%(表5),rsd不大于2.0%;乳酸钙颗粒的标示百分含量为95.2%~98.5%(表6),回收率96.6%~103.9%(表7),rsd不大于2.1%。
[0120]
以上结果表明,该方法对钙制剂中ca
2
的含量检测具有很好的适用性,为药物质量监控提供一种简便、快速以及可视化的分析手段,也为生命分析中ca
2
的监测提供了可能
性。
[0121]
表2碳酸钙d3片(ⅱ)含量测定结果
[0122][0123]
表3碳酸钙d3片(ⅱ)的回收率(n=3)
[0124][0125]
表4葡萄糖酸钙口服液含量测定结果
[0126][0127]
表5葡萄糖酸钙口服液的回收率(n=3)
[0128][0129]
表6乳酸钙颗粒含量测定结果
[0130][0131]
表7乳酸钙颗粒的回收率
[0132][0133]
4本技术总结如下:
[0134]
(1)制备方法:选择对ca
2
具有高亲和力的bapta作为识别元件,高表面性能的cds作为荧光发色基团,构建了用于ca
2
检测的cal@cds纳米荧光探针。该荧光探针具有识别能力强、荧光效率高、稳定性好等优点。
[0135]
(2)机理探讨:cal@cds纳米探针与ca
2
结合后,其荧光显著增强,呈现“信号开”的
响应模式,我们推测这一现象是由于:
①
纳米荧光探针中的cal分子中n原子上的孤电子参与ca
2
络合,削弱了光电子转移效应(pet)所致的荧光抑制现象;
②
ca
2
的引入,会与羧酸o原子以及胺基n原子之间形成配位作用和离子键,增强了cal@cds荧光探针的刚性,减少分子间碰撞产生的非辐射过程和能量损耗,提高荧光量子效率;
③
相比cal@cds纳米粒子,cal@cds-ca
2
的水合粒径增大,表明cal@cds粒子间发生了相互偶联形成细微的聚集,从而产生类似于聚集诱导发光(aie)的效应。以上3种因素可能协同导致cal@cds结合ca
2
后的荧光增强现象。
[0136]
(3)分析应用:在优化的分析条件下,cal@cds对ca
2
具有宽泛和灵敏的信号响应,定量分析的线性范围在10~500μm,lod值为0.2μm,一些共存的金属离子和生物小分子不干扰ca
2
的测定;方法的准确度和精密度良好。该纳米传感探针被成功用于碳酸钙d3片(ⅱ)、复方葡萄糖酸钙口服液和乳酸钙颗粒3种钙制剂的含量测定。
[0137]
5本技术结论如下:
[0138]
(1)合成的钙螯合剂cal具有四元羧基结构,通过离子键和配位键作用结合ca
2
,而醛基则为化学偶联cds提供了先决条件。
[0139]
(2)所制备的cds为均匀分散的球形,平均粒径为3.25nm,hrtem揭示cds纳米粒子的晶面间距为0.20nm,对应于石墨烯的(100)晶面;xps分析表明cds表面具有丰富的官能团(如c=o、c-o、-c-nh2),展现了cds的易功能化的特性,尤其是cds表面的伯胺可以有效“锚定”螯合剂cal,从而形成荧光指示剂cal@cds。
[0140]
(3)考察cds荧光光谱发现cds的最大激发波长为530nm,最大发射波长为600nm,且荧光信号稳定。
[0141]
(4)cal与cds质量比为4:1时,制备的cal@cds荧光探针对ca
2
结合能力强,且荧光信号改变显著。红外光谱和荧光光谱证实cal通过亚胺键键合于cds表面形成cal@cds。
[0142]
(5)介质ph越高,对ca
2
的结合能力越强。另外,cal@cds的水合粒径随着ca
2
浓度的升高逐渐增大,且荧光同步增强,表明cal@cds-ca
2
复合物的形成增强了荧光探针的刚性,提高了荧光效率。特别地,ca
2
浓度升高可能导致荧光探针之间相互偶联,产生轻微的聚集,形成一种类似于聚集诱导发光(aie)的荧光增强效应。
[0143]
(6)在最佳条件下制备得到的cal@cds荧光探针对ca
2
具有高度专一性和灵敏性,其他常见金属阳离子对ca
2
检测信号影响较低,具有较强的抗干扰性。在10~500μm范围内,荧光信号变化百分比与ca
2
浓度之间呈良好的线性相关(r=0.994),rsd低于1.2%,按信噪比大于3:1计,检测限为0.2μm。
[0144]
(7)基于cal@cds荧光探针的钙离子定量分析方法被用于碳酸钙d3片(ⅱ)、复方葡萄糖酸钙口服液和乳酸钙颗粒三种钙制剂的含量测定。结果显示,碳酸钙d3片(ⅱ)的标示百分含量为101.8%~103.1%,回收率95.7%~107.0%,rsd小于3.3%;复方葡萄糖酸钙口服液的标示百分含量为105.9%~109.6%,回收率98.2%~105.0%,rsd小于2.0%;乳酸钙颗粒的标示百分含量为95.2%~98.5%,回收率96.6%~103.9%,rsd小于2.1%。
[0145]
综上所述,本技术设计开发了一种简便、可靠、低成本的ca
2
纳米荧光探针,实现钙制剂中钙含量的定量检测,为钙制剂的质量监控提供了新的分析方法和技术手段。
[0146]
尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地
实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例和实施例。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
