1.本发明属于分子生物学及医药领域,具体涉及高表达热休克蛋白的巨噬细胞作为靶点在制备肝细胞癌(hcc)药物中的应用。
背景技术:
2.巨噬细胞被认为是人体的免疫屏障,是先天性免疫和获得性免疫的重要组成部分。巨噬细胞具有异质性和可塑性,在肿瘤组织中受微环境影响巨噬细胞的表型和功能发生改变。
3.目前,肿瘤相关巨噬细胞的靶向策略主要有通过调控csf1-csf1r轴耗竭或灭活单核-巨噬细胞、调控ccl2-ccr2轴抑制单核-巨噬细胞向肿瘤部位募集、使用抗cd47抗体、toll样受体激动剂、cd40激动剂和pi3kγ抑制剂等诱导巨噬细胞重编程。然而,巨噬细胞耗竭或灭活的主要缺点是系统性地、非特异性地靶向巨噬细胞会使正常免疫反应受到损害,使人体在防御外部病原体攻击时处于不利地位,因此使用抗体或小分子进行抗csf1治疗会导致不良反应。在疗效方面,临床前模型中的肿瘤相关巨噬细胞耗竭导致肿瘤内中性粒细胞被高度抑制,减弱了巨噬细胞耗竭方法的治疗效果。此外,尽管抗ccl2单克隆抗体在治疗期间能够显著减少肿瘤相关巨噬细胞的数量,但抗体撤销后单核细胞募集的快速反弹反而加速了几种乳腺癌小鼠模型的肺转移。巨噬细胞重编程是将肿瘤相关巨噬细胞的表型从促肿瘤状态变为抗肿瘤状态,具有抗肿瘤表型的巨噬细胞可以通过分泌抗肿瘤因子、吞噬、增加免疫浸润、增加t细胞和其他免疫细胞的细胞毒作用来影响肿瘤的生长。但仅靶向一种细胞不足以改变整个肿瘤微环境,进而根除肿瘤。肿瘤相关巨噬细胞在不同个体和不同肿瘤中具有明显的异质性,为了改进治疗方式,需要对不同肿瘤类型的不同肿瘤免疫微环境和新的巨噬细胞靶点有更加透彻的了解。
4.肿瘤相关巨噬细胞在hcc中的作用主要有免疫抑制、促进肿瘤侵袭和转移、促进血管生成和上皮间充质转化等。在对临床样本的研究中发现在hcc组织中有大量肿瘤相关巨噬细胞的组织浸润,数量越多、密度越高、患者预后越差。因此,深入了解hcc与肿瘤相关巨噬细胞之间的联系对于开发有效的hcc治疗方法至关重要,靶向肿瘤相关巨噬细胞可能为hcc患者提供新的早期诊断和治疗方法,改善hcc的预后。
技术实现要素:
5.为解决上述技术问题,本发明采用免疫荧光共染色对高表达热休克蛋白(hsps)的巨噬细胞在肝细胞癌患者的肿瘤组织中进行定位;检测炎性条件(lps/ifn-γ)下巨噬细胞hsps的转录水平变化,分别通过cck-8实验和划痕实验检测hsps 巨噬细胞条件培养基对肿瘤细胞增殖能力和迁移能力的影响;通过生信分析预测调控巨噬细胞hsps水平可能的信号通路,用qpcr和westernblot对相关信号通路进行验证;通过sirna干扰下调hsps 巨噬细胞p38α水平,分别用cck-8和划痕实验检测实验组和对照组巨噬细胞条件培养基对hcc细胞增
殖和迁移能力的影响,可以知道:在hcc中,持续的慢性炎症刺激通过活化hsps 巨噬细胞上p38α介导的mapk信号途径,上调促瘤细胞因子表达水平,进而促进hcc细胞的增殖与迁移。
6.根据上述实验与分析,本发明的目的在于提供高表达热休克蛋白的巨噬细胞作为靶点在制备肝细胞癌药物中的应用。
7.进一步的,所述高表达热休克蛋白的巨噬细胞通过活化p38α介导的mapk信号通路诱导获得。
8.基于同一发明构思的,本发明实施例还提供了一种抗肝细胞癌药物组合物,所述药物组合物包括p38α表达抑制剂。
9.进一步的,所述p38α表达抑制剂为p38αsirna。
10.有益效果:
11.本发明通过大量的实验和分析获得了高表达hsps的巨噬细胞对肝细胞癌发生、发展的影响以及相关作用机制,首次提出了以hsps 巨噬细胞作为靶点用于肝细胞癌的治疗,提供了采用p38αsirna阻断hsps 巨噬细胞mapk信号途径,从而减弱hcc细胞增殖和迁移的能力,达到治疗肝细胞癌的效果。
附图说明
12.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
13.图1为本发明的实施例提供的hcc组织单细胞测序数据整合分析结果;(a).髓系细胞降维聚类分群图;(b).髓系细胞中的巨噬细胞降维聚类分群图;(c).不同表型巨噬细胞在22位hcc患者中的分布;(d).不同表型巨噬细胞在22位hcc患者癌旁组织中分布的统计图;(e).不同表型巨噬细胞在22位hcc患者肿瘤组织中分布的统计图;
14.图2为本发明实施例提供的肝细胞癌组织与癌旁组织免疫荧光染色结果与统计图,(a).免疫荧光染色图,红色荧光染色为cd68,绿色荧光染色为hsp90α,蓝色荧光染色为dapi(细胞核);(b).同时表达cd68和hsp90α的细胞数量统计结果图;
15.图3为本发明实施例提供的使用pma将thp-1细胞诱导为巨噬细胞,(a).thp-1细胞用pma诱导前和诱导后的细胞形态,比例尺:100μm。(b).thp-1细胞用pma诱导前和诱导后的巨噬细胞标志物cd68mrna表达水平;
16.图4为本发明实施例提供的lps和ifn-γ诱导巨噬细胞1天、2天和3天后hsps mrna表达水平升高;(a).hspa1b mrna表达水平;(b).dnajb1mrna表达水平;(c).hsp90aa1mrna表达水平;(d).hsph1mrna表达水平;
17.图5为本发明实施例提供的lps和ifn-γ诱导巨噬细胞1天、2天和3天后细胞因子mrna表达水平升高;(a).tnf-αmrna表达水平;(b).il-1βmrna表达水平;(c).il-10mrna表达水平;(d).tgf-β1mrna表达水平;
18.图6为本发明实施例提供的hcc细胞系在使用hsps 巨噬细胞条件培养基处理后的cck-8检测结果;(a).hepg2细胞在使用hsps 巨噬细胞条件培养基处理后的cck-8结果;(b).hep3b细胞在使用hsps 巨噬细胞条件培养基处理后的cck-8结果;
19.图7为本发明实施例提供的hepg2细胞在使用hsps 巨噬细胞条件培养基处理后的划痕实验结果;(a).hepg2细胞在使用hsps 巨噬细胞条件培养基处理前后的细胞形态和划痕区域,比例尺:250μm;(b).hepg2细胞迁移率统计图;
20.图8为本发明实施例提供的hep3b细胞在使用hsps 巨噬细胞条件培养基处理后的划痕实验结果;(a).hep3b细胞在使用hsps 巨噬细胞条件培养基处理前后的细胞形态和划痕区域,比例尺:250μm;(b).hep3b细胞迁移率统计图;
21.图9为本发明实施例提供的mapk信号通路上的p38α分子在hsps 巨噬细胞上表达增高;(a).差异基因通路富集气泡图;(b).lps和ifn-γ持续诱导3天后巨噬细胞hsps和p38α的mrna表达水平;
22.图10为本发明实施例提供的不同p38αsirna干扰序列干预巨噬细胞后p38α和hsps蛋白水平及mrna水平表达变化;(a).巨噬细胞转染3条不同p38αsirna干扰序列后p38α蛋白水平表达降低;(b).lps/ifn-γ诱导的hsps 巨噬细胞转染3条不同p38αsirna干扰序列后p38α和hsps的mrna水平表达变化;
23.图11为本发明实施例提供的使用p38αsirna#3干扰序列阻断hsps 巨噬细胞的mapk信号通路后p38α和hsps蛋白水平及mrna水平表达变化;(a).巨噬细胞转染p38αsirna#3干扰序列并使用lps和ifn-γ诱导后p38α蛋白水平表达变化;(b).p38α蛋白表达水平的统计学分析;(c).巨噬细胞转染p38αsirna#3干扰序列并使用lps和ifn-γ诱导后p38α和hsps的mrna表达水平变化;
24.图12为本发明实施例提供的使用mapk信号通路阻断的hsps 巨噬细胞培养基处理hepg2细胞的cck-8结果;
25.图13为本发明实施例提供的使用mapk信号通路阻断的hsps 巨噬细胞培养基处理hepg2细胞划痕实验结果;(a).hcc细胞系hepg2细胞在使用被p38αsirna干扰以及lps和ifn-γ诱导的巨噬细胞培养基处理前后的细胞形态和划痕区域,比例尺:250μm;(b).hepg2细胞迁移率统计图;
26.图14为本发明实施例提供的使用mapk信号通路阻断的hsps 巨噬细胞培养基处理hep3b细胞划痕实验结果;(a).hcc细胞系hep3b细胞在使用被p38αsirna干扰以及lps和ifn-γ诱导的巨噬细胞培养基处理前后的细胞形态和划痕区域,比例尺:250μm;(b).hep3b细胞迁移率统计图;
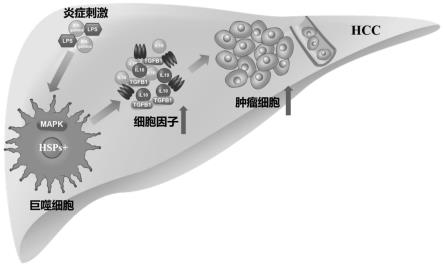
27.图15为本发明实施例提供的肝细胞癌形成机理图。
具体实施方式
28.为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述,但本发明的保护范围并不限于以下具体实施例。
29.除非另有定义,下文中所使用的所有专业术语与本领域技术人员通常理解含义相同。本文中所使用的专业术语只是为了描述具体实施例的目的,并不是旨在限制本发明的保护范围。
30.除非另有特别说明,本发明中用到的各种原材料、试剂、仪器和设备等均可通过市场购买得到或者可通过现有方法制备得到。
31.本发明采用的肿瘤组织为2018年10月至2020年10月从中南大学湘雅三医院肝胆
pcr反应,检测hsps亚型hspa1b、dnajb1、hsp90aa1、hsph1的mrna表达水平,以及细胞因子tnf-α、il-1β、il-10、tgf-β1的mrna表达水平。如图4所示,与对照组相比,加lps和ifn-γ诱导后,hspa1b、dnajb1、hsp90aa1、hsph1的mrna表达水平均增高,且具有统计学差异(p《0.05),尤其是诱导3天组,hsps的mrna表达水平增高更加显著。细胞因子的mrna表达水平如图5所示,与对照组相比,加lps和ifn-γ诱导后,促炎细胞因子tnf-α和il-1β的表达水平显著升高,且抗炎细胞因子il-10和tgf-β1的表达水平也逐渐增多,il-10和tgf-β1具有促进肿瘤的作用,促炎细胞因子tnf-α和il-1β在长时间的作用下也具有促肿瘤作用,为了更准确地模拟持续的慢性炎症性的肿瘤微环境,我们选择诱导时间更长的3天进行后续实验。
43.收集hsps 巨噬细胞的培养基,使用0.22μm滤器过滤掉细胞碎片后处理hcc细胞系hepg2细胞和hep3b细胞,用cck-8检测细胞增殖能力。结果如图6所示,使用hsps 巨噬细胞条件培养基处理hcc细胞系hepg2和hep3b细胞24小时后,hepg2细胞和hep3b细胞的增殖与对照组相比显著增高。
44.收集hsps 巨噬细胞的培养基,使用0.22μm滤器过滤后处理hcc细胞系,采用划痕实验检测肿瘤细胞的迁移能力。结果如图7和8所示,hepg2细胞和hep3b细胞在使用hsps 巨噬细胞条件培养基处理24小时后,细胞的迁移明显高于对照组,且均具有统计学差异(p《0.05)。
45.收集hsps 巨噬细胞,提取巨噬细胞总rna,进行qrt-pcr反应,对mapk信号通路的相关基因进行检测,结果发现p38α发生明显上调(图9-b),因此我们推测巨噬细胞在炎性环境下表达hsps与p38α介导的mapk信号通路的激活相关。所有数据均具有统计学差异(p《0.01)。
46.实施例3
47.取表1中不同的p38αsirna序列进行rna干扰试验,具体步骤如下:
48.溶液配制:样品为减压离心干燥品,制品干燥于管底,为干粉状,为配制成20μm溶液,需要在每一管中加入62.5μldepc水,根据对使用浓度的摸索,最终使用浓度定为80nm。
49.转染:取7.5μl/孔lipofectamine 2000,用150μl无血清rpmi 1640培养基稀释,轻轻混匀;取8μl sirna,用150μl无血清rpmi 1640培养基稀释,轻轻混匀;将稀释的lipofectamine 2000与稀释的sirna轻轻混合,混匀后室温孵育10分钟。取出铺有巨噬细胞的六孔板,弃去孔中的培养基,加入1700μl新的完全培养基,孵育结束后,将sirna与lipofectamine 2000的混合物加入孔中,缓慢摇晃六孔板,使六孔板中的培养基与转染复合物均匀混合,放回细胞培养箱,10小时后弃去孔中培养基加入10%rpmi 1640完全培养基继续培养48-72小时提取巨噬细胞的rna和蛋白质。若需加lps和ifn-γ诱导,则在转染10小时换液时加入lps和ifn-γ诱导72小时之后提取巨噬细胞rna和蛋白质。
50.结果如图10所示,从蛋白水平来看图10-a,三条序列中,干扰p38α表达最明显的是#3sirna序列,其p38α的蛋白表达最低,表明#3sirna序列干扰p38α表达的效果最佳。从mrna表达水平来看(图10-b),将hsps 巨噬细胞上的p38α使用sirna阻断后,#3sirna序列降低p38α和hsps mrna表达最显著,且p38α表达越低,hsps的表达也越低,表明炎症刺激是通过p38α介导的mapk信号通路诱导巨噬细胞hsps表达上调的。
51.结合上述实验结果阻断hsps 巨噬细胞中p38α介导的mapk信号通路,再通过cck-8检测肿瘤细胞的增殖是否被抑制,通过划痕实验检测肿瘤细胞的迁移是否被抑制。如图11
所示,实验设置为3组,阴性对照组、阴性对照组加lps/ifn-γ诱导组、p38αsirna#3序列加lps/ifn-γ诱导组。从图11-a和图11-c可见,与阴性对照组相比,加lps/ifn-γ诱导之后,p38α在蛋白水平和mrna水平表达增高,hsps的mrna表达水平也增高;同样是加lps/ifn-γ将巨噬细胞诱导为hsps 巨噬细胞,阻断了mapk信号通路的组中p38α在蛋白水平和mrna水平表达降低,hsps的mrna表达水平也低于未阻断mapk信号通路的组。表明阻断mapk信号通路后,巨噬细胞上hsps的表达被抑制,可以将其培养基用于后续处理hcc细胞系。
52.为了考察阻断hsps 巨噬细胞中p38α介导的mapk信号通路后hcc细胞的增殖情况,采用上述3组巨噬细胞的培养基来处理hcc细胞系。hepg2细胞增殖的结果如图2所示,与阴性对照组相比,使用hsps 巨噬细胞培养基处理之后,hepg2细胞的增殖能力提高,这与我们之前的结果一致;与使用hsps 巨噬细胞的培养基相比,使用阻断其mapk信号通路后的巨噬细胞培养基处理的hepg2细胞增殖减弱,且具有统计学差异(p《0.0001)。结果表明阻断hsps 巨噬细胞中p38α介导的mapk信号通路后减弱了hcc细胞的增殖。
53.为了探索阻断hsps 巨噬细胞中p38α介导的mapk信号通路后hcc细胞的迁移情况,我们使用上述3组巨噬细胞的培养基来处理hcc细胞系。hepg2细胞和hep3b细胞划痕实验的结果如图3-13和图3-14所示,与阴性对照组相比,使用hsps 巨噬细胞培养基处理之后,hepg2细胞和hep3b细胞的迁移增强,这与我们之前的结果一致;与使用hsps 巨噬细胞的培养基相比,使用阻断其mapk信号通路后的巨噬细胞培养基处理的hepg2细胞和hep3b细胞的迁移减弱,且均具有统计学差异(p《0.05)。结果表明阻断hsps 巨噬细胞中p38α介导的mapk信号通路后减弱了hcc细胞的迁移。
54.由此可知,如图15所示的肝细胞癌形成机理图,炎症刺激是通过活化hsps 巨噬细胞中p38α介导的mapk信号通路上调促瘤细胞因子表达水平,进而促进hcc细胞增殖与迁移。阻断了hsps 巨噬细胞中p38α介导的mapk信号通路后hcc细胞增殖和迁移能力减弱。为今后以巨噬细胞为靶点的hcc早期诊断和免疫治疗提供了方向。
55.以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。