1.本发明涉及还原剂和气体的制造方法,更具体地说,涉及例如可用于化学链法(chemical looping method)的还原剂和使用该还原剂进行的气体的制造方法。
背景技术:
2.近年来,作为温室气体的一种的二氧化碳,其在大气中的浓度持续上升。大气中二氧化碳浓度的上升助长了全球变暖。因此,回收被释放到大气中的二氧化碳是很重要的,而且如果能够将回收得到的二氧化碳转换为有价物质并再利用,则能够实现碳循环社会。
3.以往,作为由二氧化碳制造一氧化碳的方法,已知利用了逆水性气体转移反应的方法。但是,该以往的逆水性气体转移反应,由于作为产物的一氧化碳和水共存于体系内,因此存在因受到化学平衡的制约而二氧化碳向一氧化碳转换的效率低的问题。
4.于是,为了解决上述问题,利用化学链法进行从二氧化碳到一氧化碳的转换(合成)。这里所说的“化学链法”是将上述逆水性气体转移反应分为通过氢气进行的还原反应、和由二氧化碳生成一氧化碳的反应这两反应,通过金属氧化物(mo
x
)使这些反应牵连的方法(参照下述式)。
5.h2 mo
x
→
h2o mo
x-1
6.co2 mo
x-1
→
co mo
x
7.另外,在上述式中,mo
x-1
表示金属氧化物的一部分或全部被还原了的状态。
8.在化学链法中,在各自的反应时,作为逆反应的基质的水和一氧化碳不共存,因此有可能得到比逆水性气体转移反应的化学平衡更高的二氧化碳向一氧化碳转换的转换效率。
9.在该化学链法中,作为使反应有牵连的金属氧化物,广泛使用具有氧离子传导性的氧化铈、或氧化铁等氧载体。
10.另外,在非专利文献1中记载了通过使用担载在al2o3等载体上的氧化镍和氧化铁的混合氧载体,进一步担载作为碱性氧化物的氧化镁,能够加速混合氧载体的氧移动速度。
11.现有技术文献
12.非专利文献
13.非专利文献1:asc omega 2018,3,4378-4383
技术实现要素:
14.发明要解决的课题
15.但是,根据本发明人的研究,非专利文献1所记载的混合氧载体的使用用途不是指向二氧化碳向一氧化碳转换的化学链反应。因此,该混合氧载体在吸附二氧化碳时的反应性或与碱性氧化物的相互作用不充分,即使用于将二氧化碳转换为一氧化碳,也存在其转换效率低的问题。
16.本发明是鉴于上述情况而完成的,其目的在于提供一种二氧化碳向一氧化碳转换
的效率高、例如可用于化学链法的还原剂、以及使用该还原剂的气体的制造方法。
17.解决课题的手段
18.这样的目的通过下述的本发明来实现。
19.[1].本发明的还原剂,是在通过与含有二氧化碳的原料气体接触来还原所述二氧化碳、从而制造含有一氧化碳的生成气体时所使用的还原剂,其特征在于,含有:
[0020]
具有氧离子传导性的氧载体,和
[0021]
担载在该氧载体上的碱性氧化物。
[0022]
[2].本发明的还原剂,优选相对于所述还原剂100质量份,所述碱性氧化物的量为60质量份以下。
[0023]
[3].本发明的还原剂,优选所述碱性氧化物包含选自锂(li)、钠(na)、钾(k)、镁(mg)、锰(mn)、钴(co)、锶(sr)和铷(rb)中的至少一种。
[0024]
[4].本发明的还原剂,优选所述氧载体包含选自钒(v)、铁(fe)、钛(ti)、钼(mo)、钇(y)、铬(cr)、镧(la)、镍(ni)、铜(cu)、钨(w)、铌(nb)和铈(ce)中的至少一种。
[0025]
[5].本发明的还原剂,优选含有被担载在所述氧载体上的以ce
1-x
(m)
x
oy表示的复合金属氧化物,其中,m是其离子半径比相同价数且相同配位数的ce的离子半径小的金属元素,x表示正实数,y表示1~4的实数。
[0026]
[6].本发明的还原剂,优选所述ce的离子半径与所述金属元素m的离子半径之差,在价数为3、配位数为6时为大于0pm且47pm以下,在价数为4、配位数为8时为大于0pm且24pm以下。
[0027]
[7].本发明的还原剂,优选所述金属元素m为选自钐(sm)、锆(zr)和铪(hf)中的至少一种。
[0028]
[8].本发明的还原剂,优选该还原剂用于通过与含有二氧化碳的原料气体接触来还原所述二氧化碳、从而制造含有一氧化碳的生成气体。
[0029]
[9].本发明的还原剂,优选被氧化了的该还原剂通过与含有氢气的还原气体接触而被还原。
[0030]
[10].本发明的还原剂,优选该还原剂用于二氧化碳的还原反应和被氧化了的该还原剂的还原反应的各个反应工序。
[0031]
[11].本发明的气体的制造方法,其特征在于,通过使本发明的还原剂与含有二氧化碳的原料气体接触来还原所述二氧化碳,从而制造含有一氧化碳的生成气体。
[0032]
发明效果
[0033]
根据本发明,可以由含有二氧化碳的原料气体高效率地制造含有一氧化碳的生成气体。另外,本发明的还原剂例如可用于化学链法。
具体实施方式
[0034]
以下,基于优选实施方式对本发明的还原剂和气体的制造方法进行详细说明。
[0035]
[还原剂]
[0036]
本发明的还原剂是在通过与含有二氧化碳的原料气体接触,来还原二氧化碳,制造含有一氧化碳的生成气体时使用的(即,用于本发明的气体的制造方法)。另外,通过使还原气体与被氧化了的还原剂接触,可以使还原剂还原(再生)。
[0037]
此时,优选通过使原料气体和还原气体交替通过填充有本发明的还原剂的反应管(反应容器)内部,通过还原剂进行从二氧化碳向一氧化碳的转换、且通过还原气体进行氧化状态的还原剂的再生。
[0038]
本发明的还原剂包含氧载体和担载在该氧载体上的碱性氧化物。
[0039]
在此,氧载体是指以下化合物:具有氧离子传导性、能够产生可逆性氧缺损的化合物,从其自身通过还原产生氧元素缺损,但在氧元素缺损了的状态(还原状态)下,若与二氧化碳接触则从二氧化碳中夺取氧元素而显示还原作用的化合物。
[0040]
另一方面,碱性氧化物是具有吸附二氧化碳的性质的化合物。
[0041]
这样,通过在氧载体上担载碱性氧化物,即使在比较低的温度下也能够将二氧化碳有效地转换(还原)为一氧化碳,并且即使反复使用也能够良好地维持氧载体的活性,能够延长作为还原剂的寿命。
[0042]
得到上述效果的理由还不确定,但推定如下。即推定,碱性氧化物吸附二氧化碳,二氧化碳蓄积在氧载体的表面。蓄积的二氧化碳通过所谓的表面迁移现象向氧载体的表面扩散,由此二氧化碳向一氧化碳转换的效率良好。特别是,在化学链反应中,由于使其与作为反应气体的含有大量二氧化碳的气体和还原剂接触,因此二氧化碳吸附于氧载体的效果对反应效率有很大影响。这里,碱性氧化物可以以粒状存在于氧载体的表面,也可以以覆盖氧载体的表面的至少一部分的方式以层状存在。
[0043]
另外,例如在化学链工艺中反复使用还原剂时,氧载体由于膨胀和收缩而反复发生变形,但也可以认为碱性氧化物使该变形程度缓和,从而抑制氧载体的破坏。估计这是即使在反复使用它之后还原剂的活性仍保持良好的原因。
[0044]
[氧载体]
[0045]
氧载体只要是可产生可逆性氧缺损的化合物即可,没有特别限定,优选为通式m1oy表示的金属氧化物。
[0046]
上述通式m1oy中,m1表示属于周期表的第2族~第13族的金属元素中的至少1种,y表示正的实数。
[0047]
在此,y优选为0.5~6,更优选为1~5,进一步优选为1~4。
[0048]
通式m1oy表示的化合物可以通过还原气体进行还原而生成通式m1o
y-n
表示的化合物。通式m1o
y-n
中,m1及y与上述通式m1oy相同,n为正实数。
[0049]
另外,n通常为比y小的值,优选为0.05~5,更优选为0.1~3,进一步优选为0.15~2。
[0050]
通式m1oy表示的化合物通过与还原气体的接触而被还原,转化为通式m1o
y-n
表示的化合物。通式m1o
y-n
表示的化合物通过与含有二氧化碳的原料气体接触而被氧化,转化为通式m1oy表示的化合物。由此,还原剂能够在二氧化碳的还原反应和还原剂的还原反应中循环利用。
[0051]
如上所述,氧载体只要是使m1oy被还原为m1o
y-n
、且使m1o
y-n
被氧化为m1oy的化合物即可,没有特别限定。如果能够进行这样氧化和还原,则可用于化学链法那样的伴随二氧化碳还原反应的系统。
[0052]
氧载体所具有的金属元素m1是具有多个氧化概念状态的元素。这里,所谓“具有多个氧化概念状态的金属元素”,例如在铁(fe)的情况下,是指能够如fe
2
、fe
3
那样取多个价
数的金属元素。
[0053]
作为氧载体所具有的金属元素m1,例如可以举出属于周期表的第3族~第12族的金属元素。作为金属元素m1优选是选自钒(v)、铁(fe)、钛(ti)、钼(mo)、钇(y)、铬(cr)、镧(la)、镍(ni)、铜(cu)、钨(w)、铌(nb)和铈(ce)中的至少一种。其中,作为金属元素m1,优选铈、铬、铁等。通过使用具有这些金属元素m1的氧载体,二氧化碳向一氧化碳转换的效率进一步提高,并且即使在比较低的温度下该反应也容易进行。
[0054]
另外,氧载体可以是无定形的,也可以具有结晶性。此外,由氧载体形成的晶体可以具有任何结构。
[0055]
[碱性氧化物]
[0056]
碱性氧化物是与水反应产生碱、或与酸反应产生盐的金属元素的氧化物(金属氧化物)。其中,碱性氧化物优选是具有吸附二氧化碳的性质的金属氧化物。另外,碱性氧化物是与氧载体不同的化合物。
[0057]
碱性氧化物可以化学性吸附二氧化碳,也可以物理性吸附二氧化碳。
[0058]
在此,化学性吸附二氧化碳的碱性氧化物是指通过与二氧化碳反应而在其分子中捕捉二氧化碳的金属氧化物。另外,物理性吸附二氧化碳的碱性氧化物是指不通过化学反应而通过范德华力等捕捉二氧化碳的金属氧化物。
[0059]
其中,碱性氧化物优选是化学性吸附二氧化碳的金属氧化物。
[0060]
作为碱性氧化物所具有的金属元素,可以举出例如属于周期表的第1族、第2族、第7族或第9族的金属元素。作为金属元素优选为选自锂(li)、钠(na)、钾(k)、镁(mg)、锰(mn)、钴(co)、锶(sr)和铷(rb)中的至少一种,更优选选自锂、镁、锰和锶中的至少一种。这些碱性氧化物由于二氧化碳的吸附能力优异而优选。
[0061]
碱性氧化物吸附二氧化碳的反应是发热反应。因此,由于碱性氧化物通过吸附二氧化碳而发热,因此容易促进通过氧载体进行的从二氧化碳向一氧化碳的还原反应。
[0062]
还原剂优选用于反应温度是其平衡反应开始的温度(以下也记载为“平衡反应开始温度”)以上的二氧化碳还原反应。平衡反应开始温度,在碱性氧化物与二氧化碳反应并吸附时,是指作为平衡反应的吸附反应开始的温度。例如,如果碱性氧化物为氧化镁(mgo),则在1个气压下、平衡反应开始温度为250℃左右。
[0063]
如果反应温度为平衡反应开始温度以上,则二氧化碳容易通过表面迁移现象向氧载体供给,更适当地进行二氧化碳向一氧化碳的转换(还原)。另外,关于碱性氧化物的平衡反应,可以参照energy&fuels 2007,21,426-434「screening of co 2
adsorbing materials for zero emission power generation systems」等。
[0064]
另外,通过氧载体担载碱性氧化物,能够改善还原剂的活性,并且促进还原剂的稳定化。认为这是由于通过碱性氧化物提高了二氧化碳的吸附能力的缘故。
[0065]
例如,如果在氧载体中添加(掺杂)金属元素(碱金属元素或碱土金属元素),则在氧载体的表面存在大量该金属元素的氧化物(碱性氧化物)。
[0066]
在此,二氧化碳在氧载体上的分解可以用由二氧化碳的活性化(oc-o键的分裂及表面氧的生成)、表面氧的扩散及金属-氧-金属键的生成组成的3个阶段所构成的阳离子氧化还原机理表示。
[0067]
所有这些阶段都通过氧化还原反应进行,因此强烈依赖于氧载体表面的电子特
性。当氧载体在内部和表面掺入了少量金属元素时,氧元素在氧载体的内部和表面的表面迁移速度提高。
[0068]
本发明人认为,通过金属元素的添加会降低氧载体表面的功函数。这种效应是由氧载体表面的碱性氧化物的表面离子化引起的,形成扩散表面偶极子,并使氧载体的电子密度发生变化。
[0069]
因此,通过降低氧载体表面的功函数,除了在其表面的二氧化碳强力吸附之外,还促进二氧化碳向一氧化碳的转换。
[0070]
另一方面,如果添加过量的金属元素,则由于以下4个理由,二氧化碳的还原(即向一氧化碳的转换)容易受到阻碍。
[0071]
1.通过添加的金属离子,阻断氧载体表面的还原活性位点,从而产生的立体效应
[0072]
2.添加的金属离子的电子效应:不仅对水和一氧化碳的脱离、而且对氢和二氧化碳的吸附产生不良影响
[0073]
3.降低从二氧化碳到一氧化碳的反应选择性、提高对c3、c4和c5烃的反应选择性的氧载体表面的高碱性
[0074]
4.通过促进氧载体中活性金属元素(尖晶石的情况下为fe)的凝聚而发生相分离的金属氧化物的形成
[0075]
在本发明中,优选选择具有以上特性的碱性氧化物,将其在还原剂中的量设定在适当的范围内使用。
[0076]
因此,可以在本发明中使用的碱性氧化物当然不限于上述例示的碱性氧化物。
[0077]
如上所述,相对于还原剂100质量份,碱性氧化物的量优选为60质量份以下,更优选为50质量份以下,进一步优选为35质量份以下,特别优选为20质量份以下,最优选为1~10质量份。通过使氧载体与碱性氧化物的量的关系在上述范围内,可以使通过碱性氧化物吸附二氧化碳的量适度,并且使通过氧载体将二氧化碳转化为一氧化碳的转换容易进行。
[0078]
[复合金属氧化物]
[0079]
本发明的还原剂,氧载体还优选担载在具有以下功能的复合金属氧化物上:通过与氧载体相互作用而从氧载体夺走氧元素,并使生成的氧缺损(缺陷)在氧载体中更有效地移动(迁移)而保持。另外,复合金属氧化物优选其自身不参与反应、或即使参与、也仅参与一部分,还具有作为还原剂的结构维持体的功能。由此,能够进一步提高上述转换效率。
[0080]
复合金属氧化物优选为通式ce
1-x
(m)
x
oy表示的化合物。复合金属氧化物由于构成的金属元素复合在一起,它们相互靠近地排列,因此与氧载体有效地相互作用,所以氧载体中的氧缺损的迁移效果优异。与此相对,在单纯的金属氧化物的混合物中,这些粒子之间仅在表面附近接触,有时不能将氧缺损的迁移效果提高到期待的程度。另外,复合金属氧化物是与氧载体和碱性氧化物不同的化合物。
[0081]
在上述通式ce
1-x
(m)
x
oy中,m是可以取3价或4价的金属元素,其离子半径比相同价数且相同配位数的ce的离子半径小。
[0082]
在该复合金属氧化物中,ce的离子半径与金属元素m的离子半径之差,优选在价数为3、配位数为6时为大于0pm且47pm以下,在价数为4、配位数为8时为大于0pm且24pm以下。
[0083]
例如,各金属元素的配位数为8时的ce
4
的离子半径为97pm,因此金属元素m优选为其四价离子(m
4
)的离子半径为73pm以上且小于97pm的金属元素。另外,各金属元素的配位
数为6时的ce
3
的离子半径为101pm,因此金属元素m优选为其三价离子(m
3
)的离子半径为54pm以上且小于101pm的金属元素。
[0084]
通过使通式ce
1-x
(m)
x
oy表示的复合金属氧化物含有满足上述条件的金属元素m,由此其晶格缺陷发生变形,为了补偿该变形,与氧载体的相互作用力增强,因此,氧缺损容易顺畅地在氧载体中迁移。
[0085]
另外,单纯的金属氧化物或其混合物容易吸附原料气体或还原气体中含有的杂质,具有稳定性降低的倾向,但复合金属氧化物难以吸附杂质,能够长时间维持氧缺损的迁移能力。其结果,能够提高通过还原剂从二氧化碳向一氧化碳转换的效率。
[0086]
这里,x是正的实数,优选为0.2~0.8,更优选为0.3~0.7。此时,复合金属氧化物的晶格缺陷的变形程度容易适度。
[0087]
另外,y为1~4的实数,优选为1~3的实数,更优选为1~2的实数。此时,复合金属氧化物的稳定性容易提高。
[0088]
ce离子半径与金属元素m的离子半径之差,在各金属元素为价数3且配位数为6时,优选为大于0pm且47pm以下,在各金属元素为价数4且配位数为8时,优选为大于0pm且24pm以下,在任一情况均更优选大于0pm且20pm以下,进而优选大于0pm且15pm以下,特别优选大于1pm且8pm以下。由此,由于ce的离子半径与金属元素m的离子半径的差不过度大,所以能够防止金属元素m从复合金属氧化物脱离,同时使复合金属氧化物的晶格缺陷产生适当的变形。
[0089]
作为该金属元素m,可以举出钐(sm)、锆(zr)、铪(hf)、钇(y)、钆(gd)、铌(nb)、镨(pr)、镧(la)、钛(ti)、铟(in)、钕(nd)、钪(sc)等。其中,作为金属元素m优选为选自钐(sm)、锆(zr)和铪(hf)中的至少一种,更优选为钐。如果使用上述金属作为金属元素m,则能够充分加快氧缺损的迁移,因此能够显著提高通过还原剂从二氧化碳向一氧化碳转换的效率。
[0090]
另外,关于各金属离子的离子半径,配位数8的zr
4
为84pm,配位数8的hf
4
为83pm,配位数8的nb
4
为79pm,配位数8的ti
4
为74pm,配位数6的sm
3
为95.8pm,配位数6的y
3
为90pm,配位数6的gd
3
为93.8pm,配位数6的pr
3
为99pm,配位数6的in
3
为80pm,配位数6的nd
3
为98.3pm,配位数6的sc
3
为74.5pm。
[0091]
氧载体担载复合金属氧化物时,相对于还原剂100质量份,复合金属氧化物的量优选为50质量份以下,更优选为40质量份以下,进一步优选为30质量份以下,特别优选为10~25质量份。通过使氧载体与复合金属氧化物的量的关系在上述范围内,通过氧载体从二氧化碳向一氧化碳的转换可以进行,促进通过复合金属氧化物在氧载体中的氧缺损的迁移。因此,通过还原剂可以进一步提高二氧化碳向一氧化碳转换的效率。
[0092]
还原剂的填充密度优选为1.1g/ml以下,更优选为0.4~1g/ml,进一步优选为0.5~0.9g/ml。如果该填充密度过低,则气体的通过速度过快,还原剂与原料气体及还原气体接触的时间减少。其结果,通过还原剂从二氧化碳向一氧化碳转换的效率、通过还原气体将氧化状态的还原剂再生的效率容易降低。另一方面,如果该填充密度过高,则气体的通过速度变得过慢,反应变得难以进行,制造生成气体需要长时间。
[0093]
还原剂的细孔容积优选为0.4cm3/g以上,更优选为1~30cm3/g,进一步优选为5~20cm3/g。如果该细孔容积过小,则原料气体及还原气体难以进入还原剂的内部。其结果,还原剂与原料气体及还原气体的接触面积减少,通过还原剂从二氧化碳向一氧化碳转换的效
率、通过还原气体将氧化状态的还原剂再生的效率容易降低。另一方面,即使该细孔容积大于上限值,也不能期待进一步的效果增大,根据还原剂的种类,机械强度降低。
[0094]
作为还原剂的形状,没有特别限定,例如优选粒状。如果是粒状,则容易将还原剂的填充密度调整到上述范围。
[0095]
在此,粒状是包含粉末状、粒子状、块状、颗粒状等的概念,其形态也可以是球状、板状、多角状、破碎状、柱状、针状、鳞片状等中的任一种。
[0096]
还原剂平均粒径为优选1μm~5mm,更优选10μm~1mm,进而更优选20μm~0.5mm。如果是具有该平均粒径的还原剂,则其填充密度容易在上述范围内。
[0097]
另外,在本说明书中,平均粒径是指通过电子显微镜观察到的一个视野中的任意200个还原剂的粒径的平均值。此时,“粒径”是指还原剂的轮廓线上的两点间的距离中最大的长度。另外,还原剂为柱状时,将其端面的轮廓线上的2点间的距离中的最大长度设为“粒径”。另外,平均粒径例如在为块状等、一次粒子凝聚的情况下,表示二次粒子的平均粒径。
[0098]
还原剂的bet比表面积优选为1~500m2/g,更优选为3~450m2/g,进一步优选为5~400m2/g。通过使bet比表面积在上述范围内,容易提高通过还原剂从二氧化碳向一氧化碳转换的效率。
[0099]
另外,在本发明中,由于能够通过复合金属氧化物促进氧载体中的氧缺损的迁移,所以能够在低温(400℃左右)~高温(650℃左右)的大范围内将还原剂的氧容量维持在高的状态。即,还原剂可以在较宽的温度范围内将二氧化碳有效地转化为一氧化碳。
[0100]
还原剂在400℃下的氧容量优选为1~40质量%,更优选为2~30质量%。如果还原剂在低温下的氧容量在上述范围内,则意味着即使在实际运转时的温度(650℃左右)下氧容量也足够高,可以说是二氧化碳向一氧化碳转换的效率极高的还原剂。
[0101]
[还原剂的制造方法]
[0102]
接着,对还原剂的制造方法进行说明。
[0103]
在氧载体上担载碱性氧化物(根据需要,还有复合金属氧化物)而成的还原剂可以如下制造。首先,将氧载体、碱性氧化物以及根据需要而使用的构成复合金属氧化物的金属元素的盐溶解于酸性水中,调制水溶液。接着,将该水溶液凝胶化,然后进行干燥和烧成。即,本发明的还原剂可以通过所谓的溶胶-凝胶法容易且可靠地制造。
[0104]
作为用于制备酸性水的酸,可以列举出例如柠檬酸、乙酸、苹果酸、酒石酸、盐酸、硝酸或它们的混合物等。
[0105]
作为金属元素的盐,可以举出例如硝酸盐、硫酸盐、氯化物、氢氧化物、碳酸盐或它们的复合物等,其中优选为硝酸盐。另外,金属元素的盐可以根据需要使用水合物。
[0106]
凝胶的干燥优选在20~200℃、更优选在50~150℃的温度下进行优选0.5~20小时、更优选1~15小时的时间。通过这样干燥,可以使凝胶均匀干燥。
[0107]
凝胶的烧成优选在300~1200℃、更优选在350~800℃的温度下进行优选1~24小时、更优选1.5~20小时的时间。凝胶通过烧成可以很好地变为氧化物,但通过在上述烧成条件下的烧成,可以容易地转化为氧载体、碱性氧化物和复合金属氧化物。另外,如果在上述烧成条件下烧成,则还可以防止还原剂的过度粒子生长。
[0108]
在达到上述烧成温度之前,以升温速度1~20℃/分钟,优选升温速度2~10℃/分钟进行升温。由此,在促进还原剂的粒子的生长的同时,也可以避免结晶(粒子)的破裂。
[0109]
另外,此时如果使构成氧载体的金属元素的盐的量充分大于构成碱性氧化物和复合金属氧化物的金属元素的盐的量,则以氧载体为芯,形成担载于该芯的碱性氧化物和复合金属氧化物。此时,认为碱性氧化物和复合金属氧化物被覆或以粒状分散在氧载体(芯部)的周围而形成表面层(壳部)。
[0110]
[还原剂的使用方法]
[0111]
如上所述,本发明的还原剂例如可以在化学链法中使用。另外,如上所述,本发明的还原剂可以用于还原二氧化碳的用途。
[0112]
更具体而言,可以进行二氧化碳的还原反应和还原剂的还原反应,还原剂优选以在二氧化碳的还原反应和还原剂的还原反应之间循环的方式使用。另外,在还原剂的还原反应中,使用其他还原剂(还原气体)。
[0113]
另外,本发明的还原剂优选用于所谓的逆水性气体转移反应。逆水性气体转移反应是由二氧化碳和氢气生成一氧化碳和水的反应。逆水性气体转移反应,在应用化学链法时,分为还原剂的还原反应(第一步骤)和二氧化碳的还原反应(第二步骤)而进行,还原剂的还原反应为下述式(a)所示的反应,二氧化碳的还原反应为下述式(b)所示的反应。
[0114]
h2(气体) m1oy(固体)
[0115]
→
h2o(气体) m1o
y-n
(固体)
ꢀꢀꢀꢀ
(a)
[0116]
co2(气体) m1o
y-n
(固体)
[0117]
→
co(气体) m1o
x
(固体)
ꢀꢀꢀꢀꢀꢀꢀ
(b)
[0118]
另外,在式(a)及(b)中,m1、y及n分别与上述相同。
[0119]
即,在还原剂的还原反应中,作为还原气体的一种的氢气被氧化而生成水。另外,在二氧化碳的还原反应中,二氧化碳被还原而生成一氧化碳。
[0120]
还原剂的还原反应中的反应温度只要是能够进行还原反应的温度即可,优选为300℃以上,更优选为400℃以上,进一步优选为500℃以上,特别优选为550℃以上。在该温度范围内,可以进行有效的还原剂的还原反应。
[0121]
该反应温度的上限优选为850℃以下,更优选为750℃以下,进一步优选为700℃以下。通过将反应温度的上限设定在上述范围,可以实现经济性的提高。
[0122]
另外,二氧化碳的还原反应中的反应温度优选为300℃以上,更优选为350℃以上,进一步优选为400℃以上。在该温度范围内,可以进行有效的二氧化碳还原反应。
[0123]
另外,还原剂含有碱性氧化物时,如上所述,反应温度优选设定为碱性氧化物的平衡反应开始温度以上。
[0124]
该反应温度的上限优选为1000℃以下,更优选为850℃以下,进一步优选为700℃以下,特别优选为650℃以下。还原剂即使在低温下也能够以高效率进行从二氧化碳向一氧化碳还原的反应,因此能够将二氧化碳的还原反应设定为比较低温。另外,通过将反应温度的上限设定在上述范围内,不仅废热的灵活利用变得容易,而且能够进一步提高经济性。
[0125]
另外,在本发明中,通过二氧化碳的还原反应得到的还原物可以是一氧化碳以外的物质,具体而言可以举出甲烷。通过上述二氧化碳的还原反应得到的一氧化碳等还原物,优选进一步通过微生物发酵等转化为有机物质等。作为微生物发酵,可以举出厌氧发酵。作为得到的有机物质,可以举出甲醇、乙醇、乙酸、丁醇、它们的衍生物、或它们的混合物、异戊二烯等c5以上的化合物等。
[0126]
另外,一氧化碳等还原物也可以通过金属氧化物等转化为以往通过石油化学合成的包括烃、醇的c1至c20的化合物。作为得到的具体化合物,可以举出甲烷、乙烷、丙烯、甲醇、乙醇、丙醇、乙醛、二乙醚、乙酸、丁酸、碳酸二乙酯、丁二烯等。
[0127]
[还原剂的特性]
[0128]
本发明的还原剂优选具有以下特性。
[0129]
即,在流路内配置有压力计的内径8mm的不锈钢制的反应管内,以40cm的高度填充还原剂,以30ml/min流通浓度100体积%的氮气时,10分钟的压力上升优选为0.03mpag以下,更优选为0.01mpag以下。
[0130]
显示该特性的还原剂可以判断为填充密度和细孔容积满足上述范围,可以充分提高从二氧化碳向一氧化碳转换的效率。
[0131]
以上,对本发明的还原剂和气体的制造方法进行了说明,但本发明不限于此。
[0132]
例如,本发明的还原剂和气体的制造方法可以相对于上述实施方式具有其他任意的追加结构,可以置换为发挥同样功能的任意结构,也可以省略一部分结构。
[0133]
实施例
[0134]
以下,列举出实施例及比较例,进一步具体说明本发明,但本发明并不限定于这些实施例。
[0135]
(实施例a1)
[0136]
1.还原剂的制造
[0137]
首先,作为还原剂的前体,分别计量36.12g的硝酸铁(iii)九水合物(富士
フイルム
和光純薬工業株式会社制,纯度:99.9%)和2.58g的硝酸氧锆(ii)二水合物(
キシダ
化学株式会社制,纯度:99.0%)、4.20g硝酸铈(iii)六水合物(sigma aldrich公司制,纯度:99.0%)和0.06g硝酸镁(ii)六水合物(富士
フイルム
和光純薬工業株式会社制,纯度:99.5%)。
[0138]
接着,计量27.42g柠檬酸(富士
フイルム
和光純薬工業株式会社制,纯度:99.5%),溶解于200ml的去离子水中,得到柠檬酸水溶液。然后,一边搅拌一边在65℃下将上述前体(硝酸金属盐)添加到柠檬酸水溶液中。
[0139]
过30分钟后,将3.78g乙二醇(富士
フイルム
和光純薬工業株式会社制,纯度:99.5%)添加到柠檬酸水溶液中,使温度上升到80℃。另外,金属:柠檬酸:乙二醇的摩尔比为1∶1.2∶0.48。
[0140]
在连续搅拌的同时保持80℃的温度,直到形成粘性凝胶。然后,将凝胶转移到干燥炉中。
[0141]
凝胶的干燥在100℃下进行20小时。
[0142]
将生成的有机和无机化合物的膨润了的块状物粉碎,以750℃、4小时、3℃/分钟的速度烧成。
[0143]
最后,将烧成的块状物机械地细细粉碎,得到目标还原剂。另外,还原剂为粒状。
[0144]
2.还原剂的鉴定
[0145]
2-1.比表面积
[0146]
使用brunauer-emmett-teller(bet)分析仪(belsorp mini2)通过氮气的吸附/脱附来测定还原剂的比表面积。
[0147]
2-2.x射线衍射(xrd)
[0148]
晶体学数据由rint-ttriii装置(cukα放射线,50kv,300ma)收集。
[0149]
刚制作出的还原剂显示出对应于fe2o3(33.158、35.618、40.858、49.488、54.098)、mgo(29.24、42.86、51.64,62.38、78.26)和ce
0.5
z r
0.5
oy(29.108、33.708、48.508、57.508)相的衍射峰。
[0150]
fe2o3的衍射图案被明确地确定,而ce
0.5
zr
0.5
oy(y=1~2的实数)不存在ceo2(28.558)的峰,所以能够明确地区分。然而,ce
0.5
zr
0.5
oy的衍射峰与ceo2以外的峰(33.088、47.4778、56.338)紧密重叠。
[0151]
因此,使用xrd数据的相对强度比计算进一步明确了ceo2相不存在。xrd结果表明在ce和zr固溶体中ce的存在。
[0152]
另外,没有确认到zro2的个别衍射峰。
[0153]
由以上可知,得到的还原剂为含有由fe2o3表示的氧载体、担载于该氧载体的由ce
0.5
zr
0.5
oy表示的复合金属氧化物及mgo(碱性氧化物)的结构。
[0154]
另外,相对于还原剂100质量份,将fe、ce和zr的合计量设为50质量份(在以下的实施例a2~a5中相同。)。
[0155]
另外,相对于还原剂100质量份,mgo的量为1质量份(即,还原剂中所含的mgo的量为1质量%)。
[0156]
(实施例a2)
[0157]
除了使还原剂中所含的mgo的量为5质量%以外,与实施例a1同样地制造还原剂。另外,还原剂为粒状。
[0158]
(实施例a3)
[0159]
除了使还原剂中所含的mgo的量为10质量%以外,与实施例a1同样地制造还原剂。另外,还原剂为粒状。
[0160]
(实施例a4)
[0161]
除了将碱性氧化物从mgo变更为li2zro4以外,与实施例a2同样地制造还原剂。另外,还原剂为粒状。
[0162]
(实施例a5)
[0163]
除了将碱性氧化物从mgo变更为li2zro4以外,与实施例a3同样地制造还原剂。另外,还原剂为粒状。
[0164]
(比较例a1)
[0165]
除了变为省略碱性氧化物以外,与实施例a1同样地制造还原剂。另外,还原剂为粒状。
[0166]
(实施例b1~实施例b3及比较例b1)
[0167]
除了省略复合金属氧化物并且作为氧载体从fe2o3变为mgfe
x al
2-x
o4以外,与实施例a1~实施例a3及比较例a1同样地制造还原剂。另外,各还原剂为粒状。
[0168]
(实施例b4~实施例b8)
[0169]
除了将碱性氧化物的种类及还原剂中的量如表1所示那样变更以外,与实施例b1同样地制造还原剂。另外,各还原剂为粒状。
[0170]
(实施例c1和比较例c1)
[0171]
除了省略复合金属氧化物并且作为氧载体从fe2o3变为ceo2以外,与实施例a1和比较例a1同样地制造还原剂。另外,各还原剂为粒状。
[0172]
(实施例c2)
[0173]
除了将碱性氧化物从mgo变为li2o以外,与实施例c1同样地制造还原剂。另外,还原剂为粒状。
[0174]
(实施例d1及比较例d1)
[0175]
除了省略复合金属氧化物并且将氧载体从ceo2变为cezro2以外,与实施例c2和比较例c1同样地制造还原剂。另外,各还原剂为粒状。
[0176]
(实施例e1)
[0177]
除了省略复合金属氧化物,并且将还原剂中含有的碱性氧化物从mgo变为sro、且将其量变为50质量%以外,与实施例a1同样地制造还原剂。另外,还原剂为粒状。
[0178]
(实施例e2)
[0179]
除了使用硝酸钴六水合物(富士
フイルム
和光純薬工業株式会社制,纯度:99.0%)及硝酸铷(富士
フイルム
和光純薬工業株式会社制)代替硝酸锶,使cr2o3和sro(碱性氧化物)各自在还原剂中含有的量为1质量%以外,与实施例e1同样地制造还原剂。另外,还原剂为粒状。
[0180]
(实施例e3)
[0181]
首先,作为还原剂的前体,分别计量8.08g的硝酸铁(iii)九水合物(富士
フイルム
和光純薬工業株式会社制,纯度:99.9%)和1.44g的硝酸锰六水合物(富士
フイルム
和光純薬工業株式会社制,纯度:99.0%)。
[0182]
接着,计量10.51g柠檬酸(富士
フイルム
和光純薬工業株式会社制,纯度:99.5%),溶解于60ml的去离子水中,得到柠檬酸水溶液。然后,一边搅拌一边在65℃下将上述前体(硝酸金属盐)添加到柠檬酸水溶液中。
[0183]
经过30分钟后,将3.41g乙二醇(富士
フイルム
和光純薬工業株式会社制,纯度:99.5%)添加到柠檬酸水溶液中,使温度上升到80℃。
[0184]
在连续搅拌的同时保持80℃的温度,直到形成粘性凝胶。然后,将凝胶转移到干燥炉中。
[0185]
将凝胶在120℃下干燥5小时。
[0186]
将生成的有机和无机化合物的膨润了的块状物粉碎,以450℃、4小时、5℃/分钟的速度烧成后,再以950℃、8小时、5℃/分钟的速度烧成。
[0187]
最后,将烧成的块状物机械地细细粉碎,得到目标还原剂。另外,还原剂为粒状。
[0188]
(比较例e1)
[0189]
用研磨棒将氧化铁(iii)(富士
フイルム
和光純薬工業株式会社制,纯度:95.0%)粉碎10分钟,在700℃下烧成3小时,制造还原剂。另外,还原剂为粒状。
[0190]
(实施例f1)
[0191]
首先,作为还原剂的前体准备了硝酸铬(iii)九水合物(富士
フイルム
和光純薬工業株式会社制,纯度:98.5%)和硝酸锰六水合物(富士
フイルム
和光純薬工業株式会社制,纯度:99.0%)。
[0192]
然后,将该前体溶解于蒸馏水中,制备1mol/l的原料水溶液(a液)。
[0193]
另外,将碳酸钠溶解于蒸馏水中,调制1mol/l的碳酸钠水溶液(b液)。
[0194]
接着,将a液和b液同时滴加到装有70℃蒸馏水20ml的容器中,制成混合液。另外,a液的滴加速度为10ml/分,搅拌混合液以使生成的沉淀物不凝聚。
[0195]
另外,将混合液的温度维持在70℃,同时调节b液的滴加速度,使ph为7.0。
[0196]
然后,将混合液在维持在70℃的同时继续搅拌,进行3小时熟化。熟化结束后,通过过滤回收沉淀物,充分水洗。
[0197]
接着,利用干燥机将回收得到的沉淀物在120℃下干燥12小时,然后在700℃下烧成3小时,得到还原剂。另外,还原剂为粒状。另外,mno2(碱性氧化物)在还原剂中含量为50质量%。
[0198]
(比较例f1)
[0199]
除了变为省略碱性氧化物以外,与实施例f1同样地制造还原剂。另外,还原剂为粒状。
[0200]
3.还原剂的特性评价(转换效率)
[0201]
3-1.a~d系还原剂的特性评价
[0202]
使用具有微反应器和与微反应器直接连接的气相色谱质谱仪(gc/ms)的快速催化剂评价系统(
フロンティア
·
ラボ
株式会社制造、「
シングル
μ-
リアクター
rx-3050sr」),按照以下步骤评价还原剂的特性。
[0203]
首先,在内径3mm、长度78mm的石英反应管内填充0.2g的还原剂。然后,在以20ml/min的流量流通氦气的同时,以40℃/min的升温速度升温到650℃,加热20分钟。
[0204]
然后,在微反应器中,以30ml/min的流量流通氢气(还原气体)20分钟,进行还原剂的还原反应(第一步骤),还原剂被还原。此时,从微反应器的排出口排出的气体中含有水蒸气。
[0205]
然后,为了气体交换,将氦气以20ml/min的流量流通10分钟,再将二氧化碳气体以3ml/min的流量流通20分钟,实施二氧化碳的还原反应(第二步骤),还原二氧化碳气体(原料气体)。此时,从反应器的排出口排出的生成气体中含有一氧化碳。
[0206]
然后,将氦气以20ml/min的流量流通10分钟以进行气体交换。
[0207]
另外,在正式试验中,将微反应器的温度维持在650℃或550℃,并且在大气压条件下进行。
[0208]
3-2.e~f系还原剂的特性评价
[0209]
使用具有微反应器和与微反应器直接连接的气相色谱质谱仪(gc/ms)的快速催化剂评价系统(
フロンティア
·
ラボ
株式会社制造、「
シングル
μ-
リアクター
rx-3050sr」),按照以下步骤评价还原剂的特性。
[0210]
首先,在用微反应器进行氧载体的特性评价时,为了使还原剂活化,进行以下的步骤。在内径3mm、长度78mm的石英制的反应管内填充0.2g的氧载体。然后,在以20ml/分钟的流量流通氦气的同时,以40℃/分钟的升温速度升温,加热20分钟。
[0211]
接下来,将氢气(还原气体)以5ml/分钟的流速在微反应器的反应管中流通5分钟,进行氧载体的还原反应(第一步骤),还原剂被还原。此时,从微反应器的排出口排出的气体中含有水蒸气。
[0212]
然后,为了气体交换,将氦气以20ml/min的流量流通5分钟,再将二氧化碳气体以
5ml/min的流量流通5分钟,实施二氧化碳的还原反应(第二步骤),还原二氧化碳气体(原料气体)。此时,从微反应器的排出口排出的生成气体中含有一氧化碳。
[0213]
然后,将氦气以20ml/分钟的流速流通5分钟以进行气体交换。
[0214]
接着,为了正式试验,进行了以下的步骤。将氢气(还原气体)以15ml/分钟的流速在微反应器的反应管中流通5分钟,进行还原剂的还原反应(第一步骤),还原氧载体。此时,从微反应器的排出口排出的气体中含有水蒸气。
[0215]
然后,为了气体交换,将氦气以20ml/min的流量流通5分钟,再将二氧化碳气体以5ml/min的流量流通5分钟,实施二氧化碳的还原反应(第二步骤),还原二氧化碳气体(原料气体)。此时,从微反应器的排出口排出的生成气体中含有一氧化碳。
[0216]
另外,在以上的步骤中,在使任何气体流通时,都将还原剂的温度维持在650℃,并且在大气压条件下进行操作。
[0217]
通过下式计算利用还原剂将二氧化碳转化为一氧化碳的效率。
[0218]
另外,转换效率是二氧化碳气体向石英反应管内流通开始后1分钟内的平均转换效率。
[0219]
x
co
(%)=n
co,出
/(n
co2,进
)
×
100
[0220]
在上述式中,n是原料气体或生成气体中的二氧化碳或一氧化碳的摩尔分数。
[0221]
另外,由于反应的选择性为100%,所以总n
co2
=n
co2,进
n
co,出
。
[0222]
另外,在表1中,将各实施例a1~a5的还原剂的x
co
的值表示为将比较例a1的还原剂的x
co
的值设为“1”时的相对值(x
co,r
),将各实施例b1~b8的还原剂的x
co
的值表示为将比较例b1的还原剂的x
co
的值设为“1”时的相对值(x
co,r
),将各实施例c1~c2的还原剂的x
co
的值表示为将比较例c1的还原剂的x
co
的值设为“1”时的相对值(x
co,r
),将实施例d1的还原剂的x
co
的值表示为将比较例d1的还原剂的x
co
的值设为“1”时的相对值(x
co,r
)。另外,将各实施例e1~e3的还原剂的x
co
的值表示为将比较例e1的还原剂的x
co
的值设为“1”时的相对值(x
co,r
),将实施例f1的还原剂的x
co
的值表示为将比较例f1的还原剂的x
co
的值设为“1”时的相对值(x
co,r
)。
[0223]
另外,气相色谱质谱仪中的测定条件如下。
[0224]
色谱柱温度:200℃
[0225]
注入温度:200℃
[0226]
检测器温度:250℃
[0227]
色谱柱:ega管(l:2.5m,φ(内径):0.15mm、t:0mm)
[0228]
色谱柱流量:1.00ml/min
[0229]
分流比:250
[0230]
净化流量(purge flow rate):3.0ml/min
[0231]
将这些结果示于下表1和表2中。
[0232]
[0233][0234]
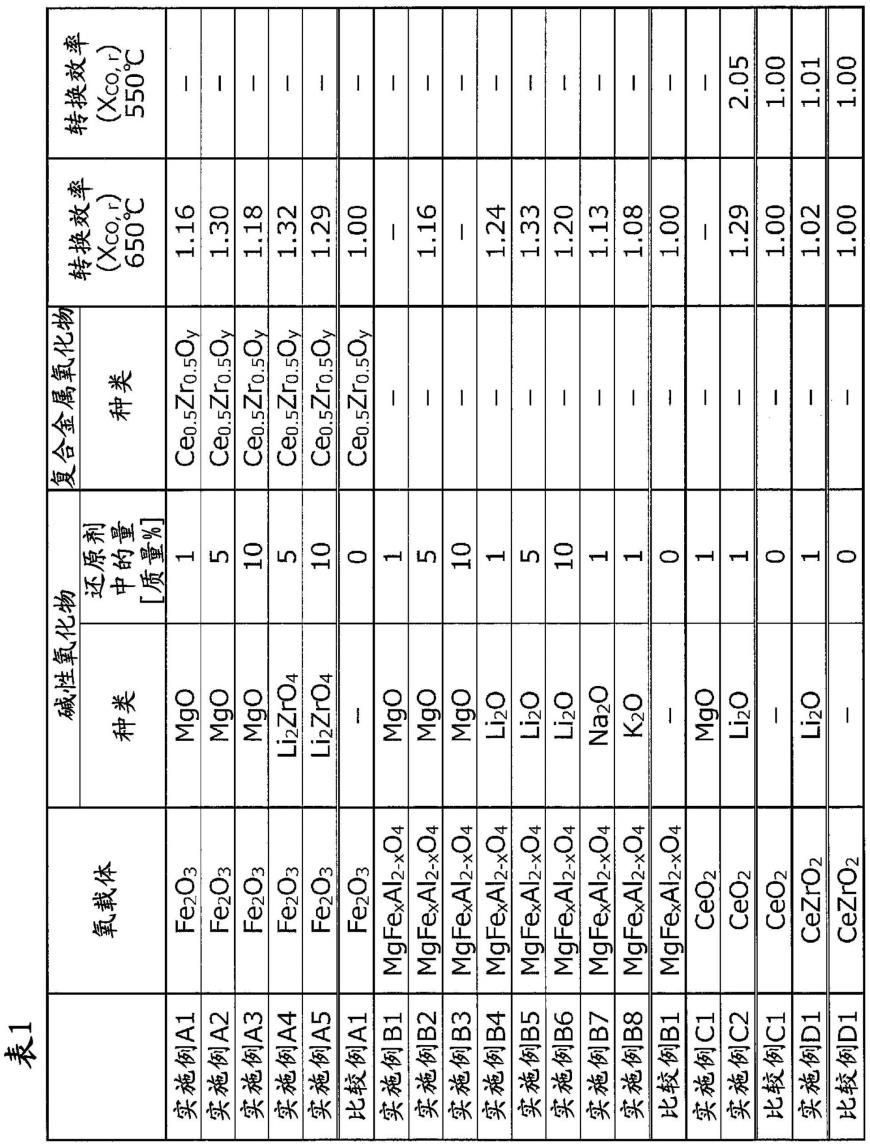
各实施例的还原剂的将二氧化碳向一氧化碳转换的效率高。另外,通过改变碱性氧化物的种类和量,可以调整二氧化碳向一氧化碳转换的效率。
[0235]
与此相对,各比较例的还原剂的将二氧化碳向一氧化碳转换的效率低。另外,关于650℃下的xco的值,比较例b1为比较例a1的约1倍,比较例c1为比较例a1的约1.15倍,比较例d1为比较例a1的约1.39倍。另外,关于650℃下的xco的值,比较例e1为比较例f1的约2.16倍。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。