一种含有5-溴代汉防己甲素甲酸乙酯与parp-1抑制剂的药物组合物
技术领域
1.本发明属于医药技术领域,具体涉及一种含有5-溴代汉防己甲素甲酸乙酯(w17)与聚腺苷二磷酸核糖聚合酶-1(parp-1)抑制剂的药物组合物,及其用于治疗耐药性卵巢癌药物中的用途,特别是5-溴代汉防己甲素甲酸乙酯(w17)与奥拉帕尼(olaparib)、和尼拉帕尼(niraparib)的药物组合物,及其在制备治疗耐药性卵巢癌药物中的用途。
背景技术:
2.恶性肿瘤是当前所有疾病中致死率最高的疾病。2018年全球新增29.5万例卵巢癌患者,18.5万人因卵巢癌死亡,其发病率及死亡率在女性所有癌症中排名第八,是女性三大常见的癌症类型之一(bray f等,ca cancer j clin,2018,68:394-424.)。
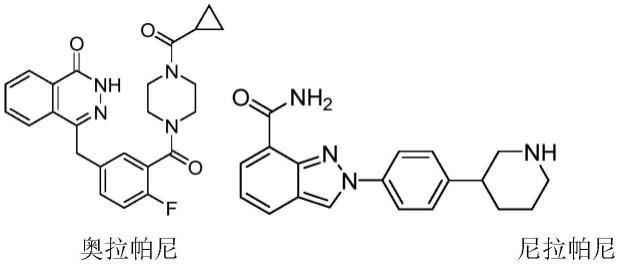
3.在抑癌基因brca突变的卵巢癌中,其同源重组修复功能出现损害,肿瘤细胞的dna双链断裂修复功能受损,故dna修复途径将依赖于聚腺苷二磷酸核糖聚合酶-1(parp-1)介导dna单链断裂的修复以维持dna的存活。因此,parp-1抑制剂与brca基因突变同时作用可使dna损伤进一步加重,以致细胞dna不能被重组修复而死亡,这种效应即为“合成致死”效应。奥拉帕尼(olaparib)、鲁卡帕尼(rucaparib)、尼拉帕尼(niraparib)、他拉唑帕尼(talazoparib)或氟唑帕尼(fluzoparib)等parp-1抑制剂正是通过协同致死效应发挥作用的新型靶向抗卵巢癌药物。目前已有多个parp-1抑制剂被批准上市或处于临床研究。奥拉帕尼(结构式如下)由astrazeneca公司研发,于2014年由fda批准上市,是第一款批准上市的口服parp-1抑制剂,也是首个获准用于brca突变卵巢癌一线维持治疗的parp-1抑制剂。尼拉帕尼(结构式如下)由merck sharp&dohme与tesaro共同研发,于2017年被fda批准上市,是首个无需brca突变或其他生物标志物检测,即可用的parp-1抑制剂,适用人群更为广泛。然而,随着奥拉帕尼、尼拉帕尼等在临床中的广泛应用,部分卵巢癌患者由于众多机制因素,如brcal/2的二次突变等而对parp-1抑制剂的治疗存在耐药性,严重影响了其在临床上的长期使用和疗效。
[0004][0005]
双苄基异喹啉生物碱汉防己甲素(tetrandrine)是防己科汉防己根部的主要活性成分(结构式如下),临床用于治疗风湿痛、关节痛、神经痛及恶性肿瘤和煤硅肺等。研究显示,汉防己甲素及其衍生物可通过多种机制增强化疗药物对耐药肿瘤的敏感性(wang g等,life sci,1995,56(5):295-06;liu xd等,cancer lett,2010,292(1):24-31;wei n等,
cancer chemother pharmacol,2011,67(5):1017-25.)。本发明人对汉防己甲素的结构进行修饰获得新型汉防己甲素衍生物5-溴代汉防己甲素甲酸乙酯(w17,结构式如下所示),初步研究显示w17与parp-1抑制剂联合使用具有优异的体外肿瘤多药耐药逆转活性和协同增敏作用。
[0006]
技术实现要素:
[0007]
本发明的目的在于提供一种5-溴代汉防己甲素甲酸乙酯(w17)和聚腺苷二磷酸核糖聚合酶-1(parp-1)抑制剂联合用药或组成药物组合物治疗肿瘤的用途,尤其是具有耐药性的肿瘤。显示出具有优异的体外肿瘤多药耐药逆转活性和协同增敏作用。
[0008]
为实现本发明的目的,提供如下实施方案。
[0009]
本发明的一种抗肿瘤药物组合物,其特征在于:包含5-溴代汉防己甲素甲酸乙酯(w17)和聚腺苷二磷酸核糖聚合酶-1(parp-1)抑制剂。
[0010]
优选的,上述本发明的药物组合物,所述聚腺苷二磷酸核糖聚合酶-1(parp-1)抑制剂选自奥拉帕尼、鲁卡帕尼、尼拉帕尼、他拉唑帕尼和氟唑帕利,更优选为奥拉帕尼或尼拉帕尼。
[0011]
优选的,上述本发明的药物组合物,5-溴代汉防己甲素甲酸乙酯与奥拉帕尼或尼拉帕尼的摩尔比为(0.50~3.0):(10~100)。
[0012]
优选的,上述本发明的药物组合物,所述肿瘤为卵巢癌,优选为耐药性卵巢癌。
[0013]
在一些具体实施方案中,上述本发明的药物组合物,还包括药学上可接受的药用辅料,其制剂形式为口服片剂、颗粒剂、胶囊或注射剂。
[0014]
在另一实施方案中,提供了5-溴代汉防己甲素甲酸乙酯(w17)在制备治疗耐药性肿瘤药物中的用途,所述用途包括将w17与奥拉帕尼、鲁卡帕尼、尼拉帕尼、他拉唑帕尼和氟唑帕尼联合用药或组成固定剂量的药物组合物。
[0015]
优选的,上述本发明的用途,所述耐药性肿瘤为耐药性卵巢癌。
[0016]
优选的,上述本发明的用途,所述用途包括将w17与奥拉帕尼或尼拉帕尼联合用药或组成固定剂量的药物组合物。
[0017]
本发明人发现5-溴代汉防己甲素甲酸乙酯(在本文中的代号也称为“w17”)在低浓度如0.50μm~3.0μm单独使用时无抗肿瘤活性,但是经过进一步的深入研究评价,意外的发现w17化合物可通过抑制药物外排蛋白pgp、影响肿瘤凋亡和存活增殖信号通路,在与腺苷二磷酸核糖聚合酶-1(parp-1)抑制剂,如奥拉帕尼、尼拉帕尼(10μm~100μm)联用时,能显著增强其抗肿瘤活性。
[0018]
上述本发明的药物组合物或用途,所述parp-1抑制剂选自奥拉帕尼(olaparib)、
鲁卡帕尼(rucaparib)、尼拉帕尼(niraparib)、他拉唑帕尼(talazoparib)或氟唑帕尼(fluzoparib)等。
[0019]
上述本发明的药物组合物,其中5-溴代汉防己甲素甲酸乙酯(w17)与parp-1抑制剂的摩尔比为(0.50~3.0):(10~100)。
[0020]
上述本发明的药物组合物,其制剂形式为口服片剂、颗粒剂、胶囊、注射剂。
[0021]
上述本发明的药物组合物,还包括药学上可接受的药用辅料。
[0022]
上述本发明的药物组合物,所述药用辅料为本领域常用辅料,填充剂如磷酸氢钙、淀粉、微晶纤维素、乙基纤维素、甘露醇、乳糖等,崩解剂如预胶化淀粉、羧甲基淀粉钠、交联羧甲基纤维素钠、交联聚维酮,粘合剂如低取代羟丙纤维素、乙醇、水、聚维酮等,润滑剂如滑石粉、硬脂酸镁等。
[0023]
本发明还提供一种5-溴代汉防己甲素甲酸乙酯(w17)和parp-1抑制剂在制备治疗耐药性卵巢癌药物中的用途,所述parp-1抑制剂,优选地,为选自奥拉帕尼、尼拉帕尼。
[0024]
本发明提供的5-溴代汉防己甲素甲酸乙酯(w17)和parp-1抑制剂,如奥拉帕尼、尼拉帕尼联合使用时,产生了明显的协同增敏作用,显著增强了parp-1抑制剂的抗肿瘤活性,特别是对耐药性卵巢癌细胞的协同增敏作用最突出。
具体实施方式
[0025]
以下实施例用于进一步理解本发明的协同增效作用效果,但不应以此限制本发明的范围。
[0026]
实施例1
[0027]
w17联用奥拉帕尼对内在耐药卵巢癌ovcar5细胞抗增殖活性的协同增敏作用。
[0028]
mtt法检测奥拉帕尼单用或联用w17对内在耐药的卵巢癌ovcar5细胞抗增殖作用的影响。
[0029]
mtt法检测奥拉帕尼单独或联用w17对内在耐药的卵巢癌ovcar5细胞的抗增殖活性:3000个/孔的对数生长期的ovcar5细胞接种于96孔培养板内,过夜培养贴壁后,加入梯度浓度的奥拉帕尼(10~100μm)、或w17(0.50~3.0μm)、或两药联合,每个药物浓度设3平行孔。继续培养72h后,弃除培养液,每孔加入0.5mg/ml mtt 100μl(无血清的rpmi1640培养液溶解),继续培养4h后,弃除mtt,每孔加入dmso 150μl,混和振荡5min,570nm波长处测定吸光度值,用如下公式计算抗增殖活性(抑制率):抑制率(%)=(1-药物处理细胞的od值均值/对照细胞od值均值)
×
100%,三次独立实验结果以均值
±
sd表示,*p《0.05,**p《0.01vs.奥拉帕尼(10μm);
#
p《0.05,
##
p《0.01vs.奥拉帕尼(25μm);
△
p《0.05,
△△
p《0.01vs.奥拉帕尼(50μm);
▽
p《0.05vs.奥拉帕尼(100μm)。
[0030]
结果如表1结果所示,奥拉帕尼(10~100μm)单独作用时对ovcar5细胞的抗增殖作用活性较差,而与低浓度w17(0.50~3.0μm)联用后,对ovcar5细胞的抗增殖活性明显增强,具有显著的协同增效的作用。
[0031]
表1.w17与奥拉帕尼联用对内在耐药卵巢癌ovcar5细胞抗增殖活性的影响
[0032][0033]
实施例2
[0034]
w17联用尼拉帕尼对内在耐药卵巢癌ovcar5细胞抗增殖活性的协同增敏作用。
[0035]
mtt法检测尼拉帕尼单用或联用w17对内在耐药的卵巢癌ovcar5细胞抗增殖作用的影响,如表2结果所示,尼拉帕尼(10~100μm)单独作用时对ovcar5细胞的抗增殖活性较差,而与低浓度w17(0.50~3.0μm)联用后,对ovcar5细胞的抗增殖活性明显增强,具有显著的协同增效的作用。
[0036]
表2.w17与尼拉帕尼联用对内在耐药卵巢癌ovcar5细胞抗增殖活性的影响
[0037][0038]
注:mtt法检测尼拉帕尼单独或联用w17对内在耐药的卵巢癌ovcar5细胞的抗增殖活性(同实施例1),表2中,**p《0.01vs.尼拉帕尼(10μm);
#
p《0.05,
##
p《0.01vs.尼拉帕尼(25μm);
△
p《0.05vs.尼拉帕尼(50μm);
▽
p《0.05vs.尼拉帕尼(100μm)。
[0039]
实施例3
[0040]
w17联用奥拉帕尼对获得性耐药卵巢癌a2780/r细胞抗增殖活性的协同增敏作用。
[0041]
mtt法检测奥拉帕尼单独或联用w17对获得性耐药卵巢癌a2780/r细胞的抗增殖活性:5000个/孔的对数生长期的a2780/r细胞接种于96孔培养板内,过夜培养贴壁后,加入梯度浓度的奥拉帕尼(10~100μm)、或w17(0.50~3.0μm)、或两药联合,每个药物浓度设3平行孔。继续培养72h后,弃除培养液,每孔加入0.5mg/ml mtt 100μl(无血清的rpmi1640培养液溶解),继续培养4h后,弃除mtt,每孔加入dmso 150μl,混和振荡5min,570nm波长处测定吸光度值,用如下公式计算抗增殖活性(抑制率):抑制率(%)=(1-药物处理细胞的od值均值/对照细胞od值均值)
×
100%,三次独立实验结果以均值
±
sd表示,*p《0.05,**p《0.01vs.奥拉帕尼(10μm);
#
p《0.05,
##
p《0.01vs.奥拉帕尼(25μm);
△
p《0.05,
△△
p《0.01vs.奥拉帕尼(50μm);
▽
p《0.05vs.奥拉帕尼(100μm)。
[0042]
mtt法检测奥拉帕尼单用或联用w17对获得性耐药的卵巢癌a2780/r细胞抗增殖活
性的影响,结果如表3所示,奥拉帕尼(10~100μm)单独作用时对a2780/r细胞的抗增殖活性较差,而与低浓度w17(0.50~3.0μm)联用后,对a2780/r细胞的抗增殖活性明显增强,具有显著的协同增效的作用。
[0043]
表3.w17联用奥拉帕尼对获得性耐药卵巢癌a2780/r细胞的抗增殖活性的影响
[0044][0045]
实施例4
[0046]
w17联用尼拉帕尼对获得性耐药卵巢癌a2780/r细胞抗增殖活性的协同增敏作用。
[0047]
mtt法检测尼拉帕尼单用或联用w17对获得性耐药的卵巢癌a2780/r细胞抗增殖作用的影响,如表4所示,尼拉帕尼(10~100μm)单独作用时对a2780/r细胞的抗增殖活性较差,而与低浓度w17(0.50~3.0μm)联用后,对a2780/r细胞的抗增殖活性明显增强,具有显著的协同增效的作用。
[0048]
表4.w17联用尼拉帕尼对获得性耐药卵巢癌a2780/r细胞的抗增殖活性的影响
[0049][0050]
注:mtt法检测尼拉帕尼单独或联用w17对获得性耐药卵巢癌a2780/r细胞的抗增殖活性(同实施例3):表4中,*p《0.05,**p《0.01vs.尼拉帕尼(10μm);
#
p《0.05,
##
p《0.01vs.尼拉帕尼(25μm);
△
p《0.05vs.尼拉帕尼(50μm);
▽
p《0.05vs.尼拉帕尼(100μm)。
[0051]
实施例5
[0052]
w17与奥拉帕尼联用对内在耐药卵巢癌ovcar5细胞单细胞增殖、克隆能力的协同抑制作用。
[0053]
集落形成实验检测奥拉帕尼单用或联用w17对内在耐药卵巢癌ovcar5细胞单细胞增殖、克隆能力的影响:对指数生长期ovcar5细胞悬液倍比稀释,按照每皿含200个细胞的浓度分别接种5ml细胞悬液到培养皿(直径60mm)中,十字方向轻轻晃动培养皿,使细胞分散均匀。培养皿置37℃、5%co2培养24h细胞贴壁后,加入梯度浓度奥拉帕尼(10~100μm)、或w17(0.50~3.0μm)、或两药联合,再培养2~3周,弃去培养液,pbs液小心浸洗2次,空气干燥。甲醇固定15min,弃甲醇后空气干燥。用giemsa染液染色10min,流水缓慢洗去染液,空气
干燥。显微镜下计数大于50个细胞克隆数,按下式计算集落形成率:集落形成率(%)=(集落数/接种细胞数)
×
100%,三次独立实验结果以均值
±
sd表示,*p《0.05,**p《0.01vs.奥拉帕尼(10μm);
#
p《0.05,
##
p《0.01vs.奥拉帕尼(25μm);
△
p《0.05,
△△
p《0.01vs.奥拉帕尼(50μm);
▽
p《0.05,
▽▽
p《0.01vs.奥拉帕尼(100μm)。
[0054]
集落形成实验检测奥拉帕尼单用或联用w17对内在耐药卵巢癌ovcar5细胞单细胞增殖、克隆能力的影响,结果如表5所示,低浓度w17(0.50~3.0μm)单独作用对ovcar5细胞单细胞增殖、克隆能力(集落形成率%)无明显影响,但与奥拉帕尼(10~100μm)联用后显著增强其对ovcar5细胞集落形成的抑制作用,具有协同增效的作用。
[0055]
表5.w17与奥拉帕尼联用对ovcar5细胞集落形成率(%)的影响
[0056][0057]
实施例6
[0058]
w17与尼拉帕尼联用对内在耐药卵巢癌ovcar5细胞单细胞增殖、克隆能力的协同抑制作用。
[0059]
集落形成实验检测尼拉帕尼单用或联用w17对内在耐药卵巢癌ovcar5细胞单细胞增殖、克隆能力的影响,实验方法同实施例5,结果如表6所示,低浓度w17(0.50~3.0μm)单独作用对ovcar5细胞单细胞增殖、克隆能力(集落形成率%)无明显影响,但与尼拉帕尼(10~100μm)联用后显著增强其对ovcar5细胞集落形成的抑制作用,具有协同增效的作用。表6中,*p《0.05,**p《0.01vs.尼拉帕尼(10μm);
#
p《0.05,
##
p《0.01vs.尼拉帕尼(25μm);
△
p《0.05,
△△
p《0.01vs.尼拉帕尼(50μm);
▽
p《0.05,
▽▽
p《0.01vs.尼拉帕尼(100μm)。
[0060]
表6.w17与尼拉帕尼联用对ovcar5细胞集落形成率(%)的影响
[0061][0062]
实施例7
[0063]
w17与奥拉帕尼联用对获得性耐药卵巢癌a2780/r细胞单细胞增殖、克隆能力的协同抑制作用。
[0064]
集落形成实验检测奥拉帕尼单用或联用w17对获得性耐药卵巢癌a2780/r细胞单
细胞增殖、克隆能力的影响,方法同实施例5,结果如表7所示,低浓度w17(0.50~3.0μm)单独作用对a2780/r细胞单细胞增殖、克隆能力(集落形成率%)无明显影响,但与奥拉帕尼(10~100μm)联用后显著增强其对a2780/r细胞集落形成的抑制作用,具有协同增效的作用。表7中,*p《0.05,**p《0.01vs.奥拉帕尼(10μm);
#
p《0.05,
##
p《0.01vs.奥拉帕尼(25μm);
△
p《0.05,
△△
p《0.01vs.奥拉帕尼(50μm);
▽
p《0.05,
▽▽
p《0.01vs.奥拉帕尼(100μm)。
[0065]
表7.w17与奥拉帕尼联用对a2780/r细胞集落形成率(%)的影响
[0066][0067]
实施例8
[0068]
w17与尼拉帕尼联用对获得性耐药卵巢癌a2780/r细胞单细胞增殖、克隆能力的协同抑制作用。
[0069]
集落形成实验检测尼拉帕尼单用或联用w17对获得性耐药卵巢癌a2780/r细胞单细胞增殖、克隆能力的影响,实验方法同实施例5,结果如表5所示,低浓度w17(0.50~3.0μm)单独作用对a2780/r细胞单细胞增殖、克隆能力(集落形成率%)无明显影响,但与尼拉帕尼(10~100μm)联用后显著增强其对a2780/r细胞集落形成的抑制作用,具有协同增效的作用。表8中,*p《0.05,**p《0.01vs.尼拉帕尼(10μm);
#
p《0.05,
##
p《0.01vs.尼拉帕尼(25μm);
△
p《0.05,
△△
p《0.01vs.尼拉帕尼(50μm);
▽
p《0.05,
▽▽
p《0.01vs.尼拉帕尼(100μm)。
[0070]
表8.w17与尼拉帕尼联用对a2780/r细胞集落形成率(%)的影响
[0071]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。