一种调控水稻抗性的受体激酶基因osifbr1
技术领域
1.本发明涉及分子生物技术领域,尤其涉及一种调控水稻抗性的受体激酶基因osifbr1。
背景技术:
2.水稻是我国最重要的粮食作物之一,水稻的高产稳产对保障经济发展和社会稳定具有重要意义。白叶枯病是由黄单胞杆菌水稻致病变种(xanthomonas oryzae pv.oryzae)引起的细菌性枯萎病,是世界上对水稻危害最大的一种细菌性病害,一般可致水稻减产20%-30%左右,严重可达50%,发病范围遍及世界各稻区,在亚洲地区尤为严重,在我国华南稻区危害较为严重。稻瘟病是由稻梨孢病菌(pyricularia oryzae)引起的真菌性病害,可引发大幅度减产,严重时减产40%~50%,甚至颗粒无收。该病为通过气流传播的流行病,对水稻生产威胁极大,危害程度因品种、栽培技术以及气候条件不同有差别,世界各稻区均有发生,其中以叶部、节部发生为多,发生后可造成不同程度减产,尤其穗颈瘟或节瘟发生早而重,可造成白穗以致绝产。目前在农业生产中,防治这两种病害的主要手段是利用抗病品种,然而病原菌毒性的变异,经常造成品种抗性的丧失。因此,培育广谱的抗病品种迫在眉睫。近年来转基因技术因其周期短、效率高而被广泛应用于水稻育种,挖掘水稻稻瘟病和白叶枯病的抗性相关基因,利用转基因育种技术改变抗性相关基因表达,对稻瘟病和白叶枯病的种质资源创制和有效防控具有重要意义。
3.类受体激酶(receptor-like kinases,rlks)是植物中广泛存在的一类跨膜蛋白激酶,影响植物的生长发育、种子萌发、光形态建成,以及对生物胁迫和非生物胁迫的响应。一般rlks由胞内区(cytoplasmic domain,cd)、跨膜区(transmembrane domain,tm)和胞外区(extracellular domain)三部分组成。往往通过细胞外结构域识别病原物的相关分子模式,激活下游免疫反应,例如活性氧(reactive oxygen species,ros)爆发,病程相关基因(pathogenesis-related gene,pr)表达增强等,来抵御病原物的侵染。水稻基因组中编码rlks的基因高达1131个,大部分rlks的功能尚不清楚,其中osifbr1的编码基因与水稻稻瘟病和白叶枯病抗性之间的关系尚未见报道。
技术实现要素:
4.针对现有技术中的上述不足,本发明的目的在于提供osifbr1基因及编码蛋白在调控水稻稻瘟病和白叶枯病抗性中的应用,敲除所述osifbr1基因表达得到的突变体更易感病,通过表达所述osifbr1基因得到的转基因植株更抗病,因此所述osifbr1基因可正向调控水稻对稻瘟病和白叶枯病的抗性。
5.为了达到上述发明目的,本发明采用的具体方案为:
6.一种调控水稻抗性的受体激酶基因osifbr1,由1019个氨基酸组成,其氨基酸序列如seq id no.1;
7.由3060个核苷酸组成,其核苷酸序列如seq id no.2;
8.所述基因osifbr1和所述类受体激酶osifbr1在抗病性中的应用;
9.通过转基因方法在植物中过量表达所述基因。
10.作为改进,通过表达所述基因osifbr1的方法包括利用非特异性启动子35s表达osifbr1基因的cdna序列。
11.作为改进,所述植物为水稻。
12.作为改进,所述抗病性指抗稻瘟病菌和白叶枯菌引起的植物病害。
13.作为改进,调控水稻抗性的受体激酶基因osifbr1在调控水稻对稻瘟病和白叶枯病抗性中的应用,利用crispr/cas9基因编辑技术敲除水稻中osifbr1基因,获得的突变体植株osifbr1;
14.所述crispr/cas9系统包括1个敲除osifbr1基因的sgrna;
15.osac37基因的敲除靶点优选为:靶点(target)核苷酸序列为:gtcaatgatttgatagacgg(seq id no.3,最后三个碱基为pam位点)。
16.本发明的有益效果为:
17.本发明提供了osifbr1基因在调控水稻对稻瘟病和白叶枯病抗性中的应用,通过crispr/cas9技术敲除所述基因osifbr1,获得敲除突变体osifbr1;通过稻瘟病和白叶枯病抗性鉴定发现,与野生型水稻相比,osifbr1突变体水稻更感病;通过非特异性启动子35s表达osifbr1的cdna序列获得过表达植株,通过稻瘟病和白叶枯病抗性鉴定发现,与野生型相比,osifbr1过表达(osifbr1ox)转基因水稻更抗病,表明osifbr1正向调控水稻对稻瘟病和白叶枯病的抗性;osifbr1过表达(osifbr1ox)转基因植株对稻瘟病和白叶枯病表现为抗性,可推广实际应用;本发明有利于水稻广谱抗病品种的培育,为后期筛选高抗水稻品种提供依据。
附图说明
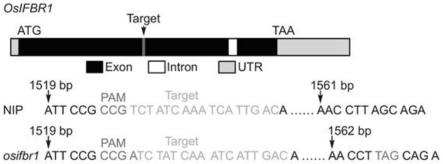
18.图1为利用crispr/cas9基因编辑技术在水稻日本晴(nip)背景中敲除所述基因osifbr1,制备osifbr1突变体。
19.图2为osifbr1突变体对稻瘟病的抗性分析,其中a表示野生型日本晴(nip)和osifbr1突变体接种稻瘟病菌后的表型;b表示野生型日本晴(nip)和osifbr1突变体接种稻瘟病菌后,叶片中稻瘟病菌的菌量检测结果。
20.图3为osifbr1突变体对白叶枯病的抗性分析,其中a表示野生型日本晴(nip)和osifbr1突变体接种白叶枯病菌后的表型;b表示野生型日本晴(nip)和osifbr1突变体接种白叶枯病菌后的病斑长度测量结果。
21.图4为过表达转基因植株osifbr1ox的制备,其中a表示过表达osifbr1基因的载体结构;b表示野生型日本晴(nip)和过表达转基因植株osifbr1ox中osifbr1表达水平检测结果。
具体实施方式
22.下面结合附图来进一步说明发明的具体实施方式,但本发明不仅仅限于以下实施例。在本发明的范围内或者在不脱离本发明的内容、精神和范围内,对本发明进行的变更、组合或替换,对于本领域的技术人员来说是显而易见的,且包含在本发明的范围之内。
23.一种调控水稻抗性的受体激酶基因osifbr1,由1019个氨基酸组成,其氨基酸序列如seq id no.1(mavynililflllllfslstaqpsadeqklllaikqdwdnpaplsswsstgnwtgvissstgqvtglslpslhiarpipasvcslknltyidlscnnltgdfptvlygcsalefldlsnnqlsgrlpdridrlslgmqhlnlssnaftgdvpsaiarfsklkslvldtnrfngnypgaaigglveletltlasnpfepgpvpkefgkltklkmlwlswmnltgtipddlsslmeltlldlsqnkmqgqipewvlkhqklenlylyasnlsgeigpnitalnlqeldlsmnkfsgsipedianlkklrllylyynnltgpipagvgmmpdltdirlfnnklsgplpaelgkhselgnfevsnnnlsgelpdtlcfnkklfdivvfnnsfsgvfptnlgdcktinnimaynnhfvgdfpkkiwsfelltnvmiynnnftgtlpseisfnisriemennrfsgalpstavglksftaennqfsgelpadmsrlanltelnlagnqlsgsippsiksltsltslnlsrnqisgeipaavgwmglyildlsdngltgdipqdfsnlhlnflnlssnqlsgevpetlqngaydrsflgnhglcatvntnmnlpacphqshnksstnliivfsvltgvvfigavaiwlliirhqkrqqdlagwkmtpfrtlhfsecdvlgnlheenvigsggsgkvyriniggkgsdgmvvavkrlwrtaaksdaksdkefdaevrilgevshiniidllccisgddtkllvyeymengsldrwlhrrddggaptaplqwptrlciaidaarglsymhhecaqpimhrdvkssnilldpafrakiadfglarilaksgepnsisaiggtfgymapeygcrakvnekvdvyafgvvllelttgrvandggadwclaewawrrykaggelhdvvdeaiqdraafledavavfllgmictgddpasrptmkevleqlvqydrtssvaaacrddsggapslskgkkdgkgksssagttagkmwgagtgdeesgsfvahpv)所示;
24.由3060个核苷酸组成,其核苷酸序列如seq id no.2(atggctgtctacaacatcctcatcctctttctactactattgctcttctctctatcgactgcgcagcccagcgccgacgagcaaaaactactcctagcaatcaagcaagattgggacaacccagctccactcagttcatggagcagcaccggcaactggactggtgttatcagtagcagcacaggtcaggtcactggcctctccttgccaagtctccatatagccagaccaatcccagcctccgtttgtagcctcaagaatctgacctacatagacctctcttgcaacaatctcaccggtgatttccccacggtgctctacggttgctcagctttggagttccttgacctatccaacaatcaattatccggcagacttccggaccgcattgacaggctatcgttggggatgcaacacctcaacctgtccagcaatgctttcaccggcgatgtgccgtcggctattgcaaggttctcgaagctcaagtcattggtccttgacactaatagattcaatgggaattacccgggtgccgccattggaggccttgtggagcttgagacgctgacgttggcatccaacccattcgagccgggtccagtcccaaaggagtttggcaagctgacaaagctgaaaatgctgtggctgtcatggatgaaccttactgggaccatccctgatgatctgtcgtcattgatggagctcacattgttggacttgtcacaaaataagatgcagggacaaatccccgagtgggtattgaagcaccagaagctcgagaatctatatctctatgcaagcaatttgagtggcgagattggtcctaacatcacagctctcaacctgcaggagcttgacctgtccatgaacaagttctctggatcaataccagaggacattgcaaacttgaagaagttgagattactatatttgtactacaacaatctcactggacccatcccggctggtgttggtatgatgccggacctcaccgacatccgtctcttcaataacaagctctctgggcccctacccgcggagcttggaaaacattcagaattggggaattttgaggtgtccaacaacaacctctctggtgagctaccggatacactttgcttcaataagaagctctttgacattgtggtgttcaacaatagcttctccggcgtgttcccgacgaaccttggggattgcaaaaccatcaacaacatcatggcatacaacaaccactttgttggggactttcccaagaagatatggtcattcgagttgctcaccaatgtcatgatttacaacaacaacttcaccggcactctacccagtgagatatcatttaacatctcgaggattgagatggagaacaatcgcttctccggtgccctcccgtcgaccgccgtcggtctgaagagtttcacggcggagaacaaccagttctccggtgaactgccagctgacatgtctaggcttgccaacctcaccgagttgaacctcgccggcaaccagttatccggctcgattccgccgtctatcaaatcattgacaagtctgacctccctcaaccttagcagaaaccagatttccggtgagatccctgccgcagtcgggtggatgggcctctacattcttgacctctccgacaacgggctcaccggcgacatacctcaagatttcagcaatctccatctcaactttctcaacctttcttctaaccagctctccggcgaggtcccggagacgctgcaaaacggcgcctacgatcgtagcttcc
mutagenesis in rice using crispr-cas system.cell research,23(10):1233
–
1236.)。将构建成功的crispr/cas9载体,通过农杆菌介导的方法,转化至野生型日本晴的幼胚诱导的愈伤组织中,经潮霉素筛选获得阳性转基因植株。
37.2、对上述获得的阳性转基因植株编辑形式进行分子鉴定:
38.以水稻叶片的基因组dna为模板,用如下鉴定引物进行pcr扩增,对扩增产物进行sanger测序,解析突变体编辑形式。
39.osifbr1突变体鉴定引物为:
40.osifbr1-check-f(seq id no.4):attgtggtgttcaacaatagct;
41.osifbr1-check-r(seq id no.5):cacgttctcctcgtggagat。
42.pcr扩增体系根据2
×
es taq mastermix(dye)使用说明书配制,具体为:2
×
es taq mastermix(dye)10μl,上游引物(10μm)0.8μl,下游引物(10μm)0.8μl,dna模板1μg,ddh2o补至20μl。
43.pcr反应体系为:94℃预变性2min;94℃变性30s,58℃退火30s,72℃延伸30s,循环32次;72℃延伸2min。
44.结果如图1所示,获得1个纯合敲除突变体株系osifbr1。在osifbr1中,osac37基因起始密码子atg下游1528bp处插入一个碱基a,产生移码突变,导致了1567-1569bp处提前形成了终止密码子。然后从纯合敲除体的后代中筛选出不含cas9基因的植株用于后续实验。
45.3、野生型日本晴(nip)和敲除突变体osifbr1接种稻瘟病菌后表型观察:采用喷雾接种法进行抗性鉴定。
46.野生型日本晴(nip)和敲除突变体osifbr1种植于苗盘中,待其生长至四叶期进行接菌。将保存在滤纸上的稻瘟病菌s5菌株接种于番茄燕麦固体培养基平板上活化。刮取菌丝转至新的番茄燕麦培养基平板上扩大培养。将菌丝进行涂断,放置26℃黑光灯培养箱中诱导产孢。用0.1%吐温涂洗平板,过滤后,将孢子浓度调至1
×
105个/ml。用喷壶均匀喷洒在水稻苗叶片上,接种后黑暗保湿培养24小时,后撤去遮光布,继续正常光照培养,接种7天后进行拍照记录发病情况。同时利用实时荧光定量pcr检测发病叶片的带菌量,取等量的野生型日本晴(nip)和敲除突变体osifbr1的叶片,提取基因组dna,用如下引物进行荧光定量pcr,比较日本晴与突变体osifbr1叶片所携带的稻瘟菌量,从而完成敲除突变体的抗稻瘟病评价。
47.实时荧光定量pcr引物为:
48.mopot2-f(seq id no.6):acgacccgtctttacttatttgg;
49.mopot2-f(seq id no.7):aagtagcgttggttttgttggat;
50.osubi-f(seq id no.8):gcccaagaagaagatcaagaac;
51.osubi-r(seq id no.9):agataacaacggaagcataaaagtc。
52.荧光定量pcr扩增体系根据2
×
sybr qpcr mixture使用说明书配制,具体为:2
×
sybr qpcr mixture10μl,上游引物(10μm)2μl,下游引物(10μm)2μl,dna模板1μg,ddh2o补至20μl。
53.荧光定量pcr反应体系为:95℃预变性10min;95℃变性30s,60℃退火1min,循环40次;72℃延伸2min。
54.结果如图2所示,相较于野生型,osifbr1突变体对稻瘟病的抗性显著降低,表现为
osifbr1突变体叶片中的稻瘟菌菌量显著高于野生型。
55.4、野生型日本晴(nip)和敲除突变体osifbr1接种白叶枯菌后表型观察:采用剪叶接种法进行抗性鉴定。
56.野生型日本晴(nip)和敲除突变体osifbr1种植于桶中,待其生长至抽穗期进行接菌。将白叶枯病菌pxo99a菌株划线于牛肉膏蛋白胨固体培养基平板上活化。挑取单菌落至牛肉膏蛋白胨液体培养基,28℃摇培过夜后,收集菌体,将活化的菌液浓度调至od600约为0.8,用剪刀蘸取菌液后,选取倒二叶,沿叶片末端剪口接菌,注意对接菌的水稻喷水保湿,每个株系至少接种20个叶片,接种14天后进行拍照记录发病情况并测量病斑长度。
57.结果如图3所示,相较于野生型,osifbr1突变体对白叶枯病的抗性显著降低,表现为osifbr1突变体株系叶片上的病斑长度显著长于野生型植株。
58.实施例2:
59.1、构建osifbr1基因过表达植株osifbr1ox:
60.提取水稻品种日本晴的rna,反转录为cdna。以此cdna为模板,用如下引物进行pcr扩增,得到长度为3076bp的pcr产物,两端分别包含xbai和bamhi的酶切位点。该pcr产物具有seq id no:2所示序列的1至3060位核苷酸。
61.osifbr1-f(seq id no.10):gctctagaatggctgtctacaacatcct;
62.osifbr1-f(seq id no.11):cgggatccaactggatgcgccacgaaa。
63.(引物中小写碱基为酶切位点以及保护碱基)
64.pcr扩增体系根据phusion dna polymerase使用说明书配制,具体为:2
×
phanta max buffer 10μl,dntp mix 0.4μl,上游引物(10μm)0.8μl,下游引物(10μm)0.8μl,cdna模板400ng,phusion dna polymerase 0.4μl,ddh2o补至20μl。
65.pcr反应体系为:95℃预变性3min;95℃变性15s,58℃退火15s,72℃延伸90s,循环32次;72℃充分延伸5min。
66.用xbai和bamhi酶切该pcr产物,得到的酶切产物与经过同样酶切的pcsv1300载体骨架进行连接,使pcr产物插入pcsv1300载体的xbai和bamhi位点见,得到最终载体。
67.经过测序,该重组载体为将seq id no:2所述序列自第1位至3060位核苷酸插入pcsv1300载体的xbai和bamhi酶切位点间,为osac37过表达载体,如图4a所示。
68.将构建成功的pcsv1300-osifbr1载体转化至野生型日本晴的幼胚诱导的愈伤组织中,通过潮霉素筛选获得阳性转基因植株。
69.2、对上述获得的阳性转基因植株进行分子鉴定
70.提取野生型日本晴和osifbr1过表达转基因植株的rna,反转录为cdna。以此cdna为模板,用如下引物进行实施例1中相同的荧光定量pcr。
71.qrt-osifbr1-f(seq id no.12):atggctgtctacaacatcctca
72.tcc;
73.qrt-osifbr1-r:(seq id no.13):aactggatgcgccacgaaac;
74.qrt-osact1-f(seq id no.14):ctcccccatgctatccttcg;
75.qrt-osact1-r(seq id no.15):tgaatgagtaaccacgctccg。
76.结果如图4b所示,osifbr1过表达植株osifbr1ox中osifbr1的平均相对表达水平明显高于野生型日本晴中osifbr1的表达水平。
77.3、野生型日本晴(nip)和过表达植物osifbr1ox接种稻瘟病菌后表型观察:采用喷雾接种法进行抗性鉴定。
78.野生型日本晴(nip)和过表达植物osifbr1ox种植于苗盘中,待其生长至四叶期进行接菌。将保存在滤纸上的稻瘟病菌s5菌株接种于番茄燕麦固体培养基平板上活化。刮取菌丝转至新的番茄燕麦培养基平板上扩大培养。将菌丝进行涂断,放置26℃黑光灯培养箱中诱导产孢。用0.1%吐温涂洗平板,过滤后,将孢子浓度调至1
×
105个/ml。用喷壶均匀喷洒在水稻苗叶片上,接种后黑暗保湿培养24小时,后撤去遮光布,继续正常光照培养,接种7天后进行拍照记录发病情况。同时利用实时荧光定量pcr检测发病叶片的带菌量,取等量的野生型日本晴(nip)和过表达植物osifbr1ox的叶片,提取基因组dna,以此为模板进行实施例1中相同的荧光定量pcr,比较日本晴与过表达植物osifbr1ox叶片所携带的稻瘟菌量,从而完成过表达植物osifbr1ox的抗稻瘟病评价。
79.相较于野生型,过表达植物osifbr1ox对稻瘟病的抗性显著增强,表现为过表达植物osifbr1ox叶片中的稻瘟菌菌量显著低于野生型。
80.4、野生型日本晴(nip)和过表达植物osifbr1ox接种白叶枯菌后表型观察:采用剪叶接种法进行抗性鉴定。
81.野生型日本晴(nip)和过表达植物osifbr1ox种植于桶中,待其生长至抽穗期进行接菌。将白叶枯病菌pxo99a菌株划线于牛肉膏蛋白胨固体培养基平板上活化。挑取单菌落至牛肉膏蛋白胨液体培养基,28℃摇培过夜后,收集菌体,将活化的菌液浓度调至od600约为0.8,用剪刀蘸取菌液后,选取倒二叶,沿叶片末端剪口接菌,注意对接菌的水稻喷水保湿,每个株系至少接种20个叶片,接种14天后进行拍照记录发病情况并测量病斑长度。
82.相较于野生型,过表达植物osifbr1ox对白叶枯病的抗性显著增强,表现为过表达植物osifbr1ox叶片上的病斑长度显著短于野生型植株。
83.以上所述仅为本发明专利的较佳实施例而已,并不用以限制本发明专利,凡在本发明专利的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明专利的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
