1.本发明属于微生物及微生物发酵技术领域,具体涉及一种全合成培养基、制备方法及其用于三孢布拉氏霉菌的培养方法。
背景技术:
2.β-胡萝卜素是一种橙黄色的萜类化合物,是在日常生活中最广泛存在的天然色素。这种脂溶性化合物是合成维生素a的重要前体,与番茄红素、角黄素、虾青素等同属于类胡萝卜素。类胡萝卜素具有很强的清除氧自由基的能力,即具有抗氧化性的特点,应用于防癌,抗癌等方面效果显著。类胡萝卜素的应用也从最早的仅作为色素添加到食品、饲料中,逐渐扩展到医药、日化等领域,成为非常重要的工业产品。
3.三孢布拉氏霉(b.trispora)是笄霉科的一种异宗接合菌,其生长速度快,能很快生成发达的菌丝。在固体培养基上,菌丝能够迅速蔓延、平铺并形成菌苔,在液体培养基中则容易形成菌丝球。
4.三孢布拉氏霉在深层液体培养下主要会形成三种不同形态,即分散的菌丝体(分散的丝状体),菌块(有一定聚集但依然能看到散出的菌丝)以及菌球(紧密的球形聚集体)(varzakakou m,roukas t,kotzekidou p,et al.effect of non-ionic surfactants and beta-ionone on the morphology of blakeslea trispora and carotenoids production from cheese whey in submerged aerobic growth:a statistical approach[j].food biotechnology,2010,24(2):197-214.)。深层培养下丝状真菌的生长和形态取决于不同的操作条件和因素,包括接种、培养基组成、发酵液流变特性和培养条件。其中,发酵液流变特性和发酵罐中搅拌强度对流型和菌体成球状态具有较大的影响:搅拌强度增加会导致菌丝收到的剪切力增加,有利于菌丝分散,但容易造成菌丝碎裂;搅拌强度降低,会导致传质效率降低,直接改变培养基的组成和流变特性,能够降低机械搅拌对于菌丝生长过程的影响。
[0005]
中国专利(申请号cn201511028714.4)公开了一种利用淀粉磷酸酯作为碳源的三孢布拉氏霉发酵培养基,中国专利(申请号cn201911221401.9)公开了利用酸解淀粉乳配合黄豆粉作为三孢布拉氏霉发酵培养基的主要组成,jing等公开了一种含有黄豆粉、玉米粉的发酵培养基(jing,keju,shuya,et al.enhancing beta-carotene biosynthesis and gene transcriptional regulation in blakeslea trispora with sodium acetate.[j].biochemical engineering journal,2016,114:10-17.),目前主要的三孢布拉氏霉培养基均利用了天然原料或天然原料衍生物,以粉状和糊状物料为三孢布拉氏霉的生长提供具有一定粘度的环境,其不足在于所述原料均可被三孢布拉氏霉代谢分解,随发酵过程进行粘度下降快,且提供的营养成分由于需要维持特定粘度,其营养物质组成不完全适合菌丝积累类胡萝卜素。中国专利(申请号cn201810028777.7)公开了一种添加含乙烯的葵花油促进三孢布拉氏霉合成类胡萝卜素的方法,天然油脂的使用能够为发酵体系增加粘度,作
为氧载体、但油脂的加入无法使发酵罐分布器处的气泡直径变小,降低了空气的利用率,且所用葵花油其代谢特性与特定配方的酯类相比,特定酯类更有利于类胡萝卜素在三孢布拉氏霉中的积累。
技术实现要素:
[0006]
本发明的目的在于克服现有技术的不足之处,提供了一种全合成培养基、制备方法及其用于三孢布拉氏霉菌的培养方法,以改性纤维素类增稠剂作为培养基组分,使用确定组分的合成酯类作为流加底物,对三孢布拉氏霉(blakeslea trispora)进行发酵培养,解决了上述背景技术中的问题。
[0007]
本发明解决其技术问题所采用的技术方案之一是:提供了一种一种全合成培养基,包括碳源、氮源、微生物、无机盐和增稠剂;其中,所述增稠剂为羧甲基纤维素钠1~15g/l,所述羧甲基纤维素钠还作为碳源组分之一,所述碳源的浓度折合葡萄糖计为40~60g/l。
[0008]
在本发明一较佳实施例中,所述碳源包括:葡萄糖20~60g/l、甘油2~5g/l、蔗糖5~10g/l、乙酸钠1~3g/l、吐温-801~10g/l、吐温-200.5~5g/l、棕榈酸甲酯5~10g/l、油酸甲酯5~10g/l、亚油酸乙酯2~5g/l、肉豆蔻酸异丙酯1~3g/l中的至少一种与羧甲基纤维素钠1~15g/l的混合物。
[0009]
在本发明一较佳实施例中,所述氮源包括:尿素5~10g/l、天冬氨酸2~10g/l、谷氨酸钠2~5g/l、天冬酰胺2~5g/l、组氨酸1~1.5g/l、脯氨酸0.5~1g/l、甲硫氨酸0.1~0.2g/l中的至少一种。
[0010]
在本发明一较佳实施例中,所述无机盐包括:硫酸镁0.2~0.5g/l、磷酸氢二钾0.5~1g/l、硫酸亚铁0.05~0.15g/l、氯化锌0.05~0.1g/l、氯化锰0.02~0.06g/l、硫酸铜0.02~0.08g/l、氯化钙0.1~0.2g/l、硫酸镍0.02~0.08g/l、氯化钴0.01~0.03g/l中的至少一种。
[0011]
在本发明一较佳实施例中,所述维生素包括:vb10.002~0.01g/l、泛酸钙0.002~0.005g/l、vb
12
0.002~0.005g/l、生物素0.003~0.009g/l中的至少一种。
[0012]
本发明解决其技术问题所采用的技术方案之二是:提供了一种全合成培养基的制备方法,包括以下步骤:
[0013]
1)使用发酵液体积70%水溶解羧甲基纤维素钠,搅拌状态下使其充分溶解溶胀,形成无色透明溶液;
[0014]
2)使用发酵液体积30%的水溶解葡萄糖、甘油、蔗糖、乙酸钠、氮源、无机盐;
[0015]
3)混合步骤1)和步骤2)的溶液,使用氢氧化钠调节ph至6.9~7.5,采用115~125℃、20~35min进行湿热灭菌,得到灭菌后培养基;
[0016]
4)混合吐温-80、棕榈酸甲酯、油酸甲酯、亚油酸乙酯、肉豆蔻酸异丙酯,采用115~125℃、20~35min进行湿热灭菌,作为酯类流加底物;
[0017]
5)、使用、水-乙醇混合溶液溶解维生素组分,使用0.2μm无菌滤膜过滤除菌;
[0018]
6)、使用灭菌后的磷酸将上述步骤3)中的灭菌后培养基ph调节至6.9~7.1,加入步骤5)中过滤后的维生素组分,制成全合成培养基的主组分。
[0019]
本发明解决其技术问题所采用的技术方案之三是:提供了一种全合成培养基的应用,包括全合成培养基的主组分和酯类流加底物,用于三孢布拉氏霉菌的培养,所述培养包
括一级培养、二级培养、发酵培养。
[0020]
本发明解决其技术问题所采用的技术方案之四是:提供了一种三孢布拉氏霉菌的培养方法,将上述一种全合成培养基作为发酵培养基进行发酵培养,包括如下步骤:
[0021]
1)菌种活化:无菌条件下将三孢布拉氏霉正、负株接种于商用pda培养基斜面,25℃避光培养6d,待孢子长出后,使用无菌生理盐水将孢子洗下,得到孢子悬液;
[0022]
2)由孢子悬液直接接种于发酵培养基,使负菌孢子浓度以发酵培养基体积计为1.2
×
105/l,负菌孢子接种培养16~24h,之后以正菌孢子数量8
×
103/l接种于上述发酵培养体系,培养温度22~28℃,培养至168~268h,根据发酵监测状态进行补料(以发酵液中残留还原糖的浓度、发酵体系调节ph用的酸碱消耗、发酵液的粘度变化作为补料依据);所述补料包括补加葡萄糖、羧甲基纤维素钠和酯类流加底物。
[0023]
本发明解决其技术问题所采用的技术方案之五是:提供了一种三孢布拉氏霉菌的培养方法,包括如下步骤:
[0024]
1)菌种活化:无菌条件下将三孢布拉氏霉正、负株接种于商用pda培养基斜面,25℃避光培养6d,待孢子长出后,使用无菌生理盐水将孢子洗下,得到孢子悬液;
[0025]
2)一级种子培养:将孢子进行计数,以一级种子液体积计,按负菌孢子数1.2
×
107/l进行接种,22~26℃培养16~24h;之后,以一级种子液体积计,按正菌孢子数8
×
105/l向负菌培养液接种,20~25℃培养至36~48h;
[0026]
3)二级种子培养:按照15~25%的接种量将一级种子接种于二级种子培养基,28℃培养12~16h;
[0027]
4)发酵培养:由一级或二级种子按照10~15%的接种量接种至发酵培养基,培养温度22~28℃,培养至168~268h,根据发酵监测状态进行补料;所述发酵培养基采用上述一种全合成培养基,所述补料包括补加葡萄糖、羧甲基纤维素钠和酯类流加底物。
[0028]
在本发明一较佳实施例中,所述一级种子培养基或二级种子培养基以计包括以下组分:羧甲基纤维素钠0.5~3.5g/l、葡萄糖20~30g/l、天冬氨酸2~3g/l、天冬酰胺1~2g/l、谷氨酸钠3~5g/l、生物素0.005~0.009g/l、vb10.005g/l,还包括麦芽提取物1g/l,ph 6.9-7.1。
[0029]
本技术方案与背景技术相比,它具有如下优点:
[0030]
1.与现有技术相比,本发明所述的全合成培养基避免了对淀粉、玉米粉、黄豆粉、玉米浆干粉等天然物料的使用,不需要溶解和糊化不溶性粉状物料,能够有效地避免因粉状物料溶解不彻底、包埋杂菌而带来的染菌风险,极大地降低了发酵过程杂菌污染的情形。同时,使用羧甲基纤维素钠等食品增稠剂,能够很好的模拟天然培养基的流变特性,并根据发酵具体情况改变发酵液的流变特性,在改变增稠剂添加量和种类的情况下,能够很好地实现对菌丝生长形态和结球形态的控制。由于类胡萝卜素在三孢布拉氏霉中的积累水平与菌丝的结球形态密切相关,通过本全合成培养基可以对三孢布拉氏霉的菌丝结球进行过程控制,以进一步研究类胡萝卜素在三孢布拉氏霉中的合成代谢。使用脂肪酸甲酯替代植物油,能够更为精确的调整脂肪酸的组成,为类胡萝卜素的积累提供更为适合的环境。
[0031]
2.通过增稠剂对发酵液流变特性进行控制,能够避免使用粉状物料时营养成分与粘度正相关的特性,方便对发酵体系的营养组成进行控制,以更好的实现产物积累。本发明中的全合成培养基能够很好地模拟依靠淀粉、玉米粉、黄豆粉、玉米浆等物料产生粘度而使
霉菌等菌丝体发生分离的发酵培养基,适用于三孢布拉霉、高山被孢霉,以及其他类有结球行为的似丝状霉菌的发酵培养,为霉菌菌丝聚集形态方面的研究提供了基础;
[0032]
3.本发明含有增稠剂的全合成培养基用于三孢布拉氏霉菌的发酵培养,最终β-胡萝卜素在菌丝体中的含量达到6.6~7.1(mg/100mg),发酵体系的β-胡萝卜素产量达到3.32g/l,为三孢布拉氏霉菌和类似的丝状真菌体形态研究提供了基础。
附图说明
[0033]
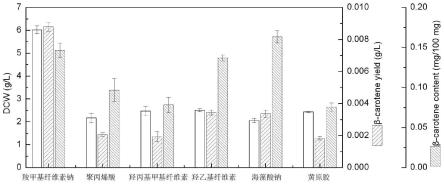
图1为实施例1中不同增稠剂添加下的三孢布拉氏霉负菌发酵结果;
[0034]
图2为实施例1中菌丝结球情况,其中a)羧甲基纤维素钠b)聚丙烯酸c)羟丙基甲基纤维素d)羟乙基纤维素e)海藻酸钠f)黄原胶;
[0035]
图3为实施例2中不同羧甲基纤维钠添加量对三孢布拉氏霉负菌生物量的影响;
[0036]
图4为实施例2中不同羧甲基纤维钠添加量对三孢布拉氏霉负菌β-胡萝卜素产量的影响;
[0037]
图5为实施例2中不同羧甲基纤维钠添加量对三孢布拉氏霉负菌β-胡萝卜素含量的影响;
[0038]
图6为实施例2中不同羧甲基纤维钠添加量对发酵液粘度的影响;
[0039]
图7为实施例2中不同羧甲基纤维钠添加对负菌菌丝球直径的影响;
[0040]
图8为实施例3中正、负菌30l混合发酵结果。
具体实施方式
[0041]
下述实施例所用三孢布拉氏霉正、负菌(blakeslea trispora《 》、《-》)来源于atcc,编号分别为atcc 14271( ),atcc 14272(-)。
[0042]
实施例1
[0043]
本实施例中,使用不同的增稠剂制备全合成培养基作为发酵培养基:
[0044]
使用羧甲基纤维素钠(mw=250000、ds=0.7)、聚丙烯酸(mw~4000)、羟丙基甲基纤维素(i型,粘度:20000mpa.s)、羟乙基纤维素(5000~6400mpa.s,25℃)、海藻酸钠、黄原胶作为增稠剂,控制添加量为1~15g/l,使其灭菌后的培养基粘度为300mpa
·
s,其他组分为(g/l):葡萄糖20,甘油5,吐温-800.5,天冬氨酸2,谷氨酸钠2,天冬酰胺2,组氨酸1,脯氨酸0.5,甲硫氨酸0.1,硫酸镁0.2,磷酸氢二钾1,硫酸亚铁0.05,氯化锌0.05,氯化锰0.02,硫酸铜0.02,氯化钙0.1,硫酸镍0.02,氯化钴0.01;
[0045]
维生素(g/l):vb10.01,泛酸钙0.002,vb
12
0.002,生物素0.003;
[0046]
将增稠剂溶解于70ml水,搅拌至充分溶解,形成透明均匀溶液,使用30ml水溶解其他组分,加入增稠剂溶液后混合均匀,于500ml锥形瓶中,121℃灭菌20min,冷却后使用1mol/l氢氧化钠溶液调节ph至7.0,使用0.2μm无菌滤膜过滤维生素,加入培养基中。
[0047]
本实施例三孢布拉氏霉菌的培养方法,包括如下步骤:
[0048]
取保藏的三孢布拉氏霉负菌接种于商用pda培养基斜面,25℃避光培养6d,待孢子长出后,使用无菌生理盐水将孢子洗下;
[0049]
按照负菌孢子个数1.2
×
105/l接种发家培养基,28℃培养240h,测定菌体生物量,以干重计(dcw),使用石油醚研磨萃取菌丝中的类胡萝卜素,使用hplc对β-胡萝卜素进行含
量测定,计算干菌丝中的β-胡萝卜素含量(mg/100mg生物量)。
[0050]
三孢布拉氏霉大量积累类胡萝卜素需要正、负菌共同培养,但类胡萝卜素的合成主要在负菌中进行,本实施例针对三孢布拉氏霉负菌进行增稠剂种类对比,结果如图1和2:使用羧甲基纤维素钠作为发酵增稠剂和全合成培养基组分,发酵结果中的生物量,β-胡萝卜素产量最高,分别为6.02g/l,0.0088g/l,含量为0.146mg/100mg,优于其他种类增稠剂。图2为发酵结束时的菌丝聚集形态图像,能够看出当羧甲基纤维素钠作为增稠剂时,菌丝球大小均匀、分散、边缘光滑,适合于菌丝传质和类胡萝卜素积累。
[0051]
实施例2
[0052]
本实施例的全合成培养基组分中,采用了不同含量羧甲基纤维素钠:
[0053]
发酵培养基组分为(g/l):羧甲基纤维素钠(mw=250000、ds=0.7)0~13.6,其他组分为葡萄糖20,吐温-800.5,天冬氨酸2,谷氨酸钠2,天冬酰胺2,组氨酸1,甲硫氨酸0.1,硫酸镁0.2,磷酸氢二钾1,硫酸亚铁0.05,氯化锌0.05,氯化锰0.02,硫酸铜0.02,氯化钙0.1,硫酸镍0.02,氯化钴0.01;
[0054]
维生素(g/l):vb10.01,泛酸钙0.002,vb
12
0.002,生物素0.003。
[0055]
分别称取1.72、6.87、13.6g羧甲基纤维素钠,溶解于70ml水,搅拌至充分溶解,形成透明均匀溶液,使用30ml水溶解其他组分,加入增稠剂溶液后混合均匀,于500ml锥形瓶中,121℃灭菌20min,冷却后使用1mol/l氢氧化钠溶液调节ph至7.0,使用0.2μm无菌滤膜过滤维生素,加入培养基中。
[0056]
本实施例三孢布拉氏霉菌的培养方法,包括如下步骤:
[0057]
取保藏的三孢布拉氏霉负菌接种于商用pda培养基斜面,25℃避光培养6d,待孢子长出后,使用无菌生理盐水将孢子洗下;
[0058]
按照负菌孢子个数1.2
×
105/l接种发家培养基,28℃培养264h,测定菌体生物量,以干重计(dcw),使用石油醚研磨萃取菌丝中的类胡萝卜素,使用hplc对β-胡萝卜素进行含量测定,计算干菌丝中的β-胡萝卜素含量(mg/100mg生物量)。
[0059]
结果如图3至7,不同的羧甲基纤维素添加量对生物量的影响,随着羧甲基纤维素的添加量增加,β-胡萝卜素产量和含量升高,高添加组的β-胡萝卜素产量为0.151g/l,是低添加组的1.45倍,其产量提高在于菌体积累的β-胡萝卜素含量升高;图6表示培养过程中发酵体系的粘度变化,说明羧甲基纤维素能够在120h内对发酵液粘度进行影响,且能够菌体生长结果;图7说明了不同羧甲基纤维素添加情况下菌丝球直径随时间的变化情况,随着初始培养基粘度的增加,菌球直径逐渐降低,且在低粘度下,菌球直径的增加时长会延长,导致菌球过大,影响类胡萝卜素在菌体中的积累,增加初始粘度有利于减小菌丝球直径,提高菌丝球的传质水平,提高类胡萝卜素的产量。
[0060]
实施例3
[0061]
本实施例的培养基组分中,以添加羧甲基纤维素钠为实验组,不添加羧甲基纤维素钠作为对照组。
[0062]
实验组发酵培养基包括以下组分(g/l):使用羧甲基纤维素钠(mw=250000、ds=0.7)7.21,葡萄糖20,甘油2,蔗糖5,乙酸钠2,吐温-801,吐温-200.5,尿素5,天冬氨酸2,谷氨酸钠2,天冬酰胺2,组氨酸1,脯氨酸1,甲硫氨酸0.2,硫酸镁0.2,磷酸氢二钾1,硫酸亚铁0.06,氯化锌0.06,氯化锰0.03,硫酸铜0.06,氯化钙0.1,硫酸镍0.05,氯化钴0.01,
vb10.01,泛酸钙0.002,vb
12
0.002,生物素0.006;
[0063]
对照组发酵培养基除羧甲基纤维素钠不添加,其余组分与实验组相同。
[0064]
将羧甲基纤维素钠溶解于15l水,搅拌至充分溶解,形成透明均匀溶液,使用3l水溶解其他组分,加入增稠剂溶液后混合均匀,于30l发酵罐中,121℃灭菌35min,冷却后使用1mol/l氢氧化钠溶液调节ph至7.0,使用0.2μm无菌滤膜过滤维生素,加入培养基中。
[0065]
本实施例于30l发酵罐对三孢布拉氏霉正、负菌进行混合发酵,具体步骤如下:
[0066]
取保藏的三孢布拉氏霉正、负菌接种于商用pda培养基斜面,25℃避光培养6d,待孢子长出后,使用无菌生理盐水将孢子洗下;
[0067]
一级种子培养基包括以下组分(g/l):羧甲基纤维素钠(mw=120000、ds=0.7)1.7,葡萄糖20,天冬氨酸2,天冬酰胺2,麦芽提取物1,谷氨酸钠3,生物素0.005,vb10.005,ph 7.1。将羧甲基纤维素钠搅拌溶解,加入其他组分后121℃灭菌20min,冷却后加入过滤的维生素,按负菌孢子数1.2
×
107/l进行接种,26℃培养20h。之后,按正菌孢子数8
×
105/l向负菌培养液接种,22℃培养至36h。
[0068]
二级种子培养基包括以下组分(g/l):羧甲基纤维素钠(mw=120000、ds=0.7)1.7,葡萄糖30,天冬氨酸2,天冬酰胺2,麦芽提取物1,谷氨酸钠3,生物素0.005,vb10.01,ph 7.1。将羧甲基纤维素钠搅拌溶解,加入其他组分后121℃灭菌20min,冷却后加入过滤的维生素,按照25%的接种量将一级种子接种于二级种子培养基,28℃培养16h。
[0069]
由二级种子按10%的接种量接种至发酵培养基,28℃培养至48h,之后25℃培养至144h,期间通过调整搅拌速度和通气量,使溶氧不低于10%,通过1mol/l氢氧化钠控制发酵ph为6.8。
[0070]
结果如图8,实验组菌丝中的β-胡萝卜素含量为7.11mg/100mg,为对照组的1.27倍。
[0071]
实施例4
[0072]
本实施例发酵培养基包括以下组分(g/l):使用羧甲基纤维素钠(mw=250000、ds=0.7)7.21,葡萄糖40,甘油5,蔗糖5,乙酸钠2,吐温-801,吐温-200.5,尿素8,天冬氨酸6,谷氨酸钠3,天冬酰胺5,组氨酸1,脯氨酸0.5,甲硫氨酸0.2,硫酸镁0.2,磷酸氢二钾1,硫酸亚铁0.08,氯化锌0.06,氯化锰0.03,硫酸铜0.06,氯化钙0.1,硫酸镍0.05,氯化钴0.01,vb10.01,泛酸钙0.002,vb
12
0.002,生物素0.006;
[0073]
酯类流加底物包括以下组分和体积分数(v/v%):棕榈酸甲酯28,油酸甲酯55,亚油酸乙酯11,肉豆蔻酸异丙酯5,吐温-801,流加底物混合后,121℃灭菌40min。
[0074]
将羧甲基纤维素钠溶解于2.5l水,搅拌至充分溶解,形成透明均匀溶液,使用0.5l水溶解其他组分,加入增稠剂溶液后混合均匀,于5l发酵罐中,121℃灭菌40min,冷却后使用1mol/l氢氧化钠溶液调节ph至7.0,使用0.2μm无菌滤膜过滤维生素,加入培养基中。
[0075]
本实施例步骤如下:
[0076]
取保藏的三孢布拉氏霉正、负菌接种于商用pda培养基斜面,25℃避光培养6d,待孢子长出后,使用无菌生理盐水将孢子洗下;
[0077]
一级种子培养基包括以下组分(g/l):羧甲基纤维素钠(mw=120000、ds=0.7)1.7,葡萄糖20,天冬氨酸2,天冬酰胺2,麦芽提取物1,谷氨酸钠3,生物素0.005,vb10.005,ph 7.1。将羧甲基纤维素钠搅拌溶解,加入其他组分后121℃灭菌20min,冷却后加入过滤的
维生素,按负菌孢子数1.2
×
107/l进行接种,26℃培养30h。之后,按正菌孢子数8
×
105/l向负菌培养液接种,22℃培养至48h。
[0078]
二级种子培养基包括以下组分(g/l):羧甲基纤维素钠(mw=250000、ds=0.7)1.7,葡萄糖30,天冬氨酸2,天冬酰胺2,麦芽提取物1,谷氨酸钠3,生物素0.005,vb10.01,ph 7.1。将羧甲基纤维素钠搅拌溶解,加入其他组分后121℃灭菌20min,冷却后加入过滤的维生素,按照25%的接种量将一级种子接种于二级种子培养基,28℃培养12h。
[0079]
由二级种子按15%的接种量接种至发酵培养基,28℃培养至48h,之后25℃培养至168h,期间通过调整搅拌速度和通气量,使溶氧不低于10%,通过1mol/l氢氧化钠控制发酵ph为6.6。在发酵至48h时:当初始糖消耗至5g/l时,一次性补入葡萄糖使发酵液残糖达到20g/l,维持至发酵结束;此时ph开始略微回升,判断其处于初级代谢向次级代谢转变阶段,同时开始流加酯类底物,按照15ml/d的添加量分次进行流加,至发酵结束。于发酵72h时,一次性补水500ml。
[0080]
收集发酵液获得菌体,测得干重为50.31g/l,发酵液中β-胡萝卜素单位为3.32g/l。由此,适用本实施例制备方法能够达到较高的β-胡萝卜素发酵单位,能够适用于工业生产。
[0081]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。