用于获得表达重组马绒毛膜促性腺激素(recg)的哺乳动物细胞系的方法、生产recg的重组细胞系、大规模recg生产方法、recg、含有recg的调配物、编码recg的核酸和用途
技术领域
1.本发明属于生物技术领域,具体涉及通过重组dna技术开发蛋白质激素及其在哺乳动物细胞中的生产。
背景技术:
2.马绒毛膜促性腺激素(ecg)与黄体生成素(lh)、卵泡刺激素(fsh)和甲状腺刺激素(tsh)一起是糖蛋白激素家族的成员(murphy和martinuk,1991)。由于ecg是由妊娠母马的子宫内膜杯的滋养层细胞生产的,因此它最初被称为妊娠母马血清促性腺激素(pmsg)。ecg在维持早期妊娠(前三个月)中起着重要作用,通过黄体激素间接刺激孕激素生产,直到胎盘可以自行分泌。由滋养层分泌的ecg的浓度在妊娠50天左右达到期最高浓度,然后开始逐渐下降(allen和moor,1972)。
3.与其它糖蛋白激素相比,ecg有两个独特的特性。一方面,在马以外的物种中,ecg表现出高fsh和lh样活性,并且对这些激素的受体具有高亲和力(combarnous等人,1984)。另一方面,它表现出高碳水化合物含量,占其总分子量的45%。这最后一个性质决定了ecg的长循环半衰期,约为六天。由于这两个特性,ecg在兽医学中用于控制不同类型牲畜的生殖活动,包含牛、绵羊、山羊和猪(rensis和lopez-gatius,2014)。
4.与糖蛋白激素家族的其它成员一样,ecg是一种异二聚体蛋白,其由两个不同的非共价连接的亚基(即α和β)构成。α亚基是所述家族的所有成员共有的,它由单个基因编码,而不同的基因编码β亚基,这赋予了异二聚体的特异性(stewart和allen,1976)。α亚基由96个氨基酸构成并且具有位于asn56和asn82处的两个n-糖基化位点,而β亚基由149个氨基酸构成并且仅具有asn13处的一个n-糖基化位点。此外,β亚基具有由28个氨基酸(122-149)构成的羧基末端肽(ctp),在ser o thr残基中含有12个o-糖基化位点(bousfield和butnev,2001)。两个亚基都含有多个分子内二硫键,并且它们的组装主要发生在内质网中,这代表了二聚体分泌过程中的限制步骤(hoshina和boime,1982)。在马科动物中,胎盘cg和垂体lhβ亚基都由相同的基因编码(sherman等人,1992)。然而,ecg由比elh更高且更支链化的碳水化合物含量构成。两种激素的n-聚糖末端差异很大。ecg的聚糖以n-乙酰神经氨酸(唾液酸)封端,而elh表现出硫酸化的n-乙酰半乳糖胺(so
4-4-galnac)聚糖。它们分子量的显著差异主要是由于ecg中存在较长的二唾液酸化聚-n-乙酰胺o-聚糖结构(smith等人,1993)。ecg的高唾液酸含量是其卓越的循环半衰期的原因,因为这种残留物会减少肾小球过滤和肝脏代谢。
5.当前,市场上可用的产品是来自妊娠母马血液的部分纯化的ecg制剂(pmsg),其存在诸多缺点。一方面,它们表现出批次间的差异,因为糖基化谱在动物之间以及在不同妊娠阶段的血清之间存在差异。另一方面,pmsg还可能含有具有潜在健康风险的污染物。这与当前的监管机构要获得不含病毒、朊病毒和其它污染蛋白的更安全的兽药产品的趋势背道而
驰。最后但同样重要的是,从妊娠母马获得含有ecg的血清的做法涉及每周抽取10升血液并随后通过触及子宫和使羊膜囊破裂来诱导人工流产。动物的遭遇损害了动物福利,从生物伦理的角度来看,这是完全值得怀疑的:这是一个血腥的过程,可能会导致严重的贫血,并且在一些情况下会以动物的生命而告终。
6.出于此原因,开发重组ecg(recg)作为pmsg的替代品是合理的。已经报道了在不同宿主中生产重组ecg的若干努力。一方面,legardinier等人(2005)描述了在两种昆虫细胞系sf9和mimic
tm
(后者是来源于前者的细胞系,其已被修饰以表达来自哺乳动物糖基转移酶的不同基因)中生产ecg。然而,所生产的激素在体内大鼠模型中并未表现出fsh/lh样活性,作者将其归因于因寡糖链中的末端唾液酸的缺失而导致的其极短的循环半衰期。另一方面,ubach等人(2009)和ingles等人(2012)描述了毕赤酵母中的ecg的表达和纯化;然而,所述重组激素在雌性大鼠的体内生物测定中没有表现出生物活性。同样,这些结果与重组激素的短循环半衰期相关,因为在90分钟之后在血清中仅能检测到1%注射蛋白质。这种快速清除可以通过在注射具有高甘露糖含量的蛋白质之后发生的甘露聚糖结合凝集素途径的激活来解释。这些结果表明了正确的糖基化谱对于ecg表现出体内生物活性的重要性,并且因此表明了正确的宿主选择对于其重组表达的重要性。
7.已经在出版物和专利中报道了在cho细胞(包含cho dg44细胞系)中开发ecg的重组版本。wo2017112987a1专利申请描述了这种cho细胞系的用途以及根据所使用的宿主获得具有预期糖基化谱的recg。尽管如此,recg的商业版本还没有在市场上销售。这一结果证明了一个有待解决的问题,即大量重组ecg(或一般来说,重组促性腺激素)不能以“有效方式”获得,或者不能像天然ecg那样具有保证其体内生物活性的糖基化谱(hesser,2011)。这样,挑战就在于开发一种生产系统,所述系统表现出高生产率以获得满足高需求的足够数量的recg(因为激素用于不同类型的牲畜),并且因此降低生产成本,这是重组激素是否在市场上繁荣的限制因素。wo2017112987a1_2017描述了dhfr-mtx基因扩增系统的用途,所述系统获得了18iu/ml的产量(在无血清培养基中)。相对于当前的pmsg生产过程,这一数值还无法实现盈利过程。
附图说明
8.图1是组装第三代慢病毒颗粒来获得recg生产重组cho-k1细胞系的示意图。
9.图2示出了sds-page及随后的蛋白质印迹,其中使用特异性抗recg抗体评估了来自recg生产细胞系的上清液中的recg的浓度。
10.图3示出了sds-page及随后的蛋白质印迹,其中评估了预选的recg生产克隆的“表观”生产率。
11.图4是比较在1l生物反应器中培养p5c3克隆时的活细胞浓度、活力、乳酸盐和葡萄糖浓度随时间变化的图表。示出了每天的温度和灌注速率。(
↓
)表示生物反应器的放流(bleeding)。
12.图5是通过sds-page、rp-hplc和sec-hplc对(a)rp-hplc后的pmsg分子、(b)recg rp-hplc和(c)recg hic进行的结构表征和纯度分析。
13.图6示出了同工型谱分析。(a)ief及随后的通过胶体考马斯蓝进行的染色。分别比较了pmsg变体(商业制剂a,foli-g)和来自细胞系和克隆的captob recg洗脱液的同工型
谱。(b)分别进行了pmsg(商业制剂a,foli-g)和来自细胞系和克隆的captob recg洗脱液的ief及随后的蛋白质印迹。(c)ief及随后的通过胶体考马斯蓝进行的染色。分别比较了pmsg(商业制剂b,novormon)、recg rp-hplc和recg hic变体的同工型谱。
14.图7示出了pmsg、recg rp-hplc和recg hic在磷酸钠缓冲溶液中的荧光发射光谱。
15.图8示出了缺口箱线图,其中示出了neu5ac含量(mol/mol蛋白质)的显著差异。
16.图9通过wax-hplc对pmsg、recg rp-hplc和recg hic进行的2-ab标记的n-聚糖分析。n-聚糖根据其电荷进行分离。
17.图10.比较的妊娠率。
技术实现要素:
18.本发明描述了一种用于获得表达重组马绒毛膜促性腺激素(recg)的哺乳动物细胞系的方法,其包括以下步骤:
19.a.提供recgα和β亚基的编码序列,所述编码序列针对它们在哺乳动物细胞中的表达进行了优化;
20.b.将所述编码序列引入慢病毒表达载体;
21.c.生产含有recg编码序列的慢病毒;
22.d.用所述慢病毒转导哺乳动物细胞;
23.e.选择最合适的哺乳动物细胞克隆来生产recg。
24.所述重组细胞系表现出无血清培养基中的至少100iu/ml的recg产量。
25.在本发明的一个优选实施例中,所述方法的步骤a.使用分别与seq id no:1和seq id no:2的那些α和β序列基本上相似的亚基序列。在步骤b.中,慢病毒载体由含有ef-1α启动子的plv载体组成。步骤c.涉及使用阳离子脂质作为媒剂,用prev、pvsvg、pmdl、plv-recgα和plv-recgβ质粒瞬时转染hek293细胞。步骤d.涉及转导cho-k1细胞。
26.在一个替代方式中,本发明的方法涉及进行两个连续的转导事件。
27.本发明的另一个目的是提供一种哺乳动物细胞系,所述细胞系通过前述方法获得并且含有编码重组马绒毛膜促性腺激素(recg)激素的核酸,其中recgα和β亚基的所述编码序列包括与seq id no:1和seq id no:2基本上相似的序列。优选地,所述哺乳动物细胞系是cho-k1并且表现出至少100iu/ml的recg产量。
28.本发明的另一个目的是提供一种用于生产重组马绒毛膜促性腺激素(recg)激素的方法,其包括以下步骤:
29.a.在生物反应器中在胎牛无血清培养基中培育所述哺乳动物细胞系,以大规模生产所述recg
30.b.收获所述上清液,和
31.c.纯化。
32.这种生产方法得到了无血清培养基中的至少100iu/ml的recg生产率。
33.在本发明的一个优选实施例中,所述步骤a.涉及在含有50%商业excel302培养基和50%磷酸盐缓冲盐水的无血清培养基中培育。在所述步骤c.中,纯化包括染料伪亲和色谱。优选地,所述染料伪亲和色谱使用captoblue-琼脂糖基质。可替代地,所述纯化步骤c.由切向流过滤和随后的recg浓缩组成。
34.任选地,所述纯化方法还囊括使用c4柱的hplc纯化步骤。
35.通过所述生产方法获得的所述recg包括至少6000iu/mg的比活性(作为与通过elisa确定的蛋白质质量相关的体内效价单位)。
36.本发明的另一个目的包括一种编码可通过所描述的生产方法获得的所述recgα亚基的核酸,其包括与seq id no:1基本上相似的序列。它还包括一种编码具有与seq id no:2基本上相似的序列的recg的所述β亚基的核酸。
37.本发明的另一个目的是一种可通过所描述的生产方法获得的recg激素,其包括具有至少3%中性结构和至少3%四唾液酸化结构的糖基化谱。优选地,所述recg包括具有至少3%中性结构、26至30%单唾液酸化结构、50至55%双唾液酸化结构、8至15%三唾液酸化结构和至少3%四唾液酸化结构的糖基化谱。
38.本发明的另一个目的是一种药物调配物,其包括治疗有效量的本文描述的recg。在一个优选形式中,所述调配物是液体,并且优选地在5℃下保持冷藏而无需冷冻用于商业化。在一个替代形式中,所述调配物是冻干的。在一个优选形式中,所述调配物进一步包括糖、防腐剂、抗氧化剂、甘露醇和抗聚集剂。优选地,所述调配物包括柠檬酸三钠二水合物、柠檬酸一水合物、精氨酸、蔗糖、甘露醇、l-甲硫氨酸、泊洛沙姆188、间甲酚和水。
39.本发明的另一个目的是一种用于在动物中诱导排卵的方法,其包括按至少140iu/动物施用recg。其中所述剂量的所述施用在其应用之后48小时诱导排卵。
具体实施方式
40.本发明描述了一种用于获得表达重组马绒毛膜促性腺激素(recg)的哺乳动物细胞系(克隆)的方法,其涉及以下步骤:
41.a.提供recgα和β亚基的编码序列,所述编码序列针对它们在哺乳动物细胞中的表达进行了优化
42.b.将所述编码序列引入慢病毒表达载体
43.c.生产含有recg编码序列的慢病毒
44.d.用所述慢病毒转导哺乳动物细胞
45.e.选择最合适的哺乳动物细胞克隆来生产recg
46.通过本发明中描述的方法获得在生物反应器中在无血清培养基中大规模生产至少100iu/ml的细胞克隆。
47.用于获得recg生产哺乳动物细胞系的方法的主要特性之一是它利用了编码recg的创新且优化的dna序列。所述序列已被修饰和优化以在哺乳动物cho细胞中表达。优选cho-k1。所述recg包括至少一个α亚基和一个β亚基,因此两个亚基的编码dna序列均已被优化。每个亚基的所述编码序列与序列seq id no:1(α)和seq id no:2(β)基本上相似或相同。
48.每个亚基的这些编码序列在其核苷酸中包括小的修饰,使其最适合cho-k1细胞的转录、翻译和翻译后机制。在优化之后观察到,ecgβ亚基的重组序列与未优化的β亚基序列(“天然”ecgβ)的同源性为82.2%,而关于不同专利中公布的其它重组序列的同源性较低(78%)。据观察,我们优化的重组序列中与天然序列的残基和其它专利中公布的优化的序列的残基不同的那些核苷酸位置对应于总数的4%。相对于现有技术中报道的那些,这一百
分比足以作为获得更高水平的recg表达的决定因素。
49.本发明的获得recg生产哺乳动物细胞系的方法通过使用第三代慢病毒载体作为遗传物质转移工具获得了稳定的recg生产细胞系。所使用的慢病毒载体是含有ef-1α启动子的plv。携带每个亚基的每个编码序列的载体被称为plv-recgα和plv-recgβ。此外,所述plv含有嘌呤霉素抗性基因的编码区作为选择标志物。
50.为了生产慢病毒颗粒,本发明描述了使用阳离子脂质作为媒剂,用质粒prev、pvsvg、pmdl、plv-recgα和plv-recgβ瞬时转染hek293细胞。一旦获得了慢病毒颗粒,使用它们来转导哺乳动物细胞(步骤d)。优选地,所述哺乳动物细胞是cho-k1细胞。优选地,所述过程包括两次连续的转导。
51.本发明的另一个目的包括一种哺乳动物细胞系,其具有编码重组马绒毛膜促性腺激素(recg)的核酸作为其基因组的一部分,其中所述recg的α和β亚基的编码序列包括与seq id no:1和seq id no:2基本上相似的序列。这些细胞通过本发明的获得recg生产哺乳动物细胞系的方法开发。优选地,所述细胞系是cho-k1。本细胞系(克隆)在无血清培养基中生产至少100iu recg/ml。
52.本发明的另一个目的是提供一种用于生产重组马绒毛膜促性腺激素(recg)激素的方法,其特征在于因为其包括以下步骤:
53.d.在生物反应器中在无血清培养基中培育所述哺乳动物细胞系(克隆),以大规模生产所述recg
54.e.收获上清液,和
55.f.纯化。
56.本发明的生产重组马绒毛膜促性腺激素(recg)的方法实现了无血清培养基中的至少100iu/ml的产量。这些高生产水平由于几种因素。首先,对于用本发明的序列seq id no:1和seq id no:2转化的细胞系的高recg生产率,所述细胞系已经针对在牛无血清培养基中培育另外适应和优化。生产所使用的培养基为mc02培养基,其包括50%商业excel302培养基和50%盐、氨基酸、碳水化合物等的组合,如表2中所描述。
57.另一个重要因素是纯化步骤。现有技术描述了复杂且昂贵的纯化过程,这使最终产品更加昂贵。本发明的生产重组马绒毛膜促性腺激素(recg)的方法结合了包括染料伪亲和色谱的纯化步骤。在一个优选实施例中,用于执行所述色谱的基质是captoblue-琼脂糖基质。任选地,可以添加使用c4柱的额外的hplc纯化步骤。
58.作为通过染料伪亲和色谱纯化的一个替代方案,所述纯化步骤包括切向流过滤步骤和随后的recg浓缩步骤。
59.通过本发明的生产重组马绒毛膜促性腺激素(recg)的方法,可以获得具有至少6000iu/mg的比活性(作为与通过elisa确定的蛋白质质量相关的体内效价单位)的recg。
60.本发明的另一个目的包括一种编码可通过本发明中描述的方法获得的recgα亚基的核酸。所述recg的所述α亚基包括与seq id no:1基本上相似的序列。
61.本发明的另一个目的包括一种编码可通过本发明中描述的方法获得的recgβα亚基的核酸。所述recg的所述β亚基包括与seq id no:2基本上相似的序列。
62.在本发明的一个优选实施例中,与seq id no:1基本上相似的所述序列是指所述序列与seq id no:1的序列具有至少90%同一性。
63.在本发明的一个优选实施例中,与seq id no:1基本上相似的所述序列是指所述序列与seq id no:1的序列具有至少95%同一性。
64.在本发明的一个优选实施例中,与seq id no:1基本上相似的所述序列是指所述序列与seq id no:1的序列具有至少98%同一性。
65.在本发明的一个优选实施例中,与seq id no:2基本上相似的所述序列是指所述序列与seq id no:1的序列具有至少90%同一性。
66.在本发明的一个优选实施例中,与seq id no:2基本上相似的所述序列是指所述序列与seq id no:1的序列具有至少95%同一性。
67.在本发明的一个优选实施例中,与seq id no:2基本上相似的所述序列是指所述序列与seq id no:1的序列具有至少98%同一性。
68.通过将比较窗口中匹配部分的数量除以比较窗口中的位置的总数并乘以100来计算同一性百分比。同一性使用blast和blast 2.0算法来进行(参见例如altschul等人,1990,《分子生物学杂志(j.mol.biol.)》215:403-410和altschul等人,1997,《核酸研究(nucleic acids res.)》25(17):3389-3402)。
69.本发明的另一个目的包括一种可通过本发明的生产重组马绒毛膜促性腺激素(recg)的方法获得的recg激素。所述recg激素包括具有至少3%中性结构和至少3%四唾液酸化结构的糖基化谱。优选地,所述激素包括具有至少3%中性结构、26至30%单唾液酸化结构、50至55%双唾液酸化结构、8至15%三唾液酸化结构和至少3%四唾液酸化结构的糖基化谱。
70.本发明的另一个目的包括一种药物调配物,其特征在于其包含治疗有效量的本发明的recg。在一个实施例方面,所述调配物是冻干的。在另一个实施例中,所述药物调配物是液体。本发明的药物调配物进一步包括糖、防腐剂、抗氧化剂、甘露醇和抗聚集剂。所述液体药物调配物进一步包括柠檬酸三钠二水合物、柠檬酸一水合物、精氨酸、蔗糖、甘露醇、l-甲硫氨酸、泊洛沙姆188、间甲酚和水。
71.本发明的另一个目的包括一种用于在动物中诱导排卵的方法,其涉及按至少140iu/动物施用可通过本发明的生产重组马绒毛膜促性腺激素(recg)的方法获得的recg。本方法设法在其应用之后48小时诱导排卵。
72.对于recg的生产,本发明解决了与从妊娠母马血液获得的激素(pmsg)的使用相关的所有缺点以及迄今为止描述的所有重组选项所呈现的那些缺点,所述重组选项均未进入兽医市场:
[0073]-用于生产本发明中描述的recg的过程取代了使用动物来获得激素,从而消除了完全违背社会要求的生物伦理和安全标准的动物的残忍遭遇;
[0074]-在本发明中获得和描述的recg是更高质量的产品,其来源于动物细胞在生物反应器中在无血清培养基中的培育,这允许了生产过程的标准化。因此,培养参数和纯化程序都易于控制和重现(与使用动物宿主时不同),从而得到批次间一致性更高的产品(recg),其不含来自动物血浆的污染物,并且因此从卫生角度来看更安全;
[0075]-本发明中描述的方法允许获得表现出体内fsh/lh活性的recg激素,这与文献中描述的使用其它类型的细胞宿主的其它技术不同,所述其它技术不允许获得表现出体内活性的重组激素;
[0076]-需要更少量的本发明中获得和描述的recg的国际单位来治疗动物。由于本发明的recg更有效,针对iatf,瘤牛(bos indicus)只需要100iu/动物,而普通牛(bos taurus)只需要140iu/动物,而不是使用从妊娠母马获得的pmsg时分别需要的300iu和400iu。此外,针对sov,瘤牛只需要1000iu,而普通牛只需要2000iu,而不是使用从母马获得的pmsg时分别需要的2000iu和4000iu;
[0077]-在按每只动物140iu recg进行治疗之后,85%的病例恢复了乏情牛的周期性,而pmsg治疗之后的成功率为65%。这是非常重要的,因为这些身体状况非常低的动物只会由于激素对卵巢的作用而进入周期性状态。如果不存在激素,则动物保持非周期状态(处于乏情期),并且因此代表非生产性动物;
[0078]-实现了更有效的动物同步。这极大地促进了它们在固定时间人工授精(ftai)和超排卵(sov)方案中的使用。针对ftai用本发明的recg治疗的所有母牛在施用之后48小时排卵,而经pmsg治疗的母牛在施用之后50至60小时排卵。让授精-妊娠程序的固定时间有效且可盈利,这对于牲畜管理至关重要,因为有数百头母牛需要治疗。这样,“早上”治疗的母牛可以在两天后的同一时间受精;
[0079]-与在动物细胞中获得的其它pmsg替代物,例如cho dg44(其似乎表现出合格的糖基化谱)相比,本发明允许获得具有迄今为止描述的最高生产率的recg。这样,本发明克服了阻碍市场上存在激素的重组形式的主要限制性缺点:本发明是能够以低成本生成大量具有生物活性的recg的技术。高生产率以及低成本无血清培养基的使用有助于降低本发明的方法的总成本。使用高回收率单步纯化方法获得的recg或通过初始样本的单次切向流过滤和浓缩程序获得的产物均表现出合格的糖基化谱,并且因此在大鼠、母牛和猪中表现出体内生物活性;
[0080]-获得了recg液体调配物,其随时间稳定并且因此优于由冻干或冷冻液体调配物组成且具有由此带来的所有缺点的现有市售产品。
[0081]
接下来,将描述为获得和执行本发明的每个目的而进行的测定的实例。应当注意,这些实例是为了说明而并非旨在限制本发明的保护范围。
[0082]
实例
[0083]
实例1-编码序列设计和优化
[0084]
本发明中开发的技术首先涉及哺乳动物细胞系的开发,特别是悬浮cho-k1细胞(中国仓鼠卵巢细胞),其生产重组马绒毛膜促性腺激素(recg)。recg的α和β亚基(recgα和recgβ)的编码序列针对在cho-k1细胞中的表达进行了优化,以获得高水平的mrna,并且因此最大化了编码蛋白质的表达。基因优化利用了遗传密码的简并性,由此蛋白质可以由各种替代遗传序列编码。由于每个生物体中的密码子使用不同,这可能会在异源宿主中表达重组蛋白方面产生缺陷,从而导致表达非常低。因此,基因优化算法允许对dna序列进行多参数优化,涵盖基因表达的多个方面:mrna的转录、剪接、翻译和降解,以实现给定蛋白质的最有效表达。
[0085]
在优化之后观察到,ecgβ的重组序列与未优化的β亚基(“天然”ecgβ)的序列的同源性为82.2%,而与本发明的背景技术部分中提及的其它重组序列的同源性较低(78%)。据观察,本发明的优化的重组激素上的编码序列中与天然序列的残基和现有技术中公布的优化的序列的残基不同的那些核苷酸位置对应于总数的4%,相对于其它专利中报道的那
些,这足以作为获得更高水平的recg表达的决定因素。
[0086]
合成序列作为dna获得,然后分别克隆到p-α_ecg(ampr)和p-β_ecg(ampr)载体中。这些载体含有细菌复制起点(col e1起点),它允许质粒扩增到大肠杆菌和氨苄青霉素抗生素抗性基因(ampr)。载体p-ecgα具有3000bp并含有360bp ecgα编码序列,其中前72bp编码天然ecgα信号肽。p-ecgβ载体含有3200bp并包含507bp ecgβ编码序列,所述序列在本序列的开头包括60bp长的信号肽。
[0087]
实例2-表达载体构建
[0088]
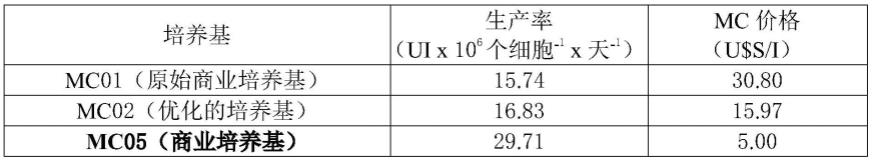
为了获得稳定的recg生产细胞系,构建了第三代慢病毒载体作为遗传物质递送方法。出于此目的,首先需要在慢病毒转移载体中克隆每个亚基的编码序列,然后执行慢病毒颗粒(lp)的组装及其随后的滴定。
[0089]
构建了编码recg的α和β亚基的慢病毒表达载体。因此,含有α亚基的载体用xbal/ecorv酶消化以释放recgα编码序列,所述序列被克隆到慢病毒质粒载体plvenhcef的nhel/ecorv位点中。含有β亚基的载体用bamhi/ecorv酶消化以释放recgβ编码序列,所述序列被克隆到plvenhcef载体的bamhi/smal位点中。在我们的实验室中开发的这种载体包含ef-1α启动子作为表达调节元件,其特征在于多种动物细胞中的高表达水平。它还包含来源于cmv增强子序列的表达刺激片段和作为选择标志物的嘌呤霉素抗性基因的编码区。所生成的质粒被原核细胞(大肠杆菌)扩增,在振荡条件下培养,并通过有机溶剂萃取和沉淀进行纯化。所选择的大肠杆菌克隆的测序证实了质粒plvenhcef-recgα和plvenhcef-recgβ中克隆的dna片段的同一性,表明分别与合成ecgα和ecgβ基因的序列具有100%同源性。
[0090]
为了生产第三代慢病毒颗粒,用四种质粒对hek293细胞(包装细胞)执行瞬时转染:prev、pglyco-g、pmdl(包装质粒)和转移载体plvenhcef-recgα和plvenhcef-recgβ(编码每个recg亚基))。出于此目的,阳离子脂质被用作dna载体。转染后30小时收获含有慢病毒颗粒的上清液,以65.000g离心浓缩并在80℃下储存直至使用(图1)。
[0091]
使用quicktiter
tm
慢病毒滴度试剂盒(细胞生物实验室公司(cell biolabs inc.))进行慢病毒颗粒滴定。这种试剂盒被设计用于仅检测慢病毒相关的hiv-1p24核心蛋白,因此,上清液中残留的游离蛋白不会干扰测定。因此,获得的recgα和recgβ的物理滴度分别为2.7x109lp/ml和2.1x109lp/ml,这可以分别近似于转导滴度5.0x106和3.9x106tu/ml的,从而产生用于转导cho-k1细胞的高滴度。
[0092]
实例3-细胞系生成
[0093]
使用所获得的慢病毒颗粒在悬浮液中生成recg生产重组cho-k1细胞系。总共进行了两个连续的转导事件(td1和td2),因为细胞没有存活到第三个转导事件。通过与增加浓度的嘌呤霉素一起孵育,使所转导的细胞系经受选择性压力。这种策略使种群中富含对较高浓度抗生素具有抗性的细胞,从而提高了整个细胞系的生产率。图2示出了sds-page测定及随后的使用特异性多克隆抗recg抗体的蛋白质印迹。可以观察到,对于相同的细胞密度,在scho td2(200)细胞系的上清液中获得了最高的recg浓度(其对至多200μg嘌呤霉素具有抗性)。
[0094]
随后,通过确定上清液中累积的激素浓度以及一段时间后的初始和最终细胞密度来评估所生成的细胞系的recg生产率。使用在我们的实验室中开发的竞争性elisa进行recg量化。所述测定涉及固相固定抗原(recg)与相同抗原(参考recg或未知样本)的溶液针
对与特异性兔抗recg抗体(pab抗recg)结合的竞争。这些抗体是在我们的实验室中先前获得的。随后,加入过氧化物酶缀合的二抗以检测残留的固相结合复合物。不同细胞系的生产率总结于表1中。
[0095]
表1.实验室规模生成的细胞系的recg比生产率
[0096]
细胞系生产率(μg x 106个细胞-1
x天-1
)scho td10.37scho td1(5)0.32scho td20.96scho td2(200)0.78
[0097]
考虑到这些结果,选择了最高recg生产细胞系(recg td2细胞系)进行克隆。
[0098]
实例4-克隆分离
[0099]
所生成的细胞系的recg生产率允许选择其中之一,从而获得具有合格的生长谱和高recg生产率的单细胞克隆。
[0100]
为了选择具有最高recg表达水平的克隆,使用特异性抗recg抗体在初始斑点印迹筛选中评估了多于400个克隆。所选择的克隆被冷冻保存。在减少待分析的克隆数量的预选步骤之后,通过sds-page及随后的蛋白质印迹来评估所选择的克隆的“表观”生产率(其被确定为针对每个克隆的相同细胞密度获得的recg的浓度)(图3)。这种分析显示,克隆p5d9(泳道3)和p5c3(泳道4)表现出最高的recg表达水平。随后,通过确定上清液中累积的激素浓度以及一段时间后的初始和最终细胞密度来评估所选择的克隆的recg生产率。recg浓度通过上述竞争性elisa确定。p5d9和p5c3克隆的估计生产率分别为0.80和0.81μg x 106个细胞-1
x天-1
。最后,选择了p5c3克隆,因为它呈现出比p5d9克隆更好的生长性能。
[0101]
实例5-优化培养条件以实现最佳糖基化
[0102]
5.1p5c3克隆在一升生物反应器中在无血清培养基中的高密度培养
[0103]
在一升生物反应器中在胎牛无血清培养基(mc01)中以灌注模式培养p5c3克隆27天。培养以7.8x105个细胞.ml-1
的细胞密度开始,并表现出指数增长,没有滞后期,直到达到1.6x107个细胞.ml-1
的最大细胞密度。细胞活力高于94%。灌注速率在培养的第三天开始,每天在0.21和1.00反应器体积之间变化。乳酸盐浓度保持在1.1g.l-1
(12.2mm)以下(图4)。克隆的比生长率为0.013小时-1
。
[0104]
之后,调配了一种新的生产培养基(mc02)。重要提示:这种培养基的组合物通过将商业培养基与盐、氨基酸、碳水化合物等组合而得到(表2)。这样做是为了优化培养基成本,将其价值降低50%。
[0105]
这种新的组合物没有改变细胞的生产率,也没有改变分子的任何特性。
[0106]
表2.培养基(mc02)组合物
[0107] g.l-1
excell 30210.5碳酸氢盐1.6谷氨酰胺0.5825葡萄糖2.25nacl4.41
kh2po40.304na2hpo40.32泊洛沙姆1880.5
[0108]
5.2 p5c3克隆在50升生物反应器中在无血清培养基中的高密度培养
[0109]
生产规模的培养。在一升生物反应器中培养细胞之后,缩放至50升生物反应器,重现实验室规模测试的细胞培养参数。由于灌注速率为每天一个反应器体积,因此在这一发酵过程中获得了50l收获物,其中每一种含有157iu/ml recg。考虑到一个剂量的本发明的recg由140iu组成并且收获了50,000ml含有157iu/mil的上清液,在24小时内总共获得了7,850,000iu。因此,本发明的生产方法以生产规模(50l)每天生成约56,000剂量的recg。由此,以生产规模获得了超过一剂量/ml的收获物。将这些结果与当前的生产方法(从妊娠母马提取)进行比较,在50l生物反应器中开发的培养条件代表约600匹母马。换言之,本发明中报道的技术在25-30天的生物过程中(包含培养、纯化、调配、包装)可以在200天内生产与600头妊娠母马相同的剂量[假设所有母马在其血液中具有相同的ecg浓度并且从每匹母马获得的ecg具有相同的质量(这是不可能的)]。
[0110]
此外,在具有不同成本的不同培养基中计算了生产规模(50l生物反应器)上的p5c3克隆的recg生产率(表3)。这些培养基包含原始商业培养基(mc01、ex-cell 302)、优化的mc02培养基(先前描述)和mc05培养基。在这最后一种培养基中,获得了更高的生产率,与其它作者公布的结果相比有更大的差异,而且成本也更低。
[0111]
表3.p5c3克隆在50l生物反应器中在不同培养基中的recg生产率和每种培养基的成本。
[0112][0113]
培养基01(mc01):ex-cell cho 302
[0114]
培养基02(mc02):mp01/p2g 50/50(mp 02)优化的培养基
[0115]
培养基05(mc05):bhk-21cd生产培养基
[0116]
在专利申请wo2017112987中,他们使用了dhfr-mtx基因扩增系统。他们没有报道生产率,而是报道了在不存在mtx的情况下适应生长之后的recgβα表达的动力学。通过阅读所述文件,获得了以iu/ml为单位的recg的近似累积值,对于在存在胎牛血清的情况下培养的细胞系,所述值为10iu/ml(24小时)、20i iu/ml(48小时)和28iu/ml(72小时),并且对于在不存在胎牛血清的情况下培养的细胞系,所述值为5iu/ml(24小时)、10iu/ml(48小时)和18iu/ml(72小时)。
[0117]
与这些结果相比,本发明中获得的细胞克隆在不存在胎牛血清的情况下在72小时内小规模生产了45.6iu/ml(p5d9)和50.2iu/ml(p5c3),而在生物反应器中的连续灌注模式下,实现了大于15iu x 106个细胞-1
x天-1
的生产率水平。这对应于24小时内的157iu/ml,代表了比专利wo2017112987中报道的值显著更高的值(他们所报道的是在不存在胎牛血清的情况下24小时内的5iu/ml)。这意味着每天生产超过7,000,000iu,代表每天超过50,000剂
量的本发明的recg。
[0118]
这样,本发明的技术允许获得迄今为止报道的最高生产率和生产值,这是由于我们技术的独特因素的结合:用于在cho-k1细胞(灰仓鼠物种)中表达的序列的优化、我们自己的第三代慢病毒载体的使用、以及cho-k1细胞系的使用,所述细胞系表达多种糖基转移酶,除了生成单唾液酸化和双唾液酸化的粘蛋白型o-聚糖外还能够将双唾液酸化、三唾液酸化和四唾液酸化复合型n-聚糖添加到多肽,这些都是ecg表现出体内生物活性的关键因素。
[0119]
事实上,独特的dna序列优化过程对于实现高激素表达是有效的,这一点可通过蛋白质的天然dna序列中有4%核苷酸已经被修饰并且它们在其它专利报道的合成序列中没有改变所证明。
[0120]
实例6-纯化
[0121]
6.1-第一纯化步骤
[0122]
在生物反应器中在excell 302(西格玛(sigma))无血清培养基中培养cho细胞之后,采用收获材料来开发第一捕获纯化步骤。因此,选择了染料伪亲和色谱,采用captoblue-琼脂糖树脂填充在xk柱(ge医疗(ge,healthcare))中并在20mm tris-hcl缓冲液ph 7中平衡。将未经前处理的澄清收获物加载到树脂上,使用流速为153.06厘米/小时,总保留时间为五分钟。在用相同的平衡溶液进行洗涤步骤之后,使用等度梯度(tris-hcl缓冲液ph 8、2m nacl、20%(v/v)乙醇)洗脱蛋白质。在第一色谱的加载和洗涤步骤期间没有观察到激素泄漏,因此加载条件是合格的。回收的完整激素的纯度水平明显高于从妊娠母马血清(pmsg)部分纯化获得的纯度水平。因此,优化了细胞培养上清液的recg捕获步骤,采用染料伪亲和树脂。由于回收率为98%(通过elisa和rp-hplc评估),因此在没有任何蛋白质损失的情况下实现了高产率。
[0123]
6.2-第二纯化步骤
[0124]
选择疏水相互作用色谱法作为第二纯化步骤,因为来自第一捕获步骤的部分纯化的激素(命名为post-blue)在高离子强度条件(2m nacl)下洗脱。为了减少操作单元的数量并降低整体纯化过程的成本,提出了以下策略:1)加载“粗洗脱液”,即没有预处理的post-blue级分,从而避免透滤步骤(因为这种馏分处于高离子强度条件中);2)筛选我们实验室可提供的两种类型的疏水配体:苯基和丁基;3)评估针对柠檬酸/柠檬酸盐缓冲液ph 6.0透滤的洗脱液,因为这是调配post-blue api(命名为fd1recg)的条件;和4)采用不同盐评估纯化性能:首先,用nacl(因为它是post-blue缓冲液中存在的一种盐),然后用na2so4,最后用(nh4)2so4(因为这是具有最高疏水作用的盐)。考虑到所有策略的纯化性能(回收率和纯度),最佳条件如下:将df1reg加载到丁基琼脂糖4ff树脂上,流速为15厘米/小时,总保留时间为三分钟。为了改善蛋白质和配体之间的疏水相互作用,树脂用50mm柠檬酸/柠檬酸盐缓冲液ph 6.0、2m(nh4)2so4平衡,并且样本(df1reg)采用相同的平衡缓冲液进行处理。此后,进行了两个洗涤步骤:第一个洗涤步骤使用与平衡步骤中所采用相同的缓冲液,而第二个洗涤步骤使用具有较低离子强度的缓冲液(50mm柠檬酸/柠檬酸盐缓冲液ph 6.0、1.5m(nh4)2so4)以去除杂质。最后,采用50mm柠檬酸/柠檬酸盐缓冲液ph 6.0、0.5m(nh4)2so4进行等度洗脱。
[0125]
实例7-调配物
[0126]
7.1-最终产品的液体调配物
[0127]
7.1.1-应用qbd工具开发recg液体调配物
[0128]
通过本发明,开发了一种recg液体调配物,其允许获得稳定的并且因此具有活性的液体形式的激素。这样,可以避免代表了更详尽和更高成本的单元操作的冻干程序。因此,获得液体调配物而不是冻干调配物,不仅保证了降低成本,而且减少了生产过程周期,从而避免了冻干产品的复原步骤。此外,在使用多剂量呈现的情况下,可以对所需的量进行拆分,从而确保其在使用期间的长期稳定性。
[0129]
7.1.1.1-调配前测定-确定影响液体调配物中的recg稳定性的重要因素
[0130]
对于通过captoblue-琼脂糖色谱纯化的recg的热强制降解研究,温度在20和70℃之间进行修改,采用的ph范围在3.0和8.0之间。将样本在热循环仪中在每种条件下加热十分钟,并在-70℃下储存直至分析。然后,在非还原性sds-page中评估每种条件下的recg等分试样,随后进行考马斯亮蓝染色以可视化recg解离程度。sds-page中的迁移率谱的差异指示ph对recg异二聚体稳定性有影响。在高温下孵育的对应于低ph范围(ph 3.0到5.0)的样本与对应于更具碱性的ph范围(ph 6.0到8.0)的样本表现出不同的条带模式。并行地,评估发射(荧光)谱(激发:274nm)以分析可能的构象变化。观察到经受较高温度和较低ph值的那些样本发生红移。红移可能与较高的变性蛋白质模式或天然构象的丧失相关。考虑到这些结果,并且出于减少化学降解过程(主要是脱氨和氧化,其在中性ph下影响较小)的目的,将最佳ph范围确定在5和7之间。同样,由于蛋白质的pl(等电点)接近3.5到5.5(根据ief测定),因此在5和7之间的ph范围内工作将保证蛋白质表现出负净电荷,从而减少如聚集等物理降解事件(与在接近recg的pl的ph值下可能发生的情况相反)。
[0131]
7.1.1.2-调配物测定
[0132]
生物治疗性蛋白质生产过程中的主要挑战之一是获得保证高蛋白质质量和稳定性的调配物。通过将实验设计(doe)与简单的分析技术和加速稳定性测定相结合,获得了一种液体调配物,其允许在加速条件(25℃、60%相对湿度,rh)下保持recg(完整、具有活性的recg)的98%生物效价至多六个月(camevet,2012)。
[0133]
采用placket-burman设计(pbd)来确定加速条件下(25℃、60%rh,七天)下几种因素对recg稳定性的影响。在中心点进行了十二次实验,一式三份,以研究n=15(实验次数)中的所述影响的标准偏差。评估了八个真实因素和三个哑变量(虚拟变量)对recg稳定性的影响。所分析的因素是:稳定剂(蔗糖、甘露醇、arg、l-met)和表面活性剂(泊洛沙姆188)的量、缓冲液的体积摩尔浓度和ph,以及api的浓度(recg剂量)。响应在于,通过确定通过rp-hplc技术评定的完整recg的曲线下面积(tr:13.58分钟)来分析在25℃、60%rh下储存七天之后的recg量(%)。
[0134]
采用帕累托图来确定影响因素。此后,应用anova检验来研究因素对响应的影响,并确认因素的显著影响。所获得的模型满足变量的正态性、同方差性和独立性假设。数据分析指示,在加速条件下影响recg稳定性的显著因素是缓冲液体积摩尔浓度(p:0.0013)、l-met(p:0.0171)、蔗糖(p:0.0044)和表面活性剂(p:0.0097)量。此外,r平方(0.8929)和经调整的r平方(0.8393)指示实验数据和拟合数据之间的关系良好。
[0135]
在recg液体调配物的优化阶段期间,进行了四因素(缓冲液体积摩尔浓度、蔗糖量、l-met和普朗尼克f-68)、五级中心复合设计(ccd)。执行了二十七次运行,并且响应再次
在于,通过rp-hplc分析在25℃、60%rh和40℃、75%rh下储存0、6、12、60、90、125和150天之后的recg量(%)。所分析的关键因素是缓冲液体积摩尔浓度、蔗糖、表面活性剂和抗氧化剂量。在所有调配物测试中,发现对recg稳定性没有显著影响的因素保持在恒定浓度水平。
[0136]
90天之后,观察到调配物之间的显著差异。因此,将27种调配物中的recg稳定性拟合为二次模型。所获得的层次模型满足变量的正态性、同方差性和独立性假设。此外,经调整的r平方(0.7238)指示实验数据和拟合数据之间的关系良好:r
aj
:0.8122;r
2aj
:0.7238;cv%1.53,失拟:0.1107(p《0.05即为显著)。
[0137]
获得了稳健的设计空间,并选择了最佳调配条件,其由70mm柠檬酸/柠檬酸盐缓冲液(ph 6.0)、161mm蔗糖、1.0mg/ml l-met和1.0mg/ml表面活性剂(加上5mm l-arg和5mg/ml甘露醇)组成。
[0138]
通过制备三个单独的调配物批次并评估在4℃、25℃、60%rh和40℃、75%rh下储存0、15、45和90天之后的稳定性,验证了这种预测recg液体调配物。90天之后,获得的完整recg量(通过rp-hplc,如由auc评定)在4℃、25℃/60%hr和40℃/75%hr下分别为125
±
3、125
±
1和94.6
±
0.2%,从而证明了所开发的液体调配物的稳健性。经验证的液体调配物经过长达150天的评估,在加速条件(25℃/60%rh)下获得了98
±
13%完整recg。
[0139]
7.2-冻干产品的调配
[0140]
稳定的溶液或调配物是确保降解程度、改变、聚集或生物活性损失可接受或可管控的溶液或调配物。在理想情况下,所述调配物必须在2-8℃下储存的六个月期间保留蛋白质初始效价的至少80%(us 7,740,884 b2)。这样,开发了一种固态赋形剂调配物,其含有盐作为缓冲剂,例如柠檬酸/柠檬酸盐,体积摩尔浓度低(10mm),ph为6.5。
[0141]
此外,固态冻干的成功涉及两个相互竞争的要求的平衡:在初级干燥期间不会塌陷的坚固饼状物的生成,和允许赋形剂和蛋白质之间相互作用的无定形状态的存在(jhonson等人,2001)。充当蛋白质稳定剂的赋形剂,例如蔗糖或海藻糖,表现得像无定形固体,而像甘露醇这样的赋形剂充当减少饼状物塌陷的结晶固体。因此,在本发明中,采用比例为4:1的甘露糖:蔗糖,其浓度分别为40g/l和10g/l。
[0142]
像糖蛋白激素这样的蛋白质易于氧化降解;因此,需要使用具有抗氧化性的化合物,例如一些氨基酸、如甲硫氨酸、螯合剂(例如,edta)或亚硫酸氢钠。此外,为了防止recg在小瓶的表面上吸附并减少空气-水界面中的蛋白质相互作用,采用了非离子表面活性剂(普朗尼克f68或泊洛沙姆p188)。在本发明中,分别采用0.1mg/ml和0.25mg/ml甲硫氨酸和泊洛沙姆p188。
[0143]
在理想情况下,复原饼状物中的recg量必须接近1,500iu/ml,最终体积与初始体积(3ml)相同。
[0144]
所述过程由以下组成:将调配物赋形剂与api混合,使用0.2-mm pes(聚醚砜)过滤器过滤,填充经适当洗涤和消毒的硼硅酸盐小瓶,(用橡胶塞密封),并根据现有技术进行冻干。
[0145]
实例8-生物化学和物理化学表征
[0146]
8.1方法
[0147]
recg通过在一升生物反应器中在无血清培养基中以灌注模式(biostat q plus,赛多利斯(sartorius))培养悬浮p5c3克隆来生产。然后,采用captoblue-琼脂糖色谱作为
捕获步骤纯化澄清上清液(sartobran-p 0.45μm,赛多利斯)。之后,为了获得更高纯度的蛋白质等分试样,评估了两个替代纯化步骤:
[0148]
a)反相高效液相色谱(rp-hplc)
[0149]
b)疏水相互作用色谱(hic)
[0150]
通过rp-hplc纯化的recg分子被命名为recg rp-hplc,而通过hic纯化的recg分子被命名为recg hic。
[0151]
foli-g,组维公司(zoovet sa)(阿根廷)和novormon,辛泰克(syntex)(阿根廷)的ecg商业制剂购自地区兽药店并用作内部参考标准品。分别为foli-g和novormon分配代码a和b。
[0152]
8.1.1-rp-hplc用于结构分析。rp-hplc用于评定生物效价
[0153]
通过梯度洗脱和uv检测(210nm),采用c4柱进行定性和定量研究。
[0154]
应用ejcr(椭圆联合置信区域)测试,证明了大鼠中的效价测定和通过rp-hplc技术如auc测量的完整recg之间的良好相关性。这里,应用了ejcr测试和双线性最小二乘(bls)回归方法。如果理想点(1,0)包含在椭圆中,则可以假设所述方法是准确的。这个椭圆区域由以二维图形绘制的数学方程来描述。椭圆尺寸与其它分析参数有关,如测定的精度。
[0155]
8.1.2-sds-page
[0156]
在整个本测定中,纯度和表观分子量在非还原条件下进行分析。进行比色检测(考马斯亮蓝)或免疫化学检测(蛋白质印迹)。对于蛋白质印迹分析,采用了我们的实验室生产的兔多克隆抗recg血清。
[0157]
8.1.3-等电聚焦(ief)
[0158]
为了分离蛋白质变体同工型,采用由电泳槽(multiphor ii)、冷却浴(multitemp iii)和电压源(eps3500xl)组成的设备进行ief。使用75%(w/v)3-5两性电解质和25%(w/v)5-7两性电解质(ge医疗)确定ph范围。通过考马斯蓝胶体染色或蛋白质印迹分析进行检测。
[0159]
8.1.4-尺寸排阻色谱(sec)-hplc
[0160]
recg变体和pmsg的纯度和同一性通过在tskgel g3000sw上执行的尺寸排阻色谱(sec)-hplc确定,粒径为10μm并进行uv检测。
[0161]
8.1.5-光谱荧光分析
[0162]
使用配备有氙气放电灯、monk-gillieson型单色器和门控光电倍增管的perkin-elmer ls-55发光光谱仪进行光谱荧光测量,所述门控光电倍增管连接到使用windows xp的amd sempron pc。
[0163]
8.1.6-高ph阴离子交换色谱及脉冲安培检测(hpaec-pad)
[0164]
通过对样本进行酸水解并随后使用配备有carbopac
tm
pa20柱(赛默飞世尔科技戴安(thermo fisher scientific dionex))的dionex ics-5000系统进行高ph阴离子交换色谱及脉冲安培检测(hpaec-pad)来确定唾液酸含量。采用n-乙酰神经氨(neu5ac)酸标准品(法国的凯尔生物化学(calbiochem))作为参考标准品。
[0165]
此外,通过对样本进行酸水解并随后使用配备有carbopactm pa20柱的dionex ics-5000系统进行hpaec-pad来确定纯化recg和pmsg聚糖中存在的中性单糖的类型和量。像样本溶液一样对单糖混合物标准溶液(cm-mono-mix-10,英国的卢德格尔(ludger))进行
处理,并使用其来标识和量化来源于糖蛋白样本的峰。
[0166]
8.1.7-n-聚糖分析
[0167]
8.1.7.1-变性条件下的酶促n-去糖基化
[0168]
为了从纯化样本中去除n-聚糖,采用pngase f试剂盒(生物实验室公司(biolabs inc.)),在变性条件下进行酶促消化。
[0169]
8.1.7.2-用于带电标记n-聚糖分析的弱阴离子交换色谱(wax)
[0170]
所释放的n-聚糖通过乙醇沉淀纯化并用2-ab荧光团标记。最后,为了分析蛋白质的中性结构、单唾液酸化结构、双唾液酸化结构、三唾液酸化结构和四唾液酸化结构的相对量,进行了弱阴离子交换(wax)色谱。
[0171]
8.2-结果
[0172]
8.2.1-样本制备
[0173]
采用染料伪亲和色谱(captoblue-琼脂糖,ge医疗)作为第一捕获步骤对在一升生物反应器(灌注模式)中培养的p5c3生产细胞克隆的澄清细胞培养物上清液进行纯化。此后,进行了两个替代色谱步骤:rp-hplc或hic(如先前所指示)。
[0174]
与两个商业分支的pmsg制剂相比,进行了生物化学和物理化学表征。
[0175]
在整个sec-hplc中,分析了不同分子的纯度。recg rp-hplc获得了90%的纯度,剩余的百分比可能对应于在rp-hplc纯化方法期间解离的异二聚体的α和β亚基。相反,通过hic纯化的recg分子呈现了55%的纯度,主要杂质为过量的游离α亚基(43%)。通过rp-hplc纯化的pmsg制剂表现出73%的纯度(图5)。
[0176]
在整个sds-page、sec-hplc(图5)和ief(图6)中,可以确定不同制剂的表观分子量和同工型谱。通过sds-page和sec-hplc分析,商业pmsg的分子量分别为67和66kda;而通过sds-page和sec-hplc分析,重组变体分别呈现出45kda和46kda的分子量。重组和商业pmsg制剂均表现出复杂的等电聚焦模式,具有多种低等电点的糖型。然而,尽管两种激素共享相当数量的同工型,但pmsg表现为较高比例的糖型集中在ph更偏酸性的区域中(对于novormon而言,这种影响更为显著),而重组变体呈现为更广泛的同工型分布在整个ph范围内。
[0177]
纯化pmsg制剂呈现的tr等于12.954分钟,而对于通过rp-hplc和hic纯化的recg,纯化重组变体表现出的tr分别等于13.583和13.747分钟(图5)。三种分子的疏水性的这些差异可能与聚糖结构的差异有关,例如唾液酸含量,因为它们是为蛋白质赋予电荷的主要结构之一。
[0178]
8.2.2-光谱荧光分析
[0179]
因为荧光谱对局部结构环境中的扰动极为敏感,所以它提供了简单而有力的证据,支持给定蛋白质的不同批次之间的高度结构相似性。此外,它可以为产品可比性和生物相似性提供有用的见解(houde等人,2015)。通过不同制剂的发射谱评定的结构构象表明了差异,所述差异不仅存在于它们的最大峰上,而且存在于它们的光谱曲线上。这些结果应指示不同制剂的构象差异(图7)。
[0180]
8.2.3-hpaec-pad
[0181]
通过使用dionex系统的hpaec-pad(高性能阴离子交换色谱及脉冲安培检测),评估了唾液酸含量(neu5ac)。pmsg(a,foli-g)、pmsg(b,novormon)、recg rp-hplc和recg-hic
的neu5ac含量分别为9.4(n=1);18
±
4(n=12);7
±
1(n=11)y 7
±
2(n=11)neu5ac mol/蛋白质mol。这些结果与通过rp-hplc和ief测定获得的结果相关。非参数统计测试(情绪中位数)允许确定不同制剂的唾液酸含量之间的显著差异(p:0.00048)。如图8中可见,缺口箱线图示出了95%置信水平上的重组激素和pmsg(b,novormon)之间的显著差异。
[0182]
尽管pmsg制剂表现出比重组变体更高的唾液酸含量,但pmsg和重组形式表现出的唾液酸:半乳糖比例几乎相同,因为三种激素的唾液酸和半乳糖残基的比例相似(pmsg(b,novormon)、recg rp-hplc和recg-hic的gal含量分别为18
±
0.9(n=2);4.7
±
0.1(n=2)y6
±
0.6(n=2)gal mol/蛋白质mol)。因此,这是可能有利于减少从循环中去除recg、减少肾小球过滤并因此使recg在靶动物物种中发挥其生物作用的属性之一。此外,激素之间的甘露糖残基的量相似,但比预期的要少,因为如果异二聚体具有三个n-糖基化位点,则man的量(mol/mol蛋白质)应接近9mol/mol。因此,这种较少含量的情况应归因于实验错误。pmsg和重组分子之间的岩藻糖含量相似。
[0183]
8.2.4-用于带电标记n-聚糖分析的弱阴离子交换色谱(wax)
[0184]
为了评估纯化pmsg商业制剂(b)与重组变体相比的唾液酸化模式,分离了来自每种激素的n-聚糖并用2-ab标记。然后将2-ab标记的聚糖施加到wax-hplc柱并根据它们的电荷并且在一定程度上根据n-聚糖结构进行分离。使用适当的标准,将聚糖标识为中性(去唾液酸)结构、单唾液酸化结构、双唾液酸化结构、三唾液酸化结构和四唾液酸化结构。
[0185]
如图9中可见,不同制剂的n-聚糖谱相似。然而,与pmsg相比,重组制剂表现出更高含量的中性聚糖和四唾液酸化聚糖。此外,与表现出不完全双唾液酸化结构(可能更复杂的)的重组变体不同,pmsg制剂表现出更高量的完全被唾液酸残基取代的双唾液酸化聚糖(峰对应于每组从左到右的最后一个位置)。
[0186]
recg rp-hplc分子表现出3.09%中性结构、30.19%单唾液酸化结构、54.22%双唾液酸化结构、8.65%三唾液酸化结构和3.86%四唾液酸化结构。recg hic含有3.65%中性结构、26.76%单唾液酸化结构、52.91%双唾液酸化结构、13.53%三唾液酸化结构和3.86%四唾液酸化结构。最后,pmsg制剂表现出以下百分比:0.72%中性结构、29.02%单唾液酸化结构、57.99%双唾液酸化结构和12.20%三唾液酸化结构(表4)。
[0187]
表4.纯化recg分子和pmsg的带电n-聚糖的相对量。
[0188][0189]
实例9-靶动物中的功效测定
[0190]
9.1-小母牛中的recg诱导的超排卵
[0191]
在超排卵和胚胎生产方案中使用单剂量ecg的功效已被示出与通过应用多剂量fsh获得的功效相似。本研究的目的是评估recg在诱导超排卵中的功效。使用以下方案对350和370kg之间的十八头小母牛进行同步:第-10天,给小母牛注射150μg pgf2α(ciclar,组维);第0天,它们接受了含1200mg p4(ivd,diprogest 1200,组维)和2mg eb注射液(苯甲
酸雌二醇,组维)的阴道内装置;第4天,将动物随机分为4组并进行注射:第1组(n=4):1000iu recg;第2组(n=4):1500iu recg;第3组(n=5):2000iu recg和第4组(n=4):2500iu pmsg;第6天,注射150μg pgf2α(ciclar,组维);第7天,撤出ivd,并重复pgf2α的剂量;第8天,应用0.02mg醋酸布舍瑞林(组维)。在第-10天和第0天进行超声(us),以确定方案开始时的发情周期的阶段。此外,在第8天,进行us以评估大于和小于8mm的卵泡数量(分别为fol《8;fol》8)和黄体(cl)数量,并执行us多普勒(mindray z6vet)以评估》8mm的卵泡的冲洗。所获得的所有数据均通过anova及随后的邓肯事后检验进行分析。然后,使用皮尔逊相关性检验(spss statistics 23,ibm)将变量冲洗、fol》8和cl关联起来。结果总结于表5中。关于fol》8和cl的量,观察到第1组和第3组之间的统计学差异(p《0.05)。卵泡冲洗与fol》8和cl呈正相关(p《0.05)。从结果推断,随着剂量的增加,recg对排卵前卵泡和cl的生产同时表现出剂量响应效应。经证明,2000iu剂量的recg在诱导小母牛超排卵方面与pmsg一样有效。最后,经证实,较高的卵泡冲洗与较多数量的排卵前卵泡和较多数量的cl相关。
[0192]
表5.用recg和pmsg进行超排卵的小母牛的fol《8、fol》8、cl和冲洗的平均值和均值标准误差(n=18)。
[0193][0194]
同一列中的具有不同上标字母的值具有显著差异(p《0.05)
[0195]
9.2-使用recg进行的妊娠检验测定
[0196]
9.2.1-tfai:传统方案
[0197]
连续8天的p4释放阴道内装置的传统方案。
[0198]
第0天:动物的卵巢状态和受验组的构象的us诊断。应用含750mg孕酮(prociclar,组维)加2mg es注射液(组维)的阴道内装置。
[0199]
第8天:撤出装置,随后根据各组注射150ug d 氯前列烯醇(ciclar,组维)、1mg环戊丙酸雌二醇(组维)和140iu recg或400iu pmsg。在固定时间人工授精(ftai)之前,在所有母牛的尾巴根部涂上热量探测器涂料,以确定是否发生(热量)攀升。
[0200]
第10天(装置去除之后48小时):固定时间人工授精
[0201]
第40天(ai后第30天):进行妊娠或周期性的诊断超声检查。
[0202]
超声检查时间安排:在时间0进行经直肠超声以确定受验雌性的卵巢状态。然后,在第40天(授精后第30天)进行超声,以获得妊娠诊断。
[0203]
精液和授精器:为了避免可能影响结果的方案之外的可能的生育力差异,所有雌性均使用来自同一头公牛的相同精液和相同批次的吸管进行授精,并且授精由同一专业人员执行。
[0204]
结果:报道了所述过程期间获得的结果以及固定时间人工授精(ftai)后第30天的超声结果的总结。
[0205]
9.2.2-j-synch ftai方案
[0206]
第0天:动物的卵巢状态和受验组的构象的us诊断。应用含600mg孕酮(diprogest,组维)加2mg苯甲酸雌二醇(eb)注射液(组维)的阴道内装置。
[0207]
第6天:撤出装置,随后根据各组注射150ug d 氯前列烯醇(ciclar,组维)和105iu recg或300iu pmsg。在固定时间人工授精(ftai)之前,在所有母牛的尾巴根部涂上热量探测器涂料,以确定是否发生(热量)攀升。
[0208]
第9天(装置去除之后72小时):所有动物均注射0.010mg醋酸布舍瑞林(组维),随后进行固定时间人工授精。
[0209]
第43天(tfai后第34天):妊娠诊断的超声检查
[0210]
超声检查时间安排:在时间0进行经直肠超声以确定受验雌性的卵巢状态。然后,在第43天(授精后第34天)进行超声,以获得妊娠诊断。
[0211]
精液和授精器:为了避免可能影响结果的方案之外的可能的生育力差异,所有雌性均使用来自同一头公牛的相同精液和相同批次的吸管进行授精,并且授精由同一专业人员执行。
[0212]
表6:tfai方案中的装置去除后的补充pmsg和recg的小母牛中的妊娠结果
[0213]
[0214][0215]
表7:tfai方案中的装置去除后的补充pmsg(400iu)和recg(140iu)的产犊和干奶母牛中的妊娠结果
[0216]
[0217]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。