1.本发明属于中药提取及其新用途技术领域,具体涉及三七花在调控抗菌肽表达方面的用途及三七花总皂苷提取方法。
背景技术:
2.三七花为五加科人参属植物三七的干燥花蕾(flowerbuds of panax notoginseng(burk)f.h.chen)。《中国药典》(2010年版)规定三七地下部分主根、支根和根茎为药用部位,而三七花为三七的非传统药用部位。但是有研究表明三七花味甘微苦,性凉,具有生津,平肝的功效。现代药理研究表明其具有镇静安神、消炎镇痛、降血压等功效,药理作用广,副作用少,治疗效果持久且稳定。综上所述,三七花具有较高的应用价值,开发前景广阔。故要想全面系统地开发利用三七花,清楚其活性成分及功效就显得尤为重要。
3.相关研究表明三七花中总皂苷含量比传统药用部位三七根中的总皂苷含量高,但是二者中单体皂苷的含量却存在显著差别。三七花中含有大量的原人参二醇型人参皂苷,其中三七皂苷fc和人参皂苷rc,rb2和rb3含量较高。有文献报道三七总皂苷在某些药理作用如抗炎、抗衰老、提高机体免疫力等方面比人参总皂苷更具优势,故此对于三七花中活性成分抗炎的功效需要进行深入系统的研究。三七花是三七中皂苷的高含量部位,可以考虑将其作为三七主根的替代品,合理利用现有的药材资源。
4.抗菌肽原指昆虫体内经诱导而产生的一类具有抗菌活性的碱性多肽物质,分子量在2000~7000左右,由20~60个氨基酸残基组成。这类活性多肽多数具有强碱性、热稳定性以及广谱抗菌等特点。世界上第一个被发现的抗菌肽的是1980年由瑞典科学家g.boman等人经注射阴沟通杆菌及大肠杆菌诱导惜古比天蚕蛹产生的具有抗菌活性的多肽,定名为cecropins。除了上述昆虫来源的抗菌肽以外,后来持续不断的研究发现更多的抗菌肽可来自不同的物种,例如,植物源的抗菌肽、昆虫以外的其他动物(包括:两栖动物、哺乳动物、软体动物、甲壳类动物、鱼类等)来源的抗菌肽,细菌来源的抗菌肽(又称细菌素)、人源抗菌肽等。
5.ll-37是迄今在人体中发现的抗菌肽cathelicidin家族中的唯一成员,也是人体内唯一的双亲性α螺旋结构的抗菌肽。ll-37主要表达于某些骨髓源性细胞(中性粒细胞、巨噬细胞、淋巴细胞等)、角质形成细胞、组织上皮细胞及某些腺体等易于与微生物发生接触的部位。作为天然免疫的重要成分,ll-37在机体遭受外来微生物侵袭时能与其他抗菌肽一起提供迅速有效的第一线防御。众多研究表明,ll-37不仅具有广谱的抗微生物活性,而且在获得性免疫中细胞因子的释放、免疫细胞的趋化和炎症性疾病的发生发展中也起着关键的作用。
6.ll-37在体内和体外都具有强烈的抗微生物功能,这些微生物包括细菌、真菌和病毒等。大量研究发现,ll-37具有抗菌谱广,不易产生耐药菌株等特点,对金黄色葡萄球菌、表皮葡萄球菌、大肠杆菌、铜绿假单胞菌、普通变形杆菌等,均表现出较强的抗菌活性。
7.ll-37还具有重要的免疫调节作用。ll-37能调节不同的免疫和非免疫细胞释放细胞因子,这些细胞因子在炎症和抗炎症反应中都发挥了重要的调节作用。许多证据表明,ll-37广泛参与许多炎症性皮肤病的发生发展过程。当机体出现创伤、炎症、感染时,皮损局部的角质形成细胞会生成大量的活性抗菌肽ll-37,参与机体的防御反应。
8.ll-37具有广谱的抗菌作用及其独特的免疫调节作用。然而,现有技术从未报道过三七花与抗菌肽之间的调控关系。
技术实现要素:
9.基于本领域存在的上述空白,本发明首次提出三七花与抗菌肽之间的调控关系,并发现三七花在抗菌肽的表达方面起显著的促进作用。
10.本发明的技术方案如下:
11.三七花在调控抗菌肽表达方面的用途。
12.所述调控指正调控;
13.优选地,所述正调控指促进抗菌肽的表达或分泌。
14.所述抗菌肽选自:植物来源的抗菌肽、细菌来源的抗菌肽、动物来源的抗菌肽、人源抗菌肽;
15.优选地,所述抗菌肽为人源抗菌肽;
16.优选地,所述人源抗菌肽为抗菌肽ll-37。
17.所述三七花为三七花提取物;
18.优选地,所述三七花提取物为三七花总皂苷。
19.更优选地,所述三七花总皂苷浓度为50μg/ml-200μg/ml。
20.所述三七花提取物的提取方法包括:以乙醇为溶剂通过超声提取技术得到三七花粗提物,再用柱层析法以乙醇为洗脱剂对三七花粗提物进行分离纯化。
21.所述提取方法包括:在三七花中加入溶剂乙醇进行超声提取;
22.优选地,所述超声提取进行3次;每次超声提取后抽滤,将所得滤液进行浓缩得到三七花粗提物;
23.优选地,三七花与溶剂乙醇的料液比为1-3g∶3-10ml优先1g∶5ml;
24.优选地,超声提取的温度为40-80℃优先60℃,超声提取的时间为10-60min优先30min;
25.优选地,所述提取方法还包括:以层析柱平衡、上样过柱、洗脱为一个循环,共进行3个循环得到洗脱液;所述上样指将三七花粗提物做为样品加入层析柱;
26.优选地,所述样品与层析柱树脂的质量比为1-3∶10-30优先1∶20;
27.优选地,所述层析柱平衡指用95%乙醇冲洗层析柱;
28.优选地,所述洗脱指先用水将层析柱洗至无色、再用洗脱剂乙醇洗脱并收集洗脱液;
29.优选地,所述洗脱液经浓缩后得到三七花提取物;
30.优选地,所述浓缩指用旋转蒸发仪将滤液中的乙醇蒸除;
31.优选地,溶剂乙醇为70%-80%优选75%的乙醇;洗脱剂乙醇为50%-70%优选50%的乙醇。
32.三七花在清除自由基、或,抑制环氧合酶、或,抑制细胞炎症因子、或,抗糖化方面的用途。
33.所述自由基选自:dpph、abts;所述环氧合酶选自环氧合酶-2cox-2;所述细胞炎症因子选自pge-2;
34.优选地,所述抗糖化指:抑制果糖胺;
35.优选地,所述三七花为三七花提取物;
36.优选地,所述三七花提取物为三七花总皂苷;
37.优选地,所述三七花提取物的提取方法包括:以乙醇为溶剂通过超声提取技术得到三七花粗提物,再用柱层析法以乙醇为洗脱剂对三七花粗提物进行分离纯化;
38.优选地,所述提取方法包括:在三七花中加入溶剂乙醇进行超声提取;
39.优选地,所述超声提取进行3次;每次超声提取后抽滤,将所得滤液进行浓缩得到三七花粗提物;
40.优选地,三七花与溶剂乙醇的料液比为1-3g∶3-10ml优先1g∶5ml;
41.优选地,超声提取的温度为40-80℃优先60℃,超声提取的时间为10-60min优先30min;
42.优选地,所述提取方法还包括:以层析柱平衡、上样过柱、洗脱为一个循环,共进行3个循环得到洗脱液;所述上样指将三七花粗提物做为样品加入层析柱;
43.优选地,所述样品与层析柱树脂的质量比为1-3∶10-30优先1∶20;
44.优选地,所述层析柱平衡指用95%乙醇冲洗层析柱;
45.优选地,所述洗脱指先用水将层析柱洗至无色、再用洗脱剂乙醇洗脱并收集洗脱液;
46.优选地,所述洗脱液经浓缩后得到三七花提取物;
47.优选地,所述浓缩指用旋转蒸发仪将滤液中的乙醇蒸除;
48.优选地,溶剂乙醇为70%-80%优选75%的乙醇;洗脱剂乙醇为50%-70%优选50%的乙醇。
49.一种三七花总皂苷提取方法,其特征在于,以乙醇为溶剂通过超声提取技术对三七花进行提取并得到三七花粗提物,再用柱层析法以乙醇为洗脱剂对三七花粗提物进行分离纯化。
50.所述的一种三七花总皂苷提取方法包括:在三七花中加入溶剂乙醇进行超声提取;
51.优选地,所述超声提取进行3次;每次超声提取后抽滤,将所得滤液进行浓缩得到三七花粗提物;
52.优选地,三七花与溶剂乙醇的料液比为1-3g∶3-10ml优先1g∶5ml;
53.优选地,超声提取的温度为40-80℃优先60℃,超声提取的时间为10-60min优先30min;
54.优选地,所述提取方法还包括:以层析柱平衡、上样过柱、洗脱为一个循环,共进行3个循环得到洗脱液;所述上样指将三七花粗提物做为样品加入层析柱;
55.优选地,所述样品与层析柱树脂的质量比为1-3∶10-30优先1∶20;
56.优选地,所述层析柱平衡指用95%乙醇冲洗层析柱;
57.优选地,所述洗脱指先用水将层析柱洗至无色、再用洗脱剂乙醇洗脱并收集洗脱液;
58.优选地,所述洗脱液经浓缩后得到三七花提取物;
59.优选地,所述浓缩指用旋转蒸发仪将滤液中的乙醇蒸除;
60.优选地,溶剂乙醇为70%-80%优选75%的乙醇;洗脱剂乙醇为50%-70%优选50%的乙醇。
61.采用上述提取方法对三七花提取得到的三七花提取物中皂苷含量为70mg/g,纯度达到59.84%,获得了本领域从未有过的新高度。
62.本发明的有益效果如下:
63.1)以50%乙醇为洗脱剂,通过柱层析法得到的三七花提取物的皂苷含量为70mg/g,纯度达到59.84%,提高了皂苷活性成分的含量和纯度,同时工艺简单,降低了成本和时间。
64.2)通过检测三七花提取物对dpph、abts自由基的抑制率,得到三七花皂苷提取物对dpph、abts自由基有明显抑制作用,可以达到显著的抗氧化效果。
65.3)三七花总皂苷具有抑制cox-2环氧合酶-2。
66.4)通过hacat细胞实验,得到三七花提取物具有明显的抗炎作用,能够显著抑制炎症因子pge-2的表达,并且能明显的促进抗菌肽ll-37的表达。
67.5)三七花总皂苷具有抑制非酶糖基化作用。为三七花总皂苷作用护肤品功效原料应用提供科学依据。
68.本发明三七花的分离纯化过程将三七花提取物中的总皂苷进行了富集,提高了三七花皂苷活性成分的含量及纯度。三七花提取物中的总皂苷活性成分的纯度提高在一定程度上可增强三七花提取物的抗氧化功效,显著抑制了uvb诱导炎症因子高表达模型中pge-2的分泌,而且明显促进抗菌肽ll-37的表达,同时三七花总皂苷能抑制环氧合酶cox-2,体现出良好的抗糖化的功效,为三七花作为一种抗炎化妆品功效添加剂的使用提供理论基础。
69.本发明开拓性地发现了三七花与抗菌肽二者之间的关联,并通过实验验证三七花提取物可正向调控抗菌肽的表达,三七花提取物对抗菌肽的调控有明显的剂量效应。100μg/ml以上的三七花提取物可不同程度地提升抗菌肽的表达量,添加了三七花提取物的抗菌肽表达量是空白对照的2.4倍至3.2倍。另一方面,本发明还验证了三七花在清除自由基、抑制环氧合酶、抑制细胞炎症因子、抗糖化方面的用途。不同稀释倍数的三七花提取物对自由基的清除率均在90%以上,效果十分显著。在抗糖化方面,本发明提取得到的三七花提取物对果糖胺抑制率最高可达57.20%。本发明的第三个方面还提供一种三七花总皂苷的提取方法,该提取方法得到三七花提取物的皂苷含量为70mg/g,纯度达到59.84%,提高了皂苷活性成分的含量和纯度,同时工艺简单,降低了成本和时间。
附图说明
70.图1为本发明的实验例得到的三七花提取物对pge-2分泌的影响。
71.图2为本发明的实验例得到的三七花提取物对抗菌肽ll-37的调控。
72.图3为本发明的实验例westernblot试验结果显示的三七花提取物对hacat细胞中pge-2的表达的影响。
73.图4为为本发明的实验例westernblot试验结果显示的三七花提取物对hacat细胞中pge-2的表达量影响的柱形图;其中*表示p<0.05,差异显著,**表示p<0.01,差异极显著(spss.25anova分析)。
74.图5为本发明的实验例westernblot试验结果显示的三七花提取物对抗菌肽ll-37的表达的影响。
75.图6为本发明的实验例westernblot试验结果显示的三七花提取物对抗菌肽ll-37的表达量影响的柱形图;其中*表示p<0.05,差异显著,**表示p<0.01,差异极显著(spss.25anova分析)。
具体实施方式
76.下面结合具体实施例和实验例对本发明做进一步的详细描述,但并不因此限制本发明的保护范围。
77.试剂耗材
78.本发明实验例部分使用的所有试剂与耗材,例如,乙醇、层析柱、celecoxib溶液、环氧合酶-2等均可商购获得。
79.生物材料来源
80.三七花、hacat细胞均可商购获得。
81.hacat细胞炎症模型为申请人实验室自行构建,具体参照“uvb辐射hacat细胞损伤模型的建立”一文记载的步骤进行构建。申请人承诺从本发明申请日起20年内可向公众发放该模型以验证本发明的效果。
82.第1组实施例、本发明三七花的调控抗菌肽新用途
83.本组实施例提供三七花在调控抗菌肽表达方面的用途。
84.本领域技术人员根据本发明的教导,可将三七花或其相关产品,例如以三七花为原料的药物、食品、保健品、护肤品、化妆品用于调控抗菌肽表达。任何利用三七花提取、制作、添加、生产、使用、销售抗菌肽调控产品的行为均落入保护范围,同时,任何包装上标注有抗菌肽调控用途的以三七花为原料、来源、辅料、主料、君药、臣药、活性成分的药物、食品、保健品、护肤品、化妆品也落入本发明的保护范围。
85.在具体的实施例中,所述调控指正调控;
86.优选地,所述正调控指促进抗菌肽的表达或分泌。
87.在一些实施例中,所述抗菌肽选自:植物来源的抗菌肽、细菌来源的抗菌肽、动物来源的抗菌肽、人源抗菌肽;
88.优选地,所述抗菌肽为人源抗菌肽;
89.优选地,所述人源抗菌肽为抗菌肽ll-37。
90.在优选的实施例中,所述三七花为三七花提取物;
91.优选地,所述三七花提取物为三七花的醇提取物;
92.优选地,所述三七花的醇提取物为三七花总皂苷。
93.在进一步的实施例中,所述三七花提取物的提取方法包括:以乙醇为溶剂通过超声提取技术得到三七花粗提物,再用柱层析法以乙醇为洗脱剂对三七花粗提物进行分离纯化。
94.在优选的实施例中,所述提取方法包括:在三七花中加入溶剂乙醇进行超声提取;
95.优选地,所述超声提取进行3次;每次超声提取后抽滤,将所得滤液进行浓缩得到三七花粗提物;
96.优选地,三七花与溶剂乙醇的料液比为1-3g∶3-10ml优先1g∶5ml;
97.优选地,超声提取的温度为40-80℃优先60℃,超声提取的时间为10-60min优先30min;
98.优选地,所述提取方法还包括:以层析柱平衡、上样过柱、洗脱为一个循环,共进行3个循环得到洗脱液;所述上样指将三七花粗提物做为样品加入层析柱;
99.优选地,所述样品与层析柱树脂的质量比为1-3∶10-30优先1∶20;
100.优选地,所述层析柱平衡指用95%乙醇冲洗层析柱;
101.优选地,所述洗脱指先用水将层析柱洗至无色、再用洗脱剂乙醇洗脱并收集洗脱液;
102.优选地,所述洗脱液经浓缩后得到三七花提取物;
103.优选地,所述浓缩指用旋转蒸发仪将滤液中的乙醇蒸除;
104.优选地,溶剂乙醇为70%-80%优选75%的乙醇;洗脱剂乙醇为50%-70%优选50%的乙醇。
105.第2组实施例、本发明的三七花抗氧化、抗炎、抗糖化用途
106.本组实施例提供三七花在清除自由基、或,抑制环氧合酶、或,抑制细胞炎症因子、或,抗糖化方面的用途。
107.本领域技术人员根据本发明的教导,可将三七花或其相关产品,例如以三七花为原料的药物、食品、保健品、护肤品、化妆品用于清除自由基、或,抑制环氧合酶、或,抑制细胞炎症因子、或,抗糖化。任何利用三七花提取、制作、添加、生产、使用、销售清除自由基的产品、或,抑制环氧合酶的产品、或,抑制细胞炎症因子的产品、或,抗糖化产品的行为均落入保护范围,同时,任何包装上标注有清除自由基、或,抑制环氧合酶、或,抑制细胞炎症因子、或,抗糖化用途的以三七花为原料、来源、辅料、主料、君药、臣药、活性成分、组成成分的药物、食品、保健品、护肤品、化妆品也落入本发明的保护范围。
108.在具体的实施例中,所述自由基选自:dpph、abts;所述环氧合酶选自环氧合酶-2cox-2;所述细胞炎症因子选自pge-2;
109.所述抗糖化指抑制果糖胺。
110.优选地,所述三七花为三七花提取物;
111.优选地,所述三七花提取物为三七花总皂苷;
112.优选地,所述三七花提取物的提取方法包括:以乙醇为溶剂通过超声提取技术得到三七花粗提物,再用柱层析法以乙醇为洗脱剂对三七花粗提物进行分离纯化;
113.优选地,所述提取方法包括:在三七花中加入溶剂乙醇进行超声提取;
114.优选地,所述超声提取进行3次;每次超声提取后抽滤,将所得滤液进行浓缩得到三七花粗提物;
115.优选地,三七花与溶剂乙醇的料液比为1-3g∶3-10ml优先1g∶5ml;
116.优选地,超声提取的温度为40-80℃优先60℃,超声提取的时间为10-60min优先30min;
117.优选地,所述提取方法还包括:以层析柱平衡、上样过柱、洗脱为一个循环,共进行3个循环得到洗脱液;所述上样指将三七花粗提物做为样品加入层析柱;
118.优选地,所述样品与层析柱树脂的质量比为1-3∶10-30优先1∶20;
119.优选地,所述层析柱平衡指用95%乙醇冲洗层析柱;
120.优选地,所述洗脱指先用水将层析柱洗至无色、再用洗脱剂乙醇洗脱并收集洗脱液;
121.优选地,所述洗脱液经浓缩后得到三七花提取物;
122.优选地,所述浓缩指用旋转蒸发仪将滤液中的乙醇蒸除;
123.优选地,溶剂乙醇为70%-80%优选75%的乙醇;洗脱剂乙醇为50%-70%优选50%的乙醇。
124.第3组实施例、本发明的三七花总皂苷提取方法
125.本组实施例提供一种三七花总皂苷提取方法。本组所有实施例都具备如下共同特征:以乙醇为溶剂通过超声提取技术对三七花进行提取并得到三七花粗提物,再用柱层析法以乙醇为洗脱剂对三七花粗提物进行分离纯化。
126.在具体的实施例中,所述的一种三七花总皂苷提取方法包括:在三七花中加入溶剂乙醇进行超声提取;
127.优选地,所述超声提取进行3次;每次超声提取后抽滤,将所得滤液进行浓缩得到三七花粗提物;
128.优选地,三七花与溶剂乙醇的料液比为1-3g∶3-10ml优先1g∶5ml;
129.优选地,超声提取的温度为40-80℃优先60℃,超声提取的时间为10-60min优先30min;
130.优选地,所述提取方法还包括:以层析柱平衡、上样过柱、洗脱为一个循环,共进行3个循环得到洗脱液;所述上样指将三七花粗提物做为样品加入层析柱;
131.优选地,所述样品与层析柱树脂的质量比为1-3∶10-30优先1∶20;
132.优选地,所述层析柱平衡指用95%乙醇冲洗层析柱;
133.优选地,所述洗脱指先用水将层析柱洗至无色、再用洗脱剂乙醇洗脱并收集洗脱液;
134.优选地,所述洗脱液经浓缩后得到三七花提取物;
135.优选地,所述浓缩指用旋转蒸发仪将滤液中的乙醇蒸除;
136.优选地,溶剂乙醇为70%-80%优选75%的乙醇;洗脱剂乙醇为50%-70%优选50%的乙醇。
137.实验例、本发明的三七花新用途实验
138.本部分内容通过大量实验验证了如下结论:
139.1.富集三七花总皂苷有效部位;2.测定三七花总皂苷的抗氧化活性;3.测定三七花总皂苷的抗糖化功效;4.测定三七花总皂苷对角质形成细胞模型炎症因子的影响;5.测定三七花总皂苷对抗菌肽ll-37的影响。
140.为了验证上述结论,通过下述5部分开展实验:
141.a.首先,以75%的乙醇为溶剂,通过超声提取技术对三七花总皂苷进行提取;
142.b.接着,以50%乙醇为洗脱剂,通过柱层析法对三七花总皂苷进行富集。
143.c.其次,通过高氯酸法对富集得到的三七花总皂苷进行定量分析;
144.d.然后,对三七花总皂苷进行自由基、环氧合酶-2cox-2、糖基化抑制作用研究;
145.e.通过hacat细胞实验,检测三七花提取物对细胞炎症因子pge-2以及抗菌肽ll-37表达的影响。
146.具体的实验操作过程如下:
147.第一部分:三七花粗提物的制备
148.三七花质脆,于研钵中研磨后即可进行提取。称取100g于烧杯中,加入75%乙醇500ml(料液比为三七花:75%乙醇=1:5),60℃超声提取30min,抽滤,收集滤液。再按原比例加入75%乙醇,重复超声提取三次。用旋转蒸发仪在60℃条件下将提取液进行浓缩,待其中乙醇蒸除,得到三七花粗提物。
149.第二部分:三七花粗提物中活性成分的分离纯化
150.先选取50%、60%、70%醇进行洗脱,结果表明50%醇对于皂苷的富集能力最强,故选择50%醇进行三七花分离纯化,以富集得到高含量皂苷。
151.对以上所得到的三七花粗提物,用柱层析法对三七花皂苷进行富集:第一步,先用95%乙醇冲洗柱子(bomex,外径(内径)*有效长度:50(44)*500,壁厚3.0)至无色,再用水冲洗柱子至无色,弃去洗脱液以平衡柱子,然后上样,上样质量:d-101大孔吸附树脂干重=1:20;第二步,上样后,先用水洗至无色,再用50%醇洗,收集50%醇洗脱液。第三步,平衡柱子,重新上样,共上样3次,收集醇洗脱液;第四步,将醇洗脱液旋蒸浓缩,得分离纯化的三七花富集液。
152.第三部分:对分离纯化的三七花提取物中的活性成分进行定量检测
153.取适量以上三七花富集液稀释10倍,取1ml按高氯酸法对活性成分进行定量检测。
154.用10ml注射器作层析管,内装3cm d-101大孔树脂,上加1cm中性氧化铝。先用25ml 70%乙醇洗柱,再用25ml水洗柱,弃去洗脱液,加入1.0ml稀释10倍的三七花富集液,用25ml水洗柱,弃去洗脱液,再用25ml70%乙醇洗脱,收集醇洗脱液于蒸发皿中,置于60℃水浴挥干。在已挥干的蒸发皿中准确加入0.2ml 5%香草醛冰乙酸溶液,转动蒸发皿,使残渣都溶解,再加入0.8ml高氯酸,混匀后移入试管中,60℃水浴加热10min,取出,冰浴冷却后,加入冰乙酸5.0ml,摇匀后于560nm波长处测定吸光度值。
155.测得富集后三七花中皂苷含量为70mg/g,纯度达到59.84%,故定为三七花总皂苷的有效部位。
156.第四部分:对分离纯化出的三七花富集液进行抗自由基检测
157.1、dpph自由基清除率
158.dpph乙醇溶液的配制:称取20mgdpph,加入无水乙醇溶解并定容于250ml容量瓶中,0-4℃下避光保存,现配现用,4h内有效。
159.待测液的配置:取富集液,对半稀释得0.5、0.25、0.12倍原溶液浓度的待测溶液。阳性对照选用1mg/ml维生素c,0-4℃下避光保存,现配现用。
160.具体实验步骤:
161.a.按下表1料液比加入各试剂。
162.表1
163.编号dpph溶液无水乙醇待测液总体积
a管1ml——1ml2mlb管1ml1ml——2mlc管——1ml1ml2ml
164.b.反应30min后,在517nm处用酶标仪测量a、b、c管的吸光度值。
165.c.清除率计算公式为:清除率(%)=[(b c)-a]/b
[0166]
d.结果分析:阳性对照dpph清除率为96.36%。
[0167][0168]
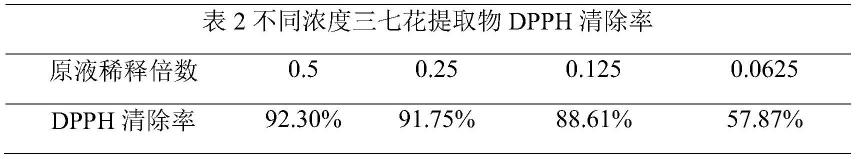
如上表2所示,实验结果表明,三七花提取物能明显抑制dpph自由基,具有显著的抗氧化效果。
[0169]
2、abts自由基清除率
[0170]
abts水溶液配置:精密称取0.03841g abts,溶解定容于10ml水中;
[0171]
k2s2o8水溶液配置:精密称取0.0662g k2s2o8溶解定容于100ml水中;
[0172]
母液配置:将abts水溶液和k2s2o8水溶液等体积混合,低温避光反应12~16h;
[0173]
abts工作液:将母液用无水乙醇稀释至在734nm处的od值为0.7
±
0.02,现用现配。
[0174]
待测液的配置:取富集液,对半稀释得0.5、0.25、0.125、0.0625、倍原溶液浓度的待测溶液。阳性对照选用1mg/ml维生素c,0-4℃下避光保存,现配现用。
[0175]
具体实验步骤:
[0176]
a.按下表3料液比加入各试剂。
[0177]
表3
[0178]
编号样品水abts试剂实验组(a)0.2ml
‑‑‑
0.8ml空白组(a0)
‑‑‑
0.2ml0.8ml
[0179]
b.室温条件下避光反应30min,用酶标仪测定其在734nm下的吸光值。
[0180]
c.abts自由基清除率:清除率(%)=[(a0-a)/a0]*100%。
[0181]
d.结果分析:阳性对照abts清除率为99.89%。
[0182][0183]
如上表4所示,实验结果表明,三七花提取物能明显抑制abts自由基,具有显著的抗氧化效果。
[0184]
第五部分样品对于cox-2环氧合酶-2的抑制作用研究
[0185]
a.参考下表,使用96孔黑板设置对照孔和样品孔,并按照下表5依次加入样品和各溶液。加入待测样品后,混匀,37℃孵育10分钟。
[0186]
表5
[0187][0188]
b.各孔加入cox-2probe 5微升。
[0189]
c.各孔快速加入cox-2substrate工作液5微升,混匀。注:加入cox-2substrate工作液后反应即会开始,如果孔数较多,可以在低温操作或使用排枪操作以减小各孔间加入cox-2substrate工作液的时间差而导致的误差,混匀也可以在培养板振荡器上进行。
[0190]
d.37℃避光孵育5分钟后进行荧光测定。激发波长为560nm,发射波长为590m。当荧光读数偏低时,也可适当延长孵育时间至10-20分钟。
[0191]
e.计算每个样品的抑制百分率。计算公式如下:
[0192]
抑制率(%)=(rfu100%酶活性对照-rfu样品)/(rfu100%酶活性对照-rfu空白对照)x100%.
[0193]
实验结果:
[0194]
表6.三七花对cox-2的抑制百分率
[0195][0196]
实验结果表明,三七花总皂苷可抑制环氧合酶-2cox-2。阳性对照(celecoxib溶液)抑制率为90.32%,其与阳性对照相比,可见三七花总皂苷抑制环氧合酶-2cox-2效果良好。
[0197]
第六部分:通过hacat细胞实验,用elisa试剂盒检测三七花富集液对uvb诱导炎症因子高表达细胞模型中炎症因子pge-2以及抗菌肽ll-37表达的影响
[0198]
(1)将hacat细胞以1
×
105/ml的密度接种于96孔板中,每孔加入100μl(边缘孔用无菌pbs填充)。在37℃、5%co2条件下培养24h后,用uvb(辐射剂量分别为25、50、75、100、125、150mj/cm2)刺激hacat细胞,结束后再分别加入适量无血清培养基,置于培养箱37℃,5%co2环境中培养24h。通过cck-8细胞毒检测实验,测量不同剂量的uvb的无毒性最高浓度,筛选uvb刺激hacat细胞炎症模型的最佳剂量。
[0199]
(2)将hacat细胞以3
×
105/ml的密度接种于六孔板中,在37℃、5%co2条件下培养
24h后,用uvb(辐射剂量分别为25、50、75、100、125、150mj/cm2)刺激hacat细胞,结束后再分别加入适量无血清培养基,置于培养箱37℃,5%co2环境中培养24h,收集上清液用elisa试剂盒检测pge-2的表达量,筛选出uvb对hacat细胞中pge-2的增加最适辐射剂量。检测结果如表7所示。
[0200][0201]
根据检测结果,在uvb辐射剂量为100mj/cm2时,细胞存活率为86.84%,pge-2表达量为269.52pg/ml,选择100mj/cm2为uvb最佳辐射剂量。
[0202]
(3)样品的制备:称取50mg三七花富集液溶于1ml dmso中,然后用mem培养基分别稀释成浓度为1000、500、200、100、50μg/ml的样品。通过cck-8细胞毒检测实验,检测不同浓度三七花对细胞存活率的影响,结果如表8所示。
[0203][0204]
根据检测结果,得到三七花富集液在1000μg/ml浓度下hacat细胞存活率为77.64%,存在一定细胞毒性。在500、200、100、50μg/ml浓度下,细胞存活率均达到80%。故结合实际情况,选择200μg/ml、100μg/ml和50μg/ml为接下来pge-2和ll-37指标检测的实验浓度。
[0205]
(4)设置三组实验组:第1组为空白对照,只有细胞(不做任何处理);第2组为辐射组,只进行uvb照射;第3组为样品组,进行uvb照射后加不同提取物。将hacat细胞按3
×
105的密度接种于6孔板中。当hacat细胞融合达80%~90%时,吸去培养液后,用pbs冲洗两次,再加适量的pbs覆盖细胞,进行uvb(100mj/cm2)辐射。结束后立即吸去孔板中的pbs缓冲液,再分别加入适量无血清培养基或样品溶液,置于培养箱37℃,5%co2环境中培养24h后收集上清液,用elisa试剂盒检测pge-2及ll-37的表达量。先拟合标准曲线,在此基础上计算样本pge-2及ll-37的表达量。检测结果如表9、图1、图2所示。
[0206]
[0207]
实验得到三七花提取物对uvb诱导炎症因子高表达模型的炎症因子pge-2有显著抑制作用(具有极显著性差异,p<0.01),且能明显的促进抗菌肽ll-37的表达(具有极显著性差异p<0.01)。
[0208]
第七部分三七花总皂苷糖基化抑制作用研究
[0209]
本实验建立bsa-果糖体外糖基化孵育体系,加入样品、阳性、阴性对照,在第三天时测定果糖胺抑制率,第四天时测定蛋白质羰基化抑制率,最后通过采用荧光定量法检测ages含量,通过公式推算出样品对糖基化三大阶段产物的抑制率。通过体外抑制neg实验建立体外功效检测方法,以期为筛选具有消除肌肤暗哑发黄,淡化老年斑功效的化妆品添加剂提供快速的评价方法。
[0210]
一、试剂、耗材准备
[0211]
a)pbs(ph=7.2~7.4)、灭菌水、0.02%叠氮化钠
[0212]
b)果糖、bsa(牛血清蛋白)、氨基胍
[0213]
c)分析天平,移液枪、5ml枪头、1ml枪头、200ul枪头,50ml(2个)、10ml、2mlep管若干
[0214]
d)0.45水系滤膜、锡纸、烧杯(5个)
[0215]
e)96孔板黑色、多功能酶标仪、涡旋器
[0216]
表10
[0217]
仪器/试剂厂家型号氨基胍东京化成工业株式会社a0309黑色96孔板jetbiofilltp-021-896多功能酶标仪tecanm200pro涡旋器海门市其抹贝尔仪器制造公司ql861pbscat#sl1326-500ml分析天平xs205 dualrangemettler toledo
[0218]
二、实验前准备
[0219]
(1)使用分析天平称取0.5gbsa,2.25g果糖,22mg氨基胍,每种样品取其50mg,加入去离子水稀释浓度为5000μg/ml,1000μg/ml,500μg/ml,250μg/ml
[0220]
三、实验过程
[0221]
(1)在pbs中加入0.02%叠氮化钠防腐剂(起到抑制细菌的作用)
[0222]
(2)20mg/ml的牛血清白蛋白(bsa)溶液:将0.5gbsa倒入50mlep管中,加入pbs至25ml,0.45水系滤膜过滤(bsa溶液容易结块不易溶解,溶解时应在合适的容器中涡旋、震荡、搅拌)
[0223]
(3)0.5mol/l果糖溶液:2.25g果糖,用pbs定容至25ml
[0224]
(4)bsa-果糖反应液:使用移液枪5ml枪头,取bsa溶液20ml、果糖溶液20ml,加入烧杯中,均匀混合。
[0225]
(5)氨基胍溶液:22mg氨基胍加入去离子水溶解定容至10ml作为阳性对照组。另配制质量浓度为5000μg/ml,1000μg/ml,500μg/ml,250μg/ml的溶液用以与样品组抑制能力做对比。
[0226]
(6)样品用去离子水溶解,漩涡器加快溶解,再用65℃的热水浸泡15min,使用离心
机转速6000时间为5min,取其上清液。需要达到澄清状态,否则会影响荧光值的准确性。样品浓度稀释梯度以5000μg/ml,1000μg/ml,500μg/ml,250μg/ml(按实际情况决定稀释梯度),受试样品稀释时使用pbs溶液进行稀释。
[0227]
(7)阴性对照组为:pbs 反应液。阳性对照组:氨基胍 反应液,空白对照组:受试样品或氨基胍 pbs。样品组:受试样品 反应液。反应液:pbs:受试样品统一为1:1.
[0228]
每组三个平行样,每组都应当跟着一个空白对照组。
[0229]
表11反应体系(ml)
[0230][0231]
加入两种试剂后应立即用漩涡器混匀如:1ml样品加1ml反应液为样品组,应有三个平行样,和一个空白对照组:1ml样品 1mlpbs。
[0232]
(8)配置不同试验组,于37℃培养箱里避光孵育。
[0233]
(9)在第3天时采用试剂盒测定果糖胺抑制率
[0234]
(10)第4天时采用试剂盒测定蛋白质羰基化抑制率
[0235]
(11)在第5天时检测各实验组的荧光强度,激发波长370nm,发射波长为440nm,增益87、80、75(该值需要根据实际测试进行适当的手动调节,通常调节该值,使得最终阴性组的荧光读数5位数最佳),测其空板后进行点样,根据公式计算抑制率。
[0236]
四、实验数据及结论
[0237]
5.1果糖胺(前期阶段amodori代表性产物)抑制率
[0238]
不同试验组在530nm下酶标仪测定其吸光度,根据计算公式:
[0239][0240][0241]
数据表明,在5000μg/ml,1000μg/ml,500μg/ml,250μg/ml下,三七花提取物果糖胺抑制率依次为57.20%、27.36%、24.94%,2.79%,在相同浓度下的阳性对照物氨基胍抑制率为39.76%、21.88%、18.74%、4.12%,三七花提取物有一定的果糖胺抑制率,且在同浓度下与氨基胍对比,三七提取物果糖胺抑制率较高。
[0242]
第八部分三七花提取物western blot检测实验
[0243]
一、实验方法
[0244]
1.样品制备
[0245]
(1)蛋白裂解液的制备
[0246]
首次使用时把pmsf晶体全部倒入到pmsf溶液中混合均匀,配制10ml100nm的pmsf溶液,置于-20℃条件下保存;根据总蛋白抽提试剂盒的说明书,取适当量的总蛋白裂解液混匀,总蛋白裂解液与磷酸酶抑制剂、蛋白酶抑制剂和pmsf三联按照体积比为100:1:1:1的
比例配制裂解液。
[0247]
(2)收集细胞
[0248]
吸出上清液,加入pbs缓冲液清洗两遍,然后向6孔板中每孔加入200μl的pbs缓冲液,并使用细胞刮刀将细胞取出,用移液枪把混合物吸进离心管中。(以上操作均在冰上进行)。
[0249]
将装有细胞的离心管在4℃1000rcf的条件下离心5min,弃上清。然后加入200μl预冷的配置好的蛋白裂解缓冲液。用移液枪吹打把细胞吹散,用旋涡震荡5min以充分裂解细胞。充分裂解后应没有明显的细胞沉淀。在4℃1000rcf的条件下,离心10min,取上清,即可收获蛋白样品。
[0250]
2.蛋白浓度的测定
[0251]
根据bca试剂盒的说明书,对提取的蛋白含量进行测定。操作步骤如下:
[0252]
(1)配制蛋白工作液。a试剂:b试剂体积比为50:1来配制蛋白工作液,上下颠倒以求完全混匀。蛋白工作液要求现配现用。
[0253]
(2)准备标准品溶液。将5mg/ml的bsa储存液用试剂盒中的稀释液稀释至31.25μg/ml、62.5μg/ml、125μg/ml、250μg/ml、500μg/ml、1000μg/ml、2000μg/ml,一共有8个浓度梯度。
[0254]
(3)准备样品溶液。取25μl蛋白样品溶液,用水稀释两倍,配制成50μl。
[0255]
(4)向96孔培养板中添加入25μl的一系列浓度蛋白标准品和稀释的样品。
[0256]
(5)向各待测孔中分别添加200μl配制出的bca工作液,震荡孔板充分混匀。
[0257]
(6)在37℃中静置反应30min后,室温静置10min。使用酶标仪测定在562nm处的吸光度。根据所测标准品吸光值和其浓度来制作标曲,并根据标曲来计算各样品的蛋白浓度(稀释的样品需要乘以其稀释倍数以得终浓度(μg/ml))。
[0258]
3.蛋白变性
[0259]
以各蛋白样品上样量为35μg、上样体积30~40μl为准,根据各蛋白样品的浓度计算所需的体积。
[0260]
按照蛋白样品:5
×
loading buffer体积比为4:1,冰上配制混合液。在100℃预热好的金属浴中预热5min,完成蛋白的变性处理。
[0261]
蛋白marker:5μl marker加入20μl loading buffer。
[0262]
4.sds-page电泳分离
[0263]
(1)制胶
[0264]
10%aps配制:称取40mg aps粉末至试管,加入360μl去离子水,现配现用。
[0265]
将长、短玻璃板组装,长玻璃板带字样的一边朝上,将玻璃板固定于制胶框,再将制胶框固定在灌胶架上并检漏。
[0266]
根据所需胶的数量,按照下表配制resolver solution和stacker solution。在尽可能减少气泡的情况下充分混匀,当向玻璃板中添加resolver solution至加样梳下方1cm左右的位置;再加入stacker solution。
[0267]
表12.tgx预混液配制表
[0268][0269]
插入加样梳,室温静置30min。
[0270]
预制胶可放4℃保存,确保在一个月内使用。
[0271]
(2)上样及电泳
[0272]
将预制胶固定在电泳槽中,短玻璃向内侧插入。
[0273]
往内槽加满电泳液,外槽的电泳液最低须加到2plates液面处,最高不可漫过胶板,再缓慢地将梳子拔出,用移液器吸取电泳液轻轻吹打加样孔,去除加样孔内残余的储存缓冲液。将预染蛋白分子量标准和一定量的蛋白样品加入对应的胶孔中。
[0274]
连通电泳仪,在300v恒压条件下电泳17min,当溴酚蓝指示带电泳至胶板底部,或实验预定位置时,即可结束电泳。
[0275]
电泳结束后,取出凝胶,留作备用。
[0276]
5.转膜及封闭
[0277]
(1)根据伯乐转印试剂盒组装加厚滤纸-pvdf膜-胶条带-加厚滤纸,轻轻赶走气泡,在25ma恒流条件下转膜3min。
[0278]
(2)转膜后根据情况使用丽春红试剂对pvdf膜进行染色。对目标蛋白条带进行剪切。
[0279]
(3)使用tbst洗膜3次洗脱颜色,每次洗膜10min。
[0280]
(4)以tbst为溶剂将bsa配制成浓度为5%的封闭液,封闭1h。完成封闭后,使用tbst进行3次洗膜,每次10min。
[0281]
6.一抗孵育
[0282]
用含3%bsa的tbst按1000:1的比例稀释的一抗,将封闭后的膜转移至小号自封袋,向其中加入稀释的一抗,赶尽气泡,在4℃冰箱中孵育12h,使用β-actin来作内参蛋白。
[0283]
7.二抗孵育
[0284]
(1)完成孵育一抗后,使用tbst洗膜3次,每次10min。洗膜后,将膜放到滤纸上吸去表面溶液,放入自封袋中,向其中添tbst稀释好的hrp标记的二抗(抗兔/抗鼠),室温孵育1h即可。
[0285]
(2)完成孵育二抗以后,使用tbst洗膜3次,每次10min。洗膜后,将膜放到凝胶显色仪的板上,显色前用滤纸吸走去膜表面溶液。
[0286]
8.蛋白检测
[0287]
制好ecl超敏显色工作液,滴加到膜上,避光反应2-3min,用凝胶显色仪曝光拍照。之后用image j分析膜上条带浓度,以计算相对目标蛋白表达量。
[0288]
二、实验结果
[0289]
1.三七花对pge-2分泌的影响,结果如图3和图4所示。
[0290]
2.三七花对ll-37分泌的影响,结果如图5和图6所示。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。