neurod1蛋白在制备用于使神经元迁移的药物中的应用
技术领域
1.本发明属于神经生物学领域,具体涉及neurod1蛋白在制备用于使神经元迁移的药物中的应用。
背景技术:
2.神经退行性疾病的常见病理特征是神经元的进行性死亡,例如阿尔茨海默氏病,帕金森氏病和亨廷顿氏病。通过诱导的新生神经元来替代死亡或损伤的神经元作为一种新的治疗策略已经进行了大量的科学研究。然而,哺乳动物大脑内部的成年神经发生在一些局部区域,在人类尸体样本中也非常稀疏。体外干细胞的移植作为一种细胞替代策略,并已显示出在成年哺乳动物脑中产生新神经元,但诸如免疫排斥和肿瘤发生可能性等挑战仍然是被广泛用于临床的主要障碍。
3.作为修复受损大脑的另一种策略,已经发现,异位表达神经转录因子(如neurod1(神经元分化因子1)、sox2、ngn2和ascl1)后,小鼠大脑中的神经胶质细胞被直接转化为神经元。这些直接的原位转分化方法对于临床应用而言可能比外部干细胞移植更安全,更有效。
4.然而,目前还没有能够使神经胶质细胞转分化后的神经元向特定靶向组织迁移的方法。
技术实现要素:
5.本发明的一个目的是针对以上要解决的技术问题,提供一种能够高效、准确地实时追踪小鼠皮层星形胶质细胞转分化为神经元的方法。
6.为了实现以上发明目的,本发明提供了neurod1蛋白在制备用于使神经元迁移的药物中的应用。进一步地,所述迁移包括神经元在同一皮质层内的切向迁移、从表层皮质层垂直迁移到更深的皮质层和/或功能性地整合到整体神经环路中。
7.优选地,所述神经元是新生的神经元。
8.优选地,所述神经元是由星形胶质细胞原位转分化而成的。
9.优选地,使所述神经元迁移到特定的靶组织。
10.本发明还提供了neurod1蛋白在制备用于靶向治疗神经退行性疾病的药物中的应用。所述的神经退行性疾病包括但不限于阿尔茨海默症、帕金森症、肌肉萎缩性侧索硬化症、亨廷顿舞蹈病、脊髓性肌萎缩症、多发性硬化症等。
11.本发明还提供了neurod1蛋白在制备用于靶向治疗脑损伤的药物中的应用。所述脑损伤的原因包括但不限于创伤、中风、肿瘤、感染、滥用药物、低氧、缺氧、毒素、栓塞、血肿、脑出血等。
12.所述药物还可以包括药学上可接受的载体,该药学上可接受的载体指用于给药的载体,包括各种赋形剂和稀释剂。合适的载体是本领域普通技术人员所熟知的。
13.本发明还提供了一种实时追踪小鼠皮层星形胶质细胞转分化为神经元的方法,该
方法包括以下步骤:
14.s1、在小鼠皮层星形胶质细胞中过表达神经转录因子neurod1;
15.s2、采用双光子显微镜实时追踪星形胶质细胞原位转分化为神经元。
16.优选地,所述步骤s1包括:将表达neurod1的重组病毒载体感染小鼠皮层星形胶质细胞。更优选地,所述病毒载体为腺相关病毒载体。或者,更优选地,所述病毒载体为逆转录病毒载体。
17.本发明在小鼠皮层星形胶质细胞中过表达神经转录因子neurod1,并采用双光子显微镜实时追踪星形胶质细胞原位转分化为神经元的动态过程。本发明使用双光子显微镜以高时空分辨率图像观察小鼠大脑,有助于解码星形胶质细胞向神经元转化过程的动态变化。历时数周的活体成像有效展现了脑内胶质细胞从具有许多短突起的典型星形胶质细胞形态逐步过渡到具有动态生长锥和长神经突起的典型神经元形态的过程。此外,新生的神经元还会沿着切线或垂直方向迁移到脑内适当的位置。本发明表明,哺乳动物的大脑具有高度的可塑性,并且胶质细胞原位转分化技术可以有效重建受损的神经环路。
附图说明
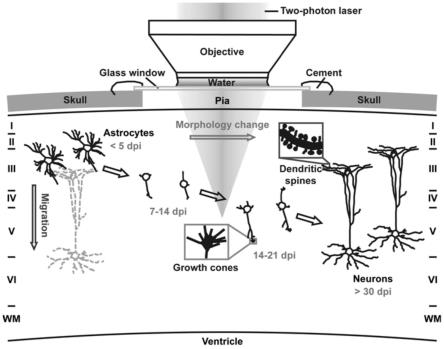
18.图1示出了双光子活体成像追踪小鼠皮层星形胶质细胞被aav neurod1感染后向神经元转化的过程。(a)对照病毒aav gfap::gfp感染的星形胶质细胞的双光子实时成像展示了从病毒感染后5天(dpi)到45dpi的40天内细胞未发生明显的形态或位置变化。(b)延时图像显示了被aav gfap::neurod1-p2a-gfp感染后3周内星形胶质细胞的形态变化。neurod1-gfp感染的细胞(箭头)最初显示为星形细胞形态,但逐渐变为神经元形态,显示出伸长的神经元样突起。gfp在23dpi处的染色显示了星形胶质细胞转化的神经元突起上有树突棘样的结构。(a)和(b)的比例尺为20微米。(c)在3个不同的转化阶段对neurod1感染的细胞进行统计分析。***p《0.001,f(2,27)=10.8;进行单因素方差分析(n=4只动物的10个细胞)。***p《0.001;9-11dpi组和21-23dpi组之间的比较。神经元样细胞的定义是最长突起/胞体直径≥4,最长突起/第二最长突起≥2(除非第二最长突起/胞体直径≥4)。误差棒代表sem。(d)在30dpi和60dpi的小鼠皮层中神经元转化效率(neun gfp /gfp )的定量分析。****p《0.0001,f(2,14)=10537;采用单因素方差分析(gfp对照组,n=6,dpi 30;neurod1实验组,dpi 30,n=5;neurod1实验组,dpi 60,n=6)。****p《0.0001;gfp对照组与neurod1实验组dpi 30。****p《0.0001;gfp对照组与neurod1实验组dpi 60。误差棒代表sem。
19.图2示出了在体双光子活体成像观察到携带neurod1的逆转录病毒感染胶质细胞后能够快速完成转分化。(a)延时成像显示了从逆转录病毒感染的神经胶质细胞到具有长轴突和生长锥的神经元样细胞的过渡变化(白框)。比例尺,20微米。(b)胶质细胞转化的神经元的生长锥的动态变化。生长锥在24小时内展现了收缩和延伸的动态变化。比例尺,10微米。(c)在两光子实时成像后,免疫染色揭示了neurod1-gfp转换的神经元中有弱neun信号(箭头)。比例尺,20微米。(d)neurod1感染后3个不同时间点的细胞转化过程的统计分析,显示了细胞类型从神经胶质细胞逐渐转化成神经元细胞。***p《0.001,f(2,30)=10.21;单因素方差分析(来自3只动物的n=11个细胞)。***p《0.001;4dpi组和10dpi组之间的比较。*p《0.05;7dpi组和10dpi组之间的比较。误差棒代表sem。
20.图3示出了neurod1介导的星形胶质细胞向神经元转化过程中的细胞迁移。(a)代表性示例显示胶质细胞转化过程中的切向迁移(箭头)。同一组细胞在neurod1-gfp感染的4、6和8dpi的分别以蓝色,红色和绿色伪彩色显示。合并图像中的白色(白色箭头)表示细胞的相对位置固定。箭头指向正在迁移的细胞。比例尺,50微米。(b)细胞迁移速度的量化。胶质细胞(红线)没有迁移。(c)代表性示例显示neurod1 aav感染的星形胶质细胞在小鼠皮层的垂直迁移。比例尺,10微米。(d)neurod1感染的细胞中免疫染色分析细胞迁移情况。冠状脑切片显示gfp阳性细胞在dpi 7均匀分布在不同的皮质层,但在30和60dpi逐渐向第5层集中。(e)在3个不同时间点对不同皮质层之间的gfp阳性细胞进行定量分析。第2/3层:**p《0.01,f(2,6)=21.79;第4层:**p《0.01,f(2,6)=19.87;第5层:****p《0.0001,f(2,6)=74.71;进行单因素向方差分析(每组n=3只动物)。第2/3层:*p《0.05;30dpi组和60dpi组之间的比较。**p《0.01;7dpi组和60dpi组之间的比较。第4层:*p《0.05;30dpi组和60dpi组之间的比较。**p《0.01;7dpi组和60dpi组之间的比较。第5层:**p《0.01;7dpi组和30dpi组之间的比较。**p《0.01;30dpi组和60dpi组之间的比较。****p《0.0001;7dpi组和60dpi组之间的比较。误差棒代表sem。
21.图4示出了neurod1转化神经元的突起shool分析。(a)细胞印迹显示胶质细胞被aav和逆转录病毒感染后的主要分支情况。比例尺,20微米。(b)在不同时间点对aav感染的gfp(红色)或neurod1(蓝色)细胞进行shool分析(gfp组中n=10个细胞;neurod1组中n=8个细胞;两组中n=3个动物)。***p《0.001,f(3,27)=65.17(2因子相互作用);进行双向重复测量方差分析。*p《0.05;**p《0.01;***p<0.001。误差棒代表sem。(c)在不同时间点对逆转录病毒感染的细胞进行shool分析(n=来自3只动物的6个细胞)。**p《0.01,f(2,18)=6.92(双因子相互作用);双向重复测量方差分析。*p<0.05。误差棒代表sem。
22.图5示出了星形胶质细胞转化的神经元具有功能。(a)代表图像显示脑切片记录的实时图片。在相衬(左图)和荧光模式(右图,gfp信号)下观察记录的细胞。比例尺,20微米。(b-d)来自被对照aav9 gfap::gfp(30dpi)感染的星形胶质细胞的代表性迹线。没有记录动作电位或突触反应。(e-g)在30dpi下被aav9 gfap::neurod1-gfp感染的细胞的代表性迹线,显示出重复动作电位(e),na 电流(f)和自发突触事件(g)。(h)neurod1转化的神经元(绿色)显示出树突棘,并在60dpi时与synapsin 1毗邻。比例尺:5微米。
23.图6示出了小鼠皮层星形胶质细胞向神经元的转化过程以及迁移和成熟过程。星形胶质细胞表达被neurod1后缩回许多精细突起,并在1-2周内延长一个或两个较长的突起。然后,转化的新生神经元显示出活跃的生长锥,以探索局部环境。同时,部分转化的新生神经元沿切线或垂直方向迁移,以找到正确的目的地。最终,新生神经元将发育成熟的顶树突和树突棘。
24.图7示出了被aav9 gfap::gfp感染的星形胶质细胞的形态变化。
25.图8示出了被neurod1-gfp感染的星形胶质细胞的形态变化。
26.图9示出了被对照病毒gfap::gfp、neurod1-gfp感染的细胞的蛋白表达情况。
27.图10示出了在cag启动子下neurod1-gfp的逆转录病毒在感染细胞中的表达情况。
具体实施方式
28.以下结合具体实施例,对本发明作进一步说明。应理解,以下实施例仅用于说明本
发明,而非用于限制本发明的范围。
29.一、方法
30.1、动物
31.野生型(c57bl/6j)小鼠购自广东省实验动物中心(中国广州)。将所有动物保持在标准实验室条件下,12h/12h光照/黑暗循环,并提供标准小鼠饲料(广东医学实验室动物中心)和蒸馏水。所有动物程序均按照arrive(体内实验动物研究报告)指南进行,并得到暨南大学iacuc的批准。
32.2、颅骨薄窗口准备和病毒注射
33.对4-8周龄的c57小鼠进行了脑外科手术以进行病毒注射。通过腹膜内注射20ml/kg的1.25%avertin(sigma,t48402)麻醉小鼠。眼药膏(广州白云山制药有限公司)用于遮盖和保护小鼠的眼睛。剔除大部分头毛,在头皮上切开一个切口,并去除结缔组织以露出颅骨。将少量氰基丙烯酸酯胶粘在头部固定适配器的边缘周围,以将头骨固定在固定装置上。然后,在解剖显微镜(carl zeiss stemi 305,德国)下使用高速颅钻(microdrill 78001,rwd life science)在小鼠新皮层上方的颅骨区域磨薄一个圆形窗口。磨薄过程中可使用人工脑脊液浸润。去除大部分松质骨后,继续用显微外科手术刀片使颅骨变薄,以获得非常薄且光滑的透光窗口。完成薄颅骨的准备工作后,使用立体定位仪器(型号940,kopf,美国),超微注射器泵(ump3 ultramicroppump,world precision,美国)和基于微处理器的控制器(micro4,world precision)进行病毒注射。病毒注射量和注射速度分别为1ml和0.12ml/min。病毒注射后,将针头留在原处约10分钟,然后缓慢拔出。病毒注射后3天开始进行双光子成像。薄颅骨方法适用于逆转录病毒感染的小鼠。
34.3、开颅玻璃窗准备
35.还对注射aav9和aav5的小鼠进行了长期颅窗成像,需要通过开颅玻璃窗进行双光子成像。病毒注射一天后,在超净工作台(sw-cj-1fd,airtech系统有限公司)中进行了开颅窗手术。用avertin麻醉小鼠。将头发剃净,并用碘酊和乙醇洗涤头皮。使用不锈钢头部固定适配器将氰基丙烯酸酯胶固定在头部上。使用高速颅钻(microdrill 78001,rwd life science)磨薄头骨表面区域的直径(2-3毫米)的圆环,然后再将圆环头骨抬起并取出。接下来,尽快用盖玻片(warner,cs-3r)盖住圆形窗口。使用组织粘合剂(3m,1469sb)粘合头骨和盖玻片。用牙科丙烯酸(常熟尚志牙科材料有限公司)将光学窗密封在颅骨上。为了避免炎症反应,通过肌肉注射方式给予地塞米松(~2mg/kg体重)。小鼠需要7到10天才能恢复炎症反应,以获得更好的成像质量。
36.4、体内双光子实时成像
37.本实验中使用配备有ti:sapphire激光源(120fs宽度脉冲,90mhz重复频率,美国coherent inc.)的双光子显微镜(zeiss lm780,德国oberkochen)。在长期重复成像过程中,将小鼠放在成像平台(北京兴林生物技术有限公司)上。激发波长设定为920nm,使用20倍水浸物镜(n.a.1.0,卡尔
·
蔡司,德国oberkochen)进行成像。图像大小为106.27微米
×
106.27微米或212.55微米
×
212.55微米。成像深度约为距硬脑膜(皮质的ii-v层)100-700微米。
38.5、组织制备和免疫荧光
39.用20ml/kg的1.25%avertin麻醉动物,然后用盐溶液(0.9%nacl)进行心脏灌流,
然后用4%多聚甲醛(pfa,sigma-aldrich,美国)灌注以固定大脑。取出大脑并在4%pfa中固定过夜,然后依次浸泡在质量浓度10%、20%、30%的蔗糖溶液(美国sigma-aldrich)中以脱水。然后在冰冻切片机(cryostar nx50,thermo fisher scientific,美国)进行切片。首先在磷酸盐缓冲液(pbs,ph 7.4)中预处理冠状脑切片3次,每次10分钟。然后在5%驴血清(gibco,美国),3%牛血清白蛋白(bsa,sigma-aldrich)和0.2%triton x-100的pbs溶液浸泡1小时。然后将一抗溶解在5%正常驴血清,3%bsa和0.2%triton x-100的pbs中于4℃孵育过夜。次日将脑片在0.2%pbst(0.2%tween-20的pbs)中进一步洗涤3次后,进行二抗孵育,将样品与dapi和与alexa fluor 488、alexa fluor 555或alexa fluor 647(1:1000,invitrogen,usa)偶联的适当二抗一起孵育在室温2小时,然后用pbst洗涤3次。最后用适当的防淬灭封片剂(vectashield,vector laboratories,美国)进行封片。样品用共聚焦显微镜(zeiss,lsm880,oberkochen,德国)成像,并用zen 2.3blue版进行分析。
40.6、抗体
41.使用了以下一抗:单克隆抗neun(兔,1:1000,abcam,ab177487),单克隆抗神经胶质纤维酸性蛋白(gfap,小鼠,1:1000,sigma,g3893),多克隆抗绿色荧光蛋白(gfp,鸡,1:1000,abcam,ab13970),单克隆抗neurod1(小鼠,1:1000,abcam,ab60704),多克隆抗微管相关蛋白2(map2,鸡,1:2000,abcam,ab5392),单克隆抗ctip2(大鼠,1:1000,abcam,ab18465),单克隆抗cux1(小鼠,1:500,abcam,ab54583),多克隆抗突触蛋白1(兔,1:1000,sigma,s193)。
42.7、膜片钳记录
43.通常在注射病毒后1个月准备进行膜片钳记录,在冰冷切割溶液(含有75mm蔗糖、85mm nacl、2.5mm kcl、0.5mm cacl2、4mm mgcl2、24mm nahco3、1.25mm nah2po4和25mm葡萄糖)中,用振动切片机(leica vt1000s,wetzlar,德国)进行300微米冠状切片。将切片孵育在包含126mm nacl、2.5mm kcl、1.25mm nah2po4、26mm nahco3、2mm mgcl2、2mm cacl2和10mm葡萄糖的人工脑脊髓液(acsf)中。在33℃持续孵育15分钟后,然后在室温持续通入95%o2和5%co2的混合气体。使用含135mm葡萄糖酸钾、10mm kcl、5mm磷酸肌酸钠、10mm hepes、2mm egta、4mm mgatp和0.5mm na2gtp(ph 7.3,用koh调节,渗透压:290mosm/l)的灌流液中进行全细胞记录,电极电阻为3
–
8mω。电压钳钳制电位为-70mv。使用pclamp 10.4软件(molecular devices,美国加利福尼亚州帕洛阿尔托)收集数据,以10khz采样并以1khz进行过滤,然后使用clampfit软件(molecular devices,美国加利福尼亚州帕洛阿尔托)进行分析。
44.8、统计分析
45.graphpad prism v7.0用于统计分析。每组动物的样本量至少为n=3,细胞n=10。为了进行统计分析,采用one-way anova(图1至图3)或two-way anova(图4)进行比较分析。统计结果表示为平均值
±
sem(误差线)。当p值《0.05时,组之间的差异被认为是显著的。
46.二、结果
47.1、星形胶质细胞向神经元转化过程的活体双光子实时成像
48.为了在双光子显微镜下追踪星形胶质细胞向神经元的转化过程,用荧光标记物特异性标记星形胶质细胞以进行长期延时成像。
49.为了实现这个目的,将病毒载体aav9 gfap::gfp注射到小鼠皮层中,该病毒在星
形胶质细胞特异性启动子gfap的控制下表达gfp,发现基本上所有感染gfp的细胞都处于典型的星形细胞形态(图1,a)。免疫染色证实,感染了gfap::gfp的细胞确实是gfap阳性的星形胶质细胞(图9,a),表明aav9 gfap::gfp以高特异性感染星形胶质细胞。
50.为了验证被aav9 gfap::gfp感染的星形胶质细胞的形态变化,连续几天进行双光子成像,以小鼠皮层表面的血管被用作重新定位先前成像区域的标志(图7)。
51.病毒注射(dpi)后5天至45dpi的双光子成像结果显示,感染gfp的星形胶质细胞不仅表现出典型的星形胶质细胞形态,并具有许多精细的突起,而且在40天内仍保持在同一位置(图1,a),这表明星形胶质细胞不会在成年小鼠的大脑或脊髓内部迁移。通过病毒载体(aav9 gfap::neurod1-gfp(参见yuchen chen,mol ther,2020))将neurod1表达在星形胶质细胞时,neurod1-gfp感染的细胞最初也显示出典型的星形胶质细胞形态,并有许多细微的突起(图1,a,11dpi)。然而,在病毒注射后约两周,被neurod1-gfp感染的星形胶质细胞开始失去精细的突起,而一个或两个类似于神经突的细长突起开始出现并逐渐伸长(图1,b,14
–
20dpi,参见图8)。当23dpi取材固定并用gfp染色后发现,被neurod1-gfp感染的细胞显示出清晰的神经元形态甚至树突状突起(图1,b,dpi 23)。定量分析显示,在感染10dpi之前,大多数被neurod1-gfp感染的细胞是星形胶质样细胞,然后在22dpi之前转化为神经元样细胞(图1,c)。为了确认这些星形胶质细胞转化细胞的神经元身份,在双光子实时成像结束后进行了一系列免疫染色。对照病毒aav9 gfap::gfp感染的细胞在30dpi时对神经元标记neun免疫阴性(图1,d,gfp),但是大多数neurod1-gfp感染的细胞(约90%)在30和60dpi时对neun免疫阳性(图1,d,neurod1-gfp)。此外,gfap免疫染色还证实对照病毒aav9 gfap::gfp感染的细胞确实是gfap阳性的星形胶质细胞(图9,a),并且neurod1-gfp感染的细胞也在gfap阳性星形胶质细胞中表达neurod1蛋白(图9,b)。除neun染色外,进一步证实neurod1-gfp感染的细胞表达了神经元特异性细胞骨架蛋白map2(图9,c)。
52.此外,用皮质层特异性标记cux1和ctip2进行免疫染色可确定neurod1-gfp转化的神经元显示出皮质神经元身份(图9,d)。
53.这些双光子实时成像研究明确表明,星形胶质细胞可以直接在小鼠皮层中转化为神经元。
54.2、逆转录病毒系统观察体内星形胶质细胞向神经元的转化
55.上面的体内双光子成像显示了从星形胶质细胞到神经元的明显形态变化,但是由于aav可以同时感染星形胶质细胞和神经元,因此进一步采用了逆转录病毒,其只能在分裂细胞(如神经胶质细胞)中表达靶基因,而不能在非分裂细胞(如非分裂的神经元)中表达靶基因。
56.使用逆转录病毒载体gfap::cre(guo等人,cell stem cell,2014)和flex-cag::neurod1-p2a-gfp(guo等人,cell stem cell,2014),经过cre介导的基因重组后,neurod1在启动子cag控制下可以长期表达,并且主要在小鼠皮层中的分裂型星形胶质细胞中表达。与aav感染的星形胶质细胞不同,被逆转录病毒感染的分裂型星形胶质细胞即使在病毒注射后的早期也常常显示较少的突起(图2,a,7dpi)。
57.与aav9 gfap::neurod1-gfp不同,其转化过程中gfap启动子可以被neurod1抑制,而逆转录病毒neurod1-gfp是在cag启动子控制之下,在感染细胞中的表达非常强,并且神经元转化过程也被加速(图2,a和图10,a-b)。
58.发现neurod1-gfp逆转录病毒感染的细胞迅速延长一到两个具有多个生长锥的长突起(图2,a,白框)。新转化的神经元的生长锥在双光子实时成像的24小时内显示出高度动态的变化(图2,b),表明这些新生成的神经元正在积极探索局部环境并可能在寻找其目标区域。
59.经过实时成像分析后,将大脑样本固定并进行免疫染色,以确认逆转录病毒neurod1-gfp感染的细胞确实是neun阳性的神经元(图2,c和图10,c-d,箭头)。逆转录病毒感染细胞的定量分析显示,在10dpi,超过70%感染了neurod1-gfp的细胞显示了的神经元形态(图2,d),这比aav诱导的速度要快得多(图1,c)。
60.这些体内双光子实时成像观察表明,新转化的神经元可以发出带有活动生长锥的长投射轴突,以探索小鼠皮层内部的局部环境。
61.3、neurod1介导的星形胶质细胞向神经元转化过程中发生了细胞迁移
62.在星形细胞到神经元转换过程的长时程双光子成像过程中,偶然观察到小鼠皮层中neurod1转化的神经元的细胞迁移现象。
63.被对照病毒gfp感染的星形胶质细胞很少显示任何位置变化(图1,a),但许多被neurod1-gfp感染的细胞显示出明显的迁移运动(图3,a,c)。
64.在图3-a中,对neurod1-gfp感染的细胞在不同时间进行了伪彩色以追踪它们的相对位置,然后将它们覆盖在一起。如箭头所指,感染了neurod1-gfp的细胞在dpi 4和8之间显示出清晰的细胞体移位(图3,a,在合并图像中从蓝色位置到绿色位置》60μm)。由于这种细胞位置变化发生在同一皮质层内,因此将其称为切向迁移。切向迁移速度的定量显示,逆转录病毒neurod1注射后,新转化的神经元开始在4dpi位置发生改变,并在6和8dpi时增加了迁移速度,而胶质细胞在同一时期停留在相同位置(图3,b)。
65.除了切向迁移,当以垂直方式重建被neurod1-gfp感染的细胞的两光子图像时,发现一些新转化的神经元也从表层皮质层垂直迁移到更深的皮质层(图3,c)。因此,星形胶质细胞转化的神经元可能不会被限制在原始位置,而是会在脑回路内迁移以找到合适的位置。
66.为了更好地了解neurod1介导的细胞转化过程中的细胞迁移,分析被neurod1病毒感染的大量星形胶质细胞的位置变化。
67.为此,使用aav9 gfap::gfp标记跨不同皮质层(l1-l5)的星形胶质细胞(图3,d)。同时,将不含gfp的aav5 gfap::neurod1与aav9 gfap::gfp组合,将gfp标记的星形胶质细胞转化为神经元。该系统的优点是所有gfp标记的神经元都必须源自gfap::gfp感染的星形胶质细胞。如果gfap::neurod1意外感染神经元,它将不会显示gfp信号。通过这种设计,病毒感染初期(7dpi)的gfp 细胞大多数呈星形胶质细胞形态,并广泛分布在l1-l5皮层的不同层中(图3,d,7dpi),但是在30dpi时gfp阳性细胞不仅有明显的形态变化,而且是它们在不同层中的分布也发生了改变(图3,d,30dpi)。特别在60dpi时,大多数gfp阳性细胞表现出典型的神经元形态,并且大部分位于皮层第v层(图3,d),这与它们的早期分布模式形成鲜明对比。定量数据显示,dpi 7时在ii/iii层中发现了约50%的gfp 细胞,而在v层中仅发现了约30%的gfp 细胞。但在60dpi时,该比率相反,并且在v层中发现了约55%的gfp 细胞(图3,e),这与显示从表层垂直迁移到较深层的双光子实时成像数据一致。总之,这些数据表明,像早期大脑发育过程中的神经元分化和迁移一样,星形胶质细胞转化的新神经元也
可以在小鼠大脑内部迁移,可能找到合适的靶标位置。
68.4、细胞转化后神经突起生长的特征
69.尽管许多研究小组都报告了体内胶质细胞向神经元的转化,但目前尚不清楚这些新生成的神经元能在多快的时间内将神经突延伸到预先存在的神经环路中。为了回答这个问题,研究了小鼠皮质星形胶质细胞向神经元转化过程中神经突生长的时间过程。进行定量分析时,由于星形胶质细胞有许多精细的过程,难以逐日可靠地计数,因此主要专注于主干分支,以便在星形胶质细胞和新转化的神经元之间进行并排比较。图4-a说明了许多示踪的例子,显示了被aav9 gfap::gfp对照病毒(红色)或aav9 gfap::neurod1-gfp(蓝色)或逆转录病毒cag::neurod1-gfp(绿色)感染的细胞的主要分支。仅被gfp感染的星形胶质细胞在病毒注射后的不同时间点显示出许多相对较短的主要分支。相反,被neurod1感染的星形胶质细胞显示出较少的分支,并且有一到两根突起逐渐延长。为了量化星形胶质细胞和新转化的神经元的主要分支模式,采用了sholl分析来距胞体中心不同距离的主要分支的数量。如图4-b所示,被aav9 gfap::gfp对照病毒感染的星形胶质细胞在20μm的半径内约10个主要分支。相反,在被aav9 neurod1-gfp感染后,细胞在9-11dpi处约6个主要分支,而在21-23dpi处进一步下降至小于3个主要分支。另一方面,伴随着许多精细突起的退缩,新转化的神经元也展现出一些长分支的延伸,在neurod1感染2-3周后变得越来越长(图4,b)。值得指出的是,在星形胶质细胞向神经元的转化过程中,被aav9 gfap::neurod1-gfp感染的星形胶质细胞中gfap启动子活性可能被沉默,从而导致长期内越来越弱的gfp信号影响双光子实时成像。因此,由于gfap启动子的沉默,本研究中主要分支的数量和可见长度可能被低估了。相反,逆转录病毒cag::neurod1-gfp不会出现此问题,因为cag启动子可以在新转化的神经元中持续激活。因此,与aav感染的静息态星形胶质细胞相比,逆转录病毒感染的细胞通常处于增生阶段,新转化的神经元在几天之内(从6到10dpi)显著伸长了它们的神经突(图4,c)。根据对aav和逆转录病毒结果的定量分析,在成年的小鼠大脑中,神经突向外生长的平均速度的估计为4至40μm/天。神经突生长的速度取决于用于驱动neurod1表达的启动子和被感染的星形胶质细胞的状态,例如增殖性或非增殖性。
70.5、星形胶质细胞转化而来的神经元有功能性整合
71.为了进一步研究星形胶质细胞转化的神经元是否可以在功能水平整合到先前存在的神经环中,采用膜片钳记录来检测病毒注射后30天皮质切片中新转化的神经元的电生理特性(图5,a)。在对照组中,感染aav9 gfap::gfp的细胞不能激发任何动作电位(图5,b),不显示任何电压门控钠电流(图5,c),并且没有自发的突触反应(图5,d),与典型的星形细胞特性(n=11)一致。相反,被neurod1-gfp感染的细胞可以激发重复动作电位(图5,e),显示出较大的电压门控钠电流(图5,f),并显示出自发的突触反应(图5,g),与典型的神经元特性一致。(记录的28个细胞中有22个细胞有神经元功能特性)。此外,在60dpi使用突触标记synapsin1进行了免疫染色,发现突触前结构与neurod1-gfp阳性细胞的树突棘毗邻(图5,h),次结果证实了neurod1转换后的神经元已整合到小鼠皮质的突触回路中。综上所述,的双光子实时成像和膜片钳记录结果表明,星形胶质细胞可以直接转化为神经元,而神经元可以整合到先前存在的神经环路中。
72.在本发明的方法中,使用双光子实时成像技术解码了小鼠皮质内部星形胶质细胞向神经元的逐步转化过程。转化过程以胶质细胞的精细突起回缩开始,然后长出具有活跃
生长锥的长的神经突起,这表明新转化的神经元正在积极探索局部环境。在小鼠皮质中观察到星形胶质细胞转化而来的神经元有明显的切向和垂直迁移,这表明新生成的神经元正在与局部环境相互作用以找到正确的位置。另一方面,星形胶质细胞在几天和几周内仍保持在同一位置,这是由于星形胶质细胞之间形成了间隙连接,从而无法自由移动。通过电生理学记录,从星形胶质细胞转化的神经元中检测到重复的动作电位和自发的突触电流,表明这些新转化的神经元已在功能水平上整合到先前存在的脑环路中。图6总结了用双光子实时成像的主要结果示意图。本发明的研究清楚地表明,小鼠皮层中的星形胶质细胞可以直接转化为神经元,并暗示着哺乳动物的大脑环路具有很高的可塑性来适应这些新生的神经元。
73.本发明的方法捕获了小鼠皮质中从星形细胞到神经元细胞的逐步转化过程。迄今为止,终末分化的神经胶质细胞如何在复杂的3d脑结构内部逐渐转化为神经元是尚未解决的一个关键问题。双光子显微镜可提供高分辨率图像,高分辨率的实时图像描述了活体动物中星形胶质细胞向神经元的逐步转化过程。初始星形胶质细胞向神经元转化的过程中通常出现动态的生长锥,表明它们在转化后正在积极探索新的环境。在成年小鼠皮层中新转化的神经元中的这些活跃的生长锥使人联想到早期脑部发育过程中来自神经干细胞的新生神经元。因此,尽管环境差异很大,但年轻的成年小鼠皮层(》2个月大)中星形胶质细胞转化的神经元的行为有点像早期大脑发育过程中新生成的神经元。
74.观察到成年小鼠皮质的切向和垂直迁移。观察到的垂直迁移是从表层到深层,这与发育中的大脑中胚胎神经元的早期迁移路径相反。这种迁移表明,在成年小鼠皮层内有足够的局部条件可以与新生成的神经元相互作用并将其引导至合适的位置。实际上,在小鼠脑室下区和海马颗粒下区的成年神经发生已经为成年哺乳动物脑中的这种神经元迁移树立了很好的例子。
75.值得指出的是,与新产生的神经元迁移相反,在连续40天的实时成像过程中,仅被gfp感染而没有neurod1的星形胶质细胞根本没有移动,即星形胶质细胞通常不会在哺乳动物的大脑或脊髓中迁移。转化前星形胶质细胞和转化后新神经元之间迁移的强烈对比是成年哺乳动物脑中星形胶质细胞已转化为神经元的另一个证据,因为星形胶质细胞和本底成熟神经元都无法迁移。
76.对新近转化的神经元之间的生长锥和细胞迁移的明确鉴定表明,这些原位星形胶质细胞转化的神经元可能正在探索其局部环境,以找到合适的靶标区域。自发的突触反应表明其他神经元也将轴突投射到新转化的神经元以形成突触连接。新生成的神经元和预先存在的成熟神经元之间的双向轴突投射表明,星形胶质细胞转化的神经元可以功能性地整合到整体神经环路中。
77.总之,本发明的方法提供了在小鼠皮层中进行实时成像的首个证据,即星形胶质细胞可以直接在原位转化为神经元。新产生的神经元可以形成活跃的生长锥来探索局部环境,神经元胞体也可以迁移到复杂的脑回路内的新位置。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
