1.本发明涉及一种检测致泻大肠埃希氏菌的显色培养基,尤其涉及一种用于检测肠道致病性大肠埃希氏菌的显色培养基,属于食品安全微生物检验与监测领域。
背景技术:
2.肠道致病性大肠埃希氏菌(enteropathogenic escherichia coli, epec)是引起宿主肠黏膜上皮细胞黏附及擦拭性损伤且不产生志贺毒素的致泻大肠埃希氏菌。该菌是引起全球婴幼儿腹泻和成人散发性腹泻的重要病原菌之一,有高度传染性,严重可导致死亡。我国的食品安全国家标准中尚无针对性的epec标准检测方法,现有的国标方法gb4789.6-2016先分离出大肠埃希氏菌,再验证其中的12个关键特征基因确定属于哪种大肠埃希氏菌。目前国际上除肠道出血性大肠埃希氏菌(enterohemorrhagic e. coli, ehec) o157外还没有其他能通过培养分离识别致泻大肠埃希氏菌的产品,直接影响了epec的检出率,使食品安全存在巨大隐患。
3.显色培养基法以传统培养基为基础,通过特异性酶底物的代谢差异等细菌生化鉴定技术,把培养、分离、鉴别一次完成,操作简便,大幅度缩短了检测时间,并通过目标菌特征性识别提高了准确性,因此具有广阔应用前景,已应用于临床医学、食品卫生、环境保护等多个领域中沙门氏菌、弧菌、李斯特氏菌、ehec o157等细菌检测。epec和ehec的表型特征相近,能否产生志贺毒素是区分两者的关键。目前关于ehec o157的显色培养基的原理是普通大肠埃希氏菌具有β-d-葡萄糖醛酸酶,而ehec o157该酶为阴性;ehec o157不发酵山梨醇和对亚碲酸盐具有抗性;利用这种差异在培养基中添加相应的酶底物,就可通过表型特征不同,有效用于ehec o157分离。还有2篇美国专利提到用α-半乳糖苷酶和β-葡萄糖苷酶底物结合亚碲酸钾优化后的培养基不仅可分离识别o157,还可识别产志贺毒素大肠埃希氏菌如o26、o103、o111、o145等肠道出血性大肠埃希氏菌的实例,这些说明了应用显色培养基法分离和识别epec的可行性。
4.综上所述,为解决现有技术中的不足,迫切需要建立一种用于检测肠道致病性大肠埃希氏菌的显色培养基,以实现食品中epec高效准确的分离与检测。
技术实现要素:
5.本发明的目的是针对现有技术的不足,提供一种适用于食品检测样本中肠道致病性大肠埃希氏菌的分离与检测的显色培养基。
6.本发明运用生物化学,微生物学及无机、有机和分析化学的原理,对不同的碳源、氮源、无机盐类、维生素、ph 值等因素进行筛选优化,研究出了本发明的培养基。
7.本发明所采取的技术方案为:一种用于检测肠道致病性大肠埃希氏菌的显色培养基,其特征在于,每1000ml的培养基包括:蛋白胨15~20g、丙酮酸钠1~5g、氯化钠2~5g、d-山梨醇5~10g、d-苹果酸1~5g、胆盐1~5g、磷酸氢二钾2~5g、磷酸二氢钾1~5g、氢氧化钠1~3g、高岭土10~15g、溴百里酚蓝0.05
~0.08g、结晶紫0~0.01g、聚乙二醇1~2g、琼脂15~18g,余量为水,ph为7.0
±
0.2。
8.在一些实施例中,优选为,所述蛋白胨为细菌学蛋白胨。
9.在一些实施例中,优选为,所述胆盐为三号胆盐。
10.在一些实施例中,优选为,所述聚乙二醇优选为peg4000。
11.本发明根据典型肠道致病性大肠埃希氏菌(typical epec,tepec)、非典型肠道致病性大肠埃希氏菌( atypical epec,aepec )以及普通大肠埃希氏菌对d-山梨醇、d-苹果酸及蛋白胨的代谢差异,利用指示剂溴百里酚蓝,对三者进行区分。其中tepec无法利用d-山梨醇和d-苹果酸,只能分解蛋白胨产碱,在溴百里酚蓝作用下,呈蓝绿色菌落和蓝色背景;aepec无法利用d-苹果酸,但在丙酮酸存在时,优先分解d-山梨醇产酸,在溴百里酚蓝作用下,呈黄色菌落。但随着时间增长,逐渐分解蛋白胨产碱,呈绿色背景;普通大肠埃希氏菌可同时分解d-山梨醇、d-苹果酸和蛋白胨,在溴百里酚蓝作用下,呈黄色以及蓝绿色菌落和蓝色背景。
12.本发明在培养基中添加了胆盐和结晶紫,可抑制样品中革兰氏阳性细菌的生长。
13.本发明在培养基中添加了高岭土,使培养基各组分分散的更均匀,并在表面吸附目标菌并通过交换金属离子刺激其生长,同时可以使固体培养基呈乳白色本底,使菌落的颜色更加明显突出。
14.细菌在本发明培养基呈现的菌落特征为:tepec无法利用d-山梨醇和d-苹果酸,呈蓝绿色菌落和蓝色背景;aepec无法利用d-苹果酸,但能优先利用d-山梨醇呈黄色菌落和绿色背景;普通大肠埃希氏菌可同时分解d-山梨醇、d-苹果酸和蛋白胨,呈黄色以及蓝绿色菌落和蓝色背景。
15.本发明的显色培养基用于分离和检测epec的方法,包括如下步骤:1) 显色平板的制备:将上述显色培养基除了琼脂、细菌蛋白胨、d-苹果酸的各组分,加入到1000ml去离子水中,搅拌溶解,此时溶液呈蓝色;加入d-苹果酸并调节ph至7.0
±
0.2,此时溶液呈绿色。最后加入细菌蛋白胨和琼脂到溶解完全的培养基中。加热煮沸,待冷却至50~55℃,无菌操作,倒平板,备用。
16.2) 样品处理:以无菌操作称取样品25 g,加入装有225ml缓冲蛋白胨水(bpw) 的无菌带滤网均质袋内,均质器拍打1~2 min,制成 1:10的样品匀液,在41
±
1℃培养过夜。
17.3) 酸处理:无菌操作,吸取0.5ml增菌液,用盐酸将ph调节至2.0,震荡混匀1~2h。
18.4) 孵育:8000
×
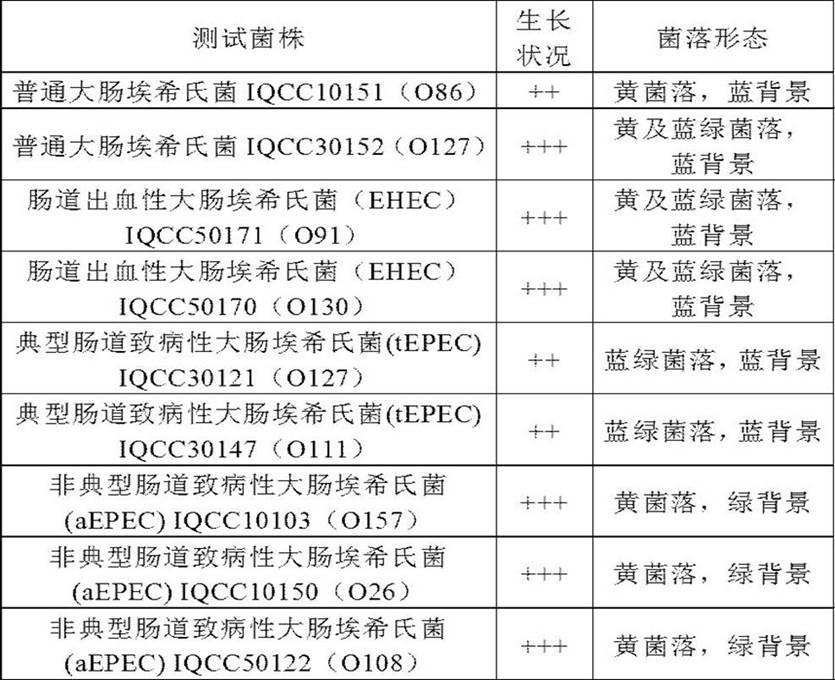
g离心2min,去上清,加入0.5 ml丙酮酸盐改性缓冲蛋白胨水(mbpwp),36
±
1℃静置培养1~2h后,用无菌接种环划线于结晶紫中性红琼脂(vrba)上,36
±
1℃培养18~24 h。
19.5) 接种培养:选取紫红色单菌落接种至显色平板上,33
±
1℃培养18~24 h。
20.6)结果分析:tepec呈蓝绿色菌落和蓝色背景;aepec呈黄色菌落和绿色背景;普通大肠埃希氏菌呈黄色以及蓝绿色菌落和蓝色背景。
21.本发明的有益效果是:本发明的显色培养基可用于肠道致病性大肠埃希氏菌的分离和检测,具有特异性强、灵敏度高、易于操作、结果判断简单等优点,适合于食品样本的检测,有广泛的应用前景。本发明的显色培养基不仅可以检测epec,还可以区分tepec和aepec。
具体实施方式
22.下面的实施例可以使本领域技术人员更全面地理解本发明,但不以任何方式限制本发明。
23.实施例1:本发明所述的显色培养基对肠道致病性大肠埃希氏菌的特异性实验。
24.1) 固体平板制备:按照配方为每1000ml的培养基中包含细菌学蛋白胨15g、丙酮酸钠1.5g、氯化钠2.5g、d-山梨醇6g、d-苹果酸5g、3号胆盐1.5g、磷酸氢二钾5g、磷酸二氢钾1.5g、氢氧化钠1.8g、高岭土15g、溴百里酚蓝0.08g、结晶紫0.001g、peg4000 1g、琼脂15g,余量为水,ph为7.0
±
0.2制备培养基。将上述显色培养基除了琼脂、细菌蛋白胨、d-苹果酸的各组分,加入到1000ml去离子水中,搅拌溶解,此时溶液呈蓝色;加入d-苹果酸并调节ph至7.0
±
0.2,此时溶液呈绿色。最后加入细菌蛋白胨和琼脂到溶解完全的培养基中。加热煮沸,待冷却至50~55℃,无菌操作,倒平板,备用。
25.2) 菌种活化与培养:受试菌包括普通大肠埃希氏菌iqcc10151(o86)、iqcc30152(o127),肠道出血性大肠埃希氏菌(ehec) iqcc50171(o91)、iqcc50170(o130),典型肠道致病性大肠埃希氏菌(tepec) iqcc30121(o127)、iqcc30147(o111),非典型肠道致病性大肠埃希氏菌(aepec) iqcc10103(o157)、iqcc10150(o26)、iqcc50122(o108)。其中iqcc 为中国检验检疫微生物菌种保藏管理中心(inspection quarantine culture collection)的简写,每株菌在试验前均经过了全基因组测序的验证。
26.将上述菌种分别活化后接种于哥伦比亚血琼脂平板,在相应最适温度下培养18~24h,直至出现明显菌落。分别挑取3~5个菌落,分散于tsb液体培养基中制成菌悬液。将菌悬液的浊度调整至0.5麦氏比浊标准,此时菌悬液的浓度为1.5
×
10
8 cfu/ml,备用。
27.3) 接种:将上述10株菌株制成的菌悬液,分别取一环划线接种于配制好的显色平板上,33
±
1℃培养18~24h,观察菌落的显色情况。
28.4) 结果分析:肠道致病性大肠埃希氏菌(epec)在此平板上生长良好,tepec呈蓝绿色菌落和蓝色背景;aepec呈黄色菌落和绿色背景;普通大肠埃希氏菌呈黄色以及蓝绿色菌落和蓝色背景;详细结果见表1。
29.表1:实施例1的实验结果。
30.实验结果说明此培养基可以很好的区分肠道致病性大肠埃希氏菌(epec)与其他大肠埃希氏菌。
31.实施例2:本发明所述的显色培养基对肠道致病性大肠埃希氏菌的生长特性实验。
32.1) 固体平板制备:见实施例1。
33.2) 菌种活化与培养:见实施例1。
34.3) 接种:选择合适稀释度的工作菌悬液0.1ml,均匀涂布接种于显色培养基和参比平板tsa。每一稀释度接种两个平板。每平板的接种水平为20~200 cfu,33
±
1℃培养18~24h,记录菌落直径及计算回收率。
35.4) 结果分析:菌落直径d(mm)及回收率(pr)结果见表2。
36.表2:实施例2的实验结果。
h。
45.5) 培养选取紫红色单菌落接种至显色平板上,33
±
1℃培养18~24 h ,观察菌落的显色情况。
46.6) 结果分析使用酸处理后,vrba上只有大肠埃希氏菌存活,再根据显色培养基的特征性菌落,识别出epec。详细结果见表3。
47.表3:实施例3的实验结果。
48.实施例4:牛肉样品中肠道致病性大肠埃希氏菌的检测。
49.1) 相关培养基配制:固体平板制备:参照实施例1和2配置平板;丙酮酸盐改性缓冲蛋白胨水(mbpwp)、酸处理液的制备:参照实施例3配置。
50.2) 人工污染样品的制备:将高温杀菌过的牛肉样品按照102cfu/25g的接种水平分别接种普通大肠埃希氏菌iqcc10151(o86)、典型肠道致病性大肠埃希氏菌(tepec) iqcc30147(o111)和非典型肠道致病性大肠埃希氏菌(aepec) iqcc10150(o26),分别编号样品1,样品2,样品3;无添加样品编号为样品4。
51.3) 样品处理:将4个样品加入225ml bpw中,均质混匀后,在41
±
1℃前增菌8~10h后,分别吸取增菌液0.5ml,调节ph为2.0左右,室温振荡混匀2h。
52.4) 接种培养:8000
×
g离心2min,去上清,加入0.5 ml mbpwp,36
±
1℃静置培养1h后,用无菌接种环划线于vrba上,36
±
1℃培养18~24 h。选取紫红色单菌落接种至显色平板上,33
±
1℃培养18~24 h ,观察菌落的显色情况。
53.5) 结果分析:使用该方法可从食品中检测出肠道致病性大肠埃希氏菌epec,详细结果见表4。
54.表4:实施例4的实验结果。
55.上述具体实施方式中的实施例是说明性的而不是限定性的,可按照所限定范围列举出若干个实施例,因此在不脱离本发明总体构思下所做的任何变化和修改,都应属本发明所限定的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。