一种基于靶向vvha基因准确检测创伤弧菌的检测方法
技术领域
1.本技术涉及生物检测技术领域,具体而言,涉及一种基于靶向vvha基因准确检测创伤弧菌的检测方法。
背景技术:
2.创伤弧菌(v.vulnificus)导致的原发性败血症临床致死率高达50%以上,是食源性感染致死致伤率最高的一种海洋弧菌。
3.目前,v.vulnificus的临床检测仍然以基于病原学培养的检测方法为主,需经过24-48h富集培养、选择性平板分离以及生化鉴定在内的一系列复杂过程,这不仅费时费力,而且临床血液和伤口等类型样本中的其他嗜盐菌的过度繁殖可能会对v.vulnificus的鉴定产生干扰。此外,当v.vulnificus暴露在不利的生长条件下,如较低的温度(低于13℃)、营养缺乏和消毒剂作用等,它常常会进入存在但不可培养(vbnc)的状态。传统的病原体培养方法无法检测到vbnc细胞,因此检测过程中可能会得到假阴性的结果,增加v.vulnificus的传播风险。
4.同时由于死亡细菌的dna也会在样品中稳定存在很长时间,常规的pcr检测无法区分实际样品(如高压灭菌后的污染食品样品、抗生素治疗后的临床样品)中来自活菌或死菌的目标dna,从而导致活细胞数的虚高从而导致不必要的恐慌和临床诊断误诊。
5.因此急需建立一种针对创伤弧菌活菌(活细胞)的及时、准确、可信的检测方法。
技术实现要素:
6.本技术的主要目的在于提供一种基于靶向vvha基因准确检测创伤弧菌的检测方法,旨在联合液滴数字pcr(droplet digital pcr,ddpcr)和叠氮溴化丙锭(pma)处理技术来对创伤弧菌活菌细胞进行准确、及时、可信的检测方法,并分析了所发明的方法的特异性、敏感性和检测活菌的能力,同时通过检测人工污染的血浆样品评估了其在临床样品中的稳定检测性能。以解决目前的问题。
7.为了实现上述目的,本技术提供了如下技术:
8.一种基于靶向vvha基因准确检测创伤弧菌的检测方法,包括如下步骤:
9.s1、基于vvha基因序列进行多重序列比对,并将序列中的相同序列输入预设的基本局部排列搜索工具中,进行引物和探针设计;
10.s2、通过qpcr方法,筛选出最佳引物对,根据所述最佳引物对设计并得到对应的探针;
11.s3、基于步骤s2中得到的引物和探针配置第一检测溶液,并基于定量实时pcr系统进行热循环处理,得到最佳qpcr循环方案;
12.s4、基于步骤s2中得到的引物和探针配置第二检测溶液,并基于液滴数字pcr系统进行扫描处理,得到最佳ddpcr扩增方案;
13.s5、将预设浓度的pma加入预制的活菌菌液和热灭活菌液中,进行曝光,获得完全
抑制死菌dna扩增而不影响活菌dna扩增的最佳pma浓度和确定最佳曝光时间;
14.s6、采用步骤s5得到的pma,处理不同浓度v.vulnificus的血浆模拟临床样本,提取基因组dna,并进行检测。
15.作为本技术的一种可选实施方案,可选地,在步骤s1中,基于vvha基因序列进行多重序列比对,并将序列中的相同序列输入预设的基本局部排列搜索工具中,进行引物和探针设计,包括:
16.预设primer-blast基本局部排列搜索工具;
17.根据genbank中已发表序列,对创伤弧菌v.vulnificus溶血素a基因(vvha基因)的序列进行多重序列比对,并将这些序列中的相同序列输入所述primer-blast中进行引物设计;
18.在所述primer-blast页面上勾选internal hybridization oligo选项,并按以下标准进行探针设计:
19.(2)探针大小设定为最小18-30bp;
20.(2)熔解温度(tm)设定为50-70℃;
21.(3)gc含量设定为40-60%;其他参数设置为默认值,探针的5'端为6-fam(6-corboxy-fluororescein),3'端为bhq1(black hole quencher 1)。
22.作为本技术的一种可选实施方案,可选地,在步骤s2中,通过qpcr方法,筛选出最佳引物对,根据所述最佳引物对设计并得到对应的探针,包括:
23.通过qpcr方法,从primer-blast中筛选出最佳引物对;
24.根据所述最佳引物对,设计与所述最佳引物对相相应的探针,用于后续的pma-qpcr和pma-ddpcr检测。
25.作为本技术的一种可选实施方案,可选地,在步骤s3中,基于步骤s2中得到的引物和探针配置第一检测溶液,并基于定量实时pcr系统进行热循环处理,得到最佳qpcr循环方案,包括:
26.配置第一检测溶液,第一检测溶液包括:10μlperfectstart ii probe qpcr supermix,1μl引物,1μl探针,2μl模板dna,5μl无核酸酶水;
27.将所述第一检测溶液置于热循环仪中,并设定热循环参数和冷却时间;
28.基于上述实施步骤,设定不同引物浓度、探针浓度和退火温度的扩增条件,并根据不同扩增条件下扩增曲线的ct值和荧光强度增强值(δrn)来判断最佳的qpcr循环参数方案。
29.作为本技术的一种可选实施方案,可选地,在步骤s4中,基于步骤s2中得到的引物和探针配置第二检测溶液,并基于液滴数字pcr系统进行扫描处理,得到最佳ddpcr扩增方案,包括:
30.配置第二检测溶液,第二检测溶液包括:7μl perfectstart ii probe qpcr supermix,1.4μl引物,0.42μl探针,1.4μl模板dna,2.38μl无核酸酶水;
31.将所述第二检测溶液注入预设的数字芯片上的加样孔,设定热循环参数和冷却时间,并进行pcr反应至终点,进行pcr扩增;
32.pcr扩增后,把数字芯片转移到芯片扫描仪上,用于读取和分析每个液滴的荧光幅度;
33.基于上述实施步骤,设定不同引物浓度、探针浓度和退火温度的扩增条件,并根据不同扩增条件下一维扩增图像中所有阳性点和阴性点之间的分离程度来判断最佳的ddpcr扩增方案。
34.作为本技术的一种可选实施方案,可选地,在步骤s5中,将预设浓度的pma加入预制的活菌菌液和热灭活菌液中,进行曝光,获得完全抑制死菌dna扩增而不影响活菌dna扩增的最佳pma浓度和确定最佳曝光时间,包括:
35.将预设浓度的pma溶解在20%的二甲亚砜中,生成储存溶液,并在-40℃下避光保存;
36.基于所述储存溶液,配置若干不同浓度的pma;
37.将配置好的pma加入预制的活菌菌液和热灭活菌液中,在黑暗中进行孵育;
38.通过预设波长的曝光设备进行曝光处理,得到最佳pma浓度;
39.在所述最佳pma浓度下,对热灭活菌液测试不同的曝光时间,确定最佳曝光时间。
40.作为本技术的一种可选实施方案,可选地,所述活菌菌液的预制方法,包括:
41.获取若干菌株,将所有菌株置于20%(v/v)甘油中,于-80℃环境中进行中保存;
42.预置培养基,将所有菌株置于所述培养基上培养,在37℃下持续摇动(180rpm)培养48h,得到v.vulnificus活菌菌液。
43.作为本技术的一种可选实施方案,可选地,所述热灭活菌液的预制方法,包括:
44.配置所述v.vulnificus活菌菌液;
45.将所述v.vulnificus活菌菌液在95℃下加热10min,得到所述热灭活菌液。
46.作为本技术的一种可选实施方案,可选地,在步骤s6中,采用步骤s5得到的pma,处理不同浓度v.vulnificus的血浆模拟临床样本,提取基因组dna,并进行检测,包括:
47.配置不同浓度v.vulnificus的血浆样本,利用血浆样本模拟被v.vulnificus感染的临床样本;
48.采用步骤s5得到的pma,处理所述临床样本;
49.处理完毕,通过dna提取试剂盒提取基因组dna,进行临床样本检测,评估验证pma-ddpcr适用于v.vulnificus的检测性能。
50.与现有技术相比较,本技术能够带来如下技术效果:
51.1、本技术联合液滴数字pcr(droplet digital pcr,ddpcr)和叠氮溴化丙锭(pma)处理来对创伤弧菌活菌细胞进行准确、及时、可信的检测方法。并分析了所发明的方法的特异性、敏感性和检测活菌的能力,同时通过检测人工污染的血浆样品评估了其在临床样品中的稳定检测性能;
52.2、本技术建立了一种基于靶向vvha基因,联合ddpcr和pma,用以准确检测v.vulnificus活菌的检测方法(pma-ddpcr),并在人工污染的血浆样品中对其检测能力进行了评估。研究中开发的以vvha基因为靶向基因并采用pma-ddpcr对创伤弧菌进行活菌检测的方法为临床诊断和评估弧菌感染的治疗效果提供了可靠的工具,这在弧菌疾病监测中有着非常重要的意义。
附图说明
53.构成本技术的一部分的附图用来提供对本技术的进一步理解,使得本技术的其它
特征、目的和优点变得更明显。本技术的示意性实施例附图及其说明用于解释本技术,并不构成对本技术的不当限定。在附图中:
54.图1是本发明的实施流程示意图;
55.图2是本发明在ddpcr中不同引物和探针浓度组合的扩增效率对比示意图,其中:(a)为ddpcr引物探针浓度优化,(b)为ddpcr扩增温度优化;
56.图3是本发明pma最佳处理浓度和曝光时间的数据图,其中:(a)为pma处理浓度优化.(b)为pma曝光时间优化,n:pma untreated control.(c)为pma-qpcr检测创伤弧菌活菌的能力,nt:not test.(d)pma-qpcr为特异性检测;
57.图4是本发明pma-qpcr and pma-ddpcr灵敏度和线性回归分析示意图,其中:(a)为不同浓度创伤弧菌纯培养的qpcr扩增曲线.(b)为基于qpcr的线性回归分析.(c)为不同浓度创伤弧菌纯培养的ddpcr fam通道检测图。(d)为基于ddpcr的线性回归分析.(e)为基于qpcr的血浆样品线性回归分析.(f)为采用ddpcr法对血浆样品进行线性回归分析。
具体实施方式
58.为了使本技术领域的人员更好地理解本技术方案,下面将结合本技术实施例中的附图,对本技术实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本技术一部分的实施例,而不是全部的实施例。基于本技术中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本技术保护的范围。
59.另外,术语“多个”的含义应为两个以及两个以上。本实施例中,在各个反应步骤中所使用到的反应溶液的成分,在可以替代的情况下,可以进行替换。
60.在本实施例中,所涉及到的qpcr、ddpcr和pma方法,其中涉及到的反应设备,仅仅是本实施例中的优选方案,同样可以采用其他可以实现对应反应步骤的设备进行替代性操作。
61.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考附图并结合实施例来详细说明本技术。
62.本发明旨在联合液滴数字pcr(droplet digital pcr,ddpcr)和叠氮溴化丙锭(pma)处理来对创伤弧菌活菌细胞进行准确、及时、可信的检测方法。并分析了所发明的方法的特异性、敏感性和检测活菌的能力,同时通过检测人工污染的血浆样品评估了其在临床样品中的稳定检测性能。
63.在具体实施时,本技术优化了方法中涉及的创伤弧菌v.vulnificus溶血素a基因(vvha)的引物/探针、扩增程序和pma处理条件,随后,本技术分析了特异性、敏感性和检测活细胞dna的能力,同时评估了pma-ddpcr在临床样本中的表现。在建立的ddpcr方法中,引物和探针的最佳浓度分别为1.0μm和0.3μm,最佳退火温度为60℃。在v.vulnificus浓度最高为108cfu/ml的情况下,区分v.vulnificus活菌和死菌的最优方案是在黑暗中用终浓度100μm的pma处理样品15min,然后将其在465nm的蓝色led灯下曝光10min。本技术使用了23株相关菌株测试了pma-ddpcr的特异性,只有v.vulnificus标准菌株和6个v.vulnificus临床分离菌株有阳性信号产生。v.vulnificus纯培养菌液中的检测限(lod)和定量限(loq)分别为29.33cfu/ml和53.64cfu/ml,在人工污染临床样本测试,ddpcr的lod低至65.20cfu/
ml。在本研究中,pma-ddpcr检测的灵敏度比pma-qpcr高出15-40倍。本技术开发的pma-ddpcr检测方法为准确检测临床样本中的v.vulnificus活菌提供了新的思路,对增强公共卫生安全保障能力,提高v.vulnificus感染的应急反应水平具有重要意义。
64.与此同时,本技术使用的ddpcr方法可以通过液滴发生器将反应混合物分成"油包水"微滴并将其分散在芯片反应区中。ddpcr的反应体系和循环参数与qpcr没有区别,但ddpcr反应体系的微滴化处理较好地解决了qpcr扩增过程中易受基质抑制性成分的影响、检测弱阳性样品的能力不稳定的问题,使其可以获得更稳定和一致的扩增效率。
65.首先,本技术的实施,需要进行细菌菌种和培养。
66.作为本技术的一种可选实施方案,可选地,所述活菌菌液的预制方法,包括:
67.获取若干菌株,将所有菌株置于20%(v/v)甘油中,于-80℃环境中进行中保存;
68.预置培养基,将所有菌株置于所述培养基上培养,在37℃下持续摇动(180rpm)培养48h,得到v.vulnificus活菌菌液。
69.本实施例,在pma-qpcr和pma-ddpcr检测过程中,使用了7株弧菌、7株其他弧菌和13株从临床样本中分离出来的其他相关细菌菌株(表1)进行后续优化和验证。参考菌株(ref.)购自海洋微生物菌种保藏中心(mccc)和中国普通微生物菌种保藏管理中心(cgmcc)。临床菌株(clin.)是从华美医院的临床样本中分离出来的,并且已通过自动微生物鉴定系统确认。所有菌株最初都置于20%(v/v)甘油中,于-80℃冰箱中保存。各弧菌菌株均使用2216e液体培养基(qdrs biotec,中国)培养,其他13种细菌菌株则在luria-bertani(lb)肉汤培养基上培养。所有菌株在37℃下持续摇动(180rpm)培养48h,得到的v.vulnificus活菌菌液用于后续实验。使用稀释涂布平板法计算v.vulnificus可培养的细胞数。
70.此外,还进行了热灭活菌液的制备。
71.作为本技术的一种可选实施方案,可选地,所述热灭活菌液的预制方法,包括:
72.配置所述v.vulnificus活菌菌液;
73.将所述v.vulnificus活菌菌液在95℃下加热10min,得到所述热灭活菌液。
74.将v.vulnificus活菌菌液在95℃下加热10min,得到热灭活菌液。在2216e琼脂培养基上涂布100μl热灭活菌液,重复涂布3个平板,用于评估灭活效果。如在37℃下培养48h后没有菌落生成,可证明菌液中所有的v.vulnificus已死亡。
75.根据用户手册,用细菌基因组dna提取试剂盒(本实施例采用了minibest bacterial genomic dna extractionkit(takara,日本))提取基因组dna。并用80μl无核酸酶水洗脱dna。使用nanodropnd-1000(thermo scientific,美国)对提取dna的浓度和质量进行分析。所有的模板dna在使用前置于-40℃冰箱中保存。
76.下面将进行本方法的实施。
77.如图1所示,一种基于靶向vvha基因准确检测创伤弧菌的检测方法,包括如下步骤:
78.s1、基于vvha基因序列进行多重序列比对,并将序列中的相同序列输入预设的基本局部排列搜索工具中,进行引物和探针设计;
79.s2、通过qpcr方法,筛选出最佳引物对,根据所述最佳引物对设计并得到对应的探针;
80.s3、基于步骤s2中得到的引物和探针配置第一检测溶液,并基于定量实时pcr系统进行热循环处理,得到最佳qpcr循环方案;
81.s4、基于步骤s2中得到的引物和探针配置第二检测溶液,并基于液滴数字pcr系统进行扫描处理,得到最佳ddpcr扩增方案;
82.s5、将预设浓度的pma加入预制的活菌菌液和热灭活菌液中,进行曝光,获得完全抑制死菌dna扩增而不影响活菌dna扩增的最佳pma浓度和确定最佳曝光时间;
83.s6、采用步骤s5得到的pma,处理不同浓度v.vulnificus的血浆模拟临床样本,提取基因组dna,并进行检测。
84.下面将具体描述各个步骤的实施步骤。
85.1、引物和探针设计
86.作为本技术的一种可选实施方案,可选地,在步骤s1中,基于vvha基因序列进行多重序列比对,并将序列中的相同序列输入预设的基本局部排列搜索工具中,进行引物和探针设计,包括:
87.预设primer-blast基本局部排列搜索工具;
88.根据genbank中已发表序列,对创伤弧菌v.vulnificus溶血素a基因(vvha基因)的序列进行多重序列比对,并将这些序列中的相同序列输入所述primer-blast中进行引物设计;
89.在所述primer-blast页面上勾选internal hybridization oligo选项,并按以下标准进行探针设计:
90.(3)探针大小设定为最小18-30bp;
91.(2)熔解温度(tm)设定为50-70℃;
92.(3)gc含量设定为40-60%;其他参数设置为默认值,探针的5'端为6-fam(6-corboxy-fluororescein),3'端为bhq1(black hole quencher 1)。
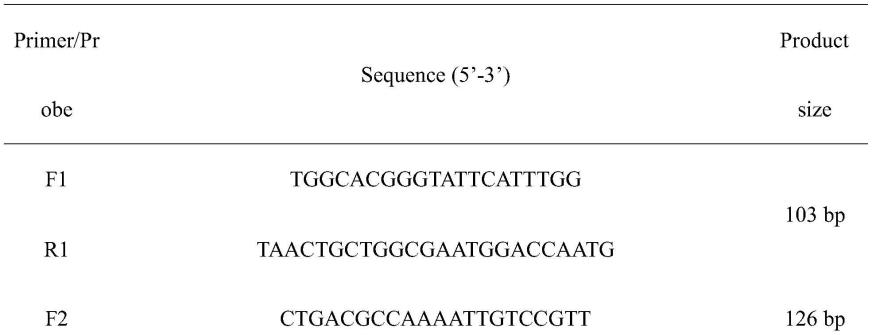
93.根据genbank中已发表的序列,对vvha基因序列进行多重序列比对(accession:kc821520.1,mw132717.1,af376032.1,ku680790.1,kp224256.1,kf255393.1,cp0112740.1),并将这些序列中的相同序列输入美国国家生物技术信息中心(ncbi)中的primer-blast(基本局部排列搜索工具)进行引物设计。同时,对于探针的设计,在primer-blast页面上勾选internal hybridization oligo选项,并按以下标准进行设计:(1)探针大小设定为最小18-30bp;(2)熔解温度(tm)设定为50-70℃;(3)gc含量设定为40-60%。其他参数设置为默认值。探针的5'端为6-fam(6-corboxy-fluororescein),3'端为bhq1(black hole quencher 1)。本研究中使用的所有引物和探针都列在表2中,并由生工合成。
94.2、引物对和探针的优化
95.作为本技术的一种可选实施方案,可选地,在步骤s2中,通过qpcr方法,筛选出最佳引物对,根据所述最佳引物对设计并得到对应的探针,包括:
96.通过qpcr方法,从primer-blast中筛选出最佳引物对;
97.根据所述最佳引物对,设计与所述最佳引物对相相应的探针,用于后续的pma-qpcr和pma-ddpcr检测。
98.引物和探针的性能是评价核酸扩增质量的关键。不是所有通过primer-blast筛选的引物对都能产生稳定的阳性信号。因此,本技术用qpcr筛选出最佳引物对,并设计出相应
cyclerpcr(pliotgene,中国)在数字芯片上进行独立的pcr反应至终点,循环参数与2.6中的qpcr一样。pcr扩增后,把数字芯片转移到芯片扫描仪(pliotgene,中国)上,用于读取和分析每个液滴的荧光幅度。为了提高ddpcr检测的准确性和有效性,本技术优化了引物/探针的浓度和退火温度。首先测试了三种浓度的引物(0.6μm,0.8μm,1.0μm)与三种浓度的探针(0.2μm,0.3μm,0.4μm)的组合,然后测试了三种不同退火温度(58℃,60℃,62℃)。最佳的ddpcr扩增方案是根据一维扩增图像中所有阳性点和阴性点之间的分离程度来判断的。
114.5、pma处理
115.作为本技术的一种可选实施方案,可选地,在步骤s5中,将预设浓度的pma加入预制的活菌菌液和热灭活菌液中,进行曝光,获得完全抑制死菌dna扩增而不影响活菌dna扩增的最佳pma浓度和确定最佳曝光时间,包括:
116.将预设浓度的pma溶解在20%的二甲亚砜中,生成储存溶液,并在-40℃下避光保存;
117.基于所述储存溶液,配置若干不同浓度的pma;
118.将配置好的pma加入预制的活菌菌液和热灭活菌液中,在黑暗中进行孵育;
119.通过预设波长的曝光设备进行曝光处理,得到最佳pma浓度;
120.在所述最佳pma浓度下,对热灭活菌液测试不同的曝光时间,确定最佳曝光时间。
121.将pma(biotium,美国)溶解在20%的二甲亚砜(solarbio,中国)中,生成10mm的储存溶液,并在-40℃下避光保存。pma处理条件的优化是在25℃的室温下进行的。为了找到能完全抑制死菌dna扩增而不影响活菌dna扩增的最低pma浓度,本技术将一系列浓度(0、10、20、40、60、100、140、180μm)的pma加入活菌菌液和热灭活菌液中,在黑暗中孵育15min。然后,使用输出波长为465nm的200w蓝色led照明灯板曝光20min。在最佳的pma浓度下,对热灭活菌液测试了不同的曝光时间(0、1、3、5、10、15、20、25和30min),以确定最佳曝光时间。
122.6、临床样本检测
123.作为本技术的一种可选实施方案,可选地,在步骤s6中,采用步骤s5得到的pma,处理不同浓度v.vulnificus的血浆模拟临床样本,提取基因组dna,并进行检测,包括:
124.配置不同浓度v.vulnificus的血浆样本,利用血浆样本模拟被v.vulnificus感染的临床样本;
125.采用步骤s5得到的pma,处理所述临床样本;
126.处理完毕,通过dna提取试剂盒提取基因组dna,进行临床样本检测,评估验证pma-ddpcr适用于v.vulnificus的检测性能。
127.为了验证pma-ddpcr与pma-qpcr在临床样本中的诊断性能,本技术使用了一系列人工添加了不同浓度v.vulnificus的血浆样本来模拟被v.vulnificus感染的临床样本。用pma处理模拟临床样本后,用minibest bacterial genomic dnaextraction kit(takara,日本)提取基因组dna,进行后续检测。
128.处理完上述各个步骤,进行统计分析:采用ibm spss statistics 23软件进行probit回归分析和方差分析(anova,α=0.05)对pma-qpcr和pma-ddpcr的检测限(lod)数据和扩增条件进行优化。使用graphpad prism 8.0软件进行受试者操作曲线(roc)分析与敏感性分析,计算出诊断临界值(cut-off value)与youden指数,以确定定量限(loq)。所有图片都是使用graphpad prism 8.0软件绘制的。
129.在本实施例中,除叠氮溴化丙锭(pma)外,其他一些光反应dna染料如:叠氮溴化乙锭(ema)也可以做处理剂。
130.本实施例的检测结果如下:
131.1、特异性引物和探针的筛选:通过primer-blast设计了六对备选引物,并列于表1。比较扩增曲线中的ct和δrn
‑‑‑
表2,可以确定储引物对(f6/r6)显示出最佳性能。因此,f6/r6和相应的探针(p6)被选择用于随后的qpcr和ddpcr检测中。
[0132][0133][0134]
表1本研究中用的引物和探针
[0135][0136]
表2不同引物对的ct和δrn
[0137]
2、qpcr扩增条件的优化:为了优化qpcr扩增的条件,比较了表3中20种引物/探针浓度的组合。对这些组合得到的ct值进行方差分析,p》0.05,证明这些组合之间的ct值没有明显差异。因此,本技术选择了具有最高δrn的组合(f/r=0.5μm和p=0.5μm)。此后,测试了五个不同的退火温度(表s3)。在随后的qpcr检测中,达到最高检测精度的65℃被定为此方法的最佳退火温度。
[0138][0139]
表3不同引物和探针浓度的ct和δrn
[0140]
3、ddpcr扩增条件的优化:在ddpcr中比较了不同引物和探针浓度组合的扩增效率。图2a中的结果显示,组合(f/r=1μm,p=0.3μm)中的阴性点与阳性点划分清晰,荧光强度高。因此,该组合被选为最佳引物/探针浓度组合。同样,如图2b所示,60℃被认为是最佳的退火温度。
[0141]
4、pma最佳处理浓度和曝光时间的筛选:不同的pma处理条件对细菌菌体有着不同的影响。考虑到实际样品中细菌的初始浓度未知,本技术选择了较高的v.vulnificus浓度(2.65
×
108cfu/ml)用于pma处理条件优化实验。如图3a所示,热灭活组随着浓度的增加,ct值逐渐升高,在100μm之后趋于平稳。而活菌组在不同浓度的pma处理下,与未处理的对照(0μm)相比,ct值没有明显差异(p》0.05),这表明不同浓度(10μm至180μm)的pma对v.vulnificus活菌的dna扩增没有抑制作用。比较pma处理期间不同曝光时间的结果见图3b,其ct值在10min时最高,这体现了该光照时间对死亡v.vulnificus dna扩增的抑制作用最强。以上结果表明,本研究的最佳方案是用最终浓度为100μm的pma处理样品,并在之后曝光10min,这可以完全抑制v.vulnificus死菌的dna扩增。
[0142]
5、检测v.vulnificus活菌的能力验证:使用qpcr检测来评估在最佳pma处理条件下检测v.vulnificus活菌的能力。将不同浓度的活菌与热灭活菌混合,用pma处理(pma-qpcr组)或不处理(qpcr组)。将相应浓度的活菌与2216e液体培养基混合,作为空白对照(2216e组)。如图3c所示,qpcr组反映的是总细胞(死细胞和活细胞)的dna扩增结果。pma-qpcr组和2216e组只反映了v.vulnificus活细胞的dna扩增情况。随着样品中活细胞的增加,两组的ct值也相应减少,且相互接近。上述结果表明,使用最佳pma处理条件时,pcr方法具备检测v.vulnificus活菌的能力。
[0143]
6、pma-qpcr和pma-ddpcr的特异性:如图3d所示,为了评估pma-qpcr和pma-ddpcr方法的特异性,本技术分别测试了从v.vulnificus和非v.vulnificus菌株分离的基因组dna。仅在v.vulnificus参考菌株和6株临床菌株中观察到阳性信号,而其他菌株(非v.vulnificus菌株)显示阴性信号。
[0144]
7、pma-qpcr和pma-ddpcr的敏感性和回归分析:为了评估灵敏度,本技术用pma-qpcr和pma-ddpcr分别检测了一系列浓度约为1.33
×
101到1.33
×
107cfu/ml的v.vulnificus纯培养菌液。图4a和4c显示了qpcr和ddpcr检测不同浓度的v.vulnificus的扩增曲线,图4b和4d是构建的标准曲线。lod是指是对低浓度的分析物样本进行测试,在95%的条件下能测得的最低值,通过probit回归分析的拟合来确定。结果显示,pma-qpcr和pma-ddpcr在检测纯培养的v.vulnificus方面的lods分别为1.14
×
103cfu/ml和29.33cfu/ml。loq被定义为检测的特异性和敏感性之和达到最大(roc曲线中的cut-offvalue)时与ct值或ddpcr测量值(copies/μl)相对应的dna量,使用回归方程、youden指数和cut-offvalue进行计算,结果显示,在纯培养细菌溶液中,loq为1.29
×
103cfu/ml(pma-qpcr)和53.64cfu/ml(pma-ddpcr)。
[0145]
8、pma-qpcr和pma-dpcr检测:对比了pma-qpcr与pma-ddpcr在人工添加血浆样品中的检测性能。结果见图4e(pma-qpcr)和图4f(pma-ddpcr),lod为1.00
×
103cfu/ml(pma-qpcr)和65.20cfu/ml(pma-ddpcr)。结果与纯培养菌液一致,证实pma-ddpcr适用于测定临床样品中的v.vulnificus。
[0146]
结论:
[0147]
使用传统的病原体培养方法检测v.vulnificus需要预先富集、分离、纯化、生化鉴定和血清学鉴定,这一过程一般需要3-7天,并且还容易得出假阴性的结果,特别是在区分同种属菌株和vbnc状态的细菌中。同时,v.vulnificus感染的非典型临床症状与越来越不明确的暴露风险,也给其早期诊断和治疗带来困难。随着分子诊断技术的发展,基于核酸片段检测的qpcr技术提供了一种快速、高效、特异的方法来检测弧菌。然而,目前还没有一个官方的权威机构可以提供具有明确量值的v.vulnificus核酸标准品。此外,引物和探针的质量、样品中的抑制性成分、实验室环境和操作者的实验技能都会直接影响到qpcr检测中标准曲线的质量,这就限制了qpcr在实际检测中的准确性。数字pcr作为第三代pcr检测方法的代表,不需要依靠标准曲线和ct值就可以进行dna定量,提高了检测的准确性。在这项研究中,本技术开发了一种基于ddpcr的v.vulnificus检测方法,同时评估了这种方法在血浆样品中的性能,这将为今后准确检测v.vulnificus提供有价值的参考。
[0148]
高温或抗生素处理后,病原体的dna仍会保留很长时间,这使得传统的pcr方法难以有效区分死菌dna和活菌dna。死菌dna可能会使影响实际活菌数量的检测,得到假阳性结果,这不利于临床v.vulnificus感染的监测。自2006年首次报道使用pma区分活细胞和死细胞的研究以来,pma已经成为最广泛使用的dna染料之一,已被广泛应用于其它病原微生物的检测中。pma不能与具有完整细菌膜结构的活细胞内的dna结合,减少了病原体感染检测中的误诊率,因此,pma-pcr已被认定为检测活细胞的一种成功方法。适当的pma处理条件是进行pma-pcr的关键,不当的处理条件可能会损害活细胞并导致错误的结果。pma浓度和pma处理过程中的曝光时间是两个重要因素,应根据目标菌株、初始浓度、曝光灯等进行优化。在本研究中,区分v.vulnificus活菌和死菌的最佳方案是在黑暗中用终浓度100μm的pma处
理样品15min,然后将其在465nm的蓝色led灯下曝光10min。本技术将活细胞与v.vulnificus的死细胞按不同比例(0-100%)混合,并通过qpcr检测ct值,验证了通过pma-qpcr检测v.vulnificus活菌的能力,同时也发现本技术选择的pma浓度(100μm)对活细胞没有影响。所以,本技术认为将pma处理与pcr(qpcr或ddpcr)检测dna结合起来,可以为评价临床v.vulnificus感染的治疗效果提供参考。
[0149]
为了成功地检测样品中的v.vulnificus,有必要选择适当的目标基因。由v.vulnificus溶血素a基因(vvha)编码的外分泌细胞毒素溶血素a是一种重要的毒力因子,它可以在目标细胞的细胞膜表面形成小孔,造成细胞感染和组织损伤。因此,vvha基因被认为是v.vulnificus的重要毒力标志物。在本研究中,本技术选择vvha基因作为目标基因,在纯培养菌液和血浆样品上测试了pma-qpcr和pma-ddpcr的检测性能。结果显示,只有在v.vulnificus菌株中观察到阳性信号,与非v.vulnificus菌株的dna没有交叉反应。这一结果清楚地验证了vvha基因适用于检测v.vulnificus。对于敏感性,本研究中pma-ddpcr的lod为29.33cfu/ml,比以往研究中表现得更好,如用qpcr检测v.vulnificus的lod为1
×
103cfu/ml、rpa(重组酶聚合酶扩增)为1.2
×
10
2-1
×
103cfu/ml、lamp(环介导等温扩增法)为2
×
103cfu/ml。在准确检测人工添加的血浆样品方面,pma-ddpcr的性能也优于pma-qpcr,这也意味着pma-ddpcr在处理临床样品方面能力更强。但由于pma-ddpcr的"油包水"微滴数量的限制,在检测前需要对具有较高浓度的v.vulnificus(高于106cfu/ml)的样品进行稀释,否则,芯片中的阳性微滴会过饱和(每个微室内的dna分子≥1),导致不能得出有效的分析结果(表3)。所以,ddpcr的检测上限低于qpcr。简而言之,在本技术的研究中,pma-ddpcr适用于检测v.vulnificus浓度为1.33
×
106至6.63
×
101cfu/ml的样品,在检测低拷贝数的目标dna时更加敏感和准确。
[0150]
以上所述仅为本技术的优选实施例而已,并不用于限制本技术,对于本领域的技术人员来说,本技术可以有各种更改和变化。凡在本技术的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本技术的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。