核酸适配体-药物结合物epcam-gems在制备治疗膀胱癌药物中的应用
技术领域
1.本发明属于生物医药技术领域,具体涉及核酸适配体-药物结合物epcam-gems在制备治疗膀胱癌药物中的应用。
背景技术:
2.膀胱癌是世界上最常见的十大恶性疾病之一,根据肿瘤生长深度分为非肌肉浸润性膀胱癌(nmibc)和肌肉浸润性膀胱癌(mibc)。其死亡率高并在世界范围内差异不大,治疗效果不理想。手术与化疗相结合是目前治疗膀胱癌的常用方法,经尿道膀胱肿瘤电切术(turbt)及术后化疗是治疗nmibc的主要方案,根治性膀胱切除及新辅助化疗联合辅助化疗是治疗mibc及高危复发nmibc的主要方法。nmibc治疗后约50%~80%患者出现肿瘤复发,约30%患者出现肿瘤进展,nmibc治疗后复发率高达30~45%,5年生存率为45~66%。吉西他滨作为膀胱癌的一线化疗药物之一,是一种胞嘧啶核衍生物,属于嘧啶类抗肿瘤药物,其作用机制是干扰癌细胞dna合成和复制。但吉西他滨的药代动力学较差,且不能明确区分正常细胞和癌细胞,并有肝功能异常、胃肠道反应、骨髓抑制等不良作用,且由于这些副作用的存在限制了其剂量的使用。总之,缺乏特异性和对化疗副作用的不耐受阻碍了吉西他滨治疗的效果。
3.随着膀胱癌分子生物学和遗传学的发展,免疫检查点抑制剂(icis)、靶向治疗和抗体药物缀合物(adc)以及基因治疗在膀胱癌治疗中的应用已经出现。然而,自icis药物引入以来,耐药性、脱靶效应和免疫相关不良事件频繁报道。尽管adc的药物可以靶向癌细胞,但由于高免疫原性和不良事件的发生,包括其毒性导致的血液系统疾病以及脱靶效应,仅适用于晚期膀胱癌患者和不适用铂类治疗的患者。基因治疗以fgfr抑制剂为代表,用于晚期膀胱癌,而fgfr突变只出现在一部分患者中,要进行筛查,筛查标准目前还不明确,也有报道称,只有一小部分fgfr突变异常的恶性肿瘤对fgfr抑制剂有反应,fgfr抑制剂也可能对药物产生耐药性,并由于脱靶效应产生高磷血症等不良反应。因此,虽然这些治疗方法为膀胱癌的治疗带来了希望,但临床应用副反应明显,具有一定局限性,不能使所有患者受益,导致膀胱癌的治疗仍未达到理想的效果。所以,膀胱癌的治疗迫切需要新的治疗方法。
4.核酸适配体和化疗药物的结合(apdc)可以很好的解决这些问题,上皮细胞粘附分子(epcam)是一种在肿瘤细胞和肿瘤干细胞(csc)中表达的生物标志物,被认为是肿瘤相关的抗原,参与调节细胞间黏附,介导信号传导、细胞迁移、增殖和分化等功能。epcam的表达在结肠癌、卵巢癌、视网膜母细胞瘤、胆囊癌、乳腺癌、前列腺癌中均有报道。
5.epcam核酸适配体与吉西他滨的结合未见相关报道。
技术实现要素:
6.针对现有膀胱癌治疗技术的不足,本发明目的是探究核酸适配体-药物结合物epcam-gems对膀胱癌的靶向性及毒性,此外在动物荷瘤模型验证epcam-gems抗肿瘤效果和
生物安全性,旨在对膀胱癌的靶向治疗药物提供一种全新的策略。
7.本发明的技术方案是:核酸适配体-药物结合物epcam-gems在制备治疗膀胱癌药物中的应用。
8.优选的,所述核酸适配体epcam的源序列为syl3c序列。
9.优选的,epcam-gems的序列如sed id no1所示。
10.优选的,所述膀胱癌包括非肌层浸润性膀胱癌,肌层浸润性膀胱癌,膀胱原位癌,转移性膀胱癌。
11.epcam在多种膀胱癌细胞及膀胱癌组织标本中高表达;epcam-gems通过空间构象与膀胱癌细胞膜表面高表达的epcam蛋白靶向结合,在血清中稳定并通过大胞饮入胞方式在胞内磷酸酶作用下释放出吉西他滨,发挥细胞毒性作用,在膀胱癌干细胞中我们也发现epcam-gems具有类似的靶向性及毒性。此外,在动物荷瘤模型中显示出显著的抗肿瘤效果,且毒性不明显。
12.本研究结果表明epcam-gems能携带吉西他滨靶向结合膀胱癌细胞并在胞内智能释放药物,发挥毒性作用,避免了副作用导致的剂量限制,能更好的发挥吉西他滨的抗癌效果。
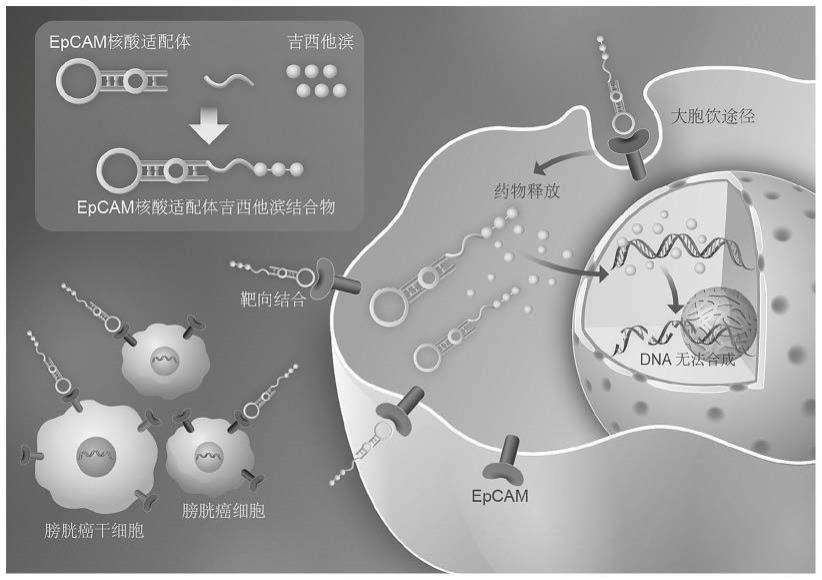
13.在本研究中,我们首次提出并合成了用于治疗膀胱癌的核酸适配体-药物结合物epcam-gems,epcam与3个吉西他滨分子通过磷酸二酯键连接。epcam-gems同时针对膀胱癌细胞和膀胱癌干细胞,对正常细胞无毒性。epcam-gems通过巨胞饮作用进入膀胱癌细胞。在细胞内溶酶体的酸性条件下,通过磷酸酶剪切将gem释放到细胞核中,抑制dna合成,从而产生细胞毒性。此外,我们建立了动物荷瘤模型,并进行了一系列的体内研究,以评估epcam-gems介导的主动靶向作为有效清除肿瘤细胞的潜力和生物安全性。结果表明,epcam-gems是一种以apdc形式治疗膀胱癌的有效策略。
14.与现有技术相比,本发明的优势在于:本发明的epcam-gems通过3
’‑5’
磷酸二酯键将epcam核酸适配体与3个吉西他滨分子相连接,靶向结合膀胱癌细胞,而对正常细胞无毒性。肿瘤干细胞的存在被认为是癌症进展、复发和不可治愈的根本原因。对于癌症的治疗,针对肿瘤干细胞靶向药物体系应该是下一代肿瘤药物的发展方向。相比较ptk7-gems核酸适配体药物结合物,epcam-gems不仅对膀胱癌细胞有毒性作用,还对膀胱癌干细胞有类似的毒性作用。并且,在体内实验中,epcam-gems相较于吉西他滨药物,常见的毒副作用明显减少甚至没有。
15.以下结合附图和具体实施方式对本发明的详细结构作进一步描述。
附图说明
16.图1为epcam-gems的合成及其在靶细胞中的作用示意图。
17.图2为epcam在膀胱癌细胞及组织中高表达。其中图2a是 western blotting显示epcam在膀胱癌细胞系和人胚胎肾细胞系hek 293t中的相对蛋白表达;图2b是免疫荧光显示epcam主要表达于膀胱癌细胞膜;图2c是配对的膀胱癌组织(t)和相邻的非癌组织(n)中epcam蛋白表达的western blotting分析。图2d是 epcam免疫组化(ihc)在膀胱癌组织和正常膀胱组织中的代表性图像。图2e是根据膀胱癌患者epcam表达情况进行kaplan-meier生存分析(log-rank检验)。
18.图3是epcam-gems及其类似物合成图解。从寡核苷酸的3
′
端到5
′
端进行合成,每个循环加入一个碱基。
19.图4是epcam的特异性结合以及epcam-gems的胞内释放。其中图4a是通过流式细胞术检测fitc标记样品孵育后与膀胱癌细胞(biu-87)和正常对照细胞(hek293t)细胞的结合能力;图4b是通过高速液相色谱方法验证epcam-gems在细胞裂解液、磷酸酶抑制剂处理的细胞裂解液、ph 5.5、ph6.5、10mmol/l gsh和10%胎牛血清孵育后的吉西他滨释放统计图。
20.图5是皮下异种移植瘤模型结果对比和分析图。其中图5a是实验结束后不同处理组肿瘤组织图像比较(共6组,每组5只裸鼠),图5b是各组裸鼠治疗期间肿瘤体积变化趋势图,显而易见,epcam-gems具有最佳的抗肿瘤效果。
21.图6是膀胱癌肿瘤干细胞筛选及毒性和靶向性验证实验。其中图6a是biu-87细胞在正常dmem完全培养基和sfm培养基中的细胞形态比较。球体是指第一次成球后细胞和第二次成球后细胞后的照片;图6b是用western blotting检测biu-87和球形biu-87中肿瘤干细胞标志物(oct4、sox2、nanog)的相对蛋白表达,其中pa1为卵巢畸胎瘤细胞作为标准阳性对照;图6c是 biu-87细胞和biu-87球体细胞分别用lib-gems、gem和epcam-gems处理12h,然后在完全培养基中孵育72h。流式细胞术分析细胞凋亡情况。右上象限为晚期凋亡,右下象限为早期凋亡;图6d是用western blotting分析分别用pbs、gem和epcam-gems处理裸鼠皮下转移瘤时肿瘤干细胞指标的表达差异。
22.图7是epcam-gems在尾静脉注射肺转移性膀胱癌小鼠模型中的抗肿瘤活性。其中图7a是小鼠肺的代表性照片和不同处理h&e染色的图像;图7b是不同治疗方法对荷瘤小鼠膀胱癌细胞肺转移结节的比较;图7c是以每周静脉注射1次的给药频率,分析5周不同治疗期间小鼠的体重。
23.图8是epcam-gem在原位膀胱癌模型中的抗肿瘤作用。其中图8a是经pbs处理的代表性切除膀胱及h&e染色组织切片(肌层浸润性膀胱癌:≥pt2期);图8b是经epcam治疗的代表性切除膀胱及h&e染色的组织切片(肌层浸润性膀胱癌:≥pt2期);图8c是经lib治疗的代表性膀胱切除及h&e染色组织切片(肌层浸润性膀胱癌:≥pt2期);图8d是经gem处理的代表性切除膀胱及h&e染色组织切片(非侵袭性乳头状癌:pt1期);图8e是经lib-gem治疗的代表性切除膀胱及h&e染色组织切片(无创乳头状癌:pt1期);图8f是经epcam-gem处理的代表性切除膀胱和h&e染色的组织切片(非浸润性乳头癌:分期≤pta)。**p 《 0.01, ***p 《 0.001。
24.图9是epcam-gems在血常规和生化检测中的生物安全性评价,*表示与pbs组比较p 《 0.05,
#
表示与epcam-gems组比较p 《 0.05。
具体实施方式
25.实验方法:1、细胞培养膀胱癌细胞株(biu-87、rt4、5637、ht-1376), 畸胎瘤细胞株(pa-1)和正常细胞株hek 293t购自美国弗吉尼亚州atcc公司。biu-87、hek 293t细胞在dmem培养基中培养,rt4细胞在5a培养基中培养,5637细胞在rpmi-1640培养基中培养,ht-1376细胞在mem培养基中培养, pa-1细胞在emem培养基中培养。上述培养基中分别添加10%胎牛血清、1%谷氨酰胺和
1%青霉素-链霉素。所有细胞在37℃,5% co2的恒温培养箱中培养。
26.2、膀胱组织样本所有148个患膀胱癌的肿瘤样本和45相邻正常的膀胱组织标本来自于2002年至2012年之间在中南大学湘雅三医院和中山大学肿瘤防治中心的膀胱癌患者。有关患者的临床病理信息从患者记录中获得,为了进行western blot分析,我们收集了20对接受根治性膀胱切除术的患者的膀胱癌组织和邻近正常膀胱组织。
27.3、免疫组化肿瘤标本经10%甲醛磷酸盐缓冲盐水固定,石蜡包埋,切片4 μm厚,采用亲和素-生物素-过氧化物酶法免疫组化epcam蛋白。简单地说,内源性过氧化物酶在3% h2o2中孵育20分钟。抗原回收是通过在10毫米柠檬酸缓冲液(ph 6.0)中120℃加热样品15分钟。切片用block ac在室温下处理30分钟后,在4℃下与抗epcam (abcam;1:500稀释)抗体。亲和素-生物素-过氧化物酶复合物系统用于二氨基联苯胺四盐酸盐的显色。切片用梅尔氏苏木素进行复染。
28.4、免疫荧光将200μl的培养基移入孔中,静置10-15 min,制备2个室载玻片。将膀胱癌细胞放入孔中,置于培养箱中静置1 h,形成融合单层。用冰冷乙醇固定细胞,然后在缓冲液中复水,在0.1% triton x-100中渗透60秒,然后在缓冲液中进一步洗涤。其中一张载玻片在缓冲液中清洗,装入fluorsave
™
(calbiochem)中,并在4
˚
c的铝箔中储存。第二张切片用10%血清在tbs中阻滞40 min,然后用epcam一抗(abcam;1:1000稀释)1小时。然后洗涤细胞,在每孔中加入二抗,静置1小时。然后洗涤细胞,安装在fluorsave
™
中,并按上述方法储存在箔中,直到使用奥林巴斯bx51荧光显微镜和滨松虎鲸er数码相机观察细胞。
29.5、wb实验使用sds裂解缓冲液制备组织和细胞裂解液,使用bradford分析法测定蛋白浓度。在10.5%十二烷基硫酸钠聚丙烯酰胺凝胶上电泳分离等量的蛋白质,并从凝胶电转移到硝化纤维素膜上。用tween (tbst)的5%牛奶缓冲盐水封闭膜1小时后,用一抗epcam(1:500稀释)、oct4(1:1000稀释)、sox2(1:1000稀释)、nanog(1:1000稀释)和内参抗-β-actin (sigma-aldrich;1:20 00),用tbst洗涤后,用抗免疫球蛋白g的二抗孵育膜;然后,根据制造商的说明,用增强的化学发光检测系统进行检测。
30.6、epcam-gems及其类似物合成步骤epcam-gems序列:tt cac tac aga ggt tgc gtc tgt ccc acg ttg tca tgg ggg gtt ggc ctg mmm tt (m代表吉西他滨的碱基),如sed id no1所示。
31.合成方法为现有方法,具体反应及条件如下:碳酸锂(900 mg)和二甲基吡啶(1350 mg)首先加入化合物1(吉西他滨269 mg,1.0 mmol,纯度97%),再用无水二氯甲烷(100ml)悬浮。部分加入二甲基色胺(460 mg,1.12 mmol),加入150ml二氯甲烷,稀释后用饱和氯化钠溶液洗涤,无水硫酸钠干燥。除去溶剂后,残留经闪蒸柱净化,得到吉西他滨化合物2(4 0 0 mg,收率73%,m h =543.3)。将吉西他滨化合物2(264 mg,0.5 mmol)再悬浮于40ml 二氯甲烷中,加入n,n-二异丙基乙胺(650 mg,5.0 mmol),在0℃下冷却。加入n-二异丙基氯磷酰胺(596 mg,2.44 mmol),用薄层层析(tlc)监测反应。当原料消失时,反应溶液用二氯甲烷(100ml)稀释,然后用饱和碳酸氢钠和饱氯化钠洗涤。所得产品用无水硫酸钠干燥,干液浓
缩,残渣经闪蒸柱净化,得到吉西他滨磷酰胺3(380mg得率80%,分子量为950.03,m na =973.09)白色粉末。确定ptk7-gems序列,根据dna合成仪(polygen gmbh,langen,德国)的要求自动进行合成。在自动合成之后,用约40 0μl的28%氢氧化铵在65℃下裂解寡核苷酸胞嘧啶-磷酸-鸟嘌呤 30min。裂解后的dna与1ml冰冷乙醇和40
µ
l 3m氯化钠混合,在-20℃下沉淀60min,然后在4℃下12000rpm离心20min,得到沉淀物。沉淀物用400
µ
l 0.1m乙酸三乙胺(teaa)溶解,然后用c18柱进行高效液相色谱纯化。dna产物经冷冻干燥后,再悬浮在灭菌的超纯水中,然后用脱盐微柱脱盐,储存于灭菌水。
32.7、特异性结合实验将biu-87和hek 293t细胞经0.02�ta消化后,约2
×
105各组细胞在含200 nm epcam-fitc、lib-fitc和仅含细胞的结合缓冲液(结合缓冲液含10%胎牛血清)中冰孵育50min。结合缓冲液由0.1mg/ml trna(sigma)、1mg/ml bsa(sigma)和5 nm mgcl2组成。在竞争结合实验中,epcam和lib以1000nm的浓度预孵育,冰上孵育1h。每组用700ul pbs洗涤三次,再用300ul pbs悬浮,用bd facsverse
™
系统进行流式细胞术检测。
33.8、hplc法测定吉西他滨释放对于细胞裂解液组吉西他滨的释放,先将细胞种到10cm大的培养皿中,然后加入有无磷酸酶抑制剂的ripa细胞裂解液缓冲液。裂解充分后,用50um epcam-gems在37
°
c恒温水浴中分别处理0h、0.5h、1h、2h、4h,然后按比例加入乙腈。充分混合后,在4
°
12000r/min低温高速离心机中离心10分钟,提取上清,hplc测定样品在260nm处的吸光度。其余各组分别在缓冲液、10% fbs或gsh中加入epcam-gems,使epcam-gems浓度为50um,按上述方法检测。为了消除其他因素对实验的影响,对上述实验进行了净化,以消除干扰。
34.9、肿瘤干细胞的筛选在无血清培养基dmem/f12中加入0.4%牛血清、5%马血清、egf(20ng/ml)、bfgf(10ng/ ml)和人胰岛素(5ng/ ml)制备肿瘤干细胞培养基。biu-87细胞在正常dmem完全培养基中,37℃,含5%二氧化碳培养。当细胞聚集达到70%时,消化和收集细胞。将肿瘤干细胞培养液悬浮于含1000细胞/ml的6孔板中。培养10天左右完成,观察成球形态。以上是第一次成球。第一个成球的细胞被消化并以同样的方式再次形成。第二个成球细胞可以被认为是肿瘤干细胞。
35.10、流式细胞术检测细胞凋亡将biu-87球形细胞提前接种于6孔板,培养24小时使细胞贴壁,用100 nm gem、lib-gems和epcam-gems处理12小时,然后分别在完全培养基中培养72小时。未处理的细胞形成对照。根据annexinv pe / 7-aad凋亡检测试剂盒说明,pbs洗涤细胞后收集,和5
µ
l annexin-v fitc 195
µ
l结合缓冲液和5
µ
l 7-aad,然后在室温下15分钟在黑暗中孵化。然后使用流式细胞仪器进行分析。
36.11、统计分析使用graphpad prism 8.0.2软件进行统计学分析,比较两个实验组时,先进行方差分析,然后进行t检验。 p 《0.05被认为具有统计学意义,数据用mean
±
sem表示,*、
#
表示p 《0.05。
37.实验结果:1、epcam-gems在膀胱癌细胞内作用过程的图解,如图1。
38.、epcam在多种膀胱癌细胞及膀胱癌组织中的表达结果显示,epcam在膀胱癌细胞中高表达,而在hek293t细胞中为阴性表达(图2a),免疫荧光分析显示epcam主要表达于膀胱癌细胞膜(图2b)。此外,与相邻正常膀胱组织相比,epcam在人膀胱癌组织样本中的总蛋白表达显著上调(图2c),免疫组化结果显示epcam在膀胱癌组织中高表达,而在相邻的正常膀胱组织中低表达(图2d)。kaplan-meier分析显示epcam高表达患者生存预后较差(p 《 0.001,图2e)。
39.、epcam-gems及其类似物合成原理图,如图3。
40.、epcam的特异性结合以及epcam-gems的胞内释放流式细胞术验证epcam-gems对膀胱癌细胞的靶向性,采用荧光素异硫氰酸酯(fitc)标记epcam及其对照序列lib,分别与epcam高表达biu87膀胱癌细胞和epcam低表达正常细胞hek 293t直接孵育。如图所示,结果显示epcam可以靶向biu-87细胞系,与epcam蛋白具有较高的结合亲和力。对于正常人胚胎肾细胞hek 293t, epcam和lib的结果仅与对照细胞相似,没有显著的荧光强度,说明缺乏epcam蛋白表达,无法靶向hek 293t细胞(图4a)。为了明确epcam-gems中gem的胞内释放情况,采用高效液相色谱(hplc)分析不同条件下的物质释放情况,如低ph5.5缓冲液(模拟肿瘤微环境)、ph6.5缓冲液(模拟酸性内切酶/溶酶体系统)、10%胎牛血清(细胞培养液),10
ꢀ×ꢀ
10-3m谷胱甘肽(模拟减瘤微环境),10%胎牛血清(细胞培养液)细胞裂解液或裂解液添加磷酸酶抑制剂,结果表明,当epcam-gems在biu
‑ꢀ
87细胞裂解液条件下时,约50%在1小时内降解,4小时内基本完成降解。而磷酸酶抑制剂的存在显著阻碍epcam-gems在4小时内释放gem,只有约10%的epcam-gems在4小时内降解。其他因素在4小时内很少或没有造成显著的降解(图4b)。这些结果支持epcam-gems释放gem是通过磷酸酶介导的降解实现的。
41.、epcam-gems在皮下移植瘤中显示出显著的抗肿瘤活性采用膀胱癌细胞系biu-87(6组,每组5只裸鼠)在异种皮下肿瘤模型中评价epcam-gems对肿瘤生长的抑制作用,我们观察到epcam-gems在降低肿瘤体积和重量方面有显著的效果。与pbs、epcam和lib组相比,epcam
‑ꢀ
gems组肿瘤体积减少近80%,而gem和lib-gems组仅减少50%。虽然gem和lib-gems也表现出一定的抗肿瘤作用,但其疗效远低于epcam-gems。epcam、lib和磷酸盐缓冲盐水(pbs)没有显示出抗肿瘤作用(图5a,图5b)。
42.、膀胱癌干细胞的筛选以及epcam-gems对膀胱癌干细胞的靶向性及毒性研究为了验证epcam-gems对膀胱癌干细胞具有相同的靶向性和毒性,我们选择两组biu-87膀胱癌细胞分别在dmem和sfm培养基中培养,最后在光镜下拍照观察其形态变化,sfm培养基中biu-87细胞呈球形(图6a)。然后我们选取几种常见的干细胞表面标记物,通过western blot实验比较两组细胞的差异。其中,pa1为人卵巢畸胎瘤细胞。作为阳性标准对照,biu-87球干细胞标志物的表达与pa1相似,而dmem培养的biu-87细胞基本无表达,说明biu-87球形细胞为肿瘤干细胞(图6b)。然后分别用lib-gems、gem和epcam-gems处理biu-87球形细胞和hek 293t细胞。流式细胞术进行细胞凋亡分析,biu-87球形细胞组epcam-gems 、gem各自早凋、晚凋、死亡细胞比例大致相等且高于control-tdo-5-gems;hek 293t细胞组epcam-gems 、control-tdo-5-gems各自早凋、晚凋、死亡细胞比例大致相等且基本与untreated组相同(图6c),说明epcam-gems对biu-87肿瘤干细胞也具有靶向性和细胞毒性。另外,我们分别提取pbs、gem和epcam-gems处理的裸鼠皮下移植瘤组织蛋白,检测肿瘤干细
胞表面标志物的定量变化。我们发现epcam-gems组的相关表达明显降低(图6d),说明epcam-gems在动物水平上杀伤了移植瘤中的肿瘤干细胞,进一步证明epcam-gems不仅能特异性杀伤膀胱癌细胞,还能杀伤导致肿瘤进展、复发和转移的膀胱癌干细胞,阻止了膀胱癌的进一步发展。
43.、epcam-gems在尾静脉注射肺转移模型中的抗肿瘤活性在人膀胱癌尾静脉注射肺转移模型中观察epcam-gems的体内抗肿瘤作用,结果显示,与gem等组相比,epcam-gems组肺转移明显降低(图7a)。此外,epcam-gems治疗组的定量肺转移结节明显低于gem治疗组和其他组(图7b)。值得注意的是,epcam-gems组未观察到显著的体重下降(图7c)。这些数据表明epcam-gems可以通过靶向投递gem到膀胱癌细胞来抑制肿瘤的转移进展。
44.、epcam-gems在原位膀胱癌模型中的抗肿瘤活性目前膀胱癌的主要治疗方法是膀胱灌注化疗。因此,我们进一步通过测定epcam-gems在膀胱癌原位模型中是否具有抑癌作用来探讨其临床意义。在治疗组中,epcam-gems膀胱组织病理学改变与其他治疗组有显著差异。特别是,epcam-gems治疗的大多数膀胱癌的肿瘤分期最低(pt0/tis/ta期),而其他组大多数肿瘤处于高于pt2期。切除膀胱的组织学检查和组织切片的h&e染色证实了这一结论(图8)。
45.、epcam-gems体内生物安全性评价考虑到gem在临床应用中所带来的不良副作用,有必要评价epcam-gems在体内的生物安全性,判断epcam-gems在体内的毒性。gem组和lib-gems组丙氨酸转氨酶(alt)和天冬氨酸转氨酶(ast)水平较高,提示肝毒性,白细胞(wbc)和血小板(plt)水平较低,这与临床报道一致。但epcam-gems组alt、ast、wbc和plt水平与pbs组相似,未见肝毒性和骨髓抑制。同时,值得注意的是,各组红细胞(rbc)、血红蛋白(hgb)、肌酐(crea)、心肌酶(ck)、尿素(urea)均无显著差异(图7)。这些结果表明,在一定的药物剂量下,epcam-gems能够克服吉西他滨的一些副作用,达到理想的抗肿瘤效果,这可能得益于epcam-gems的精确靶向作用。总之,以上数据表明epcam-gems在发挥最佳药物作用的同时,具有良好的生物安全性。
46.结论:1、epcam在多种膀胱癌细胞及膀胱癌组织中高表达。
47.2、通过科学设计合成核酸适配体-药物结合物epcam-gems及其类似物。
48.3、epcam-gems通过epcam特异性结合膀胱癌细胞并完成胞内智能释放。
49.4、epcam-gems在动物皮下异种移植瘤模型中显示出显著的抗肿瘤活性。
50.5、epcam-gems在动物肺转移瘤模型中明显抑制了膀胱癌的生长和转移。
51.6、epcam-gems在动物原位膀胱肿瘤模型中明显抑制了膀胱癌的生长和转移。
52.7、epcam-gems对膀胱癌干细胞也有相当的靶向性及毒性。
53.8、epcam-gems体内生物安全性良好。
54.本发明实验结果发现epcam-gems在膀胱癌细胞及动物模型层次上均有抗肿瘤活性,且毒性不明显,生物安全性良好。epcam-gems增强了吉西他滨与膀胱癌细胞的亲和力,加速了吉西他滨在膀胱癌细胞中的积累,减少了吉西他滨杀伤正常细胞的副作用,降低了因无法杀死肿瘤干细胞而产生的耐药性。这是epcam-gems首次合成并且用于膀胱癌的靶向治疗。综上所述,epcam-gems是一种很有前景的策略,为膀胱癌的精准治疗提供了新的方向。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。