利用蓝藻铁氧还蛋白fd直观检测目的蛋白表达纯化的方法
技术领域
1.本发明涉及一种直观检测目的蛋白表达和纯化的方法,特别涉及一种利用蓝藻显棕红色的蛋白——铁氧还蛋白fd来直观检测目的蛋白表达和纯化的方法。
背景技术:
2.fd(ferredoxin),即铁氧还蛋白,是一种广泛分布于细菌、藻类和高等植物中的小分子可溶性铁硫蛋白,其分子量约10kd。具有三种类型的铁硫中心[2fe-2s]、[3fe-4s]、[4fe-4s],可以作为电子载体传递电子。fd蛋白与光合作用关系密切,它可以将电子传递给fd-nadp
氧化酶(fnr)催化nadph的生成,而且可以通过pgr5-pgrl1和ndh复合体参与环式电子传递。蓝藻中fd基因往往有多个拷贝,例如在念珠藻属nostoc sp.pcc 7120(以下简称:nostoc 7120)中具有9个fd基因,分别编码9个不同的铁氧还蛋白,这些fd蛋白在集胞藻属(synechocystis)、柱胞藻属(cylindrospermum)、鱼腥藻属(anabaena)等蓝藻中都是保守的,其中fd1蛋白在植物和藻类中含量丰富,是光合作用所必须的铁氧还蛋白。铁硫中心是fd蛋白的氧化还原中心,其中的fe原子容易在空气中氧化而呈现棕红色,并且在大肠杆菌中重组表达的蓝藻fd蛋白由于处于氧化态而呈现棕红色。
[0003]
目的蛋白在原核系统中的表达和纯化是分子生物学研究和生物技术产业化发展过程中的重要工具,是对目的蛋白功能和性质研究的基础,更促进了现代生物学科迅猛发展。在各版本的分子生物学实验指南中,目的蛋白的表达和纯化的基本流程是:1.将目的基因克隆入合适的表达载体后导入原核细胞表达系统菌株;2.诱导表达菌株表达目的蛋白;3.通过目的蛋白所带的融合标签,如his、gst等,选择不同性质的柱料将目的蛋白与其他蛋白分离,从而达到蛋白纯化的目的。
[0004]
然而,无论是先小量诱导检测目的蛋白是否表达,还是最后检测是否通过柱料得到了纯化的目的蛋白,都需要将蛋白样品通过十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sds-page),然后用蛋白染色的方法来检测目的蛋白的表达纯化情况。sds-page检测蛋白样品需要将蛋白样品制样,配置聚丙烯酰胺凝胶,然后进行蛋白电泳,最后将蛋白染色并脱色后才能最终知道目的蛋白是否已经表达或得到纯化,这些检测过程累计长达3-4小时,费时费力。2017年,有研究人员提出用黄色的fnr(铁氧还蛋白还原酶)蛋白作为指示标签来快速检测目的蛋白表达和纯化的方法,但是由于大肠杆菌菌液破碎完离心后得到的上清液为淡黄色,若表达蛋白浓度较低则带有fnr标签的融合蛋白表达菌液破碎后上清可能也呈现淡黄色,此时,难以直观判断目的蛋白是否成功表达和纯化。另外,由于难以界定黄色与淡黄色的区别,每次蛋白纯化时均要考虑用不带有fnr标签的表达载体空载作为对照进行纯化,也较为麻烦。
技术实现要素:
[0005]
本发明的目的是提供一种直观实时检测目的蛋白表达和纯化的方法,用以解决目前体外表达纯化的目的蛋白需要通过sds-page来检测,造成操作复杂,耗时长,且不能随着
纯化进程进行实时直观检测的技术问题,以及现有指示标签(如fnr蛋白)颜色不易辨认、灵敏度不高的问题。本发明通过将目的蛋白与蓝藻带颜色的蛋白融合表达来检测目的蛋白表达和纯化的情况,提供了一种便捷直观的方法。
[0006]
为解决上述技术问题,本发明将目的蛋白与蓝藻铁氧还蛋白fd或其同源蛋白融合表达,由于fd蛋白结合铁原子,呈现棕红色,所以整个融合蛋白也呈现棕红色。通过观察融合蛋白的颜色即可判断目的蛋白是否成功表达和/或纯化,从而构建了一种直观实时检测目的蛋白表达纯化的便捷方法。具体的,本发明的技术方案如下:
[0007]
一种直观检测目的蛋白表达纯化的方法,构建目的蛋白基因与蓝藻fd基因或其同源基因的融合基因表达载体,将其转入表达菌种中进行表达,通过观察表达菌液破碎后的上清液和/或其纯化组分的颜色来判断融合蛋白是否被成功表达和/或纯化,如果上清液和/或其纯化组分呈现棕红色,则表明目的蛋白与蓝藻fd蛋白或其同源蛋白一起被表达和/或纯化。
[0008]
进一步地,在对表达的融合蛋白进行柱纯化的过程中,通过观察柱料是否变为棕红色可以判断目的蛋白是否结合上柱料。
[0009]
上述方法中,所述蓝藻fd基因或其同源基因编码的是铁氧还蛋白,具有[2fe-2s]铁硫中心,其赋予fd蛋白在可见光范围内的吸光特性,因此,fd溶液在氧化状态下呈现棕红色。
[0010]
所述蓝藻fd基因优选为蓝藻fd1基因,在念珠藻属nostoc 7120中编号为all4148,编码的蛋白为fd1。nostoc 7120中fd1蛋白的氨基酸序列如序列表中seq id no:1所示,由99个氨基酸组成,值得注意的是,它具有四个保守的半胱氨酸(cys,c)位点:c42、c47、c50、c80,这四个半胱氨酸残基结合fd1蛋白的氧化还原中心[2fe-2s],对fd1蛋白发挥电子传递功能至关重要,也是保证[2fe-2s]铁硫中心能够稳定结合,使蛋白显色的关键。相应地,fd1基因序列如序列表中seq id no:2所示,另外,由于密码子的简并性,其他与seq id no:2所示核苷酸序列同源且编码相同氨基酸序列的dna分子也可用于构建本发明的融合蛋白。
[0011]
fd1蛋白在蓝藻中十分保守,除了念珠藻属nostoc 7120,其他蓝藻中也存在fd1对应的同源基因,例如多变三离藻trichormus variabilis atcc 29413中的基因ava_0756,核苷酸序列相似性达到94.4%,所编码的蛋白氨基酸序列相似性达到94.95%;例如集胞藻属synechocysts sp.pcc 6803中的基因ssl0020,核苷酸序列相似性达到75%,所编码的蛋白氨基酸序列相似性达到73.74%;例如聚球藻属synechococcus sp.pcc 7002中的基因synpcc7002_a2326,核苷酸序列相似性达到73.3%,所编码的蛋白氨基酸序列相似性达到73.74%。与上述任意一种基因具有同源性且编码相同氨基酸序列的dna分子也可以应用于本发明直观检测目的蛋白表达纯化的方法。
[0012]
蓝藻fd基因或其同源基因与目的蛋白基因的融合基因在启动子的驱动下进行表达,所述启动子可以是组成型启动子或诱导型启动子,例如t7启动子和lac操纵子组成的诱导型启动元件。
[0013]
为了方便融合蛋白的纯化,在所述融合蛋白的n端或c端还可以连接上his标签,使得融合蛋白可以用ni亲和层析柱进行纯化。相应地,在构建融合蛋白基因时,在其5’端或3’端连接his标签的编码序列。
[0014]
进一步地,可以在fd基因或其同源基因与目的基因之间插入凝血酶酶切位点的编
码序列,在融合蛋白纯化后通过凝血酶将fd或其同源蛋白与目的蛋白切割开。
[0015]
本发明还提供了一种直观检测目的蛋白表达纯化的表达盒,包括启动子、蓝藻fd基因或其同源基因、多克隆位点(mcs)和终止子,其中多克隆位点用于插入目的基因,插入的目的基因与蓝藻fd基因或其同源基因处于相同的阅读框。
[0016]
进一步地,所述表达盒还包括凝血酶(thrombin)酶切位点的编码序列,该凝血酶酶切位点的编码序列位于蓝藻fd基因或其同源基因与多克隆位点之间。
[0017]
优选地,所述表达盒在蓝藻fd基因或其同源基因上游还连接了编码his标签的多核苷酸序列,表达出带his标签的fd蛋白或其同源蛋白。
[0018]
进一步地,所述表达盒中还具有控制诱导表达的操纵子,例如lac操纵子。
[0019]
在本发明的一个实施例中,构建了从上游到下游依次为可诱导表达元件(t7启动子 lac操纵子)、带his标签编码序列的蓝藻fd基因或其同源基因(6
×
his-fd基因)、凝血酶酶切位点的编码序列、多克隆位点(包含ndeⅰ和bamhⅰ酶切位点用来插入外源基因)、表达终止子(t7终止子)的表达盒。通过酶切连接的方式可以将目的蛋白x的基因x连入表达盒的ndeⅰ和bamhⅰ酶切位点之间,形成fd-x融合蛋白基因。将所述表达盒构建在表达载体上,然后将表达载体转入表达菌株中诱导表达,通过观察表达菌液破碎后上清液的颜色是否呈现棕红色来检测目的蛋白x是否表达。将呈棕红色的上清液经0.45μm滤膜过滤后,先用镍柱纯化6
×
his-fd-thrombin-x融合蛋白,此时柱料为棕红色,表示蛋白x已经表达并与柱料结合,然后用凝血酶酶切,洗脱之后目的蛋白x就存在于洗脱液中,而6
×
his-fd残留在柱料上,这样就可以得到纯化的目的蛋白x。
[0020]
含有所述表达盒的载体(包括中间载体和表达载体)、宿主细胞均在本发明的保护范围内。
[0021]
本发明利用蓝藻铁氧还蛋白fd或其同源蛋白与目的蛋白融合共同表达,通过检测表达菌液破碎后上清液的颜色是否呈棕红色来判断目的蛋白是否表达,并且可以检测纯化蛋白的柱料是否变棕红色来检测目的蛋白是否结合在柱料上,从而实现对目的蛋白表达纯化的直观检测,方便快捷,大大节省了常规验证目的蛋白成功表达纯化的时间。并且成功表达融合蛋白的棕红色菌液与未成功表达融合蛋白的淡黄色菌液具有十分鲜明的颜色差别,观测准确性高,可以快速直观的判断目的蛋白是否成功表达。
附图说明
[0022]
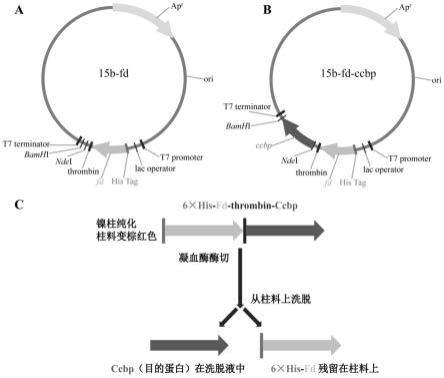
图1是实施例1中间载体15b-fd(a)和表达载体15b-fd-x(b)的构建示意图,以及从fd与目的蛋白的融合蛋白中纯化出目的蛋白的示意图(c)。
[0023]
图2是含有pet-15b对照质粒的表达菌液破碎后上清的图片(a)和含有15b-fd-ccbp表达载体的表达菌液破碎后上清的图片(b),其中a的菌液上清呈现常见的淡黄色,b的菌液上清呈现明显的棕红色。
[0024]
图3是含有pet-15b对照质粒的表达菌液破碎后上清流经镍柱柱料后的图片(a)和含有15b-fd-ccbp表达载体的表达菌液破碎后上清经过镍柱柱料后的图片(b),其中a的镍柱柱料颜色不变,为原本的淡蓝色,而b的镍柱柱料颜色变为棕红色。
[0025]
图4是本发明实施例2纯化目的蛋白的各步骤制样后的sds-page图。
具体实施方式
[0026]
以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均从常规生化试剂商店中购买。
[0027]
实验所用的大肠杆菌菌株dh5α和bl21(de3)购买于北京全式金公司,采用常规的lb培养基培养,选择生长所用的抗生素浓度为100μg/ml amp
。实验所用的原始质粒pet-15b均购买于市面上常见的生物技术公司。载体的克隆和蛋白的表达纯化步骤参见分子生物学指南。
[0028]
实施例1:整合载体的构建及阳性菌株的筛选
[0029]
(1)中间载体15b-fd的构建
[0030]
中间载体15b-fd的构建流程如图1中a所示,其中t7 promoter和lac operator构成了可诱导表达元件(t7 promoter lac operator),his-tag可以让fd基因表达的fd蛋白带上组氨酸标签。thrombin表示凝血酶酶切位点,设计目的是待融合蛋白与柱料结合后,使用凝血酶将融合蛋白中的fd和目的蛋白切开,从而从镍柱洗脱即可获得纯化的目的蛋白。ndeⅰ和bamhⅰ酶切位点之间是多克隆位点,可以将目的基因(即基因x)通过这些酶切位点连入中间载体,从而进行表达。图1a中的t7 promoter、lac operator、his tag、thrombin、多克隆位点和t7terminator等元件pcr自pet-15b质粒。利用引物对p1/p2,以pet-15b质粒为模板,扩增出包含15b-fd中除fd基因外的所有组件15b-1片段。以野生型念珠藻属nostoc 7120基因组总dna为模板,利用引物对p3/p4扩增出fd1基因,得到fd1片段。然后将15b-1片段和fd1片段利用北京全式金公司无缝连接试剂盒(peasy-uniseamless cloning and assembly kit)连接在一起得到中间载体15b-fd。
[0031]
(2)表达载体15b-fd-x的构建
[0032]
将目的蛋白x的编码基因x利用连入中间载体的ndeⅰ和bamhⅰ酶切位点之间,形成目的蛋白x的表达载体15b-fd-x。
[0033]
实施例2:利用ccbp蛋白作为目的蛋白来检测本发明的可行性
[0034]
(1)表达载体15b-fd-ccbp的构建
[0035]
15b-fd-ccbp的构建流程如图1中b所示。ccbp是蓝藻中一种钙离子结合蛋白,对蓝藻的格式形成具有重要作用,本实施例采用ccbp蛋白作为目的蛋白来检验本发明的可行性。以野生型念珠藻属nostoc 7120基因组总dna为模板,利用引物对p5/p6扩增出ccbp基因,然后用ndeⅰ和bamhⅰ酶切连入中间载体15b-fd得到表达载体15b-fd-ccbp。
[0036]
(2)直观检测ccbp蛋白的表达
[0037]
由于6
×
his-fd-thrombin-ccbp融合蛋白为棕红色,所以我们可以通过表达菌液破碎后上清液的颜色变化来直接检测目的蛋白是否已经融合表达。将表达载体15b-fd-ccbp转入大肠杆菌表达菌株bl21(de3)中,在18℃温度条件下加0.5mm的iptg诱导表达16h后,取菌液用细胞破碎仪jnbio n-mini,压力1000bar破碎3次,破碎完18,000rpm离心30min后观察破碎后菌液上清,如图2中b所示,菌液上清为棕红色。图2中a为只含pet-15b质粒表达菌液破碎后上清的颜色,可以看到为正常的淡黄色。对照图2中的a和b,我们可以验证得到:如果表达载体转入表达菌株中,诱导表达后,破碎后菌液上清若呈现棕红色,则可以直观判断目的蛋白已经得到表达。
[0038]
(3)直观检测ccbp蛋白的纯化
[0039]
我们还可以通过直观检测柱料颜色是否变棕红色来检测目的蛋白是否结合上柱料,从而方便进行纯化。在确定目的蛋白已经成功表达后,我们利用镍柱纯化6
×
his-fd-thrombin-ccbp融合蛋白。由于6
×
his-fd-thrombin-ccbp融合蛋白为棕红色,如图3中b的箭头所示,纯化的镍柱柱料为深棕红色,这表明蛋白ccbp已经结合在镍柱柱料上。而图3中a的箭头指示为只含有pet-15b质粒表达菌液破碎后上清流经柱料后柱料的颜色,此时镍柱柱料颜色没有变化,仍旧是淡蓝色。对照图3中的a和b,我们可以通过观察柱料的颜色变化,来直观检测目的蛋白是否已经与柱料结合,并为下一步纯化目的蛋白做准备。
[0040]
(4)纯化目的蛋白ccbp
[0041]
由于我们通过表达载体表达的是6
×
his-fd-thrombin-ccbp融合蛋白,所以我们还需要通过图1中c显示的步骤来纯化得到纯合的ccbp目的蛋白。我们在柱料上用凝血酶常温酶切2h后,用洗脱液洗脱下的液体就是纯化得到的ccbp目的蛋白。6
×
his-fd蛋白仍旧残留在镍柱柱料上。图4显示我们通过图1中c所示的步骤纯化目的蛋白的sds-page图。fd-ccbp表示酶切前的柱料制取的样品,可以看到大小为27kd的蛋白条带可推测为6
×
his-fd-thrombin-ccbp融合蛋白;ccbp是洗脱液制取的样品,大小为17kd的蛋白条带可推测为ccbp蛋白,此推测均已通过质谱验证。另外,如图4所示,fd-ccbp样品和ccbp样品中均有23kd左右条带,质谱结果显示其为大肠杆菌中的蛋白camp-activated global transcriptional regulator(crp),可能是纯化过程导致。因此,通过图1中c所示的步骤,我们不仅可以直观检测目的蛋白的表达和纯化过程,还能通过凝血酶酶切去除6
×
his-fd标签,从而获得纯净的目的蛋白。
[0042]
表1.本发明所用的引物序列
[0043]
引物dna序列sequence(5
’‑3’
)序列表中编号p1acaaagaagaagacctctacagcagcggcctggtgccgcgseq id no:3p2aatgtaactttaaaggttgcgtgatgatgatgatgatggcseq id no:4p3gccatcatcatcatcatcacgcaacctttaaagttacattseq id no:5p4cgcggcaccaggccgctgctgtagaggtcttcttctttgtseq id no:6p5catatggccagtgtagaacgcgaseq id no:7p6ggatcctaaaatttgtatcccctagseq id no:8
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。