抗ccr8单克隆抗体及其用途
背景技术:
1.趋化因子(c-c基序)受体8(ccr8)是β趋化因子受体家族的成员,其是一种类似于g蛋白偶联受体的七次跨膜蛋白。趋化因子及其受体对于各种细胞类型迁移到炎症部位很重要。这种受体蛋白优先在胸腺中表达。ccr8的配体是ccl1。ccl8还起到ccr8激动剂的作用。
2.ccr8主要在调节性t细胞(treg)上表达,对ccr8
treg介导的免疫抑制很重要。最近的研究已经表明,ccr8在癌症患者的人类肿瘤驻留treg中被独特地上调。还表明ccr8
骨髓细胞在癌症患者中扩增。
3.在动物模型中,已显示靶向ccr8的抗体可以显著抑制肿瘤生长并提高长期存活。这种抗肿瘤活性与肿瘤特异性t细胞的增加以及cd4
和cd8
t细胞的浸润增强相关。用抗体处理防止了treg的诱导和抑制功能,而不影响cd8
t细胞。因此,靶向ccr8是一种很有前景的癌症免疫治疗方法。
技术实现要素:
4.本文发现的抗ccr8抗体对人ccr8蛋白具有高结合亲和力,并且在介导抗体依赖性细胞毒性(adcc)方面有效。
5.在一个实施方案中,提供了一种对人趋化因子(c-c基序)受体8(ccr8)蛋白具有结合特异性的抗体或其片段。所述抗体或其片段包含重链可变区和轻链可变区,所述重链可变区包含重链互补决定区cdrh1、cdrh2和cdrh3,所述轻链可变区包含轻链互补决定区cdrl1、cdrl2和cdrl3。在一个实施方案中,所述cdrh1包含seq id no:22的氨基酸序列,所述cdrh2包含seq id no:23的氨基酸序列,所述cdrh3包含seq id no:24的氨基酸序列,所述cdrl1包含seq id no:25或28的氨基酸序列,所述cdrl2包含seq id no:26的氨基酸序列,并且所述cdrl3包含seq id no:27的氨基酸序列。
6.在一个实施方案中,所述cdrh1包含seq id no:35的氨基酸序列,所述cdrh2包含seq id no:36的氨基酸序列,所述cdrh3包含seq id no:37的氨基酸序列,所述cdrl1包含seq id no:25或28的氨基酸序列,所述cdrl2包含seq id no:26的氨基酸序列,并且所述cdrl3包含seq id no:27的氨基酸序列。
7.在一些实施方案中,还提供了包含所述抗体或其片段和药学上可接受的载体的组合物。在一些实施方案中,所述组合物进一步包含对肿瘤抗原具有特异性的第二抗体。在一些实施方案中,所述第二抗体是肿瘤调理抗体。
8.还提供了用于治疗疾病和病症的方法和用途。在一个实施方案中,提供了一种治疗有需要的患者的癌症的方法,包括向所述患者施用本公开的抗体或其片段。
附图说明
9.图1显示具有鼠vh/vl的嵌合抗体的ccr8结合亲和力。
10.图2显示三种嵌合抗体的adcc活性。
11.图3显示人源化88d2c6抗体具有高亲和力。
12.图4显示人源化137d1h10抗体具有高亲和力。
13.图5显示,与嵌合抗体相比,人源化抗体具有显著更高的adcc活性。
14.图6显示lm-108和参考抗体与人ccr8通过流式细胞术的基于细胞的结合的结果。上图:lm-108在表达人ccr8的hek293上的facs结合。下图:lm-108在hek293细胞上的facs结合。
15.图7显示lm-108与高表达人ccr8的u2os细胞通过流式细胞术的基于细胞的结合。
16.图8显示lm-108与低表达人ccr8的jurkat细胞通过流式细胞术的基于细胞的结合。
17.图9显示用jurkat/cd16a(158v)/nfat-luc细胞、靶向高表达ccr8的u2os细胞进行的lm-108的adcc报告基因分析的结果。
18.图10显示用jurkat/cd16a(158v)/nfat细胞、靶向低表达ccr8的jurkat细胞进行的lm-108的adcc报告基因分析的结果。
19.图11显示用hpbmc靶向表达ccr8的细胞(上图)或对照细胞(下图)的lm-108的adcc检验结果。
20.图12显示lm-108与单核细胞衍生的巨噬细胞通过facs的adcp。上图:lm-108 lm-108对过表达人ccr8的cho-k1细胞的adcp。下图:lm-108lm-108对对照cho-k1细胞的adcp。
21.图13显示lm-108与单核细胞衍生的巨噬细胞通过operetta的adcp成像结果。
22.图14显示在lm-108m对balb/c小鼠的ct26同基因模型的体内功效研究中,在施用lm-108m和抗mpd-1ab后ct26荷瘤小鼠的肿瘤生长曲线。
23.图15显示在lm-108对hccr8 ki小鼠的mc38同基因模型的体内功效研究中,在施用lm-108m和赋形剂后mc38荷瘤小鼠的肿瘤生长曲线。
24.图16显示lm-108-vc-mmae对表达hccr8的细胞的细胞毒性评价结果。
具体实施方式
25.定义
26.应当注意,术语“一个”或“一种”实体是指该实体的一个或多个(一种或多种);例如,“一种抗体”应理解为表示一种或多种抗体。这样,术语“一个”(或“一种”)、“一个(种)或多个(种)”和“至少一个(种)”在本文中可以互换使用。
27.如本文所用,术语“多肽”旨在涵盖单数“多肽”以及复数“多肽”,并且是指由通过酰胺键(也称为肽键)线性连接的单体(氨基酸)构成的分子。术语“多肽”是指两个或多个氨基酸的任何一条或多条链,并不指特定长度的产物。因此,“多肽”的定义中包括肽、二肽、三肽、寡肽、“蛋白质”、“氨基酸链”或用于指代两个或更多个氨基酸的一条或多条链的任何其他术语,并且术语“多肽”可以代替这些术语中的任何术语使用,或与这些术语中的任何术语互换使用。术语“多肽”还旨在指多肽的表达后修饰的产物,包括但不限于糖基化、乙酰化、磷酸化、酰胺化、通过已知的保护/阻断基团衍生化、蛋白水解切割或通过非天然存在的氨基酸进行的修饰。多肽可以源自天然生物来源或通过重组技术产生,但不一定从指定的核酸序列翻译而来。它可以以任何方式产生,包括通过化学合成产生。
[0028]“同源性”或“同一性”或“相似性”是指两条肽之间或两个核酸分子之间的序列相似性。同源性可以通过比较每个序列中的位置来确定,序列可以出于比较的目的而被比对。
当比较序列中的一个位置被相同的碱基或氨基酸占据时,则分子在该位置是同源的。序列之间的同源性程度是序列共享的匹配位置或同源位置的数量的函数。“不相关的”或“非同源的”序列与本公开的序列之一共享小于40%的同一性,但优选小于25%的同一性。
[0029]
多核苷酸或多核苷酸区(或多肽或多肽区)与另一个序列具有一定百分比(例如60%、65%、70%、75%、80%、85%、90%、95%、98%或99%)的“序列同一性”是指,当比对时,在比较两个序列时碱基(或氨基酸)相同的百分比。
[0030]
术语“等效核酸或等效多核苷酸”是指具有与核酸或其互补物的核苷酸序列具有一定程度的同源性或序列同一性的核苷酸序列的核酸。双链核酸的同源物旨在包括具有与其或其互补物具有一定程度同源性的核苷酸序列的核酸。一方面,核酸的同源物能够与核酸或其互补物杂交。同样地,“等效多肽”是指与参考多肽的氨基酸序列具有一定程度的同源性或序列同一性的多肽。在一些方面,序列同一性为至少约70%、75%、80%、85%、90%、95%、98%或99%。在一些方面,与参考多肽或多核苷酸相比,等效多肽或多核苷酸具有1、2、3、4或5个添加、缺失、取代及其组合。在一些方面,等效序列保留参考序列的活性(例如,表位结合)或结构(例如,盐桥)。
[0031]
如本文所用,“抗体”或“抗原结合多肽”是指特异性识别并结合抗原的多肽或多肽复合物。抗体可以是完整抗体及其任何抗原结合片段或单链。因此,术语“抗体”包括任何蛋白质或肽,其含有包括至少免疫球蛋白分子中具有与抗原结合的生物学活性的部分的分子。这样的实例包括但不限于重链或轻链的互补决定区(cdr)或其配体结合部分、重链或轻链可变区、重链或轻链恒定区、框架(fr)区或其任何部分,或结合蛋白的至少一个部分。
[0032]
如本文所用,术语“抗体片段”或“抗原结合片段”是抗体的一部分,例如f(ab')2、f(ab)2、fab'、fab、fv、scfv等。无论结构如何,抗体片段都与被完整抗体识别的同一抗原结合。术语“抗体片段”包括适配体(aptamer)、镜像异构体(spiegelmer)和双体(diabody)。术语“抗体片段”还包括像抗体一样通过与特定抗原结合形成复合物而起作用的任何合成的或基因工程的蛋白。
[0033]“单链可变片段”或“scfv”是指免疫球蛋白的重链(vh)和轻链(v
l
)的可变区的融合蛋白。在一些方面,所述区与10至约25个氨基酸的短接头肽连接。接头可以富含甘氨酸以提高柔性,并富含丝氨酸或苏氨酸以提高溶解度,并且可以将vh的n-末端与v
l
的c-末端相连,反之亦然。尽管去除了恒定区并引入了接头,但该蛋白仍保留了原始免疫球蛋白的特异性。scfv分子是本领域已知的,并且例如在美国专利5,892,019中被描述。
[0034]
术语抗体涵盖了各种广泛类别的多肽,其可从生物化学上被区分。本领域技术人员将理解,重链被分类为gamma、mu、alpha、delta或epsilon(γ、μ、α、δ、ε),其中有一些子类(例如γl-γ4)。该链的性质决定了抗体的“类别”分别为igg、igm、iga、igg或ige。免疫球蛋白亚类(同种型),例如igg1、igg2、igg3、igg4、igg5等,已被很好地表征,并且已知赋予功能特异性。鉴于本公开,这些类别和同种型的每一个的修饰形式对于本领域技术人员而言是容易辨别的,并且因此在本公开的范围内。所有的免疫球蛋白类别显然都在本公开的范围内,下面的讨论通常将针对免疫球蛋白分子的igg类别。关于igg,标准免疫球蛋白分子包含两条相同的分子量约为23,000道尔顿的轻链多肽和两条相同的分子量为53,000-70,000的重链多肽。四条链通常通过二硫键以“y”构型连接,其中轻链将重链括起来,从“y”的口开始,一直延伸到可变区。
[0035]
本公开的抗体、抗原结合多肽、其变体或衍生物包括但不限于多克隆、单克隆、多特异性、人类、人源化、灵长类化(primatized)或嵌合的抗体,单链抗体,表位结合片段,例如fab、fab'和f(ab')2、fd、fv、单链fv(scfv)、单链抗体、二硫键连接的fv(sdfv)、包含vk或vh结构域的片段、由fab表达文库产生的片段和抗独特型(anti-idiotypic)(抗id)抗体(包括例如本文公开的针对light抗体的抗id抗体)。本公开的免疫球蛋白或抗体分子可以是任何类型(例如,igg、ige、igm、igd、iga和igy)、类别(例如,igg1、igg2、igg3、igg4、iga1和iga2)或亚类的免疫球蛋白分子。
[0036]
轻链分为kappa或lambda(κ、λ)。每个重链类别都可以与κ或λ轻链结合。通常,当免疫球蛋白由杂交瘤、b细胞或基因工程宿主细胞产生时,轻链和重链彼此共价键合,两条重链的“尾”部通过共价二硫键或非共价键彼此键合。在重链中,氨基酸序列从y构型的分叉末端的n-末端延伸到每条链底部的c-末端。
[0037]
轻链和重链均分为结构同源区和功能同源区。术语“恒定”和“可变”在功能上使用。在这方面,应当理解,轻链部分的可变结构域(vk)和重链部分的可变结构域(vh)决定了抗原的识别和特异性。相反地,轻链的恒定结构域(ck)和重链的恒定结构域(ch1、ch2或ch3)赋予重要的生物学特性,比如分泌、跨胎盘迁移、fc受体结合、互补物结合等。按照惯例,恒定区结构域的编号随着它们变得更远离抗体的抗原结合位点或氨基末端而增加。n-末端部分是可变区,c-末端部分是恒定区;ch3和ck结构域实际上分别包含重链和轻链的羧基末端。
[0038]
如上所述,可变区允许抗体选择性识别并特异性结合抗原上的表位。即,抗体的vk结构域和vh结构域或互补决定区(cdr)的子集组合形成定义三维抗原结合位点的可变区。这种四级抗体结构形成了存在于y的各臂终端的抗原结合位点。更具体地说,抗原结合位点由vh和vk链各自上的三个cdr定义(即cdr-h1、cdr-h2、cdr-h3、cdr-l1、cdr-l2和cdr-l3)。在某些情况下,例如某些源自骆驼科物种或基于骆驼科免疫球蛋白工程改造的免疫球蛋白分子,完整的免疫球蛋白分子可以仅由重链组成,而没有轻链。参见,例如,hamers-casterman等,nature 363:446-448(1993)。
[0039]
在天然存在的抗体中,在每个抗原结合结构域中存在的六个“互补决定区”或“cdr”是短的、非连续的氨基酸序列,所述氨基酸序列被特异性定位为当在水性环境中该抗体呈现出其三维构型时形成抗原结合结构域。抗原结合结构域中的其余氨基酸(称为“框架”区)显示出较小的分子间可变性。构架区主要采用β-折叠结构,并且cdr形成环,该环连接β-折叠结构,并在某些情况下形成β-折叠结构的一部分。因此,框架区起形成支架的作用,该支架通过链间非共价相互作用将cdr定位在正确的方向上。由定位的cdr形成的抗原结合结构域限定了与免疫反应性抗原上的表位互补的表面。这种互补表面促进抗体与其同源表位的非共价结合。本领域的普通技术人员可以容易地针对任何给定的重链或轻链可变区分别鉴定包含cdr和框架区的氨基酸,因为它们已经被精确地定义(参见“sequences of proteins of immunological interest”,kabat,e.等,美国卫生与公共服务部(u.s.department of health and human services),(1983);以及chothia和lesk,j.moi.biol.,196:901-917(1987))。
[0040]
在本领域内使用和/或接受的术语有两个或更多个定义的情况下,除非有明确的相反说明,否则如本文所用术语的定义旨在包括所有这些含义。一个具体实例是使用术语“互补决定区”(“cdr”)来描述在重链和轻链多肽的可变区内均发现的非连续抗原结合位点。这种特定区已经由kabat等,美国卫生与公共服务部(u.s.dept.of health and human services),“sequences of proteins of immunological interest”(1983)和chothia等,j.moi.biol.196:901-917(1987)描述,通过引用将其整体并入本文。当彼此比较时,根据kabat和chothia的cdr定义包括氨基酸残基的重叠或子集。然而,任何一种用于指代抗体或其变体的cdr的定义的应用都旨在在本文所定义和使用的术语的范围内。作为比较,下表中列出了涵盖如上述引用的参考文献的各自所定义的cdr的合适氨基酸残基。涵盖特定cdr的确切残基数将根据cdr的序列和大小而变化。给定了抗体的可变区氨基酸序列,本领域技术人员可以常规地确定哪些残基包含特定cdr。
[0041] kabatchothiacdr-h131-3526-32cdr-h250-6552-58cdr-h395-10295-102cdr-l124-3426-32cdr-l250-5650-52cdr-l389-9791-96
[0042]
kabat等还定义了适用于任何抗体的可变结构域序列的编号系统。本领域普通技术人员可以明确地将这种“kabat编号”系统分配给任何可变结构域序列,而不依赖序列本身以外的任何实验数据。如本文所用,“kabat编号”是指由kabat等,美国卫生和公共服务部(u.s.dept.of health and human services),“sequence of proteins of immunological interest”(1983)中所示的编号系统。
[0043]
除上表外,kabat编号系统还如下描述了cdr区:cdr-h1在大约第31位氨基酸处开始(即大约在第一个半胱氨酸残基之后9个残基),包括大约5-7个氨基酸,并在下一个色氨酸残基处终止。cdr-h2在cdr-h1末端之后的第15个残基处开始,包含约16-19个氨基酸,并在下一个精氨酸或赖氨酸残基处终止。cdr-h3在cdr-h2末端后大约第33个氨基酸残基处开始;包含3-25个氨基酸;并在序列w-g-x-g处终止,其中x是任意氨基酸。cdr-l1在大约第24位残基处开始(即在半胱氨酸残基之后);包含大约10-17个残基;并在下一个色氨酸残基处终止。cdr-l2在cdr-l1末端之后大约第16个残基处开始,包含大约7个残基。cdr-l3在cdr-l2末端之后大约第33个残基处(即在半胱氨酸残基之后)开始;包含大约7-11个残基,并在序列f或w-g-x-g处终止,其中x是任意氨基酸。
[0044]
本文所公开的抗体可以来自任何动物来源,包括鸟类和哺乳动物。优选地,抗体是人、鼠、驴、兔、山羊、豚鼠、骆驼、美洲驼、马或鸡的抗体。在另一个实施方案中,可变区可以是condricthoid来源(例如来自鲨鱼)。
[0045]
如本文所用,术语“重链恒定区”包含衍生自免疫球蛋白重链的氨基酸序列。包含重链恒定区的多肽包含以下至少一种:ch1结构域、铰链(例如,上、中和/或下铰链区)结构域、ch2结构域、ch3结构域,或其变体或片段。例如,用于本公开的抗原结合多肽可以包含含ch1结构域的多肽链;含ch1结构域、铰链结构域的至少一部分和ch2结构域的多肽链;含ch1结构域和ch3结构域的多肽链;含ch1结构域、铰链结构域的至少一部分和ch3结构域的多肽链,或含ch1结构域、铰链结构域的至少一部分、ch2结构域和ch3结构域的多肽链。在另一个
实施方案中,本公开的多肽包含含ch3结构域的多肽链。进一步地,用于本公开的抗体可以缺少ch2结构域的至少一部分(例如,ch2结构域的全部或部分)。如上所述,本领域普通技术人员将理解,可以修饰重链恒定区,使得它们在氨基酸序列上与天然存在的免疫球蛋白分子不同。
[0046]
本文公开的抗体的重链恒定区可以衍生自不同的免疫球蛋白分子。例如,多肽的重链恒定区可以包含衍生自igg1分子的ch1结构域和衍生自igg3分子的铰链区。在另一个实例中,重链恒定区可以包含部分衍生自igg1分子且部分衍生自igg3分子的铰链区。在另一个实例中,重链部分可以包含部分衍生自igg1分子且部分衍生自igg4分子的嵌合铰链。
[0047]
如本文所用,术语“轻链恒定区”包括衍生自抗体轻链的氨基酸序列。优选地,轻链恒定区包含恒定κ结构域或恒定λ结构域中的至少一种。
[0048]“轻链-重链对”是指轻链和重链的集合,其可以通过轻链的cl结构域和重链的ch1结构域之间的二硫键形成二聚体。
[0049]
如前所述,各种免疫球蛋白类别的恒定区的亚基结构和三维构型是众所周知的。如本文所用,术语“vh结构域”包括免疫球蛋白重链的氨基末端可变结构域,术语“ch1结构域”包括免疫球蛋白重链的第一(最氨基末端)恒定区结构域。ch1结构域与vh结构域相邻,并且在免疫球蛋白重链分子的铰链区的氨基末端。
[0050]
如本文所用,术语“ch2结构域”包括重链分子的例如从抗体的约第244位残基延伸至第360位残基(使用常规编号方案)(第244至360位残基,kabat编号系统;和第231-340位残基,eu编号系统;请参见kabat等,美国卫生与公共服务部,“sequences of proteins of immunological interest”(1983))的部分。ch2结构域的独特之处在于它不与另一个结构域紧密配对。而是,两个n-连接的分支碳水化合物链插入完整的天然igg分子的两个ch2结构域之间。还充分证明,ch3结构域从ch2结构域延伸至igg分子的c-末端,并包含约108个残基。
[0051]
如本文所用,术语“铰链区”包括重链分子的连接ch1结构域和ch2结构域的部分。该铰链区包含约25个残基并且是柔性的,因此允许两个n-末端抗原结合区独立移动。铰链区可细分为三个不同的结构域:上、中、下铰链结构域(roux等,j.immunol 161:4083(1998))。
[0052]
如本文所用,术语“二硫键”包括在两个硫原子之间形成的共价键。氨基酸半胱氨酸包含巯基,其可以与第二个巯基形成二硫键或桥连。在大多数天然存在的igg分子中,ch1和ck区通过二硫键连接,并且两条重链通过两个在对应于第239和242位(使用kabat编号系统)(第226或229位,eu编号系统)的二硫键连接。
[0053]
如本文所用,术语“嵌合抗体”将被保持为意指其中免疫反应性区或免疫反应性位点获自或衍生自第一物种并且恒定区(根据本公开,其可以是完整的、部分的或修饰的)获自第二物种的任何抗体。在某些实施方案中,靶结合区或靶结合位点将来自非人来源(例如小鼠或灵长类),而恒定区是人的。
[0054]
如本文所用,通过确定人源化结构域和种系结构域之间的框架氨基酸差异(即非cdr差异)的数目,从氨基酸总数中减去该数目,然后除以氨基酸总数并乘以100来计算“百分比人源化”。
[0055]“特异性结合”或“对
……
具有特异性”通常是指抗体通过其抗原结合结构域与表
位结合,并且所述结合需要在抗原结合结构域和表位之间具有一定的互补性。根据该定义,当抗体通过其抗原结合结构域与表位结合比抗体与随机的、不相关的表位结合更容易时,抗体被称为与该表位“特异性结合”。术语“特异性”在本文中用于限定某种抗体与某种表位结合的相对亲和力。例如,可以认为抗体“a”对给定的表位具有比抗体“b”更高的特异性,或者可以说抗体“a”以比对相关表位“d”更高的特异性结合表位“c”。
[0056]
如本文所用,术语“治疗”(“treat”或“treatment”)是指治疗性治疗和预防性(prophylactic或preventative)措施,其中目的是预防或减缓(减轻)不期望的生理变化或紊乱,例如癌症的进展。有益的或期望的临床结果包括但不限于无论是可检测的还是不可检测的症状缓解、疾病程度减轻、疾病状态稳定(即不恶化)、疾病进展延迟或减慢、疾病状态改善或减轻,以及缓解(无论是部分还是全部)。“治疗”还可能意味着与如果未接受治疗所预期的生存期相比,生存期延长。需要治疗的那些受试者包括已经患有病症或紊乱的那些受试者以及那些易于患病症或紊乱的那些受试者或要预防病症或紊乱的那些受试者。
[0057]“受试者”或“个体”或“动物”或“患者”或“哺乳动物”是指需要诊断、预后或治疗的任何受试者,特别是哺乳动物受试者。哺乳动物受试者包括人类、家畜、农场动物以及动物园动物、运动动物或宠物,例如狗、猫、豚鼠、兔子、大鼠、小鼠、马、家牛、奶牛等。
[0058]
如本文所用,短语比如“需要治疗的患者”或“需要治疗的受试者”包括将从施用本公开所使用的抗体或组合物例如以用于检测、用于诊断程序和/或用于治疗而受益的受试者,例如哺乳动物受试者。
[0059]
抗ccr8抗体
[0060]
本公开提供了抗ccr8抗体和片段,其对人ccr8蛋白具有高亲和力、在介导adcc和adcp方面有效,并且显示出有效的体内肿瘤抑制剂效果。有趣的是,当使用抗ccr8抗体(来自wo2020138489)作为基准时,本公开的抗体表现出不与非ccr8表达细胞结合,而基准抗体还与那些对照细胞结合。因此,可以预期本发明的抗体在临床应用中具有较少的不希望的副作用。因此,这些抗体是用于治疗以过表达ccr8为特征的各种疾病(比如癌症)的合适药剂。
[0061]
因此,根据本公开的一个实施方案,提供了能够与ccr8结合的抗体及其抗原结合片段。示例性抗体包括表1中列出的那些鼠类抗体(例如137d1h10、88d2c6、89b6f8、132h8e10、10f11b2、40h10f3、53d6a9、352h11c11、362g7d3、362h10a3、367d10e7、370d2c10),以及表2-3中的人源化抗体。还包括包含与本文所示相同的cdr的那些抗体。在一些实施方案中,所公开的抗体和片段包括与本文所示的那些结合相同的表位的那些,以及与本公开的抗体和片段竞争结合ccr8的那些。
[0062]
根据本公开的一个实施方案,提供了一种包括具有本文公开的cdr区的重链和轻链可变结构域的抗体或其片段,以及其生物学等效物。
[0063]
在一个实施方案中,cdr是88d2c6或其人源化对应物的cdr,如表2b和2d中所例举的。在一个实施方案中,cdrh1包含seq id no:22的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrh2包含seq id no:23的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrh3包含seq id no:24的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrl1包含seq id no:25或28的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrl2包含seq id no:
26的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,并且cdrl3包含seq id no:27的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体。
[0064]
在一个实施方案中,cdrh1包含seq id no:22的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrh2包含seq id no:23的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrh3包含seq id no:24的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrl1包含seq id no:25的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrl2包含seq id no:26的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,并且cdrl3包含seq id no:27的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体。
[0065]
在一个实施方案中,cdrh1包含seq id no:22的氨基酸序列,cdrh2包含seq id no:23的氨基酸序列,cdrh3包含seq id no:24的氨基酸序列,cdrl1包含seq id no:25或28的氨基酸序列,cdrl2包含seq id no:26的氨基酸序列,cdrl3包含seq id no:27的氨基酸序列。
[0066]
在一些实施方案中,还提供了包含与88d2c6或其人源化对应物相同的cdr的那些。在一些实施方案中,所公开的抗体和片段包括与88d2c6或其人源化对应物结合相同表位的那些,以及与它们中的任何一种竞争结合ccr8的那些。
[0067]
在一些实施方案中,重链可变区包含选自由seq id no:3(小鼠或嵌合)和29-31(人源化)组成的组的氨基酸序列,或与选自由seq id no:3(小鼠或嵌合)和29-31(人源化)组成的组的氨基酸序列具有至少90%序列同一性的肽。
[0068]
在一些实施方案中,轻链可变区包含选自由seq id no:2(小鼠或嵌合)、32-34和41-43(人源化)组成的组的氨基酸序列,或与选自由seq id no(小鼠或嵌合):2、32-34和41-43(人源化)组成的组的氨基酸序列具有至少90%序列同一性的肽。
[0069]
在一些实施方案中,重链可变区包含seq id no:29的氨基酸序列,轻链可变区包含seq id no:32-34和41-43中任一种的氨基酸序列。在一些实施方案中,重链可变区包含seq id no:30的氨基酸序列,轻链可变区包含seq id no:32-34和41-43中任一种的氨基酸序列。在一些实施方案中,重链可变区包含seq id no:31的氨基酸序列,轻链可变区包含seq id no:32-34和41-43中任一种的氨基酸序列。在一些实施方案中,重链可变区包含seq id no:29的氨基酸序列,轻链可变区包含seq id no:33的氨基酸序列。
[0070]
在一个实施方案中,cdr是137d1h10或其人源化对应物的cdr,如表3b和3d中所例举的。在一个实施方案中,cdrh1包含seq id no:35的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrh2包含seq id no:36的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrh3包含seq id no:37的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrl1包含seq id no:25或28的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrl2包含seq id no:26的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,并且cdrl3包含seq id no:27的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体。
[0071]
在一个实施方案中,cdrh1包含seq id no:35的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrh2包含seq id no:36的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrh3包含seq id no:37的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrl1包含seq id no:25的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,cdrl2包含seq id no:26的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体,并且cdrl3包含seq id no:27的氨基酸序列或其具有一个、两个或三个缺失、添加、取代或其组合的变体。
[0072]
在一个实施例中,cdrh1包含seq id no:35的氨基酸序列,cdrh2包含seq id no:36的氨基酸序列,cdrh3包含seq id no:37的氨基酸序列,cdrl1包含seq id no:25或28的氨基酸序列,cdrl2包含seq id no:26的氨基酸序列,cdrl3包含seq id no:27的氨基酸序列。
[0073]
在一些实施方案中,还提供了包含与137d1h10或其人源化对应物相同的cdr的那些。在一些实施方案中,所公开的抗体和片段包括与137d1h10或其人源化对应物结合相同表位的那些,以及与它们中的任何一种竞争结合ccr8的那些。
[0074]
在一些实施方案中,重链可变区包含选自由seq id no:1(小鼠或嵌合)和38-40(人源化)组成的组的氨基酸序列,或与选自由seq id no:3(小鼠或嵌合)和29-31(人源化)组成的组的氨基酸序列具有至少90%序列同一性的肽。
[0075]
在一些实施方案中,轻链可变区包含选自由seq id no:2(小鼠或嵌合)、32-34和41-43(人源化)组成的组的氨基酸序列,或与选自由seq id no(小鼠或嵌合):2、32-34和41-43(人源化)组成的组的氨基酸序列具有至少90%序列同一性的肽。
[0076]
在一些实施方案中,重链可变区包含seq id no:38的氨基酸序列,轻链可变区包含seq id no:32-34和41-43中任一种的氨基酸序列。在一些实施方案中,重链可变区包含seq id no:39的氨基酸序列,轻链可变区包含seq id no:32-34和41-43中任一种的氨基酸序列。在一些实施方案中,重链可变区包含seq id no:40的氨基酸序列,轻链可变区包含seq id no:32-34和41-43中任一种的氨基酸序列。在一些实施方案中,重链可变区包含seq id no:40的氨基酸序列,轻链可变区包含seq id no:42中任一种的氨基酸序列。
[0077]
包含这些cdr区的抗体,无论是小鼠的、人源化的还是嵌合的,都具有有效的ccr8结合和抑制活性。如实施例4所示,可以修饰cdr内的某些残基以保留或改善特性或降低其产生翻译后修饰(ptm)的可能性。此类修饰的cdr可以被称为亲和力成熟的或风险降低的cdr(例如,seq id no:25)。
[0078]
修饰的cdr可以包括具有一个、两个或三个氨基酸添加、缺失和/或取代的那些。在一些实施方案中,取代可以是保守取代。
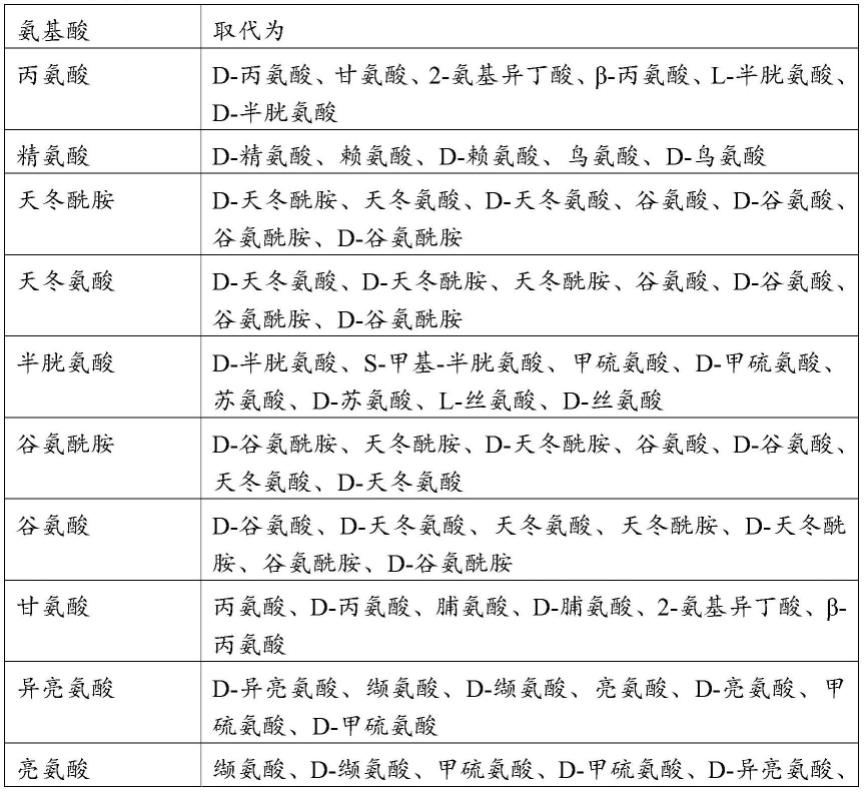
[0079]“保守氨基酸取代”是其中氨基酸残基被具有相似侧链的氨基酸残基替代的取代。具有相似侧链的氨基酸残基家族已在本领域中被定义,包括碱性侧链(例如赖氨酸、精氨酸、组氨酸)、酸性侧链(例如天冬氨酸、谷氨酸)、不带电荷的极性侧链(例如甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸)、非极性侧链(例如丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸)、β支链侧链(例如苏氨酸、缬氨酸、异亮氨酸)和芳香族侧链(例如酪氨酸、苯丙氨酸、色氨酸、组氨酸)。因此,免疫球蛋白多肽中的
非必需氨基酸残基优选被来自相同侧链家族的另一个氨基酸残基替代。在另一个实施方案中,一串氨基酸可以被侧链家族成员的顺序和/或组成不同但结构上相似的串替代。
[0080]
下表中提供了保守氨基酸取代的非限制性实例,其中相似性得分为0或更高表明两个氨基酸之间的保守取代。
[0081]
表a.氨基酸相似性矩阵
[0082] cgpsatdenqhkrvmilfyww-8-7-6-2-6-5-7-7-4-5-3-32-6-4-5-20017y0-5-5-3-3-3-4-4-2-40-4-5-2-2-1-1710 f-4-5-5-3-4-3-6-5-4-5-2-5-4-10129
ꢀꢀ
l-6-4-3-3-2-2-4-3-3-2-2-3-32426
ꢀꢀꢀ
i-2-3-2-1-10-2-2-2-2-2-2-2425
ꢀꢀꢀꢀ
m-5-3-2-2-1-1-3-20-1-20026
ꢀꢀꢀꢀꢀ
v-2-1-1-100-2-2-2-2-2-2-24
ꢀꢀꢀꢀꢀꢀ
r-4-300-2-1-1-101236
ꢀꢀꢀꢀꢀꢀꢀ
k-5-2-10-10001105
ꢀꢀꢀꢀꢀꢀꢀꢀ
h-3-20-1-1-111236
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
q-5-10-10-12214
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
n-40-1100212
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
e-50-100034
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
d-51-10004
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
t-200113
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
a-21112
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
s0111
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
p-3-16
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
g-35
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
c12
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
[0083]
表b.保守氨基酸取代
[0084][0085]
[0086]
本领域普通技术人员还将理解,本文公开的抗体可以被修饰,使得它们在氨基酸序列上与衍生它们的天然存在的结合多肽不同。例如,衍生自指定蛋白质的多肽或氨基酸序列可以与起始序列相似,例如与起始序列具有一定百分比的同一性,例如其可以为与起始序列具有60%、70%、75%、80%、85%、90%、95%、98%或99%的同一性。
[0087]
在某些实施方案中,抗体包含通常不与抗体相关的氨基酸序列或一个或多个部分。下面将更详细地描述示例性修饰。例如,本公开的抗体可以包含柔性接头序列或可以被修饰以添加功能性部分(例如,peg、药物、毒素或标记物)。
[0088]
本公开的抗体、变体或其衍生物包括被修饰的衍生物,即通过任何类型的分子与抗体的共价连接而被修饰,使得共价连接不会阻止抗体与表位结合。例如但不限于,抗体可以例如通过糖基化、乙酰化、聚乙二醇化、磷酸化、磷酸化、酰胺化、通过已知的保护/阻断基团衍生化、蛋白水解切割、与细胞配体或其他蛋白质的连接等来修饰。可以通过已知技术进行众多化学修饰中的任何一种,所述已知技术包括但不限于特异性化学切割、乙酰化、甲酰化、衣霉素的代谢合成等。另外,抗体可以包含一种或多种非经典氨基酸。
[0089]
在一些实施方案中,抗体可以与治疗剂、前药、肽、蛋白质、酶、病毒、脂质、生物反应修饰剂、药剂或peg缀合。
[0090]
抗体可以与治疗剂缀合或融合,所述治疗剂可以包括可检测的标记物(例如放射性标记物)、免疫调节剂、激素、酶、寡核苷酸、光活性治疗剂或诊断剂、细胞毒素剂(其可以是药物或毒素)、超声增强剂、非放射性标记物、其组合以及本领域已知的其它此类试剂。
[0091]
可以通过将抗体与化学发光化合物偶联,从而对抗体进行可检测地标记。然后通过检测在化学反应过程中产生的发光的存在来确定带化学发光标签的抗原结合多肽的存在。特别有用的化学发光标记化合物的实例是鲁米诺、异鲁米诺、热敏吖啶酯(theromatic acridinium ester)、咪唑、吖啶盐和草酸酯。
[0092]
还可以使用荧光发射金属(例如
152
eu或镧系元素的其他金属)可检测地标记抗体。可以使用诸如二乙烯三胺五乙酸(dtpa)或乙二胺四乙酸(edta)的金属螯合基团将这些金属连接至抗体。将不同部分缀合到抗体上的技术是众所周知的,参见,例如arnon等,“monoclonal antibodies for immunotargeting of drugs in cancer therapy”,《monoclonal antibodies and cancer therapy》,reisfeld等(编辑),第243-56页(alan r.liss公司(1985));hellstrom等,“antibodies for drug delivery”,《controlled drug delivery(第二版)》,robinson等(编辑),marcel dekker公司,第623-53页(1987);thorpe,“antibody carriers of cytotoxic agents in cancer therapy:a review”,《monoclonal antibodies'84:biological and clinical applications》,pinchera等(编辑),第475-506页(1985);“analysis,results,and future prospective of the therapeutic use of radiolabeled antibody in cancer therapy”,《monoclonal antibodies for cancer detection and therapy》,baldwin等(编辑),学术出版社,第303-16页(1985),和thorpe等“the preparation and cytotoxic properties of antibody-toxin conjugates”,immunol.rev.(52:119-58(1982))。
[0093]
双功能分子和联合疗法
[0094]
ccr8是一种趋化因子和肿瘤抗原。作为肿瘤抗原靶向分子,对ccr8具有特异性的抗体或抗原结合片段可以与对免疫细胞具有特异性的第二抗原结合片段、或对免疫检查点
具有特异性的抗原结合片段联合以产生联合疗法或双特异性抗体。
[0095]
在一些实施方案中,免疫细胞选自由t细胞、b细胞、单核细胞、巨噬细胞、中性粒细胞、树突细胞、吞噬细胞、自然杀伤细胞、嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞组成的组。免疫细胞上可以被靶向的分子包括,例如,ccl1、cd3、cd16、cd19、cd28和cd64。其他实例包括pd-1、pd-l1、ctla-4、lag-3(也称为cd223)、cd28、cd122、4-1bb(也称为cd137)、tim3、ox-40或ox40l、cd40或cd40l、light、icos/icosl、gitr/gitrl、tigit、cd27、vista、b7h3、b7h4、hevm或btla(也称为cd272)、杀伤细胞免疫球蛋白样受体(kir)和cd47。
[0096]
作为免疫检查点抑制剂,可以将对ccr8具有特异性的抗体或抗原结合片段与对肿瘤抗原具有特异性的第二抗原结合片段组合,以产生双特异性抗体。“肿瘤抗原”是在肿瘤细胞中产生的抗原性物质,即,它触发宿主中的免疫应答。肿瘤抗原可以用于鉴定肿瘤细胞,并且是用于癌症治疗的潜在候选物。体内的正常蛋白质不是抗原性的。但是,某些蛋白质是在肿瘤发生过程中产生的或过表达的,因此对人体来说是“外来的”。这可以包括与免疫系统完全隔离的正常蛋白质、正常情况下以极少量产生的蛋白质、正常情况下仅在某些发育阶段产生的蛋白质或结构因突变而被修饰的蛋白质。
[0097]
大量的肿瘤抗原在本领域中是已知的,并且可以通过筛选容易地鉴定出新的肿瘤抗原。肿瘤抗原的非限制性实例包括egfr、her2、epcam、cd20、cd30、cd33、cd47、cd52、cd133、cd73、cea、gpa33、黏蛋白、tag-72、cix、psma、叶酸结合蛋白、gd2、gd3、gm2、vegf、vegfr、整合素、αvβ3、α5β1、erbb2、erbb3、met、igf1r、epha3、trailr1、trailr2、rankl、fap和腱生蛋白(tenascin)。
[0098]
在一些方面,与相应的非肿瘤细胞相比,单价单元对在肿瘤细胞上过表达的蛋白质具有特异性。本文所用的“相应的非肿瘤细胞”是指与肿瘤细胞的来源为相同细胞类型的非肿瘤细胞。需要注意的是,此类蛋白质不一定与肿瘤抗原不同。非限制性实例包括癌胚抗原(cea),其在大多数结肠癌、直肠癌、乳腺癌、肺癌、胰腺癌和胃肠道癌中过表达;调蛋白受体(her-2、neu或c-erbb-2),其在乳腺癌、卵巢癌、结肠癌、肺癌、前列腺癌和宫颈癌中经常过表达;表皮生长因子受体(egfr),其在包括乳腺癌、头颈癌、非小细胞肺癌和前列腺癌在内的一系列实体瘤中高表达;去唾液酸糖蛋白受体;转铁蛋白受体;丝氨酸蛋白酶抑制剂酶复合物受体,其在肝细胞上表达;成纤维细胞生长因子受体(fgfr),其在胰腺导管腺癌细胞上过表达;血管内皮生长因子受体(vegfr),其用于抗血管生成基因治疗;叶酸受体,其在90%的非粘液性卵巢癌中选择性过表达;细胞表面糖萼;碳水化合物受体;和多聚免疫球蛋白受体,其可用于将基因递送至呼吸道上皮细胞,并且对诸如囊性纤维化的肺疾病的治疗具有吸引力。
[0099]
还提供了不同形式的双特异性抗体。在一些实施方案中,抗pd-l1片段和第二片段中的每一个各自独立地选自fab片段、单链可变片段(scfv)或单结构域抗体。在一些实施方案中,双特异性抗体进一步包括fc片段。
[0100]
还提供了不是仅包括抗体或抗原结合片段的双功能分子。作为肿瘤抗原靶向分子,例如本文所述的那些的对ccr8具有特异性的抗体或抗原结合片段可以任选地通过肽接头与免疫细胞因子或配体联合。连接的免疫细胞因子或配体包括但不限于il-2、il-3、il-4、il-5、il-6、il-7、il-10、il-12、il-13、il-15、gm-csf、tnf-α、cd40l、ox40l、cd27l、cd30l、4-1bbl、light和gitrl。这样的双功能分子可以将免疫检查点阻断作用与肿瘤部位
局部免疫调节相联合。
[0101]
抗体药物缀合物
[0102]
在一些实施方案中,抗体或片段可以与治疗剂、前药、肽、蛋白质、酶、病毒、脂质、生物反应修饰剂、药剂或peg缀合。
[0103]
在一个实施方案中,本公开的抗体或片段与药物部分共价连接。药物部分可以是与抗体上的缀合点反应的基团或被修饰以包括与抗体上的缀合点反应的基团。例如,药物部分可以通过烷基化(例如,在ε-氨基赖氨酸或抗体的n-末端)、氧化碳水化合物的还原胺化、羟基和羧基之间的酯交换、氨基或羧基的酰胺化以及与巯基结合来连接。
[0104]
在一些实施方案中,每个抗体分子所缀合的药物部分的数量p的范围平均为1至8;1至7、1至6、1至5、1至4、1至3或1至2。在一些实施方案中,p的范围平均为2至8、2至7、2至6、2至5、2至4或2至3。在其他实施方案中,p平均为1、2、3、4、5、6、7或8。在一些实施方案中,p的范围平均为约1至约20、约1至约10、约2至约10、约2至约9、约1至约8、约1至约7、约1至约6、约1至约5、约1至约4、约1至约3、或约1至约2。在一些实施方案中,p的范围为约2至约8、约2至约7、约2至约6、约2至约5、约2至约4或约2至约3。
[0105]
例如,当蛋白质的化学活化导致形成游离巯基时,蛋白质可以与巯基反应剂缀合。一方面,该试剂是一种对游离巯基基本上特异的试剂。此类试剂包括例如马来酰亚胺、卤代乙酰胺(例如碘代、溴代或氯代)、卤酯(例如碘代、溴代或氯代)、卤代甲基酮(例如碘代、溴代或氯代)、苄基卤化物(例如碘化物、溴化物或氯化物)、乙烯基砜和吡啶巯基。
[0106]
药物可以通过接头与抗体或片段连接。合适的接头包括,例如,可切割的和不可切割的接头。可切割接头通常在细胞内条件下易于切割。合适的可切割接头包括例如可被细胞内蛋白酶切割的肽接头,例如溶酶体蛋白酶或内体蛋白酶。在示例性实施方案中,接头可以是二肽接头,例如缬氨酸-瓜氨酸(val-cit)、苯丙氨酸-赖氨酸(phe-lys)接头或马来酰亚胺己酸-缬氨酸-瓜氨酸-对氨基苄氧羰基(maleimidocapronic-valine-citruline-p-aminobenzyloxycarbonyl,mc-val-cit-paba)接头。另一种接头是磺基琥珀酰亚胺基-4-[n-马来酰亚胺甲基]环己烷-1-羧酸酯(sulfosuccinimidyl-4-[n-maleimidomethyl]cyclohexane-1-carboxylate,smcc)。sulfo-smcc缀合通过与巯基(sulfhydryl)(thiol,-sh)反应的马来酰亚胺基团发生,而其sulfo-nhs酯对伯胺(如在赖氨酸和蛋白质或肽n-末端发现的伯胺)具有反应性。另一种接头是马来酰亚胺己酰基(mc)。其他合适的接头包括在特定ph或ph范围可水解的接头,比如腙接头。其他合适的可切割接头包括二硫键接头。接头可以与抗体共价结合,以达到抗体必须在细胞内降解以释放药物的程度,例如mc接头等。
[0107]
接头可以包括用于与抗体连接的基团。例如,接头可以包括氨基、羟基、羧基或巯基反应基团(例如,马来酰亚胺、卤代乙酰胺(例如,碘代、溴代或氯代)、卤酯(例如,碘代、溴代或氯代)、卤甲基酮(例如,碘代、溴代或氯代)、苄基卤化物(例如碘化物、溴化物或氯化物)、乙烯基砜和吡啶硫基)。
[0108]
在一些实施方案中,药物部分是细胞毒素剂或细胞生长抑制剂、免疫抑制剂、放射性同位素、毒素等。缀合物可用于抑制肿瘤细胞或癌细胞的增殖,引起肿瘤或癌细胞的凋亡,或用于治疗患者的癌症。缀合物可以相应地用于各种环境以治疗动物癌症。缀合物可以用于将药物递送至肿瘤细胞或癌细胞。不受理论束缚,在一些实施方案中,缀合物与表达密蛋白18.2的癌细胞结合或相关,并且缀合物和/或药物可以通过受体介导的内吞作用被吸
antibodies for cancer detection and therapy》,baldwin等(编辑),学术出版社,第303-16页(1985),和thorpe等“the preparation and cytotoxic properties of antibody-toxin conjugates”,immunol.rev.(52:119-58(1982))。
[0114]
编码抗体的多核苷酸及制备抗体的方法
[0115]
本公开还提供了编码本公开的抗体、其变体或衍生物的分离的多核苷酸或核酸分子。本公开的多核苷酸可以在相同多核苷酸分子上或在分别的多核苷酸分子上编码抗原结合多肽、其变体或衍生物的整个重链和轻链可变区。另外,本公开的多核苷酸可以在相同多核苷酸分子上或在分别的多核苷酸分子上编码抗原结合多肽、其变体或衍生物的重链和轻链可变区的部分。
[0116]
制备抗体的方法是本领域众所周知的并且在本文中描述。在某些实施方案中,本公开的抗原结合多肽的可变区和恒定区都是全人的。可以使用本领域描述的和如本文描述的技术制备全人抗体。例如,针对特定抗原的全人抗体可以通过向转基因动物施用所述抗原来制备,所述转基因动物已被修饰以产生这种抗体来应答抗原攻击,但其内源性基因座已被禁用。可以用于制备这种抗体的示例性技术在美国专利:6,150,584、6,458,592、6,420,140中进行了描述,其通过引用以其整体并入。
[0117]
治疗方法
[0118]
如本文所述,本公开的抗体、变体或衍生物可用于某些治疗和诊断方法。
[0119]
本公开进一步涉及基于抗体的疗法,其涉及将本公开的抗体施用于患者比如动物、哺乳动物和人以治疗本文所述的一种或多种紊乱或病症。本公开的治疗性化合物包括但不限于本公开的抗体(包括如本文所述的其变体和衍生物)和编码本公开的抗体(包括如本文所述的其变体和衍生物)的核酸或多核苷酸。
[0120]
本公开的抗体还可用于治疗或抑制癌症。在一些实施方案中,患者中的癌细胞表达或过表达ccr8。如上所述,ccr8可以在肿瘤细胞中过表达,特别是在胃、胰腺、食管、卵巢和肺的肿瘤中。抑制ccr8被证明可用于治疗肿瘤。
[0121]
因此,在一些实施方案中,提供了用于治疗有需要的患者的癌症的方法。在一个实施方案中,该方法需要向患者施用有效量的本公开的抗体。在一些实施方案中,患者中的至少一种癌细胞(例如,基质细胞)过表达ccr8。
[0122]
在本公开中还提供了细胞疗法,例如嵌合抗原受体(car)t细胞疗法。可以使用合适的细胞,其与本公开的抗ccr8抗体接触(或替代地被工程改造以表达本公开的抗ccr8抗体)。在一些实施方案中,抗体以嵌合抗原受体(car)存在。经过这样的接触或工程改造后,然后可以将细胞引入需要治疗的癌症患者中。癌症患者可以患有如本文公开的任何类型的癌症。细胞(例如,t细胞)可以是,例如,肿瘤浸润性t淋巴细胞、cd4 t细胞、cd8 t细胞或其组合,但不限于此。
[0123]
在一些实施方案中,该细胞是从癌症患者自身分离的。在一些实施方案中,该细胞由供体或细胞库提供。当从癌症患者中分离出细胞时,不期望的免疫反应可以被最小化。
[0124]
癌症的非限制性实例包括膀胱癌、乳腺癌、结肠直肠癌、子宫内膜癌、食道癌、头颈癌、肾癌、白血病、肝癌、肺癌、淋巴瘤、黑色素瘤、胰腺癌、前列腺癌和甲状腺癌。在一些实施方案中,癌症是胃癌、胰腺癌、食道癌、卵巢癌和肺癌中的一种或多种。
[0125]
可以用本公开的抗体或其变体或衍生物治疗、预防、诊断和/或预后的、与细胞存
活增加有关的其他疾病或病症包括但不限于:恶性肿瘤以及相关紊乱的进展和/或转移,恶性肿瘤以及相关紊乱比如为白血病(包括急性白血病(例如,急性淋巴细胞白血病、急性髓性白血病(包括髓母细胞性、早幼粒细胞性、髓单核细胞性、单核细胞性和红细胞性白血病))和慢性白血病(例如,慢性髓性(粒细胞性白血病和慢性淋巴细胞性白血病))、真性红细胞增多症、淋巴瘤(例如霍奇金氏病和非霍奇金氏病)、多发性骨髓瘤、华氏巨球蛋白血症、重链病和实体瘤,实体瘤包括但不限于肉瘤和癌,例如纤维肉瘤、粘液肉瘤、脂肪肉瘤、软骨肉瘤、成骨肉瘤、脊索瘤、血管肉瘤、内皮肉瘤、淋巴管肉瘤、淋巴管内皮肉瘤、滑膜瘤、间皮瘤、尤因氏肿瘤、平滑肌肉瘤、横纹肌肉瘤、结肠癌、胰腺癌、乳腺癌、卵巢癌、前列腺癌、鳞状细胞癌、基底细胞癌、腺癌、汗腺癌、皮脂腺癌、乳头状癌、乳头状腺癌、囊腺癌、髓样癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒毛膜癌、精原细胞瘤、胚胎性癌、威尔姆氏肿瘤(wilm's tumor)、宫颈癌、睾丸肿瘤、肺癌、小细胞肺癌、膀胱癌、上皮癌、神经胶质瘤、星形细胞瘤、髓母细胞瘤、颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突胶质细胞瘤、脑膜瘤(menangioma)、黑色素瘤、神经母细胞瘤和视网膜母细胞瘤。
[0126]
用于任何特定患者的具体剂量和治疗方案将取决于多种因素,包括所使用的特定抗体、其变体或衍生物、患者的年龄、体重、总体健康状况、性别、饮食、以及给药时间、排泄率、联合用药和正在治疗的特定疾病的严重程度。医疗护理人员对这些因素的判断在本领域普通技术范围内。该量还将取决于待治疗的个体患者、给药途径、制剂类型、所用化合物的特性、疾病的严重程度和所需的效果。所使用的量可以通过本领域众所周知的药理学和药代动力学原理确定。
[0127]
抗体或变体的施用方法包括但不限于皮内、肌内、腹膜内、静脉内、皮下、鼻内、硬膜外和口服途径。抗原结合多肽或组合物可以通过任何方便的途径施用,例如通过输注或团注,通过经上皮或粘膜皮肤内层(例如口腔粘膜、直肠和肠粘膜等)吸收,并且可以与其他生物活性剂一起施用。因此,含有本公开的抗原结合多肽的药物组合物可以口服、直肠、肠胃外、脑池内、阴道内、腹膜内、局部(如通过粉剂、软膏、滴剂或透皮贴剂)、口腔给药,或作为口腔或鼻腔喷雾剂。
[0128]
如本文所用的术语“肠胃外”是指施用方式,包括静脉内、肌内、腹膜内、胸骨内、皮下和关节内注射和输注。
[0129]
给药可以是全身的或局部的。此外,可能需要通过任何合适的途径(包括脑室内和鞘内注射)将本公开的抗体引入中枢神经系统;脑室内注射可以通过脑室内导管来促进,例如,连接到储液器(比如ommaya储液器)的脑室内导管。也可以采用肺部给药,例如,通过使用吸入器或雾化器,以及与雾化剂一起配制。
[0130]
可能需要将本公开的抗原结合多肽或组合物局部施用于需要治疗的区域;这可以通过例如但不限于手术期间局部输注、局部应用(例如手术后与伤口敷料结合)、通过注射、通过导管、通过栓剂或通过植入物来实现,所述植入物是多孔、无孔或凝胶状材料,包括膜,例如唾液酸膜或纤维。优选地,当施用本公开的蛋白质(包括抗体)时,必须注意使用不吸收该蛋白质的材料。
[0131]
可以通过标准临床技术确定可有效治疗、抑制和预防炎性、免疫或恶性疾病、紊乱或病症的本公开抗体的量。另外,可以任选地采用体外分析来帮助确定最佳剂量范围。制剂中采用的精确剂量还取决于给药途径和疾病、紊乱或病症的严重性,并且应根据从业者的
判断和每个患者的情况来决定。有效剂量可以从来自体外或动物模型测试系统的剂量反应曲线中推断出来。
[0132]
作为一般建议,施用于患者的本公开的抗原结合多肽的剂量通常为0.1mg/kg至100mg/kg患者体重,0.1mg/kg至20mg/kg患者体重,或1mg/kg至10mg/kg患者体重。通常,由于对外源多肽的免疫反应,人抗体比来自其他物种的抗体在人体内具有更长的半衰期。因此,较低剂量的人抗体和较低频率的给药通常是可能的。进一步地,本公开抗体的给药剂量和频率可以通过修饰例如脂化以增强抗体的吸收和组织渗透(例如,进入脑中)来降低。
[0133]
在另外的实施方案中,本公开的组合物与细胞因子联合施用。可以与本公开的组合物一起施用的细胞因子包括但不限于il-2、il-3、il-4、il-5、il-6、il-7、il-10、il-12、il-13、il-15、抗cd40、cd40l和tnf-α。
[0134]
在另外的实施方案中,本公开的组合物与其他治疗或预防方案(例如放射疗法)联合施用。
[0135]
诊断方法
[0136]
在某些肿瘤样品中观察到ccr8的过表达,并且具有ccr8过表达细胞的患者可能对用本公开的抗ccr8抗体的治疗有反应。因此,本公开的抗体也可以用于诊断和预后目的。
[0137]
可从患者获得优选包括细胞的样品,该患者可以是癌症患者或需要诊断的患者。该细胞是肿瘤组织或肿瘤块、血液样品、尿液样品或来自患者的任何样品的细胞。在对样品进行任选的预处理之后,可以在允许抗体与样品中可能存在的ccr8蛋白相互作用的条件下,将样品与本公开的抗体一起孵育。可以使用诸如elisa的方法,利用抗ccr8抗体,来检测样品中ccr8蛋白的存在。
[0138]
样品中ccr8蛋白的存在(任选以一定的量或浓度存在)可以用于诊断癌症,作为患者适合用抗体治疗的指示,或作为患者对癌症治疗有(或没有)反应的指示。对于预后方法,可以在开始癌症治疗后,在某个阶段进行一次、两次或多次检测,以指示治疗进展。
[0139]
组合物
[0140]
本公开还提供了药物组合物。这样的组合物包含有效量的抗体和可接受的载体。在一些实施方案中,该组合物进一步包括第二抗癌剂(例如,免疫检查点抑制剂)。
[0141]
在一个具体的实施方案中,术语“药学上可接受的”是指由联邦或州政府的监管机构批准或在美国药典或其他公认的药典中列出的用于动物的,更特别地是人类的。进一步地,“药学上可接受的载体”通常将是任何类型的无毒固体、半固体或液体填充剂、稀释剂、封装材料或制剂助剂。
[0142]
术语“载体”是指与治疗剂一起施用的稀释剂、辅助剂、辅料或赋形剂。这样的药物载体可以是无菌液体,比如水和油,包括石油、动物、植物或合成来源的那些,例如花生油、大豆油、矿物油、芝麻油等。当药物组合物静脉内给药时,水是优选的载体。盐溶液以及葡萄糖水溶液和甘油溶液也可以用作液体载体,特别是用于注射溶液。合适的药物辅料包括淀粉、葡萄糖、乳糖、蔗糖、明胶、麦芽、大米、面粉、白垩、硅胶、硬脂酸钠、单硬脂酸甘油酯、滑石、氯化钠、脱脂奶粉、甘油、丙烯、乙二醇、水、乙醇等。如果需要,该组合物还可以含有少量的湿润剂或乳化剂,或ph缓冲剂,比如乙酸盐、柠檬酸盐或磷酸盐。还设想了抗菌剂,比如苯甲醇或对羟基苯甲酸甲酯;抗氧化剂,比如抗坏血酸或亚硫酸氢钠;螯合剂,比如乙二胺四乙酸;以及用于调节张度(tonicity)的试剂,比如氯化钠或右旋糖(dextrose)。这些组合物
可以采取溶液、悬浮液、乳剂、片剂、丸剂、胶囊、粉剂、缓释制剂等形式。该组合物可以与传统的粘合剂和载体(例如甘油三酯)一起配制成栓剂。口服制剂可以包括标准载体,比如药用级的甘露醇、乳糖、淀粉、硬脂酸镁、糖精钠、纤维素、碳酸镁等。合适的药物载体的实例在e.w.martin的《remington'spharmaceutical sciences》中有描述,其通过引用并入本文。这样的组合物将包含治疗有效量的抗原结合多肽,优选地以纯化形式,以及适量的载体,以提供用于向患者适当施用的形式。该制剂应适合于给药方式。可以将肠胃外制剂封装在玻璃或塑料制成的安瓿、一次性注射器或多剂量小瓶中。
[0143]
在一个实施方案中,根据常规程序将所述组合物配制成适于静脉内施用于人类的药物组合物。通常,用于静脉内给药的组合物是在无菌等渗水性缓冲液中的溶液。必要时,该组合物还可以包括增溶剂和局部麻醉剂,比如利多卡因,以减轻注射部位的疼痛。通常,将成分以单位剂型单独提供或混合提供,例如,作为干燥的冻干粉或无水浓缩物提供在密闭容器中,比如指示活性剂的量的安瓿或小药囊中。在组合物将通过输注施用的情况下,可以用装有无菌药用级水或盐水的输液瓶分配。在组合物通过注射施用的情况下,可以提供一安瓿的无菌注射用水或盐水,以使得可以在施用之前将成分混合。
[0144]
本公开的化合物可以被配制成中性或盐形式。药学上可接受的盐包括那些与阴离子形成的盐,例如那些衍生自盐酸、磷酸、乙酸、草酸、酒石酸等的盐,以及那些与阳离子形成的盐,例如衍生自钠、钾、铵、钙、铁氢氧化物、异丙胺、三乙胺、2-乙基氨基乙醇、组氨酸、普鲁卡因等的盐。
[0145]
实施例
[0146]
实施例1:针对人ccr8的鼠类单克隆抗体的产生
[0147]
用人ccr8蛋白免疫不同品系的小鼠,并相应产生杂交瘤。选择ccr8阳性结合子并亚克隆。随后,进行体外结合和功能筛选,并鉴定具有最高结合亲和力和最强功能效力的先导抗体。
[0148]
下表提供了先导鼠类抗体的vh/vl序列。
[0149]
表1.先导鼠类抗体的vh/vl序列
[0150]
[0151]
[0152][0153]
实施例2.与u2os细胞上的ccr8结合
[0154]
本实施例测试了抗体与u2os细胞上表达的人ccr8蛋白结合的活性。
[0155]
一些上述鉴定的鼠类抗体的嵌合抗体(与人igg1恒定区融合)由cdna表达。将抗体与表达人ccr8的u2os细胞一起孵育。在测试的抗体中,88d2c6和137d1h10以剂量依赖性方式表现出比其他抗体高得多的亲和力(图1)。
[0156]
实施例3.adcc测定
[0157]
用过表达ccr8的cho k1和u2os细胞测定88d2c6和137d1h10以及370d2c10(均与人igg1恒定区融合,在fc中具有adcc激活突变)在介导adcc中的效力。所有三种抗体都表现出高adcc活性(图2)。
[0158]
所有三种抗体都表现出有效的adcc活性。然而,其中,88d2c6具有相当高的效力(对cho细胞的ec50为0.01743nm和对u2os细胞的ec50为0.1108)。
[0159]
实施例4.小鼠mab的人源化
[0160]
88d2c6和352h11c11的鼠类抗体可变区基因被用于创建人源化mab。将mab的vh和vl的氨基酸序列与人类ig基因序列的可用数据库进行比较,以找到总体最佳匹配的人类种系ig基因序列。然后将鼠类抗体的cdr移植到匹配的人类序列中。合成cdna并用于生产人源化抗体。然后将来自鼠类抗体的某些回复突变引入回人源化抗体。某些氨基酸被突变以减少翻译后修饰的机会。
[0161]
下面提供了人源化抗体的氨基酸序列。
[0162]
人源化序列
[0163]
a.88d2c6
[0164]
表2a.88d2c6的人源化
–
vh
[0165]
[0166][0167]
表2b.cdr序列
[0168]
cdr序列seq id no:cdr-h1pnamn22cdr-h2rirsksnnyatyyadsvkd23cdr-h3gkddgyrhyamdy24
[0169]
表2c.88d2c6的人源化
–
vl
[0170][0171]
表2d.cdr序列
[0172][0173]
表2e.人源化抗体
[0174] vlvl v1vl v2vl v3vh88-xi
ꢀꢀꢀ
vh v1
ꢀꢀ
88-h1l288-h1l3vh v2
ꢀꢀ
88-h2l288-h2l3vh v3
ꢀꢀ
88-h3l288-h2l3
[0175]
b.137d1h10
[0176]
表3a.137d1h10的人源化
–
vh
[0177][0178]
表3b.cdr序列
[0179]
cdr序列seq id no:cdr-h1tyamn35cdr-h2rirskannyatyyadsvkd36cdr-h3drsrgedyamdy37
[0180]
表3c.137d1h10的人源化
–
vl
[0181][0182]
表3d.cdr序列
[0183][0184]
表3e.人源化抗体
[0185] vlvl v1vl v2vl v3vh137-xi
ꢀꢀꢀ
vh v1
ꢀꢀꢀꢀ
vh v2
ꢀꢀ
137-h2l2137-h2l3
vh v3
ꢀꢀ
137-h3l2137-h3l3
[0186]
实施例5.人源化抗体测试
[0187]
本实施例测试了一些人源化抗体对ccr8的结合亲和力及其诱导adcc的能力。
[0188]
实验程序类似于实施例2-3。图3显示了88d2c6的人源化抗体的亲和力。显然,它们都有高的亲和力(还参见表4)。
[0189]
表4a.与cho-k1细胞表达的ccr8的结合
[0190] 88-h1l288-h1l388-h2l288-h2l388-h3l288-h3l388-xi基线响应2669214324942276393734743631最大响应32782319473283031610324953221433947logec50-0.7515-0.5189-0.6391-0.5461-0.6861-0.5826-0.6548曲线坡度1.5021.3771.4041.4081.3821.3451.480ec500.17720.30280.22960.28440.20600.26150.2214跨度30113298043033629334285572874030316
[0191]
表4b.与u2os细胞表达的ccr8的结合
[0192] 88-h1l288-h1l388-h2l288-h2l388-h3l288-h3l388-xi基线响应2106154227561530282616231027最大响应28891276352832925780274352742129659logec50-0.6779-0.5797-0.7241-0.5119-0.6841-0.6289-0.6921曲线坡度1.4091.3871.5241.4501.5211.3781.097ec500.20990.26320.18880.30770.20700.23500.2032跨度26785260922557424250246092579828632
[0193]
图4显示了137d1h10的人源化抗体的亲和力(数据见表5)。
[0194]
表5a.与cho-k1细胞表达的ccr8的结合
[0195] 137-h2l2137-h2l3137-h3l2137-h3l3137-xi基线响应25482244426438203032最大响应2934730182331983338934947logec50-0.7893-0.5055-0.6843-0.7538-0.7792曲线坡度1.1411.2721.5921.4491.581ec500.16250.31230.20690.17630.1663跨度2679927937289342956931915
[0196]
表5b.与u2os细胞表达的ccr8的结合
[0197] 137-h2l2137-h2l3137-h3l2137-h3l3137-xi基线响应915.41322206520982172最大响应2625127254322573192733430logec50-0.8422-0.4841-0.6897-0.7169-0.6052曲线坡度1.1711.1221.3511.4921.422ec500.14380.32800.20430.19190.2482跨度2533625932301922982931258
[0198]
就adcc(图5)而言,令人惊讶的是,所有人源化抗体都表现出比嵌合对应物更高(约5至10倍)的adcc诱导活性。
[0199]
实施例6.基于细胞的抗体结合
[0200]
本实施例将137-h3l2(lm-108)与参考抗体在基于细胞的结合方面进行了比较。
[0201]
使用流式细胞术评估了lm-108和参考抗体(根据wo2020138489合成)对过表达人ccr8的细胞(hek293/h_ccr8)的基于细胞的结合。将过表达人ccr8的hek293(hek293/h_ccr8)和亲本hek293细胞与滴定的lm-108、参考抗体及其同种型对照(从200nm,4倍稀释,12个点)在4℃下孵育60分钟。细胞用facs缓冲液洗涤两次,然后用荧光缀合的第二抗体(alexa647羊抗人igg,jackson,109-605-098)在4℃下染色60分钟。细胞洗涤两次后,通过流式细胞术进行分析。
[0202]
lm-108和参考抗体均以剂量依赖性方式有效结合hek293/h_ccr8细胞,ec50分别为1.03nm和0.99nm(图6a和表6a)。对于lm-108没有观察到非特异性结合,但参考抗体对亲本hek293细胞显示出轻微的非特异性结合(图6b和表6b)。
[0203]
表6a.与表达ccr8的hek293细胞的结合
[0204]
抗体ec50(nm)最大值(mfi)lm-1081.02876795参考抗体0.993886817同种型不适用192
[0205]
表6b.与不表达ccr8的hek293细胞的结合
[0206]
抗体ec50(nm)最大值(mfi)lm-108不适用108参考抗体不适用472同种型不适用145
[0207]
使用流式细胞术评估了lm-108对具有高水平ccr8表达的细胞的基于细胞的结合。所使用的细胞是u2os(u2os/h_ccr8)。如图7和表7所示,lm-108能够以剂量依赖的方式有效结合u2os/h_ccr8细胞,其中ec50为0.25nm。
[0208]
表7.与高表达ccr8的u2os细胞的结合
[0209]
抗体ec50(nm)最大值(mfi)lm-1080.250343087同种型不适用215
[0210]
还使用流式细胞术评估了lm-108对具有低水平ccr8表达的细胞的基于细胞的结合。所使用的细胞为jurkat工程改造细胞(jurkat/h_ccr8)。如图8和表8所示,lm-108能够以剂量依赖的方式有效结合jurkat/h_ccr8细胞,其中ec50为0.21nm。
[0211]
表8.与低表达ccr8的jurkat细胞的结合
[0212]
抗体ec50(nm)最大值(mfi)lm-1080.21241423同种型不适用134
[0213]
实施例7.adcc报告基因分析
[0214]
本实施例显示了靶向不同表达ccr8的细胞的adcc报告基因分析的结果。
[0215]
靶向u2os/h_ccr8的adcc报告基因分析
[0216]
lm-108的adcc活性是用报告基因分析评价的,表达cd16a(158v)的jurkat/nfat-luc报告细胞作为效应细胞。过表达人ccr8的u2os细胞用作靶细胞。u2os/h_ccr8细胞以每孔1e4细胞的密度种植在96孔板中过夜,然后与每孔1.5
×
105个效应细胞共培养,滴定的lm-108和同种型对照至终浓度从10μg/ml,5倍稀释,10个点。37℃孵育6小时后,加入one-glo(promega)进行发光检测。
[0217]
结果如图9所示。用jurkat/cd16a/nfat-luc报告细胞靶向u2os/h_ccr8细胞,lm-108表现出有效的adcc效应(ec50=0.00605nm)。
[0218]
靶向jurkat/h_ccr8的adcc报告基因分析
[0219]
lm-108的adcc活性通过报告基因分析评价,用表达cd16a(158v)的jurkat/nfat-luc报告细胞作为效应细胞。产生低表达人ccr8的jurkat细胞作为靶细胞以模拟肿瘤相关treg的表达水平。
[0220]
效应细胞(jurkat报告细胞)和靶细胞(jurkat/h_ccr8)以3:1的比例与滴定的lm-108和同种型对照(终浓度从200nm,5倍稀释,11个点)混合。37℃孵育6小时后,加入one-glo(promega)进行发光检测。如图10所示,lm-108具有剂量依赖性adcc效应,ec
50
=0.14nm。
[0221]
lm-108对过表达人ccr8的hek293(hek293/h_ccr8)和hek293细胞与原代人pbmc的adcc作用
[0222]
效应细胞(hpbmc)和靶细胞(hek293/h_ccr8或hek293)以50:1的比例与滴定的lm-108和同种型对照(最终浓度从10nm,7倍稀释,12个点)混合。在37℃下孵育6小时后,通过细胞毒性检测试剂盒(roche,04744934001)分析每孔中的50μl上清液。
[0223]
如图11a所示,lm-108以剂量依赖性方式对表达ccr8的hek293细胞表现出特异性和强的adcc效应,ec
50
为0.002nm(图6a)。对亲本hek293细胞未观察到非特异性杀伤(图11b)。
[0224]
实施例8.抗体依赖性细胞吞噬作用(adcp)的测试
[0225]
在该实施例中,lm-108对过表达人ccr8的cho-k1细胞的抗体依赖性细胞吞噬作用(adcp)是通过facs用单核细胞衍生的巨噬细胞(mdm)评价的。
[0226]
在100ng/ml人m-csf存在下,从分离自人pbmc的单核细胞诱导效应细胞mdm,持续7天。靶细胞是cho-k1(阴性对照)和过表达人ccr8的cho-k1细胞,其标记cfse。将效应细胞、cfse标记的靶细胞和滴定的测试抗体lm-108或其同种型对照在37℃、5%co2的培养箱中孵育2小时。细胞用facs缓冲液(1
×
dpbs 2%fbs)洗涤,然后用apc缀合的人cd14抗体染色以鉴定巨噬细胞。用facs缓冲液洗涤两次后,通过流式细胞术分析样品。吞噬指数确定为cd14-apc /cfse 双阳性细胞占总cd14 阳性细胞的百分比。
[0227]
如图12a-b所示,lm-108对过表达人ccr8的cho-k1细胞具有特异性和剂量依赖性吞噬作用,但对对照细胞没有。
[0228]
lm-108与单核细胞衍生的巨噬细胞(mdm)的adcp也由operetta测定。在100ng/ml人m-csf存在下,从分离自人pbmc的单核细胞诱导效应细胞mdm,持续6天。然后将效应细胞以2
×
104计数/孔接种到具有透明底部的黑色96孔板中,并继续培养2天以进行粘附。靶细胞为jurkat(阴性对照)和过表达人ccr8的jurkat细胞(jurkat/h_ccr8)。将cfse标记的靶
细胞和测试抗体lm-108或其同种型对照加入含有巨噬细胞的平板中,并在37℃、5%co2培养箱中孵育2小时。效应细胞:靶细胞比例为1:2。洗涤细胞并用apc缀合的人cd14抗体染色以鉴定巨噬细胞。洗涤两次后,用4%多聚甲醛(pfa)稀释液固定细胞,并在通过operetta拍照前在4℃冰箱中避光保存。
[0229]
如图13所示,lm-108对过表达人ccr8的jurkat细胞诱导adcp,而其同种型对照则没有。lm-108和同种型对照均未对jurkat细胞诱导明显的吞噬作用。
[0230]
实施例9.体内功效
[0231]
在该实施例中,进行了lm-108或其小鼠替代物的体内功效研究。
[0232]
第一个实验是用lm-108m(lm-108的替代抗体(surrogate antibody))在ct26同基因模型上进行的。在本研究中,每只小鼠在右侧腋窝(外侧)皮下接种0.1ml pbs中的ct26肿瘤细胞(5
×
105)用于肿瘤发展。在细胞接种后的第三天将动物随机分为4组(n=7),然后开始治疗。pbs组作为赋形剂,lm-108m和mpd-1抗体以10mg/kg的剂量在第0天、第3天、第7天、第10天、第14天和第17天通过腹腔(i.p.)作为单一药剂给药或联合给药。由于对照组的平均肿瘤体积超过2000mm3,实验在第18天终止。
[0233]
使用卡尺在二维方向上每周测量肿瘤大小三次,并使用以下公式表示体积(以mm3计):v=0.5a
×
b2其中a和b分别是肿瘤的长径和短径。然后将肿瘤大小用于计算t/c(%)值。t/c(%)使用以下公式计算:t/c%=(t
i-t0)/(v
i-v0)
×
100,ti为治疗组在规定日的平均肿瘤体积,t0为治疗组在治疗第一天的平均肿瘤体积,vi是赋形剂对照组在与ti同一天的平均肿瘤体积,v0是赋形剂组在治疗第一天的平均肿瘤体积。使用以下公式计算每组的tgi:tgi(%)=[100-t/c]。
[0234]
图14显示了ct26荷瘤balb/c小鼠在施用lm-108m和抗mpd-1ab后的肿瘤生长曲线。lm-108m作为单一药剂或与mpd-1抗体联合显示出强的抗肿瘤活性(表9)。数据点代表组(n=7)平均值,误差条代表平均值的标准误差(sem)。与使用pbs的赋形剂对照相比,通过t-检验基于肿瘤大小计算p值。
[0235]
表9.体内功效(ct26同基因模型)
[0236][0237][0238][0239]
第二个实验使用从biocytogen购买的人ccr8 ki小鼠。每只hccr8 ki小鼠在右侧腋窝(外侧)皮下接种在0.1ml pbs中的mc38肿瘤细胞(1
×
106)用于肿瘤发展。在细胞接种
后的第三天将动物随机分组,然后开始治疗以进行功效研究。在第0天、第3天、第7天、第10天通过腹腔(i.p.)施用10mg/kg剂量的lm-108。当对照组的平均肿瘤体积超过2000mm3时终止实验。
[0240]
使用卡尺在二维方向上每周测量肿瘤大小三次,并使用以下公式表示体积(以mm3计):v=0.5a
×
b2,其中a和b分别是肿瘤的长径和短径。然后将肿瘤大小用于计算t/c(%)值。t/c(%)使用以下公式计算:t/c%=(t
i-t0)/(v
i-v0)
×
100,ti为治疗组在规定日的平均肿瘤体积,t0为治疗组在治疗第一天的平均肿瘤体积,vi是赋形剂对照组在与ti同一天的平均肿瘤体积,v0是赋形剂组在治疗第一天的平均肿瘤体积。使用以下公式计算每组的tgi:tgi(%)=[100-t/c]。数据点代表组(n=8)平均值,误差条代表平均值的标准误差(sem)。与赋形剂对照相比,通过t-检验基于肿瘤大小计算p值。
[0241]
图15显示了mc38荷瘤小鼠在施用lm-108后的肿瘤生长曲线,数据汇总于表10中。lm-108显示出有效的肿瘤抑制效果。
[0242]
表10.体内功效(mc38同基因模型)
[0243][0244][0245][0246]
实施例10.细胞毒性评估
[0247]
本实施例评价了抗体-药物缀合物lm-108-vc-mmae(单甲基奥瑞他汀e)对表达人ccr8的hek293细胞的细胞毒性。
[0248]
为了评价lm-108是否可用于adc开发,通过共培养表达人ccr8的hek293细胞和lm-108-vc-mmae的滴定adc来评价mmae缀合的lm-108的细胞毒性。
[0249]
hek293/h_ccr8细胞以每孔1.5
×
104个细胞的密度种植在96孔板中过夜,然后与滴定的lm-108-vc-mmae共培养,至终浓度从100nm,3倍稀释,9个点。在37℃下孵育96小时后,加入cell-titer-glo(promega)进行细胞活力评价。
[0250]
如图16所示,mmae缀合的lm-108对表达人ccr8的hek293细胞具有有效的细胞毒性(ic50=0.5285nm)。
[0251]
***
[0252]
本公开的范围不受所描述的具体实施方案的限制,所述具体实施方案旨在作为本公开的个别方面的单一说明,并且任何在功能上等效的组合物或方法均在本公开的范围内。对本领域技术人员明显的是,在不脱离本公开的精神或范围的情况下,可以对本公开的方法和组合物进行各种修改和变化。因此,本公开旨在覆盖本公开的修改和变化,只要这些
修改和变化落入所附权利要求及其等效物的范围内。
[0253]
本说明书中提及的所有出版物和专利申请均以引用方式并入本文,其程度就如同每个单独的出版物或专利申请被特别地和单独地指示为以引用方式并入一样。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。