用于核酸分析和定量的方法和系统
本技术是申请日为2017年11月16日、申请号为201780083776.6、发明名称为“用于核酸分析和定量的方法和系统”的中国专利申请(其对应pct申请的申请日为2017年11月16日、申请号为pct/us2017/062078)的分案申请。交叉引用
1.本技术要求于2016年11月17日提交的美国临时专利申请序列号62/423,601的权益,该申请通过引用整体并入本文。
背景技术:
2.微流体装置是含有小规模处理流体的结构的装置。通常,微流体装置以亚毫米级操作并处理微升、纳升或更少量的流体。在微流体装置中,主要的污染机制是微结构内残存的空气或气泡。当使用热塑性材料来产生微流体结构时,这可能特别成问题,因为热塑性塑料的透气性非常低。
3.为了避免残存空气的污染,先前的微流体结构使用具有热塑性材料的简单直通道或分支通道设计,或者使用高透气性材料如弹性体来制造装置。然而,简单的设计限制了微流体装置可能的功能,并且弹性体材料的制造困难且昂贵,特别是在大规模时。
4.微流体结构的一个应用是数字聚合酶链反应(dpcr)。dpcr将核酸样品稀释到提供许多分区阵列的微流体结构的每个分区中有一个或更少核酸模板,并在整个阵列上执行pcr反应。通过计数模板被成功pcr扩增的分区并将泊松统计应用于结果来定量靶核酸。与流行的通过将未知样品的pcr扩增率与一组已知qpcr标准物的pcr扩增率进行比较来定量模板的定量实时pcr(qpcr)不同,dpcr已被证明具有更高的灵敏度、更高的精确度和更好的再现性。
5.对于基因组研究人员和临床医生而言,dpcr在稀有突变检测、拷贝数变体定量和下一代测序文库定量中特别有用。在无细胞dna液体活检和病毒载量定量的临床环境中的潜在用途进一步增加了dpcr技术的价值。现有的dpcr解决方案已经使用了弹性体阀阵列、硅通孔方法和液滴在油中的微流体包封。尽管可用的dpcr平台数目越来越多,但与依赖于计数pcr扩增循环数的旧qpcr技术相比,dpcr一直处于劣势。通量、易用性、表现和成本的组合是dpcr在市场上获得采用的主要障碍。
技术实现要素:
6.本文提供了可用于扩增和定量核酸以及检测靶标(例如,实际的或怀疑的靶标)例如病原体(例如,细菌)的存在或不存在的方法和系统。本公开内容提供了可通过使用数字聚合酶链反应(dpcr)实现样品制备、样品扩增和样品分析的方法、系统和装置。与其他系统和方法相比,这可使核酸能够以降低的成本和复杂性被扩增和定量。
7.本公开内容的方法和系统可采用高分辨率熔解(hrm)分析来检测核酸(例如,脱氧核糖核酸,dna)序列变体。本公开内容的hrm方法可产生具有单核苷酸分辨率的序列依赖性熔解曲线,所有这些通过与核酸扩增如聚合酶链反应(pcr)的无缝整合而完成,在一些情况
下没有任何后扩增处理步骤。与宽范围pcr结合,本公开内容的hrm方法和系统可极大地扩展可鉴别的序列变体的广度。
8.本文认识到与目前可获得的熔解曲线方法相关的各种限制。常规的批量pcr/hrm分析设计可能在解决遗传和表观遗传分析中的几个关键需求方面受到限制。一个关键限制是由于pcr抑制剂的干扰或过量的背景人dna而导致的灵敏度不足。另一个关键限制是其无法剖析异质群体中的多种序列变体并准确地定量每种变体。
9.本文认识到需要确定稀有等位基因变体的绝对量和相对等位基因比率。在感染性疾病中,精确检测和鉴别微小病原体载量,以及定量分辨混合微生物群体以区分感染与定居或者或污染,进一步强调了定量区分样品中共同存在的变体的重要性。
10.本公开内容提供了将数字pcr(dpcr)中的绝对定量与hrm分析相整合的数字hrm分析平台。这可在单分子水平下并且以高通量方式提供深度分析。
11.在一个方面,本公开内容提供了用于分析多个核酸分子的方法,包括提供包含多个分区的装置,其中所述多个分区的至少一子集包含所述多个核酸分子,其中所述多个分区的至少一子集的每个分区被配置成允许气体通过至少一个屏障从所述多个分区的至少一子集流向所述多个分区的至少一子集的外部的环境,所述屏障将所述多个分区的至少一子集与所述外部环境分隔开;当使所述多个分区的至少一子集经受受控加热时,从所述多个分区的至少一子集收集信号;以及处理所述收集的信号,以产生指示所述多个分区的至少一子集中的所述多个核酸分子的至少一子集的熔点的数据。
12.在一些实施方案中,所述方法进一步包括在提供所述包含多个核酸分子的装置之前,在足以产生所述多个核酸分子作为核酸样品的扩增产物的条件下对所述核酸样品进行核酸扩增反应。在一些实施方案中,所述方法进一步包括在进行所述核酸扩增反应之前,将所述核酸样品装载到所述多个分区的至少一子集中。在一些实施方案中,所述核酸扩增反应在所述多个分区的至少一子集中进行。在一些实施方案中,对所述核酸样品进行核酸扩增反应包括扩增所述核酸样品的核酸分子的至少一子集的内部转录间隔区的至少一部分。在一些实施方案中,核酸扩增反应使用选自引物、脱氧核糖核苷酸、缓冲液、辅因子、嵌入染料(intercalating dye)和聚合酶的一种或多种试剂。在一些实施方案中,所述一种或多种试剂包括荧光团或荧光标记。在一些实施方案中,所述方法进一步包括在对所述核酸样品进行核酸扩增反应之前,使所述核酸样品的核酸分子的至少一子集与嵌入染料接触。
13.在一些实施方案中,在使所述多个分区的至少一子集经受受控加热的同时从所述多个分区的至少一子集收集信号在多个时间点执行。
14.在一些实施方案中,在使所述多个分区的至少一子集经受受控加热时的同时从所述多个分区的至少一子集中收集信号包括对所述多个分区的至少一子集进行成像以收集所述信号。
15.在一些实施方案中,处理所述收集的信号包括使用所述信号生成所述多个分区的至少一子集中的多个核酸分子的子集的信号相对温度数据(signal versus temperature data)。
16.在一些实施方案中,所述多个核酸分子衍生自含有或疑似含有病原体的样品。在一些实施方案中,所述病原体是至少一种细菌。在一些实施方案中,所述至少一种细菌选自炭疽芽孢杆菌(bacillus anthracis)、蜡状芽孢杆菌(bacillus cereus)、耐盐芽孢杆菌
(bacillus halodurans)、蕈状芽孢杆菌(bacillus mycoides)、多粘芽孢杆菌(bacillus polymexa)、枯草芽孢杆菌(bacillus subtilis)、苏云金芽孢杆菌(bacillus thuringensis)、头状葡萄球菌(staphylococcus capitis)、山羊葡萄球菌(staphylococcus caprae)、溶血葡萄球菌(staphylococcus haemolyticus)、人葡萄球菌(staphylococcus hominis)、缓慢葡萄球菌(staphylococcus lentus)、路邓葡萄球菌(staphylococcus lugdunensis)、腐生葡萄球菌(staphylococcus saprophyticus)、木糖葡萄球菌(staphylococcus xylosus)、疮疱丙酸杆菌(propionibacterium acnes)、粪肠球菌(enterococcus faecalis)、放线菌(actinobacteria)、α变形菌(alphaproteobacteria)、拟杆菌(bacteroidetes)、β变形菌(betaproteobacteria)、衣原体(chlamydiaes)、ε变形菌(epsilonproteobacteria)、厚壁菌(firmicutes)、γ变形菌(gammaproteobacteria)、螺旋体(spirochaetales)和软壁菌(tenericutes)。在一些实施方案中,所述方法进一步包括在提供包含多个核酸分子的装置之前,分离或提取来自所述至少一种细菌的所述多个核酸分子或其子集。在一些实施方案中,所述方法进一步包括使用指示熔点的所述数据来确定所述多个分区的至少一子集的每个分区中所述病原体的存在或不存在。
17.在一些实施方案中,所述多个核酸分子从其衍生的样品是生物样品。在一些实施方案中,所述生物样品包括选自血液、尿液、精液、粘液和唾液的体液。在其他实施方案中,所述多个核酸分子从其衍生的样品是环境样品。
18.在一些实施方案中,提供所述装置进一步包括将所述多个核酸分子装载到所述多个分区中,其中在所述装载期间,使所述多个分区的至少一子集中的气体经受从所述多个分区的至少一子集向所述多个分区的至少一子集的外部的所述环境的流动。
19.在一些实施方案中,所述屏障包括聚合物材料。在一些实施方案中,所述聚合物材料是热塑性材料。在一些实施方案中,所述屏障在跨越所述屏障施加的压差下至少部分透气。在一些实施方案中,所述屏障是基本上光学透明的。在一些实施方案中,所述屏障具有约50μm至约200μm的厚度。
20.在一些实施方案中,所述装置包含至少一个微通道,所述微通道包含至少一个入口、至少一个出口和多个虹吸孔,其中所述多个分区的至少一子集中的每一个通过所述多个虹吸孔与所述至少一个微通道流体连通。
21.在一些实施方案中,所述多个分区包括约1,000至约20,000个分区。
22.在一些实施方案中,所述多个核酸分子是脱氧核糖核酸分子。在其他实施方案中,所述多个核酸分子是核糖核酸分子。
23.在另一方面,本公开内容提供了用于分析多个核酸分子的方法,包括:提供包含多个分区的装置,其中所述多个分区的至少一子集包含所述多个核酸分子,其中所述多个分区的至少一子集的每个分区被配置成允许气体通过至少一个屏障从所述多个分区的至少一子集流向所述多个分区的至少一子集外部的环境,所述屏障将所述多个分区的至少一子集与所述外部环境分隔开;使所述多个分区的至少一子集经受足以使用所述多个核酸分子进行核酸扩增反应的条件,以从所述多个核酸分子的至少一子集生成扩增产物;当使所述多个分区的至少一子集经受所述条件时,在多个时间点从所述多个分区的至少一子集收集信号;以及处理所述信号以确定所述多个分区的至少一子集中的核酸分子的数目。
24.在一些实施方案中,使所述多个分区的至少一子集经受足以进行核酸扩增反应的条件包括热循环,并且收集信号包括每个热循环从所述多个分区的至少一子集的每个分区收集信号多于一次。在一些实施方案中,所述热循环包括变性阶段、延伸阶段和退火阶段。在一些实施方案中,使用平板热循环仪进行所述热循环。
25.在一些实施方案中,所述核酸扩增反应使用选自引物、脱氧核糖核苷酸、缓冲液、辅因子、嵌入染料和聚合酶的一种或多种试剂。在一些实施方案中,所述一种或多种试剂包括荧光团或荧光标记。在一些实施方案中,在多个时间点从所述多个分区的至少一子集收集信号包括对所述多个分区的至少一子集进行成像以收集信号。在一些实施方案中,所述多个分区的至少一子集同时成像。在一些实施方案中,使用检测两个或更多个波长的荧光发射的检测器进行成像。在一些实施方案中,处理信号以确定所述多个分区的至少一子集中的核酸分子的数目包括确定所述多个分区的至少一子集的每个分区的光强度,其中所述光强度与所述多个分区的至少一子集的每一个中的扩增产物的量成比例。
26.在一些实施方案中,提供包含所述多个核酸分子的所述装置进一步包括将所述多个核酸分子装载到所述多个分区中,其中在所述装载期间,使所述多个分区的至少一子集中的气体经受从所述多个分区的至少一子集向所述多个分区的至少一子集的外部的所述环境的流动。
27.在一些实施方案中,所述屏障包括聚合物材料。在一些实施方案中,所述聚合物材料是热塑性材料。在一些实施方案中,在跨越所述屏障施加的压差下,所述屏障至少部分透气。在一些实施方案中,所述屏障是基本上光学透明的。在一些实施方案中,所述屏障具有约50μm至约200μm的厚度。
28.在一些实施方案中,所述装置包含至少一个微通道,所述微通道包含至少一个入口、至少一个出口和多个虹吸孔,其中所述多个分区中的至少一子集中的每一个通过所述多个虹吸孔与所述至少一个微通道流体连通。
29.在一些实施方案中,所述多个分区包括约1,000至约20,000个分区。
30.在一些实施方案中,所述多个核酸分子是脱氧核糖核酸分子。在其他实施方案中,所述多个核酸分子是核糖核酸分子。
31.在进一步的方面,本公开内容提供了用于分析多个核酸分子的系统,包括:被配置用于接收包含多个分区的装置的支持单元,其中所述多个分区的至少一子集的每个分区被配置成允许气体通过至少一个屏障从所述多个分区的至少一子集流向所述多个分区的至少一子集的外部的环境,所述屏障将所述多个分区的至少一子集与所述外部环境分隔开;被配置用于在多个时间点从所述多个分区的至少一子集收集信号的检测器;以及可操作地耦合至所述检测器的一个或多个计算机处理器,其中所述一个或多个计算机处理器被单独地或共同地编程用于:(i)使所述多个分区的至少一子集经受足以使用所述多个核酸分子进行核酸扩增反应的条件,以从所述多个核酸分子的至少一子集生成扩增产物;(ii)当使所述多个分区的至少一子集经受(i)中的所述条件时,接收由所述检测器在所述多个时间点从所述多个分区的至少一子集收集的所述信号;以及(iii)处理所述信号以确定所述多个分区的至少一子集中的核酸分子的数目。
32.在一些实施方案中,所述系统进一步包括被配置用于将所述多个核酸分子引导至所述多个分区的流体流动单元。在一些实施方案中,所述一个或多个计算机处理器被单独
地或共同地编程以引导所述流体流动单元将所述多个核酸分子装载到所述多个分区中。
33.在另一方面,本公开内容提供了用于分析多个核酸分子的系统,包括:被配置用于接收包含多个分区的装置的支持单元,其中所述多个分区的至少一子集的每个分区被配置成允许气体通过至少一个屏障从所述多个分区的至少一子集流向所述多个分区的至少一子集的外部的环境,所述屏障将所述多个分区的至少一子集与所述外部环境分隔开;被配置用于使所述多个分区的至少一子集经受受控加热的热单元;被配置用于从所述多个分区的至少一子集收集信号的检测器;以及可操作地耦合至所述热单元和所述检测器的一个或多个计算机处理器,其中所述一个或多个计算机处理器被单独地或共同地编程用于:(i)引导所述热单元使所述多个分区的至少一子集经受受控加热;(ii)当所述多个分区的至少一子集经受受控加热时,接收由所述检测器从所述多个分区的至少一子集收集的所述信号;以及(iii)处理在(ii)中收集的所述信号,以产生指示所述多个分区的至少一子集中的所述多个核酸分子的至少一子集的熔点的数据。
34.在一些实施方案中,所述系统进一步包括被配置用于将所述多个核酸分子引导至所述多个分区的流体流动单元。在一些实施方案中,所述一个或多个计算机处理器被单独地或共同地编程以引导所述流体流动单元将所述多个核酸分子装载到所述多个分区中。
35.本公开内容的另一方面提供了包含机器可执行代码的非暂时性计算机可读介质,所述机器可执行代码在由一个或多个计算机处理器执行时实现上文或本文其他各处的任何方法。
36.本公开内容的另一方面提供了包含一个或多个计算机处理器以及与之耦合的计算机存储器的系统。所述计算机存储器包含机器可执行代码,所述机器可执行代码在由一个或多个计算机处理器执行时实现上文或本文其他各处的任何方法。
37.通过仅示出并描述了本公开内容的说明性实施方案的以下具体实施方式,本公开内容的其他方面和优点将会对本领域技术人员而言变得显而易见。应当理解,本公开内容能够具有其他不同的实施方案,并且其若干细节能够在各个明显方面进行修改,所有这些都不偏离本公开内容。因此,附图和说明书在本质上将会被视为是说明性而非限制性的。援引并入
38.本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其程度如同特别地且单独地指出每个单独的出版物、专利或专利申请均通过引用而并入。
附图说明
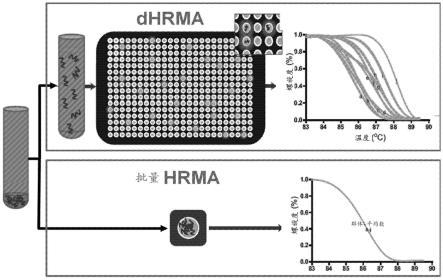
39.本发明的新颖特征在随附权利要求中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述以及附图(在本文中也称为“图”),将会获得对本发明特征和优点的更好理解,在这些附图中:
40.图1a和图1b图示了微流体结构的实例;图1a从俯视图示出了该结构,而图1b图示了该结构的横截面;
41.图2a和图2b示意性地图示了微流体装置内的微室、虹吸孔和微通道的示例性布置;图2a示出了其中使用平行的子通道和一个或多个交叉通道来形成微室网格的实施方案;图2b示出了其中蛇形图案的单个微通道形成微室的六边形网格的实施方案;
42.图3a-图3d示出了使用示例性微流体装置的方法;图3a示出了在低压下施加试剂
的步骤;图3b示出了在微流体装置上施加压差以促使分区和除气的步骤;图3c示出了在低压下施加流体以清除微通道的步骤;图3d示出了该方法完成后系统的状态;
43.图4示意性地图示了微流体装置的制造方法;
44.图5示意性地图示了与微流体装置一起采用的示例性数字pcr过程;
45.图6示意性地图示了用于在单个机器中执行核酸扩增和定量方法的机器;
46.图7示意性地图示了被编程或以其他方式配置用于实现本文提供的方法的示例性计算机控制系统;
47.图8a和图8b示出了微流体装置和样品分区;图8a示出了通过微模塑热塑性塑料而形成的微流体装置;图8b示出了样品分区过程的荧光图像;
48.图9示出了用于处理核酸样品的示例性系统;
49.图10a-图10d示出了平均含有约一个核酸模板拷贝的分区和含有零核酸模板拷贝的分区(无模板对照或ntc)的核酸扩增的双色(一种颜色代表样品信号,而另一种颜色代表标准化信号)荧光检测;图10a示出了扩增后每个分区零个拷贝(ntc);图10b示出了每个分区含有约一个拷贝的分区的核酸扩增;图10c示出了两种荧光颜色的ntc荧光强度图;以及图10d示出了扩增样品的两种荧光颜色的荧光强度图;
50.图11a-图11c示出了定量数字聚合酶链反应(qdpcr)过程的表示;图11a示出了示例性微流体装置的分区的表示;图11b示出了示例性装置的每个分区中样品的扩增动力学;图11c示出了应用于图11b中所示的扩增动力学的qdpcr过程的结果;
51.图12a-图12b示出了用于样品处理和/或分析的装置;图12a示出了该装置;图12b图示了装置的一个反应阵列内的分区的一部分的布置;
52.图13图示了用于样品处理和/或分析的装置的示意图,该装置伴有用于提供装置流体控制的气动单元;
53.图14a-图14b示意性地图示了平板热循环单元;图14a图示了平板热循环单元;图14b图示了添加气动夹具的图14a的平板热循环单元,其中夹具打开以使得装置如图12a的装置可装载到热循环单元中;
54.图15图示了用于样品处理和/或分析的完整的qdpcr系统,包括热、光学、气动和机械单元;
55.图16图示了执行qdpcr以供样品处理和/或分析的方法;
56.图17a-图17b示出了用于处理核酸分子的示例性系统;图17a示出了用于处理核酸分子的整个示例性系统;图17b示出了示例性系统的一部分,包括成像组件和用于样品处理和/或分析的装置;
57.图18示出了在可用于样品处理和/或分析的装置中在不同条件下扩增分区的子集后拍摄的样品图像;
58.图19示出了使用图17a-图17b的示例性系统拍摄的并且对应于图18的图像的样品qdpcr数据;
59.图20a-图20b示出了可用于样品处理和/或分析的装置的差异装载;图20a示出了包含不同数目的核酸分子的装置中的分区子集的图像;图20b示出了图20a的图像的泊松分析;
60.图21示出了可用于样品处理和/或分析的不同装载的装置的图像和对应的密度和
分区占据;
61.图22a-图22b示意性地图示了高分辨率熔解(hrm)分析;图22a图示了数字与批量hrm分析之间的差异;图22b示出了不同细菌种类的hrm曲线及其确定分区占据的用途;
62.图23a-图23e示出了各种细菌种类的hrm数据;图23a示出了各种细菌的16s和内部转录间隔区(its)复合物衍生的hrm曲线;图23b示出了不同种类的杆菌(bacilus)属的hrm曲线;图23c示出了不同种类的葡萄球菌(staphylococcus)属的hrm曲线;图23d示出了不同种类的肺炎链球菌(s.pneumonia)的its hrm曲线;图23e示出了由门整理的不同细菌种类的its序列同源性的热图;
63.图24a-图24b示意性地图示了hrm分析;图24a图示了来自包含多个dna分子的样品的dna的分区;图24b示出了对应于不同理论分区群体的温度依赖性荧光信号;
64.图25示出了在不同条件下在可用于样品处理和/或分析的装置中分区子集的hrm分析期间拍摄的样品图像;以及
65.图26示出了对应于图25的图像的样品hrm数据。
具体实施方式
66.尽管本文中已经示出并描述了本发明的多个实施方案,但对于本领域技术人员将会显而易见的是,这些实施方案仅以示例的方式提供。本领域技术人员在不偏离本发明的情况下可想到多种变化、改变和替代。应当理解,可以使用本文所述的本发明实施方案的各种替代方案。
67.如本文所用的,术语“扩增(amplification)”和“扩增(amplify)”可互换使用,并且通常是指生成核酸的一个或多个拷贝或者“扩增产物”。例如,这样的扩增可使用聚合酶链反应(pcr)或等温扩增。
68.如本文所用的,术语“核酸”通常是指任何长度的核苷酸(例如,至少2、3、4、5、6、7、8、9、10、100、500或1000个核苷酸)的聚合形式,该核苷酸为脱氧核糖核苷酸或核糖核苷酸,或其类似物。核酸可包含选自腺苷(a)、胞嘧啶(c)、鸟嘌呤(g)、胸腺嘧啶(t)和尿嘧啶(u)或其变体的一个或多个亚基。核苷酸可包括a、c、g、t或u,或其变体。核苷酸可包括可掺入生长的核酸链中的任何亚基。这样的亚基可以是a、c、g、t或u,或者对一个或多个互补a、c、g、t或u具有特异性的任何其他亚基,或者与嘌呤(即a或g,或其变体)或嘧啶(即c、t、或u,或其变体)互补的任何其他亚基。在一些实例中,核酸可以是单链或双链的,在一些情况下,核酸分子是环状的。核酸的非限制性实例包括脱氧核糖核酸(dna)和核糖核酸(rna)。核酸可包括基因或基因片段的编码区或非编码区、由连锁分析界定的一个或多个基因座、外显子、内含子、信使rna(mrna)、转移rna、核糖体rna、短干扰rna(sirna)、短发夹rna(shrna)、微小rna(mirna)、核酶、cdna、重组核酸、分支核酸、质粒、载体、分离的任意序列的dna、分离的任意序列的rna、核酸探针和引物。核酸可包含一种或多种修饰的核苷酸,如甲基化核苷酸和核苷酸类似物。
69.如本文所用的,术语“聚合酶链反应试剂”或“pcr试剂”可互换使用,并且通常是指包含完成核酸扩增反应(例如,dna扩增)所必需的试剂的组合物,这样的试剂的非限制性实例包括对靶核酸具有特异性的引物集或引发位点(例如,切口)、聚合酶、合适的缓冲液、辅因子(例如,二价和一价阳离子)、dntp和其他酶。pcr试剂还可包括探针、指示物以及包含探
针和指示物的分子。
70.如本文所用的,术语“探针”通常是指包含可检测部分的分子,该分子的存在与否可用于检测扩增产物是否存在。可检测部分的非限制性实例可包括放射性标记、稳定同位素标记、荧光标记、化学发光标记、酶标记、比色标记或其任意组合。
71.如本文所用的,术语“延伸”通常是指以模板引导的方式将核苷酸掺入核酸。可经由酶的帮助进行延伸。例如,可经由聚合酶的帮助进行延伸。可发生延伸的条件包括“延伸温度”和“延伸持续时间”,前者通常是指实现延伸的温度,而后者通常是指为发生延伸所分配的时间量。
72.如本文所用的,术语“指示物分子”通常是指包含可检测部分的分子,该分子的存在与否可用于指示样品分区。可检测部分的非限制性实例可包括放射性标记、稳定同位素标记、荧光标记、化学发光标记、酶标记、比色标记或其任意组合。
73.如本文所用的,术语“样品”通常是指含有或疑似含有核酸分子的任何样品。核酸分子可以在细胞样品或生物体中或者来自细胞样品或生物体,该细胞样品或生物体例如细菌。例如,样品可以是含有一种或多种核酸分子的生物样品。该生物样品可从选自血液(例如,全血)、血浆、血清、尿液、唾液、粘膜分泌物、痰、粪便和泪液的一种或多种组分中获得(例如,提取或分离),或者包含上述一种或多种组分。生物样品可以是液体或组织样品(例如,皮肤样品)。可以从无细胞体液如全血获得样品。从无细胞体液获得的样品可包含无细胞dna和/或无细胞rna。样品可包含循环肿瘤细胞。样品可取自受试者,并且其中包含的核酸的分析用于诊断目的。或者,样品可以是环境样品(例如,土壤、废物、环境空气等)、工业样品(例如,来自任何工业过程的样品)或食物样品(例如,乳制品、蔬菜产品和肉制品)。
74.如本文所用的,术语“流体”通常是指液体或气体。流体不能维持确定的形状,并且在可观察的时间框架期间将会流动以填充其置于其中的容器。因此,流体可具有允许流动的任何合适的粘度。如果存在两种或更多种流体,每种流体可由本领域普通技术人员从基本上任何流体(液体、气体等)中独立地选择。
75.如本文所用的,术语“分区”通常指划分或分配成部分或份额。例如,经分区的样品是与其他样品分离的样品。使样品能够进行分区的结构的实例包括孔和微室。
76.如本文所用的,术语“微流体”通常是指包含至少一个微通道、多个虹吸孔和微室阵列的芯片、区域、装置、物品或系统。微通道可具有小于或等于约10毫米(mm)、小于或等于约5mm、小于或等于约4mm、小于或等于约3mm、小于或等于约2mm、小于或等于约1.5mm、小于或等于约1mm、小于或等于约750微米(μm)、小于或等于约500μm、小于或等于约250μm、小于或等于约100μm或更小的横截面尺寸。
77.如本文所用的,术语“深度”通常使指从微通道、虹吸孔或分区(例如,微室)的底部至封盖微通道、多个虹吸孔和分区(例如,微室)阵列的薄膜所测量的距离。
78.如本文所用的,术语“横断面”或“横截面”可互换使用,并且通常是指基本上垂直于特征的较长尺寸的微通道或虹吸孔的尺寸或面积。
79.本公开内容描述了涉及微流体装置的使用的方法和包含微流体装置的系统,该微流体装置由聚合物材料如热塑性材料形成,并且包含薄膜以允许加压除气同时在释放压力时充当气体屏障。使用热塑性塑料来形成微流体结构可允许使用廉价且高度可扩展的注塑过程,同时薄膜可提供经由加压来除气的能力,避免可能存在于不包含此类薄膜的一些微
流体结构中的污染问题。
80.该结构的一种用途是微流体设计,该微流体设计包含由例如热塑性塑料形成的通过微通道连接的闭端微室阵列。该设计可用于例如数字pcr(dpcr)或定量dpcr(qdpcr)应用,以将试剂分区到微室阵列中,从而用于定量核酸或者用于高分辨率熔解(hrm)分析以分析在微室阵列中分区的核酸的定量和特征。用于分析样品的微流体装置
81.在一个方面,本公开内容提供了用于加工和/或分析核酸样品的微流体装置的使用方法和包含该微流体装置的系统。该装置可包含与入口和出口连接的微通道。微流体装置还可包含多个微室和多个虹吸孔。多个微室可通过多个虹吸孔与微通道连接。微流体装置可包含热塑性薄膜,该热塑性薄膜封盖并密封(例如,气密密封)微通道、微室和虹吸孔。当跨越热塑性薄膜施加压差时,热塑性薄膜可以至少部分透气。
82.图1a和图1b示出了根据本公开内容某些实施方案的微流体结构的实例。图1a从顶视图示出了示例性微流体装置。该微流体装置包含具有入口120和出口130的微通道110。微通道与多个虹吸孔101b-109b连接。多个虹吸孔将微通道与多个微室101a-109a连接。图1b示出了沿着标示为a-a'的虚线的单个微室的横截面图。单个微室101a通过虹吸孔101b与微通道110连接。微流体装置主体140可由刚性塑料材料(例如,热塑性材料)形成。微流体装置的微结构可被薄膜150封盖并密封。当跨越膜施加较小压差时,薄膜150可以是不透气的,而当跨越膜施加较大压差时,薄膜150可以是透气的。这可允许在向微流体装置的内部结构施加压力时通过薄膜150来除气。备选地,在向微流体装置外部施加真空时,可发生除气。
83.可通过升高的压力诱导薄膜的透气性。压力诱导的透气性薄膜可覆盖微室的阵列或其子集,并且微通道虹吸孔可被非透气性膜覆盖。备选地,压力诱导的透气性薄膜可覆盖微室的阵列或其子集,并且虹吸孔和微通道可被非透气性膜覆盖。备选地,压力诱导的透气性薄膜可覆盖微室的阵列或其子集、虹吸孔和微通道。薄膜的厚度可为小于或等于约500微米(μm)小于或等于约250μm、小于或等于约200μm、小于或等于约150μm、小于或等于约100μm、小于或等于约75μm、小于或等于约50μm、小于或等于约25μm或更小。薄膜的厚度可为约0.1μm至约200μm或约0.5μm至约150μm。例如,薄膜的厚度可为约50μm至约200μm。在一些实例中,薄膜的厚度可为约100μm至约200μm。例如,薄膜的厚度为约100μm至约150μm。在一个实例中,薄膜的厚度为约100μm。薄膜的厚度可通过薄膜的可制造性、薄膜的透气性、待除气的每个分区的体积、可用的压力和/或完成虹吸过程所需的时间以及其他因素来选择。
84.微流体装置可包含单个微室阵列。备选地,微流体装置可包含多个微室阵列,每个微室阵列与其他微室阵列分离。微室阵列可成排、以网格配置、以交替图案或以任何其他配置进行布置。微流体装置可具有至少约1个、至少约2个、至少约3个、至少约4个、至少约5个、至少约10个、至少约15个、至少约20个、至少约30个、至少约40个、至少约50个或更多个微室阵列。微室阵列可以是相同的。微流体装置可包含多个不同的微室阵列。微室阵列可全部具有相同的外部尺寸(即,包含微室阵列所有特征的微室阵列的长度和宽度),或者微室阵列可具有不同的外部尺寸。
85.微室阵列可具有至多约100mm、约75mm、约50mm、约40mm、约30mm、约20mm、约10mm、约8mm、约6mm、约4mm、约2mm、约1mm或更小的宽度。微室阵列可具有至多约50mm、约40mm、约30mm、约20mm、约10mm、约8mm、约6mm、约4mm、约2mm、1mm或更小的长度。宽度可为约1mm至
100mm或10mm至50mm。长度可为约1mm至50mm或5mm至20mm。
86.在一些实例中,微室阵列可具有约100mm的宽度和约40mm的长度。在一些实例中,微室阵列可具有约80mm的宽度和约30mm的长度。在一些实例中,微室阵列可具有约60mm的宽度和约25mm的长度。在一些实例中,微室阵列可具有约40mm的宽度和约15mm的长度。在一些实例中,微室阵列可具有约30mm的宽度和约10mm的长度。在一些实例中,微室阵列可具有约20mm的宽度和约8mm的长度。在一些实例中,微室阵列可具有约10mm的宽度和约4mm的长度。外部尺寸可通过所需微室的总数目、每个微室的尺寸以及用于可制造性的每个微室之间的最小距离来确定。
87.微通道可基本上平行或基本上垂直于微流体装置的较长尺寸。备选地,微通道可既不基本上平行也不基本上垂直于微流体装置的较长尺寸。微通道与微流体装置的较长尺寸之间的角度可为至少约5
°
、至少约10
°
、至少约15
°
、至少约20
°
、至少约30
°
、至少约40
°
、至少约50
°
、至少约60
°
、至少约70
°
、至少约90
°
、至少约100
°
、至少约110
°
、至少约120
°
、至少约130
°
、至少约140
°
、至少约150
°
、至少约160
°
或至少约170
°
。微通道可为单个长通道。微通道可具有弯曲、曲线或角度。微通道可具有小于或等于100mm、小于或等于约75mm、小于或等于约50mm、小于或等于约40mm、小于或等于约30mm、小于或等于约20mm、小于或等于约10mm、小于或等于约8mm、小于或等于约6mm、小于或等于约4mm、小于或等于约2mm或更小的较长尺寸。微通道的长度可被微流体装置的外部长度或宽度限制。微通道可具有小于或等于约500μm、小于或等于约250μm、小于或等于约100μm、小于或等于约80μm、小于或等于约60μm、小于或等于约30μm、小于或等于约20μm、小于或等于约10μm或更小的深度。微通道可具有小于或等于约500μm、小于或等于约250μm、小于或等于约100μm、小于或等于约75μm、小于或等于约50μm、小于或等于约40μm、小于或等于约30μm、小于或等于约20μm、小于或等于约10μm或更小的横截面尺寸(例如,宽度)。
88.在一些实例中,微通道的横截面尺寸可为约100μm宽
×
约100μm深。在一些实例中,微通道的横截面尺寸可为约100μm宽
×
约80μm深。在一些实例中,微通道的横截面尺寸可为约100μm宽
×
约60μm深。在一些实例中,微通道的横截面尺寸可为约100μm宽
×
约40μm深。在一些实例中,微通道的横截面尺寸可为约100μm宽
×
约20μm深。在一些实例中,微通道的横截面尺寸可为约100μm宽
×
约10μm深。在一些实例中,微通道的横截面尺寸可为约80μm宽
×
约100μm深。在一些实例中,微通道的横截面尺寸可为约60μm宽
×
约100μm深。在一些实例中,微通道的横截面尺寸可为约40μm宽
×
约100μm深。在一些实例中,微通道的横截面尺寸可为约20μm宽
×
约100μm深。在一些实例中,微通道的横截面尺寸可为约10μm宽
×
约100μm深。在一些实例中,微通道的横截面尺寸可为约80μm宽
×
约80μm深。在一些实例中,微通道的横截面尺寸可为约60μm宽
×
约60μm深。在一些实例中,微通道的横截面尺寸可为约40μm宽
×
约40μm深。在一些实例中,微通道的横截面尺寸可为约20μm宽
×
约20μm深。在一些实例中,微通道的横截面尺寸可为约10μm宽
×
约10μm深。微通道的横截面形状可为任何合适的横截面形状,包括但不限于圆形、椭圆形、三角形、正方形或矩形。微通道的横截面积可以是沿微通道的长度恒定的。备选地或附加地,微通道的横截面积可沿微通道的长度变化。微通道的横截面积可在约50%至150%之间、约60%至125%之间、约70%至120%之间、约80%至115%之间、约90%至110%之间、约95%至100%之间或约98%至102%之间变化。微通道的横截面积可小于或等于约10,000平方微米(μm2)、小于或等于约7,500μm2、小于或等于约
5,000μm2、小于或等于约2,500μm2、小于或等于约1,000μm2、小于或等于约750μm2、小于或等于约500μm2、小于或等于约400μm2、小于或等于约300μm2、小于或等于约200μm2、小于或等于约100μm2或更小。
89.微通道可具有单个入口和单个出口。备选地,微通道可具有多个入口、多个出口、或者多个入口和多个出口。入口和出口可具有相同的直径,或者它们可具有不同的直径。入口和出口可具有小于或等于约2.5毫米(mm)、小于或等于约2mm、小于或等于约1.5mm、小于或等于约1mm、小于约0.5mm或更小的直径。
90.微室阵列可具有至少约1,000个微室、至少约5,000个微室、至少约10,000个微室、至少约20,000个微室、至少约30,000个微室、至少约40,000个微室、至少约50,000个微室、至少约100,000个微室或更多。在一些实例中,微流体装置可具有约10,000至约30,000个微室。在一些实例中,微流体装置可具有约15,000至约25,000个微室。微室可为圆柱形形状、半球形状形、或者圆柱形和半球形形状的组合。微室可具有小于或等于约500μm、小于或等于约250μm、小于或等于约100μm、小于或等于约80μm、小于或等于约60μm、小于或等于约30μm、小于或等于约15μm或更小的直径。微室的深度可为小于或等于约500μm、小于或等于约250μm、小于或等于约100μm、小于或等于约80μm、小于或等于约60μm、小于或等于约30μm、小于或等于约15μm或更小。在一些实例中,微室可具有约30μm的直径和约100μm的深度。在一些实例中,微室可具有约35μm的直径和约80μm的深度。在一些实例中,微室可具有约40μm的直径和约70μm的深度。在一些实例中,微室可具有约50μm的直径和约60μm的深度。在一些实例中,微室可具有约60μm的直径和约40μm的深度。在一些实例中,微室可具有约80μm的直径和约35μm的深度。在一些实例中,微室可具有约100μm的直径和约30μm的深度。微室和微通道可具有相同的深度。备选地,微室和微通道可具有不同的深度。
91.虹吸孔的长度可以是恒定的。备选地,虹吸孔的长度可有所变化。虹吸孔可具有小于或等于约150μm、小于或等于约100μm、小于或等于约50μm、小于或等于约25μm、小于或等于约10μm、小于或等于约5μm或更小的较长尺寸。虹吸孔的深度可为小于或等于约50μm、小于或等于约25μm、小于或等于约10μm、小于或等于约5μm或更小。虹吸孔可具有小于或等于约50μm、小于或等于约40μm、小于或等于约30μm、小于或等于约20μm、小于或等于约10μm、小于或等于约5μm或更小的横截面宽度。
92.在一些实例中,虹吸孔的横截面尺寸可为约50μm宽
×
约50μm深。在一些实例中,虹吸孔的横截面尺寸可为约50μm宽
×
约40μm深。在一些实例中,虹吸孔的横截面尺寸可为约50μm宽
×
约30μm深。在一些实例中,虹吸孔的横截面尺寸可为约50μm宽
×
约20μm深。在一些实例中,虹吸孔的横截面尺寸可为约50μm宽
×
约10μm深。在一些实例中,虹吸孔的横截面尺寸可为约50μm宽
×
约5μm深。在一些实例中,虹吸孔的横截面尺寸可为约40μm宽
×
约50μm深。在一些实例中,虹吸孔的横截面尺寸可为约30μm宽
×
约50μm深。在一些实例中,虹吸孔的横截面尺寸可为约20μm宽
×
约50μm深。在一些实例中,虹吸孔的横截面尺寸可为约10μm宽
×
约50μm深。在一些实例中,虹吸孔的横截面尺寸可为约5μm宽
×
约50μm深。在一些实例中,虹吸孔的横截面尺寸可为约40μm宽
×
约40μm深。在一些实例中,虹吸孔的横截面尺寸可为约30μm宽
×
约30μm深。在一些实例中,虹吸孔的横截面尺寸可为约20μm宽
×
约20μm深。在一些实例中,虹吸孔的横截面尺寸可为约10μm宽
×
约10μm深。在一些实例中,虹吸孔的横截面尺寸可为约5μm宽
×
约5μm深。虹吸孔的横截面形状可为任何合适的横截面形状,包括但
不限于圆形、椭圆形、三角形、正方形或矩形。虹吸孔的横截面积可以是沿虹吸孔的长度恒定的。备选地或附加地,虹吸孔的横截面积可沿虹吸孔的长度变化。虹吸孔在与微通道连接处的横截面积可大于虹吸孔在与微室连接处的横截面积。备选地,虹吸孔在与微室连接处的横截面积可大于虹吸孔在与微通道连接处的横截面积。虹吸孔的横截面积可在约50%至150%之间、约60%至125%之间、约70%至120%之间、约80%至115%之间、约90%至110%之间、约95%至100%之间、或约98%至102%之间变化。虹吸孔的横截面积可为小于或等于约2,500μm2、小于或等于约1,000μm2、小于或等于约750μm2、小于或等于约500μm2、小于或等于约250μm2、小于或等于约100μm2、小于或等于约75μm2、小于或等于约50μm2、小于或等于约25μm2或更小。虹吸孔在与微通道连接处的横截面积可小于或等于微通道的横截面积。虹吸孔在与微通道连接处的横截面积可小于或等于约98%、小于或等于约95%、小于或等于约90%、小于或等于约85%、小于或等于约80%、小于或等于约75%、小于或等于约70%、小于或等于约60%、小于或等于约50%、小于或等于约40%、小于或等于约30%、小于或等于约20%、小于或等于约10%、小于或等于约5%、小于或等于约1%、或者小于或等于约0.5%的微通道横截面积。
93.虹吸孔可基本上垂直于微通道。备选地,虹吸孔可不基本上垂直于微通道。虹吸孔与微通道之间的角度可为至少约5
°
、至少约10
°
、至少约15
°
、至少约20
°
、至少约30
°
、至少约40
°
、至少约50
°
、至少约60
°
、至少约70
°
、至少约90
°
、至少约100
°
、至少约110
°
、至少约120
°
、至少约130
°
、至少约140
°
、至少约150
°
、至少约160
°
或至少约170
°
。
94.微室可以以各种图案布置。图2a和图2b图示了微室、虹吸孔和微通道布置的示例性图案。可采用多个微通道或可使用单个微通道。微通道可包含一组子通道。该组子通道可通过一个或多个交叉通道连接。子通道可基本上彼此平行,使得微室阵列形成微室网格。图2a图示了其中使用平行子通道230和一个或多个交叉通道220形成微室网格的实施方案。
95.可构建微室以便形成微室的六边形网格,其中弯曲或成角度的子通道连接微室。微室的六边形网格还可通过单个微通道形成并连接,如通过在微流体装置上形成蛇形图案240的微通道连接。图2b示出了其中处于蛇形图案的单个微通道形成微室的六边形网格的实施方案。以蛇形配置布置的微室的另一个实例在图12b中示出。
96.子通道的长度可以是恒定的。备选地,子通道的长度可有所变化。子通道可具有小于或等于100mm、小于或等于约75mm、小于或等于约50mm、小于或等于约40mm、小于或等于约30mm、小于或等于约20mm、小于或等于约10mm、小于或等于约8mm、小于或等于约6mm、小于或等于约4mm、小于或等于约2mm或更小的较长尺寸。子通道的长度可受到微流体装置的外部长度或宽度的限制。子通道可与微通道具有相同的横截面尺寸。备选地,子通道可与微通道具有不同的横截面尺寸。子通道可与微通道具有相同的深度和不同的横截面尺寸。备选地,子通道可与微通道具有相同的横截面尺寸和不同的深度。例如,子通道可具有小于或等于约500μm、小于或等于约250μm、小于或等于约100μm、小于或等于约80μm、小于或等于约60μm、小于或等于约30μm、小于或等于约15μm或更小的深度。子通道可具有小于或等于约500μm、小于或等于约250μm、小于或等于约100μm、小于或等于约75μm、小于或等于约50μm、小于或等于约40μm、小于或等于约30μm、小于或等于约20μm、小于或等于约10μm或更小的横截面宽度。
97.在一些实例中,子通道的横截面尺寸可为约100μm宽
×
约100μm深。在一些实例中,
子通道的横截面尺寸可为约100μm宽
×
约80μm深。在一些实例中,子通道的横截面尺寸可为约100μm宽
×
约60μm深。在一些实例中,子通道的横截面尺寸可为约100μm宽
×
约40μm深。在一些实例中,子通道的横截面尺寸可为约100μm宽
×
约20μm深。在一些实例中,子通道的横截面尺寸可为约100μm宽
×
约10μm深。在一些实例中,子通道的横截面尺寸可为约80μm宽
×
约100μm深。在一些实例中,子通道的横截面尺寸可为约60μm宽
×
约100μm深。在一些实例中,子通道的横截面尺寸可为约40μm宽
×
约100μm深。在一些实例中,子通道的横截面尺寸可为约20μm宽
×
约100μm深。在一些实例中,子通道的横截面尺寸可为约10μm宽
×
约100μm深。在一些实例中,子通道的横截面尺寸可为约80μm宽
×
约80μm深。在一些实例中,子通道的横截面尺寸可为约60μm宽
×
约60μm深。在一些实例中,子通道的横截面尺寸可为约40μm宽
×
约40μm深。在一些实例中,子通道的横截面尺寸可为约20μm宽
×
约20μm深。在一些实例中,子通道的横截面尺寸可为约10μm宽
×
约10μm深。子通道的横截面形状可为任何合适的横截面形状,包括但不限于圆形、椭圆形、三角形、正方形或矩形。子通道的横截面形状可与微通道的横截面形状不同。子通道的横截面形状可与微通道的横截面形状相同。子通道的横截面积可以是沿子通道的长度恒定的。备选地或附加地,子通道的横截面积可沿微通道的长度变化。子通道的横截面积可在约50%至150%之间、约60%至125%之间、约70%至120%之间、约80%至115%之间、约90%至110%之间、约95%至100%之间、或约98%至102%之间变化。子通道的横截面积可小于或等于约10,000μm2、小于或等于约7,500μm2、小于或等于约5,000μm2、小于或等于约2,500μm2、小于或等于约1,000μm2、小于或等于约750μm2、小于或等于约500μm2、小于或等于约400μm2、小于或等于约300μm2、小于或等于约200μm2、小于或等于约100μm2或更小。子通道的横截面积可与微通道的横截面积相同。子通道的横截面积可小于或等于微通道的横截面积。例如,子通道的横截面积可为小于或等于约98%、小于或等于约95%、小于或等于约90%、小于或等于约85%、小于或等于约80%、小于或等于约75%、小于或等于约70%、小于或等于约60%、小于或等于约50%、小于或等于约40%、小于或等于约30%、小于或等于约20%、小于或等于约20%或更小的微通道横截面积。
98.交叉通道的长度可以是恒定的。备选地,交叉通道的长度可有所变化。交叉通道可具有小于或等于约100mm、小于或等于约75mm、小于或等于约50mm、小于或等于约40mm、小于或等于约30mm、小于或等于约20mm、小于或等于约10mm、小于或等于约8mm、小于或等于约6mm、小于或等于约4mm、小于或等于约2mm或更小的较长尺寸。交叉通道的长度可受到微流体装置的外部长度或宽度的限制。交叉通道可与微通道具有相同的横截面尺寸。备选地,交叉通道可与微通道具有不同的横截面尺寸。交叉通道可与微通道具有相同的深度和不同的横截面尺寸。备选地,交叉通道可与微通道具有相同的横截面尺寸和不同的深度。例如,交叉通道可具有小于或等于约500μm、小于或等于约250μm、小于或等于约100μm、小于或等于约80μm、小于或等于约60μm、小于或等于约30μm、小于或等于约15μm或更小的深度。交叉通道可具有小于或等于约500μm、小于或等于约250μm、小于或等于约100μm、小于或等于约75μm、小于或等于约50μm、小于或等于约40μm、小于或等于约30μm、小于或等于约20μm、小于或等于约10μm或更小的横截面宽度。
99.在一些实例中,交叉通道的横截面尺寸可为约100μm宽
×
约100μm深。在一些实例中,交叉通道的横截面尺寸可为约100μm宽
×
约80μm深。在一些实例中,交叉通道的横截面
尺寸可为约100μm宽
×
约60μm深。在一些实例中,交叉通道的横截面尺寸可为约100μm宽
×
约40μm深。在一些实例中,交叉通道的横截面尺寸可为约100μm宽
×
约20μm深。在一些实例中,交叉通道的横截面尺寸可为约100μm宽
×
约10μm深。在一些实例中,交叉通道的横截面尺寸可为约80μm宽
×
约100μm深。在一些实例中,交叉通道的横截面尺寸可为约60μm宽
×
约100μm深。在一些实例中,交叉通道的横截面尺寸可为约40μm宽
×
约100μm深。在一些实例中,交叉通道的横截面尺寸可为约20μm宽
×
约100μm深。在一些实例中,交叉通道的横截面尺寸可为约10μm宽
×
约100μm深。在一些实例中,交叉通道的横截面尺寸可为约80μm宽
×
约80μm深。在一些实例中,交叉通道的横截面尺寸可为约60μm宽
×
约60μm深。在一些实例中,交叉通道的横截面尺寸可为约40μm宽
×
约40μm深。在一些实例中,交叉通道的横截面尺寸可为约20μm宽
×
约20μm深。在一些实例中,交叉通道的横截面尺寸可为约10μm宽
×
约10μm深。
100.交叉通道的横截面形状可为任何合适的横截面形状,包括但不限于圆形、椭圆形、三角形、正方形或矩形。交叉通道的横截面形状可与微通道的横截面形状不同。交叉通道的横截面形状可与微通道的横截面形状相同。交叉通道的横截面积可以是沿交叉通道的长度恒定的。备选地或附加地,交叉通道的横截面积可沿微通道的长度变化。交叉通道的横截面积可在约50%至150%之间、约60%至125%之间、约70%至120%之间、约80%至115%之间、约90%至110%之间、约95%至100%之间、或约98%至102%之间变化。交叉通道的横截面积可为小于或等于约10,000μm2、小于或等于约7,500μm2、小于或等于约5,000μm2、小于或等于约2,500μm2、小于或等于约1,000μm2、小于或等于约750μm2、小于或等于约500μm2、小于或等于约400μm2、小于或等于约300μm2、小于或等于约200μm2、小于或等于约100μm2或更小。交叉通道的横截面积可与微通道的横截面积相同。备选地,交叉通道的横截面积可小于微通道的横截面积。交叉通道的横截面积可为小于或等于约98%、小于或等于约95%、小于或等于约90%、小于或等于约85%、小于或等于约80%、小于或等于约75%、小于或等于约70%、小于或等于约60%、小于或等于约50%、小于或等于约40%、小于或等于约30%、小于或等于约20%、小于或等于约20%或更小的微通道横截面积。用于制造微流体装置的方法
101.可通过任何有用的方法制造可用于本公开内容的方法和系统的微流体装置。例如,装置的制造可能涉及注塑热塑性塑料以产生微流体结构。微流体结构可包含微通道、多个微室和多个虹吸孔。多个微室可通过多个虹吸孔与微通道连接。微通道可包含入口和出口。可施加热塑性薄膜以封盖微流体结构。当跨越热塑性薄膜施加压差时,热塑性薄膜可至少部分透气。
102.热塑性薄膜可通过注塑形成。热塑性薄膜可通过热粘合施加于微流体结构。备选地或附加地,可通过化学键合来施加薄膜。可形成热塑性薄膜作为注塑过程的一部分,并在注塑过程中形成热塑性薄膜以形成微流体装置。
103.微流体装置的主体和薄膜可包含相同的材料。备选地,微流体装置的主体和薄膜可包含不同的材料。微流体装置的主体和薄膜可包含热塑性塑料。热塑性塑料的实例包括但不限于环烯烃聚合物、丙烯酸、丙烯腈丁二烯苯乙烯、尼龙、聚乳酸、聚苯并咪唑、聚碳酸酯、聚醚砜、聚醚醚酮、聚醚酰亚胺、聚乙烯、聚苯醚、聚苯硫醚、聚丙烯、聚苯乙烯、聚氯乙烯、聚四氟乙烯、聚酯、聚氨酯或其任何衍生物。微流体装置可包含均聚物、共聚物或其组
合。微流体装置可由非弹性材料形成。备选地或附加地,微流体装置可由弹性材料形成。
104.热塑性塑料和薄膜均可由环烯烃聚合物组成。一种合适的热塑性塑料是zeonor 1430r(zeon chemical,japan),而一种合适的薄膜是zeonox 1060r(zeon chemical,japan)。薄膜可包含在低压下不透气而在压力下至少部分透气的材料。
105.本公开内容的微流体装置的入口和出口可通过机械钻孔形成。备选地,入口和出口通过熔化、溶解或蚀刻热塑性塑料而形成。
106.图4图示了制造可用于样品加工和/或分析的装置的方法。在图4中,使用注塑过程401形成微流体结构。如图1a和图1b所示,微流体结构包含微室阵列,该微室阵列通过虹吸孔与至少一个微通道连接。微流体结构由薄膜封盖。在封盖过程中,微结构的至少一侧中的开口被从上覆盖,以便封闭和密封微结构。可通过将薄膜施加于注塑的微流体结构的过程402来执行封盖。备选地,可通过作为注塑过程401的一部分形成薄膜来执行封盖。
107.作为另一实例,虽然在经由注塑形成微结构的上下文中进行了描述,但是如上所述,通过其他微制造技术形成的微流体装置也可受益于使用这样的热塑性薄膜以允许除气。这样的技术包括微机械加工、微光刻和热压印以及其他微制造技术。
108.本公开内容的装置可以是可消耗装置(例如,被设计用于单次使用,如分析和/或处理单个样品)或可重复使用的装置(例如,被设计用于多次使用,如分析和/或处理多个样品)。包含在装置中的材料的选择可反映该装置将被使用一次还是多次。例如,可消耗装置可包含比可重复使用装置更便宜的材料。类似地,可根据装置的使用来调整制造过程。例如,用于可消耗装置的制造过程可涉及产生较少的浪费和/或涉及较少或较便宜的步骤。可重复使用的装置可以是可清洁的和/或可消毒的,以便于使用相同的装置分析和/或处理多个样品。例如,可重复使用的装置可包含能够承受适于消毒的高温的材料。可消耗装置可包含或可不包含此类材料。分析样品的方法
109.在一个方面,本公开内容提供了用于使用微流体装置分析样品如核酸分子的方法。核酸分子可在含有或疑似含有病原体的样品中或者来自含有或疑似含有病原体的样品,该病原体如细菌。该方法可包括提供如本文所述的微流体装置。该装置可包含微通道。微通道可包含入口和出口。微流体装置可进一步包含通过多个虹吸孔与微通道连接的多个微室。微流体装置可通过邻近微流体装置表面安置的薄膜(例如,热塑性薄膜)密封,使得热塑性薄膜封盖微通道、多个微室和多个虹吸孔。可将试剂和/或样品施加至入口或出口。可通过在试剂和/或样品与微流体装置之间提供第一压差来使试剂和/或样品流入微流体装置,从而填充微流体装置。可通过在微通道与多个微室之间施加第二压差以将试剂和/或样品移动到多个微室中并推动多个微室内的气体通过薄膜,从而使试剂和/或样品分区到微室中。第二压差可大于第一压差。可在入口与出口之间施加第三压差以将流体引入微通道而不将流体引入微室中。第三压差可小于第二压差。可在样品之前、之后或与样品同时添加试剂。还可通过另一种方法在装置的一个或多个分区中提供试剂。例如,在用薄膜覆盖一个或多个分区之前,可将试剂沉积在一个或多个分区内。
110.装置的入口和出口可与气动泵或真空系统流体连通。气动泵或真空系统可以是本公开内容的系统的组件或与本公开内容的系统分离。可通过在微流体装置的各个特征之间施加压差来执行样品和/或试剂的填充和分区。可在不在微室与微通道之间使用阀以分离
样品和/或试剂的情况下执行样品和/或试剂的填充和分区。例如,可通过在待装载的样品和/或试剂与微通道之间施加压差来执行微通道的填充。该压差可通过对样品和/或试剂加压或者通过向微通道施加真空来实现。可通过在微通道与微室之间施加压差来执行微室的填充。这可以通过对微通道加压或通过对微室施加真空来实现。可通过在流体与微通道之间施加压差来执行样品和/或试剂的分区。该压差可通过对流体加压或通过向微通道施加真空来实现。
111.在不同的施加压差下,薄膜可具有不同的渗透性特性。例如,薄膜在第一压差和第三压差(例如,低压)下可以是不透气的,该第一压差和第三压差可为较小幅度的压差。薄膜在第二压差(例如,高压)下可以至少部分透气,该第二压差可为较大幅度的压差。第一压差和第三压差可以相同或者可以不同。第一压差可以是入口或出口中的试剂与微流体装置之间的压差。在微流体装置填充期间,试剂的压力可高于微流体装置的压力。在微流体装置填充期间,试剂与微流体装置之间的压差(例如,低压)可小于或等于约8磅/平方英寸(psi)、小于或等于约6psi、小于或等于约4psi、小于或等于约2psi、小于或等于约1psi或更小。在一些实例中,在微流体装置填充期间,试剂与微流体装置之间的压差可为约1psi至约8psi。在一些实例中,在微流体装置填充期间,试剂与微流体装置之间的压差可为约1psi至约6psi。在一些实例中,在微流体装置填充期间,试剂与微流体装置之间的压差可为约1psi至约4psi。可通过在试剂与微流体装置之间施加压差达小于或等于约20分钟、小于或等于约15分钟、小于或等于约10分钟、小于或等于约5分钟、小于或等于约3分钟、小于或等于约2分钟、小于或等于约1分钟或更短来填充微流体装置。
112.经填充的微流体装置可在微通道、虹吸孔、微室或其任意组合中具有样品或者一种或多种试剂。样品或者一种或多种试剂向微室中的回填可发生在微流体装置填充时或可发生在施加第二压差期间。第二压差(例如,高压)可对应于微通道与多个微室之间的压差。在施加第二压差期间,较高压力域中的第一流体可推动较低压力域中的第二流体通过薄膜并离开微流体装置。第一流体和第二流体可包括液体或气体。液体可包括水性混合物或油性混合物。可通过对微通道加压来实现第二压差。备选地或附加地,可通过对微室施加真空来实现第二压差。在施加第二压差期间,微通道中的样品和/或试剂可流入微室中。备选地,在施加第二压差期间,残存在虹吸孔、微室和微通道内的气体可通过薄膜除气。在微室的回填和除气期间,微室与微通道之间的压差可为大于或等于约6psi、大于或等于约8psi、大于或等于约10psi、大于或等于约12psi、大于或等于约14psi、大于或等于约16psi、大于或等于约18psi、大于或等于约20psi或更大。在一些实例中,在微室的回填期间,微室与微通道之间的压差为约8psi至约20psi。在一些实例中,在微室的回填期间,微室与微通道之间的压差为约8psi至约18psi。在一些实例中,在微室的回填期间,微室与微通道之间的压差为约8psi至约16psi。在一些实例中,在微室的回填期间,微室与微通道之间的压差为约8psi至约14psi。在一些实例中,在微室的回填期间,微室与微通道之间的压差为约8psi至约12psi。在一些实例中,在微室的回填期间,微室与微通道之间的压差为约8psi至约10psi。可通过施加压差达超过约5分钟、超过约10分钟、超过约15分钟、超过约20分钟、超过约25分钟、超过约30分钟或更久来使微室回填和除气。
113.可通过从微通道中去除过量的样品和/或试剂来使样品和/或试剂分区。从微通道中去除过量的样品和/或试剂可防止一个微室中的试剂和/或样品通过虹吸孔扩散到微通
道中并进入其他微室。可通过将流体引入微通道的入口或出口来除去微通道内的过量样品和/或试剂。流体的压力可大于微通道的压力,从而在流体与微通道之间产生压差。流体可为氧气、氮气、二氧化碳、空气、稀有气体或其任意组合。在样品分区期间,流体与微通道之间的压差可为小于或等于约8psi、小于或等于约6psi、小于或等于约4psi、小于或等于约2psi、小于或等于约1psi或更小。在一些实例中,在样品和/或试剂分区期间,流体与微通道之间的压差可为约1psi至约8psi。在一些实例中,在样品和/或试剂分区期间,流体与微通道之间的压差可为约1psi至约6psi。在一些实例中,在样品和/或试剂分区期间,流体与微通道之间的压差可为约1psi至约4psi。可通过在流体与微通道之间施加压差达小于或等于约20分钟、小于或等于约15分钟、小于或等于约10分钟、小于或等于约5分钟、小于或等于约3分钟、小于或等于约2分钟、小于或等于约1分钟或更短来使样品和/或试剂分区。
114.图3a-图3d图示了使用图1a中所示的微流体装置的方法。在图3a中,经由气动泵300将低压施加于入口120处的试剂,以推动试剂进入微通道110,从而经由虹吸孔填充微室。压力推动试剂流过微通道,从而经由虹吸孔流入微室。此时,诸如泡301的气泡可保留在微室、虹吸孔或微通道内。可持续经由施加低压进行填充直至微室、虹吸孔和微通道基本上充满试剂。试剂可以是将用于聚合酶链反应的试剂。可稀释试剂使得微流体装置的每个微室中的试剂中存在不多于一个pcr模板。例如,装置的多个分区的至少一子集的每个分区可包含至多一个核酸分子。在一些实例中,装置的多个分区的子集的每个分区可包含仅一个核酸分子。
115.在图3b中,将气动泵300与入口120和出口130连接,并施加高压。高压通过试剂传递并施加至诸如泡301的气泡上。在该高压的影响下,薄膜150变得透气,并且泡301可通过薄膜150除气。通过施加该高压,可使得微室、虹吸孔和微通道基本上无气泡,从而避免污染。
116.在图3c中,通过经由气动泵300向入口120处的气体施加低压来重新引入流体。气压可能不足以允许气体通过薄膜除气,或可能足够高以推动气泡进入虹吸孔和微室。替代地,气体可清除微通道的试剂,从而使试剂分离在每个微室和虹吸孔中。该气体可为空气。备选地,该气体可为惰性气体,如氮气、二氧化碳或稀有气体。这样的气体可用于避免试剂与空气的组分气体之间的反应。
117.图3d图示了图3c中已施加低压后系统的状态。在施加低压气体后,微室和虹吸孔可仍然充满试剂,而微通道可被清除试剂。由于虹吸孔产生的毛细力和高表面张力,试剂可在微室内保持静止。毛细力和高表面张力可防止试剂流入微通道并使试剂蒸发最小化。可使用与关于图3a-图3d描述的过程类似的过程来对装置内的样品进行分区。
118.可通过试剂内指示物的存在来验证样品的分区。指示物可包括含有可检测部分的分子。可检测部分可包括放射性物质、荧光标记、化学发光标记、酶标记、比色标记或其任意组合。放射性物质的非限制性实例包括3h、14c、22na、32p、33p、35s、42k、45ca、59fe、123i、124i、125i、131i或203hg。荧光标记的非限制性实例包括荧光蛋白、光学活性染料(例如,荧光染料)、有机金属荧光团或其任意组合。化学发光标记的非限制性实例包括萤光素酶类的酶,如海萤(cypridina)萤光素酶、高斯(gaussia)萤光素酶、海肾(renilla)萤光素酶和萤火虫萤光素酶。酶标记的非限制性实例包括辣根过氧化物酶(hrp)、碱性磷酸酶(ap)、β半乳糖苷酶、葡萄糖氧化酶或其他公知的标记。
119.指示物分子可为荧光分子。荧光分子可包括荧光蛋白、荧光染料和有机金属荧光团。指示物分子可为蛋白质荧光团。蛋白质荧光团可包括绿色荧光蛋白(gfp,在绿色光谱区发荧光的荧光蛋白,通常发射波长为500-550纳米的光)、青色荧光蛋白(cfp,在青色光谱区发荧光的荧光蛋白,通常发射波长为450-500纳米的光)、红色荧光蛋白(rfp,在红色光谱区发荧光的荧光蛋白,通常发射波长为600-650纳米的光)。蛋白质荧光团的非限制性实例包括acgfp、acgfp1、amcyan、amcyan1、aq143、asred2、azami green、azurite、bfp、cerulean、cfp、cgfp、citrine、copgfp、cypet、dkeima-tandem、dsred、dsred-express、dsred-monomer、dsred2、dtomato、dtomato-tandem、ebfp、ebfp2、ecfp、egfp、emerald、eosfp、eyfp、gfp、hcred-tandem、hcred1、jred、katuska、kusabira orange、kusabira orange2、mapple、mbanana、mcerulean、mcfp、mcherry、mcitrine、mecfp、memerald、mgrape1、mgrape2、mhoneydew、midori-ishi cyan、mkeima、mko、morange、morange2、mplum、mraspberry、mrfp1、mruby、mstrawberry、mtagbfp、mtangerine、mteal、mtomato、mturquoise、mwasabi、phiyfp、reash、sapphire、superfolder gfp、t-sapphire、tagcfp、taggfp、tagrfp、tagrfp-t、tagyfp、tdtomato、topaz、turbogfp、venus、yfp、ypet、zsgreen和zsyellow1的突变体和光谱变体。
120.指示物分子可以是荧光染料。荧光染料的非限制性实例包括sybr绿;sybr蓝;dapi;碘化丙锭;hoeste;sybr金;溴化乙锭;吖啶;原黄素;吖啶橙;吖啶黄素;荧光香豆素(fluorcoumanin);椭圆玫瑰树碱;道诺霉素;氯喹;偏端霉素d;色霉素;乙菲啶(homidium);光神霉素;多吡啶钌;氨茴霉素;菲啶和吖啶;碘化丙锭;碘化己锭;二氢乙锭;单叠氮化乙锭;acma;hoechst 33258;hoechst 33342;hoechst34580;dapi;吖啶橙;7-aad;放线菌素d;lds751;羟脒(hydroxystilbamidine);sytox blue;sytox green;sytox orange;popo-1;popo-3;yoyo-1;yoyo-3;toto-1;toto-3;jojo-1;lolo-1;bobo-1;bobo-3;po-pro-1;po-pro-3;bo-pro-1;bo-pro-3;to-pro-1;to-pro-3;to-pro-5;jo-pro-1;lo-pro-1;yo-pro-1;yo-pro-3;picogreen;oligreen;ribogreen;sybr gold;sybr green i;sybr green ii;sybr dx;syto-40、syto-41、syto-42、syto-43、syto-44和syto-45(蓝);syto-13、syto-16、syto-24、syto-21、syto-23、syto-12、syto-11、syto-20、syto-22、syto-15、syto-14和syto-25(绿);syto-81、syto-80、syto-82、syto-83、syto-84和syto-85(橙);syto-64、syto-17、syto-59、syto-61、syto-62、syto-60和syto-63(红);荧光素;异硫氰酸荧光素(fitc);四甲基异硫氰酸罗丹明(tritc);罗丹明;四甲基罗丹明;r-藻红蛋白;cy-2;cy-3;cy-3.5;cy-5;cy5.5;cy-7;德克萨斯红(texas red);phar-red;别藻蓝蛋白(apc);sybr green i;sybr green ii;sybr gold;celltracker green;7-aad;乙锭同型二聚体i;乙锭同型二聚体ii;乙锭同型二聚体iii;伞形酮;曙红;绿色荧光蛋白;赤藓红;香豆素;甲基香豆素;芘;孔雀绿;茋;萤光黄;级联蓝(cascade blue);二氯三嗪胺荧光素;丹磺酰氯;荧光镧系络合物(如包含铕和铽的那些络合物);羧基四氯荧光素;5-羧基荧光素和/或6-羧基荧光素(fam);5-碘乙酰胺基荧光素或6-碘乙酰胺基荧光素;5-{[2-5-(乙酰基巯基)-琥珀酰基]氨基}荧光素和5-{[3-5-(乙酰基巯基)-琥珀酰基]氨基}荧光素(samsa-荧光素);丽丝胺罗丹明b磺酰氯;5-羧基罗丹明和/或6-羧基罗丹明(rox);7-氨基-甲基-香豆素;7-氨基-4-甲基香豆素-3-乙酸(amca);bodipy荧光团;8-甲氧基芘-1,3,6-三磺酸三钠盐;3,6-二磺酸-4-氨基-萘二甲酰亚胺;藻胆蛋白;alexafluor 350、alexafluor 405、alexafluor 430、
alexafluor 488、alexafluor 532、alexafluor 546、alexafluor 555、alexafluor 568、alexafluor 594、alexafluor 610、alexafluor 633、alexafluor 635、alexafluor 647、alexafluor 660、alexafluor 680、alexafluor 700、alexafluor 750和alexafluor 790染料;dylight 350、dylight 405、dylight 488、dylight 550、dylight 594、dylight 633、dylight 650、dylight 680、dylight 755和dylight 800染料;以及其他荧光团。
[0121]
指示物分子可为有机金属荧光团。有机金属荧光团的非限制性实例包括镧系离子螯合物,该镧系离子螯合物的非限制性实例包括三(二苯甲酰基甲烷)单(1,10-菲咯啉)铕(iii)、三(二苯甲酰基甲烷)单(5-氨基-1,10-菲咯啉)铕(iii)和lumi4-tb穴状化合物。
[0122]
可从微流体装置或其多个分区(例如,微室)的子集收集信号(例如,拍摄图像)。收集信号可包括拍摄装置或其多个分区的子集的图像。信号(例如,图像)可从单个微室、微室阵列或多个微室阵列同时收集。可通过微流体装置的主体、通过微流体装置的薄膜或两者来收集信号。微流体装置的主体可以是基本上光学透明的。备选地,微流体装置的主体可以是基本上光学不透明的。类似地,薄膜可以是基本上光学透明的。备选地,微流体装置的主体可以是基本上光学不透明的。
[0123]
可在任何有用的时间并以任何有用的频率从微流体装置或其多个分区的子集收集信号。例如,可在用试剂或样品填充微流体装置之前收集信号(例如,图像)。还可在用试剂或样品填充微流体装置期间收集信号。备选地或附加地,可在用试剂或样品填充微流体装置之后收集信号。例如,可收集信号以验证试剂或样品的分区。还可在反应(例如,核酸扩增反应)期间收集信号以监测反应的产物(例如,扩增产物)。类似地,可在装置或其多个分区的子集的受控加热期间(例如,在高分辨率熔解分析期间)收集信号。可以以指定的间隔如在指定的时间点收集信号。备选地或附加地,可拍摄微流体装置或其多个分区的子集的视频。指定的间隔可包括在反应期间至少每300秒、至少每240秒、至少每180秒、至少每120秒、至少每90秒、至少每60秒、至少每30秒、至少每15秒、至少每10秒、至少每5秒、至少每4秒、至少每3秒、至少每2秒、至少每1秒或更频繁地收集信号(例如,拍摄图像)。如本文所述,还可响应于来自处理器的指令收集信号。
[0124]
本文所述的涉及使用微流体装置的方法可包括扩增来自样品的多个核酸分子。微流体装置可填充有一种或多种扩增试剂,如核酸分子、扩增反应所必需的组分(例如,引物、聚合酶和脱氧核糖核苷酸)、指示物分子和扩增探针。如本文所述,扩增反应可涉及对多个微室或其子集进行热循环。可通过从微流体装置的多个微室或其子集收集信号(例如,成像)来进行核酸扩增的检测。可通过计数核酸分子在其中成功扩增的微室并应用泊松统计来对核酸分子进行定量。还可通过处理在整个扩增反应中的不同时间点收集的信号来对核酸分子进行定量。例如,可在核酸扩增反应的每个热循环(例如,每个扩增循环)期间收集一个或多个信号,并且该信号可用于确定在例如在实时或定量聚合酶链反应(实时pcr或qpcr)中的扩增速率。核酸扩增和定量可在单个整合单元,例如,在装置的给定分区或多个分区的子集内进行。
[0125]
可使用多种核酸扩增反应来扩增样品中的核酸分子,从而生成扩增产物。核酸靶标的扩增可以是线性的、指数式的或其组合。核酸扩增方法的非限制性实例包括引物延伸、聚合酶链反应、逆转录、等温扩增、连接酶链反应、解旋酶依赖性扩增、不对称扩增、滚环扩增和多重置换扩增。扩增反应的扩增产物可为dna或rna。对于包含dna分子的样品,可采用
任何dna扩增方法。dna扩增方法包括但不限于pcr、实时pcr、装配pcr、不对称pcr、数字pcr、拨出pcr、解旋酶依赖性pcr、巢式pcr、热启动pcr、反向pcr、甲基化特异性pcr、微引物pcr、多重pcr、重叠-延伸pcr、热不对称交错pcr、递降pcr和连接酶链反应。dna扩增可以是线性的、指数式的或其任意组合。如本文所述,还可以用数字pcr(dpcr)、实时定量pcr(qpcr)或定量数字pcr(qdpcr)实现dna扩增。
[0126]
核酸扩增所必需的试剂可包括聚合酶、反向引物、正向引物和扩增探针。聚合酶的实例包括但不限于核酸聚合酶、转录酶或连接酶(即,催化键形成的酶)。聚合酶可以是天然存在的或合成的。聚合酶的实例包括dna聚合酶、rna聚合酶、热稳定聚合酶、野生型聚合酶、修饰的聚合酶、大肠杆菌(e.coli)dna聚合酶i、t7 dna聚合酶、噬菌体t4dna聚合酶、φ29(phi29)dna聚合酶、taq聚合酶、tth聚合酶、tli聚合酶、pfu聚合酶、pwo聚合酶、vent聚合酶、deepvent聚合酶、ex-taq聚合酶、la-taw聚合酶、sso聚合酶、poc聚合酶、pab聚合酶、mth聚合酶、es4聚合酶、tru聚合酶、tac聚合酶、tne聚合酶、tma聚合酶、tca聚合酶、tih聚合酶、tfi聚合酶、platinum taq聚合酶、tbr聚合酶、tfl聚合酶、pfutubo聚合酶、pyrobest聚合酶、kod聚合酶、bst聚合酶、sac聚合酶、具有3’至5’外切核酸酶活性的klenow片段聚合酶,及其变体、修饰产物和衍生物。对于热启动聚合酶,可能需要在约92℃至95℃的温度下进行约2分钟至10分钟的变性步骤。
[0127]
核酸扩增反应可包括扩增探针。扩增探针可为序列特异性寡核苷酸探针。当与扩增产物杂交时,扩增探针可为光学活性的。扩增探针可仅在核酸扩增进行时可检测。从包括核酸分子的多个分区收集的信号(例如,光信号)的强度可与分区中包含的扩增产物的量成比例。例如,从特定的分区收集的信号可与该特定的分区中的扩增产物的量成比例。探针可与本文所述的任何光学活性可检测部分(例如,染料)连接,并且还可包括能够阻断相关联的染料的光学活性的猝灭物。可用作可检测部分的探针的非限制性实例包括taqman探针、taqman tamara探针、taqman mgb探针、lion探针、锁定核酸探针或分子信标。可用于阻断探针的光学活性的猝灭物的非限制性实例包括black hole猝灭物(bhq)、iowa black fq和rq猝灭物、或者internal zen猝灭物。备选地或附加地,探针或猝灭物可以是可用于本公开内容的方法的上下文中的任何已知探针。
[0128]
扩增探针可为双标记荧光探针。双标记探针可包含与核酸连接的荧光报道分子和荧光猝灭物。荧光报道分子和荧光猝灭物可紧邻彼此定位。紧邻的荧光报道分子和荧光猝灭物可阻断荧光报道分子的光学活性。双标记探针可与待扩增的核酸分子结合。在扩增期间,荧光报道分子和荧光猝灭物可被聚合酶的外切核酸酶活性切割。从扩增探针切割荧光报道分子和猝灭物可使荧光报道分子重新获得其光学活性并能够被检测。双标记荧光探针可包括激发波长最大值为约450纳米(nm)、500nm、525nm、550nm、575nm、600nm、625nm、650nm、675nm、700nm或更高且发射波长最大值为约500nm、525nm、550nm、575nm、600nm、625nm、650nm、675nm、700nm或更高的5’荧光报道分子。双标记荧光探针还可包含3’荧光猝灭物。荧光猝灭物可猝灭约380nm至550nm之间、390nm至625nm之间、470nm至560nm之间、480nm至580nm之间、550nm至650nm之间、550nm至750nm之间或620nm至730nm之间的荧光发射波长。
[0129]
在装置的微室内进行的核酸扩增反应可包括微流体装置的微室或其子集的热循环。热循环可包括通过对微流体装置施加加热或冷却来控制微流体装置的温度。加热或冷
却方法可包括电阻加热或冷却、辐射加热或冷却、传导加热或冷却、对流加热或冷却或其任意组合。热循环可包括将微室在足够高以使核酸分子变性的温度下温育一段时间,然后将微室在延伸温度下温育延伸持续时间的循环。热循环还可包括将微室在足以使引物退火至核酸分子的温度下在退火温度下温育退火持续时间的循环。变性温度可根据例如特定的核酸样品、所用的试剂和所需的反应条件而变化。变性温度可为约80℃至约110℃。变性温度可为约85℃至约105℃。变性温度可为约90℃至约100℃。变性温度可为约90℃至约98℃。变性温度可为约92℃至约95℃。变性温度可为至少约80℃、至少约81℃、至少约82℃、至少约83℃、至少约84℃、至少约85℃、至少约86℃、至少约87℃、至少约88℃、至少约89℃、至少约90℃、至少约91℃、至少约92℃、至少约93℃、至少约94℃、至少约95℃、至少约96℃、至少约97℃、至少约98℃、至少约99℃、至少约100℃或更高。
[0130]
变性的持续时间可根据例如特定的核酸样品、所用的试剂和所需的反应条件而变化。变性的持续时间可为小于或等于约300秒、240秒、180秒、120秒、90秒、60秒、55秒、50秒、45秒、40秒、35秒、30秒、25秒、20秒、15秒、10秒、5秒、2秒或1秒。备选地,变性的持续时间可为不大于约120秒、90秒、60秒、55秒、50秒、45秒、40秒、35秒、30秒、25秒、20秒、15秒、10秒、5秒、2秒或1秒。
[0131]
延伸温度可根据例如特定的核酸样品、所用的试剂和所需的反应条件而变化。延伸温度可为约30℃至约80℃。延伸温度可为约35℃至约75℃。延伸温度可为约45℃至约65℃。延伸温度可为约55℃至约65℃。延伸温度可为约40℃至约60℃。延伸温度可为至少约35℃、至少约36℃、至少约37℃、至少约38℃、至少约39℃、至少约40℃、至少约41℃、至少约42℃、至少约43℃、至少约44℃、至少约45℃、至少约46℃、至少约47℃、至少约48℃、至少约49℃、至少约50℃、至少约51℃、至少约52℃、至少约53℃、至少约54℃、至少约55℃、至少约56℃、至少约57℃、至少约58℃、至少约59℃、至少约60℃、至少约61℃、至少约62℃、至少约63℃、至少约64℃、至少约65℃、至少约66℃、至少约67℃、至少约68℃、至少约69℃、至少约70℃、至少约71℃、至少约72℃、至少约73℃、至少约74℃、至少约75℃、至少约76℃、至少约77℃、至少约78℃、至少约79℃或至少约80℃。
[0132]
延伸时间可根据例如特定的核酸样品、所用的试剂和所需的反应条件而变化。延伸的持续时间可为小于或等于约300秒、240秒、180秒、120秒、90秒、60秒、55秒、50秒、45秒、40秒、35秒、30秒、25秒、20秒、15秒、10秒、5秒、2秒或1秒。备选地,延伸的持续时间可为不大于约120秒、90秒、60秒、55秒、50秒、45秒、40秒、35秒、30秒、25秒、20秒、15秒、10秒、5秒、2秒或1秒。
[0133]
退火温度可根据例如特定的核酸样品、所用的试剂和所需的反应条件而变化。退火温度可为约30℃至约80℃。退火温度可为约35℃至约75℃。退火温度可为约45℃至约65℃。退火温度可为约55℃至约65℃。退火温度可为约40℃至约60℃。退火温度可为至少约35℃、至少约36℃、至少约37℃、至少约38℃、至少约39℃、至少约40℃、至少约41℃、至少约42℃、至少约43℃、至少约44℃、至少约45℃、至少约46℃、至少约47℃、至少约48℃、至少约49℃、至少约50℃、至少约51℃、至少约52℃、至少约53℃、至少约54℃、至少约55℃、至少约56℃、至少约57℃、至少约58℃、至少约59℃、至少约60℃、至少约61℃、至少约62℃、至少约63℃、至少约64℃、至少约65℃、至少约66℃、至少约67℃、至少约68℃、至少约69℃、至少约70℃、至少约71℃、至少约72℃、至少约73℃、至少约74℃、至少约75℃、至少约76℃、至少约77
℃、至少约78℃、至少约79℃或至少约80℃。
[0134]
退火时间可根据例如特定的核酸样品、所用的试剂和所需的反应条件而变化。退火持续时间可为小于或等于约300秒、240秒、180秒、120秒、90秒、60秒、55秒、50秒、45秒、40秒、35秒、30秒、25秒、20秒、15秒、10秒、5秒、2秒或1秒。备选地,退火持续时间可为不大于约120秒、90秒、60秒、55秒、50秒、45秒、40秒、35秒、30秒、25秒、20秒、15秒、10秒、5秒、2秒或1秒。
[0135]
核酸扩增可包含热循环的多个循环(例如,多个扩增循环)。可执行任何合适数目的循环。执行的循环数目可为大于约5、大于约10、大于约15、大于约20、大于约30、大于约40、大于约50、大于约60、大于约70、大于约80、大于约90、大于约100个循环或更多。执行的循环数目可取决于获得可检测的扩增产物所必需的循环的数目。例如,在pcr(例如,dpcr、qpcr或qdpcr)期间检测核酸扩增所必需的循环的数目可为小于或等于约100、小于或等于约90、小于或等于约80、小于或等于约70、小于或等于约60、小于或等于约50、小于或等于约40、小于或等于约30、小于或等于约20、小于或等于约15、小于或等于约10、小于或等于约5个循环或更少。
[0136]
达到可检测量的扩增产物的时间可根据例如特定的核酸样品、所用的试剂、所用的扩增反应、所用的扩增循环数目和所需的反应条件而变化。达到可检测量的扩增产物的时间可为约120分钟或更短、90分钟或更短、60分钟或更短、50分钟或更短、40分钟或更短、30分钟或更短、20分钟或更短、10分钟或更短或者5分钟或更短。
[0137]
缓变速率(即,微室从一个温度转变成另一温度的速率)对于扩增是重要的。例如,扩增反应产生可检测量的扩增产物的温度和时间可根据缓变速率而变化。缓变速率可影响扩增期间所用的时间、温度或者时间和温度两者。缓变速率在循环之间可以是恒定的,或者在循环之间可有所变化。可基于正在处理的样品来调整缓变速率。例如,可选择最佳缓变速率以提供稳健且有效的扩增方法。
[0138]
图5图示了使用上述微流体装置采用的数字pcr过程。在步骤501中,如图3a-图3d所示,使试剂分区。在步骤502中,使试剂经受热循环以对微室中的试剂运行pcr反应。例如,可使用平板热循环仪来执行该步骤。在步骤503中,执行图像采集以确定哪些微室已成功运行pcr反应。例如,可使用三色探针检测单元来执行图像采集。在步骤504中,将泊松统计应用于计数步骤503中确定的微室,以将阳性室的原始数目转换成核酸浓度。
[0139]
用于分析多个核酸分子的方法可包括提供包含如本文所述的多个分区的装置。多个分区的至少一子集可包含多个核酸分子(例如,脱氧核糖核酸或核糖核酸分子)。多个分区的子集中的每个分区可被配置成允许气体通过至少一个屏障从分区流向分区外部的环境,所述至少一个屏障将分区与外部环境分隔开。然后可使多个分区的子集经受足以使用多个核酸分子进行核酸扩增反应的条件,以从多个核酸分子的至少一子集生成扩增产物。当多个分区的子集经受这些条件时,可在多个时间点从多个分区的子集收集信号。然后可处理从多个分区收集的信号以确定多个分区的子集中的核酸分子的数目。信号处理可在扩增反应进行时或在扩增反应完成后进行。
[0140]
使多个分区的子集经受足以进行核酸扩增反应的条件可包括热循环,如本文所述。热循环可包括变性阶段、延伸阶段和退火阶段,并且可涉及温度和持续时间的任何有用组合。可执行任何有用的热循环数目。例如,如果在扩增反应正在进行时处理信号,则控制
热循环过程的处理器可达到阈值,之后热循环被编程为停止。备选地,用户可与执行扩增和信号收集过程的系统交互,并选择在给定循环数目后结束热循环。可使用平板热循环仪或任何其他有用的温度控制装置执行热循环。
[0141]
从多个分区的子集收集信号可涉及每个热循环每个分区收集多于一个信号。例如,可在每个退火阶段期间、在每个延伸阶段期间、在每个变性阶段期间或其任何组合收集信号。或者,执行该方法的系统可被编程用于在多个预定时间点收集信号。这些时间点可均匀间隔(例如,每5秒)或根据预定模式(例如,前100秒期间每5秒,然后每20秒,或任何其他有用模式)间隔。如本文所述,收集信号可包括成像。检测器可被配置用于同时对装置的多个分区的所有子集进行成像。用于成像的检测器可检测两个或更多个波长的荧光发射。这样的检测器可能能够测量对应于不同起始核酸分子(例如,模板)的核酸扩增产物。例如,包含两种不同核酸分子的样品可暴露于两种不同的引物,每种引物包括不同的可检测标记(例如,染料或荧光探针)并且每种引物对不同的核酸分子具有特异性。不同的可检测标记可发射不同波长的荧光信号,每个波长可由相同的检测器检测。确定多个分区的子集中的核酸分子的数目可涉及确定每个分区的光强度,其与每个分区中的扩增产物的量成比例。
[0142]
如本文所述,核酸扩增反应可涉及一种或多种试剂。例如,可使用诸如引物、脱氧核糖核苷酸、缓冲液、辅因子、嵌入染料和聚合酶等试剂。可在将样品装载到装置中之前、之后或与样品同时将这些试剂装载到装置中。可使用受控的流体流动(例如,如关于图3a-图3d所述)将多个核酸分子装载到装置的多个分区中。多个分区的子集中的气体可经受从分区向外部环境的流动。例如,如本文所述,用包含核酸分子的样品装载装置或其多个分区的子集可引起通过屏障从分区除气。
[0143]
用于分析核酸分子的方法中的装置可具有本文所述的任何特征。装置的屏障可包括聚合物材料,如热塑性材料,并且可以是薄膜。屏障可以是基本上光学透明的。屏障可具有约50μm至约200μm(例如,约50μm、100μm、150μm或200μm)的厚度。该装置可包含至少一个微通道,该微通道包含至少一个入口和至少一个出口以及多个虹吸孔。多个分区的子集可通过多个虹吸孔与微通道流体连通。多个分区可包括约1,000至约20,000个分区(例如,至少约1,000、1,500、2,000、2,500、3,000、3,500、4,000、4,500、5,000、10,000、15,000或20,000个分区)。
[0144]
图11图示了上述微流体装置将采用的定量数字pcr过程。图11a示出了示例性微流体装置的分区子集的表示。在某些分区中,不存在核酸模板;在其他分区中,存在一个或多个模板。图11b图示了示例性装置的每个分区中样品的扩增动力学。如图11b所示,存在不同数目的核酸模板的分区表现出不同的扩增动力学。没有模板的分区不会扩增。另外,如果与其他分区相比存在更多模板,则分区扩增得更快。每条垂直虚线表示单个扩增循环,共五个扩增循环。虽然示出了五个循环,但可执行任何数目的循环,这取决于方法的特定特征和/或系统的配置。例如,任何给定分区中可能存在的核酸分子的数目、所用的试剂和其他反应条件可能影响所需的循环数,因为当任何给定分区中可能存在更宽范围的模板数目时可能需要更多循环来提供绝对定量。图11c图示了应用于图11b中所示的扩增动力学的qdpcr过程的结果。具体地,图11c图示了基于在图11b中所示的五个pcr扩增循环期间测量的扩增动力学计算的存在于每个分区中的核酸模板的数目。
[0145]
图16图示了使用本文所述的装置执行qdpcr的方法。在步骤1601中,装置的多个分
区或其子集装载有一种或多种试剂。可以例如如本文所述执行试剂和/或样品的装载。在一些情况下,在将薄膜置于分区上方(例如,密封装置)之前,可将试剂置于分区或装置的另一部分(例如,使用自动机械过程)中。例如,在密封装置之前,可将试剂包、泡罩包装、凝胶或其他这样的组件沉积在分区中。如本文所述,还可添加包含多个核酸分子的样品。
[0146]
在步骤1602中,可将装置装载到系统中用于执行qdpcr。例如,该装置可物理地放置在热单元诸如加热板上,并用气动夹持装置夹持就位,或者放置在分析系统的壳体中的槽、凹槽或凹陷中。对准标记和/或机械键可便于放置装置。可将装置装载到机械装载单元中,所述机械加载单元对装置进行排队以供以序列化顺序进行放置和分析。在一些情况下,在步骤1601之前执行步骤1602,并且在将装置放入分析系统内之后将试剂装载到装置中。这样的系统可包括流体流动单元和/或其他机械和流体组件用于向装置装载试剂,该组件包括如本文所述的储器、泵、阀和仪表。
[0147]
在步骤1603中,使用装载到装置的多个分区的子集中的多个核酸或其子集来执行核酸扩增反应。如本文所述,扩增反应可涉及一个或多个热循环。例如,pcr扩增反应可涉及变性阶段、退火阶段和延伸阶段。扩增循环可持续约60至180秒(例如,约150秒,在变性温度下持续30秒以及在退火/延伸温度下持续120秒)。还可采用另外的步骤和/或不同的持续时间。
[0148]
在步骤1604中,从装置的多个分区的子集中的每个分区收集信号。例如,可拍摄分区的图像并测量光信号。成像可通过例如移动光学单元以扫描热单元,通过移动热单元以扫描光学单元,或者通过移动光学单元和热单元两者以允许对装置或其多个分区的子集进行成像来进行。可一次收集整个装置的信号(例如,使用一个或多个检测器,诸如一个或多个相机,或者使用被配置用于一次从整个装置收集信号的单个检测器)或者可一次从装置的仅一部分(例如,对应于装置的多个分区的子集)收集信号。在前一种情况下,可能不需要扫描热单元和/或检测器。可在扩增期间一次或多次收集信号,以例如在每个循环期间提供扩增动力学的评估。在一些情况下,可仅在每个扩增循环后一次收集信号,以在完成扩增循环后确定已发生的扩增量。收集信号可包括对装置的多个分区的子集进行成像。可使用嵌入双链核酸的荧光染料,或通过使用仅在与互补序列反应后发荧光的猝灭dna探针进行成像。在任一情况下,可通过用适合于荧光探针的激发光源照射分区并确定哪些分区发荧光以及荧光强度来进行成像。在一些情况下,步骤1603和1604可并行执行,在核酸扩增反应(例如,热循环)期间收集信号(例如,成像)。
[0149]
在步骤1605中,基于在步骤1604中收集的信号确定装置的多个分区的子集的每个分区中的扩增动力学。通过确定扩增速率,可估计不会在多个分区的子集的每个分区中的核酸分子的原始数目。例如,在图11b中,示出了对应于五个扩增循环的分区阵列的扩增动力学。对应于阵列中每个分区的核酸分子的数目显示在图11c中,并且可通过例如测量高于背景水平的荧光量并将其与核酸分子(例如,模板)的数目相关联来确定。在这样的实例中,最初包含更多核酸分子的分区将更快地扩增并因此更早地产生可检测的荧光。荧光变得可检测的时间(例如,扩增循环)越早,分区中最初存在的模板越多。因此,存在的核酸分子的数目可通过在荧光首次变得可检测时完成或剩余的循环数目来确定。还可应用确定扩增动力学的其他方法。在每一个中,最终确定是基于所收集的信号量、检测到信号的时间和/或信号产生的增加速率的最初存在于每个分区中的模板的数目。
[0150]
在步骤1606中,通过将最初存在于多个分区的子集的每个分区中的核酸分子的数目相加来确定装置的多个分区的子集中存在的核酸分子的总数目。
[0151]
在步骤1607中,从系统卸载装置以进行qdpcr。卸载(例如,移除)装置可包括步骤1601的装载程序的镜像或不同的程序。例如,手动装载的装置可由机械装载单元自动卸载,或者可以以其他方式卸载(例如,通过真空拾取和放置系统)。然后可用另一个装置重复该过程。用于核酸样品的热力学分析的方法
[0152]
本公开内容提供了用于样品的热力学分析的方法。例如,本文所述的装置可用于高分辨率熔解(hrm)分析。用于分析多个核酸分子的方法可包括提供包含如本文所述的多个分区的装置。多个分区中的至少一个子集可包含多个核酸分子(例如,脱氧核糖核酸或核糖核酸分子)。多个分区的子集中的每个分区可被配置成允许气体通过至少一个屏障从分区流向分区外部的环境,所述至少一个屏障将分区与外部环境分隔开。然后可使多个分区的子集经受受控加热。当多个分区的子集经受这些条件时,可以例如在多个时间点从多个分区的子集收集信号。然后可处理从多个分区收集的信号以产生指示多个分区的子集中的多个核酸分子的至少一子集的熔点的数据。信号处理可在受控加热进行时或在受控加热完成之后进行。
[0153]
该方法可进一步包括在足以产生多个核酸分子作为核酸样品的扩增产物的条件下对核酸样品进行核酸扩增反应(例如,如本文所述)。可在多个分区的子集中进行扩增反应。例如,包含核酸分子的样品可在执行核酸扩增反应之前装载到多个分区的子集中。执行扩增反应可包括使用与用于执行多个分区的子集的受控加热相同的热单元(例如,加热器)来加热多个分区的子集。扩增反应可涉及一种或多种试剂,如一种或多种引物、脱氧核糖核苷酸、缓冲液、辅因子、嵌入染料和聚合酶或其任意组合。试剂可包括可检测标记,如荧光团或荧光标记。在一些情况下,在进行扩增反应之前,使核酸样品的核酸分子的至少一子集与嵌入染料接触可能是有用的。
[0154]
可以以任何有用的速率并在任何有用的温度范围内执行对装置的多个分区的子集的受控加热。例如,可从至少约25℃、约30℃、约35℃、约40℃、约45℃、约50℃、约55℃、约60℃、约65℃、约70℃、约75℃、约80℃、约85℃、约90℃或约95℃或更高的较低温度进行受控加热。可进行受控加热直到至少约35℃、约40℃、约45℃、约50℃、约55℃、约60℃、约65℃、约70℃、约75℃、约80℃、约85℃、约90℃、约91℃、约92℃、约93℃、约94℃、约95℃、约96℃、约97℃、约98℃、约99℃或约100℃或更高的较高温度。温度可以以任何有用的增量进行增加。例如,温度可以以至少约0.01℃、约0.05℃、约0.1℃、约0.2℃、约0.3℃、约0.4℃、约0.5℃、约1℃、约2℃、约3℃、约4℃、约5℃或约10℃或更高增加。受控加热还可以以不均匀间隔的温度增量发生。例如,在预期核酸分子显著熔解的范围内,温度可以以约0.1℃增加(例如,细粒度测量),并且在预期核酸分子没有显著熔解的范围内,温度可以以约1℃增加(例如,粗粒度测量)。受控加热可以以任何有用的速率进行,诸如至少约0.0001℃/秒、约0.0002℃/秒、约0.0003℃/秒、约0.0004℃/秒、约0.0005℃/秒、约0.0006℃/秒、约0.0007℃/秒、约0.0008℃/秒、约0.0009℃/秒、约0.001℃/秒、约0.002℃/秒、约0.003℃/秒、约0.004℃/秒、约0.005℃/秒、约0.006℃/秒、约0.007℃/秒、约0.008℃/秒、约0.009℃/秒、约0.01℃/秒、约0.02℃/秒、约0.03℃/秒、约0.04℃/秒、约0.05℃/秒、约0.06℃/秒、约0.07℃/秒、约0.08℃/秒、约0.09℃/秒、约0.1℃/秒、约0.2℃/秒、约0.3℃/秒、约0.4℃/
秒、约0.5℃/秒、约0.6℃/秒、约0.7℃/秒、约0.8℃/秒、约0.9℃/秒、约1℃/秒、约2℃/秒、约3℃/秒、约4℃/秒和约5℃/秒或更快。执行受控加热过程的热单元(例如,加热器)可在任何有用的持续时间内维持给定温度。例如,给定温度可维持至少约1秒、约2秒、约3秒、约4秒、约5秒、约6秒、约7秒、约8秒、约9秒、约10秒、约15秒、约20秒、约25秒、约30秒、约45秒、约60秒、约70秒、约80秒、约90秒、约100秒、约110秒、约120秒、约130秒、约140秒、约150秒、约160秒、约170秒、约180秒、约190秒、约200秒、约210秒、约220秒、约230秒、约240秒、约250秒或约300秒或更久。
[0155]
可在任何期望的时间点从多个分区的子集收集信号。例如,可至少约每1秒、约每2秒、约每3秒、约每4秒、约每5秒、约每6秒、约每7秒、约每8秒、约每9秒、约每10秒、约每20秒、约每30秒、约每45秒、约每60秒、约每70秒、约每80秒、约每90秒、约每100秒、约每110秒、约每120秒、约每130秒、约每140秒、约每150秒、约每160秒、约每170秒、约每180秒、约每190秒、约每200秒、约每210秒、约每220秒、约每230秒、约每240秒、约每250秒或约每300秒或更久收集信号。每个温度间隔可收集一次或多于一次信号。例如,可在将温度升高到下一个温度间隔之前的温度间隔末端处收集信号。收集信号可包括成像,如本文所述。处理收集的信号可包括使用信号以生成多个分区的子集中的多个核酸分子的子集的信号相对温度数据。
[0156]
在该方法中分析的多个核酸分子可衍生自含有或疑似含有病原体的样品。病原体可以是至少一种细菌。细菌可选自但不限于炭疽芽孢杆菌、蜡状芽孢杆菌、耐盐芽孢杆菌、蕈状芽孢杆菌、多粘芽孢杆菌、枯草芽孢杆菌、苏云金芽孢杆菌、头状葡萄球菌、山羊葡萄球菌、溶血葡萄球菌、人葡萄球菌、缓慢葡萄球菌、路邓葡萄球菌、腐生葡萄球菌、木糖葡萄球菌、疮疱丙酸杆菌、粪肠球菌、放线菌、α变形菌、拟杆菌、β变形菌、衣原体、ε变形菌、厚壁菌、γ变形菌、螺旋体和软壁菌。该方法可涉及另外的处理步骤以分离或提取来自细菌的核酸分子。对核酸样品进行核酸扩增反应可包括对核酸样品的核酸分子的子集的内部转录间隔区的至少一部分进行扩增。备选地或附加地,可发生核糖体rna(例如,16s)的扩增。
[0157]
用于本文所述方法的样品可以是生物样品。生物样品可包括选自血液、尿液、精液、粘液、唾液及其任意组合的体液。备选地,样品可以是环境样品,如本文所述。
[0158]
该方法可进一步包括将多个核酸分子装载到装置的多个分区中,其中在装载期间,包括多个核酸分子的多个分区的子集中的气体经受从多个分区的子集向外部环境的流动。
[0159]
用于分析核酸分子的方法的装置可具有本文所述的任何特征。装置的屏障可包括聚合物材料,如热塑性材料,并且可以是薄膜。屏障可以是基本上光学透明的。屏障可具有约50μm至约200μm(例如,约50μm、100μm、150μm或200μm)的厚度。该装置可包含至少一个微通道,该微通道包含至少一个入口和至少一个出口以及多个虹吸孔。多个分区的子集可通过多个虹吸孔与微通道流体连通。多个分区可包括约1,000至约20,000个分区(例如,约1,000、1,500、2,000、2,500、3,000、3,500、4,000、4,500、5,000、10,000、15,000或20,000个分区)。
[0160]
图22a-图22b示意性地图示了高分辨率熔解(hrm)分析。图22a图示了数字与批量hrm分析之间的差异。如顶部图所示,在数字hrm分析中,每个分区包含至多1个靶dna分子,并且分辨出不同细菌的熔解曲线。底部图示出了批量hrm分析,其中从异质样品测量单个不可区分的熔解曲线。图22b示出了包含多种不同细菌种类的混合样品的hrm曲线。来自金黄
色葡萄球菌、粪肠球菌和痤疮丙酸杆菌的不同螺旋曲线显示在顶部图中,而底部图示出了它们使用泊松统计确定分区占据的用途。
[0161]
图23a-图23e示出了各种细菌种类的hrm数据。图23a示出了89种不同细菌的16s和内部转录间隔区(its)复合物衍生的hrm曲线。值得注意的是,对应于细菌核酸分子的its区域的熔解曲线显示出比对应于16s核糖体rna的熔解曲线更宽的温度范围和更大的曲线多样性。图23b示出了杆菌属的7个不同物种的hrm曲线,图23c示出了葡萄球菌属的9个不同物种的hrm曲线,图23d显示了肺炎链球菌的5个不同物种的its hrm曲线。图23e示出了由门整理的153个不同细菌物种的its序列同源性的热图。
[0162]
图24a-图24b示意性地图示了hrm分析。图24a图示了来自用批量pcr反应扩增的包含多个人gdna和hiv原病毒dna分子的样品dna的分区。将样品分区,使得每个分区平均存在约30亿个gdna碱基对,并且hiv原病毒dna不受干扰。图24b示出了发生pcr的分区的假设hrm分析。每个图示出了对应于不同理论分区群体的温度依赖性荧光信号。最左侧的图示出了包含全部5种扩增子的分区的假设信号;中间的图示出了仅示出扩增子1、2和4的分区的假设信号;并且最右侧的图示出了仅示出扩增子2和5的分区的假设信号。用于分析样品的系统
[0163]
在一个方面,本公开内容提供了用于使用微流体装置(例如,如本文所述)分析多个核酸分子的系统。该系统可包括被配置用于接收包含多个分区的装置的支持单元。装置的多个分区的子集的每个分区被配置成允许气体通过至少一个屏障从分区流向分区外部的环境,所述屏障将多个分区的子集与外部环境分隔开。该系统还可包括被配置成在多个时间点从装置的多个分区的子集收集信号的检测器。该系统还可包括可操作地耦合到检测器的一个或多个计算机处理器。一个或多个计算机处理器可被单独地或共同地编程用于使多个分区的子集经受如本文所述的足以使用多个核酸分子进行核酸扩增反应的条件,以从多个核酸分子的至少一子集生成扩增产物。一个或多个计算机处理器还可被编程用于,当扩增反应进行时接收由检测器在多个时间点从多个分区的子集收集的信号。信号可被收集并存储在检测器中并在给定时间发送到处理器,或者可在信号收集时提供给处理器。一个或多个计算机处理器可被编程用于引导来自多个分区的子集的信号的收集。它们还可被编程用于处理收集的信号以确定多个分区的子集中的核酸分子的数目。该系统可进一步包括被配置用于将多个核酸分子引导至多个分区的流体流动单元(例如,气动单元)。一个或多个计算机处理器可被单独地或共同地编程用于引导流体流动单元将多个核酸分子装载到多个分区中。
[0164]
本公开内容还提供了用于使用微流体装置(例如,如本文所述)来分析含有或疑似含有多个核酸分子的样品的系统。这样的分析可涉及核酸分子(如样品中的dna)的解离特征的热力学评估。热力学评估可包括确定dna的熔点和dna分子的单个链的结合强度。
[0165]
如上所述,该系统可包含支持单元和检测器。该系统还可包含被配置用于使多个分区的子集经受受控加热的热单元。该系统还可包含可操作地耦合到检测器的一个或多个计算机处理器。一个或多个计算机处理器可被单独地或共同地编程用于引导热单元使多个分区的子集经受受控加热。一个或多个计算机处理器还可被编程用于在多个分区的子集经受受控加热的同时接收由检测器从多个分区的子集收集的信号。它们还可被编程用于处理收集的信号以生成指示多个分区的子集的熔点的数据。该系统可进一步包括被配置用于将
多个核酸分子引导至多个分区的流体流动单元(例如,气动单元)。一个或多个计算机处理器可被单独地或共同地编程用于引导流体流动单元将多个核酸分子装载到多个分区中。
[0166]
该系统可包括支持单元,如被配置用于保持一个或多个微流体装置的传送台、平台、槽或凹槽。微流体装置可包括具有入口和出口的微通道、通过多个虹吸孔连接到微通道的多个微室以及封盖或覆盖微流体装置的薄膜(例如,热塑性薄膜)。该设备可包括与微流体装置流体连通的气动单元。气动单元可将试剂装载到微流体装置中并将试剂分区到微室中。该系统可包含多个微室热连通的热单元。热单元可控制微室的温度并使微室进行热循环。该系统可包含用于从装置的微室或其子集收集信号的检测器。检测器可以是能够对多个微室成像的光学单元。该系统还可包含其耦合到支持单元、气动单元、热单元和检测器(例如,光学单元)的一个或多个计算机处理器。一个或多个计算机处理器可被编程用于(i)引导气动单元将试剂装载到微流体装置中并将试剂分区到多个微室中,(ii)引导热单元使多个微室进行热循环,以及(iii)引导检测器(例如,光学单元)从多个微室收集信号(例如,图像)。
[0167]
支持单元可被配置用于输入微流体装置、保持微流体装置和输出微流体装置。支持单元可在一个或多个坐标中静止。备选地或附加地,支持单元可以能够在x方向、y方向、z方向或其任意组合中移动。支持单元可以能够保持单个微流体装置。备选地或附加地,支持单元可以能够保持至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或更多个微流体装置。
[0168]
气动单元可被配置成与微流体装置的入口和出口流体连通。气动单元可具有能够与多个入口和多个出口连接的多个连接点。气动单元可以能够一次对单个微室阵列进行填充、回填和分区,或者串联地对多个微室阵列进行填充、回填和分区。气动单元可进一步包括真空单元。气动单元可向微流体装置提供增加的压力或者向微流体装置提供真空。
[0169]
热单元可被配置成与微流体装置的微室热连通。热单元可被配置用于控制单个微室阵列的温度或控制多个微室阵列的温度。热控制单元可在所有微室阵列上执行相同的热程序,或者可对不同的微室阵列执行不同的热程序。热单元可被配置用于执行热循环和受控加热两者。备选地,系统可包含多个热单元,每个热单元被配置用于执行单独的热过程,诸如热循环和受控加热。
[0170]
检测器可被配置用于从装置的多个分区的全部或子集收集信号。例如,检测器可收集光学、阻抗或任何其他有用的信号类型。检测器可以是光学单元。光学单元可被配置用于发射和检测多个波长的光。发射波长可对应于所用指示物和扩增探针的激发波长。发射光可包含具有在约450nm、500nm、525nm、550nm、575nm、600nm、625nm、650nm、675nm、700nm或其任意组合附近的最大强度的波长。检测到的光可包含具有在约500nm、525nm、550nm、575nm、600nm、625nm、650nm、675nm、700nm或其任意组合附近的最大强度的波长。光学单元可被配置用于发射一种、两种、三种、四种或更多种波长的光。光学单元可被配置用于检测一种、两种、三种、四种或更多种波长的光。一种发射光波长可对应于指示物分子的激发波长。另一种发射光波长可对应于扩增探针的激发波长。一种检测到的光波长可对应于指示物分子的发射波长。另一种检测到的光波长可对应于用于检测微室内反应的扩增探针。光学单元可被配置用于对微室的子集或微室阵列的部分进行成像。备选地或附加地,光学单元可在单个图像中对整个微室阵列进行成像。
[0171]
图6图示了用于在单个机器中执行图5的过程的机器600。机器600包含气动单元601,该气动单元601含有泵和歧管,并且可在z方向上移动,可操作以执行如图3a-图3d所述的压力施加。机器600还包含热单元602,如平板热循环仪,以使微流体装置进行热循环,从而使聚合酶链反应得以运行。机器600进一步包含光学单元603,如落射荧光光学单元,光学单元603可光学地确定微流体装置中的哪些微室已成功运行pcr反应。光学单元603可将该信息馈送到处理器604,处理器604使用泊松统计将成功微室的原始计数转换成核酸浓度。支持单元605(例如,传送台)可用于使给定的微流体装置在各个单元之间移动以及同时处理多个微流体装置。上述微流体装置与将该功能并入单个机器相结合,相对于其他dpcr的实现降低了dpcr的成本、工作流程复杂性和空间需求。
[0172]
图12a图示了根据本公开内容的一个实施方案的装置。该装置图示出包含八个独立的反应阵列,每个反应阵列可独立地填充有试剂。每个反应阵列包含20,000个单独的分区。图12b图示了装置的一个反应阵列内的分区的一部分的布置。该图示出了装载导管的蛇形路径和以装载导管为茎的待装载的分区的近视图。每个圆形形状代表单个分区,其可装载有含有零个、一个或更多个核酸模板的试剂,并且将如本文所述单独进行扩增和分析。
[0173]
图13示出了装置以及用于提供装置流体控制的气动单元的示意图。每个端口向装置1300上的八个(在本实施方案中)反应阵列之一提供流体接口。如本文所述,在每个反应阵列的入口和出口处施加的低压和高压的顺序将试剂装载到反应阵列内的分区中。气动单元1301控制这些压力的施加,并且其包括电子压力调节器1302以及至少两个阀1303和1304。可包含更多的阀(例如,以提供每个单个反应阵列单独的装载)。该装置可包含机械键以帮助在本公开内容的系统内的定向和对准(诸如装置顶部的标签1305),或者可包含视觉特征如对准标记(未示出)。
[0174]
图14a示出了用于本公开内容的实施方案的平板热循环单元。根据本公开内容的实施方案,平板热循环单元提供热控制以实现pcr扩增循环。该平板包括螺纹孔(未示出),使得气动夹具可直接安装到平板上。这允许将例如本文所述的装置夹持到平板,以供装置内包含的样品和试剂的热循环。
[0175]
图14b图示了添加了气动夹具1402的图14a的平板热循环单元1401,其中夹具打开,使得装置1403如图12a的装置可装载到热单元中。在该图中,装置1403被装载到组合的热单元/夹持系统中以供pcr扩增循环。在将装置1403装载到热单元/夹持系统中之后,可通过气动驱动施加气动压力以用气动夹具1402夹持装置并将装置保持就位。气动驱动可与上述关于图13所述的气动单元集成,或者可以是单独的气动系统。在其中气动单元集成的系统中,可将空装置置于循环单元中,并且装置可在板上保持就位的同时装载试剂。在将试剂/样品装载装置装载到系统中例如用于扩增之前,还可用单独的气动单元进行试剂和/或样品装载。
[0176]
图15图示了用于本公开内容的实施方案的完整qdpcr系统1500。系统1500包括热单元1501、光学单元1502(包括组件1502a、1502b和1502c)、气动单元1503和机械单元1504。根据本公开内容的实施方案,每个单元与其他单元合作以执行qdpcr过程。
[0177]
热单元1501提供装载有试剂和/或样品的装置或其多个分区的子集的热循环和/或受控加热。热单元1501提供使装置经受热循环和/或受控加热的能力。如本文所述,热循环可包括变性阶段、退火阶段和延伸阶段。单个pcr扩增循环可在例如约60至120秒的时间
段内发生。其他温度曲线也可用于根据本发明的实施方案的使用。例如,热单元1501可被配置用于将装置加热到允许储存pcr扩增反应的产物的保持温度而不进行进一步改变。热单元1501还可被配置用于执行受控加热,例如,以供高分辨率熔解分析,如本文所述。热单元1501可包括组件,诸如温度控制单元、温度探针、电路和任何其他有用的组件。热单元1501可包括用于支持装置的支持单元,并且可包括气动夹具1505以将装置保持到热单元1501。
[0178]
光学单元1502在扩增或受控加热期间、之前和/或之后提供装置或其多个分区的子集的成像。光学单元1502可被配置用于对每个分区进行成像,例如每个扩增循环至少1次。每个分区可更频繁地进行成像(例如,每个扩增循环2次或每个扩增循环10次),如本文所述。光学单元1502还可被配置用于在受控加热过程期间的多个时间点对每个分区进行成像。
[0179]
光学单元1502可对装置部分成像(例如,在每次成像中对分区的5
×
5网格成像)、作为整体成像或者基于每个阵列成像(例如,在单次成像中对给定阵列中的所有20,000个分区进行成像)。如果光学单元1502能够在单次成像中对整个装置成像,则可能不需要移动光学单元1502。对于部分成像,光学单元1502可被配置用于将其自身定向到装置(例如,使用机械键或对准标记),然后在装置的分区之间进行扫描。或者,光学单元1502可固定到位,且可移动热单元1501以允许光学单元1502对每个分区或分区组进行成像。光学单元1502可被配置用于使用印刷在装置上的对准标记来将其自身定向。光学单元1502可通过热单元1501的位置来定向,或者通过定位光学单元1502、热单元1501和任何相关的处理单元来定向。光学单元1502包括光源1502a、激发滤光片1502b、二向色镜1502c、发射滤光片1502d、聚焦透镜1502e和图像传感器1502f,如本文所述。
[0180]
气动单元1503提供用于装置的流体处理和/或夹持的功能。相同的气动单元1503可为装置提供流体处理/试剂装载能力,并且为安装在热单元1501上的气动夹具1505提供气动夹持功能。备选地,气动单元1503可仅为气动夹具1505提供夹持功能,并且单独的气动单元(未示出)为装置提供试剂装载。
[0181]
机械单元1504提供各种组件的机械操纵和移动。在图示的实施方案中,机械单元1504提供跨越装置的分区扫描光学单元1502的能力。在该实施方案中,机械单元1504将光学单元1502移动到下一个成像位置,允许其成像,然后重复该过程直到所有分区都已成像。该过程可根据需要重复多次,这取决于所需的扩增循环的数目和每个循环的图像数以及/或者感兴趣的受控加热过程。机械单元1504可移动热单元1501而不是光学单元1502。例如,机械单元1504可将热单元1501移动到成像位置,使得可通过光学单元1502拍摄图像,然后可再次移动热单元1501以允许对新的成像位置成像。可根据需要重复该过程。机械单元1504可提供附加功能,诸如装置的机械操作,以在执行qdpcr过程之前将装置装载到热单元1501中,或者在qdpcr过程完成之后自动将装置从热单元1501卸载。
[0182]
本公开内容的系统可包括多种情况,热单元1501、光学单元1502、气动单元1503和机械单元1504中的一种或多种可合并到同一系统中以便提供自动系统,其可同时处理多个装置,或其可允许在不同装置上依次执行不同的步骤。另外,该系统可包含处理器,以便实现由光学单元1502检测的扩增动力学的分析,或用于如上文关于本公开内容所述的其他分析功能。
[0183]
图17a-图17b示出了用于处理核酸分子的示例性系统。图17a示出了用于处理核酸
分子的整个示例性系统,包括耦合至计算机处理器1702的用户界面1701、热单元1703和相机1704。图17b示出了特写图,其图示了装置1708上方的相机1704、led发射器/散热器1705、滤光块1706和快门1707。
[0184]
本公开内容不限于本文描述的具体实施方案的范围。实际上,除了本文所述的实施方案之外,本公开内容的其他各个实施方案和修改从前述描述和附图中对于本领域普通技术人员而言将会显而易见。
[0185]
例如,虽然在dpcr应用的上下文中描述,但是可能需要填充有经由气体或其他流体分离的液体的许多分离微室的其他微流体装置可受益于热塑性薄膜的使用以允许除气从而避免气体污染,同时还提供了关于可制造性和成本方面的优势。根据本公开内容的实施方案,除了pcr之外,其他核酸扩增方法如环介导等温扩增可适于执行特定核酸序列的数字检测。微室也可用于分离单个细胞,其中虹吸孔被设计成接近待分离细胞的直径。当虹吸孔远小于血细胞的大小时,本文所述的方法可用于例如,从全血中分离血浆。用于分析核酸样品的计算机系统
[0186]
本公开内容提供了被编程用于实现本公开内容的方法的计算机控制系统。图7示出了计算机系统701,其可被编程或以其他方式被配置用于核酸样品处理和分析,包括样品分区、扩增和检测。计算机系统701可调节本公开内容的方法和系统的各个方面。计算机系统701可以是用户的电子设备或是可相对于电子设备远程定位的计算机系统。电子设备可为移动电子设备。
[0187]
计算机系统701包括中央处理单元(cpu,本文中也称为“处理器”和“计算机处理器”)705,其可以是单核或多核处理器,或者是用于并行处理的多个处理器。计算机系统701还包括存储器或存储位置710(例如,随机存取存储器、只读存储器、闪速存储器)、电子存储单元715(例如,硬盘)、用于与一个或多个其他系统通信的通信接口720(例如,网络适配器)以及外围设备725,诸如高速缓冲存储器、其他存储器、数据存储和/或电子显示适配器。存储器710、存储单元715、接口720和外围设备725通过通信总线(实线)如主板与cpu 705相通信。存储单元715可为用于存储数据的数据存储单元(或数据存储库)。计算机系统701可借助于通信接口720可操作地耦合至计算机网络(“网络”)730。网络730可为因特网、互联网和/或外联网,或可与因特网相通信的内联网和/或外联网。在一些情况下,网络730可为电信和/或数据网络。网络730可包括一个或多个计算机服务器,该计算机服务器可实现分布式计算,诸如云计算。在一些情况下,网络730可借助于计算机系统701实现对等网络,这可使与计算机系统701耦合的设备能够起到客户端或服务器的作用。
[0188]
cpu 705可执行一系列机器可读指令,该计算机可读指令可体现在程序或软件中。该指令可存储在存储位置如存储器710中。指令可针对cpu 705,该指令随后可编程或以其他方式配置cpu 705以实现本公开内容的方法。由cpu 705执行的操作的实例可包括提取、解码、执行和回写。
[0189]
cpu 705可以是电路如集成电路的一部分。系统701的一个或多个其他组件可包含在电路中。在一些情况下,该电路为专用集成电路(asic)。
[0190]
存储单元715可存储文件,诸如驱动程序、库和保存的程序。存储单元715可存储用户数据,例如,用户偏好和用户程序。在一些情况下,计算机系统701可包括一个或多个附加数据存储单元,所述附加数据存储单元位于计算机系统701外部,诸如位于通过内联网或因
特网与计算机系统701相通信的远程服务器上。
[0191]
计算机系统701可通过网络730与一个或多个远程计算机系统相通信。例如,计算机系统701可与用户(例如,服务提供商)的远程计算机系统相通信。远程计算机系统的实例包括个人计算机(例如,便携式pc)、平板或平板型pc(例如,ipad、galaxy tab)、电话、智能电话(例如,iphone、支持android的设备、)或个人数字助理。用户可经由网络730访问计算机系统701。
[0192]
如本文所述的方法可通过机器(例如,计算机处理器)可执行代码的方式来实现,该机器可执行代码存储在计算机系统701的电子存储位置上,例如存储器710或电子存储单元715上。机器可执行代码或机器可读代码可以以软件的形式提供。在使用过程中,该代码可由处理器705执行。在一些情况下,可从存储单元715检索该代码并将其存储于存储器710上以备处理器705迅速存取。在一些情况下,可排除电子存储单元715,而将机器可执行指令存储于存储器710上。
[0193]
所述代码可被预编译并配置用于由具有适于执行该代码的处理器的机器使用,或可在运行期间被编译。该代码可以以编程语言提供,可选择编程语言以使该代码能够以预编译或即时编译(as-compiled)的方式执行。
[0194]
在一个方面,本公开内容提供了包含机器可执行代码的非暂时性计算机可读介质,该机器可执行代码在由一个或多个计算机处理器执行时实现用于形成微流体装置以扩增和定量核酸样品的方法。该方法可包括:注塑热塑性塑料以产生微流体结构,该微流体结构包含至少一个微通道、多个微室和多个虹吸孔,其中该多个微室通过多个虹吸孔与至少一个微通道连接;形成至少一个入口和至少一个出口,其中该至少一个入口和该至少一个出口与至少一个微通道流体连通;以及施加热塑性薄膜以封盖微流体结构,其中热塑性薄膜对于跨越热塑性薄膜施加的压差至少部分透气。
[0195]
在另一方面,本公开内容提供了包含机器可执行代码的非暂时性计算机可读介质,该机器可执行代码在由一个或多个计算机处理器执行时实现用于分析和定量核酸样品的方法。该方法可包括以下步骤的一个或多个:提供包含多个微室的微流体装置;如本文所述(例如,使用气动或流体流动单元和一系列压差)向微流体装置填充样品和/或一种或多种试剂;循环地(例如,用于扩增反应的热循环)和/或以受控的缓变上升(例如,用于高分辨率熔解或其他热力学分析)加热装置的多个微室或其子集;在扩增反应或受控加热时或在其过程中或在这些过程完成之后,从多个微室或其子集收集信号;以及处理从多个微室收集的信号以确定多个分区的子集中的核酸分子的数目和/或产生指示对应于多个分区的子集中的多个核酸分子或其子集的熔点的数据。一个或多个处理器还可被编程用于实现用样品和/或试剂填充装置的微室或其子集的方法。该方法可包括:提供包含至少一个微通道的微流体装置,其中该至少一个微通道包含至少一个入口和至少一个出口,并且其中该微流体装置进一步包含通过多个虹吸孔与微通道连接的多个微室,以及邻近微流体装置的表面安置的热塑性薄膜,使得热塑性薄膜封盖微通道、多个微室和多个虹吸孔;向至少一个入口或至少一个出口提供试剂;通过在样品和/或试剂与微流体装置之间提供第一压差来填充微流体装置,其中第一压差使样品和/或试剂流入微流体装置;在微通道与多个微室之间施加第二压差以使样品和/或试剂移动到多个微室中,并推动多个微室内的气体通过封盖或
覆盖多个微室、多个虹吸孔和微通道的热塑性薄膜,其中第二压差大于第一压差;以及在至少一个入口与至少一个出口之间施加第三压差以将流体引入微通道而不将流体引入微室中,其中第三压差小于第二压差。
[0196]
本文提供的系统和方法的各方面,诸如计算机系统701,可在编程中体现。本技术的各个方面可被认为是“产品”或“制品”,其一般为在一种类型的机器可读介质上携带或体现的机器(或处理器)可执行代码和/或相关联数据的形式。机器可执行代码可存储在电子存储单元如存储器(例如,只读存储器、随机存取存储器、闪速存储器)或硬盘上。“存储”型介质可包括计算机的任何或全部有形存储器、处理器等,或其相关联单元或模块,诸如各种半导体存储器、磁带驱动器、磁盘驱动器等,其可在任何时间为软件编程提供非暂时性存储。该软件的全部或部分有时可通过因特网或各种其他电信网络进行通信。例如,这样的通信可使软件能够从一个计算机或处理器加载到另一计算机或处理器中,例如,从管理服务器或主机加载到应用服务器的计算机平台中。因此,可承载软件元素的另一类型的介质包括光波、电波和电磁波,诸如跨本地设备之间的物理接口、通过有线和光学陆线网络以及通过各种空中链路而使用的。携载这类波的物理元件,诸如有线或无线链路、光学链路等,也可以被认为是承载软件的介质。如本文所用的,除非限于非暂时性有形“存储”介质,否则诸如计算机或机器“可读介质”等术语是指参与向处理器提供指令以供执行的任何介质。
[0197]
因此,诸如计算机可执行代码等机器可读介质可采取许多形式,包括但不限于有形存储介质、载波介质或物理传输介质。非易失性存储介质包括例如光盘或磁盘,诸如任何计算机中的任何存储设备等,诸如可用于实现如附图中所示的数据库等。易失性存储介质包括动态存储器,诸如这样的计算机平台的主存储器。有形传输介质包括同轴缆线;铜线和光纤,包括构成计算机系统内总线的线。载波传输介质可采取电信号或电磁信号或者声波或光波的形式,诸如在射频(rf)和红外(ir)数据通信过程中生成的那些。因此,计算机可读介质的常见形式包括例如:软盘、柔性盘、硬盘、磁带、任何其他磁性介质、cd-rom、dvd或dvd-rom、任何其他光学介质、穿孔卡片纸带、任何其他具有孔洞图案的物理存储介质、ram、rom、prom和eprom、flash-eprom、任何其他存储器芯片或匣盒、传送数据或指令的载波、传送此类载波的电缆或链路、或者计算机可从中读取编程代码和/或数据的任何其他介质。这些计算机可读介质形式中的许多可涉及将一个或多个指令的一个或多个序列携带至处理器以供执行。
[0198]
计算机系统701可包括电子显示器735或与之通信,电子显示器735包含用于提供例如上皮组织的深度轮廓的用户界面(ui)740。ui的实例包括但不限于图形用户界面(gui)和基于网络的用户界面。
[0199]
本公开内容的方法和系统可通过一种或多种算法来实现。算法可在由中央处理单元705执行时通过软件实现。算法可例如调控系统或实现本文提供的方法。
[0200]
尽管本文中已经示出并描述了公开内容的优选实施方案,但对于本领域技术人员而言将会显而易见的是,此类实施方案仅以实例的方式提供。本领域技术人员在不偏离本文所述的发明的情况下现将想到许多变化、改变和替换。应当理解,本文所述的本发明实施方案的各种替代方案可用于实践本发明。以下权利要求旨在限定本发明的范围,并由此涵盖这些权利要求范围内的方法和结构及其等同项。本发明提供了包括但不限于以下实施方式:
1.一种用于分析多个核酸分子的方法,包括:(a)提供包含多个分区的装置,其中所述多个分区的至少一子集包含所述多个核酸分子,其中所述多个分区的所述至少一子集中的每个分区被配置成允许气体通过至少一个屏障从所述多个分区的所述至少一子集流向所述多个分区的所述至少一子集的外部的环境,所述屏障将所述多个分区的所述至少一子集与所述外部环境分隔开;(b)当使所述多个分区的所述至少一子集经受受控加热时,从所述多个分区的所述至少一子集收集信号;以及(c)处理在(b)中收集的所述信号,以产生指示所述多个分区的所述至少一子集中的所述多个核酸分子的至少一子集的熔点的数据。2.根据实施方式1所述的方法,进一步包括在(a)之前,在足以产生所述多个核酸分子作为核酸样品的扩增产物的条件下对所述核酸样品进行核酸扩增反应。3.根据实施方式2所述的方法,进一步包括在进行所述核酸扩增反应之前,将所述核酸样品装载到所述多个分区的所述至少一子集中。4.根据实施方式2或3所述的方法,其中所述核酸扩增反应在所述多个分区的所述至少一子集中进行。5.根据实施方式2-4中任一项所述的方法,其中对所述核酸样品进行核酸扩增反应包括扩增所述核酸样品的核酸分子的至少一子集的内部转录间隔区的至少一部分。6.根据实施方式2-5中任一项所述的方法,其中所述核酸扩增反应使用一种或多种试剂,所述一种或多种试剂选自引物、脱氧核糖核苷酸、缓冲液、辅因子、嵌入染料和聚合酶。7.根据实施方式6所述的方法,其中所述一种或多种试剂包括荧光团或荧光标记。8.根据实施方式2-7中任一项所述的方法,进一步包括在对所述核酸样品进行核酸扩增反应之前,使所述核酸样品的核酸分子的至少一子集与嵌入染料接触。9.根据实施方式1-8中任一项所述的方法,其中(b)在多个时间点执行。10.根据实施方式1-9中任一项所述的方法,其中(b)包括对所述多个分区的所述至少一子集进行成像以收集所述信号。11.根据实施方式1-10中任一项所述的方法,其中(c)中的所述处理包括使用所述信号生成针对所述多个分区的所述至少一子集中的所述多个核酸分子的所述至少一子集的信号相对温度数据。12.根据实施方式1-11中任一项所述的方法,其中所述多个核酸分子衍生自含有或疑似含有病原体的样品。13.根据实施方式12所述的方法,其中所述病原体是至少一种细菌。14.根据实施方式13所述的方法,其中所述至少一种细菌选自炭疽芽孢杆菌、蜡状芽孢杆菌、耐盐芽孢杆菌、蕈状芽孢杆菌、多粘芽孢杆菌、枯草芽孢杆菌、苏云金芽孢杆菌、头状葡萄球菌、山羊葡萄球菌、溶血葡萄球菌、人葡萄球菌、缓慢葡萄球菌、路邓葡萄球菌、腐生葡萄球菌、木糖葡萄球菌、疮疱丙酸杆菌、粪肠球菌、放线菌、α变形菌、拟杆菌、β变形菌、衣原体、ε变形菌、厚壁菌、γ变形菌、螺旋体和软壁菌。15.根据实施方式13或14所述的方法,进一步包括在(a)之前,分离或提取来自所述至少一种细菌的所述多个核酸分子或其子集。
16.根据实施方式12-15中任一项所述的方法,进一步包括使用指示熔点的所述数据来确定所述多个分区的所述至少一子集的每个分区中所述病原体的存在或不存在。17.根据实施方式12-16中任一项所述的方法,其中所述样品是生物样品。18.根据实施方式17所述的方法,其中所述生物样品包括选自血液、尿液、精液、粘液和唾液的体液。19.根据实施方式12-16中任一项所述的方法,其中所述样品是环境样品。20.根据实施方式1-19中任一项所述的方法,其中(a)进一步包括将所述多个核酸分子装载到所述多个分区中,其中在所述装载期间,使所述多个分区的所述至少一子集中的气体经受从所述多个分区的所述至少一子集向所述多个分区的所述至少一子集的外部的所述环境的流动。21.根据实施方式1-20中任一项所述的方法,其中所述屏障包括聚合物材料。22.根据实施方式21所述的方法,其中所述聚合物材料是热塑性材料。23.根据实施方式1-22中任一项所述的方法,其中所述屏障在跨越所述屏障施加的压差下是至少部分透气的。24.根据实施方式1-23中任一项所述的方法,其中所述屏障是基本上光学透明的。25.根据实施方式1-24中任一项所述的方法,其中所述屏障具有约50μm至约200μm的厚度。26.根据实施方式1-25中任一项所述的方法,其中所述装置包含至少一个微通道,所述微通道包含至少一个入口、至少一个出口和多个虹吸孔,其中所述多个分区的所述至少一子集中的每一个通过所述多个虹吸孔与所述至少一个微通道流体连通。27.根据实施方式1-26中任一项所述的方法,其中所述多个分区包括约1,000至约20,000个分区。28.根据实施方式1-27中任一项所述的方法,其中所述多个核酸分子包括脱氧核糖核酸分子。29.根据实施方式1-27中任一项所述的方法,其中所述多个核酸分子包括核糖核酸分子。30.一种用于分析多个核酸分子的方法,包括:(a)提供包含多个分区的装置,其中所述多个分区的至少一子集包含所述多个核酸分子,其中所述多个分区的所述至少一子集中的每个分区被配置成允许气体通过至少一个屏障从所述多个分区的所述至少一子集流向所述多个分区的所述至少一子集外部的环境,所述屏障将所述多个分区的所述至少一子集与所述外部环境分隔开;(b)使所述多个分区的所述至少一子集经受足以使用所述多个核酸分子进行核酸扩增反应的条件,以从所述多个核酸分子的至少一子集生成扩增产物;(c)当使所述多个分区的所述至少一子集经受(b)中的所述条件时,在多个时间点从所述多个分区的所述至少一子集收集信号;以及(d)处理所述信号以确定所述多个分区的所述至少一子集中的核酸分子的数目。31.根据实施方式30所述的方法,其中(b)中使所述多个分区的所述至少一子集经受足以进行核酸扩增反应的条件包括热循环,并且其中(c)中的所述收集信号包括在每个热循环中从所述多个分区的所述至少一子集的每个分区收集信号多于一次。
32.根据实施方式31所述的方法,其中所述热循环包括变性阶段、延伸阶段和退火阶段。33.根据实施方式31或32所述的方法,其中所述热循环使用平板热循环仪进行。34.根据实施方式30-33中任一项所述的方法,其中(b)中的所述核酸扩增反应使用选自引物、脱氧核糖核苷酸、缓冲液、辅因子、嵌入染料和聚合酶的一种或多种试剂。35.根据实施方式34所述的方法,其中所述一种或多种试剂包括荧光团或荧光标记。36.根据实施方式30-35中任一项所述的方法,其中(c)包括对所述多个分区的所述至少一子集进行成像以收集所述信号。37.根据实施方式36所述的方法,其中所述多个分区的所述至少一子集同时成像。38.根据实施方式36或37所述的方法,其中使用检测两个或更多个波长的荧光发射的检测器进行(c)。39.根据实施方式36-38中任一项所述的方法,其中(d)包括确定所述多个分区的所述至少一子集的每个分区的光强度,其中所述光强度与所述多个分区的所述至少一子集的每一个中的扩增产物的量成比例。40.根据实施方式30-39中任一项所述的方法,其中(a)进一步包括将所述多个核酸分子装载到所述多个分区中,其中在所述装载期间,使所述多个分区的所述至少一子集中的气体经受从所述多个分区的所述至少一子集向所述多个分区的所述至少一子集的外部的所述环境的流动。41.根据实施方式30-40中任一项所述的方法,其中所述屏障包括聚合物材料。42.根据实施方式41所述的方法,其中所述聚合物材料是热塑性材料。43.根据实施方式30-42中任一项所述的方法,其中所述屏障在跨越所述屏障施加的压差下是至少部分透气的。44.根据实施方式30-43中任一项所述的方法,其中所述屏障是基本上光学透明的。45.根据实施方式30-44中任一项所述的方法,其中所述屏障具有约50μm至约200μm的厚度。46.根据实施方式30-45中任一项所述的方法,其中所述装置包含至少一个微通道,所述微通道包含至少一个入口、至少一个出口和多个虹吸孔,其中所述多个分区中的所述至少一子集中的每一个通过所述多个虹吸孔与所述至少一个微通道流体连通。47.根据实施方式30-46中任一项所述的方法,其中所述多个分区包括约1,000至约20,000个分区。48.根据实施方式30-47中任一项所述的方法,其中所述多个核酸分子包括脱氧核糖核酸分子。49.根据实施方式30-47中任一项所述的方法,其中所述多个核酸分子包括核糖核酸分子。50.一种用于分析多个核酸分子的系统,包括:被配置用于接收包含多个分区的装置的支持单元,其中所述多个分区的至少一子集中的每个分区被配置成允许气体通过至少一个屏障从所述多个分区的所述至少一子集
流向所述多个分区的所述至少一子集的外部的环境,所述屏障将所述多个分区的所述至少一子集与所述外部环境分隔开;被配置用于在多个时间点从所述多个分区的所述至少一子集收集信号的检测器;以及可操作地耦合至所述检测器的一个或多个计算机处理器,其中所述一个或多个计算机处理器被单独地或共同地编程用于:(i)使所述多个分区的所述至少一子集经受足以使用所述多个核酸分子进行核酸扩增反应的条件,以从所述多个核酸分子的至少一子集生成扩增产物;(ii)当使所述多个分区的所述至少一子集经受(i)中的所述条件时,接收由所述检测器在所述多个时间点从所述多个分区的所述至少一子集收集的所述信号;以及(iii)处理所述信号以确定所述多个分区的所述至少一子集中的核酸分子的数目。51.根据实施方式50所述的系统,进一步包括被配置用于将所述多个核酸分子引导至所述多个分区的流体流动单元。52.根据实施方式51所述的系统,其中所述一个或多个计算机处理器被单独地或共同地编程以引导所述流体流动单元将所述多个核酸分子装载到所述多个分区中。53.一种用于分析多个核酸分子的系统,包括:被配置用于接收包含多个分区的装置的支持单元,其中所述多个分区的至少一子集中的每个分区被配置成允许气体通过至少一个屏障从所述多个分区的所述至少一子集流向所述多个分区的所述至少一子集的外部的环境,所述屏障将所述多个分区的所述至少一子集与所述外部环境分隔开;被配置用于使所述多个分区的所述至少一子集经受受控加热的热单元;被配置用于从所述多个分区的至少一子集收集信号的检测器;以及可操作地耦合至所述热单元和所述检测器的一个或多个计算机处理器,其中所述一个或多个计算机处理器被单独地或共同地编程用于:(i)引导所述热单元使所述多个分区的所述至少一子集经受受控加热;(ii)当所述多个分区的所述至少一子集经受受控加热时,接收由所述检测器从所述多个分区的所述至少一子集收集的所述信号;以及(iii)处理在(ii)中收集的所述信号,以产生指示所述多个分区的所述至少一子集中的所述多个核酸分子的至少一子集的熔点的数据。54.根据实施方式53所述的系统,进一步包括被配置用于将所述多个核酸分子引导至所述多个分区的流体流动单元。55.根据实施方式54所述的系统,其中所述一个或多个计算机处理器被单独地或共同地编程以引导所述流体流动单元将核酸样品或所述多个核酸分子装载到所述多个分区中。实施例1:试剂分区的证明
[0201]
使用以标准显微镜载玻片尺寸制造的微流体装置来证明试剂分区。微流体装置的总尺寸为1英寸宽,3英寸长和0.6英寸厚。该装置含有四种不同的微室阵列设计和共八个不同的微室阵列。图8a示出了八单元装置和四种阵列设计之一的放大透视图。微流体装置由
环烯烃聚合物(cop)zeonor 790r(zeon chemicals,japan)模塑,并用100μm cop薄膜zeonox zf14(zeon chemicals,japan)通过热粘合来密封。所示的放大的微流体区段具有通过虹吸孔与微室连接的蛇形微通道。微室处于网格配置。微室和微通道具有40μm的深度,虹吸孔具有10μm的深度。每个分离的微流体区段都具有入口通道和出口通道。在将膜热粘合到微流体装置的基部之前,对入口通道和出口通道机械钻孔。入口通道和出口通道的直径为1.6mm。
[0202]
图8b示出了试剂装载、微室回填和分区的荧光图像。在装载微流体装置之前,将2微升(μl)的4千道尔顿(kda)荧光素缀合的葡聚糖(sigma-aldrich,st.louis,mo)移液到入口中。然后使微流体装置与气动控制器接触。气动控制器通过向入口施加4psi的压力达3分钟来装载微流体装置的微通道。通过将入口和出口加压至10psi达20分钟来填充微室。然后通过在4psi下使空气从微流体装置的入口流动来使试剂分区,以从微通道中清除试剂。
[0203]
图20a示出了对应于一系列装置的差异病毒装载的图像。图片包括分区的图像,包括每个分区5、0.5、0.05和0.005个核酸拷贝。这些图像在热循环之后拍摄,并且使用荧光成像仪对fam和rox荧光团成像。图20b示出了使用image j和r软件对图20a中的图像的对应的泊松分析。类似地,图21示出了对应于一系列装置的差异装载的图像。图片包括分区的图像,包括每个分区10、1.0、0.1和0.01个核酸拷贝。最右侧的图示出了对应于每个装置的相应密度和分区占据。实施例2:用于dpcr的单一仪器工作流程
[0204]
用于对微流体装置中的核酸进行扩增和定量的方法可在单个仪器中进行。该仪器可以能够进行试剂分区、热循环、图像采集和数据分析。图9示出了能够进行单一仪器工作流程的原型仪器。该仪器被设计为一次容纳最多四个装置,并能够同时进行图像采集和热循环。该仪器包含用于试剂分区的气动单元、用于温度控制和热循环的热单元、用于成像的光学单元、以及扫描单元。光学单元具有两种荧光成像能力,并且能够检测大约520nm和600nm的荧光发射,其分别对应于fam和rox荧光团的发射波长。光学单元具有25mm
×
25mm的视场,并且数值孔径(na)为0.14。
[0205]
可使用成熟的qpcr测定,利用taqman探针作为报道分子来测试单一仪器工作流程。简言之,将核酸样品与pcr试剂混合。pcr试剂包含正向引物、反向引物、taqman探针和rox指示物。正向引物的序列为5
’‑
gcc tca ata aag ctt gcc ttg a-3’。反向引物的序列为5
’‑
ggg gcg cac tgc tag aga-3’。taqman探针的序列为5
’‑
[fam]-cca gag tca cac aac aga cgg gca ca-[bhq1]-3’。按照上述方案,将核酸样品和pcr试剂装载到微流体装置内并分区。通过以下方式进行pcr扩增:将微室的温度升高至95℃并保持温度10分钟,然后进行40个以下循环:将微室的温度以每秒2.4℃的速率从95℃缓变至59℃,在59℃下保持1分钟,然后将温度恢复到95℃。图10a-图10d示出了在pcr扩增后每个分区含有约一个核酸模板拷贝和每个分区含有零个核酸模板拷贝(无模板对照或ntc)的分区的样品的荧光图像,以及pcr扩增后每个分区含有约一个核酸拷贝和ntc分区的样品的荧光强度图。图10a示出了不含核酸模板的分区样品的荧光图像,每个灰点代表含有pcr试剂的单个微室。通过以约575nm的光激发每个微室内的rox指示物并对发射光谱进行成像来获取该图像,该发射光谱具有约600nm的最大发射。图10b示出了在pcr扩增后每个分区含有约一个核酸模板拷贝的分区样品。在pcr扩增后,成像示出了含有rox指示物的微室和同时含有rox指示物和fam
探针发射的微室。fam探针具有约495nm的激发波长和最大约520nm的发射波长。单个微室含有rox指示物、fam探针和bhq-1猝灭物。与图10a相同,每个灰点代表包含无核酸模板的分区样品的微室。白点代表含有已成功扩增的核酸样品的微室。在成功pcr扩增后,可从taqman探针切割fam荧光团和bhq-1猝灭物,从而产生可检测的荧光信号。图10c和图10d分别示出了经分区的和扩增的微流体装置的每个微室的fam荧光强度相对于rox荧光强度的2维散点图。图10c示出了每个分区含有零个核酸模板的样品,从而导致fam荧光强度在rox荧光强度范围内主要恒定。图10d示出了每个分区含有约一个核酸模板拷贝的样品,从而导致fam荧光强度由于分区内存在扩增信号而随着rox荧光强度变化。实施例3:qdpcr
[0206]
使用已知的pcr试剂盒制备两种试剂混合物,第一种试剂混合物的靶标量是第二种的10倍。将试剂装载到两个相邻的装置单元中,并使用现成的控制器和定制接口夹具气动制备。然后移取装置(1708)并将其定位在图17a-图17b的系统内。装置1708通过一块玻璃保持在标准平板热循环仪1703上,以实现良好的热接触。使用标准96-61℃x40 pcr方案使装置1708热循环40次。在每个循环的低温步骤(61℃)期间(循环11-40),使用相机1704自动拍摄图像。图像显示在图18中,其中第一列中的图像在第20个循环处拍摄,第二列中的图像在第30个循环处拍摄,第三列中的图像在第40个循环处拍摄。顶行图像对应于以每个分区10个拷贝的比率装载,而底行对应于每个分区1个拷贝。使用自定义imagej插件来提取30个循环的图像中每个的10倍图像集的53个选定点的平均强度数据。这些数据绘制在图19中,并针对背景变化进行归一化。实施例4:hrm分析
[0207]
使用已知的试剂盒制备两种试剂混合物,第一种试剂混合物的靶标量是第二种的10倍。将试剂装载到两个相邻的装置单元中,并使用现成的控制器和定制接口夹具气动制备。然后移取装置(1708)并将其定位在图17a-图17b的系统内。装置1708通过一块玻璃保持在标准平板热循环仪1703上,以实现良好的热接触。使用标准96-61℃x40 pcr方案使装置1708热循环40次以完成dpcr步骤。当热单元1703以约0.1℃/s的速率将温度从约60℃升高到约90℃时,相机1704连续地每5秒对装置成像。图像显示在图25中,其中第一列中的图像在约70℃下拍摄,第一列中的图像在约80℃下拍摄,第三列中的图像在约90℃下拍摄。顶行图像对应于以每个分区10个拷贝的比率装载,而底行对应于每个分区1个拷贝。使用自定义imagej插件来提取10倍图像集的每个图像中的54个选定点的平均强度数据。这些数据绘制在图26中。
[0208]
尽管本文中已经示出并描述了本发明的优选实施方案,但对于本领域技术人员而言将会显而易见的是,这些实施方案仅以示例的方式提供。说明书中提供的具体实例并非旨在限制本发明。尽管已经参考前述说明书描述了本发明,但对本文实施方案的描述和说明并不意味着以限制性的意义来解释。本领域技术人员在不偏离本发明的情况下现将想到多种变化、改变和替换。此外,应当理解,本发明的所有方面并不限于本文阐述的具体描述、配置或相对比例,其取决于多个条件和变量。应当理解,本文所述的本发明实施方案的各种替代方案均可用于实践本发明。因此,本发明还考虑到应当涵盖任何这样的替代、修改、变化或等同项。以下述权利要求旨在限定本发明的范围,并由此涵盖这些权利要求范围内的方法和结构及其等同项。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。