1.本发明属于农产品深加工技术领域,尤其涉及一种蓝莓多糖的绿色分离纯化方法及应用。
背景技术:
2.蓝莓(vacciniμmμliginosμm),又称越桔或蓝浆果,属杜鹃花科(ericaceae)越桔属(vacciniμmspp.)落叶灌木植物,其果成熟后为蓝色,果味酸甜细腻,蓝莓中含有非常丰富的营养成分,被誉为“世界浆果之王”,果实中含有丰富的花青素、多糖、维生素、膳食纤维、蛋白质、脂肪、va、ve、sod等营养元素,其中蓝莓中花青素含量较高,花青素和多糖是蓝莓的主要功能性物质,花青素因具有独特的生理活性而被广泛研究。蓝莓果实中含有的活性物质具有抗衰老、缓解视疲劳、改善记忆力、抗氧化、抗癌症等功效。
3.蓝莓除了含有大量的花青素以外还含有大量的多糖,提取蓝莓花青素的同时也会附加提取蓝莓多糖,蓝莓花青素中的蓝莓多糖会影响蓝莓花青素干燥,降低蓝莓花青素纯度,从蓝莓花青素粗提物中分离蓝莓多糖,既提高了蓝莓原材料的利用率,也获得了除了蓝莓花青素外的活性物质蓝莓多糖。
4.近年来对蓝莓的研究不断深入,现代药理学研究表明蓝莓多糖具有抗氧化、抗肿瘤、抗衰老、增强免疫、降低胆固醇等功效。目前,关于蓝莓有效成分提取的公开文献有一些,例如:
5.1、专利申请cn201910501440.8,公开了一种蓝莓花青素高选择性分离方法,包括如下步骤:(1)高选择性分离材料研制,利用表面修饰技术,制备对蓝莓花青素具有高选择性分离材料;(2)分离材料应用,基于制备的高选择性分离材料,利用柱色谱技术,纯化蓝莓提取物,制备高纯度花青素及蓝莓多糖。该方法可促进蓝莓资源开发利用和产业化生产,为蓝莓高值化、综合开发提供技术支撑。
6.2、专利申请cn201510954307.x,公开了一种蓝莓渣粗多糖的制备方法,该蓝莓渣粗多糖的制备方法包括的以下步骤:准备原料、热水处理两次、复合酶解处理、浓缩处理、脱色处理、醇析处理及冷干处理。本发明适当结合传统水提法及新技术复合酶解法,合理改进,既减少了多糖损失,相应的提高了提取率,又提高了多糖纯度,方便了后续多糖纯化过程,还具有工艺条件温和、低能耗、高效率的特点。
7.3、专利申请cn201510942429.7,公开了一种利用蓝莓植物茎叶制备多种组合提取物的方法,以蓝莓新鲜或干燥枝叶为原料,通过粗碎预处理,采用超声波或微波辅助进行乙醇提取,水提,酶水解,及大孔树脂吸附、膜分离等组合联提工艺,分步制备蓝莓原花青素、绿原酸、多糖等活性成分组合提取物。本发明适应原料范围较宽,生产过程物料循环利用,工艺绿色环保,资源利用率高,生产成本低,产品品质好。
8.4、专利申请cn201510470256.3,公开了一种提取蓝莓果实多种活性成分的方法,包括:将干燥粉碎的蓝莓果皮渣先酶水解,然后微波提取,固液离心分离,微孔滤袋精滤,合并滤液;滤液用超滤膜脱色除杂,再膜分离,将截留液真空浓缩,醇沉,干燥得蓝莓多糖提取
物;将超滤透析液上大孔树脂过柱吸附,再用乙醇洗脱解析,解析液纳滤膜分离、浓缩,截留液真空浓缩,冷冻干燥,得蓝莓花青素与原花青素组合提取物;将纳滤膜透析液过反渗透膜进一步分离脱水,截留液真空浓缩,喷雾干燥,得蓝莓鞣花酸提取物。本发明一种工艺可得蓝莓多糖、原花青素、花青素及鞣花酸等多种有效成分,提取物纯度较高,质量好,生产工艺绿色节能环保。
9.但是,现有技术提取得到的蓝莓多糖杂质较多,且分离纯化过程会加入大量有机物,分离纯化方法比较复杂,分离纯化后产品还会有有机物残留,且得到的蓝莓多糖纯度不高,影响产品品质。
技术实现要素:
10.本发明为解决上述技术问题,提供了一种蓝莓多糖的绿色分离纯化方法及应用。
11.为了能够达到上述所述目的,本发明采用以下技术方案:
12.一种蓝莓多糖的绿色分离纯化方法,包括以下步骤:
13.(1)样品分离:将蓝莓花青素粗提物通过大孔树脂进行湿法上柱,静置吸附,然后用蒸馏水洗脱,采用苯酚-硫酸法进行多糖检测,直至洗脱溶液无糖组分流出,再将蓝莓多糖洗脱液进行浓缩,获得蓝莓多糖浸膏;
14.(2)醇沉:用热蒸馏水将步骤(1)的蓝莓多糖浸膏溶解,然后在搅拌状态下加入乙醇,静置过夜后,过滤,收集沉淀;
15.(3)除杂:先用热蒸馏水将步骤(2)的沉淀溶解成多糖溶液,然后用活性炭对溶液脱色,离心过滤,得多糖上清液,再用木瓜蛋白酶对多糖上清液脱蛋白,离心过滤,取上清液,得到蓝莓多糖半成品;
16.(4)纯化:将步骤(3)的蓝莓多糖半成品湿法上样于deae-cellμlosede-52型大孔树脂,用四种不同浓度的溶液通过柱层析色谱法进行梯度洗脱,分别收集各流分,利用苯酚-硫酸法跟踪检测洗脱液,直至无糖分流出,然后将各流分分别用蒸馏水进行透析,透析袋内液分别减压浓缩并真空冷冻干燥,得到fr-a1、fr-a2、fr-a3、fr-a4四种分离纯化的蓝莓多糖。
17.进一步地,在步骤(1),所述蓝莓花青素粗提物与树脂的质量按照1:30湿法上柱,洗脱时间为60~65min;浓缩的温度为63~68℃。
18.进一步地,在步骤(2),所述蒸馏水的温度为60~65℃;乙醇的质量分数为90%;所述静置过夜的温度为4℃;过滤是常压过滤。
19.进一步地,在步骤(3),所述活性炭与多糖溶液的质量比=1:1,脱色时间为120~130min。
20.进一步地,在步骤(3),所述无色多糖溶液与木瓜蛋白酶的质量比=50000~50500:1,脱蛋白的温度为50~55℃,时间为120~130min。
21.进一步地,在步骤(3),所述离心过滤的转速为8000~8500r/min,离心时间为5min。
22.进一步地,在步骤(4),所述四种不同浓度的溶液分别是浓度为0mol/l、0.1mol/l、0.3mol/l、0.5mol/l的nacl溶液。
23.进一步地,在步骤(4),所述梯度洗脱时溶液的流速为1.8~2.2ml/h。
24.进一步地,在步骤(4),所述减压浓缩的温度为50℃;所述真空冷冻干燥的温度为-55~-50℃,真空度为0~100pa。
25.进一步地,一种如上述所述的绿色分离纯化方法制得的蓝莓多糖在制备抗氧化药物、保健品或食品中的应用。
26.一、分离纯化后蓝莓多糖含量的测定
27.采用苯酚-硫酸法检测分离纯化后蓝莓多糖(样品),其原理在于多糖大分子在浓硫酸加入水中的迅速高温下,脱水生成糖醛及其衍生物。
28.标准曲线的制备:称取烘干恒重的葡萄糖配制成0.1mg/ml的葡萄糖标准品母液,分别稀释成0.005mg/ml、0.015mg/ml、0.025mg/ml、0.035mg/ml、0.045mg/ml,取1ml样品加入6%苯酚1ml,再缓慢加入5ml浓硫酸反应,摇匀混合液,静置10min冷却后测定溶液在波长490nm下吸光度(因苯酚和浓硫酸有颜色,需取1ml水加入6%苯酚1ml,再缓慢加入5ml浓硫酸做空白样),以葡萄糖浓度绘制曲线,得到回归方程y=11.21x 0.002,r2=0.999,其中y为各吸光值,x为葡萄糖的浓度(mg/ml)。
29.分离纯化后的蓝莓多糖的含量测定:称取样品配置成5mg/ml的样品溶液,取样品溶液20μl于试管中,加蒸馏水补足1ml,随后向试管中加入1ml、6%的苯酚溶液和5ml浓硫酸,摇匀后静置10min,于490nm处测定吸光值,每个样测三次平行,将吸光值均值带入回归方程中计算出样品中葡萄糖的含量。蓝莓多糖得率,计算公式如下:
[0030][0031]
式中:c是蓝莓多糖浓度(mg/ml),v是待测样品体积(ml),n是稀释倍数,m是蓝莓花青素粗提物的质量(g)。
[0032]
选取五个实验进行测定,实验结果如下表1所示。
[0033]
表1
[0034]
样品编号蓝莓多糖得率(%)11.5821.6231.6441.6851.62
[0035]
二、蓝莓多糖抗氧化性研究
[0036]
1.检测样品:将从蓝莓花青素分离出的原始蓝莓粗多糖,以及通过分离纯化后的蓝莓多糖fr-a1、fr-a2、fr-a3、fr-a4四各组分,分别配置成5mg/ml的溶液,待用。
[0037]
2.多糖组分的体外抗氧化性测定
[0038]
①
对
·
oh清除率测定
[0039]
采用水杨酸显色法,在此测定中的
·
oh由h2o2和fe
2
反应(fenton反应)产生,如在此混合反应体系中加入水杨酸,水杨酸便会捕捉由fenton反应产生的
·
oh并发生颜色反应,此有色物质在510nm处有最大吸收。若
·
oh被清除水杨酸与
·
oh的颜色反应便会受阻,从而反应体系的吸光值就会有变化,因此可借此来评价某物质抗氧化性的能力。称取各部分备试样品125mg,用蒸馏水溶解并定容至25ml,配制成5mg/ml的样品溶液,用时再以此浓
度配制成所需浓度。反应体系为1ml、9mmol/lfeso4,1ml、9mmol/lh2o2,1ml、9mmol/l水杨酸,1ml蒸馏水,1ml不同浓度的被试样品溶液。反应混合物共5ml,将其摇匀后置于37℃恒温水浴锅中加热反应30min,后于510nm处测定混合体系的吸光值(a1),用1ml的蒸馏水代替反应体系中的水杨酸测得样品本底吸光值(a2),用1ml的蒸馏水代替反应体系中的样品测得空白吸光值(a0)。以vc作为阳性对照,其测定方法相同。每个质量浓度做三个平行,最终值取三次的平均值,清除率计算式如下:
[0040]
·
oh清除率/%=[1-(a1-a2)/a0]
×
100
ꢀꢀ
(1)
[0041]
②
对dpph
·
清除能力测定
[0042]
此测定方法参照sμnhaihong等的方法,准确称取适量的dpph
·
粉末配制成0.1mmol/l的dpph
·
乙醇溶液,定容于棕色容量瓶中,此溶液应在临用前现配。dpph
·
在有机溶剂中显紫色,该有色物质在517nm处有最大吸收。当具有抗氧化活性的物质在溶液中提供的氢原子与dpph
·
的单个电子成对时,紫色的dpph
·
溶液便会变为黄色,此时溶液中dpph
·
被清除,在该波长下的吸收便会发生变化从而导致吸光值发生变化,因此可借此来评价某物质抗氧化活性的强弱。将质量浓度为5mg/ml的各被试样品用蒸馏水稀释到所需质量浓度。反应体系由2ml不同浓度的各试样品溶液,2ml、0.1mmol/ldpph
·
溶液和1ml蒸馏水组成。将反应组合摇匀后置于25℃。
[0043]
恒温水浴锅中避光加热反应15min,后于517nm处测定混合体系的吸光值(a1),用2ml的蒸馏水代替2ml的dpph
·
溶液其余相同,测得样品的本底吸光值(a2),用2ml的蒸馏水代替2ml的样品其余相同,测得空白吸光值(a0)。以vc作为阳性对照其他操作相同。清除率计算式如下:
[0044]
dpph
·
清除率/%=[1-(a1-a2)/a0]
×
100
ꢀꢀ
(2)
[0045]
③
对fe
3
总还原力测定
[0046]
物质对fe
3
的还原能力是评价物质抗氧化活性能力强弱的重要指标之一,某些具有还原性的物质通过发生氧化反应来保护其他物质从而达到抗氧化的目的。本实验测定采用铁氰化钾显色法来对高粱根提取物的还原能力进行测定。称取各部分试样品50mg用蒸馏水溶解并定容至25ml,配制成2mg/ml的样品溶液。将浓度为2mg/ml的各被试样品稀释到所需浓度。取各不同浓度被试样品0.5ml,加入ph6.6的pbs缓冲液1ml及1%的铁氰化钾溶液1ml,摇匀后于50℃恒温水浴锅中加热反应30min。加热结束后急速冷却并加入10%的三氯乙酸溶液1ml,充分混匀后3500rpm离心10min,取上清液1ml并加入0.1%的三氯化铁溶液1ml,随后加入4ml的蒸馏水。混匀后于700nm处测定反应体系的吸光值(a1),以1ml的蒸馏水代替不同浓度的试样品其他操作相同测定空白吸光值(a0)。以vc作阳性对照其他操作相同测定吸光值。以(a1-a0)来衡量提取物还原能力的强弱,还原力的强弱与吸光值的大小成正相关。
[0047]
3.测定结果
[0048]
测定结果如下表2所示。
[0049]
表2
[0050]
样品
·
oh清除率(%)dpph
·
清除能力(%)fe
3
总还原力(%)原始粗多糖45.2148.2630.15fr-a174.5370.1746.61
fr-a260.4962.6940.12fr-a355.7453.1633.83fr-a450.1352.3833.19
[0051]
实验结果显示,经本发明方法分离纯化得到的多糖组分fr-a1、fr-a2、fr-b3、fr-a4,均具有优于粗多糖抗氧化作用,表明本发明制备的各组分相对于蓝莓原始粗多糖均具有更优的抗氧化能力,尤其是fr-a1组分的抗氧化能力最佳。
[0052]
三、蓝莓多糖抗抑郁活性研究
[0053]
分别取蓝莓多糖醇沉的沉淀和上清溶液,然后进行体外抗抑郁活性评价研究,步骤如下:
[0054]
①
小鼠的分组、给药与造模
[0055]
将小鼠正常饲养7d后,对其进行分组、标记并称体重。分别将雌、雄各分为15组,分别为:正常对照组、氟西汀(10mg
·
kg
-1
)组、蓝莓粗提物(200、600、800mg
·
kg
-1
)组、蓝莓提取物30%乙醇部位组、蓝莓提取物50%乙醇部位组、蓝莓提取物70%乙醇部位组、蓝莓粗多糖醇沉上清组、蓝莓粗多糖醇沉沉淀组,除正常组、氟西汀组和蓝莓粗体物组外,其余各组均分为100、200、300mg
·
kg
-1
剂量组,每组10只。7d后开始造模,参照文献制备小鼠慢性不可预测应激抑郁模型。除正常组外,交替给予每组小鼠以下刺激:悬尾6min、强迫游泳(水温25℃)6min、禁食24h、禁水24h、潮湿饲养(100g垫料加200ml水)12h、冰水刺激(水温0~5℃)6min、束缚12h、倾斜鼠笼30
°
并12h、24h全黑、昼夜颠倒。同一刺激3d内不重复,避免小鼠产生适应性。连续刺激21d后,给药组按剂量给予相应浓度的药物,正常对照组和抑郁组给予等量蒸馏水,每天1次。给药7、14、21d后进行测试。
[0056]
②
蓝莓多糖对小鼠体重的影响。
[0057]
分别对0d、造模21d以及给药7、14、21d后小鼠测量体重,观察比较分析小鼠体重变化。
[0058]
③
蓝莓多糖对小鼠糖水偏好的影响
[0059]
糖水偏爱实验反映抑郁症动物的快感缺失症状。刺激结束禁食、禁水12h后,同时给予每只小鼠预先定量好的1%庶糖水和自来水各一瓶,6h后更换两管的位置,避免小鼠产生位置偏爱,小鼠自由饮水12h后,收取庶糖水管和自来水管并称重。计算:
[0060]
糖水偏爱率=蔗糖水饮用量/(蔗糖水饮用量 自来水饮用量)
×
100%。
[0061]
④
蓝莓多糖对小鼠悬尾不动时间的影响
[0062]
悬尾实验是研究抗抑郁的经典模型之一。将小鼠倒挂在一个无法逃出的铁架台上,可诱导小鼠出现不动状态,用于反应抑郁症动物的行为绝望被悬挂的小鼠为克服不正常体位倒挂会进行试图恢复正常体位的挣扎活动,挣扎一段时间后小鼠会出现短时间的四肢和身体都无挣扎行为的状态,称为不动状态。通过检测实验中小鼠出现挣扎后的不动行为的累积时长,评估小鼠的抑郁行为状态。造模21d后,于第7、14、21天末次ig给药30min后,将小鼠用皮筋拴住尾巴将其固定在铁架台的横杆上,使小鼠头部呈向下的悬挂状态。其头部与平台面之间的距离为15cm,每只小鼠之间用板隔开,避免小鼠间相互干扰。悬尾实验共进行6min前2min为适应时间,记录第2分钟末到第6分钟末,小鼠不动状态的累计时间。
[0063]
⑤
蓝莓多糖对小鼠游泳不动时间的影响
[0064]
强迫游泳实验(forcedswimmingtest,fst)是目前最常用的抗抑郁症动物模型。将
小鼠放在一个局限的无法逃出的空间里游泳,被放入局限带水空间的小鼠为了避免没入水中,使头部保持浮在水面以上,四肢不断挣扎为使头部露出水面,挣扎一段时间后小鼠会出现短时间的四肢和身体都无挣扎行为的状态呈漂浮状态,鼻孔露出水面而仅有的细小的肢体运动之外,无其他运动行为,此行为为不动状态。造模21天后,于第7、14、21天末次ig给药30min后,将小鼠置透明柱形容器(30cm
×
15cm)中,水深10cm,水温25
±
2℃,进行强迫游泳实验。测试时间为6min,前2min为适应时间,计时从第2分钟末到第6分钟末小鼠不动行为的累计时间。
[0065]
2.蓝莓多糖抗抑郁评价结果
[0066]
①
蓝莓多糖对小鼠体重的影响
[0067]
蓝莓多糖沉淀和上清溶液对小鼠体重变化的影响见表3。造模前后和给药前后,同组小鼠的体重变化不大,且与正常对照组比较无显著差异,表明造模和给药对小鼠体重的影响不显著。
[0068]
表3蓝莓多糖对小鼠体重变化影响
[0069]
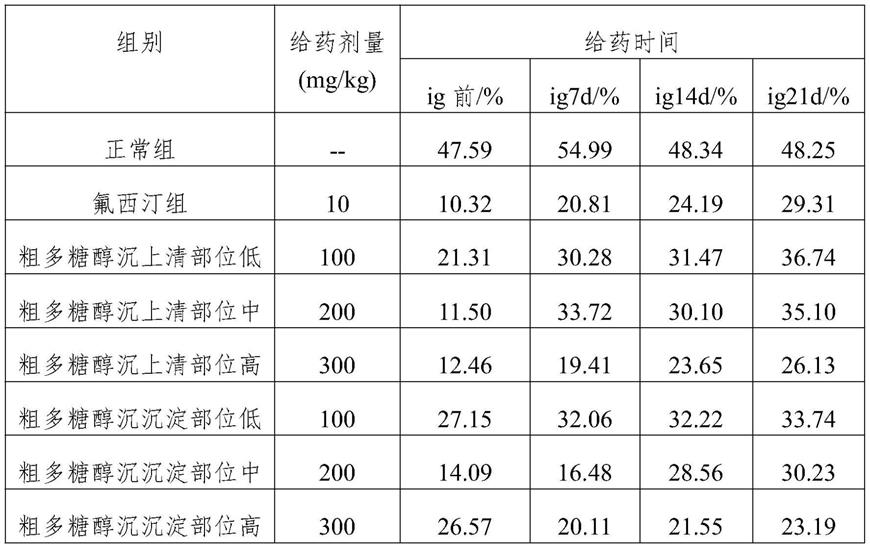
组别给药剂量(mg/kg)造模前(g)造模后(g)ig7d(g)ig14d(g)ig21d(g)正常组
‑‑
29.034.936.034.837.9氟西汀组1030.532.531.731.934.7粗多糖醇沉上清低10029.628.231.833.037.3粗多糖醇沉上清中20029.332.134.033.035.6粗多糖醇沉上清高30028.427.830.530.733.7粗多糖醇沉沉淀低10028.131.632.931.135.5粗多糖醇沉沉淀中20026.931.032.132.536.9粗多糖醇沉沉淀高30027.130.834.532.334.9
[0070]
②
蓝莓多糖对小鼠糖水偏好的影响
[0071]
蓝莓多糖沉淀和上清溶液对小鼠糖水偏好的影响见表4。与正常对照组比较,氟西汀、粗多糖醇沉上清各剂量均能显著提高小鼠的糖水偏好(p<0.05或p<0.01);其余各组的差异无统计学意义。
[0072]
表4蓝莓多糖对小鼠糖水偏好影响
[0073][0074]
③
蓝莓多糖对小鼠悬尾不动时间的影响
[0075]
蓝莓多糖对小鼠悬尾行为的影响见表5。与正常对照组比较,氟西汀、蓝莓粗提物各剂量各剂量以及粗多糖醇沉沉淀各剂量均能显著缩短小鼠悬尾的累积不动时间(p<0.05或p<0.01);其余各组比较,差异无统计学意义。
[0076]
表5蓝莓多糖对小鼠悬尾不动时间影响
[0077][0078]
④
蓝莓多糖对小鼠游泳不动时间的影响
[0079]
蓝莓各提取物对小鼠强迫游泳行为的影响见表6。与正常对照组比较,氟西汀、粗多糖醇沉沉淀各剂量均可显著缩短小鼠强迫游泳的不动时间(p<0.05或p<0.01),其余各组的差异无统计学意义。
[0080]
表6蓝莓多糖对小鼠强迫游泳时间影响
[0081][0082][0083]
由此可知,采用慢性不可预知性刺激建立小鼠抑郁模型,通过强迫游泳和悬尾实验,模型组小鼠的累积不动时间均显著高于正常对照组(p<0.05或p<0.01),说明模型建立成功。蓝莓多糖沉淀具有显著的抗抑郁作用,其有效成分主要集粗多糖醇沉上清组小鼠的糖水偏好呈上升趋势,粗多糖醇沉沉淀组小鼠的悬尾不动时间缩短,粗多糖醇沉沉淀组小鼠的游泳不动时间缩短,呈现不规律性,这可能是小鼠在缓慢恢复导致的。
[0084]
由于本发明采用了以上技术方案,具有以下有益效果:
[0085]
(1)本发明能够从蓝莓花青素中分离和纯化得到蓝莓多糖,既纯化了蓝莓花青素,又获得了蓝莓多糖,且得到的蓝莓多糖具有抗氧化的作用,为后续蓝莓多糖产品提供原料。
[0086]
(2)本技术方法分离纯化后得到的蓝莓多糖纯净度高,方法简单不复杂,分离纯化后产品没有有机物残留,产品品质得到了提高。
[0087]
(3)本技术方法分离纯化后的蓝莓多糖,经小鼠抗抑郁试验,初步确定有一定抗抑郁效果,为后续蓝莓多糖作为医药保健食品提供了理论依据。
具体实施方式
[0088]
下面对本发明的具体实施方式作进一步详细的说明,但本发明并不局限于这些实施方式,任何在本实施例基本精神上的改进或代替,仍属于本发明权利要求所要求保护的范围。
[0089]
实施例1
[0090]
一种蓝莓多糖的绿色分离纯化方法,包括以下步骤:
[0091]
(1)样品分离:将蓝莓花青素粗提物通过大孔树脂进行湿法上柱,静置吸附,然后用蒸馏水洗脱,采用苯酚-硫酸法进行多糖检测,直至洗脱溶液无糖组分流出,再将蓝莓多糖洗脱液进行浓缩,获得蓝莓多糖浸膏;所述蓝莓花青素粗提物与树脂的质量按照1:30湿法上柱,洗脱时间为60min;浓缩的温度为63℃;
[0092]
(2)醇沉:用热蒸馏水将步骤(1)的蓝莓多糖浸膏溶解,然后在搅拌状态下加入乙醇,静置过夜后,过滤,收集沉淀;所述蒸馏水的温度为60℃;乙醇的质量分数为90%;所述静置过夜的温度为4℃;过滤是常压过滤;
[0093]
(3)除杂:先用热蒸馏水将步骤(2)的沉淀溶解成多糖溶液,然后用活性炭对溶液脱色,离心过滤,得多糖上清液,再用木瓜蛋白酶对多糖上清液脱蛋白,离心过滤,取上清液,得到蓝莓多糖半成品;所述活性炭与多糖溶液的质量比=1:1,脱色时间为120min;所述无色多糖溶液与木瓜蛋白酶的质量比=50000:1,脱蛋白的温度为50℃,时间为120min;所述离心过滤的转速为8000r/min,离心时间为5min;
[0094]
(4)纯化:将步骤(3)的蓝莓多糖半成品湿法上样于deae-cellμlosede-52型大孔树脂,用四种不同浓度的溶液通过柱层析色谱法进行梯度洗脱,分别收集各流分,利用苯酚-硫酸法跟踪检测洗脱液,直至无糖分流出,然后将各流分分别用蒸馏水进行透析,透析袋内液分别减压浓缩并真空冷冻干燥,得到fr-a1、fr-a2、fr-a3、fr-a4四种分离纯化的蓝莓多糖;所述四种不同浓度的溶液分别是浓度为0mol/l、0.1mol/l、0.3mol/l、0.5mol/l的nacl溶液;所述梯度洗脱时溶液的流速为1.8~2.2ml/h;所述减压浓缩的温度为50℃;所述真空冷冻干燥的温度为-55℃,真空度为10pa。
[0095]
一种如上述所述的绿色分离纯化方法制得的蓝莓多糖在制备抗氧化药物、保健品或食品中的应用。
[0096]
实施例2
[0097]
一种蓝莓多糖的绿色分离纯化方法,包括以下步骤:
[0098]
(1)样品分离:将蓝莓花青素粗提物通过大孔树脂进行湿法上柱,静置吸附,然后用蒸馏水洗脱,采用苯酚-硫酸法进行多糖检测,直至洗脱溶液无糖组分流出,再将蓝莓多糖洗脱液进行浓缩,获得蓝莓多糖浸膏;所述蓝莓花青素粗提物与树脂的质量按照1:30湿法上柱,洗脱时间为65min;浓缩的温度为68℃;
[0099]
(2)醇沉:用热蒸馏水将步骤(1)的蓝莓多糖浸膏溶解,然后在搅拌状态下加入乙醇,静置过夜后,过滤,收集沉淀;所述蒸馏水的温度为65℃;乙醇的质量分数为90%;所述静置过夜的温度为4℃;过滤是常压过滤;
[0100]
(3)除杂:先用热蒸馏水将步骤(2)的沉淀溶解成多糖溶液,然后用活性炭对溶液脱色,离心过滤,得多糖上清液,再用木瓜蛋白酶对多糖上清液脱蛋白,离心过滤,取上清液,得到蓝莓多糖半成品;所述活性炭与多糖溶液的质量比=1:1,脱色时间为130min;所述无色多糖溶液与木瓜蛋白酶的质量比=50500:1,脱蛋白的温度为55℃,时间为130min;所述离心过滤的转速为8500r/min,离心时间为5min;
[0101]
(4)纯化:将步骤(3)的蓝莓多糖半成品湿法上样于deae-cellμlosede-52型大孔树脂,用四种不同浓度的溶液通过柱层析色谱法进行梯度洗脱,分别收集各流分,利用苯酚-硫酸法跟踪检测洗脱液,直至无糖分流出,然后将各流分分别用蒸馏水进行透析,透析袋内液分别减压浓缩并真空冷冻干燥,得到fr-a1、fr-a2、fr-a3、fr-a4四种分离纯化的蓝莓多糖;所述四种不同浓度的溶液分别是浓度为0mol/l、0.1mol/l、0.3mol/l、0.5mol/l的nacl溶液;所述梯度洗脱时溶液的流速为2.2ml/h;所述减压浓缩的温度为50℃;所述真空冷冻干燥的温度为-55℃,真空度为100pa。
[0102]
一种如上述所述的绿色分离纯化方法制得的蓝莓多糖在制备抗氧化药物、保健品或食品中的应用。
[0103]
实施例3
[0104]
一种蓝莓多糖的绿色分离纯化方法,包括以下步骤:
[0105]
(1)样品分离:将蓝莓花青素粗提物通过大孔树脂进行湿法上柱,静置吸附,然后用蒸馏水洗脱,采用苯酚-硫酸法进行多糖检测,直至洗脱溶液无糖组分流出,再将蓝莓多糖洗脱液进行浓缩,获得蓝莓多糖浸膏;所述蓝莓花青素粗提物与树脂的质量按照1:30湿法上柱,洗脱时间为61min;浓缩的温度为64℃;
[0106]
(2)醇沉:用热蒸馏水将步骤(1)的蓝莓多糖浸膏溶解,然后在搅拌状态下加入乙醇,静置过夜后,过滤,收集沉淀;所述蒸馏水的温度为61℃;乙醇的质量分数为90%;所述静置过夜的温度为4℃;过滤是常压过滤;
[0107]
(3)除杂:先用热蒸馏水将步骤(2)的沉淀溶解成多糖溶液,然后用活性炭对溶液脱色,离心过滤,得多糖上清液,再用木瓜蛋白酶对多糖上清液脱蛋白,离心过滤,取上清液,得到蓝莓多糖半成品;所述活性炭与多糖溶液的质量比=1:1,脱色时间为122min;所述无色多糖溶液与木瓜蛋白酶的质量比=50100:1,脱蛋白的温度为51℃,时间为122min;所述离心过滤的转速为8100r/min,离心时间为5min;
[0108]
(4)纯化:将步骤(3)的蓝莓多糖半成品湿法上样于deae-cellμlosede-52型大孔树脂,用四种不同浓度的溶液通过柱层析色谱法进行梯度洗脱,分别收集各流分,利用苯酚-硫酸法跟踪检测洗脱液,直至无糖分流出,然后将各流分分别用蒸馏水进行透析,透析袋内液分别减压浓缩并真空冷冻干燥,得到fr-a1、fr-a2、fr-a3、fr-a4四种分离纯化的蓝莓多糖;所述四种不同浓度的溶液分别是浓度为0mol/l、0.1mol/l、0.3mol/l、0.5mol/l的nacl溶液;所述梯度洗脱时溶液的流速为1.9ml/h;所述减压浓缩的温度为50℃;所述真空冷冻干燥的温度为-54℃,真空度为20pa。
[0109]
一种如上述所述的绿色分离纯化方法制得的蓝莓多糖在制备抗氧化药物、保健品或食品中的应用。
[0110]
实施例4
[0111]
一种蓝莓多糖的绿色分离纯化方法,包括以下步骤:
[0112]
(1)样品分离:将蓝莓花青素粗提物通过大孔树脂进行湿法上柱,静置吸附,然后用蒸馏水洗脱,采用苯酚-硫酸法进行多糖检测,直至洗脱溶液无糖组分流出,再将蓝莓多糖洗脱液进行浓缩,获得蓝莓多糖浸膏;所述蓝莓花青素粗提物与树脂的质量按照1:30湿法上柱,洗脱时间为64min;浓缩的温度为67℃;
[0113]
(2)醇沉:用热蒸馏水将步骤(1)的蓝莓多糖浸膏溶解,然后在搅拌状态下加入乙醇,静置过夜后,过滤,收集沉淀;所述蒸馏水的温度为64℃;乙醇的质量分数为90%;所述静置过夜的温度为4℃;过滤是常压过滤;
[0114]
(3)除杂:先用热蒸馏水将步骤(2)的沉淀溶解成多糖溶液,然后用活性炭对溶液脱色,离心过滤,得多糖上清液,再用木瓜蛋白酶对多糖上清液脱蛋白,离心过滤,取上清液,得到蓝莓多糖半成品;所述活性炭与多糖溶液的质量比=1:1,脱色时间为128min;所述无色多糖溶液与木瓜蛋白酶的质量比=50400:1,脱蛋白的温度为54℃,时间为128min;所述离心过滤的转速为8400r/min,离心时间为5min;
[0115]
(4)纯化:将步骤(3)的蓝莓多糖半成品湿法上样于deae-cellμlosede-52型大孔树脂,用四种不同浓度的溶液通过柱层析色谱法进行梯度洗脱,分别收集各流分,利用苯酚-硫酸法跟踪检测洗脱液,直至无糖分流出,然后将各流分分别用蒸馏水进行透析,透析袋内液分别减压浓缩并真空冷冻干燥,得到fr-a1、fr-a2、fr-a3、fr-a4四种分离纯化的蓝
莓多糖;所述四种不同浓度的溶液分别是浓度为0mol/l、0.1mol/l、0.3mol/l、0.5mol/l的nacl溶液;所述梯度洗脱时溶液的流速为2.1ml/h;所述减压浓缩的温度为50℃;所述真空冷冻干燥的温度为-51℃,真空度为80pa。
[0116]
一种如上述所述的绿色分离纯化方法制得的蓝莓多糖在制备抗氧化药物、保健品或食品中的应用。
[0117]
实施例5
[0118]
一种蓝莓多糖的绿色分离纯化方法,包括以下步骤:
[0119]
(1)样品分离:将蓝莓花青素粗提物通过大孔树脂进行湿法上柱,静置吸附,然后用蒸馏水洗脱,采用苯酚-硫酸法进行多糖检测,直至洗脱溶液无糖组分流出,再将蓝莓多糖洗脱液进行浓缩,获得蓝莓多糖浸膏;所述蓝莓花青素粗提物与树脂的质量按照1:30湿法上柱,洗脱时间为603min;浓缩的温度为65℃;
[0120]
(2)醇沉:用热蒸馏水将步骤(1)的蓝莓多糖浸膏溶解,然后在搅拌状态下加入乙醇,静置过夜后,过滤,收集沉淀;所述蒸馏水的温度为63℃;乙醇的质量分数为90%;所述静置过夜的温度为4℃;过滤是常压过滤;
[0121]
(3)除杂:先用热蒸馏水将步骤(2)的沉淀溶解成多糖溶液,然后用活性炭对溶液脱色,离心过滤,得多糖上清液,再用木瓜蛋白酶对多糖上清液脱蛋白,离心过滤,取上清液,得到蓝莓多糖半成品;所述活性炭与多糖溶液的质量比=1:1,脱色时间为125min;所述无色多糖溶液与木瓜蛋白酶的质量比=50300:1,脱蛋白的温度为53℃,时间为125min;所述离心过滤的转速为8300r/min,离心时间为5min;
[0122]
(4)纯化:将步骤(3)的蓝莓多糖半成品湿法上样于deae-cellμlosede-52型大孔树脂,用四种不同浓度的溶液通过柱层析色谱法进行梯度洗脱,分别收集各流分,利用苯酚-硫酸法跟踪检测洗脱液,直至无糖分流出,然后将各流分分别用蒸馏水进行透析,透析袋内液分别减压浓缩并真空冷冻干燥,得到fr-a1、fr-a2、fr-a3、fr-a4四种分离纯化的蓝莓多糖;所述四种不同浓度的溶液分别是浓度为0mol/l、0.1mol/l、0.3mol/l、0.5mol/l的nacl溶液;所述梯度洗脱时溶液的流速为2.0ml/h;所述减压浓缩的温度为50℃;所述真空冷冻干燥的温度为-53℃,真空度为50pa。
[0123]
一种如上述所述的绿色分离纯化方法制得的蓝莓多糖在制备抗氧化药物、保健品或食品中的应用。
[0124]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在没有背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同含义和范围内的所有变化囊括在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。