1.本发明涉及可用于治疗癌症的抗体、双特异性抗体等。
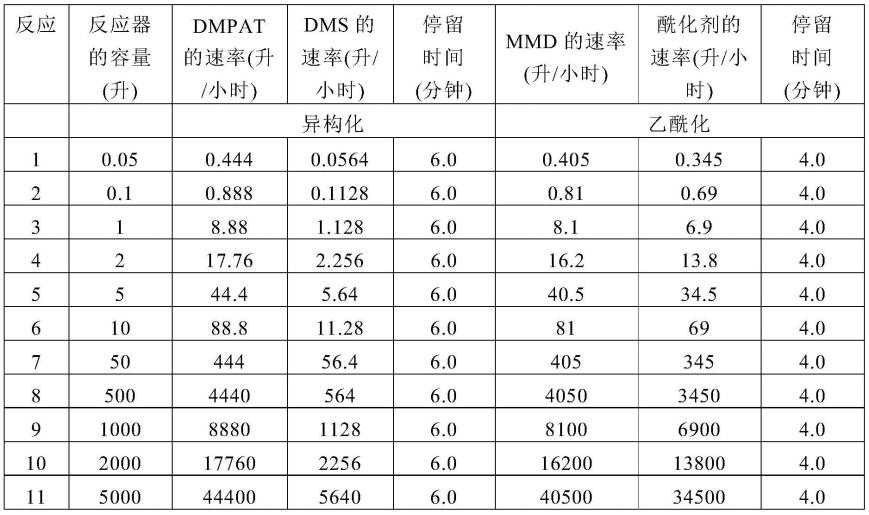
背景技术:
2.ny-eso-1是通过重组cdna表达文库的血清学分析(serological analysis of recombinant cdna expression libraries,serex)法从食道癌中鉴定出的分子(非专利文献1),lage-1的别名也叫做ny-eso-2,是通过肿瘤cdna文库的代表性差异分析(representational difference analysis)鉴定出的分子(非专利文献2)。虽然已知这些分子在正常组织中都仅限于在睾丸中表达,但功能尚不明确。有报告称,ny-eso-1、lage-1在黑色素瘤、肺癌、膀胱癌、卵巢癌、软组织肉瘤、骨髓瘤等种类广泛的癌症中有所表达(非专利文献3),暗示出它们与癌症的关联性。另外,关于与恶性程度的关联,有报告称ny-eso-1在黑色素瘤的转移灶的表达高于原发灶(非专利文献4);尿路上皮癌中,与早期癌症相比,ny-eso-1、lage-1在中期癌症的表达较高(非专利文献5);ny-eso-1在存在染色体异常的高风险骨髓瘤中的表达高于染色体正常的骨髓瘤(非专利文献6)。由这些信息可以看出,ny-eso-1和lage-1作为癌症特异性高的分子受到关注,作为癌症疫苗疗法的药物发现目标正在进行大量研发,但目前为止尚无得到认可的药物。
3.已知ny-eso-1、lage-1的第157位至第165位的9-mer的ny-eso肽sllmwitqc会与hla(histocompatibility leukocyte antigen,组织相容性白细胞抗原)-a2形成复合物(hla/ny-eso肽复合物),向细胞外提呈(非专利文献7)。如上所述,由于ny-eso-1、lage-1的表达是癌症特异性的表达,因此暗示hla/ny-eso肽复合物是仅在hla-a2阳性且ny-eso-1或lage-1阳性的癌细胞上存在的癌症特异性的治疗目标(非专利文献8)。而且,作为与hla/ny-eso肽复合物结合的分子,报告了tcr(专利文献1、2)和抗体(专利文献3、专利文献8)。
4.作为针对癌症靶分子的结合分子的用途之一,有cd3双特异性(bispecific)抗体(非专利文献9、10),它的机理是将t细胞向癌细胞诱导,从而显示细胞毒性引发的抗肿瘤效果的t细胞重定向。作为目前上市的cd3双特异性抗体药物,可举出作为针对cd19的bite(bispecfic t-cell engager,双特异性t细胞衔接器)的博纳吐单抗(blinatumomab)。它在急性淋巴细胞白血病(all)中得到认可,而以其他血液癌为对象的临床试验正在进行。但是,与通常用作治疗用抗体的igg型抗体相比,作为双特异的抗体构型而没有fc区域的串联scfv(tafv)向患者施用时的血液中半衰期非常短(非专利文献11)。
5.作为具有血液中半衰期与igg型抗体程度相同的异二聚体fc区域的双特异性(bispecific)抗体,使用了knobs-into-holes、crossmab、duobody(注册商标)等(专利文献4、5、6、7)各种抗体构型的cd3双特异性抗体的研究和临床试验正在进行当中,报告了利用了针对hla/ny-eso肽复合物的抗体的cd3双特异性抗体(非专利文献12)。
6.现有技术文献
7.专利文献
8.专利文献1:wo2005/113595
9.专利文献2:wo2017/109496
10.专利文献3:wo2010/106431
11.专利文献4:wo1998/050431
12.专利文献5:wo2006/106905
13.专利文献6:wo2011/028952
14.专利文献7:wo2011/131746
15.专利文献8:wo2021/003357
16.非专利文献
17.非专利文献1:proc natl acad sci u s a.;94(5):1914-8(1997).
18.非专利文献2:int j cancer.;76(6):903-8(1998).
19.非专利文献3:immunol cell biol.;84(3):303-17(2006).
20.非专利文献4:j surg res.;98(2):76-80(2001).
21.非专利文献5:cancer res.;61(12):4671-4(2001).
22.非专利文献6:blood.;105(10):3939-44(2005).
23.非专利文献7:j exp med.;187(2):265-70(1998).
24.非专利文献8:j immunol.;176(12):7308-16(2006).
25.非专利文献9:nature;314(6012);628-31(1985).
26.非专利文献10:int rev immunol.;4(2);159-73(1989).
27.非专利文献11:drug des devel ther.;10;757-765(2016).
28.非专利文献12:第21回
がん
免疫学会抄録集;o13-4
技术实现要素:
29.【发明所要解决的问题】
30.本发明的目的在于提供能够用作抗肿瘤剂的新型抗hla-a2/ny-eso抗体,以及含有包括该抗体等的与hla-a2/ny-eso结合的分子作为有效成分的抗肿瘤剂。
31.【用于解决问题的技术方案】
32.本发明人为了解决上述问题而进行了潜心研究,创造出新型抗hla-a2/ny-eso抗体,以及包括该抗体等的与hla-a2/ny-eso结合的分子,从而完成了本发明。
33.即,本发明包含如下内容。
34.[1]一种与人hla/ny-eso特异性结合的抗体或其结合片段,所述抗体或其结合片段含有:
[0035]
由seq id no:54所示的氨基酸序列组成的重链cdrh1;
[0036]
由seq id no:55所示的氨基酸序列组成的重链cdrh2;
[0037]
由seq id no:56所示的氨基酸序列组成的重链cdrh3;
[0038]
由seq id no:57所示的氨基酸序列组成的轻链cdrl1,或者由seq id no:57所示的氨基酸序列中第7位氨基酸为w和/或第8位氨基酸为k的氨基酸序列组成的轻链cdrl1;
[0039]
由seq id no:58所示的氨基酸序列组成的轻链cdrl2;以及,
[0040]
由seq id no:59所示的氨基酸序列组成的轻链cdrl3,或者由seq id no:59所示的氨基酸序列中第2位氨基酸为a或s的氨基酸序列组成的轻链cdrl3。
[0041]
[2]根据[1]所述的抗体或其结合片段,所述抗体或其结合片段含有选自由以下(i)~(v)的组组成的组的1个或2个以上的组的cdrh1~cdrh3和cdrl1~cdrl3:
[0042]
(i)由seq id no:54所示的氨基酸序列组成的重链cdrh1;
[0043]
由seq id no:55所示的氨基酸序列组成的重链cdrh2;
[0044]
由seq id no:56所示的氨基酸序列组成的重链cdrh3;
[0045]
由seq id no:57所示的氨基酸序列组成的轻链cdrl1;
[0046]
由seq id no:58所示的氨基酸序列组成的轻链cdrl2;以及,
[0047]
由seq id no:59所示的氨基酸序列组成的轻链cdrl3;
[0048]
(ii)由seq id no:54所示的氨基酸序列组成的重链cdrh1;
[0049]
由seq id no:55所示的氨基酸序列组成的重链cdrh2;
[0050]
由seq id no:56所示的氨基酸序列组成的重链cdrh3;
[0051]
由seq id no:57所示的氨基酸序列中第7位氨基酸为w的氨基酸序列组成的轻链cdrl1;
[0052]
由seq id no:58所示的氨基酸序列组成的轻链cdrl2;以及,
[0053]
由seq id no:59所示的氨基酸序列组成的轻链cdrl3;
[0054]
(iii)由seq id no:54所示的氨基酸序列组成的重链cdrh1;
[0055]
由seq id no:55所示的氨基酸序列组成的重链cdrh2;
[0056]
由seq id no:56所示的氨基酸序列组成的重链cdrh3;
[0057]
由seq id no:57所示的氨基酸序列组成的轻链cdrl1;
[0058]
由seq id no:58所示的氨基酸序列组成的轻链cdrl2;以及,
[0059]
由seq id no:59所示的氨基酸序列中第2位氨基酸为a的氨基酸序列组成的轻链cdrl3;
[0060]
(iv)由seq id no:54所示的氨基酸序列组成的重链cdrh1;
[0061]
由seq id no:55所示的氨基酸序列组成的重链cdrh2;
[0062]
由seq id no:56所示的氨基酸序列组成的重链cdrh3;
[0063]
由seq id no:57所示的氨基酸序列组成的轻链cdrl1;
[0064]
由seq id no:58所示的氨基酸序列组成的轻链cdrl2;以及,
[0065]
由seq id no:59所示的氨基酸序列中第2位氨基酸为s的氨基酸序列组成的轻链cdrl3;以及,
[0066]
(v)由seq id no:54所示的氨基酸序列组成的重链cdrh1;
[0067]
由seq id no:55所示的氨基酸序列组成的重链cdrh2;
[0068]
由seq id no:56所示的氨基酸序列组成的重链cdrh3;
[0069]
由seq id no:57所示的氨基酸序列中第7位氨基酸为w,第8位氨基酸为k的氨基酸序列组成的轻链cdrl1;
[0070]
由seq id no:58所示的氨基酸序列组成的轻链cdrl2;以及,
[0071]
由seq id no:59所示的氨基酸序列组成的轻链cdrl3。
[0072]
[3]根据[1]所述的抗体或其结合片段,所述抗体或其结合片段含有重链可变区和轻链可变区,所述重链可变区由seq id no:27所示的氨基酸序列的氨基酸编号21~140的氨基酸序列,或与seq id no:38或seq id no:39所示的氨基酸序列具有95%以上序列同一
性的氨基酸序列组成;所述轻链可变区由seq id no:27或seq id no:52所示的氨基酸序列的氨基酸编号156~266的氨基酸序列,或与seq id no:40所示的氨基酸序列具有95%以上序列同一性的氨基酸序列组成。
[0073]
[4]根据[1]所述的抗体或其结合片段,所述抗体或其结合片段含有以下重链可变区和轻链可变区:
[0074]
(h1)由seq id no:6所示的氨基酸序列组成的重链可变区;
[0075]
(h2)由seq id no:18所示的氨基酸序列组成的重链可变区;
[0076]
(h3)由seq id no:29所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0077]
(h4)由seq id no:26所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0078]
(h5)由seq id no:27所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0079]
(h6)由seq id no:28所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0080]
(h7)由seq id no:36所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0081]
(h8)由seq id no:47所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0082]
(h9)由seq id no:48所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0083]
(h10)由seq id no:50所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0084]
(h11)由seq id no:51所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0085]
(h12)由seq id no:52所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0086]
(h13)由seq id no:53所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;
[0087]
(h14)由seq id no:30所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;或者,
[0088]
(h15)由seq id no:156所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区;以及,
[0089]
(l1)由seq id no:8所示的氨基酸序列组成的轻链可变区;
[0090]
(l2)由seq id no:20所示的氨基酸序列组成的轻链可变区;
[0091]
(l3)由seq id no:29所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0092]
(l4)由seq id no:26所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0093]
(l5)由seq id no:27所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0094]
(l6)由seq id no:28所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0095]
(l7)由seq id no:36所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0096]
(l8)由seq id no:47所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0097]
(l9)由seq id no:48所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0098]
(l10)由seq id no:50所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0099]
(l11)由seq id no:51所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0100]
(l12)由seq id no:52所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0101]
(l13)由seq id no:53所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0102]
(l14)由seq id no:30所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;或者,
[0103]
(l15)由seq id no:156所示的氨基酸序列的第161位~第271位的氨基酸序列组成的轻链可变区。
[0104]
[5]根据[4]所述的抗体或其结合片段,所述抗体或其结合片段含有以下重链可变区和轻链可变区:
[0105]
(h1l1)由seq id no:6所示的氨基酸序列组成的重链可变区,和由seq id no:8所示的氨基酸序列组成的轻链可变区;
[0106]
(h2l2)由seq id no:18所示的氨基酸序列组成的重链可变区,和由seq id no:20所示的氨基酸序列组成的轻链可变区;
[0107]
(h3l3)由seq id no:29所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:29所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0108]
(h4l4)由seq id no:26所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:26所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0109]
(h5l5)由seq id no:27所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:27所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0110]
(h6l6)由seq id no:28所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:28所示的氨基酸序列的第156位~第266位的氨基酸序列组
成的轻链可变区;
[0111]
(h7l7)由seq id no:36所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:36所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0112]
(h8l8)由seq id no:47所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:47所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0113]
(h9l9)由seq id no:48所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:48所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0114]
(h10l10)由seq id no:50所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:50所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0115]
(h11l11)由seq id no:51所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:51所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0116]
(h12l12)由seq id no:52所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:52所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0117]
(h13l13)由seq id no:53所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:53所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;
[0118]
(h14l14)由seq id no:30所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:30所示的氨基酸序列的第156位~第266位的氨基酸序列组成的轻链可变区;或者,
[0119]
(h15l14)由seq id no:156所示的氨基酸序列的第21位~第140位的氨基酸序列组成的重链可变区,和由seq id no:156所示的氨基酸序列的第161位~第271位的氨基酸序列组成的轻链可变区。
[0120]
[6]根据[1]~[5]中任一项所述的抗体或其结合片段,所述抗体或其结合片段为scfv。
[0121]
[7]根据[6]所述的抗体或其结合片段,所述抗体或其结合片段为以下scfv:
[0122]
(s1)由seq id no:70所示的氨基酸序列的第21~266位的氨基酸序列组成的scfv;
[0123]
(s2)含有由seq id no:18所示的氨基酸序列组成的重链可变区和由seq id no:20所示的氨基酸序列组成的轻链可变区的scfv;
[0124]
(s3)由seq id no:29所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0125]
(s4)由seq id no:26所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0126]
(s5)由seq id no:27所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0127]
(s6)由seq id no:28所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0128]
(s7)由seq id no:36所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0129]
(s8)由seq id no:47所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0130]
(s9)由seq id no:48所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0131]
(s10)由seq id no:50所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0132]
(s11)由seq id no:51所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0133]
(s12)由seq id no:52所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0134]
(s13)由seq id no:53所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;
[0135]
(s14)由seq id no:30所示的氨基酸序列的第21位~第266位的氨基酸序列组成的scfv;或者,
[0136]
(s15)由seq id no:156所示的氨基酸序列的第21位~第271位的氨基酸序列组成的scfv。
[0137]
[8]一种多核苷酸,所述多核苷酸编码[1]~[7]中任一项所述的抗体或其结合片段。
[0138]
[9]一种载体,所述载体含有[8]所述的多核苷酸。
[0139]
[10]一种宿主细胞,所述宿主细胞含有[8]所述的多核苷酸或[9]所述的载体。
[0140]
[11]一种与人hla/ny-eso特异性结合的抗体或其结合片段的制造方法,所述方法包括:(i)培养[10]所述的宿主细胞的步骤;以及(ii)从步骤(i)得到的培养物中纯化抗体或其结合片段的步骤。
[0141]
[12]一种与人hla/ny-eso特异性结合的抗体或其结合片段,所述抗体或其结合片段通过[11]所述的方法得到。
[0142]
[13]一种与hla-a2/ny-eso结合的抗体或其结合片段,所述抗体或其结合片段具有以下(i)或(ii)所述的性质:
[0143]
(i)与[7]所述的抗体或其结合片段所识别的hla-a2/ny-eso上的位点结合;
[0144]
(ii)与[7]所述的抗体或其结合片段竞争与人hla-a2/ny-eso的结合。
[0145]
[14]一种药物组合物,所述药物组合物含有以下作为有效成分:[1]~[7]、[12]和[13]中任一项所述的抗体或其结合片段;[8]所述的多核苷酸;[9]所述的载体;或者[10]所述的细胞。
[0146]
[15]一种与人hla/ny-eso特异性结合的分子,所述分子含有[1]~[7]、[12]和
[13]中任一项所述的抗体或其结合片段。
[0147]
[16]根据[15]所述的分子,所述分子为多特异性抗体。
[0148]
[17]根据[15]所述的分子,所述分子为双特异性抗体。
[0149]
[18]根据[15]~[17]中任一项所述的分子,所述分子含有与cd3特异性结合的抗体或其结合片段。
[0150]
[19]根据[18]所述的分子,其中,与cd3特异性结合的抗体或其结合片段是含有以下链的与cd3特异性结合的抗体或其结合片段:
[0151]
(cch1)由seq id no:141所示的氨基酸序列组成的重链cdrh1;
[0152]
(cch2)由seq id no:142所示的氨基酸序列组成的重链cdrh2,或者由seq id no:142所示的氨基酸序列中第3位氨基酸为n或s的氨基酸序列组成的重链cdrh2;
[0153]
(cch3)由seq id no:143所示的氨基酸序列组成的重链cdrh3;
[0154]
(ccl1)由seq id no:144所示的氨基酸序列组成的轻链cdrl1;
[0155]
(ccl2)由seq id no:145所示的氨基酸序列组成的轻链cdrl2,或者由seq id no:145所示的氨基酸序列中第2位氨基酸为n的氨基酸序列组成的轻链cdrl2;以及,
[0156]
(ccl3)由seq id no:146所示的氨基酸序列组成的轻链cdrl3。
[0157]
[20]根据[19]所述的分子,其中,与cd3特异性结合的抗体或其结合片段含有:
[0158]
(ch1)由seq id no:136所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区;
[0159]
(ch2)由seq id no:137所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区;
[0160]
(ch3)由seq id no:147所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区;
[0161]
(ch4)由seq id no:138所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区;
[0162]
(ch5)由seq id no:139所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区;
[0163]
(ch6)由seq id no:140所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区;
[0164]
(ch7)由seq id no:155所示的氨基酸序列的第272位~第389位的氨基酸序列组成的重链可变区;
[0165]
(ch8)由seq id no:156所示的氨基酸序列的第277位~第394位的氨基酸序列组成的重链可变区;或者,
[0166]
(ch9)由seq id no:157所示的氨基酸序列的第277位~第394位的氨基酸序列组成的重链可变区;以及,
[0167]
(cl1)由seq id no:136所示的氨基酸序列的第135位~第243位的氨基酸序列组成的轻链可变区;
[0168]
(cl2)由seq id no:137所示的氨基酸序列的第135位~第241位的氨基酸序列组成的轻链可变区;
[0169]
(cl3)由seq id no:147所示的氨基酸序列的第135位~第243位的氨基酸序列组
成的轻链可变区;
[0170]
(cl4)由seq id no:138所示的氨基酸序列的第135位~第241位的氨基酸序列组成的轻链可变区;
[0171]
(cl5)由seq id no:139所示的氨基酸序列的第135位~第243位的氨基酸序列组成的轻链可变区;
[0172]
(cl6)由seq id no:140所示的氨基酸序列的第135位~第243位的氨基酸序列组成的轻链可变区;
[0173]
(cl7)由seq id no:155所示的氨基酸序列的第405位~第511位的氨基酸序列组成的轻链可变区;
[0174]
(cl8)由seq id no:156所示的氨基酸序列的第410位~第516位的氨基酸序列组成的轻链可变区;或者,
[0175]
(cl9)由seq id no:157所示的氨基酸序列的第410位~第516位的氨基酸序列组成的轻链可变区。
[0176]
[21]根据[20]所述的分子,其中,与cd3特异性结合的抗体或其结合片段含有:
[0177]
(ch1cl1)由seq id no:136所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区,和由seq id no:136所示的氨基酸序列的第135位~第243位的氨基酸序列组成的轻链可变区;
[0178]
(ch2cl2)由seq id no:137所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区,和由seq id no:137所示的氨基酸序列的第135位~第241位的氨基酸序列组成的轻链可变区;
[0179]
(ch3cl3)由seq id no:147所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区,和由seq id no:147所示的氨基酸序列的第135位~第243位的氨基酸序列组成的轻链可变区;
[0180]
(ch4cl4)由seq id no:138所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区,和由seq id no:138所示的氨基酸序列的第135位~第241位的氨基酸序列组成的轻链可变区;
[0181]
(ch5cl5)由seq id no:139所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区,和由seq id no:139所示的氨基酸序列的第135位~第243位的氨基酸序列组成的轻链可变区;
[0182]
(ch6cl6)由seq id no:140所示的氨基酸序列的第2位~第119位的氨基酸序列组成的重链可变区,和由seq id no:140所示的氨基酸序列的第135位~第243位的氨基酸序列组成的轻链可变区;
[0183]
(ch7cl7)由seq id no:155所示的氨基酸序列的第272位~第389位的氨基酸序列组成的重链可变区,和由seq id no:155所示的氨基酸序列的第272位~第389位的氨基酸序列组成的轻链可变区;
[0184]
(ch8cl8)由seq id no:156所示的氨基酸序列的第277位~第394位的氨基酸序列组成的重链可变区,和由seq id no:156所示的氨基酸序列的第410位~第516位的氨基酸序列组成的轻链可变区;或者,
[0185]
(ch9cl9)由seq id no:157所示的氨基酸序列的第277位~第394位的氨基酸序列
组成的重链可变区,和由seq id no:157所示的氨基酸序列的第410位~第516位的氨基酸序列组成的轻链可变区。
[0186]
[22]根据[18]~[21]中任一项所述的分子,其中,与cd3特异性结合的抗体或其结合片段为scfv。
[0187]
[23]根据[22]所述的分子,其中,scfv包括:
[0188]
(cs1)由seq id no:136所示的氨基酸序列的第2位~第243位的氨基酸序列组成的scfv;
[0189]
(cs2)由seq id no:137所示的氨基酸序列的第2位~第241位的氨基酸序列组成的scfv;
[0190]
(cs3)由seq id no:147所示的氨基酸序列的第2位~第243位的氨基酸序列组成的scfv;
[0191]
(cs4)由seq id no:138所示的氨基酸序列的第2位~第241位的氨基酸序列组成的scfv;
[0192]
(cs5)由seq id no:139所示的氨基酸序列的第2位~第243位的氨基酸序列组成的scfv;
[0193]
(cs6)由seq id no:140所示的氨基酸序列的第2位~第243位的氨基酸序列组成的scfv;
[0194]
(cs7)由seq id no:155所示的氨基酸序列的第272位~第511位的氨基酸序列组成的scfv;
[0195]
(cs8)由seq id no:156所示的氨基酸序列的第277位~第516位的氨基酸序列组成的scfv;或者,
[0196]
(cs9)由seq id no:157所示的氨基酸序列的第277位~第516位的氨基酸序列组成的scfv。
[0197]
[24]根据[18]~[23]中任一项所述的分子,所述分子含有第一多肽和第二多肽,所述第一多肽从n末端向c末端依次含有与人hla/ny-eso特异性结合的scfv、与cd3特异性结合的scfv以及fc区域(i);所述第二多肽含有fc区域(ii);优选地,所述分子在fc区域(i)和fc区域(ii)中缔合。
[0198]
[25]根据[24]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[1]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0199]
[26]根据[24]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[2]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0200]
[27]根据[24]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[3]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0201]
[28]根据[24]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[4]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0202]
[29]根据[24]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[5]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0203]
[30]根据[19]~[24]中任一项所述的分子,其中,与cd3特异性结合的scfv是作为scfv的[18]所述的与cd3特异性结合的抗体或其结合片段。
[0204]
[31]根据[19]~[24]中任一项所述的分子,其中,与cd3特异性结合的scfv是作为scfv的[19]所述的与cd3特异性结合的抗体或其结合片段。
[0205]
[32]根据[19]~[24]中任一项所述的分子,其中,与cd3特异性结合的scfv是作为scfv的[20]或[21]所述的与cd3特异性结合的抗体或其结合片段。
[0206]
[33]根据[19]~[24]中任一项所述的分子,其中,与cd3特异性结合的scfv是作为scfv的[23]所述的与cd3特异性结合的抗体或其结合片段。
[0207]
[34]根据[24]~[33]中任一项所述的分子,所述分子含有选自由以下氨基酸序列组成的组的氨基酸序列:seq id no:85所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:87所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:88所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:89所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:90所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:91所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:92所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:93所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:94所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:95所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:96所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:86所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:149所示的氨基酸序列的第21位~第511位的氨基酸序列,以及seq id no:150所示的氨基酸序列的第21位~第511位的氨基酸序列。
[0208]
[35]根据[24]~[33]中任一项所述的分子,所述分子含有选自由以下氨基酸序列组成的组的氨基酸序列:seq id no:155所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:156所示的氨基酸序列的第21位~第516位的氨基酸序列、seq id no:157所示的氨基酸序列的第21位~第516位的氨基酸序列。
[0209]
[36]根据[24]~[34]中任一项所述的分子,其中,第一多肽含有seq id no:85、seq id no:87、seq id no:88、seq id no:89、seq id no:90、seq id no:91、seq id no:92、seq id no:93、seq id no:94、seq id no:95、seq id no:96、seq id no:86、seq id no:149或seq id no:150所示的氨基酸序列的第529位~第745位的氨基酸序列。
[0210]
[37]根据[24]~[33]和[35]中任一项所述的分子,其中,第一多肽含有:seq id no:155所示的氨基酸序列的第529位~第745位的氨基酸序列、seq id no:156所示的氨基酸序列的第534位~第750位的氨基酸序列,或者seq id no:157所示的氨基酸序列的第534位~第750位的氨基酸序列。
[0211]
[38]根据[34]或[36]所述的分子,其中,第一多肽由选自由以下氨基酸序列组成的组的氨基酸序列组成:seq id no:85所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:87所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:88所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:89所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:90所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:91所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:92所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:93所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:94所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:95所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:96
所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:86所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:149所示的氨基酸序列的第20位~第745位的氨基酸序列,以及seq id no:150所示的氨基酸序列的第20位~第745位的氨基酸序列。
[0212]
[39]根据[35]或[37]所述的分子,其中,第一多肽由选自由以下组成的组的氨基酸序列组成:seq id no:155所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:156所示的氨基酸序列的第20位~第750位的氨基酸序列;或者,seq id no:157所示的氨基酸序列的第20位~第750位的氨基酸序列。
[0213]
[40]根据[24]~[39]中任一项所述的分子,其中,第二多肽含有seq id no:84所示的氨基酸序列的第20位~第246位的氨基酸序列。
[0214]
[41]根据[18]~[23]中任一项所述的分子,所述分子含有第一多肽、第二多肽和第三多肽,
[0215]
第一多肽从n末端向c末端依次含有与人hla/ny-eso特异性结合的scfv、与cd3特异性结合的scfv以及fc区域(i);
[0216]
第二多肽由含有fc区域(ii)的免疫球蛋白重链组成;
[0217]
第三多肽由免疫球蛋白轻链组成,
[0218]
优选地,第二多肽和第三多肽缔合,
[0219]
第一多肽和第二多肽在各自的fc区域中缔合。
[0220]
[42]根据[41]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[1]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0221]
[43]根据[41]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[2]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0222]
[44]根据[41]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[3]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0223]
[45]根据[41]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[4]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0224]
[46]根据[41]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[5]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0225]
[47]根据[42]~[46]中任一项所述的分子,其中,与cd3特异性结合的scfv是作为scfv的[18]所述的与cd3特异性结合的抗体或其结合片段。
[0226]
[48]根据[42]~[46]中任一项所述的分子,其中,与cd3特异性结合的scfv是作为scfv的[19]所述的与cd3特异性结合的抗体或其结合片段。
[0227]
[49]根据[42]~[46]中任一项所述的分子,其中,与cd3特异性结合的scfv是作为scfv的[20]或[21]所述的与cd3特异性结合的抗体或其结合片段。
[0228]
[50]根据[42]~[46]中任一项所述的分子,其中,与cd3特异性结合的scfv是作为scfv的[23]所述的与cd3特异性结合的抗体或其结合片段。
[0229]
[51]根据[41]~[50]中任一项所述的分子,其中,第二多肽含有seq id no:99所示的氨基酸序列的氨基酸编号20~242的氨基酸序列。
[0230]
[52]根据[41]~[51]中任一项所述的分子,其中,第三多肽含有seq id no:100所示的氨基酸序列。
[0231]
[53]根据[41]~[52]中任一项所述的分子,其中,第一多肽含有选自由以下氨基酸序列组成的组的氨基酸序列:seq id no:85所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:87所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:88所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:89所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:90所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:91所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:92所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:93所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:94所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:95所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:96所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:86所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:149所示的氨基酸序列的第21位~第511位的氨基酸序列,以及seq id no:150所示的氨基酸序列的第21位~第511位的氨基酸序列。
[0232]
[54]根据[41]~[53]中任一项所述的分子,其中,第一多肽由选自由以下氨基酸序列组成的组的氨基酸序列组成:seq id no:85所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:87所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:88所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:89所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:90所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:91所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:92所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:93所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:94所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:95所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:96所示的氨基酸序列的第20位~第745位的氨基酸序列和seq id no:86所示的氨基酸序列的第20位~第745位的氨基酸序列、seq id no:149所示的氨基酸序列的第20位~第745位的氨基酸序列和seq id no:150所示的氨基酸序列的第20位~第745位的氨基酸序列。
[0233]
[55]根据[18]~[23]中任一项所述的分子,所述分子含有第一多肽、第二多肽和第三多肽,所述第一多肽从n末端向c末端依次含有与人hla/ny-eso特异性结合的scfv、与cd3特异性结合的抗体重链的可变区和恒定区ch1,以及免疫球蛋白fc区域(i);所述第二多肽含有免疫球蛋白的铰链区和fc区域(ii);所述第三多肽含有由可变区和恒定区组成的抗体轻链,优选地,第一多肽和第二多肽在fc区域(i)和fc区域(ii)中缔合,第一多肽在抗体重链的可变区和恒定区ch1中与第三多肽缔合。
[0234]
[56]根据[55]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[1]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0235]
[57]根据[55]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[2]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0236]
[58]根据[55]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[3]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0237]
[59]根据[55]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv
的[4]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0238]
[60]根据[55]所述的分子,其中,与人hla/ny-eso特异性结合的scfv是作为scfv的[5]所述的与人hla/ny-eso特异性结合的抗体或其结合片段。
[0239]
[61]根据[18]~[21]中任一项所述的分子,其中,与cd3特异性结合的抗体或其结合片段为fab。
[0240]
[62]根据[56]~[61]中任一项所述的分子,其中,与cd3特异性结合的fab是作为fab的[18]所述的与cd3特异性结合的抗体或其结合片段。
[0241]
[63]根据[56]~[61]中任一项所述的分子,其中,与cd3特异性结合的fab是作为fab的[19]所述的与cd3特异性结合的抗体或其结合片段。
[0242]
[64]根据[56]~[61]中任一项所述的分子,其中,与cd3特异性结合的fab是作为fab的[20]或[21]所述的与cd3特异性结合的抗体或其结合片段。
[0243]
[65]根据[55]~[64]中任一项所述的分子,其中,第一多肽含有seq id no:160所示的氨基酸序列的第21位~第394位的氨基酸序列。
[0244]
[66]根据[55]~[65]中任一项所述的分子,其中,第一多肽含有以下(i)~(iii)中任一项所述的氨基酸序列:
[0245]
(i)seq id no:160所示的氨基酸序列的第20位~第724位的氨基酸序列;
[0246]
(ii)seq id no:197所示的氨基酸序列的第20位~第719位的氨基酸序列;
[0247]
(iii)seq id no:198所示的氨基酸序列的第20位~第719位的氨基酸序列。
[0248]
[67]根据[55]~[66]中任一项所述的分子,其中,第二多肽含有seq id no:84所示的氨基酸序列的第20位~第246位的氨基酸序列。
[0249]
[68]根据[56]~[67]中任一项所述的分子,其中,第三多肽含有seq id no:161所示的氨基酸序列的第21位~第127位的氨基酸序列。
[0250]
[69]根据[56]~[68]中任一项所述的分子,其中,第三多肽含有seq id no:161所示的氨基酸序列的第21位~第233位的氨基酸序列。
[0251]
[70]根据[15]~[69]中任一项所述的分子,在所述分子含有的一个或两个以上的多肽的氨基酸序列中,有一个或两个氨基酸从所述序列的羧基末端缺失。
[0252]
[71]一种多核苷酸,所述多核苷酸含有编码[15]~[70]中任一项所述的分子所含有的氨基酸序列的核苷酸序列。
[0253]
[72]一种载体,所述载体含有[71]所述的多核苷酸。
[0254]
[73]一种宿主细胞,所述宿主细胞含有[71]所述的多核苷酸或[72]所述的载体。
[0255]
[74]一种与人hla/ny-eso和人cd3特异性结合的分子的制造方法,所述方法包括:(i)培养[73]所述的宿主细胞的步骤;以及(ii)从步骤(i)得到的培养物中纯化抗体或其结合片段的步骤。
[0256]
[75]一种与人hla/ny-eso和人cd3特异性结合的分子,所述分子通过[74]所述的方法得到。
[0257]
[76]一种药物组合物,所述药物组合物含有以下作为有效成分:[15]~[70]和[75]中任一项所述的分子;[71]所述的多核苷酸;[72]所述的载体;或者[73]所述的宿主细胞。
[0258]
[77]根据[14]或[76]所述的药物组合物,所述药物组合物为抗癌剂。
[0259]
[78]根据[77]所述的药物组合物,其中,癌症是选自由以下癌症组成的组的一种或两种以上的癌症:肾癌、黑色素瘤、鳞状细胞癌、基底细胞癌、结膜癌、口腔癌、喉癌、咽癌、甲状腺癌、肺癌(非小细胞肺癌(腺癌、鳞状细胞癌、大细胞癌)、小细胞肺癌)、乳腺癌、食道癌、胃癌、十二指肠癌、小肠癌、结肠直肠癌、直肠癌、阑尾癌、肛门癌、肝癌、胆囊癌、胆管癌、胰腺癌、肾上腺癌、膀胱癌、前列腺癌、子宫癌、阴道癌、脂肪肉瘤、血管肉瘤、软骨肉瘤、横纹肌肉瘤、尤因肉瘤、骨肉瘤、未分化多形性肉瘤、黏液纤维肉瘤、恶性外周神经鞘膜瘤、腹膜后肉瘤、滑膜肉瘤、子宫肉瘤、胃肠道间质瘤、平滑肌肉瘤、上皮样肉瘤、b细胞淋巴瘤、nk/t细胞淋巴瘤、霍奇金淋巴瘤、骨髓性白血病、淋巴细胞白血病、骨髓增生性疾病、骨髓增生异常综合征、多发性骨髓瘤、睾丸癌和卵巢癌。
[0260]
[79]根据[76]~[78]中任一项所述的药物组合物,所述药物组合物与其他药剂组合使用。
[0261]
本说明书包含了作为本技术的优先权基础的日本专利申请号2020-061476号的公开内容。
[0262]
发明效果
[0263]
根据本发明,可以得到与hla-a2/ny-eso结合的抗体,以及与hla-a2/ny-eso结合且与cd3结合的新型双特异性抗体(双特异性分子)。另外,还可以得到含有这种抗体(分子)作为有效成分的新型药物组合物。该抗体或该分子等具有细胞毒活性,可以用作癌症等的治疗剂或预防剂。
附图说明
[0264]
图1是表示抗hla/ny-eso scfv nya-0001、1143、1154、1163、2023、2027、2035、2044、2045、2047、2048、2060、2061、2143、nyc-0003、0004对于添加了各种点突变肽的t2细胞的标准化gmfi的表。*/下划线表示与各scfv对于添加了ny-eso肽的t2细胞的标准化gmfi相比,为一半以下。
[0265]
图2a是表示选择的同源性肽信息的表。使用netmhcpan2.8预测针对hla-a0201的结合性,以50%抑制浓度(ic
50
)表示。
[0266]
图2b是表示抗hla/ny-eso scfv nya-0001、1143、1154、1163、2023、2027、2035、2044、2045、2047、2048、2060、2061、2143、nyc-0003、0004对于添加了各种同源性肽的t2细胞的标准化gmfi的表。*/下划线表示与各scfv对于添加了dmso的t2细胞的标准化gmfi相比,为较大值。
[0267]
图3是表示本实施例所示的抗体的构型的图。(a)scfv:是抗体h链可变区(vh,后述)和抗体l链可变区(vl,后述)(均为白色)通过接头连接而成的构型。本实施例中评价了抗hla-a2/ny-eso和cd3的scfv。(b)fab:是由vh(白色)与抗体h链恒定区(ch1:方格图案)以及vl(白色)与抗体l链恒定区(横线)组成的构型。本实施例中评价了抗hla-a2/ny-eso fab等。(c)tafv:是两种scfv(白色与右上斜线)通过接头连接而成的构型。本实施例中评价了含有抗hla-a2/ny-eso scfv和抗cd3 scfv的tafv。(d)tafv-异二聚体fc型:是在tafv的c末端侧添加一个引入了形成异二聚体的突变的fc(左上斜线)(也称作第一多肽),并与另一个fc(涂黑:也称作第二多肽)杂合子缔合而形成的构型。本实施例中评价了含有抗hla-a2/ny-eso scfv和抗cd3 scfv的tafv-异二聚体fc。(e)tafv-fab-异二聚体fc型:是向上述
tafv-异二聚体fc型添加了fab而成的构型。本实施例中评价了含有抗hla-a2/ny-eso scfv和抗cd3 scfv的tafv,以及使用了hla-a2/ny-eso fab的tafv-fab-异二聚体fc等。(f)表示在tafv-异二聚体fc型和tafv-fab-异二聚体fc型中通用的第一多肽。第一多肽从n末端向c末端依次含有与人hla/ny-eso特异性结合的scfv、与cd3特异性结合的scfv以及fc区域(i)。(g)表示tafv-异二聚体fc型的第二多肽。第二多肽含有铰链区和fc区域(ii)。(h)表示tafv-fab-异二聚体fc型的第二多肽。第二多肽含有铰链区和包括fc区域(ii)的免疫球蛋白重链。(i)表示tafv-fab-异二聚体fc型的第三多肽。第三多肽含有免疫球蛋白轻链。
[0268]
图4a是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0019、nyf-0022、nyf-0023、nyf-0027、nyf-0035、nyf-0044、nyf-0047对于表达内源性人ny-eso的u266b1细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0269]
图4b是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0058对于表达内源性人ny-eso的u266b1细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0270]
图4c是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0023、nyf-0045、nyf-0048、nyf-0060、nyf-0061对于表达内源性人ny-eso的u266b1细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0271]
图4d是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0019、nyf-0022、nyf-0023、nyf-0027、nyf-0035、nyf-0044、nyf-0047对于表达内源性人ny-eso的nci-h1703细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0272]
图4e是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0058对于表达内源性人ny-eso的nci-h1703细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0273]
图4f是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0023、nyf-0045、nyf-0048、nyf-0060、nyf-0061对于表达内源性人ny-eso的nci-h1703细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0274]
图4g是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0019、nyf-0022、nyf-0023、nyf-0027、nyf-0035、nyf-0044、nyf-0047对于不表达内源性人ny-eso的ags细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0275]
图4h是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0058对于不表达内源性人ny-eso的ags细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0276]
图4i是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0023、nyf-0045、nyf-0048、nyf-0060、nyf-0061对于不表达内源性人ny-eso的ags细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0277]
图4j是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0019、nyf-0022、nyf-0023、nyf-0027、nyf-0035、nyf-0044、nyf-0047对于不
表达内源性人ny-eso的cfpac-1细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0278]
图4k是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0058对于不表达内源性人ny-eso的cfpac-1细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0279]
图4l是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0023、nyf-0045、nyf-0048、nyf-0060、nyf-0061对于不表达内源性人ny-eso的cfpac-1细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0280]
图5a是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0019、nyf-0044、nyf-0047在人pbmc转移模型中具有抗肿瘤活性的图。图中的误差棒表示标准误差(仅nyf-0044第32天为n=4,其他为n=5)。
[0281]
图5b是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0022、nyf-0023、nyf-0027、nyf-0035、nyf-0058在人pbmc转移模型中具有抗肿瘤活性的图。图中的误差棒表示标准误差(n=5,仅空白对照组为n=6)。
[0282]
图5c是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyf-0016、nyf-0045、nyf-0048、nyf-0060、nyf-0061在人pbmc转移模型中具有抗肿瘤活性的图。图中的误差棒表示标准误差(n=5)。
[0283]
图6a是表示本实施例所示的抗体的构型的图。(a)杂合型:是在fab的c末端侧和在scfv的c末端侧分别添加两个引入了形成异二聚体的突变的fc(斜线和涂黑),在这两个fc缔合而形成的构型。本实施例中评价了含有抗hla-a2/ny-eso fab和抗cd3 scfv的杂合型。(b)双型:是在两种不同的scfv各自的c末端侧分别添加两个引入了形成异二聚体的突变的fc(左上斜线和涂黑),在这两个fc杂合子缔合而形成的构型。本实施例中评价了含有抗hla-a2/ny-eso scfv和抗cd3 scfv的双型。(c)scfv-fab-异二聚体fc型:是在通过接头将scfv与fab连接的c末端侧添加一个引入了形成异二聚体的突变的fc(左上斜线),并与另一个fc(涂黑)缔合而形成的构型。本实施例中评价了含有抗cd3 scfv(右上斜线)和抗hla-a2/ny-eso fab的scfv-fab-异二聚体fc型。另外,也评价了含有抗hla-a2/ny-eso scfv(右上斜线)和抗cd3 fab的scfv-fab-异二聚体fc型。
[0284]
图6b是表示本实施例所示的抗体的构型的图。(a)tafv-异二聚体fc型:同图3(d)。该构型是在tafv的c末端侧添加一个引入了形成异二聚体的突变的fc(左上斜线),并与另一个fc(涂黑)和杂合子缔合而形成的构型。本实施例中评价了由抗hla-a2/ny-eso scfv和抗cd3 scfv组成的tafv-异二聚体fc型。(b)tafv(反向)-异二聚体fc型:是将上述tafv-异二聚体fc型中的2个scfv的顺序颠倒而成的构型。本实施例中评价了由抗cd3scfv和抗hla-a2/ny-eso scfv组成的tafv(反向)-异二聚体fc型。(c)表示tafv(反向)-异二聚体fc型的第一多肽。第一多肽从n末端向c末端依次含有与cd3特异性结合的scfv、与人hla/ny-eso特异性结合的scfv以及fc区域(i)。(d)表示tafv(反向)-异二聚体fc型的第二多肽。第二多肽含有铰链区和fc区域(ii)。
[0285]
图7a是表示在人pbmc共存下,各种抗hla-a2/ny-eso-抗cd3双特异性分子(杂合体(nyg-3143)、双体(nyg-2143)、tafv-异二聚体fc体(nyf-0011))对于表达内源性人ny-eso的u266b1细胞表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0286]
图7b是表示在人pbmc共存下,各种抗hla-a2/ny-eso-抗cd3双特异性分子(scfv-fab-异二聚体fc体(nyf-0003)、tafv-异二聚体fc体(nyf-0010)、tafv(反向)-异二聚体fc体(nyf-0004))对于表达内源性人ny-eso的u266b1细胞表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0287]
图8是ny-eso中的肽的氨基酸序列(seq id no:1)。
[0288]
图9是magec-1中的肽的氨基酸序列(seq id no:2)。
[0289]
图10是用于进行scfv序列分析的引物1(seq id no:3)。
[0290]
图11是用于进行scfv序列分析的引物2(seq id no:4)。
[0291]
图12是nya-0001的重链可变区的核苷酸序列(seq id no:5)。
[0292]
图13是nya-0001的重链可变区的氨基酸序列(seq id no:6)。
[0293]
图14是nya-0001的轻链可变区的核苷酸序列(seq id no:7)。
[0294]
图15是nya-0001的轻链可变区的氨基酸序列(seq id no:8)。
[0295]
图16是nya-0060的重链可变区的核苷酸序列(seq id no:9)。
[0296]
图17是nya-0060的重链可变区的氨基酸序列(seq id no:10)。
[0297]
图18是nya-0060的轻链可变区的核苷酸序列(seq id no:11)。
[0298]
图19是nya-0060的轻链可变区的氨基酸序列(seq id no:12)。
[0299]
图20是nya-0068的重链可变区的核苷酸序列(seq id no:13)。
[0300]
图21是nya-0068的重链可变区的氨基酸序列(seq id no:14)。
[0301]
图22是nya-0068的轻链可变区的核苷酸序列(seq id no:15)。
[0302]
图23是nya-0068的轻链可变区的氨基酸序列(seq id no:16)。
[0303]
图24是nya-0082的重链可变区的核苷酸序列(seq id no:17)。
[0304]
图25是nya-0082的重链可变区的氨基酸序列(seq id no:18)。
[0305]
图26是nya-0082的轻链可变区的核苷酸序列(seq id no:19)。
[0306]
图27是nya-0082的轻链可变区的氨基酸序列(seq id no:20)。
[0307]
图28是nya-1163标签添加物的核苷酸序列(seq id no:21)。
[0308]
图29是nya-2023标签添加物的核苷酸序列(seq id no:22)。
[0309]
图30是nya-2027标签添加物的核苷酸序列(seq id no:23)。
[0310]
图31是nya-1143标签添加物的核苷酸序列(seq id no:24)。
[0311]
图32是nya-2143标签添加物的核苷酸序列(seq id no:25)。
[0312]
图33是nya-1163标签添加物的氨基酸序列(seq id no:26),nya-1163为氨基酸编号21~266。
[0313]
图34是nya-2023标签添加物的氨基酸序列(seq id no:27),nya-2023为氨基酸编号21~266。
[0314]
图35是nya-2027标签添加物的氨基酸序列(seq id no:28),nya-2027为氨基酸编号21~266。
[0315]
图36是nya-1143标签添加物的氨基酸序列(seq id no:29),nya-1143为氨基酸编号21~266。
[0316]
图37是nya-2143标签添加物的氨基酸序列(seq id no:30),nya-2143为氨基酸编号21~266。
[0317]
图38是nya-1154标签添加物的核苷酸序列(seq id no:31)。
[0318]
图39是nya-1154标签添加物的氨基酸序列(seq id no:32),nya-1154为氨基酸编号21~266。
[0319]
图40是hla-a*0201(genbank:asa47534.1)的截短物的氨基酸序列(seq id no:33)。
[0320]
图41是β2-微球蛋白的氨基酸序列(seq id no:34)。
[0321]
图42是nya-2035标签添加物的核苷酸序列(seq id no:35)。
[0322]
图43是nya-2035标签添加物的氨基酸序列(seq id no:36),nya-2035为氨基酸编号21~266。
[0323]
图44是nya-1143-vh01的氨基酸序列(seq id no:37)。
[0324]
图45是nya-1143-vh02的氨基酸序列(seq id no:38)。
[0325]
图46是nya-1143-vh03的氨基酸序列(seq id no:39)。
[0326]
图47是nya-1143-vl01的氨基酸序列(seq id no:40)。
[0327]
图48是nya-2044标签添加物的核苷酸序列(seq id no:41)。
[0328]
图49是nya-2045标签添加物的核苷酸序列(seq id no:42)。
[0329]
图50是nya-2047标签添加物的核苷酸序列(seq id no:43)。
[0330]
图51是nya-2048标签添加物的核苷酸序列(seq id no:44)。
[0331]
图52是nya-2060标签添加物的核苷酸序列(seq id no:45)。
[0332]
图53是nya-2061标签添加物的核苷酸序列(seq id no:46)。
[0333]
图54是nya-2044标签添加物的氨基酸序列(seq id no:47),nya-2044为氨基酸编号21~266。
[0334]
图55是nya-2045标签添加物的氨基酸序列(seq id no:48),nya-2045为氨基酸编号21~266。
[0335]
图56是nya-0082的氨基酸序列(seq id no:49)。
[0336]
图57是nya-2047标签添加物的氨基酸序列(seq id no:50),nya-2047为氨基酸编号21~266。
[0337]
图58是nya-2048标签添加物的氨基酸序列(seq id no:51),nya-2048为氨基酸编号21~266。
[0338]
图59是nya-2060标签添加物的氨基酸序列(seq id no:52),nya-2060为氨基酸编号21~266。
[0339]
图60是nya-2061标签添加物的氨基酸序列(seq id no:53),nya-2061为氨基酸编号21~266。
[0340]
图61是nya-0001的重链cdrh1~cdrh3和轻链cdrl1~l3的氨基酸序列(seq id no:54~seq id no:59)。
[0341]
图62是nya-2023的cdrl1的氨基酸序列(seq id no:60)。
[0342]
图63是nya-2027的cdrl3的氨基酸序列(seq id no:61)。
[0343]
图64是nya-1154的cdrh3和cdrl3的氨基酸序列(seq id no:62和seq id no:63)。
[0344]
图65是nya-0035的cdrl1的氨基酸序列(seq id no:64)。
[0345]
图66是nyc-0003标签添加物的核苷酸序列(seq id no:65)。
[0346]
图67是nyc-0004标签添加物的核苷酸序列(seq id no:66)。
[0347]
图68是nyc-0003标签添加物的氨基酸序列(seq id no:67),nyc-0003为氨基酸编号21~263。
[0348]
图69是nyc-0004标签添加物的氨基酸序列(seq id no:68),nyc-0004为氨基酸编号21~263。
[0349]
图70是nya-0001标签添加物的核苷酸序列(seq id no:69)。
[0350]
图71是nya-0001标签添加物的氨基酸序列(seq id no:70),nya-0001为氨基酸编号21~266。
[0351]
图72是hc1的核苷酸序列(seq id no:71)。
[0352]
图73是nyf-0016-hc2的核苷酸序列(seq id no:72)。
[0353]
图74是nyf-0019-hc2的核苷酸序列(seq id no:73)。
[0354]
图75是nyf-0022-hc2的核苷酸序列(seq id no:74)。
[0355]
图76是nyf-0023-hc2的核苷酸序列(seq id no:75)。
[0356]
图77是nyf-0027-hc2的核苷酸序列(seq id no:76)。
[0357]
图78是nyf-0035-hc2的核苷酸序列(seq id no:77)。
[0358]
图79是nyf-0044-hc2的核苷酸序列(seq id no:78)。
[0359]
图80是nyf-0045-hc2的核苷酸序列(seq id no:79)。
[0360]
图81是nyf-0047-hc2的核苷酸序列(seq id no:80)。
[0361]
图82是nyf-0048-hc2的核苷酸序列(seq id no:81)。
[0362]
图83是nyf-0060-hc2的核苷酸序列(seq id no:82)。
[0363]
图84是nyf-0061-hc2的核苷酸序列(seq id no:83)。
[0364]
图85是hc1的氨基酸序列(seq id no:84)。
[0365]
图86是nyf-0016-hc2的氨基酸序列(seq id no:85),nya-1143为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0366]
图87是nyf-0019-hc2的氨基酸序列(seq id no:86),nya-2143为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0367]
图88是nyf-0022-hc2的氨基酸序列(seq id no:87),nya-1163为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0368]
图89是nyf-0023-hc2的氨基酸序列(seq id no:88),nya-2023为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0369]
图90是nyf-0027-hc2的氨基酸序列(seq id no:89),nya-2027为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0370]
图91是nyf-0035-hc2的氨基酸序列(seq id no:90),nya-2035为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0371]
图92是nyf-0044-hc2的氨基酸序列(seq id no:91),nya-2044为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0372]
图93是nyf-0045-hc2的氨基酸序列(seq id no:92),nya-2045为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0373]
图94是nyf-0047-hc2的氨基酸序列(seq id no:93),nya-2047为氨基酸编号21~
266,c3e-7085为氨基酸编号272~511。
[0374]
图95是nyf-0048-hc2的氨基酸序列(seq id no:94),nya-2048为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0375]
图96是nyf-0060-hc2的氨基酸序列(seq id no:95),nya-2060为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0376]
图97是nyf-0061-hc2的氨基酸序列(seq id no:96),nya-2061为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0377]
图98是nya-0001-fab-hc1-k delete的核苷酸序列(seq id no:97)。
[0378]
图99是nya-0001-lc的核苷酸序列(seq id no:98)。
[0379]
图100是nya-0001-fab-hc1-k delete的氨基酸序列(seq id no:99),nya-0001的重链可变区为氨基酸编号20~139。
[0380]
图101是nya-0001-lc的氨基酸序列(seq id no:100),nya-0001的轻链可变区为氨基酸编号21~131。
[0381]
图102是nya-1143-fab-hc1-k delete的核苷酸序列(seq id no:101)。
[0382]
图103是nya-1143-lc的核苷酸序列(seq id no:102)。
[0383]
图104是c3e-7085-hc2-k deletec的核苷酸序列(seq id no:103)。
[0384]
图105是nya-1143-fab-hc1-k delete的氨基酸序列(seq id no:104),nya-1143的重链可变区为氨基酸编号20~139。
[0385]
图106是nya-1143-lc的氨基酸序列(seq id no:105),nya-1143的轻链可变区为氨基酸编号21~131。
[0386]
图107是c3e-7085-hc2-k delete的氨基酸序列(seq id no:106),c3e-7085为氨基酸编号21~260。
[0387]
图108是nya-1143-hc1-k delete的核苷酸序列(seq id no:107)。
[0388]
图109是nya-1143-hc1-k delete的氨基酸序列(seq id no:108),nya-1143为氨基酸编号21~266。
[0389]
图110是c3e-7085-nya-1154-fab-hc2-k delete的核苷酸序列(seq id no:109)。
[0390]
图111是nya-1154-lc的核苷酸序列(seq id no:110)。
[0391]
图112是oaa-hc1-k delete的核苷酸序列(seq id no:111)。
[0392]
图113是c3e-7085-nya-1154-fab-hc2-k delete的氨基酸序列(seq id no:112),c3e-7085为氨基酸编号21~260,nya-1154的重链可变区为氨基酸编号266~285。
[0393]
图114是nya-1154-lc的氨基酸序列(seq id no:113),nya-1154的轻链可变区为氨基酸编号21~131。
[0394]
图115是oaa-hc1-k delete的氨基酸序列(seq id no:114)。
[0395]
图116是nyf-0010-hc2-k delete的核苷酸序列(seq id no:115)。
[0396]
图117是nyf-0004-hc2-k delete的核苷酸序列(seq id no:116)。
[0397]
图118是nyf-0011-hc2-k delete的核苷酸序列(seq id no:117)。
[0398]
图119是nyf-0010-hc2-k delete的氨基酸序列(seq id no:18),nya-1154为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0399]
图120是nyf-0004-hc2-k delete的氨基酸序列(seq id no:119),c3e-7085为氨
基酸编号21~260,nya-1154为氨基酸编号272~511。
[0400]
图121是nyf-0011-hc2-k delete的氨基酸序列(seq id no:120),nya-1143为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0401]
图122是点突变ny-eso肽1f的氨基酸序列(seq id no:121)。
[0402]
图123是点突变ny-eso肽2m的氨基酸序列(seq id no:122)。
[0403]
图124是点突变ny-eso肽3a的氨基酸序列(seq id no:123)。
[0404]
图125是点突变ny-eso肽4a的氨基酸序列(seq id no:124)。
[0405]
图126是点突变ny-eso肽5a的氨基酸序列(seq id no:125)。
[0406]
图127是点突变ny-eso肽6l的氨基酸序列(seq id no:126)。
[0407]
图128是点突变ny-eso肽7f的氨基酸序列(seq id no:127)。
[0408]
图129是点突变ny-eso肽8a的氨基酸序列(seq id no:128)。
[0409]
图130是点突变ny-eso肽9a的氨基酸序列(seq id no:129)。
[0410]
图131是gp100肽的氨基酸序列(seq id no:130)。
[0411]
图132是同源性肽dolpp1的氨基酸序列(seq id no:131)。
[0412]
图133是同源性肽il20rb的氨基酸序列(seq id no:132)。
[0413]
图134是同源性肽prkd2的氨基酸序列(seq id no:133)。
[0414]
图135是同源性肽cd163的氨基酸序列(seq id no:134)。
[0415]
图136是同源性肽p2ry8的氨基酸序列(seq id no:135)。
[0416]
图137是c3e-7034的氨基酸序列(seq id no:136)。
[0417]
图138是c3e-7036的氨基酸序列(seq id no:137)。
[0418]
图139是c3e-7085的氨基酸序列(seq id no:138)。
[0419]
图140是c3e-7088的氨基酸序列(seq id no:139)。
[0420]
图141是c3e-7093的氨基酸序列(seq id no:140)。
[0421]
图142是c3e-7085的重链cdrh1~cdrh3和轻链cdrl1~cdrl3的氨基酸序列(seq id no:141~seq id no:146)。
[0422]
图143是c3e-7078的氨基酸序列(seq id no:147)。
[0423]
图144是nyf-0014-hc2的核苷酸序列(seq id no:148)。
[0424]
图145是nyf-0014-hc2的氨基酸序列(seq id no:149),nya-0001为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0425]
图146是nyf-0082-hc2的氨基酸序列(seq id no:150),nya-0082为氨基酸编号21~266,c3e-7085为氨基酸编号272~511。
[0426]
图147是人cd3ε的氨基酸序列(seq id no:151)。
[0427]
图148是nyz-0038-hc2全长的核苷酸序列(seq id no:152)。
[0428]
图149是nyz-0082-hc2全长的核苷酸序列(seq id no:153)。
[0429]
图150是nyz-0083-hc2全长的核苷酸序列(seq id no:154)。
[0430]
图151是nyz-0038-hc2全长的氨基酸序列(seq id no:155),nya-2061为氨基酸编号21~266,c3e-7096为氨基酸编号272~511。
[0431]
图152是nyz-0082-hc2全长的氨基酸序列(seq id no:156),nya-3061为氨基酸编号21~271,c3e-7096为氨基酸编号277~516。
[0432]
图153是nyz-0083-hc2全长的氨基酸序列(seq id no:157),nya-3061为氨基酸编号21~271,c3e-7097为氨基酸编号277~516。
[0433]
图154是nyz-1010-hc2全长的核苷酸序列(seq id no:158)。
[0434]
图155是c3e-7085-lc全长的核苷酸序列(seq id no:159)。
[0435]
图156是nyz-1010-hc2全长的氨基酸序列(seq id no:160),nya-3061为氨基酸编号21~271,c3e-7085的重链可变区为氨基酸编号277~394。
[0436]
图157是c3e-7085-lc全长的氨基酸序列(seq id no:161)。
[0437]
图158a是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038、0082、0083、1010对于添加了各种点突变肽的cd3e敲除t2细胞的标准化gmfi的表。*/下划线表示与各fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子对于添加了ny-eso肽的cd3e敲除t2细胞的标准化gmfi相比,为一半以下。*粗体字表示为四分之一以下。
[0438]
图158b是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038、0082、0083、1010对于添加了各种同源性肽的cd3e敲除t2细胞的标准化gmfi的表。*/下划线表示与各fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子对于添加了dmso的cd3e敲除t2细胞的标准化gmfi相比,为较大值。
[0439]
图159a是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038、0082、0083对于表达内源性人ny-eso的u266b1细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0440]
图159b是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-1010对于表达内源性人ny-eso的u266b1细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0441]
图159c是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0082、1010对于表达内源性人ny-eso的nci-h1703细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0442]
图159d是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038、0083对于表达内源性人ny-eso的nci-h1703细胞具有细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0443]
图159e是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038、0082、0083对于不表达内源性人ny-eso的ags细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0444]
图159f是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-1010对于不表达内源性人ny-eso的ags细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0445]
图159g是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0082、1010对于不表达内源性人ny-eso的cfpac-1细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0446]
图159h是表示在人pbmc共存下,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038、0083对于不表达内源性人ny-eso的cfpac-1细胞未表现出细胞毒活性的图。图中的误差棒表示标准偏差(n=3)。
[0447]
图160a是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038在人pbmc转移模型中具有抗肿瘤活性的图。图中的误差棒表示标准误差(n=5)。
[0448]
图160b是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0082在人pbmc转移模型中具有抗肿瘤活性的图。图中的误差棒表示标准误差(n=5)。
[0449]
图160c是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0083在人pbmc转移模型中具有抗肿瘤活性的图。图中的误差棒表示标准误差(n=5)。
[0450]
图160d是表示fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-1010在人pbmc转移模型中具有抗肿瘤活性的图。图中的误差棒表示标准误差(n=5)。
[0451]
图161是肽接头的氨基酸序列(seq id no:162)。
[0452]
图162是表示对各种fc添加型抗hla/ny-eso-抗cd3双特异性分子进行酸处理时的多聚体的含量(%)的图。
[0453]
图163是表示抗hla/ny-eso的scfv-异二聚体fc的溶液稳定性评价的结果的图。
[0454]
图164是nya-3061全长的核苷酸序列(seq id no:163)。
[0455]
图165是nya-3061全长的氨基酸序列(seq id no:164)。
[0456]
图166是nyc-0005全长的核苷酸序列(seq id no:165)。
[0457]
图167是nyc-0005全长的氨基酸序列(seq id no:166)。
[0458]
图168是nyc-0006全长的核苷酸序列(seq id no:167)。
[0459]
图169是nyc-0006全长的氨基酸序列(seq id no:168)。
[0460]
图170是nyc-0007全长的核苷酸序列(seq id no:169)。
[0461]
图171是nyc-0007全长的氨基酸序列(seq id no:170)。
[0462]
图172是nyc-0008全长的核苷酸序列(seq id no:171)。
[0463]
图173是nyc-0008全长的氨基酸序列(seq id no:172)。
[0464]
图174是nyc-0009全长的核苷酸序列(seq id no:173)。
[0465]
图175是nyc-0009全长的氨基酸序列(seq id no:174)。
[0466]
图176是nyc-0010全长的核苷酸序列(seq id no:175)。
[0467]
图177是nyc-0010全长的氨基酸序列(seq id no:176)。
[0468]
图178是hc-h全长的核苷酸序列(seq id no:177)。
[0469]
图179是hc-h全长的氨基酸序列(seq id no:178)。
[0470]
图180是nyd-2047-hc-k全长的核苷酸序列(seq id no:179)。
[0471]
图181是nyd-2047-hc-k全长的氨基酸序列(seq id no:180)。
[0472]
图182是nyd-2061-hc-k全长的核苷酸序列(seq id no:181)。
[0473]
图183是nyd-2061-hc-k全长的氨基酸序列(seq id no:182)。
[0474]
图184是nyd-3061-hc-k全长的核苷酸序列(seq id no:183)。
[0475]
图185是nyd-3061-hc-k全长的氨基酸序列(seq id no:184)。
[0476]
图186是nyc-0011-hc-k全长的核苷酸序列(seq id no:185)。
[0477]
图187是nyc-0011-hc-k全长的氨基酸序列(seq id no:186)。
[0478]
图188是nyc-0012-hc-k全长的核苷酸序列(seq id no:187)。
[0479]
图189是nyc-0012-hc-k全长的氨基酸序列(seq id no:188)。
[0480]
图190是nyc-0013-hc-k全长的核苷酸序列(seq id no:189)。
[0481]
图191是nyc-0013-hc-k全长的氨基酸序列(seq id no:190)。
[0482]
图192是nyc-0014-hc-k全长的核苷酸序列(seq id no:191)。
[0483]
图193是nyc-0014-hc-k全长的氨基酸序列(seq id no:192)。
[0484]
图194是nyc-0015-hc-k全长的核苷酸序列(seq id no:193)。
[0485]
图195是nyc-0015-hc-k全长的氨基酸序列(seq id no:194)。
[0486]
图196是nyc-0016-hc-k全长的核苷酸序列(seq id no:195)。
[0487]
图197是nyc-0016-hc-k全长的氨基酸序列(seq id no:196)。
[0488]
图198是nyz-1007-hc2全长的氨基酸序列(seq id no:197),nya-2061为氨基酸编号21~266,c3e-7085的重链可变区为氨基酸编号272~389。
[0489]
图199是nyz-1017-hc2全长的氨基酸序列(seq id no:198),nya-2047为氨基酸编号21~266,c3e-7085的重链可变区为氨基酸编号277~389。
具体实施方式
[0490]
下面对本发明进行详细说明。
[0491]
1.定义
[0492]
本发明中,“基因”是指含有编码蛋白质的氨基酸的碱基序列的核苷酸链或其互补链。例如,作为含有编码蛋白质的氨基酸的碱基序列的核苷酸链或其互补链的多核苷酸、寡核苷酸、dna、mrna、cdna、crna等,均包含在“基因”的含义中。基因是单链、双链或三链以上的核苷酸,dna链与rna链的缔合物、一条核苷酸链上混有核糖核苷酸(rna)和脱氧核糖核苷酸(dna)的核苷酸,以及含有这种核苷酸链的双链或三链以上的核苷酸,也包含在“基因”的含义中。本发明中,碱基序列与核苷酸序列意思相同。
[0493]
本发明中,“多核苷酸”、“核苷酸链”、“核酸”以及“核酸分子”意思相同。例如,dna、rna、探针、寡核苷酸、引物等也包含在“多核苷酸”的含义中。多核苷酸是由单链、双链或三条以上的链组成的多核苷酸。dna链与rna链的缔合物、一条多核苷酸链上混有核糖核苷酸(rna)和脱氧核糖核苷酸(dna)的多核苷酸,以及含有这种多核苷酸链的双链或三条以上的链的缔合物,也包含在“多核苷酸”的含义中。
[0494]
本发明中,“多肽”、“肽”以及“蛋白质”意思相同。
[0495]
本发明中,有时会将“抗原”用于“免疫原”的含义。
[0496]
本发明中,“细胞”也包括来自动物个体的各种细胞、继代培养细胞、初代培养细胞、细胞系、重组细胞以及微生物等。
[0497]
本发明中,“抗体”与免疫球蛋白意思相同。但是,本发明的抗hla/ny-eso抗体的情况下的“抗体”则用作具有恒定区和可变区的免疫球蛋白之意。抗体是天然抗体,或者是通过部分合成或完全合成制造的免疫球蛋白,本发明中没有特别限制。本发明的抗hla/ny-eso抗体包含在后述的“分子”中。
[0498]
本发明中,“ny-eso肽”是指ny-eso-1和lage-1的第157位至第165位这9个氨基酸所组成的肽(sllmwitqc,seq id no:1)。
[0499]
本发明中,“hla-a2/ny-eso”是指ny-eso肽和组织相容性白细胞抗原-a2(histocompatibility leukocyte antigen-a2,hla-a2)的复合物,也记作“hla/ny-eso”。
[0500]
本发明中,“抗hla-a2/ny-eso抗体”是指与hla-a2/ny-eso结合的抗体,换言之,则
是识别hla-a2/ny-eso的抗体。同样地,“抗hla-a2/ny-eso scfv”是指与hla/ny-eso结合的scfv,换言之,则是识别hla-a2/ny-eso的scfv。“抗hla-a2/ny-eso抗体”和“抗hla-a2/ny-eso scfv”也分别记作“抗hla/ny-eso抗体”和“抗hla/ny-eso scfv”。
[0501]
四链抗体的基本结构是由两条相同的轻链(l链)和两条相同的重链(h链)构成的。轻链通过一个共价二硫键与重链结合。两条重链根据重链的同种型,通过一个或多个二硫键相互结合。各个轻链、重链具有规则间隔的链内二硫键。重链和轻链中,存在氨基酸序列表现出非常高的相似性的恒定区,以及氨基酸序列的相似性低的可变区。轻链在氨基末端具有恒定区(cl)连续的可变区(vl)。重链在氨基末端具有3个恒定区(ch1/ch2/ch3)连续的可变区(vh)。vl和vh配对,cl与重链的第一恒定区(ch1)并列。vl与vh配对形成单一的抗原结合位点。
[0502]
本发明的抗体的恒定区没有特别限制,但作为用于治疗或预防人类疾病的本发明的抗体,优选使用人类抗体的恒定区。作为人类抗体的重链恒定区,例如可举出cγ发、c发明、c发明、c发明、c发、c发、c发明、c发明、cε等。作为人类抗体的轻链恒定区,例如可举出c。、c。等。
[0503]
fab由重链的vh和之后的ch1,以及轻链的vl和之后的cl组成。vh和vl包含互补性决定区(cdr)。
[0504]
fc(也称作fc区域)是重链的恒定区的羧基末端区域,含有ch2和ch3,是二聚体。本发明的fc既可以是天然序列的fc,也可以是在天然序列中发生突变的突变型的fc(称作“突变型fc”)。在本发明的多特异性分子和双特异性分子中,优选的fc区域为突变型fc,更优选的是能够形成异二聚体的一组fc。作为一组fc,可举出后述的第一多肽含有的fc(i)以及第二多肽含有的fc(ii)的组合。只要一组fc能够缔合(形成异二聚体),就没有限制。
[0505]
作为突变型fc,可例举但不限于:wo2013/063702公开的、具有提升的稳定性的异多聚体所包含的修饰fc区域(包含异二聚体fc区域);wo1996/27011公开的、异多聚体所包含的、包含从具有“突起”和“空隙”的igg抗体衍生的免疫球蛋白的ch3区域的fc;wo2009/089004公开的、包含将一个以上的氨基酸残基取代为带电氨基酸从而在静电上有利的异二聚体所包含的ch3区域的fc;wo2014/110601公开的、使用了构象突变和/或pi(等电点)突变的异二聚体所包含的异二聚体fc区域;wo2010/151792公开的、包含含有使与蛋白a的结合消失或减少的修饰的ch3区域的异二聚体的fc等。
[0506]
可变区由以下两种区域组成:被称为高变区(hvr,hypervariable region)的具有极度可变性的区域,以及与该区域分离的被称为框架区(fr,framework region)的相对不变的区域。天然的重链和轻链的可变区包含通过3个高变区连接的4个fr,各链的高变区通过fr与其他链的高变区一同保持得极近,有助于形成抗体的抗原结合位点。
[0507]
已知抗体分子的重链和轻链分别有3处互补性决定区(cdr,complemetarity determining region)。互补性决定区也叫做高变区,位于抗体的重链和轻链的可变区内,是一级结构中突变性特别高的位点。在重链和轻链的多肽链的一级结构上,通常各分离为3处。本发明中,对于抗体的互补性决定区,将重链的互补性决定区从重链氨基酸序列的氨基末端侧起,依次记作cdrh1、cdrh2、cdrh3;将轻链的互补性决定区从轻链氨基酸序列的氨基末端侧起,依次记作cdrl1、cdrl2、cdrl3。这些位点在构象上相互接近,决定着针对结合的抗原的特异性。
[0508]
本发明中,cdr的位置和长度由imgt的定义(developmental and comparative immunology 27(2003)55-77)确定。
[0509]
fr是cdr残基以外的可变区。可变区一般具有fr1、fr2、fr3、fr4这四个fr。
[0510]
重链和轻链所包含的cdr和fr从氨基末端起向羧基末端,分别依次配置有frh1-cdrh1-frh2-cdrh2-frh3-cdrh3-frh4,以及frl1-cdrl1-frl2-cdrl2-frl3-cdrl3-frl4。
[0511]
cdr和fr的位置也可以由该技术领域所公知的各种定义,例如imgt以外的kabat、chothia、abm、contact等的定义来确定。
[0512]
本发明中,“抗体的抗原结合片段”是指由重链可变区和轻链可变区构成的、具有与抗原的结合活性的抗体的部分片段。作为“抗体的抗原结合片段”,例如可举出但不限于:fab、f(ab’)2、scfv、fab’、fv、单域抗体(single-domain antibody,sdab)等抗原结合片段。该抗体的抗原结合片段是通过用木瓜蛋白酶、胃蛋白酶等酶对抗体蛋白的全长分子进行处理而得到的,此外,也可以是使用重组基因在适当的宿主细胞中产生的重组蛋白。本发明中,“抗体的结合片段”与“抗体的抗原结合片段”意思相同。
[0513]
本发明中,抗体所结合的“位点”,即抗体所识别的“位点”是指抗体所结合或识别的抗原上的部分肽或部分高级结构。
[0514]
本发明中,该位点也叫做表位、抗体的结合位点。本发明中,“突变抗体”是指具有在原抗体所具有的氨基酸序列中氨基酸发生取代、缺失、添加(添加包括插入)(以下统称为“突变”)而形成的氨基酸序列,且与本发明的hla/ny-eso结合的多肽。该突变抗体中的突变氨基酸的数量为1、2、3、4、5、6、7、8、9、10、12、15、20、25、30、40或50个。该突变抗体也包含在本发明的“抗体”中。
[0515]
本发明中,“1个或数个”中的“数个”是指2~10个。
[0516]
本说明书中,“分子”是包括上述抗体、抗体的抗原结合片段的分子,还包括由抗体或来自这些抗体的多个抗原结合片段形成的为多特异性的分子。
[0517]
本说明书中,“为多特异性的分子”、“多特异性的分子”以及“多特异性分子”意思相同,只要是能够与一个分子上的多个彼此不同的表位,和/或,两个以上的分子上的彼此不同的表位结合的分子,就没有特别限制。作为多特异性分子,也包括包含重链可变区(vh)和轻链可变区(vl)的抗体。这种多特异性分子包括但不限于:具有不同的两种以上的重链和轻链的完全长度抗体分子,即igg型多特异性分子;以及由两种以上的具有vl和vh的抗原结合片段组成的分子,即将fab、fab’、fv、scfv、sdab等组合而派生出的分子,即串联scfv(tandem scfv)、双体、单链双体、三体等。此外,多特异性分子也包括:将在抗原结合片段没有免疫球蛋白骨架而有抗原结合性的蛋白质通过基因方式或化学方式连接而产生的分子。本发明中,除了不包含抗体或其抗原结合片段的情况以外,这种多特异性分子也可以叫做“多特异性的抗体”、“多特异性抗体”等。
[0518]
作为本发明的抗hla/ny-eso抗体或该抗体的抗原结合片段,或者,本发明的分子所起到的活性、性质,例如可以举出生物活性、物理化学性质(也叫作物化性质)等。具体可以举出:细胞毒活性、adcc活性、抗肿瘤活性(皆在后文进行阐述)等各种生物活性;对抗原和表位的结合活性;制造和保存时的稳定性;热稳定性等物化性质。
[0519]
本发明中,“在严谨条件下杂交”是指,在含有5
×
ssc的溶液中在65℃进行杂交、接着分别在以下条件洗涤的杂交或与之同等的条件的杂交:在含有2
×
ssc-0.1%sds的溶液
中在65℃进行20分钟洗涤、在含有0.5
×
ssc-0.1%sds的水溶液中在65℃进行20分钟洗涤,以及在含有0.2
×
ssc-0.1%sds的水溶液中在65℃进行20分钟洗涤。ssc是指150mm nacl-15mm柠檬酸钠的水溶液,n
×
ssc意为n倍浓度的ssc。
[0520]
本发明中,“细胞毒性”是指以某种形式使细胞产生病理性变化,不限于直接的外伤,还意为dna的切断和碱基二聚体的形成、染色体的切断、细胞分裂装置的损伤、各种酶活性的下降等所有细胞在结构和功能上的损伤。本发明中,“细胞毒活性”是指引起上述细胞毒性。
[0521]
本发明中,“抗体依赖性细胞毒活性”是指“antibody dependent cellular cytotoxicity(adcc)活性”,意为nk细胞通过抗体对肿瘤细胞等靶细胞造成伤害的作用活性。
[0522]
本发明中,“t细胞重定向的细胞毒活性”是指通过包括抗肿瘤抗原抗体和抗hla/ny-eso抗体的多特异性分子,引起上述细胞毒性。即,意为抗肿瘤抗原抗体与靶肿瘤细胞结合,抗hla/ny-eso抗体与t细胞结合,由此使靶肿瘤细胞与t细胞的距离接近,通过t细胞活化来诱导细胞毒性。该分子也可以包含在药物组合物中。
[0523]
2.抗原
[0524]
2-1.hla/ny-eso抗原
[0525]
本发明中使用的术语“hla/ny-eso”与hla/ny-eso蛋白含义相同。
[0526]
hla/ny-eso是hla-a2、β2-微球蛋白、ny-eso肽的三者复合物。hla-a2是hla的等位基因的一种,已知是在白种人(caucasian)中频率最高的等位基因。hla在细胞的内质网内,形成与β2-微球蛋白和自身蛋白的肽片段的三者复合物,并向细胞外提呈,接受t细胞的tcr(t cell receptor,t细胞受体)识别。ny-eso肽(sllmwitqc,seq id no:1,图8)是由ny-eso-1、lage-1的第157位至第165位这9个氨基酸组成的肽,有报告称ny-eso肽会由hla-a2提呈。
[0527]
2-2.cd3抗原
[0528]
本发明中使用的术语“cd3”与cd3蛋白含义相同。
[0529]
cd3作为多分子t细胞受体复合物的一部分而在t细胞上表达,是γ链、δ链、ε链、ζ链、η链这5种多肽(分子量依次为25000-28000、21000、20000、16000、22000)的复合物。
[0530]
作为cd3复合物,可举出γ、δ、ε、ζ、η链。这些链也称为亚基。抗cd3抗体与t细胞结合,由此通过t细胞活化来诱导细胞毒性。很多抗cd3抗体会与cd3ε结合。
[0531]
编码人cd3ε的cdna的核苷酸序列登记在ncbi/genbank,登记号为nm_000733(nm_000733.3);人cd3ε的氨基酸序列登记在ncbi/genpept,登记号为np_000724(nm_000724.1)。编码食蟹猴cd3的cdna的核苷酸序列登记在genbank,登记号为nm_001283615.1。人cd3ε的氨基酸序列记载在序列表的seq id no:151(图147)。
[0532]
2-3.抗原的制备
[0533]
本发明所使用的上述抗原蛋白hla/ny-eso、cd3(以下也将hla/ny-eso、cd3统统记作该抗原蛋白)可以通过以下方式制备:从动物组织(包括体液)、来自该动物组织的细胞或该细胞的培养物中纯化和分离;基因重组;体外翻译;化学合成等。
[0534]
该抗原蛋白的cdna例如可以通过所谓的pcr法获得,pcr法是将表达该抗原蛋白的mrna的器官的cdna文库作为模板,使用将该抗原蛋白的cdna特异性扩增的引物,进行聚合
酶链式反应(以下称作“pcr”)(saiki,r.k.,et al.,science(1988)239,487-49)。
[0535]
和由与编码在人或大鼠中表达的该抗原蛋白的核苷酸序列互补的核苷酸序列组成的多核苷酸在严谨条件下杂交,并且,编码具有与该抗原蛋白同等的生物活性的蛋白质的多核苷酸也包含在该抗原蛋白的cdna中。
[0536]
然后,还有与从编码在人或大鼠中表达的该抗原蛋白基因座转录的剪接突变体或与该剪接突变体在严谨条件下杂交并且编码具有与该抗原蛋白同等的生物活性的蛋白质的多核苷酸也包含在该抗原蛋白的cdna中。
[0537]
编码人或大鼠的该抗原蛋白的氨基酸序列所组成的,或者从这些序列中除去信号序列之后的氨基酸序列中1个或数个氨基酸被取代、缺失或添加的氨基酸序列所组成的,具有与该抗原蛋白同等的生物活性的蛋白质的核苷酸序列,也包含在该抗原蛋白基因的核苷酸序列中。
[0538]
在从人或大鼠的该抗原蛋白的基因座转录的剪接突变体所编码的氨基酸序列所组成的,或者在该氨基酸序列中1个或数个氨基酸被取代、缺失或添加的氨基酸序列所组成的、且具有与该抗原蛋白同等的生物活性的蛋白质,也包含在该抗原蛋白中。
[0539]
2-4.对抗原蛋白的结合特异性
[0540]
本发明的抗hla/ny-eso抗体及其抗原结合片段等会识别hla/ny-eso。即,会与hla/ny-eso抗原结合。目前尚不知晓hla/ny-eso在小鼠、大鼠、食蟹猴等非人动物中存在。
[0541]
本发明的多特异性分子所包含的抗cd3抗体及其结合片段等会识别cd3抗原,即,会与cd3抗原结合。该抗cd3抗体等优选与人cd3、猴cd3等结合,更优选与人cd3和食蟹猴cd3结合。另一方面,该优选的抗cd3抗体不与大鼠和/或小鼠的cd3结合。
[0542]
本发明的多特异性分子的抗肿瘤活性例如可以通过以下方式进行评价:(i)向移植有人外周血淋巴细胞的非人动物,优选大鼠或小鼠,更优选内源性效应器功能不全的大鼠或小鼠(例如免疫缺陷的大鼠或小鼠)移植人类癌细胞、人类癌组织等,进行评价;或者,(ii)向敲入有人cd3基因的非人动物,优选大鼠或小鼠移植导入有hla和ny-eso基因的小鼠癌细胞等,进行评价。使用这些免疫缺陷动物或敲入动物进行评价,能够利用小鼠和/或大鼠的活体实施各种检测、免疫组织化学等,这在含有本发明的多特异性分子的药物、非临床开发等中是优选的。
[0543]
本发明中,“识别”即“结合”是指不是非特异性的吸附的结合。作为是否识别即是否结合的判定标准,例如可举出解离常数(dissociation constant,以下称作“kd”)。本发明优选抗体等对于hla/ny-eso或cd3的kd值为1
×
10-5
m以下、5
×
10-6
m以下、2
×
10-6
m以下、1
×
10-6
m以下;对于hla/ny-eso的优选kd值为5
×
10-7
m以下、2
×
10-7
m以下、1
×
10-7
m以下、5
×
10-8
m以下、2
×
10-8
m以下、1
×
10-8
m以下、5
×
10-9
m以下或2
×
10-9
m以下,更优选为1
×
10-9
m以下。作为具有优异抗原结合活性的本发明的抗hla/ny-eso scfv,可例举出nya-1143、nya-2023、nya-2143、nya-2044、nya-2045、nya-2060、nya-2061、nya-3061。nya-1143、nya-2044、nya-2045和nya-2143等对于hla/ny-eso的kd值为1
×
10-9
m以下(实施例4等)。
[0544]
本发明中的抗原和抗体的结合可以通过spr法、bli法等生物分子间相互作用分析系统,或者elisa法、ria法等进行测定或判定。细胞表面上表达的抗原和抗体的结合可以通过流式细胞术分析法等进行测定。
[0545]
spr法(表面等离子共振分析法)作为以下分析方法使用:通过化学动力学(动力
学)分析,测量结合速度常数(ka值)和解离速率常数(kd值),以求出作为亲和指标的解离常数(kd值)等。作为用于spr分析的设备,可例举出:biacore(商标)(ge healthcare公司生产)、proteon(商标)(biorad公司生产)、spr-navi(商标)(bionavis公司生产)、spreeta(商标)(texas instruments公司生产)、spri-plexii(商标)(堀场公司生产)、autolab spr(商标)(metrohm公司生产)等。
[0546]
bli法(biolayer interferometry,生物膜层干涉)是使用生物膜干涉来测量生物分子间相互作用的方法。作为使用bli法分析相互作用时所使用的设备,可例举octet系统(pall fortebio公司生产)等。
[0547]
elisa(enzyme-linked immunosorbent assay,酶联免疫吸附测定)法是利用特异性抗体或抗原捕捉样品溶液中所含有的目的抗原或抗体,并利用酶反应进行检测和定量的方法。将酶标记的抗原或抗体整合到反应系,检测酶活性。酶活性的检测使用吸收光谱因反应而变化的底物,通过吸光度测定来转换为数值。
[0548]
cell-elisa是捕捉每个细胞的位于细胞表面的测定对象,并利用酶反应进行检测和定量的方法。
[0549]
ria法(radio immunoassay,放射免疫测定)使用放射性物质标记抗体,测定来自抗体的放射性,由此能够进行抗体的定量。
[0550]
流式细胞术分析法是将细胞分散到流体中,使该流体细细流动,对各个细胞进行光学分析的方法。用荧光色素标记的抗体通过抗原抗体反应与细胞表面抗原结合,测定与细胞结合的被标记的抗体的荧光强度,由此对抗体的抗原结合性进行定量。
[0551]
作为本发明的抗hla/ny-eso抗体等中具有优异抗原结合特异性的抗体,可例举:作为抗hla/ny-eso scfv的nya-0001、nya-1143、nya-1163、nya-2023、nya-2027、nya-2035、nya-2044、nya-2045、nya-2047、nya-2048、nya-2060、nya-2061、nya-2143和nya-3061(实施例6等)。
[0552]
3.与hla/ny-eso特异性结合的抗体或其结合片段
[0553]
3-1.抗hla/ny-eso或其结合片段
[0554]
本发明提供识别hla/ny-eso并与之结合的抗体或其结合片段。
[0555]
如前所述,hla/ny-eso是包含hla-a2和9mer的ny-eso肽(sllmwitqc,seq id no:1)的复合物。ny-eso肽是胞内蛋白,是来自癌-睾丸(cancer-testis)抗原ny-eso-1或lage-1的肽。hla/ny-eso向癌细胞表面提呈。
[0556]
本发明的抗hla/ny-eso抗体和该抗体的抗原结合片段(以下也记作本发明的抗体等)可以是单克隆抗体和多克隆抗体中的任一种。本发明的单克隆抗体的同种型没有特别限制,例如可举出igg1、igg2、igg3、igg4等的igg,igm,iga1、iga2等的iga,igd,ig等。单克隆抗体的同种型和亚类例如可通过琼脂双向免疫扩散法、elisa法、ria法等来确定。作为本发明的单克隆抗体,可举出:来自非人动物的抗体(非人动物抗体)、人抗体、嵌合化抗体(也叫做“嵌合抗体”)、人源化抗体等,优选可以使用人抗体。本发明的抗体的范围也包括抗体的突变体(后述的“突变抗体”),例如,人抗体的范围也包括人突变抗体。
[0557]
作为非人动物抗体,可举出来自哺乳类动物、鸟类动物等脊椎动物的抗体等。作为来自哺乳类动物的抗体,可举出小鼠抗体、大鼠抗体等来自啮齿类动物的抗体等。作为来自鸟类动物的抗体,可举出鸡抗体等。
[0558]
作为嵌合化抗体,可举出但不限于:来自非人动物抗体的可变区与人抗体(人免疫球蛋白)恒定区结合而形成的抗体等。
[0559]
作为人源化抗体,可举出但不限于:将非人动物抗体的可变区中的cdr移植到人抗体(人免疫球蛋白的可变区)而形成的抗体;除了cdr以外,也将非人动物抗体的框架区的部分序列移植到人抗体而形成的抗体;将来自上述任一种非人动物抗体的一个或两个以上的氨基酸取代为人型氨基酸而形成的抗体等。
[0560]
抗体可以通过各种公知方法制作。作为公知方法,可以通过使用杂交瘤的方法和细胞免疫法等制作,也可以通过基因重组的方法制作。另外,也已知有获得来自从人抗体文库中筛选的噬菌体展示的人抗体的方法。例如,可以使用将人抗体的可变区作为scfv,使其在噬菌体表面表达,选择与抗原结合的噬菌体的噬菌体展示法。通过对根据与抗原结合而选择的噬菌体的基因进行分析,可以确定编码与抗原结合的人抗体的可变区的dna序列。只要明确了与抗原结合的scfv的dna序列,就可以制作具有该序列的表达载体,将其导入到适当的宿主中并表达,由此能够获得人抗体(wo92/01047,wo92/20791,wo93/06213,wo93/11236,wo93/19172,wo95/01438,wo95/15388、annu.rev.immunol(1994)12,433-455)。
[0561]
也可以将如此得到的具有高活性的抗体用作先导抗体,使编码该先导抗体的基因突变,制作更高活性的突变体(后述的“突变抗体”)。
[0562]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的重链所包含的cdrh1~cdrh3,可优选举出:由seq id no:54(图61)所示的氨基酸序列组成的cdrh1,由seq id no:55(图61)所示的氨基酸序列组成的cdrh2,以及由seq id no:56(图61)所示的氨基酸序列、或者由在seq id no:56(图61)所示的氨基酸序列中第6位氨基酸为n(asn)的氨基酸序列组成的重链cdrh3的组合。更优选地,可举出以下重链可变区所包含的cdrh1~cdrh3的组合:由seq id no:6(图13)所示的氨基酸序列组成的nya-0001重链可变区;由seq id no:18(图25)所示的氨基酸序列组成的nya-0082重链可变区;由seq id no:27(图34)所示的氨基酸序列的氨基酸编号21~140组成的nya-2023重链可变区;由seq id no:28(图35)所示的氨基酸序列的氨基酸编号21~140组成的nya-2027重链可变区;由seq id no:29(图36)所示的氨基酸序列的氨基酸编号21~140组成的nya-1143重链可变区;由seq id no:26(图33)所示的氨基酸序列的氨基酸编号21~140组成的nya-1163重链可变区;由seq id no:27(图34)所示的氨基酸序列的氨基酸编号21~140组成的nya-2023重链可变区;由seq id no:28(图35)所示的氨基酸序列的氨基酸编号21~140组成的nya-2027重链可变区;由seq id no:36(图43)所示的氨基酸序列的氨基酸编号21~140组成的nya-2035重链可变区;由seq id no:47(图54)所示的氨基酸序列的氨基酸编号21~140组成的nya-2044重链可变区;由seq id no:48(图55)所示的氨基酸序列的氨基酸编号21~140组成的nya-2045重链可变区;由seq id no:50(图57)所示的氨基酸序列的氨基酸编号21~140组成的nya-2047重链可变区;由seq id no:51(图58)所示的氨基酸序列的氨基酸编号21~140组成的nya-2048重链可变区;由seq id no:52(图59)所示的氨基酸序列的氨基酸编号21~140组成的nya-2060重链可变区;由seq id no:53(图60)所示的氨基酸序列的氨基酸编号21~140组成的nya-2061重链可变区;或者,由seq id no:30(图37)所示的氨基酸序列的氨基酸编号21~140组成的nya-2143重链可变区。
[0563]
另外,还可举出由seq id no:156(图152)所示的氨基酸序列的氨基酸编号21~
140组成的nya-3061重链可变区所包含的cdrh1~cdrh3的组合。
[0564]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的轻链所包含的cdrl1~cdrl3,可优选举出:由seq id no:57(图61)所示的氨基酸序列,或者由在seq id no:57(图61)所示的氨基酸序列中第7位氨基酸为w(trp)或第8位氨基酸为k(lys)的氨基酸序列组成的cdrl1,由seq id no:58(图61)所示的氨基酸序列组成的cdrl2,以及由seq id no:59(图61)所示的氨基酸序列,或者由在seq id no:59(图61)所示的氨基酸序列中第2位氨基酸为a(ala)或s(ser)的氨基酸序列组成的cdrl3的组合。
[0565]
更优选地,可举出以下轻链可变区所包含的cdrl1~cdrl3的组合:由seq id no:8(图15)所示的氨基酸序列组成的nya-0001轻链可变区;由seq id no:20(图27)所示的氨基酸序列组成的nya-0082轻链可变区;由seq id no:29(图36)所示的氨基酸序列的氨基酸编号156~266组成的nya-1143轻链可变区;由seq id no:26(图33)所示的氨基酸序列的氨基酸编号156~266组成的nya-1163轻链可变区;由seq id no:27(图34)所示的氨基酸序列的氨基酸编号156~266组成的nya-2023轻链可变区;由seq id no:28(图35)所示的氨基酸序列的氨基酸编号156~266组成的nya-2027轻链可变区;由seq id no:36(图43)所示的氨基酸序列的氨基酸编号156~266组成的nya-2035轻链可变区;由seq id no:47(图54)所示的氨基酸序列的氨基酸编号156~266组成的nya-2044轻链可变区;由seq id no:48(图55)所示的氨基酸序列的氨基酸编号156~266组成的nya-2045轻链可变区;由seq id no:50(图57)所示的氨基酸序列的氨基酸编号156~266组成的nya-2047轻链可变区;由seq id no:51(图58)所示的氨基酸序列的氨基酸编号156~266组成的nya-2048轻链可变区;由seq id no:52(图59)所示的氨基酸序列的氨基酸编号156~266组成的nya-2060轻链可变区;由seq id no:53(图60)所示的氨基酸序列的氨基酸编号156~266组成的nya-2061轻链可变区;或者,由seq id no:30(图37)所示的氨基酸序列的氨基酸编号156~266组成的nya-2143轻链可变区。
[0566]
另外,还可举出由seq id no:156(图152)所示的氨基酸序列的氨基酸编号161~271组成的nya-3061轻链可变区所包含的cdrl1~cdrl3的组合。
[0567]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的重链所包含的cdrh1~cdrh3以及轻链所包含的cdrl1~cdrl3,可优选举出:由seq id no:54(图61)所示的氨基酸序列组成的cdrh1、由seq id no:55(图61)所示的氨基酸序列组成的cdrh2、由seq id no:56(图61)所示的氨基酸序列,或者由在seq id no:56(图61)所示的氨基酸序列中第6位氨基酸为n(asn)的氨基酸序列组成的重链cdrh3、由seq id no:57(图61)所示的氨基酸序列,或者由在seq id no:57(图61)所示的氨基酸序列中第7位氨基酸为n(asn)和/或第8位氨基酸为k(lys)的氨基酸序列组成的cdrl1、由seq id no:58(图61)所示的氨基酸序列组成的cdrl2,以及由seq id no:59(图61)所示的氨基酸序列,或者由在seq id no:59所示的氨基酸序列中第2位氨基酸为a (ala)或s(ser)的氨基酸序列组成的cdrl3的组合。更优选地,可举出以下重链可变区和轻链可变区分别包含的cdrh1~cdrh3和cdrl1~cdrl3的组合:由seq id no:6和seq id no:8分别所示的氨基酸序列组成的nya-0001重链可变区和轻链可变区;由seq id no:29(图36)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-1143重链可变区和轻链可变区;由seq id no:26(图33)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-1163重链可变区和轻链可变区;由seq id no:27(图34)
所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2023重链可变区和轻链可变区;由seq id no:28(图35)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2027重链可变区和轻链可变区;由seq id no:36(图43)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2035重链可变区和轻链可变区;由seq id no:47(图54)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2044重链可变区和轻链可变区;由seq id no:48(图55)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2045重链可变区和轻链可变区;由seq id no:50(图57)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2047重链可变区和轻链可变区;由seq id no:51(图58)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2048重链可变区和轻链可变区;由seq id no:52(图59)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2060重链可变区和轻链可变区;由seq id no:53(图60)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2061重链可变区和轻链可变区;或者,由seq id no:30(图37)所示的氨基酸序列的氨基酸编号21~140和156~266组成的nya-2143重链可变区和轻链可变区。
[0568]
另外,还可举出由seq id no:156(图152)所示的氨基酸序列的氨基酸编号21~140和161~271组成的nya-3061重链可变区和轻链可变区分别包含的cdrh1~cdrh3和cdrl1~cdrl3的组合。
[0569]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的重链可变区,可举出上述重链cdr或包含它们的组合的重链可变区作为优选示例,更优选地,可例举:nya-0001重链可变区、nya-0082重链可变区、nya-1143重链可变区、nya-1163重链可变区、nya-2023重链可变区、nya-2027重链可变区、nya-2035重链可变区、nya-2044重链可变区、nya-2045重链可变区、nya-2047重链可变区、nya-2048重链可变区、nya-2060重链可变区、nya-2061重链可变区、nya-2143重链可变区,以及nya-3061重链可变区。各个重链可变区的氨基酸序列如上所述。
[0570]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的轻链可变区,可举出上述轻链cdr或包含它们的组合的轻链可变区作为优选示例,更优选地,可例举:nya-0001轻链可变区、nya-0082轻链可变区、nya-1143轻链可变区、nya-1163轻链可变区、nya-2023轻链可变区、nya-2027轻链可变区、nya-2035轻链可变区、nya-2044轻链可变区、nya-2045轻链可变区、nya-2047轻链可变区、nya-2048轻链可变区、nya-2060轻链可变区、nya-2061轻链可变区、nya-2143轻链可变区,以及nya-3061轻链可变区。各个轻链可变区的氨基酸序列如上所述。
[0571]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的重链可变区和轻链可变区,可举出上述重链和轻链的cdr或包含它们的组合的重链可变区和轻链可变区作为优选示例,更优选地,可例举:nya-0001重链可变区和轻链可变区、nya-0082重链可变区和轻链可变区、nya-1143重链可变区和轻链可变区、nya-1163重链可变区和轻链可变区、nya-2023重链可变区和轻链可变区、nya-2027重链可变区和轻链可变区、nya-2035重链可变区和轻链可变区、nya-2044重链可变区和轻链可变区、nya-2045重链可变区和轻链可变区、nya-2047重链可变区和轻链可变区、nya-2048重链可变区和轻链可变区、nya-2060重链可变区和轻链可变区、nya-2061重链可变区和轻链可变区,以及nya-2143重链可变区和轻链可变区的
组合,和nya-3061重链可变区和轻链可变区的组合。
[0572]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的重链,可举出包含上述优选或更优选的重链可变区的重链作为优选示例,更优选地,可例举:nya-0001重链、nya-0082重链、nya-1143重链、nya-1163重链、nya-2023重链、nya-2027重链、nya-2035重链、nya-2044重链、nya-2045重链、nya-2047重链、nya-2048重链、nya-2060重链、nya-2061重链、nya-2143重链,以及nya-3061重链。
[0573]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的轻链,可举出包含上述优选或更优选的轻链可变区的轻链作为优选示例,更优选地,可例举:nya-0001轻链、nya-0082轻链、nya-1143轻链、nya-1163轻链、nya-2023轻链、nya-2027轻链、nya-2035轻链、nya-2044轻链、nya-2045轻链、nya-2047轻链、nya-2048轻链、nya-2060轻链、nya-2061轻链、nya-2143轻链,以及nya-3061轻链。
[0574]
作为本发明的抗hla/ny-eso抗体或其抗原结合片段的重链和轻链,可举出分别包含上述优选或更优选的重链可变区和轻链可变区的重链和轻链作为优选示例,更优选地,可例举:nya-0001、nya-1143、nya-1163、nya-2023、nya-2027、nya-2035、nya-2044、nya-2045、nya-2047、nya-2048、nya-2060、nya-2061、nya-2143,以及nya-3061的重链和轻链的组合。
[0575]
抗体的抗原结合片段是指,该抗体所具有的功能中至少保持抗原结合性的片段或其修饰物。作为该抗体的功能,一般可举出:抗原结合活性、调节抗原活性的活性、抗体依赖性细胞毒活性,以及补体依赖性细胞毒活性等。作为本发明的抗体等和包含本发明的抗体等的多特异性分子时的功能,例如可举出:t细胞的重定向、t细胞的活化、t细胞的活化产生的对癌细胞的细胞毒活性。
[0576]
作为抗体的抗原结合片段,只要是该抗体所具有的活性中至少保持抗原结合性的该抗体的片段,就没有特别限制,例如可举出但不限于:fab、fab’、f(ab’)2、fv、重链和轻链的fv通过适当的接头连接而成的单链fv(scfv)、单域抗体(sdab)等。像具有接头部分的scfv那样,含有本发明的抗体的抗原结合片段以外的部分的分子,也包含在本发明的抗体的抗原结合片段的含义中。
[0577]
抗体蛋白的氨基末端和/或羧基末端的氨基酸缺失1个或数个或者数个以上而形成的、且保持该抗体所具有的功能的至少一部分的分子,也包含在抗体的抗原结合片段的含义中。这种抗体的抗原结合片段的修饰物,也包含在本发明的抗体或其抗原结合片段,或者其修饰物(后述)中。
[0578]
本发明的抗体或其抗原结合片段的一个形式是scfv。scfv通过将抗体的重链可变区和轻链可变区用多肽的接头连接而得到(pluckthun a.the pharmacology of monoclonal antibodies113,rosenburg和moore编,springer verlag,new york,269-315(1994),nature biotechnology(2005),23,1126-1136)。另外,将两个scfv用多肽接头连接而制作的串联scfv,也可以用作双特异性分子。此外,三个以上的scfv所组成的三体等也可以用作双特异性分子。
[0579]
作为对hla/ny-eso具有特异性的scfv(也叫做“抗hla/ny-eso scfv”),可优选例举包含上述cdrh1~cdrh3和cdrl1~cdrl3的scfv;更优选地可例举包含上述重链可变区和轻链可变区的scfv;进一步优选地可例举:nya-0001(seq id no:70(图71)所示的氨基酸序
列的氨基酸编号21~266);nya-0082(包含seq id no:18(图25)所示的氨基酸序列和seq id no:20(图27)所示的氨基酸序列);nya-1143(seq id no:29(图36)所示的氨基酸序列的氨基酸编号21~266);nya-1163(seq id no:26(图33)所示的氨基酸序列的氨基酸编号21~266);nya-2023(seq id no:27(图34)所示的氨基酸序列的氨基酸编号21~266);nya-2027(seq id no:28(图35)所示的氨基酸序列的氨基酸编号21~266);nya-2035(seq id no:36(图43)所示的氨基酸序列的氨基酸编号21~266);nya-2044(seq id no:47(图54)所示的氨基酸序列的氨基酸编号21~266);nya-2045(seq id no:48(图55)所示的氨基酸序列的氨基酸编号21~266);nya-2047(seq id no:50(图57)所示的氨基酸序列的氨基酸编号21~266);nya-2048(seq id no:51(图58)所示的氨基酸序列的氨基酸编号21~266);nya-2060(seq id no:52(图59)所示的氨基酸序列的氨基酸编号21~266);nya-2061(seq id no:53(图60)所示的氨基酸序列的氨基酸编号21~266);以及nya-2143(seq id no:30(图37)所示的氨基酸序列的氨基酸编号21~266)。另外,还可例举nya-3061(seq id no:156(图152)所示的氨基酸序列的氨基酸编号21~271)。
[0580]
抗hla/ny-eso scfv的优选形式包括在羧基末端侧融合有flag-his标签的形式(也单纯称为“标签添加物”)。作为优选的标签添加物,可举出:nya-0001标签添加物(seq id no:70(图71)的氨基酸编号20~292);nya-1143标签添加物(seq id no:29(图36)的氨基酸编号20~292);nya-1163标签添加物(seq id no:26(图33)的氨基酸编号20~292);nya-2023标签添加物(seq id no:27(图34)的氨基酸编号20~292);nya-2027标签添加物(seq id no:28(图35)的氨基酸编号20~292);nya-2035标签添加物(seq id no:36(图43)的氨基酸编号20~292);nya-2044标签添加物(seq id no:47(图54)的氨基酸编号20~292);nya-2045标签添加物(seq id no:48(图55)的氨基酸编号20~292);nya-2047标签添加物(seq id no:50(图57)的氨基酸编号20~292);nya-2048标签添加物(seq id no:51(图58)的氨基酸编号20~292);nya-2060标签添加物(seq id no:52(图59)的氨基酸编号20~292);nya-2061标签添加物(seq id no:53(图60)的氨基酸编号20~292);以及nya-2143标签添加物(seq id no:30(图37)的氨基酸编号20~292)。
[0581]
其中,在fc添加型双特异性分子中,nya-2023及其标签添加物、nya-2047及其标签添加物、nya-2048及其标签添加物、nya-2060及其标签添加物,以及nya-2061及其标签添加物具有优异的生物活性、物化性质等,是更加优选的。
[0582]
另外,当抗hla/ny-eso scfv及其标签添加物在宿主细胞中表达时,可以在其氨基末端添加信号肽。作为添加了信号肽的抗hla/ny-eso scfv标签添加物的氨基酸序列,可以举出seq id no:70、seq id no:29、seq id no:26~seq id no:28、seq id no:36、seq id no:47、seq id no:48、seq id no:50~seq id no:53,以及seq id no:30(图71、36、33~35、43、54、55、57~60和37)。
[0583]
scfv可以使用将抗体的可变区作为单链抗体(scfv),使其在噬菌体表面表达,选择与抗原结合的噬菌体的噬菌体展示法来获得(nature biotechnology(2005),23,(9),p.1105-1116)。通过对根据与抗原结合而选择的噬菌体的基因进行分析,可以确定编码与抗原结合的人抗体的可变区的dna序列。只要明确了与抗原结合的scfv的dna序列,就可以制作具有该序列的表达载体,将其导入到适当的宿主中并表达,由此能够获得人抗体(wo92/01047、wo92/20791、wo93/06213、wo93/11236、wo93/19172、wo95/01438、wo95/
15388、annu.rev.immunol(1994)12,p.433-455、nature biotechnology(2005)23(9),p.1105-1116)。
[0584]
本发明的抗体也可以是具有单一的重链可变区,而没有轻链序列的抗体。这种抗体叫做单域抗体(single domain antibody,sdab)或纳米抗体(nanobody),有报告称其具有抗原结合能力(muyldemans s.et.al.,protein eng.,(1994)7(9),1129-35,hamers-casterman c.et.al.,nature(1993)363(6428),446-448)。这些抗体也包含在本发明中的抗体的抗原结合片段的含义中。
[0585]
另外,本发明包括使用适当的接头将抗体的重链和轻链的全长序列连接而成的单链免疫球蛋白(single chain immunoglobulin)(lee,h-s,et.al.,molecular immunology(1999)36,61-71;shirrmann,t.et.al.,mabs(2010),2(1),1-4)。通过将这种单链免疫球蛋白二聚体化,可以保持与本来为四聚体的抗体相似的结构和活性。本发明的抗hla/ny-eso抗体也可以是单链免疫球蛋白。
[0586]
在本发明的scfv中,重链可变区和轻链可变区也可以通过二硫键结合。
[0587]
本发明的抗hla/ny-eso抗体如果与hla/ny-eso结合,则也可以是由来自多个不同抗体的部分构成的抗体,例如可举出:在多个不同抗体间交换重链和/或轻链而形成的抗体、交换重链和/或轻链的全长而形成的抗体、只交换可变区或只交换恒定区而形成的抗体、只交换cdr的全部或一部分而形成的抗体等。嵌合化抗体的重链可变区和轻链可变区也可以来自不同的本发明的抗hla/ny-eso抗体。人源化抗体的重链和轻链的可变区中的重链cdr1至重链cdr3以及轻链cdr1至轻链cdr3,可以来自两种或两种以上的本发明的抗hla/ny-eso抗体。人抗体的重链和轻链的可变区中的重链cdr1至重链cdr3以及轻链cdr1至轻链cdr3,也可以是两种或两种以上的本发明的抗hla/ny-eso抗体所具有的cdr的组合。
[0588]
本发明的抗hla/ny-eso抗体也包括以下抗体:包含与含有编码本发明的抗hla/ny-eso抗体所包含的氨基酸序列的核苷酸序列的多核苷酸的互补链在严谨条件下杂交的多核苷酸所包含的核苷酸序列所编码的氨基酸序列,且与hla/ny-eso结合的抗体。
[0589]
也可以是以下抗体或其抗原结合片段:含有与本发明的抗hla/ny-eso抗体或其抗原结合片段的重链可变区所包含的氨基酸序列(优选为seq id no:27所示的氨基酸序列的氨基酸编号21~140的氨基酸序列、seq id no:38所示的氨基酸序列、seq id no:39所示的氨基酸序列,或者,seq id no:160、seq id no:197或seq id no:198所示的氨基酸序列的氨基酸编号21~140的氨基酸序列),和/或,轻链可变区所包含的氨基酸序列(优选为seq id no:27所示的氨基酸序列的氨基酸编号156~266的氨基酸序列、seq id no:52所示的氨基酸序列的氨基酸编号156~266的氨基酸序列、seq id no:40所示的氨基酸序列、seq id no:160所示的氨基酸序列的氨基酸编号161~271的氨基酸序列,或者,seq id no:197或seq id no:198所示的氨基酸序列的氨基酸编号156~266的氨基酸序列)具有90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以上同一性的氨基酸序列,且与hla/ny-eso结合的抗体或其抗原结合片段。
[0590]
关于轻链可变区的位置和长度,与根据imgt的定义确定的情况相比,如果使用不同于imgt的定义(例如kabat、chothia、abm、contact等)来确定,则在根据imgt的定义确定的该轻链可变区氨基酸序列的羧基末端,有时还会含有一个或两个以上的氨基酸,例如精氨酸和甘氨酸。具有这种轻链可变区的抗体或其结合片段,也包含在本发明的抗体或其结
合片段中。
[0591]
作为本发明的抗体等,也可以是向本发明的抗hla/ny-eso抗体的结合片段导入突变,优化针对hla/ny-eso,特别是人和/或食蟹猴的hla/ny-eso的结合能力的抗体等。作为导入突变的具体方法,可举出:使用错配pcr法的随机诱变法、使用nnk文库的位点特异性氨基酸突变导入、利用结构信息的位点特异性突变导入,以及它们的组合。
[0592]
3-2.抗hla/ny-eso抗体的突变体(突变抗体)
[0593]
本发明的抗hla/ny-eso抗体的突变抗体优选可以具备以下功能:降低对蛋白质的分解或氧化的感受性;维持、改善生物活性和功能,或者抑制生物活性和功能的下降和变化;改善或调节抗原结合能力,或者赋予物理化学性质或功能性质。已知蛋白质表面的特定氨基酸侧链发生变化,该蛋白质的功能和活性会发生变化,这种示例包括天冬酰胺侧链的脱酰胺化、天冬氨酸侧链的异构化等。为了防止这种氨基酸侧链的变化而取代为其他氨基酸的突变抗体,也包含在本发明的突变抗体的范围内。
[0594]
作为本发明的突变抗体的示例,可举出:具有在抗体所具有的氨基酸序列中进行保守性氨基酸取代而形成的氨基酸序列的抗体。保守性氨基酸取代是指,在与氨基酸侧链有关联的氨基酸组内发生的取代。
[0595]
优选的氨基酸组如下:酸性组=天冬氨酸、谷氨酸;碱性组=赖氨酸、精氨酸、组氨酸;非极性组=丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸、色氨酸;以及不带电极性组=甘氨酸、天冬酰胺、谷氨酰胺、半胱氨酸、丝氨酸、苏氨酸、酪氨酸。其他优选的氨基酸组如下:脂肪族羟基组=丝氨酸和苏氨酸;含酰胺组=天冬酰胺和谷氨酰胺;脂肪族组=丙氨酸、缬氨酸、亮氨酸和异亮氨酸;以及芳香族组=苯丙氨酸、色氨酸和酪氨酸。该突变抗体中的氨基酸取代,优选在不会降低原抗体所具有的抗原结合活性的范围内进行。
[0596]
以下也包含在本发明的抗hla/ny-eso抗体、其抗原结合片段、其突变体(突变抗体或其抗原结合片段),或本发明的分子中:具有在nya-2023等本发明的抗体所具有的氨基酸序列中进行了保守性氨基酸取代和/或其他突变的氨基酸序列,且与hla/ny-eso结合的突变抗体、它们的抗原结合片段、包含它们的分子等;具有在来自含有nya-2023等的本发明的抗体的cdrh1至cdrh3以及cdrl1至cdrl3的任一氨基酸序列中进行了保守性氨基酸取代和/或其他突变的氨基酸序列,且与hla/ny-eso结合的包含该cdr的嵌合化抗体、人源化抗体、人抗体、它们的抗原结合片段、含有它们的分子等。
[0597]
3-3.抗hla/ny-eso抗体的结合片段
[0598]
作为本发明的一个形式,提供了本发明的抗hla/ny-eso抗体的抗原结合片段(以下单纯称作“结合片段”)。本发明的抗hla/ny-eso抗体的结合片段中,包含嵌合化抗体、人源化抗体或人抗体的结合片段。抗体的结合片段是指,该抗体所具有的功能中至少保持抗原结合性的片段或其修饰物。作为该抗体的功能,一般可举出:抗原结合活性、调节抗原活性的活性(例如激动剂活性)、使抗原在细胞中内化的活性、抑制或促进与和抗原相互作用的物质的相互作用的活性等。
[0599]
作为抗体的结合片段,只要是该抗体所具有的活性中至少保持抗原结合性的该抗体的片段,就没有特别限制。作为这种抗体的结合片段,例如可举出但不限于:fab、fab’、f(ab’)2、fab轻链的羧基末端与fab重链的氨基末端通过适当的接头连接而成的单链fab
(scfab)、fv、重链和轻链的fv通过适当的接头连接而成的单链fv(scfv)、具有单一的重链可变区而没有轻链序列的单域抗体(sdab),或者也称作纳米抗体(nanobody)(muyldemans s.et.al.,protein eng.,(1994)7(9),1129-35,hamers-casterman c.et.al.,nature(1993)363(6428),446-448)]等。像持有接头部分的scfab、scfv那样,含有本发明的抗体的结合片段以外的部分的分子,也包含在本发明的抗体的结合片段的含义中。
[0600]
3-4.抗hla/ny-eso抗体或其结合片段的修饰物、复合物
[0601]
本发明提供抗体或其结合片段的修饰物。本发明的抗体或其结合片段的修饰物是指,对本发明的抗体或其结合片段实施了化学或生物学的修饰而形成的修饰物。化学修饰物包括:通向氨基酸骨架的化学部分的化学键、n-键或o-键碳水化合物链的化学修饰物等。生物修饰物包括:翻译后修饰(例如,在n-键或o-键添加糖链、氨基末端区域或羧基末端区域的加工、脱酰胺化、天冬氨酸的异构化、甲硫氨酸的氧化)的修饰物、使用原核生物宿主细胞进行表达以在氨基末端添加甲硫氨酸残基而形成的修饰物等。另外,为了能够检测或分离本发明的抗体或抗原而标记的物质,例如酶标记物、荧光标记物、亲和标记物,也包含在该修饰物的含义中。这种本发明的抗体或其结合片段的修饰物,可以用于改善原来的本发明的抗体或其结合片段的稳定性和血液中的滞留性、降低抗原性、检测或分离该抗体或抗原等。
[0602]
作为化学修饰物所包含的化学部分,可例举:聚乙二醇(peg)、乙二醇/丙二醇共聚物、羧甲基纤维素、葡聚糖、聚乙烯醇等水溶性聚合物。
[0603]
作为生物修饰物,可举出:通过酶处理和细胞处理等实施修饰的修饰物、通过基因重组而添加标签等其他肽的融合体,以及将表达内源性或外源性糖链修饰酶的细胞作为宿主制备的修饰物等。
[0604]
该修饰可以在抗体或其结合片段中的任意位置,或者在期望的位置实施,也可以在一个或两个以上的位置实施相同的修饰或两种以上的不同修饰。
[0605]
但是,这些重链序列的缺失,或者,重链或轻链序列的修饰不会对抗体的抗原结合能力和效应器功能(补体的活化和抗体依赖性细胞毒性作用等)造成影响。
[0606]
因此,本发明也包含经受该缺失或修饰的抗体。例如,可举出:在重链羧基末端缺失了一个或两个氨基酸的缺失体(journal of chromatography a;705;129-134(1995));重链羧基末端的甘氨酸、赖氨酸这两个氨基酸残基缺失,而新的位于羧基末端的脯氨酸残基酰胺化的缺失体(analytical biochemistry,360:75-83(2007));抗体的重链或轻链的氨基末端的谷氨酰胺或谷氨酸残基被焦谷氨酰化修饰的抗体(国际专利公布wo2013/147153号)等(这些统称为“缺失体”)。不过,只要能保持抗原结合能力和效应器功能,则本发明涉及的抗体的重链和轻链的羧基末端的缺失体不限于上述种类。当本发明涉及的抗体含有两条以上的链(例如重链)时,该两条以上的链(例如重链)既可以是完全长度的重链和选自由上述缺失体组成的组的重链中的任一种,也可以是任意两种的组合。各缺失体的量比或分子数比会受到产生本发明涉及的抗体的哺乳类动物培养细胞的种类和培养条件的影响,但作为本发明涉及的抗体的主成分,可举出两条重链在羧基末端都缺失一个氨基酸残基的情况。
[0607]
另外,即使本发明的抗体或其抗原结合片段(本发明的分子、多特异性分子、双特异性分子等包含的抗体或其抗原结合片段)在氨基末端和/或羧基末端添加有来自表达载
体和/或信号序列等的一个或数个氨基酸(且其部分或全部如前所述进行了修饰),只要能维持期望的抗原结合活性,就包含在本发明的抗体的修饰物或其抗原结合片段的修饰物的范围内,包含这种抗体或抗原结合片段的修饰物的分子也包含在本发明的分子的范围内。
[0608]
本发明中,“抗体或其结合片段”包含“抗体或其抗原结合片段的修饰物”的含义。另外,本发明的分子、多特异性分子、双特异性分子等包含的“抗体或其抗原结合片段”,包含涉及的“抗体或其抗原结合片段的修饰物”的含义。
[0609]
另外,通过调节与本发明的抗体结合的糖链修饰(糖基化、去岩藻糖基化等),能够增强抗体依赖性细胞毒活性。作为抗体糖链修饰的调节技术,可举出但不限于:国际专利公布wo99/54342号、wo00/61739号、wo02/31140号等。
[0610]
本发明也包含上述抗体与其他分子通过接头连接而成的复合物(immunoconjugate,免疫缀合物)。作为抗体与放射性物质或具有药理作用的化合物(药物)缀合而成的抗体-药物复合物的示例,可举出adc(antibody-drug conjugate,抗体药物缀合物)(methods mol biol.(2013)1045:1-27;nature biotechnology(2005)23,p.1137-1146)。
[0611]
另外,本发明还包含这些抗体与其他功能性多肽连接而成的复合物。作为这种抗体-肽复合物的示例,可举出抗体与白蛋白结合多肽的复合物(protein eng des sel.(2012)(2):81-8)。
[0612]
上述抗体的修饰物、糖链修饰被调节的抗体、复合物包含在本发明的抗体中;上述抗体的修饰物、糖链修饰被调节的抗体、复合物的结合片段包含在本发明的抗体的结合片段中。
[0613]
4.抗体的产生方法
[0614]
本发明的抗体例如可以通过将编码重链可变区的dna或编码轻链可变区的dna插入到表达载体,使用该载体转化用于表达的宿主细胞,培养宿主细胞,从而使细胞产生本发明的抗体作为重组抗体。
[0615]
关于编码抗体的dna,将编码重链可变区的dna与编码重链恒定区的dna连接,可以得到编码重链的dna;另外,将编码轻链可变区的dna与编码轻链恒定区的dna连接,可以得到编码轻链的dna。
[0616]
关于本发明的抗hla/ny-eso抗体,可以将上述编码重链的dna和编码轻链的dna插入到表达载体,使用该载体转化宿主细胞,培养该宿主细胞,从而产生本发明的抗hla/ny-eso抗体。此时,既可以将上述编码重链的dna和编码轻链的dna导入到相同的表达载体,使用该载体转化宿主细胞,也可以将编码重链的dna和编码轻链的dna引入到各自不同的表达载体,使用两个载体转化宿主细胞。此时,也可以将编码重链可变区和轻链可变区的dna引入到预先引入有编码重链恒定区的dna和编码轻链恒定区的dna的载体。另外,该载体也可以包含编码促进宿主细胞分泌抗体的信号肽的dna。这种情况下,编码信号肽的dna与编码抗体的dna符合读框地连接。抗体产生后除去信号肽,由此可以得到作为成熟蛋白质的抗体。
[0617]
此时,也可以将编码重链可变区的dna、编码轻链可变区的dna、编码重链可变区的dna与编码重链恒定区的dna连接而成的dna、编码轻链可变区的dna与编码轻链恒定区的dna连接而成的dna,与启动子、增强子、多聚腺苷酸化信号等元件功能性地连接。在此,功能
性地连接是指,进行连接以使元件实现其功能。
[0618]
表达载体只要能够在动物细胞、细菌、酵母等宿主中复制,就没有特别限制,例如可举出公知的质粒、噬菌体等。作为用于构建表达载体的载体,例如可举出:pcdna(商标)(赛默飞世尔科技公司)、flexi(注册商标)载体(普洛麦格公司)、puc19、puex2(amersham公司生产)、pgex-4t、pkk233-2(pharmacia公司生产)、pmam-neo(clontech公司生产)等。作为宿主细胞,既可以使用大肠杆菌、枯草杆菌等原核细胞,也可以使用酵母、动物细胞等真核细胞,优选使用真核细胞。例如,作为动物细胞,可以使用人胚胎肾细胞系hek293细胞、中国仓鼠卵巢(cho)细胞等。表达载体可以通过公知的方法导入到宿主细胞,转化宿主细胞。例如可举出:电穿孔法、磷酸钙沉淀法、deae-葡聚糖转染法等。产生的抗体可以使用在普通的蛋白质中使用的分离、纯化方法进行纯化。例如,可以适宜选择和组合:亲和层析、其他的层析、滤膜、超滤膜、盐析、透析等。
[0619]
5.与hla/ny-eso结合的分子
[0620]
本发明的分子包含本发明的抗hla/ny-eso抗体或其抗原结合片段。本发明的分子优选为具有两个以上的抗原结合位点的多特异性分子。即,本发明的分子是能够与一个分子上的两个以上彼此不同的表位或两个以上的分子上的彼此不同的表位结合的分子,包含多个彼此不同的抗原结合片段。这种多特异性分子包括但不限于:igg型多特异性分子;具有两种以上可变区的多特异性分子;例如串联scfv(tafv)、单链双体、双体和三体等抗体片段、通过共价键或非共价键连接的抗体片段。多特异性分子也可以包含fc。
[0621]
本发明的多特异性分子除了本发明的抗hla/ny-eso抗体或其抗原结合片段外,还可以包含一个或两个以上的其他抗体或该抗体的抗原结合片段。作为其他抗体的抗原结合片段,例如可举出fab、f(ab)’、fv、scfv、sdab。
[0622]
本发明优选的多特异性分子还包含抗cd3抗体或其抗原结合片段,也与cd3特异性结合。
[0623]
本发明的多特异性分子所包含的抗cd3抗体或其抗原结合片段,只要是与人cd3结合的抗体或其结合片段就没有特别限制,优选也与食蟹猴等非人灵长类动物的cd3结合。作为更优选的抗cd3抗体或其抗原结合片段,可例举含有以下重链可变区和轻链可变区的抗体或其抗原结合片段:由seq id no:141所示的氨基酸序列组成的重链可变区cdrh1;由seq id no:142所示的氨基酸序列组成的重链可变区cdrh2;由seq id no:143所示的氨基酸序列组成的重链可变区cdrh3;由seq id no:144所示的氨基酸序列组成的轻链可变区cdrl1;由seq id no:145所示的氨基酸序列组成的轻链可变区cdrl2;以及由seq id no:146所示的氨基酸序列组成的轻链可变区cdrl3(以上参考图142)。
[0624]
作为该含有cdrh1~cdrh3和cdrl1~cdrl3的更优选的抗体或其抗原结合片段,可例举含有以下重链可变区的抗体或其抗原结合片段:由seq id no:136(图137)所示的氨基酸序列的氨基酸编号2~119的氨基酸序列组成的c3e-7034重链可变区;由seq id no:137(图138)所示的氨基酸序列的氨基酸编号2~119的氨基酸序列组成的c3e-7036重链可变区;由seq id no:138(图139)所示的氨基酸序列的氨基酸编号2~119的氨基酸序列组成的c3e-7085重链可变区;由seq id no:139(图140)所示的氨基酸序列的氨基酸编号2~119的氨基酸序列组成的c3e-7088重链可变区;由seq id no:140(图141)所示的氨基酸序列的氨基酸编号2~119的氨基酸序列组成的c3e-7093重链可变区;由seq id no:155(图151)所示
的氨基酸序列的氨基酸编号272~389的氨基酸序列组成的c3e-7096重链可变区;由seq id no:156(图152)所示的氨基酸序列的氨基酸编号277~394的氨基酸序列组成的c3e-7096重链可变区;由seq id no:157(图153)所示的氨基酸序列的氨基酸编号277~394的氨基酸序列组成的c3e-7097重链可变区。
[0625]
另外,作为该含有cdrh1~cdrh3和cdrl1~cdrl3的更优选的抗体或其抗原结合片段,可例举含有以下轻链可变区的抗体或其抗原结合片段:由seq id no:136(图137)所示的氨基酸序列的氨基酸编号135~243的氨基酸序列组成的c3e-7034轻链可变区;由seq id no:137(图138)所示的氨基酸序列的氨基酸编号135~241的氨基酸序列组成的c3e-7036轻链可变区;由seq id no:138(图139)所示的氨基酸序列的氨基酸编号135~241的氨基酸序列组成的c3e-7085轻链可变区;由seq id no:139(图140)所示的氨基酸序列的氨基酸编号135~243的氨基酸序列组成的c3e-7088轻链可变区;由seq id no:140(图141)所示的氨基酸序列的氨基酸编号135~243的氨基酸序列组成的c3e-7093轻链可变区;由seq id no:155(图151)所示的氨基酸序列的氨基酸编号405~511的氨基酸序列组成的c3e-7096轻链可变区;由seq id no:156(图152)所示的氨基酸序列的氨基酸编号410~516的氨基酸序列组成的c3e-7096轻链可变区;由seq id no:157(图153)所示的氨基酸序列的氨基酸编号410~516的氨基酸序列组成的c3e-7097轻链可变区。
[0626]
作为该含有cdrh1~cdrh3和cdrl1~cdrl3的更优选的抗体或其抗原结合片段,可例举含有以下重链可变区和轻链可变区的组合的抗体或其抗原结合片段:由seq id no:136(图137)所示的氨基酸编号2~119和135~243组成的c3e-7034重链可变区和轻链可变区的组合;由seq id no:137(图138)所示的氨基酸编号2~119和135~241组成的c3e-7036重链可变区和轻链可变区的组合;由seq id no:147(图143)所示的氨基酸编号2~119和135~243组成的c3e-7078重链可变区和轻链可变区的组合;由seq id no:138(图139)所示的氨基酸编号2~119和135~241组成的c3e-7085重链可变区和轻链可变区的组合;由seq id no:139(图140)所示的氨基酸编号2~119和135~243组成的c3e-7088重链可变区和轻链可变区的组合;由seq id no:140(图141)所示的氨基酸编号2~119和135~243组成的c3e-7093重链可变区和轻链可变区的组合;由seq id no:155(图151)所示的氨基酸编号272~389和405~511组成的c3e-7096重链可变区和轻链可变区的组合;由seq id no:156(图152)所示的氨基酸编号277~394和410~516组成的c3e-7096重链可变区和轻链可变区的组合;由seq id no:157(图153)所示的氨基酸编号277~394和410~516组成的c3e-7097重链可变区和轻链可变区的组合。
[0627]
另外,作为该含有cdrh1~cdrh3和cdrl1~cdrl3的更优选的抗体或其抗原结合片段,可例举含有以下scfv以及这些scfv中的任一scfv的抗体或抗体的结合片段等:由seq id no:136(图137)所示的氨基酸序列的氨基酸编号2~243的氨基酸序列组成的c3e-7034scfv;由seq id no:137(图138)所示的氨基酸序列的氨基酸编号2~241的氨基酸序列组成的c3e-7036scfv;由seq id no:147(图143)所示的氨基酸序列的氨基酸编号2~243的氨基酸序列组成的c3e-7078scfv;由seq id no:138(图139)所示的氨基酸序列的氨基酸编号2~241的氨基酸序列组成的c3e-7085scfv;由seq id no:139(图140)所示的氨基酸序列的氨基酸编号2~243的氨基酸序列组成的c3e-7088scfv;由seq id no:140(图141)所示的氨基酸序列的氨基酸编号2~243的氨基酸序列组成的c3e-7093scfv。对cd3具有特异性的
scfv(也叫做“抗cd3 scfv”)的优选形式包括在羧基末端侧附加了flag-his标签的形式(也单纯称为“标签添加物”)。作为优选的标签添加物,可例举c3e-7034(seq id no:136,图137)、c3e-7036(seq id no:137,图138)、c3e-7085(seq id no:138,图139)、c3e-7088(seq id no:139,图140)以及c3e-7093(seq id no:140,图141),更优选地可举出c3e-7085。
[0628]
本发明的多特异性分子的优选示例,可举出双特异性分子。“双特异性”是指能够与同一个分子的两个彼此不同的表位或两个分子上的彼此不同的表位结合,包含具有这种双特异性的抗体或抗原结合片段。本发明的双特异性分子会与hla/ny-eso结合,还会与cd3结合。
[0629]
作为本发明的双特异性分子,可举出具有以下结构(构型)的分子。
[0630]
双scfv型的双特异性分子中,与不同的表位结合的两种scfv,分别通过接头与二聚体的一个fc连接,或者不通过接头而是直接结合。或者,与不同的表位结合的两种scfv通过接头分别与ch、cl连接,再分别通过接头与二聚体的一个fc连接。该双特异性分子是引入了突变的fc与杂合子缔合而成的构型,其中,引入的突变在两种不同的scfv的每一个的下游形成异二聚体。双scfv型的双特异性分子叫做双型双特异性分子,或者单纯叫做双型(图6a(b))。
[0631]
本发明中,例如可以使用由抗hla-a2/ny-eso scfv和抗cd3 scfv组成的双型双特异性分子。
[0632]
或者,作为本发明的双特异性分子可以是如下的分子:与不同的表位结合的fab和scfv,第一抗体fab通过接头与二聚体的一个fc结合,第二抗体scfv通过接头与另一个fc结合而成的双特异性分子。该双特异性分子是引入了突变的fc与杂合子缔合而成的构型,其中,引入的突变在fab和scfv的每一个的下游形成异二聚体。这种双特异性分子叫做杂合型双特异性分子或杂合型(图6a(a))。本发明中,例如可以使用由抗hla-a2/ny-eso fab和抗cd3 scfv组成的杂合型。
[0633]
另外,也可以是第一抗体fab和第二抗体scfv通过接头与二聚体的一个fc结合而成的双特异性分子。这种情况下,既可以将fab与fc结合,并将scfv与该fab结合,也可以将scfv与fc结合,并将fab与该scfv结合。优选将fab结合,并将scfv与该fab结合。fab与scfv的结合可以通过接头将scfv与fab的可变区结合。该双特异性分子是引入了突变的fc缔合而成的构型,其中,引入的突变在通过接头将scfv与fab连接的下游形成异二聚体。这种双特异性分子叫做scfv-fab-异二聚体fc型双特异性分子,或scfv-fab-异二聚体fc型(图6a(c))。
[0634]
本发明中,例如可以使用由抗cd3 scfv和抗hla-a2/ny-eso fab组成的scfv-fab-异二聚体fc型。
[0635]
另外,具有第一抗体与第二抗体这两种scfv通过接头连接而成的构型的tafv(图3(c)),可以通过接头与二聚体的一个fc结合,或者不通过接头而是直接结合。这种双特异性分子叫做tafv-异二聚体fc型双特异性分子,或tafv-异二聚体fc型(图3(d))。该双特异性分子是引入了突变的fc与杂合子缔合而成的构型,其中,引入的突变在tafv的下游形成异二聚体。tafv中的第一抗体与第二抗体的连接顺序没有限制,当tafv中的第一抗体与第二抗体的连接顺序颠倒时,与最初的双特异性分子叫做tafv-异二聚体fc型相对应地,叫做tafv(反向)-异二聚体fc型(也叫做tafv(反向)-fc型)。
[0636]
图6a(a)示出了杂合型双特异性分子的结构,图6a(b)示出了双型双特异性分子的结构,图6a(c)示出了scfv-fab-异二聚体fc型双特异性分子的结构。另外,图3(a)示出了scfv的结构,图3(b)示出了fab的结构,图3(c)示出了tafv的结构,图3(d)示出了tafv-异二聚体fc型双特异性分子的结构,图3(e)示出了tafv-fab-异二聚体fc型双特异性分子的结构。另外,图6b(a)示出了tafv-异二聚体fc型双特异性分子的结构(与图3(d)相同),图6b(b)示出了tafv(反向)-异二聚体fc型双特异性分子的结构,图6b(c)示出了tafv(反向)-异二聚体fc型双特异性分子所包含的第一多肽的结构,图6(d)示出了tafv(反向)-异二聚体fc型双特异性分子所包含的第二多肽的结构。
[0637]
本发明的双特异性分子具有多个多肽缔合而成的结构。
[0638]
本发明中,例如作为tafv,可以使用抗hla-a2/ny-eso scfv和抗cd3 scfv的tafv。关于tafv-异二聚体fc型双特异性分子,优选地,(a)含有第一多肽和第二多肽,第一多肽从n末端向c末端依次含有与hla/ny-eso特异性结合的scfv、与cd3特异性结合的scfv以及免疫球蛋白fc区域(i);第二多肽含有免疫球蛋白的铰链区和fc区域(ii);更优选地,(b)第一多肽和第二多肽在fc区域(i)和fc区域(ii)中缔合。第一多肽和第二多肽的fc区域也可以含有用于形成异二聚体的突变。将tafv-异二聚体fc型双特异性分子的示例示于图3(d)。如图3(d)所示,第一多肽的fc区域(i)部分与涂黑表示的第二多肽的fc区域(ii)部分结合,第一多肽和第二多肽缔合。图3(f)表示第一多肽,图3(g)表示第二多肽。例如,在图3(d)中,白色表示的scfv是抗hla-a2/ny-eso scfv,右上斜线表示的scfv是抗cd3 scfv。
[0639]
本发明更优选的tafv-异二聚体fc型双特异性分子所含有的第一多肽包含以下氨基酸序列:seq id no:85所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:87所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:88所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:89所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:90所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:91所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:92所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:93所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:94所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:95所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:96所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:86所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:149所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:150所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:155所示的氨基酸序列的第20位~第511位的氨基酸序列、seq id no:156所示的氨基酸序列的第20位~第516位的氨基酸序列或者seq id no:157所示的氨基酸序列的第20位~第516位的氨基酸序列。进一步优选的tafv-异二聚体fc型双特异性分子所含有的第一多肽包含以下氨基酸序列:seq id no:85、seq id no:87、seq id no:88、seq id no:89、seq id no:90、seq id no:91、seq id no:92、seq id no:93、seq id no:94、seq id no:95、seq id no:96、seq id no:86、seq id no:149、seq id no:150或seq id no:155所示的氨基酸序列的第529位~第745位的氨基酸序列;或者seq id no:156或seq id no:157所示的氨基酸序列的第534位~第750位的氨基酸序列。更进一步优选的tafv-异二聚体fc型双特异性分子所含有的第一多肽由以下氨基酸序列组成:seq id no:85所示的氨基酸序列的第21位~第745位的氨基酸
序列;seq id no:87所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:88所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:89所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:90所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:91所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:92所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:93所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:94所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:95所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:96所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:86所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:149所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:150所示的氨基酸序列的第21位~第745位的氨基酸序列;或者seq id no:155所示的氨基酸序列的第20位~第745位的氨基酸序列。或者,由seq id no:156所示的氨基酸序列的第20位~第750位的氨基酸序列或seq id no:157所示的氨基酸序列的第20位~第750位的氨基酸序列组成。
[0640]
本发明优选的tafv-异二聚体fc型双特异性分子所含有的第二多肽包含来自人抗体的铰链区和突变型fc,更优选的tafv-异二聚体fc型双特异性分子所含有的第二多肽包含seq id no:84所示的氨基酸序列的第20位~第246位的氨基酸序列。
[0641]
其中,以下抗体可以例举为本发明优选的tafv-异二聚体fc型双特异性分子:由seq id no:85所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0016;由seq id no:87所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0022;由seq id no:88所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0023;由seq id no:89所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0027;由seq id no:90所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0035;由seq id no:91所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0044;由seq id no:92所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0045;由seq id no:93所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0047;由seq id no:94所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0048;由seq id no:95所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0060;由seq id no:96所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的
第二多肽缔合而成的nyf-0061;由seq id no:86所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0019;由seq id no:149所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0014;以及由seq id no:150所示的氨基酸序列的第21位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第21位~第246位组成的第二多肽缔合而成的nyf-0082。
[0642]
另外,以下可以例举为本发明优选的tafv-异二聚体fc型双特异性分子:由seq id no:155所示的氨基酸序列的第20位~第745位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第20位~第246位组成的第二多肽缔合而成的nyz-0038;由seq id no:156所示的氨基酸序列的第20位~第750位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第20位~第246位组成的第二多肽缔合而成的nyz-0082;由seq id no:157所示的氨基酸序列的第20位~第750位的氨基酸序列组成的第一多肽和由seq id no:84所示的氨基酸序列的第20位~第246位组成的第二多肽缔合而成的nyz-0083。
[0643]
其中,nyf-0023、nyf-0047、nyf-0048、nyf-0060、nyf-0061、nyz-0038、nyz-0082以及nyz-0083具有特别优异的生物活性、物化性质等,故优选。
[0644]
另外,第一抗体tafv可以通过接头或不通过接头而直接与二聚体的一个fc结合,第一抗体或第二抗体fab可以通过接头或不通过接头而直接与另一个fc结合。该双特异性分子是在tafv-异二聚体fc型的第二多肽的fc区域(ii)(涂黑)侧的上游添加了fab的构型。这种双特异性分子叫做tafv-fab-异二聚体fc型双特异性分子,或tafv-fab-异二聚体fc型(图3)。
[0645]
本发明中,作为tafv-fab-异二聚体fc型双特异性分子所包含的tafv,例如可以使用抗hla-a2/ny-eso scfv和抗cd3 scfv的tafv;作为fab,例如可以使用hla/ny-eso fab。
[0646]
关于tafv-fab-异二聚体fc型双特异性分子,优选地,(a)含有第一多肽、第二多肽和第三多肽,第一多肽从n末端向c末端依次含有与人hla/ny-eso特异性结合的scfv、与cd3特异性结合的scfv以及免疫球蛋白fc区域(i);第二多肽由包含fc区域(ii)的免疫球蛋白重链组成;第三多肽由免疫球蛋白轻链组成;更优选地,(b)第二多肽和第三多肽缔合,(c)第一多肽和第二多肽在fc区域(i)和fc区域(ii)中缔合。tafv-fab-异二聚体fc型双特异性分子的示例示于图3(e),第一多肽示于图3(f),第二多肽示于图3(h),第三多肽示于图3(i)。如图3(e)所示,第一多肽的fc区域(i)部分与涂黑表示的由包含fc区域(ii)的免疫球蛋白重链组成的第二多肽,在第一多肽的fc区域(i)部分和第二多肽的fc区域(ii)部分结合,另外,免疫球蛋白轻链与第二多肽结合。该优选的tafv-fab-异二聚体fc型双特异性分子,也可以是包含tafv和免疫球蛋白的fc区域的tafv-异二聚体fc型双特异性分子与fab结合而形成的。作为优选的tafv-fab异二聚体fc型双特异性分子所含有的第一多肽包含的氨基酸序列,可例举:seq id no:85所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:87所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:88所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:89所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:90所示的氨基酸序列的第21位~第511位的氨基酸序列、
seq id no:91所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:92所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:93所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:94所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:95所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:96所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:86所示的氨基酸序列的第21位~第511位的氨基酸序列、seq id no:149所示的氨基酸序列的第21位~第511位的氨基酸序列;以及seq id no:150所示的氨基酸序列的第21位~第511位的氨基酸序列。更优选的tafv-fab异二聚体fc型双特异性分子所含有的第一多肽由以下氨基酸序列组成:seq id no:85所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:87所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:88所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:89所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:90所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:91所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:92所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:93所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:94所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:95所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:96所示的氨基酸序列的第21位~第745位的氨基酸序列;以及seq id no:86所示的氨基酸序列的第21位~第745位的氨基酸序列;seq id no:149所示的氨基酸序列的第21位~第745位的氨基酸序列;或者,seq id no:150所示的氨基酸序列的第21位~第745位的氨基酸序列。
[0647]
本发明优选的tafv-fab-异二聚体fc型双特异性分子所含有的第二多肽包含人抗体或人源化抗体重链的可变区、ch1区域和铰链区,以及突变型fc;更优选的tafv-fab-异二聚体fc型双特异性分子所含有的第二多肽包含seq id no:99所示的氨基酸序列的第20位~第242位的氨基酸序列。
[0648]
本发明优选的tafv-fab-异二聚体fc型双特异性分子所含有的第三多肽包含人抗体或人源化抗体轻链的可变区和恒定区;更优选的tafv-fab-异二聚体fc型双特异性分子所含有的第三多肽包含seq id no:100所示的氨基酸序列的第21位~第131位。
[0649]
该优选的tafv-fab-异二聚体fc型双特异性分子所含有的第二多肽中的可变区和ch1区域以及第三多肽构成fab,优选的fab是抗hla/ny-eso抗体的fab,例如是nya-0001的fab。
[0650]
本发明中,作为scfv-fab-异二聚体fc型双特异性分子所包含的scfv,例如可以使用抗hla-a2/ny-eso scfv或抗cd3 scfv;作为fab,例如可以使用hla/ny-eso fab或抗cd3 fab。
[0651]
关于scfv-fab-异二聚体fc型双特异性分子,优选地,(a)含有第一多肽、第二多肽和第三多肽,第一多肽从n末端向c末端依次含有与人hla/ny-eso特异性结合的scfv、与cd3特异性结合的抗体重链的可变区和恒定区ch1,以及免疫球蛋白fc区域(i);第二多肽含有免疫球蛋白的铰链区和fc区域(ii);第三多肽含有由可变区和恒定区组成的抗体轻链;更优选地,(b)第一多肽和第二多肽在fc区域(i)和fc区域(ii)中缔合,第一多肽在抗体重链的可变区和恒定区ch1中与第三多肽(的抗体轻链)缔合。第一多肽和第二多肽的fc区域既可以是野生型,也可以含有形成异二聚体的突变。将scfv-fab-异二聚体fc型双特异性分子
的示例示于图6a(c)。图6a(c)的右半部分是第一多肽和第三多肽,左半部分是第二多肽。如图6a(c)所示,第一多肽的fc区域(i)部分与涂黑表示的第二多肽的fc区域(ii)部分缔合,第一多肽和第三多肽缔合。例如,在图6a(c)中,右上斜线表示的scfv是抗hla-a2/ny-eso scfv,白色和方格图案以及横线表示的fab是抗cd3 fab。
[0652]
作为优选的scfv-fab-异二聚体fc型双特异性分子所含有的第一多肽包含的氨基酸序列,可例举seq id no:160所示的氨基酸序列的第21位~第394位的氨基酸序列,更优选地可例举第20位~第724位的氨基酸序列。
[0653]
另外,作为优选的scfv-fab-异二聚体fc型双特异性分子所含有的第一多肽包含的其他氨基酸序列,可例举seq id no:197所示的氨基酸序列的第21位~第389位的氨基酸序列,更优选地可例举第20位~第719位的氨基酸序列。
[0654]
此外,作为优选的scfv-fab-异二聚体fc型双特异性分子所含有的第一多肽包含的其他氨基酸序列,可例举seq id no:198所示的氨基酸序列的第21位~第389位的氨基酸序列,更优选地可例举第20位~第719位的氨基酸序列。
[0655]
本发明优选的scfv-fab-异二聚体fc型双特异性分子所含有的第二多肽包含来自人抗体的铰链区和突变型fc,更优选的scfv-fab-异二聚体fc型双特异性分子所含有的第二多肽包含seq id no:84所示的氨基酸序列的第20位~第246位的氨基酸序列。
[0656]
本发明优选的scfv-fab-异二聚体fc型双特异性分子所含有的第三多肽包含来自人抗体的轻链。作为更优选的scfv-fab-异二聚体fc型双特异性分子所含有的第三多肽,可例举seq id no:161所示的氨基酸序列的第21位~第127位的氨基酸序列,进一步优选地可例举第21位~第233位的氨基酸序列。
[0657]
其中,由以下的第一多肽、第二多肽和第三多肽缔合而成的nyz-1010可以例举为本发明优选的scfv-fab-异二聚体fc型双特异性分子:由seq id no:160所示的氨基酸序列的第20位~第724位的氨基酸序列组成的第一多肽;由seq id no:84所示的氨基酸序列的第20位~第246位组成的第二多肽;由seq id no:161所示的氨基酸序列的第21位~第233位组成的第三多肽。
[0658]
另外,由以下的第一多肽、第二多肽和第三多肽缔合而成的nyz-1007也可以例举为本发明优选的scfv-fab-异二聚体fc型双特异性分子:由seq id no:197所示的氨基酸序列的第20位~第719位的氨基酸序列组成的第一多肽;由seq id no:84所示的氨基酸序列的第20位~第246位组成的第二多肽;由seq id no:161所示的氨基酸序列的第21位~第233位组成的第三多肽。
[0659]
此外,由以下的第一多肽、第二多肽和第三多肽缔合而成的nyz-1017也可以例举为本发明优选的scfv-fab-异二聚体fc型双特异性分子:由seq id no:198所示的氨基酸序列的第20位~第719位的氨基酸序列组成的第一多肽;由seq id no:84所示的氨基酸序列的第20位~第246位组成的第二多肽;由seq id no:161所示的氨基酸序列的第21位~第233位组成的第三多肽。
[0660]
本发明的双特异性分子所含有的一个、两个或三个以上的肽,可以是前述的“缺失体”,即在其羧基末端,特别是来自抗体重链的羧基末端,一个或两个(或其以上)氨基酸发生了突变(包括缺失)。例如,本发明优选的scfv-fab-异二聚体fc型双特异性分子之一的nyz-1010所含有的第一多肽具有的氨基酸序列的羧基末端可以是seq id no:160的第724
位lys、缺失一个氨基酸的第723位gly、包含它们的混合物中的任何一个。同样,本发明优选的scfv-fab-异二聚体fc型双特异性分子所含有的第二多肽具有的氨基酸序列的羧基末端,可以是seq id no:84的第246位lys、缺失一个氨基酸的第245位gly、包含它们的混合物中的任何一个。
[0661]
本发明的双特异性分子所包含的scfv和fab优选为人源化抗体或人抗体的scfv和fab,fc优选为人抗体的fc。
[0662]
本发明的双特异性分子所包含的可变区中,从抗体的氨基末端侧起,可以按照重链可变区、轻链可变区的顺序结合,或者,也可以按照轻链可变区、重链可变区的顺序结合。两个可变区之间,也可以存在接头(任意)。另外,在氨基末端侧的可变区的氨基末端,也可以存在甘氨酸残基(任意)。串联scfv型的双特异性分子也可以在羧基末端侧的可变区的羧基末端结合接头、flag标签,和/或his标签(任意)。作为优选形式之一,可例举从氨基末端起,依次结合重链可变区、第一接头、轻链可变区、第二接头、flag标签,以及his标签。
[0663]
接头包括单链多肽或单链寡肽,或者也包括peg、核苷酸、糖链、化合物等合成物。另外,只要是结合两个多肽,就没有特别限制,可以使用公知的接头。
[0664]
作为接头的长度,例如肽接头的长度为5~30个氨基酸。当双特异性分子含有多个接头时,既可以使用长度都相同的肽接头,也可以使用长度不同的肽接头。
[0665]
作为肽接头,例如可以例举(gly
·
gly
·
gly
·
gly
·
ser)(seq id no:161)的循环,但也可以在其中添加一至数个与gly、ser不同的氨基酸残基。
[0666]
综上所述,本发明的多特异性抗体,特别是双特异性抗体能够采用的结构(构型)中,优选为tafv-异二聚体fc型、tafv-fab-异二聚体fc型,以及scfv-fab-异二聚体fc型;更优选为tafv-异二聚体fc型。从n末端向c末端,按照抗hla/ny-eso scfv、抗cd3 scfv的顺序排列的构型(tafv-异二聚体fc型)与反向排列的构型(tafv(反向)-异二聚体fc型)相比,进一步优选(实施例11等)。另外,其他更加优选的构型为scfv-fab-异二聚体fc型。
[0667]
本发明也包括以下分子:包含与含有编码本发明的分子所包含的氨基酸序列的核苷酸序列的多核苷酸的互补链在严谨条件下杂交的多核苷酸所包含的核苷酸序列所编码的氨基酸序列,且与hla/ny-eso结合,优选再与cd3结合的分子。
[0668]
本发明也包括以下分子:包含与本发明的分子所包含的氨基酸序列具有90%、91%、92%、93%、94%、95%、96%、97%、98%或99%以上同一性的氨基酸序列,且与hla/ny-eso结合,优选还与cd3结合的分子。
[0669]
本发明的抗体、其结合片段以及包含它们的多特异性抗体具备优异的生物活性、物理化学性质(以下称作“物化性质”)、安全性、体内动力学等性质。(a)作为生物活性或其指标,可例举:抗原结合活性、体外细胞毒活性、体内抗肿瘤活性等。例如,对于hla/ny-eso的解离常数(kd值)为100nm以下或50nm以下,优选为20nm以下或10nm以下,更优选为5nm以下。另外,例如,对于表达内源性人ny-eso的细胞系u266b1和/或nci-h1703,将人外周血单核细胞用作效应细胞发挥出的细胞毒活性的ec
50
值为20nm以下,优选为10nm以下,更优选为5nm以下(作为体外细胞毒活性的测定和计算,可以例举但不限于实施例8记载的方法)。另外,例如,将0.1ml的人鳞状细胞肺癌细胞系nci-h1703的6
×
107细胞/ml悬浮液移植到nog小鼠的皮下,4天后将0.2ml的人外周血单核细胞的3.75
×
107细胞/ml悬浮液移植到尾静脉内,14天后开始,每周一次测定将抗体进行3次施用后的肿瘤的体积,此时相对于施用溶剂
的对照组,肿瘤增殖抑制活性为50%以上,优选为75%以上,更优选为90%以上(作为体内抗肿瘤活性的测定和计算,可以例举但不限于实施例9记载的方法)。(b)生物药物含有的杂质关系到药物的安全性,因此需要对在制造和保存中有无增加进行适当的规范设定和管理。其中,hmws(凝集物)是主要的杂质之一,会导致免疫原性风险和药效的降低等,因此该项目应当格外严格管理。关于杂质的管理,不仅在制造时,包括制造步骤中和制造后的经时稳定性(有无增加)在内,也必须实施评价。由于药物的有效期是根据长期稳定性试验的结果来设定的,因此经时稳定的抗体可以设定更长的有效期。所以,作为筛选合适抗体以用于生物药物时的指标,即本发明的物理化学性质,可举出耐酸性(抑制hmws的生成等)、溶液稳定性(抑制hmws的生成等)。作为其他指标,可例举适合于本发明的抗体或其结合片段或包含它们的分子的产生的宿主细胞,例如,向expi293f细胞中导入编码它们所包含的氨基酸序列的基因而得到的重组细胞在培养物中的产量多,收率高等。具有这些物理化学性质特征的本发明的优选抗体、其抗原结合片段,以及含有它们的多特异性抗体能够做到以下事项:能够将它们的溶液暴露在酸性条件下,能够实施或容易实施它们的制造,例如蛋白a、离子交换等色谱法、病毒灭活等步骤;对于它们的溶液可以将hmws的生成抑制在低水平,因此能够实施或容易实施它们的制造、制剂化、含有它们的药物的流通和保存等;能够高效生产它们。关于耐酸性,例如,在ph值3.5、室温下保温1小时,接着通过尺寸排阻色谱测定并计算hmws,产生的hmws的含量为5%以下,优选为2%以下,更优选为1%以下(作为用于耐酸性评价的hmws含量的测定和计算,可例举但不限于实施例19-1记载的方法)。关于溶液稳定性,例如,溶解在由25mm组氨酸和5%山梨糖醇组成的溶液中,使ph值为6.0,浓度为25mg/ml,在25℃下保存6天,接着通过尺寸排阻色谱测定并计算hmws,hmws的含量为20%以下,优选为10%以下(作为用于溶液稳定性评价的hmws含量的测定和计算,可例举但不限于实施例19-2记载的方法)。作为生产效率或收率的测定和计算,可例举但不限于实施例20、21记载的方法。(c)作为安全性或其指标,可例举抗原识别特性、施用时的观察结果等。例如,会识别野生型ny-eso肽上的多个氨基酸,不会与具有和野生型ny-eso肽相似但不相同的氨基酸序列的同源性肽结合,脱靶效应引起的副作用风险低。另外,可以预测在基于ispri网络的免疫原性筛选(epivax,inc)中,免疫原性低,针对抗体引起的细胞因子产生等的副作用风险低。另外,例如,向balb/c小鼠施用本发明的双特异性抗体所包含的nyf-0023、nyf-0045、nyf-0047、nyf-0048、nyf-0060、nyf-0061、nyz-0082或者nyz-1010,结果未确认到不利于血液中半衰期的观察结果,也未确认到体重减少、其他显著的毒性观察结果。另外,向食蟹猴单次施用nyz-0082或nyz-1010,结果未确认到不利于血液中半衰期的观察结果,在普通状态、体重、采食量、体温测定以及血浆中细胞因子量方面,未确认到施用引起的变化。(d)作为动力学或其指标,可例举血液中半衰期等。例如,向balb/c小鼠或食蟹猴施用在本发明中获得的数个双特异性抗体,结果未确认到不利于血液中半衰期的观察结果。这种具备优异的生物活性、物理化学性质、安全性、体内动力学等性质的本发明的抗体、其结合片段和分子,可以优选包含在药物组合物中。作为具有(a)记载的抗原结合活性和(b)记载的各种性质的本发明的优选抗体或其抗原结合片段,可例举但不限于:nya-1143,nya-1163、nya-2023、nya-2027、nya-2035、nya-2044,nya-2045、nya-2047、nya-2048、nya-2060、nya-2031、nya-2047、nya-2061、nya-2143以及nya-3061;更优选地可例举但不限于:nya-2047、nya-2061、nya-2143以及nya-3061。另外,作为具有(a)~(d)记载的性质的本发明的优选多特异性抗体,可
例举但不限于:nyf-0016、nyf-0019、nyf-0022、nyf-0023、nyf-0027、nyf-0035、nyf-0044、nyf-0045、nyf-0047、nyf-0048、nyf00058、nyf-0060、nyf-0061、nyz-0038、nyz-0082、nyz-0088以及nyz-1010;更优选地可例举但不限于:nyf-0061、nyz-0038、nyz-0082、nyz-0088、nyz-1007、nyz-1010、nyz-1017。
[0670]
本发明中,抗体所结合的“位点”,即抗体所识别的“位点”是指抗体所结合或识别的抗原上的部分肽或部分高级结构。本发明中,该位点也叫做表位、抗体的结合位点。作为本发明的抗hla/ny-eso抗体所结合或识别的hla/ny-eso上的位点,可例举:hla/ny-eso肽中的多个氨基酸、部分高级结构等。
[0671]
与本发明的抗体或结合片段“结合相同的位点的抗体或其结合片段”,也包含在本发明中。与某个抗体“结合相同的位点的抗体”是指,与该抗体所识别的抗原分子上的位点结合的其他抗体。如果第一抗体所结合的抗原分子上的部分肽或部分构象与第二抗体结合,则可以判定第一抗体和第二抗体与同一位点结合。当本发明的第一抗体具有上述(a)记载的抗原结合活性时,与hla/ny-eso上的同一位点结合的第二抗体极有可能具有同样的活性,该第二抗体也包含在本发明中。另外,如果在与hla/ny-eso的结合中与本发明的第一抗体竞争的抗体也具有(a)记载的抗原结合活性,则也包含在本发明中。这种与本发明的单克隆抗体所识别的hla/ny-eso上的位点结合的抗体、在与hla/ny-eso的结合中与本发明的单克隆抗体竞争的抗体,以及它们的结合片段,优选具有(a)记载的体外细胞毒活性和体内抗肿瘤活性以及(b)~(d)记载的性质中的一种或两种以上的性质,更优选具有三种以上的性质,最优选具有全部性质。
[0672]
抗体的结合位点可以通过免疫测定法等本领域技术人员公知的方法来确定。例如,可以通过以下方式来确定结合位点:从c末端或n末端适当切除抗原的氨基酸序列,制作一系列的肽,研究抗体对这些肽的反应性,确定大致的识别位点后,再合成短肽,研究抗体对这些短肽的反应性。另外,例如还可以通过以下方式来确定结合位点:将抗原或抗原片段肽等的氨基酸序列中的特定位点或区域缺失或取代为其他氨基酸序列,或者在氨基酸序列中导入突变,研究抗体对这些肽的反应性。抗原片段肽可以使用基因重组、肽合成等技术来制备。
[0673]
当抗体与抗原的部分高级结构结合或识别抗原的部分高级结构时,可以使用x射线结构分析,锁定与该抗体相邻的抗原上的氨基酸残基,由此确定该抗体的结合位点。例如,可以通过将抗体或其片段,以及抗原或其片段结合并结晶,进行结构分析,来锁定与抗体具有相互作用距离的抗原上的氨基酸残基。相互作用距离为以下,优选为以下,更优选为以下。一个或一个以上的这种与抗体具有相互作用距离的氨基酸残基可以构成抗体的抗原结合位点(表位)。当该氨基酸残基为两个以上时,各氨基酸在一级序列上可以彼此不相邻。
[0674]
本发明的抗hla/ny-eso抗体或其结合片段可以对hla/ny-eso的氨基酸序列中存在的多个氨基酸进行特异性识别。识别该多个氨基酸的抗体或其结合片段、在与hla/ny-eso的结合中与本发明的抗体或其结合片段竞争的抗体或其结合片段,或者与该多个氨基酸具有相互作用距离的抗体或其结合片段,也包含在本发明中。另外,包含这种抗体或其结合片段的多特异性抗体,也包含在本发明中。
[0675]
6.药物组合物
[0676]
本发明包含抗癌剂,该抗癌剂含有本发明的抗hla/ny-eso抗体或与hla/ny-eso结合的多特异性分子作为有效成分。
[0677]
本发明的抗癌剂可以针对选自以下癌症或肿瘤中的一种或多种使用:癌、肉瘤、淋巴瘤、白血病、骨髓瘤、生殖细胞瘤、脑肿瘤、类癌瘤、成神经细胞瘤、视网膜母细胞瘤、肾母细胞瘤。具体而言,关于癌,可以举出:肾癌、黑色素瘤、鳞状细胞癌、基底细胞癌、结膜癌、口腔癌、喉癌、咽癌、甲状腺癌、肺癌(非小细胞肺癌(腺癌、鳞状细胞癌、大细胞癌)、小细胞肺癌)、乳腺癌、食道癌、胃癌、十二指肠癌、小肠癌、结肠直肠癌、直肠癌、阑尾癌、肛门癌、肝癌、胆囊癌、胆管癌、胰腺癌、肾上腺癌、膀胱癌、前列腺癌、子宫癌、阴道癌等;关于肉瘤,可以举出:脂肪肉瘤、血管肉瘤、软骨肉瘤、横纹肌肉瘤、尤因肉瘤、骨肉瘤、未分化多形性肉瘤、黏液纤维肉瘤、恶性外周神经鞘膜瘤、腹膜后肉瘤、滑膜肉瘤、子宫肉瘤、胃肠道间质瘤、平滑肌肉瘤、上皮样肉瘤等;关于淋巴瘤,可以举出:b细胞淋巴瘤、nk/t细胞淋巴瘤、霍奇金淋巴瘤等;关于白血病,可以举出:骨髓性白血病、淋巴细胞白血病、骨髓增生性疾病、骨髓增生异常综合征等;关于骨髓瘤,可以举出:多发性骨髓瘤等;关于生殖细胞瘤,可以举出:睾丸癌、卵巢癌等;关于脑肿瘤,可以举出:神经胶质瘤、脑膜瘤等。
[0678]
本发明的抗癌剂可以含有:在治疗上有效量的抗hla/ny-eso抗体或与hla/ny-eso结合的多特异性分子,以及药学上可接受的载体、稀释剂、增溶剂、乳化剂、防腐剂、辅助剂等。“药学上可接受的载体”等可以根据对象疾病的种类和药剂的施用形式从大范围适宜选择。本发明的抗癌剂的施用方法可以适当选择,例如可以注射施用,还可以采用局部输注、腹腔内施用、选择性静脉内输注、静脉注射、皮下注射、器官灌注液输注等。另外,注射用的溶液可以使用盐溶液、葡萄糖溶液,或者盐水与葡萄糖溶液的混合物、由各种缓冲液等组成的载体进行制剂化。另外,也可以在粉末状态下进行制剂化,在使用时与上述液体载体进行混合来制备注射液。
[0679]
关于其他施用方法,也可以和制剂的开发一起适当选择。例如,在口服施用的情况下,可以应用口服液剂和散剂、丸剂、胶囊剂和片剂等。在口服液剂的情况下,作为悬浮剂和糖浆剂等口服液体调整物,可以使用以下物质进行制造:水;蔗糖、山梨糖醇、果糖等糖类;peg等乙二醇类;芝麻油、大豆油等油类;对羟基苯甲酸烷基酯等防腐剂;草莓风味、薄荷等风味剂类等。散剂、丸剂、胶囊剂和片剂可以使用以下物质进行制剂化:乳糖、葡萄糖、蔗糖、甘露醇等赋形剂;淀粉、精氨酸钠等崩解剂;硬脂酸镁、滑石等润滑剂;聚乙烯醇、羟丙基纤维素、明胶等粘合剂;脂肪酸酯等表面活性剂;甘油等塑化剂等。片剂和胶囊剂在容易施用这一点,是本发明的组合物中的优选单位施用形式。在制造片剂和胶囊剂时,使用固体的制造载体。
[0680]
有效用于治疗的抗hla/ny-eso抗体或与hla/ny-eso结合的多特异性分子的量根据治疗病状的性质、患者的年龄和状态而变,最终可由医生决定。例如,一次的量为每1kg体重0.0001mg~100mg。规定的施用量可以是1~180天施用一次,也可以是每天分割施用2次、3次、4次或以上,以适当的间隔施用。
[0681]
另外,包含本发明的抗hla/ny-eso抗体或与hla/ny-eso结合的多特异性分子所包含的氨基酸序列的多核苷酸、包含该多核苷酸的载体、包含该多核苷酸或载体的细胞,以及含有该多核苷酸、该载体和该细胞中的任一种作为有效成分的药物组合物,也包含在本发明中。该药物组合物优选为抗癌剂。
[0682]
另外,本发明的药物组合物可以与其他药剂组合使用。其他药剂是化学疗法剂、放射疗法、生物药物等,没有特别限制,可以与本发明的药物组合物同时或不同时段施用或应用,且可以作为包含本发明的药物组合物的单一制剂或两种以上的不同制剂或疗法施用或应用。
[0683]
[实施例]
[0684]
下面在实施例中对本发明进行更加具体的说明,但本发明并不受这些实施例限制。
[0685]
另外,以下实施例中关于基因操作的各操作,如无特别说明,则是按照“分子克隆(molecular cloning)”(sambrook,j.,fritsch,e.f.和maniatis,t.著,cold springharbor laboratory press于1989年出版)记载的方法和其他本领域技术人员使用的实验书记载的方法进行;或者,当使用市售试剂和试剂盒时,则按照市售品的说明书进行。关于基因合成和载体构建所需的引物合成,则根据需要进行了合成委托(株式会社fasmac、赛默飞世尔科技公司,以及eurofins genomics公司)。
[0686]
(实施例1)获得来自人抗体噬菌体文库的抗hla/ny-eso抗体
[0687]
1)-1hla/ny-eso抗原蛋白的制备
[0688]
通过将由分别表达hla-a*0201(genbank:asa47534.1)的截短物(添加生物素连接酶识别序列,seq id no:33)和β2-微球蛋白(uniprotkb-p61769,seq id no:34)的大肠杆菌(bl21(de3),安捷伦科技有限公司)制备的各包涵体和ny-eso肽:sllmwitqc(序列表的seq id no:1)大幅稀释而进行重折叠之后,通过凝胶过滤柱(superdex 200 10/300,ge healthcare公司)制备hla-a*0201/β2-微球蛋白/ny-eso肽复合物(以下记作hla/ny-eso)。
[0689]
作为阴性对照抗原,使用magec-1肽:ilfgislrev(序列表的seq id no:2)进行同样的重折叠,制备hla-a*0201/β2-微球蛋白/magec-1肽复合物(以下记作hla/mc1)。接着,通过大肠杆菌的生物素连接酶将制备的hla/ny-eso和hla/mc1生物素化后,通过凝胶过滤柱(superdex 200 10/300,ge healthcare公司)进行分离,制备各生物素化蛋白。
[0690]
1)-2具有与hla/ny-eso的结合能力的scfv的分离
[0691]
从人抗体噬菌体文库中分离与hla/ny-eso结合的scfv。首先,向将生物素化hla/mc1固定化的dynabeads链霉亲和素m-280(赛默飞世尔科技公司)中添加噬菌体,回收未结合的噬菌体。接着,添加将生物素化hla/ny-eso固定化的dynabeads链霉亲和素m-280ag,使用磁力架(dynamag-2,赛默飞世尔科技公司)通过洗涤操作,将未结合的噬菌体除去。
[0692]
之后,让与hla/ny-eso结合的噬菌体感染大肠杆菌(xl-1blue,安捷伦科技有限公司),回收并扩增与hla/ny-eso结合的噬菌体。共计实施3次筛选后,从多克隆噬菌粒换到在scfv的羧基末端添加flag标签、his标签的大肠杆菌用的表达载体上之后,转化大肠杆菌,在iptg(isopropyl-β-d-thiogalactopyranoside,异丙基-β-d-硫代半乳糖苷)(西格玛奥德里奇公司)的存在下使scfv表达,用于elisa筛选。
[0693]
1)-3通过elisa筛选hla/ny-eso结合scfv
[0694]
在384孔maxi-sorp板(black,nunc公司)的每个孔中各添加50μl的通过pbs(含有0.138m氯化钠、0.0027m氯化钾的0.01m磷酸缓冲生理盐水(ph值7.4),西格玛奥德里奇公司)稀释到1μg/ml的neutravidin(life technologies公司),在4℃静置过夜,使其固定化。
用含有0.05%tween-20(bio-rad公司)的pbs(elisa缓冲液)洗涤3次后,用pbs稀释到1μg/ml,添加实施例1)-2中使用的生物素化hla/ny-eso,在室温下振荡1小时。用elisa缓冲液洗涤3次后,用blocker casein(赛默飞世尔科技公司)封闭,再用elisa缓冲液洗涤3次。之后,添加表达scfv的大肠杆菌的培养液,在室温下反应2小时。用elisa缓冲液洗涤3次后,添加50μl用elisa缓冲液稀释到5000倍的辣根过氧化物酶(horseradish peroxidase,hrp)标记的抗flag抗体(西格玛奥德里奇公司),在室温下反应1小时。用elisa缓冲液洗涤5次后,添加supersignal pico elisa化学发光底物(赛默飞世尔科技公司),用读板仪(envision 2104multilabel reader,珀金埃尔默公司)测定10分钟后的化学发光,分离与hla/ny-eso结合的elisa阳性克隆。
[0695]
1)-4elisa阳性克隆ny-r119的核苷酸序列和氨基酸序列的确定
[0696]
从1)-3获得的elisa阳性克隆中,选择ny-r119作为与hla/ny-eso的结合能力强且识别特异性优异的scfv。ny-r119的重链和轻链可变区的核苷酸序列的分析使用dye terminator法(bigdye(注册商标)terminator v3.1,赛默飞世尔科技公司)实施。用于序列分析的引物序列如下所示。
[0697]
引物a:5
’‑
ctcttcgctattacgccagctggcga-3’(序列表的seq id no:3(图10))
[0698]
引物b:5
’‑
ataacaatttcacacaggaaacagctatga-3’(序列表的seq id no:4(图11))
[0699]
将确定的编码ny-r119的重链可变区的cdna的核苷酸序列示于seq id no:5(图12),将氨基酸序列示于seq id no:6(图13)。
[0700]
将确定的编码ny-r119的轻链可变区的cdna的核苷酸序列示于seq id no:7(图14),将氨基酸序列示于seq id no:8(图15)。
[0701]
imgt的cdr定义中的ny-r119的cdr序列分别为:cdrh1示于seq id no:54(图61),cdrh2示于seq id no:55(图61),cdrh3示于seq id no:56(图61),cdrl1示于seq id no:57(图61),cdrl2示于seq id no:58(图61),cdrl3示于seq id no:59(图61)。
[0702]
1)-5 nya-0001的制作
[0703]
1)-5-1 nya-0001表达载体的构建
[0704]
为了制备各种评价用样品,构建了ny-r119的哺乳培养用表达载体。另外,将哺乳培养细胞中表达的ny-r119命名为nya-0001。ny-r119和nya-0001的scfv部分、重链和轻链可变区,以及cdrh1~3和cdrl1~3由同一氨基酸序列组成。通过in-fusion hd克隆试剂盒(clontech公司),将编码nya-0001的dna片段插入到以pcdna3.3(赛默飞世尔科技公司)为骨架的哺乳动物细胞用表达载体,构建了nya-0001表达载体。
[0705]
对构建的nya-0001表达载体的核苷酸序列进行重新分析,确认到nya-0001全长核苷酸序列是序列表的seq id no:69(图70)所示的核苷酸序列。另外,上述核苷酸序列中,该序列所编码的nya-0001全长氨基酸序列是seq id no:70(图71)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-0001,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。此外,第181位至第188位的氨基酸序列是cdrl1,第206位至第208位的氨基酸序列是cdrl2,第245位至第256位的氨基酸序列是cdrl3。
[0706]
1)-5-2 nya-0001的表达和纯化
[0707]
按照手册,对expi293f细胞(赛默飞世尔科技公司)进行继代培养。用expi293表达培养基(赛默飞世尔科技公司)将处于对数增殖期的expi293f细胞培养液稀释到2.5
×
106细胞/ml,用于生产nya-0001。在20ml的opti-pro sfm培养基(赛默飞世尔科技公司)中加入0.3mg的nya-0001表达载体和0.9mg的聚乙烯亚胺(polyscience#24765)并平稳搅拌,再放置5分钟,然后添加到expi293f细胞。在37℃、8%co2培养箱中以135rpm振荡培养6天,用0.2μm滤膜(millipore公司)对得到的培养上清液进行过滤,得到nya-0001的培养上清液。纯化通过以下方式进行:使用ni sepharose excel(ge healthcare公司)进行洗脱后浓缩,通过用25mm组氨酸、300mm nacl、5%山梨糖醇、ph值6.0平衡的凝胶过滤柱(superdex 200 increase,ge healthcare公司)进行纯化。纯化蛋白样品用于分析用尺寸排阻色谱法(sec),确定纯度和浓度后,用于各种评价。
[0708]
(实施例2)nya-0001突变体的制作
[0709]
2)-1 nya-0001突变体的获得
[0710]
将nya-0001基因作为模板,使用利用pcr导入突变的方法(error-prone-based文库),或者,对于cdr的全部残基的每个残基,合成使20种氨基酸随机突变的寡聚体,从而构建文库的方法(oligo-based文库),构建噬菌体文库,进行高结合能力克隆的筛选,获得nya-0060、nya-0068、nya-0082作为高结合能力突变体,确定各核苷酸序列。
[0711]
将获得的编码nya-0060的重链可变区的cdna的核苷酸序列示于seq id no:9(图16),将氨基酸序列示于seq id no:10(图17)。
[0712]
将获得的编码nya-0060的轻链可变区的cdna的核苷酸序列示于seq id no:11(图18),将氨基酸序列示于seq id no:12(图19)。
[0713]
将获得的编码nya-0068的重链可变区的cdna的核苷酸序列示于seq id no:13(图20),将氨基酸序列示于seq id no:14(图21)。
[0714]
将获得的编码nya-0068的轻链可变区的cdna的核苷酸序列示于seq id no:15(图22),将氨基酸序列示于seq id no:16(图23)。
[0715]
将获得的编码nya-0082的重链可变区的cdna的核苷酸序列示于seq id no:17(图24),将氨基酸序列示于seq id no:18(图25)。
[0716]
将获得的编码nya-0082的轻链可变区的cdna的核苷酸序列示于seq id no:19(图26),将氨基酸序列示于seq id no:20(图27)。
[0717]
2)-2利用从nya-0060、nya-0068、nya-0082鉴定的突变位点和组合,制作高结合能力突变体
[0718]
通过in-fusion hd克隆试剂盒(clontech公司),将编码具有nya-0060、nya-0068的各个突变位点的nya-1163、nya-2023的dna片段插入到以pcdna3.3(赛默飞世尔科技公司)为骨架的哺乳动物细胞用表达载体,构建了哺乳动物细胞用scfv表达载体。
[0719]
另外,作为从nya-0060、nya-0068、nya-0082鉴定的突变位点和它们的组合,设计了nya-2027、nya-1143、nya-2143。向在1)-5中构建的nya-0001表达载体导入位点特异性突变,或者通过in-fusion hd克隆试剂盒(clontech公司),将编码目的scfv的dna片段插入到以pcdna3.3(赛默飞世尔科技公司)为骨架的哺乳动物细胞用表达载体,由此构建了各哺乳动物细胞用scfv表达载体。
[0720]
对构建的scfv表达载体的核苷酸序列进行重新分析,确认到nya-1163全长核苷酸
序列是序列表的seq id no:21(图28)所示的核苷酸序列。
[0721]
确认到nya-2023全长核苷酸序列是序列表的seq id no:22(图29)所示的核苷酸序列。
[0722]
确认到nya-2027全长核苷酸序列是序列表的seq id no:23(图30)所示的核苷酸序列。
[0723]
确认到nya-1143全长核苷酸序列是序列表的seq id no:24(图31)所示的核苷酸序列。
[0724]
确认到nya-2143全长核苷酸序列是序列表的seq id no:25(图32)所示的核苷酸序列。
[0725]
另外,在上述核苷酸序列中,确认到该序列所编码的nya-1163、nya-2023、nya-2027、nya-1143以及nya-2143全长氨基酸序列。
[0726]
nya-1163全长氨基酸序列是序列表的seq id no:26(图33)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-1163,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0727]
nya-2023全长氨基酸序列是序列表的seq id no:27(图34)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2023,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0728]
nya-2027全长氨基酸序列是序列表的seq id no:28(图35)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2027,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0729]
nya-1143全长氨基酸序列是序列表的seq id no:29(图36)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-1143,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0730]
nya-2143全长氨基酸序列是序列表的seq id no:30(图37)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2143,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是
cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0731]
需要说明的是,nya-1163的cdr序列与nya-0001的cdr序列全部相同。另外,nya-1143、nya-2143以及nya-2023的cdr序列相同,cdrh1示于seq id no:54(图61),cdrh2示于seq id no:55(图61),cdrh3示于seq id no:56(图61),cdrl1示于seq id no:60(图62),cdrl2示于seq id no:58(图61),cdrl3示于seq id no:59(图61)。此外,关于nya-2027的cdr序列,cdrh1示于seq id no:54(图61),cdrh2示于seq id no:55(图61),cdrh3示于seq id no:56(图61),cdrl1示于seq id no:57(图61),cdrl2示于seq id no:58(图61),cdrl3示于seq id no:61(图63)。
[0732]
另外,设计组合了在筛选高结合能力克隆时看到的结合突变位点的nya-1154,向nya-0001表达载体导入位点特异性突变,由此构建了以pcdna3.3(赛默飞世尔科技公司)为骨架的nya-1154表达载体。对构建的scfv表达载体的核苷酸序列进行重新分析,确认为seq id no:31(图38)所示的核苷酸序列。在上述核苷酸序列中,确认到该序列所编码的nya-1154全长氨基酸序列(seq id no:32(图39))。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-1154,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0733]
nya-1154的cdr序列分别为:cdrh1示于seq id no:54(图61),cdrh2示于seq id no:55(图61),cdrh3示于seq id no:62(图64),cdrl1示于seq id no:57(图61),cdrl2示于seq id no:58(图61),cdrl3示于seq id no:63(图64)。
[0734]
通过与1)-5-2相同的方法,使nya-1163、nya-2023、nya-2027、nya-1143、nya-2143以及nya-1154进行表达,纯化了各目的scfv。纯化蛋白样品用于分析用sec,确定纯度和浓度后,用于各种检测。
[0735]
2)-3制作nya-1143突变体
[0736]
2)-3-1nya-2035的制作
[0737]
作为nya-1143的突变体,设计nya-2035,向哺乳动物细胞用nya-1143表达载体导入位点特异性突变,由此构建了nya-2035表达载体。对构建的scfv表达载体的核苷酸序列进行重新分析,确认为seq id no:35(图42)所示的核苷酸序列。在上述核苷酸序列中,确定了该序列所编码的nya-2035全长氨基酸序列(seq id no:36(图43))。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2035,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。imgt的cdr定义中的nya-2035的cdr序列分别为:cdrh1示于seq id no:54(图61),cdrh2示于seq id no:55(图61),cdrh3示于seq id no:56(图61),cdrl1示于seq id no:64(图65),cdrl2示于seq id no:58(图61),cdrl3示于seq id no:59(图61)。
[0738]
2)-3-2nya-1143cdr接枝突变体的制作
[0739]
为了提升物化性质,设计了nya-1143cdr接枝突变体。将nya-1143的vh和vl的框架
2045、nya-2047、nya-2048、nya-2060以及nya-2061的cdr序列与nya-1143相同。
[0752]
nya-2044全长氨基酸序列是序列表的seq id no:47(图54)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2044,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0753]
nya-2045全长氨基酸序列是序列表的seq id no:48(图55)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2045,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0754]
nya-2047全长氨基酸序列是序列表的seq id no:50(图57)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2047,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0755]
nya-2048全长氨基酸序列是序列表的seq id no:51(图58)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2048,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0756]
nya-2060全长氨基酸序列是序列表的seq id no:52(图59)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2060,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0757]
nya-2061全长氨基酸序列是序列表的seq id no:53(图60)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-2061,第267位至第292位的氨基酸序列是flag-his标签。另外,第46位至第53位的氨基酸序列是cdrh1,第71位至第78位的氨基酸序列是cdrh2,第117位至第129位的氨基酸序列是cdrh3。另外,氨基酸编号181至188是cdrl1,氨基酸编号206至208是cdrl2,氨基酸编号245至256是cdrl3。
[0758]
2)-3-3nya-1143突变体的表达和纯化
[0759]
通过与1)-5-2相同的方法,使在2)-3-1和2)-3-2中制作的nya-2035、nya-2044、
nya-2045、nya-2047、nya-2048、nya-2060以及nya-2061进行表达,纯化了各目的scfv。纯化蛋白样品用于分析用sec,确定纯度和浓度后,用于各种检测。
[0760]
(实施例3)制作抗hla/ny-eso参考抗体的scfv
[0761]
设计对hla/ny-eso具有高结合能力的抗体3m4e5和t1(wo2010/106431)的scfv,将3m4e5的scfv命名为nyc-0003,将t1的scfv命名为nyc-0004。
[0762]
将nyc-0003和nyc-0004的各dna片段进行全合成(赛默飞世尔科技公司),通过in-fusion hd克隆试剂盒(clontech公司),构建了以pcdna3.3(赛默飞世尔科技公司)为骨架的哺乳动物细胞用scfv表达载体。
[0763]
对构建的scfv表达载体的核苷酸序列进行重新分析,确认到nyc-0003和nyc-0004全长核苷酸序列是序列表的seq id no:65(图66)和seq id no:66(图67)所示的核苷酸序列。另外,上述核苷酸序列中,该序列所编码的nyc-0003全长氨基酸序列是seq id no:67(图68)所示的氨基酸序列,并且nyc-0004全长氨基酸序列是seq id no:68(图69)所示的氨基酸序列。
[0764]
通过与1)-5-2相同的方法,使nyc-0003和nyc-0004进行表达,纯化了各目的scfv。各纯化蛋白样品用于分析用sec,确定纯度和浓度后,用于各种检测。
[0765]
(实施例4)用biacore评价与hla/ny-eso的结合能力
[0766]
使用biacore t200,将抗hla/ny-eso scfv作为配体捕获(捕捉)到固定化的抗his抗体,将抗原作为分析物进行测定。抗原使用在1)-1中制备的hla/ny-eso。按照试剂盒说明书,将抗his抗体(his捕获试剂盒,ge healthcare公司)固定化到传感芯片cm5(ge healthcare公司)。将用hbs-ep (ge healthcare公司)稀释到0.5μg/ml的评价的各抗hla/ny-eso scfv以10μl/min接触60秒并固定化。然后,将用hbs-ep 稀释的多种浓度的hla/ny-eso作为分析物,以30μl/min的流量添加各样品120秒,通过间隔600秒测定的单循环动力学分析计算出kd,将结果记载于表1。结果表明,与亲本抗体nya-0001相比,其突变体均与hla/ny-eso强力结合。另外,与nyc-0004相比,nya-1143、nya-2023、nya-2143、nya-2044、nya-2045、nya-2060以及nya-2061的结合较强,其中nya-1143、nya-2044、nya-2045、nya-2143的kd显示为1nm以下。
[0767]
[表1]
[0768]
克隆名称kd(nm)nya-000133.8nya-11431.0nya-116313.0nya-20232.4nya-202711.2nya-20353.2nya-20440.8nya-20450.8nya-20475.3nya-20486.3nya-20601.1
nya-20611.5nya-21430.9nyc-00038.1nyc-00042.8
[0769]
(实施例5)抗hla/ny-eso scfv的ny-eso肽内的识别氨基酸分析
[0770]
将人淋巴母细胞融合细胞系t2(atcc)细胞用含有20%fbs的aim-v培养基(赛默飞世尔科技公司)调整到适当浓度,添加ny-eso肽(seq id no:1)、点突变ny-eso肽1f、2m、3a、4a、5a、6l、7f、8a、9a(seq id no:121(图122)、seq id no:122(图123)、seq id no:123(图124)、seq id no:124(图125)、seq id no:125(图126)、seq id no:126(图127)、seq id no:127(图128)、seq id no:128(图129)、seq id no:129(图130))、gp100肽(seq id no:130(图131))(均来自sigma genosys公司)用dmso溶解至5mm的溶液使最终浓度变为50μm;或者添加1/100量的dmso,在37℃孵育4小时。用含有20%fbs的aim-v培养基洗涤2次后,用含有5%fbs的pbs制备成适当浓度,添加live/dead可固定死细胞染色试剂盒(赛默飞世尔科技公司),在4℃静置30分钟。用含有5%fbs的pbs洗涤2次后,将细胞分成两组,用含有5%fbs的pbs以105细胞/孔的量向96孔u底微板接种,离心后除去上清液。关于一组细胞,以25μl/孔的量添加用含有5%fbs的pbs稀释到100nm的抗hla/ny-eso scfv,在4℃静置30分钟。用含有5%fbs的pbs洗涤2次后,以25μl/孔的量添加用含有5%fbs的pbs稀释的penta-his alexa fluor488(qiagen公司),在4℃静置30分钟。用含有5%fbs的pbs洗涤2次后,以25μl/孔的量添加用含有5%fbs的pbs稀释的抗小鼠-igg alexa fluor488(赛默飞世尔科技公司),在4℃静置30分钟。用含有5%fbs的pbs洗涤2次后,用mildform 10n(富士胶片和光纯药株式会社)固定过夜后,用含有5%fbs的pbs再次悬浮。为了以hla/肽复合物量进行标准化,关于另一组细胞,以25μl/孔的量添加用含有5%fbs的pbs稀释到10μg/ml的hla-a2抗体bb7.2-alexa fluor 488,或者小鼠igg2b-alexa fluor 488,在4℃静置30分钟。用含有5%fbs的pbs洗涤2次后,用mildform 10n(富士胶片和光纯药株式会社)固定过夜后,用含有5%fbs的pbs再次悬浮。用流式细胞仪(cantoii,becton dickinson公司)对这些细胞悬浮液进行检测。用flowjo(treesta r公司)进行数据分析,测定t2细胞的死细胞去除级分的alexa fluor 488的几何平均荧光强度(gmfi)。以t2细胞上的hla/肽复合物量标准化的表示各scfv的结合性的值标准化gmfi用以下公式计算。
[0771]
标准化gmfi=(a/b)
×
((c/d)/(e/f))
[0772]
·
a/b=相对gmfi
[0773]
a:添加了抗体的dmso或者添加了各肽的t2细胞的gmfi
[0774]
b:未添加抗体的dmso或者添加了各肽的t2细胞的gmfi
[0775]
·
(c/d)/(e/f)=dmso或者添加了各肽的t2细胞的hla/肽复合物量校正值
[0776]
c:添加了hla-a2抗体的dmso或者添加了各肽的t2细胞的gmfi
[0777]
d:添加了小鼠igg2b抗体的dmso或者添加了各肽的t2细胞的gmfi
[0778]
e:添加了添加hla-a2抗体的dmso的t2细胞的gmfi
[0779]
f:添加了添加小鼠igg2b抗体的dmso的t2细胞的gmfi
[0780]
如图1所示,抗hla/ny-eso scfv nya-0001、1143、2044、2045、2047、2048、2060、2061与野生型ny-eso肽相比,针对在第1、4、5、7位氨基酸导入了点突变的添加了肽的t2的
结合性降低到了一半以下,因此表示识别到了ny-eso肽的第1、4、5、7位氨基酸。同样,还表示nya-1154识别到了第1、5位,nya-1163识别到了第1、3、4、5、6、7位,nya-2023、2027、2035识别到了第1、4、5位,nya-2143识别到了第1、5、7位。另一方面,还表示nyc-0003、0004识别到了第4、5位。
[0781]
(实施例6)抗hla/ny-eso scfv的抗原结合特异性评价
[0782]
为了在人类蛋白质组(swiss-prot)中检索有可能结合的与ny-eso肽:sllmwitqc(seq id no:1)氨基酸序列相似但不相同的人类肽(以下称为“同源性肽”),检索了表示很多本发明抗体识别到的第1、4、5位一致的9-mer肽。关于检索到的9-mer肽,用netmhcpan2.8预测针对hla-a0201的结合性,选择了预测ic50为500nm以下的、图2a所示的9-mer肽,作为用于评价抗hla/ny-eso scfv的结合特异性的同源性肽。将t2细胞用含有20%fbs的aim-v培养基(赛默飞世尔科技公司)调整到适当浓度,将ny-eso肽(seq id no:1)、同源性肽dolpp1、il20rb、prkd2、cd163、p2ry8(seq id no:131(图132)、seq id no:132(图133)、seq id no:133(图134)、seq id no:134(图135)、seq id no:135(图136))、gp100肽(seq id no:130(图131))(均来自sigma genosys公司)用dmso溶解至5mm,将该溶液的最终浓度变为50μm,或者向该溶液添加1/100量的dmso,通过与实施例5相同的方法对各抗体的结合性进行评价。以t2细胞上的hla/肽复合物量标准化的表示各scfv的结合性的值标准化gmfi用以下公式计算。
[0783]
标准化gmfi=(a/b)
×
((c/d)/(e/f))
[0784]
·
a/b=相对gmfi
[0785]
a:添加了抗体的dmso或者添加了各肽的t2细胞的gmfi
[0786]
b:未添加抗体的dmso或者添加了各肽的t2细胞的gmfi
[0787]
·
(c/d)/(e/f)=dmso,或者添加了各肽的t2细胞的hla/肽复合物量校正值
[0788]
c:添加了hla-a2抗体的dmso或者添加了各肽的t2细胞的gmfi
[0789]
d:添加了小鼠igg2b抗体的dmso或者添加了各肽的t2细胞的gmfi
[0790]
e:添加了添加hla-a2抗体的dmso的t2细胞的gmfi
[0791]
f:添加了添加小鼠igg2b抗体的dmso的t2细胞的gmfi
[0792]
如图2b所示,抗hla/ny-eso scfv nya-0001、1143、1163、2023、2027、2035、2044、2045、2047、2048、2060、2061、2143均未与添加了同源性肽的细胞结合,表示特异性高。另一方面,观察到nya-1154、nyc-0003、0004与部分添加了同源性肽的t2细胞进行了结合。
[0793]
(实施例7)fc添加型抗hla/ny-eso-抗cd3双特异性分子的制作
[0794]
7)-1fc添加型抗hla/ny-eso-抗cd3双特异性分子表达载体的制作
[0795]
7)-1-1tafv-异二聚体fc型双特异性分子表达载体的制作
[0796]
为了评价tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子,设计了各分子的表达载体。抗hla/ny-eso抗体使用了nya-1143、nya-2143、nya-1163、nya-2023、nya-2027、nya-2035、nya-2044、nya-2045、nya-2047、nya-2048、nya-2060以及nya-2061。抗cd3抗体使用了作为人源化抗cd3 scfv的c3e-7085(wo2018/117237)。异二聚体fc序列使用了导入降低效应器功能且形成异多聚体的突变的fc序列(wo2014/190441)。
[0797]
合成编码导入降低效应器功能且形成异多聚体的突变的fc(hc1或hc2)的dna片段(株式会社fasmac),通过in-fusion hd克隆试剂盒(clontech公司),制作以pcdna3.3(赛默
飞世尔科技公司)为骨架的哺乳动物细胞用表达载体,命名为“p_hc1”。
[0798]
制作向用ggggs接头将nya-1143和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0016-hc2”。
[0799]
通过向p_nyf-0016-hc2导入位点特异性突变,来制作向用ggggs接头将nya-2143和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0019-hc2”。
[0800]
使用in-fusion hd克隆试剂盒(clontech公司),将编码p_nyf-0016-hc2的nya-1143的碱基序列部分置换为编码nya-1163的dna片段,以此来制作向用ggggs接头将nya-1163和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0022-hc2”。
[0801]
通过向p_nyf-0016-hc2导入位点特异性突变,来制作向用ggggs接头将nya-2023和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0023-hc2”。
[0802]
通过对向用ggggs接头将nya-0001和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体导入位点特异性突变,来制作向用ggggs接头将nya-2027和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0027-hc2”。
[0803]
通过向p_nyf-0016-hc2导入位点特异性突变,来制作向用ggggs接头将nya-2035和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0035-hc2”。
[0804]
使用in-fusion hd克隆试剂盒(clontech公司),将编码p_nyf-0016-hc2的nya-1143的碱基序列部分置换为编码nya-2044的dna片段,以此来制作向用ggggs接头将nya-2044和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0044-hc2”。
[0805]
使用in-fusion hd克隆试剂盒(clontech公司),将编码p_nyf-0016-hc2的nya-1143的碱基序列部分置换为编码nya-2045的dna片段,以此来制作向用ggggs接头将nya-2045和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0045-hc2”。
[0806]
使用in-fusion hd克隆试剂盒(clontech公司),将编码p_nyf-0016-hc2的nya-1143的碱基序列部分置换为编码nya-2047的dna片段,以此来制作向用ggggs接头将nya-2047和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0047-hc2”。
[0807]
使用in-fusion hd克隆试剂盒(clontech公司),将编码p_nyf-0016-hc2的nya-1143的碱基序列部分置换为编码nya-2048的dna片段,以此来制作向用ggggs接头将nya-2048和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0048-hc2”。
[0808]
通过向p_nyf-0044-hc2导入位点特异性突变,来制作向用ggggs接头将nya-2060和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0060-hc2”。
[0809]
通过向p_nyf-0045-hc2导入位点特异性突变,来制作向用ggggs接头将nya-2061和c3e-7085连接的tafv的羧基末端导入编码hc2的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0061-hc2”。
[0810]
对p_hc1的核苷酸序列进行重新分析,确认到hc1全长核苷酸序列是序列表的seq id no:71(图72)所示的核苷酸序列。
[0811]
对p_nyf-0016-hc2的核苷酸序列进行重新分析,确认到nyf-0016-hc2全长核苷酸序列是序列表的seq id no:72(图73)所示的核苷酸序列。
[0812]
对p_nyf-0019-hc2的核苷酸序列进行重新分析,确认到nyf-0019-hc2全长核苷酸序列是序列表的seq id no:73(图74)所示的核苷酸序列。
[0813]
对p_nyf-0022-hc2的核苷酸序列进行重新分析,确认到nyf-0022-hc2全长核苷酸序列是序列表的seq id no:74(图75)所示的核苷酸序列。
[0814]
对p_nyf-0023-hc2的核苷酸序列进行重新分析,确认到nyf-0023-hc2全长核苷酸序列是序列表的seq id no:75(图76)所示的核苷酸序列。
[0815]
对p_nyf-0027-hc2的核苷酸序列进行重新分析,确认到nyf-0027-hc2全长核苷酸序列是序列表的seq id no:76(图77)所示的核苷酸序列。
[0816]
对p_nyf-0035-hc2的核苷酸序列进行重新分析,确认到nyf-0035-hc2全长核苷酸序列是序列表的seq id no:77(图78)所示的核苷酸序列。
[0817]
对p_nyf-0044-hc2的核苷酸序列进行重新分析,确认到nyf-0044-hc2全长核苷酸序列是序列表的seq id no:78(图79)所示的核苷酸序列。
[0818]
对p_nyf-0045-hc2的核苷酸序列进行重新分析,确认到nyf-0045-hc2全长核苷酸序列是序列表的seq id no:79(图80)所示的核苷酸序列。
[0819]
对p_nyf-0047-hc2的核苷酸序列进行重新分析,确认到nyf-0047-hc2全长核苷酸序列是序列表的seq id no:80(图81)所示的核苷酸序列。
[0820]
对p_nyf-0048-hc2的核苷酸序列进行重新分析,确认到nyf-0048-hc2全长核苷酸序列是序列表的seq id no:81(图82)所示的核苷酸序列。
[0821]
对p_nyf-0060-hc2的核苷酸序列进行重新分析,确认到nyf-0060-hc2全长核苷酸序列是序列表的seq id no:82(图83)所示的核苷酸序列。
[0822]
对p_nyf-0061-hc2的核苷酸序列进行重新分析,确认到nyf-0061-hc2全长核苷酸序列是序列表的seq id no:83(图84)所示的核苷酸序列。
[0823]
另外,在上述核苷酸序列中,确认到该序列所编码的hc1、nyf-0016-hc2、nyf-0019-hc2、nyf-0022-hc2、nyf-0023-hc2、nyf-0027-hc2、nyf-0035-hc2、nyf-0044-hc2、nyf-0045-hc2、nyf-0047-hc2、nyf-0048-hc2、nyf-0060-hc2、nyf-0061-hc2全长氨基酸序列。
[0824]
hc1全长氨基酸序列是序列表的seq id no:84(图85)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第20位至第246位的氨基酸序列是hc。
[0825]
nyf-0016-hc2全长氨基酸序列是序列表的seq id no:85(图86)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-1143―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0826]
nyf-0019-hc2全长氨基酸序列是序列表的seq id no:86(图87)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2143―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0827]
nyf-0022-hc2全长氨基酸序列是序列表的seq id no:87(图88)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-1163―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0828]
nyf-0023-hc2全长氨基酸序列是序列表的seq id no:88(图89)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2023―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0829]
nyf-0027-hc2全长氨基酸序列是序列表的seq id no:89(图90)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2027―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0830]
nyf-0035-hc2全长氨基酸序列是序列表的seq id no:90(图91)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2035―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0831]
nyf-0044-hc2全长氨基酸序列是序列表的seq id no:91(图92)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2044―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0832]
nyf-0045-hc2全长氨基酸序列是序列表的seq id no:92(图93)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2045―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0833]
nyf-0047-hc2全长氨基酸序列是序列表的seq id no:93(图94)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2047―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0834]
nyf-0048-hc2全长氨基酸序列是序列表的seq id no:94(图95)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2048―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0835]
nyf-0060-hc2全长氨基酸序列是序列表的seq id no:95(图96)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2060―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的
氨基酸序列是hc2。
[0836]
nyf-0061-hc2全长氨基酸序列是序列表的seq id no:96(图97)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2061―c3e-7085tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0837]
7)-1-2tafv-fab-异二聚体fc型双特异性分子表达载体的制作
[0838]
设计了tafv-fab-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子表达用载体。抗hla/ny-eso抗体使用了nya-0001。抗cd3抗体使用了作为人源化抗cd3 scfv的c3e-7085(wo2018/117237)。异二聚体fc序列使用了导入降低效应器功能且形成异多聚体的突变的fc序列(wo2014/190441)。
[0839]
制作导入了nya-0001的重链可变区、来自人igg的ch1区域,以及降低效应器功能、且编码hc1-k delete的dna片段的哺乳动物细胞用表达载体,命名为“p_nya-0001-fab-hc1-k delete”。另外,制作导入了nya-0001轻链可变区、编码来自人igg的cl区域的dna片段的哺乳动物细胞用表达载体,命名为“p_nya-0001-lc”。
[0840]
对p_nya-0001-fab-hc1-k delete的核苷酸序列进行重新分析,确认到nya-0001-fab-hc1-k delete全长核苷酸序列是序列表的seq id no:97(图98)所示的核苷酸序列。
[0841]
对p_nya-0001-lc的核苷酸序列进行重新分析,确认到nya-0001-lc全长核苷酸序列是序列表的seq id no:98(图99)所示的核苷酸序列。
[0842]
另外,在上述核苷酸序列中,确认到该序列所编码的nya-0001-fab-hc1-k delete和nya-0001-lc全长氨基酸序列。
[0843]
nya-0001-fab-hc1-k delete全长氨基酸序列是序列表的seq id no:99(图100)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第20位至第139位的氨基酸序列是可变区,第140位至第468位的氨基酸序列是恒定区。另外,第45位至第52位的氨基酸序列是cdrh1(seq id no:54(图61)),第70位至第77位的氨基酸序列是cdrh2(seq id no:55(图61)),第116位至第128位的氨基酸序列是cdrh3(seq id no:56(图61))。
[0844]
nya-0001-lc全长氨基酸序列是序列表的seq id no:100(图101)所示的氨基酸序列。第1位至第20位的氨基酸序列是信号序列,第21位至第131位的氨基酸序列是可变区,第132位至第237位的氨基酸序列是恒定区。另外,氨基酸编号46至53是cdrl1(seq id no:57(图61)),氨基酸编号71至73是cdrl2(seq id no:58(图61)),氨基酸编号110至121是cdrl3(seq id no:59(图61))。
[0845]
7)-2fc添加型抗hla/ny-eso-抗cd3双特异性分子的表达
[0846]
7)-2-1tafv-异二聚体fc型双特异性分子的表达
[0847]
按照手册,对expi293f细胞(赛默飞世尔科技公司)进行继代培养。在expi293表达培养基(赛默飞世尔科技公司)中,将处于对数增殖期的expi293f细胞培养液稀释到2.5
×
106细胞/ml,用于生产各种双特异性分子。在20ml的opti-pro sfm培养基(赛默飞世尔科技公司)中加入0.3mg的按1:1.5的比例混合有载体p_nyf-0016-hc2和p_hc1的载体混合物、0.9mg的聚乙烯亚胺(polyscience#24765)并平稳搅拌,再放置5分钟,然后添加到expi293f细胞。在37℃、8%co2培养箱中以135rpm振荡培养6天,用0.2μm滤膜(millopore公司)对得到的培养上清液进行过滤,得到tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子
(nyf-0016)的培养上清液。使构成nyf-0016的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:85(图86)和seq id no:84(图85)。
[0848]
通过同样的方法,使用p_nyf-0019-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0019)的培养上清液。使构成nyf-0019的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:86(图87)和seq id no:84(图85)。
[0849]
使用p_nyf-0022-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0022)的培养上清液。使构成nyf-0022的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:87(图88)和seq id no:84(图85)。
[0850]
使用p_nyf-0023-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0023)的培养上清液。使构成nyf-0023的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:88(图89)和seq id no:84(图85)。
[0851]
使用p_nyf-0027-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0027)的培养上清液。使构成nyf-0027的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:89(图90)和seq id no:84(图85)。
[0852]
使用p_nyf-0035-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0035)的培养上清液。使构成nyf-0035的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:90(图91)和seq id no:84(图85)。
[0853]
使用p_nyf-0044-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0044)的培养上清液。使构成nyf-0044的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:91(图92)和seq id no:84(图85)。
[0854]
使用p_nyf-0045-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0045)的培养上清液。使构成nyf-0045的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:92(图93)和seq id no:84(图85)。
[0855]
使用p_nyf-0047-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0047)的培养上清液。使构成nyf-0047的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:93(图94)和seq id no:84(图85)。
[0856]
使用p_nyf-0048-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0048)的培养上清液。使构成nyf-0048的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:94(图95)和seq id no:84(图85)。
[0857]
使用p_nyf-0060-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0060)的培养上清液。使构成nyf-0060的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:95(图96)和seq id no:84(图85)。
[0858]
使用p_nyf-0061-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0061)的培养上清液。使构成nyf-0061的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:96(图97)和seq id no:84(图85)。
[0859]
7)-2-2tafv-fab-异二聚体fc型双特异性分子的表达
[0860]
通过与7)-2-1相同的方法,使用按照1:1:1.5的比例混合有p_nyf-0023-hc2、p_nya-0001-fab-hc1-k delete和p_nya-0001-lc的载体混合物,表达并制备了tafv-fab-异
二聚体fc型双特异性分子(nyf-0058)的培养上清液。使构成nyf-0058的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:88(图89)的氨基酸编号20~745、seq id no:99(图100)的氨基酸编号20~468,以及seq id no:100(图101)的氨基酸编号21~237。
[0861]
7)-3fc添加型抗hla/ny-eso-抗cd3双特异性分子的纯化
[0862]
通过蛋白a亲和层析和凝胶过滤层析的两阶段步骤,从7)-2中得到的培养上清液中纯化出各种双特异性分子。
[0863]
在用ph值7.4的pbs平衡的mabselectsure柱(ge healthcare bioscience公司,也单纯称作“ge healthcare公司”)中将培养上清液上样,吸附目的双特异性分子。用pbs去除非吸附成分后,用ph值3.5的醋酸缓冲液洗脱吸附成分。用ph值9.5的tris缓冲液将洗脱级分的ph值调整为中性后,将洗脱级分浓缩,用于预先用25mm组氨酸、300mm nacl、5%山梨糖醇、ph值5.5平衡的凝胶过滤柱superdex 200 10/300(ge healthcare bioscience公司)。从通过凝胶过滤层析得到的峰级分中,回收相当于目的异二聚体的级分,通过sds-聚丙烯酰胺凝胶电泳(sds-page),确认到目的抗hla/ny-eso-抗cd3双特异性分子已经形成。纯化蛋白样品用于分析用sec,确定纯度和浓度后,用于各种评价。
[0864]
(实施例8)fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子的细胞毒活性评价
[0865]
8)-1靶细胞的制备
[0866]
在含有10%fbs的rpmi1640培养基(富士胶片和光纯药株式会社)中,将表达内源性人ny-eso的细胞系(u266b1和nci-h1703)和不表达内源性人ny-eso的细胞系(ags和cfpac-1)制备成1
×
106细胞/ml的浓度,以每1ml各细胞悬浮液100μl的量添加铬-51放射性核素(珀金埃尔默公司),在37℃、5%co2的条件下培养2小时。用含有10%fbs的rpmi1640培养基洗涤2次后,用含有10%fbs的rpmi1640培养基再次悬浮,使浓度变成1
×
105细胞/ml,将该产物用作靶细胞。
[0867]
8)-2效应细胞的制备
[0868]
在37℃将市售的冷冻人pbmc(cellular technology limited公司)解冻,转移到在含有10%fbs的rpmi1640培养基中添加anti-aggregate wash试剂(cellular technology limited公司)的溶液中洗涤2次后,用含有10%fbs的rpmi1640培养基制备成1
×
106细胞/ml,作为效应细胞。
[0869]
8)-3细胞毒性检测
[0870]
以50μl/孔的量,向96孔u底微板添加8)-1中获得的各靶细胞。以50μl/孔的量,向其添加制备成各种浓度的实施例7中制备的各种fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子,以100μl/孔的量添加实施例8)-2中制备的效应细胞,在室温下以1000rpm离心1分钟后,在37℃、5%co2的条件下培养20至24小时。将50μl上清液回收到lumaplate(珀金埃尔默公司),在50℃大约干燥2小时后,用读板仪(topcount,珀金埃尔默公司)进行测定。试验重复实施三次,细胞溶解率通过以下公式计算。
[0871]
细胞溶解率(%)=(a-b)/(c-b)
×
100
[0872]
a:样品孔的计数。
[0873]
b:背景(未添加抗体的孔)计数的平均值(n=3)。在添加抗体时添加了50μl的检测用培养基。除此之外进行了与样品孔相同的操作。c:最大释放(用表面活性剂溶解靶细胞的孔)计数的平均值(n=3)。在添加抗体时添加了50μl的检测培养基。添加100μl表面活性剂,
与样品孔同样地将50μl的量转移到lumaplate,实施了测定。
[0874]
如图4a-f所示,对于表达内源性人ny-eso的细胞系(u266b1和nci-h1703),各种抗hla-a2/ny-eso-抗cd3双特异性分子显示出了细胞毒活性。使用分析软件(sigmaplot,12.0版)的四参数逻辑曲线(four parameter logistics curve)的算式计算ec
50
,将u266b1细胞系中的结果记载在表2,将nci-h1703细胞系中的结果记载在表3。不适用(not applicable,na)表示相关系数r值未算出,无法进行曲线拟合。另一方面,如图4g-l所示,未确认到对于不表达内源性人ny-eso的细胞系(ags和cfpac-1)的细胞毒活性。
[0875]
[表2]
[0876] 名称ec
50
(nm)1nyf-00160.302nyf-00190.203nyf-00221.304nyf-00230.905nyf-00272.686nyf-00350.977nyf-00440.108nyf-00450.189nyf-00470.9310nyf-00481.1011nyf-00580.9512nyf-00600.3913nyf-00610.40
[0877]
[表3]
[0878][0879][0880]
*na=not applicable(不适用)
[0881]
(实施例9)fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子在人pbmc转移模型中
的体内活性评价
[0882]
用含有50%基质胶(corning公司)的pbs将人鳞状细胞肺癌细胞系nci-h1703(atcc)制备成6
×
107细胞/ml,向nog小鼠(雌性,6~7周龄)的皮下移植0.1ml(第0天)。在第4天用pbs将人pbmc制备成3.75
×
107细胞/ml,向尾静脉内移植0.2ml。从大约1周后(第6天~第7天)起,随着时间的经过,用电子数显卡尺测量肿瘤的长径(mm)和短径(mm),根据如下所示的算式计算出预估肿瘤体积。
[0883]
预估肿瘤体积(mm3)=各个体的预估肿瘤体积的平均值
[0884]
各个体的预估肿瘤体积=长径
×
短径2/2
[0885]
在第14天,根据肿瘤体积进行分组,使各组n=5~6,向尾静脉内施用各种抗hla-a2/ny-eso-抗cd3双特异性分子(为1mg/kg,为了以同摩尔量进行对比,因此只有nyf-0058为1.5mg/kg)。施用在第14天、第21天、第28天实施。在各种抗hla-a2/ny-eso-抗cd3双特异性分子施用组中确认到了抗肿瘤效果(图5a-c)。通过如下所示的算式计算出第31~32天的肿瘤生长抑制(%),记载在表4。
[0886]
肿瘤生长抑制(%)=100-(各组的预估肿瘤体积/空白对照的预估肿瘤体积
×
100)
[0887]
[表4]
[0888][0889][0890]
(实施例10)各种fc添加型构型抗hla/ny-eso-抗cd3双特异性分子的制作
[0891]
10)-1各种fc添加型构型抗hla/ny-eso-抗cd3双特异性分子表达载体的制作
[0892]
10)-1-1杂合型双特异性分子表达载体的制作
[0893]
为了评价杂合型抗hla/ny-eso-抗cd3双特异性分子,设计了各分子的表达载体。抗hla/ny-eso抗体使用了nya-1143。抗cd3抗体使用了作为人源化抗cd3 scfv的c3e-7085(pct/jp2017/046006)。异二聚体fc序列使用了导入降低效应器功能且形成异多聚体的突变的fc序列(wo2014/190441)。
[0894]
制作导入了编码nya-1143的重链可变区、来自人igg的ch1区域,以及导入了降低效应器功能且形成异多聚体的突变的fc区域的dna片段的哺乳动物细胞用表达载体,命名
为“p_nya-1143-fab-hc1-k delete”。另外,制作导入了编码nya-1143轻链可变区、来自人igg的cl区域的dna片段的哺乳动物细胞用表达载体,命名为“p_nya-1143-lc”。另外,制作了哺乳动物细胞用表达载体“p_c3e-7085-hc2-k delete”,该表达载体导入了编码在人源化抗cd3 scfv(c3e-7085)的羧基末端导入了降低效应器功能且形成异多聚体的突变的fc区域的dna片段。
[0895]
对p_nya-1143-fab-hc1-k delete的核苷酸序列进行重新分析,确认到nya-1143-fab-hc1-k delete全长核苷酸序列是序列表的seq id no:101(图102)所示的核苷酸序列。
[0896]
对p_nya-1143-lc的核苷酸序列进行重新分析,确认到nya-1143-lc全长核苷酸序列是序列表的seq id no:102(图103)所示的核苷酸序列。
[0897]
对p_c3e-7085-hc2-k delete的核苷酸序列进行重新分析,确认到c3e-7085-hc2-k delete全长核苷酸序列是序列表的seq id no:103(图104)所示的核苷酸序列。
[0898]
另外,在上述核苷酸序列中,确认到该序列所编码的nya-1143-fab-hc1-k delete、nya-1143-lc和c3e-7085-hc2-k delete全长氨基酸序列。
[0899]
nya-1143-fab-hc1-k delete全长氨基酸序列是序列表的seq id no:104(图105)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第139位的氨基酸序列是可变区,第140位至第468位的氨基酸序列是恒定区。另外,第45位至第52位的氨基酸序列是cdrh1(seq id no:54(图61)),第70位至第77位的氨基酸序列是cdrh2(seq id no:55(图61)),第116位至第128位的氨基酸序列是cdrh3(seq id no:56(图61))。
[0900]
nya-1143-lc全长氨基酸序列是序列表的seq id no:105(图106)所示的氨基酸序列。第1位至第20位的氨基酸序列是信号序列,第21位至第131位的氨基酸序列是可变区,第132位至第237位的氨基酸序列是恒定区。另外,氨基酸编号46至53是cdrl1(seq id no:60(图62)),氨基酸编号71至73是cdrl2(seq id no:58(图61)),氨基酸编号110至121是cdrl3(seq id no:59(图61))。
[0901]
c3e-7085-hc2-k delete全长氨基酸序列是序列表的seq id no:106(图107)所示的氨基酸序列。第1位至第19位的氨基酸序列是信号序列,第21位至第260位的氨基酸序列是c3e-7085,第261位至第262位的氨基酸序列是接头,第263位至第493位的氨基酸序列是导入了降低效应器功能且形成异二聚体的突变的fc。
[0902]
10)-1-2双型双特异性分子表达载体的制作
[0903]
为了评价双型抗hla/ny-eso-抗cd3双特异性分子,设计了以下表达载体。制作了哺乳动物细胞用表达载体“p_nya-1143-hc1-k delete”,该表达载体在nya-1143的羧基末端导入了dna片段,该dna片段编码导入了降低效应器功能且形成异多聚体的突变的fc区域。
[0904]
对p_nya-1143-hc1-k delete的核苷酸序列进行重新分析,确认到nya-1143-hc1-k delete全长核苷酸序列是序列表的seq id no:107(图108)所示的核苷酸序列。另外,在上述核苷酸序列中,确认到该序列所编码的nya-1143-hc1-k delete全长氨基酸序列。nya-1143-hc1-k delete全长氨基酸序列是序列表的seq id no:108(图109)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第266位的氨基酸序列是nya-1143,第267位至第268位的氨基酸序列是接头,第269位至第499位的氨基酸序列是导入了降低效应器功能且形成异二聚体的突变的fc。
[0905]
10)-1-3scfv-fab-异二聚体fc型双特异性分子表达载体的制作
[0906]
为了评价scfv-fab-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子,设计了各分子的表达载体。抗hla/ny-eso抗体使用了nya-1154,抗cd3抗体使用了c3e-7085。异二聚体fc序列使用了导入降低效应器功能且形成异多聚体的突变的fc序列。
[0907]
制作导入了编码在c3e-7085的羧基末端的nya-1154的重链可变区、来自人igg的ch1区域,以及导入了降低效应器功能且形成异多聚体的突变的fc区域的dna片段的哺乳动物细胞用表达载体,命名为“p_c3e-7085-nya-1154-fab-hc2-k delete”。另外,制作导入了nya-1154轻链可变区、编码来自人igg的cl区域的dna片段的哺乳动物细胞用表达载体,命名为“p_nya-1154-lc”。另外,制作导入了编码hc1-k delete的dna片段的哺乳动物细胞用表达载体,命名为“p_oaa-hc1-k delete”。
[0908]
对p_c3e-7085-nya-1154-fab-hc2-k delete的核苷酸序列进行重新分析,确认到c3e-7085-nya-1154-fab-hc2-k delete全长核苷酸序列是序列表的seq id no:109(图110)所示的核苷酸序列。
[0909]
对p_nya-1154-lc的核苷酸序列进行重新分析,确认到nya-1154-lc全长核苷酸序列是序列表的seq id no:110(图111)所示的核苷酸序列。
[0910]
对p_oaa-hc1-k delete的核苷酸序列进行重新分析,确认到oaa-hc1-k delete全长核苷酸序列是序列表的seq id no:111(图112)所示的核苷酸序列。
[0911]
另外,在上述核苷酸序列中,确认到该序列所编码的c3e-7085-nya-1154-fab-hc2-k delete、nya-1154-lc和oaa-hc1-k delete全长氨基酸序列。
[0912]
c3e-7085-nya-1154-fab-hc2-k delete全长氨基酸序列是序列表的seq id no:112(图113)所示的氨基酸序列。第1位至第19位的氨基酸序列是信号序列,第21位至第260位的氨基酸序列是c3e-7085,第261位至第385位的氨基酸序列是接头,第266位至第385位的氨基酸序列是nya-1154-重链可变区。另外,氨基酸编号386至714的氨基酸序列是hc2-k delete。
[0913]
nya-1154-lc全长氨基酸序列是序列表的seq id no:113(图114)所示的氨基酸序列。第1位至第20位的氨基酸序列是信号序列,第21位至第131位的氨基酸序列是可变区,第132位至第237位的氨基酸序列是恒定区。另外,氨基酸编号46至53是cdrl1(seq id no:57(图61)),氨基酸编号71至73是cdrl2(seq id no:58(图61)),氨基酸编号110至121是cdrl3(seq id no:63(图64))。
[0914]
oaa-hc1-k delete全长氨基酸序列是序列表的seq id no:114(图115)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第20位至第245位的氨基酸序列是oaa-hc1-k delete。
[0915]
10)-1-4各种用于评价构型的tafv-异二聚体fc型双特异性分子表达载体的制作
[0916]
为了对各种用于评价构型的tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子进行评价,设计了各分子的表达载体。抗hla/ny-eso抗体使用了nya-1143和nya-1154。抗cd3抗体使用了作为人源化抗cd3 scfv的c3e-7085。异二聚体fc序列使用了导入降低效应器功能且形成异多聚体的突变的fc序列。
[0917]
制作向用ggggs接头将nya-1154和c3e-7085连接的tafv的羧基末端导入编码hc2-k delete的dna片段的哺乳动物细胞用表达载体,命名为“p_nyf-0010-hc2-k delete”。
1154-fab-hc2-k delete、p_oaa-hc1-k delete、p_nya-1154-lc的载体混合物,表达并制备了scfv-fab-异二聚体fc型(scfv-fab-fc型)双特异性分子(nyf-0003)的培养上清液。使构成nyf-0003的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:112(图113)、seq id no:113(图114)和seq id no:114(图115)。
[0934]
10)-2-4各种用于评价构型的tafv-异二聚体fc型双特异性分子的表达
[0935]
通过与7)-2-1相同的方法,使用p_nyf-0010-hc2-k delete、p_oaa-hc1-k delete,表达并制备了tafv-异二聚体fc型(tafv-fc型)抗hla/ny-eso-抗cd3双特异性分子(nyf-0010)的培养上清液。使构成nyf-0010的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:118(图119)和seq id no:114(图115)。
[0936]
使用p_nyf-0004-hc2-k delete、p_oaa-hc1-k delete,表达并制备了tafv(反向)-异二聚体fc型(tafv(反向)-fc型)抗hla/ny-eso-抗cd3双特异性分子(nyf-0004)的培养上清液。使构成nyf-0004的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:119(图120)和seq id no:114(图115)。
[0937]
使用p_nyf-0011-hc2-k delete、p_oaa-hc1-k delete,表达并制备了tafv-fc型抗hla/ny-eso-抗cd3双特异性分子(nyf-0011)的培养上清液。使构成nyf-0011的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:120(图121)和seq id no:114(图115)。
[0938]
10)-3各种构型fc添加型抗hla/ny-eso-抗cd3双特异性分子的纯化
[0939]
通过蛋白a亲和层析和陶瓷羟基磷灰石的两阶段步骤,从10)-2-1和10)-2-2中得到的培养上清液中纯化出各种双特异性分子。
[0940]
在用ph值7.4的pbs平衡的mabselectsure柱(ge healthcare bioscience公司)中将培养上清液上样,吸附目的双特异性分子。用pbs去除非吸附成分后,用ph值3.6的醋酸缓冲液洗脱吸附成分。用ph值9.5的tris缓冲液将洗脱级分的ph值调整为中性,将缓冲液交换成25mm组氨酸、150mm nacl、5%山梨糖醇、ph值5.5。在用10mm磷酸钾/50mm mes/ph值6.5的缓冲液平衡的陶瓷羟基磷灰石柱(bio-scale cht type-1 hydroxyapatite column,日本bio-rad公司)中,将用10mm磷酸钾/50mm mes/ph值6.5的缓冲液稀释了5倍的目的级分溶液上样。通过氯化钠实施线性浓度梯度洗脱,收集到了对应于目的异二聚体的级分。用于预先用25mm组氨酸、300mm nacl、5%山梨糖醇、ph值6.0平衡的凝胶过滤柱superdex 200 10/300(ge healthcare bioscience公司)。从通过凝胶过滤层析而得到的峰级分中,回收对应于目的异二聚体的级分,将缓冲液交换成25mm组氨酸、150mm nacl、5%山梨糖醇、ph值5.5。通过sds-聚丙烯酰胺凝胶电泳(sds-page),确认到目的抗hla/ny-eso-抗cd3双特异性分子已经形成。纯化蛋白样品用于分析用sec,确定纯度和浓度后,用于各种评价。
[0941]
另外,通过与7)-3相同的方法,利用蛋白a亲和层析和凝胶过滤层析的两阶段步骤,从10)-2-3和10)-2-4中得到的培养上清液中纯化出各种双特异性分子。通过sds-聚丙烯酰胺凝胶电泳(sds-page),确认到目的抗hla/ny-eso-抗cd3双特异性分子已经形成。纯化蛋白样品用于分析用sec,确定纯度和浓度后,用于各种评价。
[0942]
(实施例11)各种构型fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子的体外活性评价
[0943]
11)-1杂合体、双体、tafv-fc体抗hla-a2/ny-eso-抗cd3双特异性分子的体外活性
评价
[0944]
11)-1-1靶细胞的制备
[0945]
通过与实施例8)-1相同的方法,制备u266b1细胞系,用作靶细胞。
[0946]
11)-1-2效应细胞的制备
[0947]
通过与实施例8)-2相同的方法,制备市售的冷冻人pbmc(cellular technology limited公司),用作效应细胞。
[0948]
11)-1-3细胞毒性检测
[0949]
以50μl/孔的量向96孔u底微板添加实施例11)-1-1中获得的各靶细胞。以50μl/孔的量向其添加制备成各种浓度的实施例10中制备的各种构型抗hla-a2/ny-eso-抗cd3双特异性分子,以100μl/孔的量添加实施例11)-1-2中制备的效应细胞,在室温下以1000rpm离心1分钟后,在37℃、5%co2的条件下培养20~24小时。将50μl上清液回收到lumaplate(珀金埃尔默公司),在50℃大约干燥2小时后,用读板仪(topcount,珀金埃尔默公司)进行测定。试验重复实施三次,细胞溶解率通过以下公式计算。细胞溶解率(%)=(a-b)/(c-b)
×
100
[0950]
a:样品孔的计数。
[0951]
b:背景(未添加抗体的孔)计数的平均值(n=3)。在添加抗体时添加了50μl的检测用培养基。除此之外进行了与样品孔相同的操作。c:最大释放(用表面活性剂溶解靶细胞的孔)计数的平均值(n=3)。在添加抗体时添加了50μl的检测培养基。添加100μl表面活性剂,与样品孔同样地将50μl的量转移到lumaplate,实施了测定。如图7a所示,tafv-fc体显示出了细胞毒活性。使用分析软件(sigmaplot,12.0版)的四参数逻辑曲线(four parameter logistics curve)的算式计算ec
50
,将结果记载在表5。不适用(not applicable,na)表示相关系数r值未算出,无法进行曲线拟合。未确认到杂合体、双体的细胞毒活性。
[0952]
[表5]
[0953] 构型名称ec
50
(nm)1杂合nyg-3143na*2双体nyg-2143na*3tafv-fcnyf-00110.27
[0954]
*na=not applicable(不适用)
[0955]
11)-2scfv-fab-fc体、tafv-fc体、tafv(反向)-fc体抗hla-a2/ny-eso-抗cd3双特异性分子的体外活性评价
[0956]
11)-2-1靶细胞的制备
[0957]
通过与实施例8)-1相同的方法,制备u266b1细胞系,用作靶细胞。
[0958]
11)-2-2效应细胞的制备
[0959]
通过与实施例8)-2相同的方法,制备市售的冷冻人pbmc(cellular technology limited公司),用作效应细胞。
[0960]
11)-2-3细胞毒性检测
[0961]
以50μl/孔的量向96孔u底微板添加11)-2-1中获得的各靶细胞。以50μl/孔的量向其添加制备成各种浓度的实施例10中制备的各种构型抗hla-a2/ny-eso-抗cd3双特异性分子,以100μl/孔的量添加实施例11)-2-2中制备的效应细胞,在室温下以1000rpm离心1分钟
后,在37℃、5%co2的条件下培养20至24小时。将50μl上清液回收到lumaplate(珀金埃尔默公司),在50℃大约干燥2小时后,用读板仪(topcount,珀金埃尔默公司)进行测定。试验重复实施三次,细胞溶解率通过以下公式计算。细胞溶解率(%)=(a-b)/(c-b)
×
100
[0962]
a:样品孔的计数。
[0963]
b:背景(未添加抗体的孔)计数的平均值(n=3)。在添加抗体时添加了50μl的检测用培养基。除此之外进行了与样品孔相同的操作。c:最大释放(用表面活性剂溶解靶细胞的孔)计数的平均值(n=3)。在添加抗体时添加了50μl的检测培养基。添加100μl表面活性剂,与样品孔同样地将50μl的量转移到lumaplate,实施了测定。如图7b所示,tafv-fc体显示出了细胞毒活性。使用分析软件(sigmaplot,12.0版)的四参数逻辑曲线(four parameter logistics curve)的算式计算ec
50
,将结果记载在表6。不适用(not applicable,na)表示相关系数r值未算出,无法进行曲线拟合。与tafv-异二聚体fc体相比,scfv-fab-异二聚体fc体、tafv(反向)-异二聚体fc体为低活性。
[0964]
[表6]
[0965] 构型名称ec
50
(nm)1scfv-fab-异二聚体fcnyf-0003na*2tafv-异二聚体fcnyf-00100.133tafv(反向)-异二聚体fcnyf-00040.88
[0966]
*na=not applicable(不适用)
[0967]
(实施例12)向nyf-0061导入突变和改变了构型的各种fc添加型抗hla/ny-eso-抗cd3双特异性分子的制作
[0968]
12)-1向nyf-0061导入突变和改变了构型的各种fc添加型抗hla/ny-eso-抗cd3双特异性分子表达载体的制作
[0969]
为了提升物化性质,设计了nyf-0061的突变体,制作了构成各分子的以下载体。
[0970]
向包含编码nyf-0061的氨基酸序列的核苷酸序列的载体p_nyf-0061-hc2的c3e-7085序列导入突变,命名为“p_nyz-0038-hc2”。
[0971]
向包含编码nyf-0061的氨基酸序列的核苷酸序列的载体p_nyf-0061-hc2的nya-2061序列和c3e-7085序列导入突变,命名为“p_nyz-0082-hc2”和“p_nyz-0083-hc2”。
[0972]
对p_nyz-0038-hc2的核苷酸序列进行重新分析,确认到nyz-0038-hc2全长核苷酸序列是序列表的seq id no:152(图148)所示的核苷酸序列。
[0973]
对p_nyz-0082-hc2的核苷酸序列进行重新分析,确认到nyz-0082-hc2全长核苷酸序列是序列表的seq id no:153(图149)所示的核苷酸序列。
[0974]
对p_nyz-0083-hc2的核苷酸序列进行重新分析,确认到nyz-0083-hc2全长核苷酸序列是序列表的seq id no:154(图150)所示的核苷酸序列。
[0975]
另外,在上述核苷酸序列中,确认到该序列所编码的nyz-0038-hc2、nyz-0082-hc2、nyz-0083-hc2全长氨基酸序列。
[0976]
nyz-0038-hc2全长氨基酸序列是序列表的seq id no:155(图151)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第511位的氨基酸序列是nya-2061―c3e-7096tafv,第512位至第513位的氨基酸序列是接头,第514位至第745位的氨基酸序列是hc2。
[0977]
nyz-0082-hc2全长氨基酸序列是序列表的seq id no:156(图152)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第516位的氨基酸序列是nya-3061―c3e-7096tafv,第517位至第518位的氨基酸序列是接头,第519位至第750位的氨基酸序列是hc2。
[0978]
nyz-0083-hc2全长氨基酸序列是序列表的seq id no:157(图153)所示的氨基酸序列。该序列中,第1位至第19位的氨基酸序列是信号序列,第21位至第516位的氨基酸序列是nya-3061―c3e-7097tafv,第517位至第518位的氨基酸序列是接头,第519位至第750位的氨基酸序列是hc2。
[0979]
为了研究将nyf-0061的构型变为scfv-fab-异二聚体fc型,设计了构成各分子的以下载体。
[0980]
制作导入了编码多肽所包含的氨基酸序列的dna片段的哺乳动物细胞用表达载体,命名为“p_nyz-1010-hc2”,其中,该多肽是在nya-3061的羧基末端依次添加(i)c3e-7085的重链可变区、(ii)来自人igg的ch1区域,以及(iii)导入了降低效应器功能且形成异多聚体的突变的fc区域而形成的。另外,制作导入了编码多肽所包含的氨基酸序列的dna片段的哺乳动物细胞用表达载体,命名为“p_c3e-7085-lc”,其中,该多肽是在c3e-7085轻链可变区的羧基末端添加来自人igg的cl区域而形成的。
[0981]
对p_nyz-1010-hc2的核苷酸序列进行重新分析,确认到nyz-1010-hc2全长核苷酸序列是序列表的seq id no:158(图154)所示的核苷酸序列。
[0982]
对p_c3e-7085-lc的核苷酸序列进行重新分析,确认到c3e-7085-lc全长核苷酸序列是序列表的seq id no:159(图155)所示的核苷酸序列。
[0983]
另外,在上述核苷酸序列中,确认到该序列所编码的nyz-1010-hc2、c3e-7085-lc全长氨基酸序列。
[0984]
nyz-1010-hc2全长氨基酸序列是序列表的seq id no:160(图156)所示的氨基酸序列。第1位至第19位的氨基酸序列是信号序列,第21位至第271位的氨基酸序列是nya-3061,第272位至第276位的氨基酸序列是接头,第277位至第394位的氨基酸序列是c3e-7085-重链可变区。另外,第395位至第724位的氨基酸序列是恒定区。
[0985]
c3e-7085-lc全长氨基酸序列是序列表的seq id no:161(图157)所示的氨基酸序列。第1位至第20位的氨基酸序列是信号序列,第21位至第127位的氨基酸序列是可变区,第128位至第233位的氨基酸序列是恒定区。另外,氨基酸编号46至53是cdrl1(seq id no:144(图142)),氨基酸编号71至73是cdrl2(seq id no:145(图142)),氨基酸编号110至117是cdrl3(seq id no:146(图142))。
[0986]
12)-2向nyf-0061导入突变和改变了构型的各种fc添加型抗hla/ny-eso-抗cd3双特异性分子的表达和纯化
[0987]
通过与7)-2-1相同的方法,使用p_nyz-0038-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyz-0038)的培养上清液。使构成nyz-0038的各载体进行表达,将得到的氨基酸的序列示于序列表的seq id no:155(图151)和seq id no:84(图85)。
[0988]
使用p_nyz-0082-hc2、p_hc1,表达并制备了tafv-异二聚体fc型抗hla/ny-eso-抗cd3双特异性分子(nyz-0082)的培养上清液。使构成nyz-0082的各载体进行表达,将得到的
no:126(图127)、seq id no:127(图128)、seq id no:128(图129)、seq id no:129(图130))、gp100肽(seq id no:130(图131))(均来自sigma genosys公司),将使用live/dead可固定死细胞染色试剂盒(赛默飞世尔科技公司)染色的细胞分成2组,用含有5%fbs的pbs以105细胞/孔的量接种到96孔u底微板,离心后除去上清液。关于一组细胞,以25μl/孔的量添加用含有5%fbs的pbs稀释到100nm的实施例12中制备的各种fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子,在4℃静置30分钟。用含有5%fbs的pbs洗涤2次后,以25μl/孔的量添加用含有5%fbs的pbs稀释的pe标记的f(ab’)2片段抗人igg(jackson immuno research laboratories公司),在4℃静置30分钟。用含有5%fbs的pbs洗涤2次后,用mildform 10n(富士胶片和光纯药株式会社)固定过夜后,用含有5%fbs的pbs再次悬浮。为了以hla/肽复合物量进行标准化,关于另一组细胞,以25μl/孔的量添加用含有5%fbs的pbs稀释到10μg/ml的hla-a2抗体bb7.2-alexa fluor 488(biorad公司),或者小鼠igg2b-alexa fluor 488(biorad公司),在4℃静置30分钟。用含有5%fbs的pbs洗涤2次后,用mildform 10n(富士胶片和光纯药株式会社)固定过夜后,用含有5%fbs的pbs再次悬浮。用流式细胞仪(cantoii,becton dickinson公司)对这些细胞悬浮液进行检测。用flowjo(treestar公司)进行数据分析,测定cd3e敲除t2细胞的死细胞去除级分的pe或alexa fluor 488的几何平均荧光强度(gmfi)。以cd3e敲除t2细胞上的hla/肽复合物量标准化的表示各fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子的结合性的值标准化gmfi用以下公式计算。
[1000]
标准化gmfi=(a/b)
×
((c/d)/(e/f))
[1001]
·
a/b=相对gmfi
[1002]
a:添加了抗体的dmso或者添加了各肽的cd3e敲除t2细胞的pe gmfi
[1003]
b:未添加抗体的dmso或者添加了各肽的cd3e敲除t2细胞的pe gmfi
[1004]
·
(c/d)/(e/f)=dmso,或者添加了各肽的cd3e敲除t2细胞的hla/肽复合物量校正值
[1005]
c:添加了hla-a2抗体的dmso或者添加了各肽的cd3e敲除t2细胞的alexa488 gmfi
[1006]
d:添加了小鼠igg2b抗体的dmso或者添加了各肽的cd3e敲除t2细胞的alexa488 gmfi
[1007]
e:添加了添加hla-a2抗体的dmso的cd3e敲除t2细胞的alexa488 gmfi
[1008]
f:添加了添加小鼠igg2b抗体的dmso的cd3e敲除t2细胞的alexa488 gmfi
[1009]
如图158a所示,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038、0082、0083、1010与野生型ny-eso肽相比,针对在第1、4、5、7位氨基酸导入了点突变的添加了肽的cd3e敲除t2的结合性降低到了四分之一以下,因此表示强力识别到了ny-eso肽的第1、4、5、7位氨基酸。
[1010]
(实施例16)fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子的抗原结合特异性评价
[1011]
通过与实施例6)相同的方法,将显示出与4种本发明抗体所特别强力地识别的ny-eso肽:sllmwitqc(seq id no:1)序列中第1、4、5位的氨基酸序列一致的、图2a所示的9-mer肽选择为同源性肽,实施了结合特异性评价。将cd3e敲除t2细胞用含有20%fbs的aim-v培养基(赛默飞世尔科技公司)调整到适当浓度,添加将ny-eso肽(seq id no:1)、同源性肽
dolpp1、il20rb、prkd2、cd163、p2ry8(seq id no:131(图132)、seq id no:132(图133)、seq id no:133(图134)、seq id no:134(图135)、seq id no:135(图136))、gp100肽(seq id no:130(图131))(均来自sigma genosys公司)用dmso溶解至5mm的溶液,将该溶液的最终浓度变为50μm,或者添加1/100量的dmso,通过与实施例15相同的方法对各抗体的结合性进行评价。以cd3e敲除t2细胞上的hla/肽复合物量标准化的表示各fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子的结合性的值、标准化gmfi用以下公式计算。
[1012]
标准化gmfi=(a/b)
×
((c/d)/(e/f))
[1013]
a:添加了抗体的dmso或者添加了各肽的cd3e敲除t2细胞的pe gmfi
[1014]
b:未添加抗体的dmso或者添加了各肽的cd3e敲除t2细胞的pe gmfi
[1015]
·
(c/d)/(e/f)=dmso,或者添加了各肽的cd3e敲除t2细胞的hla/肽复合物量校正值
[1016]
c:添加了hla-a2抗体的dmso或者添加了各肽的cd3e敲除t2细胞的alexa488 gmfi
[1017]
d:添加了小鼠igg2b抗体的dmso或者添加了各肽的cd3e敲除t2细胞的alexa488 gmfi
[1018]
e:添加了添加hla-a2抗体的dmso的cd3e敲除t2细胞的alexa488 gmfi
[1019]
f:添加了添加小鼠igg2b抗体的dmso的cd3e敲除t2细胞的alexa488 gmfi
[1020]
如图158b所示,fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子nyz-0038、0082、0083、1010均未与任何添加了同源性肽的细胞结合,表示特异性极高。
[1021]
(实施例17)fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子的细胞毒活性评价
[1022]
17)-1靶细胞的制备
[1023]
通过与实施例8)-1相同的方法,制备表达内源性人ny-eso的细胞系(u266b1和nci-h1703),以及不表达内源性人ny-eso的细胞系(ags和cfpac-1)的悬浮液,用作靶细胞。
[1024]
17)-2效应细胞的制备
[1025]
通过与实施例8)-2相同的方法,制备市售的冷冻人pbmc(cellular technology limited公司)的悬浮液,用作效应细胞。
[1026]
17)-3细胞毒性检测
[1027]
以50μl/孔的量向96孔u底微板添加实施例17)-1中获得的各靶细胞。以50μl/孔的量向其添加制备成各种浓度的实施例12中制备的各种fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子,以100μl/孔的量添加实施例17)-2中制备的效应细胞,在室温下以1000rpm离心1分钟后,在37℃、5%co2的条件下培养20至24小时。将50μl上清液回收到lumaplate(珀金埃尔默公司),在50℃大约干燥2小时后,用读板仪(topcount,珀金埃尔默公司)进行测定。试验重复实施三次,细胞溶解率通过以下公式计算。细胞溶解率(%)=(a-b)/(c-b)
×
100
[1028]
a:样品孔的计数。
[1029]
b:背景(未添加抗体的孔)计数的平均值(n=3)。在添加抗体时添加了50μl的检测用培养基。除此之外进行了与样品孔相同的操作。
[1030]
c:最大释放(用表面活性剂溶解靶细胞的孔)计数的平均值(n=3)。在添加抗体时添加了50μl的检测培养基。添加100μl表面活性剂,与样品孔同样地将50μl的量转移到lumaplate,实施了测定。
[1031]
如图159a-d所示,对于表达内源性人ny-eso的细胞系(u266b1和nci-h1703),显示出了各种抗hla-a2/ny-eso-抗cd3双特异性分子的细胞毒活性。使用分析软件(sigmaplot,12.0版)的四参数逻辑曲线(four parameter logistics curve)的算式计算ec
50
,将u266b1细胞系中的结果记载在表8,将nci-h1703细胞系中的结果记载在表9。另一方面,如图159e-h所示,未确认到对于不表达内源性人ny-eso的细胞系(ags和cfpac-1)的细胞毒活性。
[1032]
[表8]
[1033] 名称ec
50
(nm)1nyz-00381.012nyz-00820.453nyz-00830.254nyz-10100.96
[1034]
[表9]
[1035][1036][1037]
(实施例18)fc添加型抗hla-a2/ny-eso-抗cd3双特异性分子在人pbmc转移模型中的体内活性评价
[1038]
用含有50%基质胶(corning公司)的pbs将人鳞状细胞肺癌细胞系nci-h1703(atcc)制备成6
×
107细胞/ml,向nog小鼠(雌性,6~7周龄)的皮下移植0.1ml(第0天)。在第4天用pbs将人pbmc制备成3.75
×
107~5x107细胞/ml,向尾静脉内移植0.2ml。从大约1周后(第6天~第7天)起,随着时间的经过,用电子数显卡尺测量肿瘤的长径(mm)和短径(mm),根据如下所示的算式计算出预估肿瘤体积。
[1039]
预估肿瘤体积(mm3)=各个体的预估肿瘤体积的平均值
[1040]
各个体的预估肿瘤体积=长径
×
短径2/2
[1041]
在第14天,根据肿瘤体积进行分组,使各组n=5,向尾静脉内施用各种抗hla-a2/ny-eso-抗cd3双特异性分子(nyz-1010为1mg/kg,为了以同摩尔量进行对比,nyz-1010为1.2mg/kg)。施用在第14天、第21天实施。在各种抗hla-a2/ny-eso-抗cd3双特异性分子施用组中确认到了抗肿瘤效果(图160a-d)。通过如下所示的算式计算出第28~29天的肿瘤生长抑制(%),记载在表10。
[1042]
肿瘤生长抑制(%)=100-(各组的预估肿瘤体积/空白对照的预估肿瘤体积
×
100)
[1043]
[表10]
[1044] 名称肿瘤生长抑制(%)1nyz-0038100.02nyz-0082100.03nyz-008399.8
4nyz-101099.9
[1045]
(实施例19)各种fc添加型抗hla/ny-eso-抗cd3双特异性分子的物理化学性质的对比
[1046]
19)-1酸处理评价
[1047]
使用amicon(millipore公司),对7)-2-1中制作的nyf-0016和各种nya-1143cdr接枝突变体(nyf-0044、nyf-0045、nyf-0047、nyf-0048、nyf-0060以及nyf-0061)进行离心浓缩,将缓冲液交换成25mm乙酸钠、5%山梨糖醇、ph值5.5后,将浓度制备成15mg/ml(nyf-0016为10mg/ml)。然后,将各样品用于100mm乙酸钠、ph值3.5或对照,使用xpress微透析器(scienova公司)透析到25mm乙酸钠、5%山梨糖醇、ph值5.5中后,回收样品,在室温静置1小时。接着,使用500mm tris-hcl、ph值9.0,将各样品的ph值恢复为5.0。使用acquity uplc beh200 sec 1.7μm4.6*150mm(waters公司),通过尺寸排阻色谱法(sec)对各样品进行分析。使用0.2m ki/200mm kcl/ph值7.0,以0.2ml/min的流量对流动相进行分析(检测波长为280nm)。对各样品中所含有的多聚体的含量(%)进行各峰分析,通过面积百分比法进行计算,将结果记载在图162。nyf-0016中,通过酸处理,多聚体增加到96%。另一方面,各种nya-1143cdr接枝突变体中,通过酸处理所形成的多聚体的量则有所下降,得到了改善。特别是nyf-0047、nyf-0048、nyf-0060和nyf-0061中,通过酸处理所形成的多聚体的量降低到1%以下,耐酸性得到了大幅改善。
[1048]
19)-2溶液稳定性评价
[1049]
使用7)-2-1中制作的nyf-0061,以及12)-2中制作的nyz-0038、nyz-0082、nyz-0083、nyz-1010,通过amicon ultra-4(millipore公司)进行离心浓缩,将缓冲液交换成25mm组氨酸、5%山梨糖醇、ph值6.0后,添加25mm组氨酸、5%山梨糖醇、ph值6.0,将样品浓度制备为25mg/ml,作为评价用样品。另外,使用advancebio sec 300a 2.7μm 4.6
×
300mm(agilent公司),通过尺寸排阻色谱法,利用面积百分比法,计算各评价用样品起始时的高分子量物质(high molecular weights speices,hmws)。使用0.2m ki/200mm kcl/ph值7.0,以0.2ml/min的流量对流动相进行分析(检测波长为280nm)。关于各样品的溶液稳定性试验,在25℃保存6天(nyf-0061保存7天)后,在与上述相同的条件下实施尺寸排阻色谱法,通过面积百分比法计算各样品的hmws(%),将结果记载在表11。nyf-0061的随保存时间的经过而变化的hmws(%)大约增加到了10.6%。另一方面,nyz-0038、nyz-0082、nyz-0083和nyz-1010的随保存时间的经过而变化的hmws(%)则只大约增加了2%以下。因此,与nyf-0061相比,nyz-0038、nyz-0082、nyz-0083和nyz-1010的溶液稳定性优异。
[1050]
[表11]
[1051]
克隆名称hmws(%)nyf-006110.6nyz-00382.1nyz-00821.7nyz-00831.9nyz-10100.8
[1052]
(实施例20)制作抗hla/ny-eso的scfv
[1053]
20)-1抗hla/ny-eso的scfv表达载体的构建
[1054]
设计对hla-a2/ny-eso-1具有高结合能力的抗体mab24955n、mab24956n、mab28075p、mab28105p、mab28113p和mab29822p2(wo2021/003357)的scfv,将mab24955n的scfv命名为nyc-0005,mab24956n的scfv命名为nyc-0006,mab28075p的scfv命名为nyc-0007,mab28105p的scfv命名为nyc-0008,mab28113p的scfv命名为nyc-0009,mab29822p2的scfv命名为nyc-0010。
[1055]
设计以pcdna3.4(赛默飞世尔科技公司)为骨架的各种nyc-0005、nyc-0006、nyc-0007、nyc-0008、nyc-0009和nyc-0010的哺乳动物细胞用scfv表达用载体。另外,为了统一载体骨架和构型以对比哺乳动物细胞中的表达量,设计了nya-2047、nya-2061,nya-3061的哺乳动物细胞用scfv表达用载体。
[1056]
对构建的scfv表达载体的核苷酸序列进行重新分析,确认到nya-2047、nya-2061、nya-3061、nyc-0005、nyc-0006、nyc-0007、nyc-0008、nyc-0009和nyc-0010全长核苷酸序列分别是序列表的seq id no:43(图50)、seq id no:46(图53)、seq id no:163(图164)、seq id no:165(图166)、seq id no:167(图168)、seq id no:169(图170)、seq id no:171(图172)、seq id no:173(图174)和seq id no:175(图176)所示的核苷酸序列。另外,上述核苷酸序列中,该序列所编码的nya-2047全长氨基酸序列是seq id no:50(图57)所示的氨基酸序列,nya-2061全长氨基酸序列是seq id no:53(图60)所示的氨基酸序列,nya-3061全长氨基酸序列是seq id no:164(图165)所示的氨基酸序列,nyc-0005全长氨基酸序列是seq id no:166(图167)所示的氨基酸序列,nyc-0006全长氨基酸序列是seq id no:168(图169)所示的氨基酸序列,nyc-0007全长氨基酸序列是seq id no:170(图171)所示的氨基酸序列,nyc-0008全长氨基酸序列是seq id no:172(图173)所示的氨基酸序列,nyc-0009全长氨基酸序列是seq id no:174(图175)所示的氨基酸序列,nyc-0010全长氨基酸序列是seq id no:176(图177)所示的氨基酸序列。
[1057]
20)-2表达和纯化抗hla/ny-eso的scfv
[1058]
expi293f细胞(赛默飞世尔科技公司)的培养和基因导入采用与1)-5-2记载的方法相同的方法实施。为了评价产量,导入基因后,在37℃、8%co2培养箱中以135rpm振荡培养4天,用0.2μm滤膜(赛默飞世尔科技公司)对得到的培养上清液进行过滤,得到抗hla/ny-eso scfv的培养上清液。使用ni sepharose excel(cytiva公司)实施纯化,将洗脱液用于分析用尺寸排阻色谱法(sec),确定浓度。将产量示于表12。通过ni sepharose excel将nya-2047、nya-2061、nya-3061纯化后,关于洗脱液中的换算为每1l培养上清液的产量,与nyc-0005、nyc-0006、nyc-0007、nyc-0008、nyc-0009和nyc-0010相比,均有所增多。
[1059]
[表12]
[1060][1061]
将各scfv的ni sepharose excel洗脱液浓缩,通过用25mm组氨酸、300mm nacl、5%山梨糖醇、ph值5.5平衡的凝胶过滤柱(superdex 200 increase,cytiva)进行纯化。纯化蛋白样品用于分析用尺寸排阻色谱法(sec),确定纯度和浓度后,用于各种评价。
[1062]
(实施例21)抗hla/ny-eso的scfv-异二聚体fc的表达和纯化
[1063]
21)-1抗hla/ny-eso的scfv-异二聚体fc表达载体的构建
[1064]
为了对比不同构型中的产率,构建了将抗hla/ny-eso的scfv的构型转换为fc融合体的表达载体。异二聚体fc序列(以下记作hc-h和hc-k)使用了文献(nat biotechnol.1998jul;16(7)677-81.)所报告的序列。
[1065]
设计对hla-a2/ny-eso-1具有高结合能力的抗体mab24955n、mab24956n、mab28075p、mab28105p、mab28113p和mab29822p2(wo2021/003357)的scfv-异二聚体fc,将mab24955n的scfv-异二聚体fc命名为nyc-0011,mab24956n的scfv-异二聚体fc命名为nyc-0012,mab28075p的scfv-异二聚体fc命名为nyc-0013,mab28105p的scfv-异二聚体fc命名为nyc-0014,mab28113p的scfv-异二聚体fc命名为nyc-0015,mab29822p2的scfv-异二聚体fc命名为nyc-0016。另外,将nya-2047的scfv-异二聚体fc命名为nyd-2047,nya-2061的scfv-异二聚体fc命名为nyd-2061,nya-3061的scfv-异二聚体fc命名为nyd-3061。
[1066]
设计以pcdna3.3或pcdna3.4(赛默飞世尔科技公司)为骨架的各种hc-h、nyc-0011-hc-k、nyc-0012-hc-k、nyc-0013-hc-k、nyc-0014-hc-k、nyc-0015-hc-k和nyc-0016-hc-k的哺乳动物细胞用表达载体。另外,为了统一载体骨架和构型以对比哺乳动物细胞中的表达量,设计了nyd-2047-hc-k、nyd-2061-hc-k、nyd-3061-hc-k的哺乳动物细胞用表达载体。
[1067]
对构建的scfv-异二聚体fc表达载体的核苷酸序列进行重新分析,确认到hc-h、nyd-2047-hc-k、nyd―2061-hc-k、nyd-3061-hc-k、nyc-0011-hc-k、nyc-0012-hc-k、nyc-0013-hc-k、nyc-0014-hc-k、nyc-0015-hc-k和nyc-0016-hc-k全长核苷酸序列分别是序列表的seq id no:177(图178)、seq id no:179(图180)、seq id no:181(图182)、seq id no:183(图184)、seq id no:185(图186)、seq id no:187(图188)、seq id no:189(图190)、seq id no:191(图192)、seq id no:193(图194)和seq id no:195(图196)所示的核苷酸序列。另外,上述核苷酸序列中,该序列所编码的hc-h全长氨基酸序列是seq id no:178(图179)所示的氨基酸序列,nyd-2047-hc-k全长氨基酸序列是seq id no:180(图181)所示的氨基
酸序列,nyd-2061-hc-k全长氨基酸序列是seq id no:182(图183)所示的氨基酸序列,nyd-3061-hc-k全长氨基酸序列是seq id no:184(图185)所示的氨基酸序列,nyc-0011-hc-k全长氨基酸序列是seq id no:186(图187)所示的氨基酸序列,nyc-0012-hc-k全长氨基酸序列是seq id no:188(图189)所示的氨基酸序列,nyc-0013-hc-k全长氨基酸序列是seq id no:190(图191)所示的氨基酸序列,nyc-0014-hc-k全长氨基酸序列是seq id no:192(图193)所示的氨基酸序列,nyc-0015-hc-k全长氨基酸序列是seq id no:194(图195)所示的氨基酸序列,nyc-0016-hc-k全长氨基酸序列是seq id no:196(图197)所示的氨基酸序列。
[1068]
21)-2抗hla/ny-eso的scfv-异二聚体fc的表达和纯化
[1069]
expi293f细胞(赛默飞世尔科技公司)的培养和基因导入采用与1)-5-2记载的方法相同的方法实施。将制作各克隆所使用的质粒的组合示于以下的表13。
[1070]
[表13]
[1071]
克隆名称hc-khc-hnyd-2047nyd-2047-hc-khc-hnyd-2061nyd-2061-hc-khc-hnyd-3061nyd-3061-hc-khc-hnyc-0011nyc-0011-hc-khc-hnyc-0012nyc-0012-hc-khc-hnyc-0013nyc-0013-hc-khc-hnyc-0014nyc-0014-hc-khc-hnyc-0015nyc-0015-hc-khc-hnyc-0016nyc-0016-hc-khc-h
[1072]
为了评价产量,导入基因后,在37℃、8%co2培养箱中以135rpm振荡培养4天,用0.2μm滤膜(赛默飞世尔科技公司)对得到的培养上清液进行过滤,得到抗hla/ny-eso scfv-异二聚体fc的培养上清液。纯化通过以下方式进行:在用ph值7.4的pbs平衡的mabselectsure树脂(cytiva公司)中将培养上清液上样,吸附目的抗hla/ny-eso的scfv-异二聚体fc。用pbs去除非吸附成分后,用乙酸缓冲液洗脱,用tris缓冲液将洗脱液的ph值制备成中性后,将洗脱液用于分析用尺寸排阻色谱法(sec),确定纯度和浓度。将换算为每1l培养上清液的产量示于表14。通过mabselectsure树脂将nyd-2047、nyd-2061、nyd-3061纯化后,关于洗脱液中的换算为每1l培养上清液的产量,与nyc-0011、nyc-0012、nyc-0013、nyc-0014、nyc-0015和nyc-0016相比,均有所增多。
[1073]
[表14]
[1074]
克隆名称每1l的产量(mg)nyd-204793.3nyd-2061112.2nyd-3061127.5nyc-001117.2nyc-00124.2nyc-001354.1nyc-00141.8
nyc-001512.2nyc-001616.6
[1075]
将各scfv-异二聚体fc的mabselectsure树脂洗脱液浓缩,通过用25mm组氨酸、300mm nacl、5%山梨糖醇、ph值5.5平衡的凝胶过滤柱(superdex 200increase,cytiva)进行纯化。纯化蛋白样品用于分析用尺寸排阻色谱法(sec),将纯度和量得到了保证的nyd-2047、nyd-2061、nyd-3061、nyc-0011、nyc-0013和nyc-0015用作溶液稳定性评价用样品。需要说明的是,nyc-0016由于在sec中预测的洗脱时间内无法检测到目的物,因此判断在培养上清液中未表达目的物。
[1076]
(实施例22)抗hla/ny-eso的scfv-异二聚体fc的溶液稳定性评价
[1077]
使用实施例21中制备的nyd-2047、nyd-2061、nyd-3061、nyc-0011、nyc-0013和nyc-0015,通过amicon ultra-4(millipore公司)进行离心浓缩,将缓冲液交换成pbs后,添加pbs,将样品浓度调整为5mg/ml,作为评价用样品。另外,使用advancebio sec 300a 2.7μm 4.6
×
150mm(agilent公司),通过尺寸排阻色谱法,利用面积百分比法,计算各评价用样品起始时的hmws(%)。使用0.2m ki/200mm kcl/ph值7.0,以0.2ml/min的流量对流动相进行分析(检测波长为280nm)。关于各样品的加速劣化试验,在40℃保存1天、7天后,在与上述相同的条件下实施尺寸排阻色谱法,通过面积百分比法计算各样品的hmws(%)。将表示各样品在40℃保存时的随时间变化的结果示于图163。
[1078]
nyd-2047、nyd-2061、nyd-3061的随保存时间的经过而变化的hmws(%)大约增加到了8.7%、8.1%、4.4%。另一方面,nyc-0011、nyc-0013和nyc-0015的随保存时间的经过而变化的hmws(%)分别明显增加了71.8%、42.4%、97.3%。
[1079]
由以上结果可知,与nyc-0011、nyc-0013和nyc-0015相比,nyd-2047、nyd-2061和nyd-3061的溶液稳定性优异。另外,nyd-3061在评价样品中hmws(%)最低,溶液稳定性最优异。
[1080]
(实施例23)用biacore评价与hla/ny-eso的结合能力
[1081]
使用相当于构成nyc-0011、nyc-0013和nyc-0015的抗hla/ny-eso的scfv的nyc-0005、nyc-0007、nyc-0008,评价了对hla/ny-eso的结合能力。
[1082]
使用biacore t200,将上述抗hla/ny-eso scfv作为配体捕获(捕捉)到固定化的抗his抗体,将抗原作为分析物进行测定。抗原使用在1)-1中制备的hla/ny-eso。按照试剂盒说明书,将抗his抗体(his捕获试剂盒,cytiva公司)固定化到传感芯片cm5(cytiva公司)。将用hbs-ep (cytiva公司)稀释到0.5μg/ml的评价的各抗hla/ny-eso scfv以10μl/min接触60秒并固定化。然后,将用hbs-ep 稀释的多种浓度的hla/ny-eso作为分析物,以30μl/min的流量添加各样品120秒,通过间隔600秒测定的单循环动力学分析计算出kd,将结果记载于表15。在用作阳性对照的nya-2047对hla/ny-eso的结合能力稳定确认的条件下,确认了nyc-0005、nyc-0007、nyc-0008与hla/ny-eso进行了结合。
[1083]
[表15]
[1084]
克隆名称kdnyc-00059.3nmnyc-00071.0μmnyc-00087.9nm
[1085]
【工业实用性】
[1086]
本发明的双特异性抗体能够用作癌症等的治疗剂或预防剂。
[1087]
本说明书所引用的全部出版物、专利以及专利申请通过直接引用而并入本说明书。
[1088]
序列表自由文本
[1089]
seq id no:1:ny-eso中的肽的氨基酸序列(图8)
[1090]
seq id no:2:magec-1中的肽的氨基酸序列(图9)
[1091]
seq id no:3:用于进行scfv序列分析的引物1(图10)
[1092]
seq id no:4:用于进行scfv序列分析的引物2(图11)
[1093]
seq id no:5:nya-0001的重链可变区的核苷酸序列(图12)
[1094]
seq id no:6:nya-0001的重链可变区的氨基酸序列(图13)
[1095]
seq id no:7:nya-0001的轻链可变区的核苷酸序列(图14)
[1096]
seq id no:8:nya-0001的轻链可变区的氨基酸序列(图15)
[1097]
seq id no:9:nya-0060的重链可变区的核苷酸序列(图16)
[1098]
seq id no:10:nya-0060的重链可变区的氨基酸序列(图17)
[1099]
seq id no:11:nya-0060的轻链可变区的核苷酸序列(图18)
[1100]
seq id no:12:nya-0060的轻链可变区的氨基酸序列(图19)
[1101]
seq id no:13:nya-0068的重链可变区的核苷酸序列(图20)
[1102]
seq id no:14:nya-0068的重链可变区的氨基酸序列(图21)
[1103]
seq id no:15:nya-0068的轻链可变区的核苷酸序列(图22)
[1104]
seq id no:16:nya-0068的轻链可变区的氨基酸序列(图23)
[1105]
seq id no:17:nya-0082的重链可变区的核苷酸序列(图24)
[1106]
seq id no:18:nya-0082的重链可变区的氨基酸序列(图25)
[1107]
seq id no:19:nya-0082的轻链可变区的核苷酸序列(图26)
[1108]
seq id no:20:nya-0082的轻链可变区的氨基酸序列(图27)
[1109]
seq id no:21:nya-1163标签添加物的核苷酸序列(图28)
[1110]
seq id no:22:nya-2023标签添加物的核苷酸序列(图29)
[1111]
seq id no:23:nya-2027标签添加物的核苷酸序列(图30)
[1112]
seq id no:24:nya-1143标签添加物的核苷酸序列(图31)
[1113]
seq id no:25:nya-2143标签添加物的核苷酸序列(图32)
[1114]
seq id no:26:nya-1163标签添加物的氨基酸序列(图33),nya-1163为氨基酸编号21~266
[1115]
seq id no:27:nya-2023标签添加物的氨基酸序列(图34),nya-2023为氨基酸编号21~266
[1116]
seq id no:28:nya-2027标签添加物的氨基酸序列(图35),nya-2027为氨基酸编号21~266
[1117]
seq id no:29:nya-1143标签添加物的氨基酸序列(图36),nya-1143为氨基酸编号21~266
[1118]
seq id no:30:nya-2143标签添加物的氨基酸序列(图37),nya-2143为氨基酸编
号21~266
[1119]
seq id no:31:nya-1154标签添加物的核苷酸序列(图38)
[1120]
seq id no:32:nya-1154标签添加物的氨基酸序列(图39),nya-1154为氨基酸编号21~266
[1121]
seq id no:33:hla-a*0201(genbank:asa47534.1)的截短物的氨基酸序列(图40)
[1122]
seq id no:34:β2-微球蛋白的氨基酸序列(图41)
[1123]
seq id no:35:nya-2035标签添加物的核苷酸序列(图42)
[1124]
seq id no:36:nya-2035标签添加物的氨基酸序列(图43),nya-2035为氨基酸编号21~266
[1125]
seq id no:37:nya-1143-vh01的氨基酸序列(图44)
[1126]
seq id no:38:nya-1143-vh02的氨基酸序列(图45)
[1127]
seq id no:39:nya-1143-vh03的氨基酸序列(图46)
[1128]
seq id no:40:nya-1143-vl01的氨基酸序列(图47)
[1129]
seq id no:41:nya-2044标签添加物的核苷酸序列(图48)
[1130]
seq id no:42:nya-2045标签添加物的核苷酸序列(图49)
[1131]
seq id no:43:nya-2047标签添加物的核苷酸序列(图50)
[1132]
seq id no:44:nya-2048标签添加物的核苷酸序列(图51)
[1133]
seq id no:45:nya-2060标签添加物的核苷酸序列(图52)
[1134]
seq id no:46:nya-2061标签添加物的核苷酸序列(图53)
[1135]
seq id no:47:nya-2044标签添加物的氨基酸序列(图54),nya-2044为氨基酸编号21~266
[1136]
seq id no:48:nya-2045标签添加物的氨基酸序列(图55),nya-2045为氨基酸编号21~266
[1137]
seq id no:49:nya-0082的氨基酸序列(图56)
[1138]
seq id no:50:nya-2047标签添加物的氨基酸序列(图57),nya-2047为氨基酸编号21~266
[1139]
seq id no:51:nya-2048标签添加物的氨基酸序列(图58),nya-2048为氨基酸编号21~266
[1140]
seq id no:52:nya-2060标签添加物的氨基酸序列(图59),nya-2060为氨基酸编号21~266
[1141]
seq id no:53:nya-2061标签添加物的氨基酸序列(图60),nya-2061为氨基酸编号21~266
[1142]
seq id no:54:nya-0001重链cdrh1(图61)
[1143]
seq id no:55:nya-0001重链cdrh2(图61)
[1144]
seq id no:56:nya-0001重链cdrh3(图61)
[1145]
seq id no:57:nya-0001轻链cdrl1(图61)
[1146]
seq id no:58:nya-0001轻链cdrl2(图61)
[1147]
seq id no:59:nya-0001轻链cdrl3(图61)
[1148]
seq id no:60:nya-2023的cdrl1的氨基酸序列(图62)
[1149]
seq id no:61:nya-2027的cdrl3的氨基酸序列(图63)
[1150]
seq id no:62:nya-1154重链cdrh3(图64)
[1151]
seq id no:63:nya-1154轻链cdrl3(图64)
[1152]
seq id no:64:nya-0035的cdrl1的氨基酸序列(图65)
[1153]
seq id no:65:nyc-0003标签添加物的核苷酸序列(图66)
[1154]
seq id no:66:nyc-0004标签添加物的核苷酸序列(图67)
[1155]
seq id no:67:nyc-0003标签添加物的氨基酸序列(图68),nyc-0003为氨基酸编号21~263
[1156]
seq id no:68:nyc-0004标签添加物的氨基酸序列(图69),nyc-0004为氨基酸编号21~263
[1157]
seq id no:69:nya-0001标签添加物的核苷酸序列(图70)
[1158]
seq id no:70:nya-0001标签添加物的氨基酸序列(图71),nya-0001为氨基酸编号21~266
[1159]
seq id no:71:hc1的核苷酸序列(图72)
[1160]
seq id no:72:nyf-0016-hc2的核苷酸序列(图73)
[1161]
seq id no:73:nyf-0019-hc2的核苷酸序列(图74)
[1162]
seq id no:74:nyf-0022-hc2的核苷酸序列(图75)
[1163]
seq id no:75:nyf-0023-hc2的核苷酸序列(图76)
[1164]
seq id no:76:nyf-0027-hc2的核苷酸序列(图77)
[1165]
seq id no:77:nyf-0035-hc2的核苷酸序列(图78)
[1166]
seq id no:78:nyf-0044-hc2的核苷酸序列(图79)
[1167]
seq id no:79:nyf-0045-hc2的核苷酸序列(图80)
[1168]
seq id no:80:nyf-0047-hc2的核苷酸序列(图81)
[1169]
seq id no:81:nyf-0048-hc2的核苷酸序列(图82)
[1170]
seq id no:82:nyf-0060-hc2的核苷酸序列(图83)
[1171]
seq id no:83:nyf-0061-hc2的核苷酸序列(图84)
[1172]
seq id no:84:hc1的氨基酸序列(图85)
[1173]
seq id no:85:nyf-0016-hc2的氨基酸序列(图86),nya-1143为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1174]
seq id no:86:nyf-0019-hc2的氨基酸序列(图87),nya-2143为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1175]
seq id no:87:nyf-0022-hc2的氨基酸序列(图88),nya-1163为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1176]
seq id no:88:nyf-0023-hc2的氨基酸序列(图89),nya-2023为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1177]
seq id no:89:nyf-0027-hc2的氨基酸序列(图90),nya-2027为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1178]
seq id no:90:nyf-0035-hc2的氨基酸序列(图91),nya-2035为氨基酸编号21~
266,c3e-7085为氨基酸编号272~511
[1179]
seq id no:91:nyf-0044-hc2的氨基酸序列(图92),nya-2044为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1180]
seq id no:92:nyf-0045-hc2的氨基酸序列(图93),nya-2045为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1181]
seq id no:93:nyf-0047-hc2的氨基酸序列(图94),nya-2047为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1182]
seq id no:94:nyf-0048-hc2的氨基酸序列(图95),nya-2048为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1183]
seq id no:95:nyf-0060-hc2的氨基酸序列(图96),nya-2060为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1184]
seq id no:96:nyf-0061-hc2的氨基酸序列(图97),nya-2061为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1185]
seq id no:97:nya-0001-fab-hc1-k delete的核苷酸序列(图98)
[1186]
seq id no:98:nya-0001-lc的核苷酸序列(图99)
[1187]
seq id no:99:nya-0001-fab-hc1-k delete的氨基酸序列(图100),nya-0001的重链可变区为氨基酸编号20~139
[1188]
seq id no:100:nya-0001-lc的氨基酸序列(图101),nya-0001的轻链可变区为氨基酸编号21~131
[1189]
seq id no:101:nya-1143-fab-hc1-k delete的核苷酸序列(图102)
[1190]
seq id no:102:nya-1143-lc的核苷酸序列(图103)
[1191]
seq id no:103:c3e-7085-hc2-k deletec的核苷酸序列(图104)
[1192]
seq id no:104:nya-1143-fab-hc1-k delete的氨基酸序列(图105),nya-1143的重链可变区为氨基酸编号20~139
[1193]
seq id no:105:nya-1143-lc的氨基酸序列(图106),nya-1143的轻链可变区为氨基酸编号21~131
[1194]
seq id no:106:c3e-7085-hc2-k delete的氨基酸序列(图107),c3e-7085为氨基酸编号21~260
[1195]
seq id no:107:nya-1143-hc1-k delete的核苷酸序列(图108)
[1196]
seq id no:108:nya-1143-hc1-k delete的氨基酸序列(图109),nya-1143为氨基酸编号21~266
[1197]
seq id no:109:c3e-7085-nya-1154-fab-hc2-k delete的核苷酸序列(图110)
[1198]
seq id no:110:nya-1154-lc的核苷酸序列(图111)
[1199]
seq id no:111:oaa-hc1-k delete的核苷酸序列(图112)
[1200]
seq id no:112:c3e-7085-nya-1154-fab-hc2-k delete的氨基酸序列(图113),c3e-7085为氨基酸编号21~260,nya-1154的重链可变区为氨基酸编号266~285
[1201]
seq id no:113:nya-1154-lc的氨基酸序列(图114),nya-1154的轻链可变区为氨基酸编号21~131
[1202]
seq id no:114:oaa-hc1-k delete的氨基酸序列(图115)
[1203]
seq id no:115:nyf-0010-hc2-k delete的核苷酸序列(图116)
[1204]
seq id no:116:nyf-0004-hc2-k delete的核苷酸序列(图117)
[1205]
seq id no:117:nyf-0011-hc2-k delete的核苷酸序列(图118)
[1206]
seq id no:118:nyf-0010-hc2-k delete的氨基酸序列(图119),nya-1154为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1207]
seq id no:119:nyf-0004-hc2-k delete的氨基酸序列(图120),c3e-7085为氨基酸编号21~260,nya-1154为氨基酸编号272~511
[1208]
seq id no:120:nyf-0011-hc2-k delete的氨基酸序列(图121),nya-1143为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1209]
seq id no:121:点突变ny-eso肽1f的氨基酸序列(图122)
[1210]
seq id no:122:点突变ny-eso肽2m的氨基酸序列(图123)
[1211]
seq id no:123:点突变ny-eso肽3a的氨基酸序列(图124)
[1212]
seq id no:124:点突变ny-eso肽4a的氨基酸序列(图125)
[1213]
seq id no:125:点突变ny-eso肽5a的氨基酸序列(图126)
[1214]
seq id no:126:点突变ny-eso肽6l的氨基酸序列(图127)
[1215]
seq id no:127:点突变ny-eso肽7f的氨基酸序列(图128)
[1216]
seq id no:128:点突变ny-eso肽8a的氨基酸序列(图129)
[1217]
seq id no:129:点突变ny-eso肽9a的氨基酸序列(图130)
[1218]
seq id no:130:gp100肽的氨基酸序列(图131)
[1219]
seq id no:131:同源性肽dolpp1的氨基酸序列(图132)
[1220]
seq id no:132:同源性肽il20rb的氨基酸序列(图133)
[1221]
seq id no:133:同源性肽prkd2的氨基酸序列(图134)
[1222]
seq id no:134:同源性肽cd163的氨基酸序列(图135)
[1223]
seq id no:135:同源性肽p2ry8的氨基酸序列(图136)
[1224]
seq id no:136:c3e-7034的氨基酸序列(图137)
[1225]
seq id no:137:c3e-7036的氨基酸序列(图138)
[1226]
seq id no:138:c3e-7085的氨基酸序列(图139)
[1227]
seq id no:139:c3e-7088的氨基酸序列(图140)
[1228]
seq id no:140:c3e-7093的氨基酸序列(图141)
[1229]
seq id no:141:c3e-7085重链cdrh1(图142)
[1230]
seq id no:142:c3e-7085重链cdrh2(图142)
[1231]
seq id no:143:c3e-7085重链cdrh3(图142)
[1232]
seq id no:144:c3e-7085轻链cdrl1(图142)
[1233]
seq id no:145:c3e-7085轻链cdrl2(图142)
[1234]
seq id no:146:c3e-7085轻链cdrl3(图142)
[1235]
seq id no:147:c3e-7078的氨基酸序列(图143)
[1236]
seq id no:148:nyf-0014-hc2的核苷酸序列(图144)
[1237]
seq id no:149:nyf-0014-hc2的氨基酸序列(图145),nya-0001为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1238]
seq id no:150:nyf-0082-hc2的氨基酸序列(图146),nya-0082为氨基酸编号21~266,c3e-7085为氨基酸编号272~511
[1239]
seq id no:151:人cd3ε的氨基酸序列(图147)
[1240]
seq id no:152:nyz-0038-hc2全长核苷酸序列(图148)
[1241]
seq id no:153:nyz-0082-hc2全长核苷酸序列(图149)
[1242]
seq id no:154:nyz-0083-hc2全长核苷酸序列(图150)
[1243]
seq id no:155:nyz-0038-hc2全长氨基酸序列(图151)
[1244]
seq id no:156:nyz-0082-hc2全长氨基酸序列(图152)
[1245]
seq id no:157:nyz-0083-hc2全长氨基酸序列(图153)
[1246]
seq id no:158:nyz-1010-hc2全长核苷酸序列(图154)
[1247]
seq id no:159:c3e-7085-lc全长核苷酸序列(图155)
[1248]
seq id no:160:nyz-1010-hc2全长氨基酸序列(图156)
[1249]
seq id no:161:c3e-7085-lc全长氨基酸序列(图157)
[1250]
seq id no:162:肽接头的氨基酸序列(图161)
[1251]
seq id no:163:nya-3061全长核苷酸序列(图164)
[1252]
seq id no:164:nya-3061全长氨基酸序列(图165)
[1253]
seq id no:165:nyc-0005全长核苷酸序列(图166)
[1254]
seq id no:166:nyc-0005全长氨基酸序列(图167)
[1255]
seq id no:167:nyc-0006全长核苷酸序列(图168)
[1256]
seq id no:168:nyc-0006全长氨基酸序列(图169)
[1257]
seq id no:169:nyc-0007全长核苷酸序列(图170)
[1258]
seq id no:170:nyc-0007全长氨基酸序列(图171)
[1259]
seq id no:171:nyc-0008全长核苷酸序列(图172)
[1260]
seq id no:172:nyc-0008全长氨基酸序列(图173)
[1261]
seq id no:173:nyc-0009全长核苷酸序列(图174)
[1262]
seq id no:174:nyc-0009全长氨基酸序列(图175)
[1263]
seq id no:175:nyc-0010全长核苷酸序列(图176)
[1264]
seq id no:176:nyc-0010全长氨基酸序列(图177)
[1265]
seq id no:177:hc-h全长核苷酸序列(图178)
[1266]
seq id no:178:hc-h全长氨基酸序列(图179)
[1267]
seq id no:179:nyd-2047-hc-k全长核苷酸序列(图180)
[1268]
seq id no:180:nyd-2047-hc-k全长氨基酸序列(图181)
[1269]
seq id no:181:nyd-2061-hc-k全长核苷酸序列(图182)
[1270]
seq id no:182:nyd-2061-hc-k全长氨基酸序列(图183)
[1271]
seq id no:183:nyd-3061-hc-k全长核苷酸序列(图184)
[1272]
seq id no:184:nyd-3061-hc-k全长氨基酸序列(图185)
[1273]
seq id no:185:nyc-0011-hc-k全长核苷酸序列(图186)
[1274]
seq id no:186:nyc-0011-hc-k全长氨基酸序列(图187)
[1275]
seq id no:187:nyc-0012-hc-k全长核苷酸序列(图188)
[1276]
seq id no:188:nyc-0012-hc-k全长氨基酸序列(图189)
[1277]
seq id no:189:nyc-0013-hc-k全长核苷酸序列(图190)
[1278]
seq id no:190:nyc-0013-hc-k全长氨基酸序列(图191)
[1279]
seq id no:191:nyc-0014-hc-k全长核苷酸序列(图192)
[1280]
seq id no:192:nyc-0014-hc-k全长氨基酸序列(图193)
[1281]
seq id no:193:nyc-0015-hc-k全长核苷酸序列(图194)
[1282]
seq id no:194:nyc-0015-hc-k全长氨基酸序列(图195)
[1283]
seq id no:195:nyc-0016-hc-k全长核苷酸序列(图196)
[1284]
seq id no:196:nyc-0016-hc-k全长氨基酸序列(图197)
[1285]
seq id no:197:nyz-1007-hc全长氨基酸序列(图198)
[1286]
seq id no:198:nyz-1017-hc全长氨基酸序列(图199)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。