sipsy1蛋白质及其相关生物材料在调控谷子类胡萝卜素合成中的应用
技术领域
1.本发明属于生物技术领域,具体涉及sipsy1蛋白质及其相关生物材料在调控谷子类胡萝卜素合成中的应用。
背景技术:
2.类胡萝卜素是人体不可或缺的营养元素,具有清除体内自由基、延缓机体衰老、增强免疫力、抗癌等作用;在高等植物中类胡萝卜素将摄取的光能传送给叶绿素a,辅助进行光合作用,同时类胡萝卜素的积累可使高等植物表现出丰富的颜色;类胡萝卜素也是脱落酸、独角金内酯等植物激素的重要前体,与植物生长密切相关,因此利用生物强化手段增强作物中的类胡萝卜素含量具有重要意义。
3.目前己发现的天然类胡萝卜素已有700多种,依据其化学结构的元素组成及理化性质可分为胡萝卜素(由碳、氢两种元素构成的胡萝卜素具体包括α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素和番茄红素等)和叶黄素(由碳、氢、氧三大元素构成,可形成环氧基、羟基、酮基、羧基、甲氧基等多种含氧官能团,如叶黄素、玉米黄质、紫黄质和虾青素等)两类。
4.谷子起源于中国,脱壳后为小米,其抗旱、耐逆、适应性广、营养丰富、风味独特等特点使其成为我国最大的杂粮作物。小米品质是影响我国谷子产业发展的重要因素。小米颜色即黄色素含量是重要的外观指标,同时也是重要的营养指标,小米的黄色素主要是叶黄素、玉米黄质、隐黄素等类胡萝卜素。
5.类胡萝卜素的合成代谢受外因、内因等多种因素的影响,其中光照、温度等环境因素对类胡萝卜素的影响显著;从自身原因来说,参与类胡萝卜素合成代谢的相关基因的表达、蛋白质的丰度及活性调控植物体内类胡萝卜素的含量。类胡萝卜素的生物合成和代谢途径相对保守,目前在拟南芥、水稻、玉米、小麦、番茄、胡萝卜、柑橘等多个物种中已经广泛研究,但在谷子中类胡萝卜素研究较少,研究谷子的类胡萝卜素合成途径、提高小米黄色素含量对提高谷子品质具有重要意义。
技术实现要素:
6.本发明的目的是提供sipsy1蛋白质在调控谷子类胡萝卜素合成代谢中的应用。
7.为了实现上述目的,本发明首先提供了sipsy1蛋白质的新用途。
8.本发明提供了sipsy1蛋白质在如下a1)-a6)中任一种中的应用:
9.a1)调控谷子籽粒中的黄色素含量和/或类胡萝卜素含量;
10.a2)调控谷子籽粒中的黄色素和/或类胡萝卜素合成与代谢;
11.a3)调控谷子籽粒的颜色和/或透明度;
12.a4)改善或提高谷子品质;
13.a5)培育转基因谷子;
14.a6)谷子育种;
15.所述sipsy1蛋白质为如下(a1)-(a4)任一所述的蛋白质:
16.(a1)seq id no.3所示的蛋白质;
17.(a2)在(a1)所述蛋白质的n端或/和c端连接标签得到的融合蛋白;
18.(a3)将(a1)经过一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与谷子黄色素和/或类胡萝卜素合成相关的蛋白质;
19.(a4)来源于谷子且与(a1)具有98%以上同一性且与谷子黄色素和/或类胡萝卜素合成相关的蛋白质。
20.上述(a2)所述蛋白质中,所述标签(protein-tag)是指利用dna体外重组技术,与目的蛋白一起融合表达的一种多肽或者蛋白,以便于目的蛋白的表达、检测、示踪或纯化。具体可为gfp标签、flag标签、his标签、mbp标签、ha标签、myc标签、gst标签和/或sumo标签等。
21.上述(a3)所述蛋白质中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加具体可为不超过10个氨基酸残基的取代和/或缺失和/或添加,或不超过9个氨基酸残基的取代和/或缺失和/或添加,或不超过8个氨基酸残基的取代和/或缺失和/或添加,或不超过7个氨基酸残基的取代和/或缺失和/或添加,或不超过6个氨基酸残基的取代和/或缺失和/或添加,或不超过5个氨基酸残基的取代和/或缺失和/或添加,或不超过4个氨基酸残基的取代和/或缺失和/或添加,或不超过3个氨基酸残基的取代和/或缺失和/或添加,或不超过2个氨基酸残基的取代和/或缺失和/或添加,或不超过1个氨基酸残基的取代和/或缺失和/或添加。
22.上述(a4)所述蛋白质中,所述同一性是指氨基酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索一对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
23.上述(a1)-(a4)任一所述蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
24.为了实现上述目的,本发明还提供了与上述sipsy1蛋白质相关的生物材料的新用途。
25.本发明提供了与上述sipsy1蛋白质相关的生物材料在如下a1)-a6)中任一种中的应用:
26.a1)调控谷子籽粒中的黄色素含量和/或类胡萝卜素含量;
27.a2)调控谷子籽粒中的黄色素和/或类胡萝卜素合成与代谢;
28.a3)调控谷子籽粒的颜色和/或透明度;
29.a4)改善或提高谷子品质;
30.a5)培育转基因谷子;
31.a6)谷子育种;
32.所述与上述sipsy1蛋白质相关的生物材料为编码上述sipsy1蛋白质的核酸分子或含有所述核酸分子的表达盒、重组载体、重组微生物。
33.所述核酸分子为如下(b1)-(b2)任一所述的dna分子:
34.(b1)seq id no.1或seq id no.2所示的dna分子;
35.(b2)来源于谷子且与(b1)具有75%以上同一性且编码上述sipsy1蛋白质的dna分子。
36.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码sipsy1蛋白质的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的sipsy1核苷酸序列75%或者更高同一性的核苷酸,只要编码sipsy1蛋白质且具有相同功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
37.上述(b2)所述核酸分子中,所述同一性是指与天然核酸序列的序列相似性。同一性包括与本发明的编码seq id no.3所示的氨基酸序列组成的蛋白质的核苷酸序列具有75%或更高,或80%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
38.所述表达盒可为能够在宿主细胞中表达sipsy1蛋白质的dna,该dna不但可包括启动sipsy1基因转录的启动子,还可包括终止sipsy1基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
39.所述重组载体可为含有seq id no.1或seq id no.2所示的用于编码sipsy1蛋白质的dna分子的载体。为了便于对转基因谷子细胞或谷子进行鉴定及筛选,可对所用表达载体进行加工,如加入可在谷子中表达的编码可产生颜色变化的酶或发光化合物的基因(gus基因、荧光素酶基因等)、具有抗性的抗生素标记物(庆大霉素标记物、卡那霉素标记物等)或是抗化学试剂标记基因(如抗除莠剂基因)等。所述重组载体具体可为sipsy1超表达载体。所述sipsy1超表达载体为将seq id no.2所示的sipsy1基因的cds序列去除终止密码子tag后插入至pcambia-1305载体的kpn i和spe i酶切位点间,且保持pcambia-1305载体的其他序列不变后得到的载体。
40.所述重组微生物可为含有上述核酸分子或上述表达盒或上述重组载体的酵母、细菌、藻和真菌。所述细菌具体可为农杆菌,如农杆菌eha105。
41.上述a1)-a6)所述应用中,所述调控为提高,具体体现为:当sipsy1蛋白质在谷子中的活性和/或含量提高时,所述谷子籽粒中的黄色素含量和/或类胡萝卜素含量提高、籽粒颜色变黄、籽粒透明度增加。
42.所述谷子育种的目的为获得籽粒黄色素含量和/或类胡萝卜素含量高或籽粒颜色变黄的谷子品种。
43.为了实现上述目的,本发明还提供了抑制sipsy1的物质的新用途。
44.本发明提供了抑制sipsy1的物质在如下b1)-b5)中任一种中的应用:
45.b1)降低谷子籽粒中的黄色素含量和/或类胡萝卜素含量;
46.b2)抑制谷子籽粒中的黄色素和/或类胡萝卜素合成与代谢;
47.b3)使谷子籽粒颜色变白;
48.b4)培育转基因谷子;
49.b5)谷子育种;
50.所述抑制sipsy1的物质为抑制或降低谷子中上述sipsy1蛋白质活性和/或含量的
物质,或抑制谷子中上述核酸分子表达的物质,或敲除谷子中上述核酸分子的物质。
51.上述b1)-b5)所述应用中,所述抑制或降低谷子中sipsy1蛋白质活性和/或含量的物质可为任何能够使谷子中sipsy1蛋白质活性和/或含量降低或缺失的物质,如抑制sipsy1蛋白质合成或促进sipsy1蛋白质降解或抑制sipsy1蛋白质功能的蛋白质、多肽或小分子化合物(如蛋白活性抑制剂)。
52.所述抑制谷子中编码sipsy1蛋白质核酸分子表达的物质可为任何能够使谷子中sipsy1蛋白质编码基因无法表达的物质,如沉默谷子中sipsy1蛋白质编码基因的物质(包括mirna、sirna、dsrna、shrna等)。
53.所述敲除谷子中编码sipsy1蛋白质核酸分子的物质可以是以任何方式实现宿主细胞不产生sipsy1基因的功能性蛋白质产物的物质,具体方式如去除全部或部分编码基因序列、引入移码突变使得不产生功能性蛋白质、去除或改变调节组分(例如启动子编辑)使得基因序列不被转录等。通常,敲除在基因组dna水平上进行,使得细胞的后代也永久地携带敲除。
54.进一步的,所述敲除谷子中编码sipsy1蛋白质核酸分子的物质可为基于crispr/cas9系统对sipsy1蛋白质编码基因进行编辑的物质,如sgrna和cas9蛋白,又如编码所述sgrna的dna分子和编码所述cas9蛋白的dna分子,再如具有编码所述sgrna的dna分子的表达载体和具有编码所述cas9蛋白的dna分子的表达载体,或具有编码sgrna的dna分子和编码cas9蛋白的dna分子的表达载体。
55.更进一步的,所述sgrna的靶序列具体如seq id no.4或seq id no.5所示。所述具有编码sgrna的dna分子和编码cas9蛋白的dna分子的表达载体具体可为重组载体pylcrispr/cas9pubi-h-sipsy1。所述重组载体pylcrispr/cas9pubi-h-sipsy1为将seq id no.6所示的dna分子插入pylcrispr/cas9pubi-h载体的bsa i酶切位点处,且保持pylcrispr/cas9pubi-h载体的其他序列不变后得到的载体。
56.所述谷子育种的目的为获得籽粒黄色素含量或类胡萝卜素含量低或籽粒颜色变白的谷子品种。
57.为了实现上述目的,本发明还提供了一种培育籽粒黄色素含量和/或类胡萝卜素含量提高的转基因谷子的方法。
58.本发明提供的培育籽粒黄色素含量和/或类胡萝卜素含量提高的转基因谷子的方法包括提高受体谷子中上述sipsy1蛋白质的含量和/或活性,得到转基因谷子的步骤;所述转基因谷子籽粒中的黄色素含量和/或类胡萝卜素含量高于所述受体谷子。
59.进一步的,所述提高受体谷子中上述sipsy1蛋白质的含量和/或活性的方法可为在受体谷子中过表达sipsy1蛋白质。
60.所述过表达的方法可为将sipsy1蛋白质编码基因导入受体谷子。
61.更进一步的,所述sipsy1蛋白质编码基因的核苷酸序列如seq id no.1或seq id no.2所示。
62.在本发明的具体实施例中,所述sipsy1蛋白质编码基因通过上述sipsy1超表达载体导入受体谷子。
63.为了实现上述目的,本发明还提供了一种培育籽粒黄色素含量和/或类胡萝卜素含量降低的转基因谷子的方法。
64.本发明提供的培育籽粒黄色素含量和/或类胡萝卜素含量降低的转基因谷子的方法包括降低受体谷子中上述sipsy1蛋白质的含量和/或活性,得到转基因谷子的步骤;所述转基因谷子籽粒中的黄色素含量和/或类胡萝卜素含量低于所述受体谷子。
65.进一步的,所述降低受体谷子中上述sipsy1蛋白质的含量和/或活性的方法是通过对所述受体谷子中sipsy1蛋白质编码基因进行抑制或敲除来实现。
66.再进一步的,所述敲除受体谷子中sipsy1蛋白质编码基因的方法可为基于crispr/cas9系统对受体谷子中的sipsy1蛋白质编码基因进行编辑。
67.更进一步的,所述基于crispr/cas9系统对受体谷子中sipsy1蛋白质编码基因进行编辑的方法可为将基于crispr/cas9系统对sipsy1蛋白质编码基因进行基因编辑的物质导入受体谷子中,所述基于crispr/cas9系统对sipsy1蛋白质编码基因进行基因编辑的物质可为sgrna和cas9蛋白,又可为编码所述sgrna的dna分子和编码所述cas9蛋白的dna分子,还可为具有编码所述sgrna的dna分子的表达载体和具有编码所述cas9蛋白的dna分子的表达载体,或具有编码sgrna的dna分子和编码cas9蛋白的dna分子的表达载体。
68.在本发明的一个具体实施例中,所述sgrna的靶序列具体如seq id no.4或seq id no.5所示。所述基于crispr/cas9系统对sipsy1蛋白质编码基因进行基因编辑的物质具体为上述重组载体pylcrispr/cas9pubi-h-sipsy1。
69.为了实现上述目的,本发明最后提供了一种转基因谷子的制备方法。
70.本发明提供的转基因谷子的制备方法包括如下步骤:对受体谷子中上述核酸分子进行编辑,得到基因编辑谷子的步骤;所述基因编辑谷子籽粒中的黄色素含量和/或类胡萝卜素含量低于所述受体谷子。
71.进一步的,所述对受体谷子中上述核酸分子进行编辑的方法可为上述基于crispr/cas9系统对受体谷子中sipsy1蛋白质编码基因进行编辑的方法。
72.更进一步的,所述基因编辑谷子具体可为sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8和sipsy1#11。
73.所述sipsy1敲除谷子纯合编辑株系sipsy1#1与野生型谷子ci846的差异仅在于在编码sipsy1蛋白质基因上发生了一个碱基t的缺失,该缺失碱基t位于seq id no.2所示的sipsy1基因编码区的第571位。
74.所述sipsy1敲除谷子纯合编辑株系sipsy1#8与野生型谷子ci846的差异仅在于在编码sipsy1蛋白质基因上发生了39bp的片段缺失,该39bp缺失片段位于seq id no.2所示的sipsy1基因编码区的第85-123位。
75.所述sipsy1敲除谷子纯合编辑株系sipsy1#11与野生型谷子ci846的差异仅在于在编码sipsy1蛋白质基因上发生了一个碱基t的插入,该碱基t的插入位置为seq id no.2所示的sipsy1基因编码区的第116位和第117位之间。
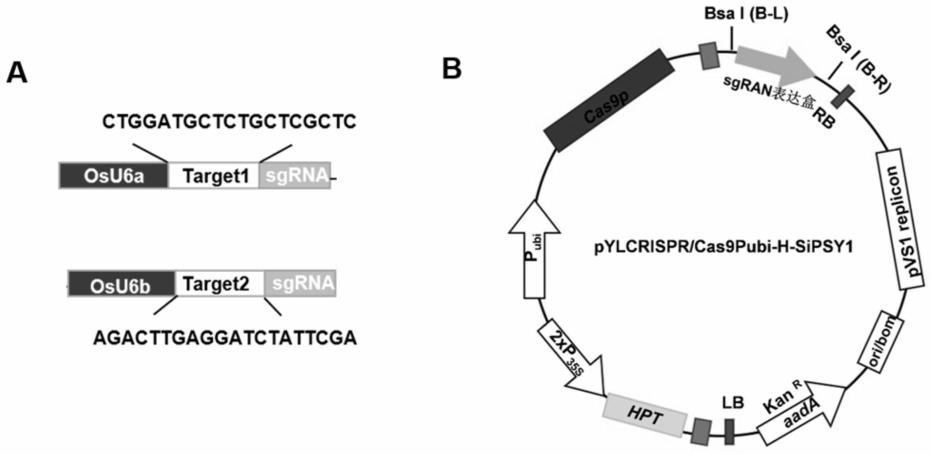
76.上述任一所述方法中,所述导入具体可为通过使用ti质粒、ri质粒、植物病毒载体、直接dna转化、显微注射、电导、农杆菌介导等常规生物学方法转化谷子细胞或组织,并将转化的谷子组织培育成植株。
77.上述任一所述应用或方法中,所述黄色素或所述类胡萝卜素包括胡萝卜素和叶黄素。进一步的,所述胡萝卜素可为β-胡萝卜素。所述叶黄素可为叶黄素和玉米黄质。
78.上述任一所述应用或方法中,所述谷子品种具体可为ci846。
79.本发明利用crispr/cas9基因编辑技术和转基因技术,验证了sipsy1基因具有调控谷子黄色素或类胡萝卜素合成代谢的功能,具体表现为:该基因功能的缺失会导致谷子籽粒中的黄色素或类胡萝卜素含量降低,籽粒颜色变白;该基因超表达会导致谷子籽粒中的黄色素或类胡萝卜素含量提高,籽粒颜色变黄加深且透明度增加。本发明首次发现sipsy1基因功能的改变会导致谷子籽粒中黄色素或类胡萝卜素含量的改变,进而可利用本发明的sipsy1基因调控小米米色,加强sipsy1的特异性表达技术以改善谷子米色,本发明在谷子育种、品种改良和新种质创制上具有十分重要的应用。
附图说明
80.图1为2个含有不同sipsy1靶点的sgrna表达盒的结构示意图及sipsy1敲除载体pylcrispr/cas9pubi-h-sipsy1的结构示意图。
81.图2为野生型谷子ci846和sipsy1敲除谷子纯合编辑株系中的sipsy1基因结构及靶点序列比对。
82.图3为sipsy1超表达谷子oe13株系的sipsy1表达量检测。
83.图4为野生型谷子ci846及sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11的籽粒颜色。
84.图5为野生型谷子ci846及sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11的类胡萝卜素含量。
85.图6为野生型谷子ci846及sipsy1超表达谷子oe13株系的籽粒颜色和类胡萝卜素含量。
具体实施方式
86.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
87.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
88.下述实施例中的野生型谷子ci846记载于文献“a transposon insertion drove the loss of natural seed shattering during foxtail millet domestication.mol biol evol.2022apr 7:msac078.doi:10.1093/molbev/msac078.epub ahead of print.pmid:35388422.”中。
89.实施例1、sipsy1蛋白质在调控谷子类胡萝卜素合成中的应用
90.本发明中的sipsy1蛋白质的氨基酸序列如seq id no.3所示。在野生型谷子ci846的cdna中,编码sipsy1蛋白的cds序列如seq id no.2所示,在野生型谷子ci846的基因组序列中,编码sipsy1蛋白的基因组序列如seq id no.1所示。
91.一、sipsy1敲除谷子的获得
92.1、sipsy1敲除载体的构建
93.1)sipsy1敲除靶点的设计
94.根据sipsy1基因序列,利用在线靶点设计网站crispr-p 2.0(http://crispr.hzau.edu.cn/crispr2/)设计靶点,根据靶点的位置以及打靶的特异性选择合适的靶点,最终筛选得到如下两个sipsy1基因敲除靶点:靶点1和靶点2。靶点1和靶点2具体序列如下:
95.靶点1:5
’‑
ctggatgctctgctcgctc-3’(seq id no.4)
96.靶点2:5
’‑
agacttgaggatctattcga-3’(seq id no.5)。
97.2)sipsy1敲除载体的构建
98.将seq id no.6所示的dna分子插入pylcrispr/cas9pubi-h载体(ma et al.,a robust crispr/cas9 system for convenient,high-efficiency multiplex genome editing in monocot and dicot plants,2015,molecular plant)的bsa i酶切位点处,且保持pylcrispr/cas9pubi-h载体的其他序列不变,得到sipsy1敲除载体pylcrispr/cas9pubi-h-sipsy1。sipsy1敲除载体pylcrispr/cas9pubi-h-sipsy1中含有2个分别靶向靶点1和靶点2的sgrna表达盒,其结构示意图如图1a所示;sipsy1敲除载体pylcrispr/cas9pubi-h-sipsy1的结构示意图如图1b所示。
99.2、sipsy1敲除谷子的获得与鉴定
100.将测序正确的sipsy1敲除载体导入农杆菌eha105,得到重组菌;使用农杆菌介导的遗传转化手段转化野生型谷子ci846幼胚愈伤,得到t0代转基因植株。
101.采用引物5
’‑
agtcatccacccatccc-3’和5
’‑
tcctacaataccacccttt-3’对t0代转基因植株进行dna检测,确定转基因植物编辑方式,获得t1代种子,在温室进行播种,对t1代转基因植株再次扩增与测序,检测编辑方式是否稳定遗传及植株编辑位点的纯杂合,最终得到3个sipsy1敲除谷子纯合编辑株系(即两条染色体发生的突变一致),分别命名为sipsy1#1、sipsy1#8、sipsy1#11。
102.与野生型谷子ci846相比,sipsy1#1的差异仅在于在编码sipsy1蛋白质基因上(在第3个外显子上)发生了一个碱基t的缺失,该缺失碱基t位于seq id no.2所示的sipsy1基因编码区的第571位,从而造成移码并导致蛋白翻译提前终止,sipsy1蛋白功能缺失。野生型谷子ci846和sipsy1敲除谷子纯合编辑株系sipsy1#1的sipsy1序列比对示意图如图2b和2c所示。
103.与野生型谷子ci846相比,sipsy1#8的差异仅在于在编码sipsy1蛋白质基因上(在第1个外显子上)发生了39bp(tgctcctccctgctcaagaggcggcgccgctggatgctc)的片段缺失,该39bp缺失片段位于seq id no.2所示的sipsy1基因编码区的第85-123位,从而导致sipsy1蛋白质的氨基酸序列第29-41位氨基酸(cssllkrrrrwml)的缺失,sipsy1蛋白功能缺失。野生型谷子ci846和sipsy1敲除谷子纯合编辑株系sipsy1#8的sipsy1序列比对示意图如图2b和2c所示。
104.与野生型谷子ci846相比,sipsy1#11的差异仅在于在编码sipsy1蛋白质基因上(在第1个外显子上)发生了一个碱基t的插入,该碱基t的插入位置为seq id no.2所示的sipsy1基因编码区的第116位和第117位之间,从而造成移码并导致蛋白翻译提前终止,sipsy1蛋白功能缺失。野生型谷子ci846和sipsy1敲除谷子纯合编辑株系sipsy1#11的sipsy1序列比对示意图如图2b和2c所示。
105.二、sipsy1超表达谷子的获得
106.1、sipsy1超表达载体的构建
107.将seq id no.2所示的sipsy1基因的cds序列去除终止密码子tag后插入至pcambia-1305载体(该载体的核苷酸序列如seq id no.7所示,该载体中自带gfp标签蛋白序列)的kpn i和spe i酶切位点间,且保持pcambia-1305载体的其他序列不变,得到sipsy1超表达载体。sipsy1超表达载体表达sipsy1和gfp的融合蛋白,其中,gfp用来检测载体是否成功转入植株中。
108.2、sipsy1超表达谷子的获得与鉴定
109.将sipsy1超表达载体导入农杆菌eha105,得到重组菌;使用农杆菌介导的遗传转化手段转化野生型谷子ci846幼胚愈伤,得到转基因植株。
110.利用引物5
’‑
ccctgccttcatacgct-3’和5
’‑
aagatggtgcgctcctg-3’对转基因植株进行pcr鉴定,扩增获得1698bp条带的转基因植株即为转基因阳性植株。
111.3、sipsy1超表达植株表达水平检测
112.检测转基因阳性植株和野生型谷子ci846中的sipsy1表达水平,具体步骤如下:
113.1)rna提取
114.取转基因阳性植株叶片,取样后放入提前准备好的锡箔纸中,投入到液氮中,整个取样过程速度要快,避免样品中rna降解。rna提取采用trizol法,实验中要用到的器具(研钵、研磨棒、镊子、剪刀等)用95%的乙醇淋浇,燃烧,去除rnase,待燃烧冷却后将所有器具浸入到液氮中预冷。实验操作台用75%的酒精擦拭干净,然后用rnase zap擦拭试验台,除去台面上的rnase。在整个操作过程中,需要戴手套、口罩,尽量避免有rnase降解rna。
115.2)rna反转录
116.利用takara公司的prime script ii 1st strand cdna synthesis kit(catno.6210a,takara,otsushiga,japan)将rna反转成cdna,操作前试验台用酒精擦拭,并喷rnase zap擦拭试验台,需带口罩和手套。操作步骤按照试剂盒中体系说明加样,即得到cdna,将cdna稀释10倍成工作液,-20℃保存。
117.3)荧光定量pcr
118.以cdna为模板采用引物qpsy1-f(5
’‑
aggcaacaactgaaagcgtgta-3’)和qpsy1-r(5
’‑
agatgtcctcatcagagagccc-3’)利用taq pro universal sybr qpcr master mix试剂(vazyme,catno.q712-02)进行qrt-pcr,实验按照说明书配置qrt-pcr反应体系,每个cdna样品进行4次独立重复试验。qrt-pcr反应体系配置好后加入到qrt-pcr96孔板中,用applied bio systems 7300analyzer荧光定量pcr仪器运行qrt-pcr反应程序。qrt-pcr反应程序为:95℃、2min预变性,然后按照95℃、1min,55℃、1min,72℃、1min,共40个循环,最后72℃、7min延伸。最终利用excel计算各供试植株中的sipsy1相对表达量。
119.结果如图3所示,结果显示:sipsy1超表达谷子oe13株系中的sipsy1相对表达量是野生型谷子ci846的4.5倍。
120.三、sipsy1在调控谷子类胡萝卜素合成代谢中的应用
121.供试植株:野生型谷子ci846;sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11;sipsy1超表达谷子oe13株系。
122.观察供试植株籽粒颜色,并采用液相色谱串联质谱(lc-ms/ms)技术检测供试植株籽粒中的类胡萝卜素成分含量。每份材料选取3个生物学重复,样品保证正常灌浆成熟,对
取样的材料种子脱皮处理后检测类胡萝卜素含量变化。采用spss statistics20.0软件对数据进行处理,实验结果以平均值
±
标准偏差表示,p<0.05(*)表示具有显著性差异,p<0.001(***)表示具有极显著性差异。液相色谱串联质谱(lc-ms/ms)检测的数据采集仪器系统主要包括超高效液相色谱(ultra performance liquid chromatography,uplc)(exionlc
tm ad,https://sciex.com.cn/)和串联质谱(tandem mass spectrometry,ms/ms)(6500 ,https://sciex.com.cn/)。液相色谱串联质谱(lc-ms/ms)检测的液相条件具体如下:
123.1)色谱柱:ymc c30(3μm,100mm
×
2.0mm i.d.);
124.2)流动相:a相,甲醇/乙腈(1:3,v/v)加入0.01%bht和0.1%甲酸;b相,甲基叔丁基醚加入0.01%bht;
125.3)梯度洗脱程序:0min a/b为100:0(v/v),3min为100:0(v/v),5min为30:70(v/v),9min为5:95(v/v),10min为100:0(v/v),11min为100:0(v/v);
126.4)流速0.8ml/min;柱温28℃;进样量2μl。
127.野生型谷子ci846和sipsy1敲除谷子纯合编辑株系的籽粒颜色和类胡萝卜素含量检测结果如图4-图5所示。与野生型谷子ci846相比,sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11籽粒颜色均表现为白色,黄色素显著降低。同时测定了野生型谷子ci846和3个sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11籽粒中的叶黄素、玉米黄质和β-胡萝卜素含量,野生型谷子ci846和3个sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11籽粒中的叶黄素含量分别为9.375μg/g、2.493μg/g、2.331μg/g、1.821μg/g;野生型谷子ci846和3个sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11籽粒中的玉米黄质含量分别为1.474μg/g、0.542μg/g、0.414μg/g、0.331μg/g;野生型谷子ci846和3个sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11籽粒中的β-胡萝卜素含量分别为0.102μg/g、0.053μg/g、0.070μg/g、0.056μg/g。可以看出:3个sipsy1敲除谷子纯合编辑株系sipsy1#1、sipsy1#8、sipsy1#11籽粒中的叶黄素和玉米黄质含量极显著低于野生型谷子ci846,其中叶黄素含量分别降低了73.4%、67.5%和74.8%,玉米黄质含量分别降低了63.2%、61.6%和69.4%,β-胡萝卜素含量也显著降低。以上结果说明sipsy1敲除后导致谷子类胡萝卜素含量降低,最终导致米色变白。
128.sipsy1超表达谷子oe13株系的籽粒颜色和类胡萝卜素含量检测结果如图6所示。与野生型谷子ci846相比,sipsy1超表达谷子oe13株系籽粒颜色表现为变黄加深且透明度增高。同时测定了野生型谷子ci846和sipsy1超表达谷子oe13株系籽粒中的叶黄素、玉米黄质和β-胡萝卜素含量,野生型谷子ci846和sipsy1超表达谷子oe13株系籽粒中的叶黄素含量分别为9.375μg/g、14.107μg/g,野生型谷子ci846和sipsy1超表达谷子oe13株系籽粒中的玉米黄质含量分别为1.474μg/g、1.688μg/g,野生型谷子ci846和sipsy1超表达谷子oe13株系籽粒中的β-胡萝卜素含量分别为0.102μg/g、0.121μg/g。可以看出:相对于野生型谷子ci846来说,sipsy1超表达谷子oe13株系籽粒中的叶黄素和玉米黄质含量显著增高,分别增加了1.5倍和1.17倍。以上结果说明sipsy1超表达后导致谷子类胡萝卜素含量升高,米色变黄加深,同时透明度增强。
129.综上所述,sipsy1蛋白质及其编码基因可以调控谷子类胡萝卜素合成代谢,进而调控谷子籽粒颜色,影响谷子品质。
130.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
