1.本发明涉及材料化学技术领域,具体为一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的制备方法及其应用。
背景技术:
2.近年来,癌症是目前人类死亡率最高的疾病,治疗癌症的方法大多以放疗为主,化疗为辅,传统的化疗药物在杀死肿瘤细胞的同时也会损害人体的正常细胞,导致免疫功能下降,对人体造成不可逆的损伤,为实现癌症的定点释放药物从而达到靶向治疗的目的,极大减少化学药物对非病变部位的伤害,作为一种新型可定点治疗癌症的材料——可注射型原位凝胶,在生物医药方面发挥着越来越重要的作用,拥有着巨大的应用前景。
3.原位水凝胶是一种特殊的水凝胶,它指的是以溶液状态给药后,能立即在给药部位发生相转变转化形成非化学交联的半固体制剂,目前市场上大部分报道可用于原位注射的凝胶大多由高分子聚合物所构成,其分子量大、在生物体内难降解,超分子凝胶通常是由小分子自聚集缠绕所形成的自组装网状结构,它通过氢键、π-π堆积,静电力,供体-受体相互作用、金属配位、亲疏水、范德华力等非共价相互作用形成的,由于其可逆的凝胶性、易于调节的分子结构和性质及其易降解性,受到了极大的关注,已被广泛应用于生物传感器、有机催化剂、光响应材料、药物传输领域等方面,基于小分子的超分子原位水凝胶不仅能克服传统高分子水凝胶材料带来的问题,还具备以下优点:1、具有药物控释作用,其纤维互相缠绕形成的三维结构,可将药物包裹其中,药物能够促进凝胶的自我组装,凝胶以响应外界条件刺激的方式调节药物的释放,两者相互促进,提高药物控释的效率;2、具有优异的热可逆性和热稳定性;3、具有良好的生物相容性、易降解的特点;4、制剂以溶液的形式注射入生物体内,与生物体内的水接触后形成凝胶,固定在病变部位,起到定点释放药物、定点治疗癌症的作用,酰胺衍生物是一类重要的小分子凝胶剂;由于酰胺基团上的官能团具有可灵活旋转的特点,扩大了其配位的可能性,且酰胺含有活性基团(氨基),其经过修饰后可得到多种具有生物活性的衍生物,已被广泛应用于农业、催化剂、医药和食品等领域,氢键的相互作用是生物系统中最重要的非共价相互作用之一,在超分子凝胶材料的制备中发挥着重要作用;在有机配体中,酰胺具有多个氢键位点,易于分子间产生氢键作用力,且基于吡啶酰胺的配体具有适应超分子结构几何要求的能力,是一种很好的超分子凝胶制剂,可用于可注射型原位凝胶材料的制备,在生物医学领域显出极强的应用潜能。
4.经过调研,目前酰胺衍生物的可注射型超分子原位凝胶报道较少,因而对设计合成新型的凝胶因子并开发相应的可注射原位凝胶具有十分重要的意义。
技术实现要素:
5.本发明的目的在于提供一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的制备方法及其应用,以解决上述背景技术中提出的问题。
6.为实现上述目的,本发明提供如下技术方案:一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的制备方法,包括步骤一,原料选取;步骤二,3,5-吡啶二甲酰氯合成;步骤三,酰胺衍生物的合成;步骤四,产品制备;
7.其中上述步骤一中,首先按照配方设计称取适量的聚乙二醇和 3,5-吡啶二甲酸备用;
8.其中上述步骤二中,当步骤一中的原料选取完成后,取用100ml 的圆底烧瓶,将步骤一中的3,5-吡啶二甲酸加入,随即向烧瓶中加入二氯亚砜与2-4滴引发剂,在65-75℃下进行回流,随后减压蒸馏溶剂后得到3,5-吡啶二酰氯固体待用;
9.其中上述步骤三中,取用适量的3-氨基吡啶溶解到无水二氯甲烷中备用,制成3,5-吡啶二酰氯溶液备用,随后,称量适量的3-氨基吡啶加入到250ml的圆底烧瓶中,加入无水二氯甲烷作为溶剂溶解,并加入3ml的三乙胺,随后在冰浴条件下逐滴加入上述制得的 3,5-吡啶二酰氯溶液,在常温下搅拌反应,然后将溶液抽滤,并用去离子水淋洗多次,60-80℃下真空干燥24小时得到酰胺衍生物 pda-n3备用;
10.其中上述步骤四中,当步骤三中的pda-n3制备完成后,适量纯化后的酰胺衍生物pda-n3加入到步骤一中称取的聚乙二醇中,80-90℃下加热直至完全溶解,冷却后即制成注射型吡啶酰胺衍生物小分子原位凝胶制剂。
11.优选的,所述步骤二中,3,5-吡啶二甲酸和二氯亚砜的摩尔比为1:2,引发剂为n,n-二甲基甲酰胺,反应时间为3.5-4.5h。
12.优选的,所述步骤三中,3,5-吡啶二甲酰氯10mmol,3-氨基吡啶为20mmol,三乙胺的量为3ml,反应时间为10-24h。
13.优选的,所述步骤四中,聚乙二醇原料选自医用级的peg200、 peg400和peg600中的任意一种。
14.优选的,所述步骤四中,纯化处理溶解所用溶剂为二氯甲烷,萃取剂为去离子水。
15.优选的,所述步骤四中,纯化的方法为:用乙醇比水重结晶,80℃下真空干燥24h。
16.一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的应用,包括步骤一,浓度设计;步骤二,药物负载;步骤三,检测分析;
17.其中上述步骤一中,根据不同的治疗需求,设计多种性质的原位凝胶制剂,应用于不同场景,即调整酰胺衍生物pda-n3在不同级别聚乙二醇中的含量,得到不同浓度的原位凝胶制剂,加水得到水凝胶,加水之后形成的原位凝胶冷冻干燥后呈纤维状结构,按照上述制备方法制成原位凝胶制剂备用;
18.其中上述步骤二中,将步骤一中的调整浓度之后的原位凝胶制剂作为注射用药物负载的支架或载体,也可用于靶向缓释治疗药物的负载,用于临床治疗;
19.其中上述步骤三中,将vb12分别以100mg/l、150mg/l、200mg/l 的浓度负载于该种吡啶酰胺衍生物小分子凝胶材料中,每隔一定时间取上层缓冲液,以紫外-可见分光光度法测试,同时将人脐静脉内皮细胞置于干凝胶薄膜沉积的96孔板中,在细胞培养箱中培养,每隔一定时间用5μmol/l的钙黄绿素-am染色,并用荧光倒置显微镜观察其活力情况,并且用cell counting kit-8法对细胞增殖情况进行检测分析,另外,将该吡啶酰胺衍生物小分子物质的peg溶液注射至小鼠体内,观察其胶凝状态及降解或代谢情况。
20.优选的,所述步骤一中,酰胺衍生物pda-n3在聚乙二醇中的浓度为4-20g/l。
21.优选的,所述步骤三中,当溶剂为peg400时,控制凝胶因子的浓度6g/l,原位凝胶在小鼠体内可保持15天左右;而当凝胶因子为 10g/l时,原位凝胶在小鼠体内可保持21天左右,之后被降解或代谢。
22.与现有技术相比,本发明的有益效果是:本发明选择3,5-吡啶二羧酸作为反应底物,以3-氨基吡啶对其加以修饰,得到一种吡啶酰胺衍生物pda-n3,将该衍生物溶解于peg溶剂中,得到可注射的制剂,通过调控注射剂的组成,具体的说是调控凝胶因子的浓度,达到调控原位凝胶稳定性,实现调控凝胶在生物体内被吸收的时间长度,便于根据不同的治疗需求,设计多种性质的原位凝胶制剂,应用于不同场景,同时本发明的凝胶与依赖温度升高而形成凝胶的温敏性凝胶相比,具有不受注射时环境温度的影响,具有更大、更宽的使用范围,并且制备方法流程极为简便,制备的凝胶制剂生物相容性好,并且对药物的缓释效果优异,在药物的精准靶向治疗方面具有极大的实用前景。
附图说明
23.图1为本发明的凝胶制剂在加入水的情况下形成稳定凝胶的过程示意图;
24.图2为本发明的凝胶制剂在加入水之后所形成凝胶材料的干凝胶扫描电子显微镜照片;
25.图3为本发明的凝胶制剂在加入水之后所形成凝胶材料对vb12 的药物控释效果图;
26.图4为本发明的凝胶制剂在加入水之后所形成凝胶材料的细胞培养的荧光倒置显微镜照片;
27.图5为本发明的凝胶制剂在加入水之后所形成凝胶材料的细胞增殖行为图;
28.图6为原位凝胶制剂的体外预实验示意图;
29.图7为本发明的凝胶制剂的体外预实验示意图凝胶制剂在小鼠体内的成胶和降解过程图,其中a为凝胶因子浓度为6g/l,b为凝胶因子为10g/l;
30.图8为本发明的制备方法流程图;
31.图9为本发明的应用流程图;
具体实施方式
32.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.请参阅图1-9,本发明提供的一种技术方案:
34.实施例1:
35.一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的制备方法,包括步骤一,原料选取;步骤二,3,5-吡啶二甲酰氯合成;步骤三,酰胺衍生物的合成;步骤四,产品制备;
36.其中上述步骤一中,首先按照配方设计称取适量的聚乙二醇和 10mmol的3,5-吡啶二甲酸备用;
37.其中上述步骤二中,当步骤一中的原料选取完成后,取用100ml 的圆底烧瓶,将步
骤一中10mmol的3,5-吡啶二甲酸加入,20mmol 二氯亚砜,并滴加4滴引发剂dmf,且3,5-吡啶二甲酸和二氯亚砜的摩尔比为1:2,引发剂为n,n-二甲基甲酰胺,在65℃下进行回流,反应时间为3.5h,随后减压蒸馏溶剂后得到3,5-吡啶二酰氯固体待用;
38.其中上述步骤三中,取用10mmol的3-氨基吡啶溶解到50ml无水二氯甲烷中备用,制成3,5-吡啶二酰氯溶液备用,随后,称量 20mmol的3-氨基吡啶加入到250ml的圆底烧瓶中,加入100ml无水二氯甲烷作为溶剂溶解,并加入3ml的三乙胺,随后在冰浴条件下逐滴加入上述制得的3,5-吡啶二酰氯溶液,在常温下搅拌反应,反应时间为10h,然后将溶液抽滤,并用去离子水淋洗多次,80℃下真空干燥24小时得到酰胺衍生物pda-n3备用;
39.其中上述步骤四中,当步骤三中的pda-n3制备完成后,乙醇比水重结晶静置24小时,过滤,80℃真空干燥24小时,得到纯化的pda-n3固体研磨备用,且纯化处理溶解所用溶剂为二氯甲烷,萃取剂为去离子水,称取20mg已纯化后的酰胺衍生物pda-n3加入到步骤一中称取的聚乙二醇中,聚乙二醇原料选自医用级的peg400,80℃下加热直至完全溶解,待溶解降至室温加入0.8ml的去离子水,混匀,静置,得到稳定的注射型吡啶酰胺衍生物小分子原位凝胶制剂。
40.一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的应用,包括步骤一,浓度设计;步骤二,药物负载;步骤三,检测分析;
41.其中上述步骤一中,根据不同的治疗需求,设计多种性质的原位凝胶制剂,应用于不同场景,即调整酰胺衍生物pda-n3在不同级别聚乙二醇中的含量,得到不同浓度的原位凝胶制剂,且酰胺衍生物 pda-n3在聚乙二醇中的浓度为4-20g/l,加水得到水凝胶,加水之后形成的原位凝胶冷冻干燥后呈纤维状结构,按照上述制备方法制成原位凝胶制剂备用;
42.其中上述步骤二中,将步骤一中的调整浓度之后的原位凝胶制剂作为注射用药物负载的支架或载体,也可用于靶向缓释治疗药物的负载,用于临床治疗;
43.其中上述步骤三中,将vb12分别以100mg/l的浓度负载于该种吡啶酰胺衍生物小分子凝胶材料中,每隔一定时间取上层缓冲液,以紫外-可见分光光度法测试,同时将人脐静脉内皮细胞置于干凝胶薄膜沉积的96孔板中,在细胞培养箱中培养,每隔一定时间用5μmol/l 的钙黄绿素-am染色,并用荧光倒置显微镜观察其活力情况,并且用cell counting kit-8法对细胞增殖情况进行检测分析,另外,将该吡啶酰胺衍生物小分子物质的peg溶液注射至小鼠体内,观察其胶凝状态及降解或代谢情况。
44.实施例2:
45.一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的制备方法,包括步骤一,原料选取;步骤二,3,5-吡啶二甲酰氯合成;步骤三,酰胺衍生物的合成;步骤四,产品制备;
46.其中上述步骤一中,首先按照配方设计称取适量的聚乙二醇和 10mmol的3,5-吡啶二甲酸备用;
47.其中上述步骤二中,当步骤一中的原料选取完成后,取用100ml 的圆底烧瓶,将步骤一中20mmol的3,5-吡啶二甲酸加入,40mmol 二氯亚砜,并滴加4滴引发剂dmf,且3,5-吡啶二甲酸和二氯亚砜的摩尔比为1:2,引发剂为n,n-二甲基甲酰胺,在70℃下进行回流,反应时间为4h,随后减压蒸馏溶剂后得到3,5-吡啶二酰氯固体待用;
48.其中上述步骤三中,取用10mmol的3-氨基吡啶溶解到50ml无水二氯甲烷中备用,制成3,5-吡啶二酰氯溶液备用,随后,称量 20mmol的3-氨基吡啶加入到250ml的圆底烧
瓶中,加入100ml无水二氯甲烷作为溶剂溶解,并加入3ml的三乙胺,随后在冰浴条件下逐滴加入上述制得的3,5-吡啶二酰氯溶液,在常温下搅拌反应,反应时间为15h,然后将溶液抽滤,并用去离子水淋洗多次,80℃下真空干燥24小时得到酰胺衍生物pda-n3备用;
49.其中上述步骤四中,当步骤三中的pda-n3制备完成后,乙醇比水重结晶静置24小时,过滤,80℃真空干燥24小时,得到纯化的pda-n3固体研磨备用,且纯化处理溶解所用溶剂为二氯甲烷,萃取剂为去离子水,称取20mg已纯化后的酰胺衍生物pda-n3加入到步骤一中称取的聚乙二醇中,聚乙二醇原料选自医用级的peg400,90℃下加热直至完全溶解,待溶解降至室温即得注射型吡啶酰胺衍生物小分子原位凝胶制剂。
50.一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的应用,包括步骤一,浓度设计;步骤二,药物负载;步骤三,检测分析;
51.其中上述步骤一中,根据不同的治疗需求,设计多种性质的原位凝胶制剂,应用于不同场景,即调整酰胺衍生物pda-n3在不同级别聚乙二醇中的含量,得到不同浓度的原位凝胶制剂,且酰胺衍生物 pda-n3在聚乙二醇中的浓度为4-20g/l,加水得到水凝胶,加水之后形成的原位凝胶冷冻干燥后呈纤维状结构,按照上述制备方法制成原位凝胶制剂备用;
52.其中上述步骤二中,将步骤一中的调整浓度之后的原位凝胶制剂作为注射用药物负载的支架或载体,也可用于靶向缓释治疗药物的负载,用于临床治疗;
53.其中上述步骤三中,将vb12分别以150mg/l的浓度负载于该种吡啶酰胺衍生物小分子凝胶材料中,每隔一定时间取上层缓冲液,以紫外-可见分光光度法测试,同时将人脐静脉内皮细胞置于干凝胶薄膜沉积的96孔板中,在细胞培养箱中培养,每隔一定时间用5μmol/l 的钙黄绿素-am染色,并用荧光倒置显微镜观察其活力情况,并且用cell counting kit-8法对细胞增殖情况进行检测分析,另外,将该吡啶酰胺衍生物小分子物质的peg溶液注射至小鼠体内,观察其胶凝状态及降解或代谢情况。
54.实施例3:
55.一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的制备方法,包括步骤一,原料选取;步骤二,3,5-吡啶二甲酰氯合成;步骤三,酰胺衍生物的合成;步骤四,产品制备;
56.其中上述步骤一中,首先按照配方设计称取适量的聚乙二醇和 10mmol的3,5-吡啶二甲酸备用;
57.其中上述步骤二中,当步骤一中的原料选取完成后,取用100ml 的圆底烧瓶,将步骤一中30mmol的3,5-吡啶二甲酸加入,60mmol 二氯亚砜,并滴加4滴引发剂dmf,且3,5-吡啶二甲酸和二氯亚砜的摩尔比为1:2,引发剂为n,n-二甲基甲酰胺,在75℃下进行回流,反应时间为4.5h,随后减压蒸馏溶剂后得到3,5-吡啶二酰氯固体待用;
58.其中上述步骤三中,取用10mmol的3-氨基吡啶溶解到50ml无水二氯甲烷中备用,制成3,5-吡啶二酰氯溶液备用,随后,称量 20mmol的3-氨基吡啶加入到250ml的圆底烧瓶中,加入100ml无水二氯甲烷作为溶剂溶解,并加入3ml的三乙胺,随后在冰浴条件下逐滴加入上述制得的3,5-吡啶二酰氯溶液,在常温下搅拌反应,反应时间为24h,然后将溶液抽滤,并用去离子水淋洗多次,80℃下真空干燥24小时得到酰胺衍生物pda-n3备用;
59.其中上述步骤四中,当步骤三中的pda-n3制备完成后,乙醇比水重结晶静置24小时,过滤,80℃真空干燥24小时,得到纯化的pda-n3固体研磨备用,且纯化处理溶解所用溶剂为二氯甲烷,萃取剂为去离子水,称取20mg已纯化后的酰胺衍生物pda-n3加入到步骤一
中称取的聚乙二醇中,聚乙二醇原料选自医用级的peg600,90℃下加热直至完全溶解,待溶解降至室温即得注射型吡啶酰胺衍生物小分子原位凝胶制剂。
60.一种注射型吡啶酰胺衍生物小分子原位凝胶制剂的应用,包括步骤一,浓度设计;步骤二,药物负载;步骤三,检测分析;
61.其中上述步骤一中,根据不同的治疗需求,设计多种性质的原位凝胶制剂,应用于不同场景,即调整酰胺衍生物pda-n3在不同级别聚乙二醇中的含量,得到不同浓度的原位凝胶制剂,且酰胺衍生物 pda-n3在聚乙二醇中的浓度为4-20g/l,加水得到水凝胶,加水之后形成的原位凝胶冷冻干燥后呈纤维状结构,按照上述制备方法制成原位凝胶制剂备用;
62.其中上述步骤二中,将步骤一中的调整浓度之后的原位凝胶制剂作为注射用药物负载的支架或载体,也可用于靶向缓释治疗药物的负载,用于临床治疗;
63.其中上述步骤三中,将vb12分别以200mg/l的浓度负载于该种吡啶酰胺衍生物小分子凝胶材料中,每隔一定时间取上层缓冲液,以紫外-可见分光光度法测试,同时将人脐静脉内皮细胞置于干凝胶薄膜沉积的96孔板中,在细胞培养箱中培养,每隔一定时间用5μmol/l 的钙黄绿素-am染色,并用荧光倒置显微镜观察其活力情况,并且用cell counting kit-8法对细胞增殖情况进行检测分析,另外,将该吡啶酰胺衍生物小分子物质的peg溶液注射至小鼠体内,观察其胶凝状态及降解或代谢情况。
64.各实施例性质对比如下表:
[0065][0066]
基于上述,对上述制备得到的这种注射型吡啶酰胺衍生物小分子原位凝胶制剂在加入水之后所形成凝胶材料的干凝胶进行微观形貌分析,得到如图2所示的结果;由图可见,冷冻干燥后的凝胶材料主要呈纤维状结构;
[0067]
对上述制备得到的这种注射型吡啶酰胺衍生物小分子原位凝胶制剂在加入水之后所形成凝胶材料进行药物控释研究,得到如图3所示的结果;由图可知,维生素b12在300小时左右达到缓释平衡,缓释率达90%以上,说明该凝胶材料对维生素b12具有良好的缓释效果;
[0068]
对上述制备得到的这种注射型吡啶酰胺衍生物小分子原位凝胶制剂在加入水之后所形成凝胶材料进行人脐静脉内皮细胞培养,得到如图4和图5所示的结果;由图4可知,随着培养时间的延长,凝胶薄膜上的细胞出现了一定程度增殖,在第七天完全铺满培养板;由图 5可见,相对于初始投入量,huvec在第七天的增值量已经远远超过,且与不加干凝胶的培养板培养的细胞相比,增值情况相似,说明该吡啶酰胺衍生物小分子凝胶材料具有良好的生物相容性;
[0069]
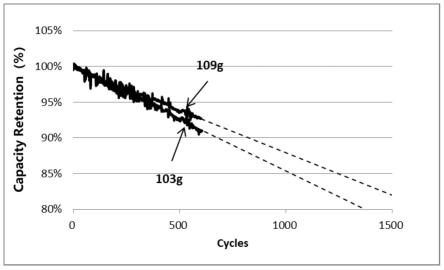
对上述制备得到的这种注射型吡啶酰胺衍生物小分子原位凝胶制剂进行活体注射研究,得到如图7a和7b所示的结果,由图可知,将原位凝胶制剂注射至小鼠体内,随即在注射部位形成原位凝胶,当前原位凝胶制剂中,吡啶酰胺衍生物的浓度为6g/l、8g/l和10g/l,其在小鼠体内可保持天数分别对应15d、18d和21d左右,之后被降解或代谢,且对小鼠生长状况几乎无影响,说明该凝胶材料在生物体内具有一定的稳定性和相容性。
[0070]
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。