1.本技术属于生物学免疫分析技术领域,更具体地说,它涉及一种用于免疫检测的组合物、试剂盒、检测方法及应用。
背景技术:
2.免疫诊断是利用抗原抗体之间的特异性免疫反应来测定免疫状态、检测各种疾病的诊断方法。目前的免疫检测技术主要包括放射免疫技术,免疫胶体金技术、酶联免疫分析技术、化学发光免疫分析技术等。放射免疫虽然灵敏度高,但用品昂贵,且存在放射性污染;胶体金免疫反应速度快,操作便捷,但灵敏度和特异性差;酶联免疫法虽然灵敏度较高,但其结果好坏取决于包被基质,固相载体的包被难以达到各批次之间一致,因此重复性较差;化学发光免疫灵敏度高、自动化程度高,但是发光强度低、不易测量,仪器设备较昂贵。
技术实现要素:
3.对于感染性疾病的诊断,最理想的是针对病原体的诊断,但由于某些病原体生长所需条件高,生长时间长、检出的阳性率低,给临床诊断带来一定困难。发明人发现检测机体免疫产生的特异性抗体在一定程度上可弥补以上的不足,因此迫切需要开发出特异性高、灵敏度高、通量高的抗体检测技术应用于感染性疾病的诊断。
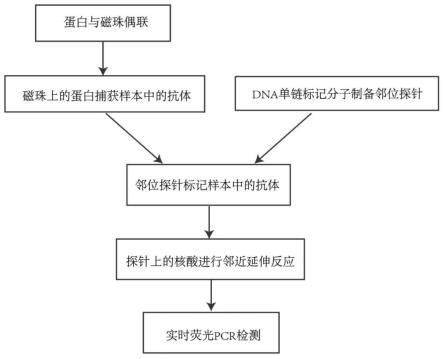
4.基于此,本技术提供了一种用于免疫检测的组合物,利用该组合物检测时,第一蛋白和第二蛋白能够特异性识别并结合于目标分子形成复合物,此时第一核苷酸序列和第二核苷酸序列在空间位置上相互邻近,通过连接反应形成一段可扩增的dna序列,以实时pcr进行放大和检测,将对抗体的检测转变为对dna检测,实现定量抗体的分析。
5.本技术是通过以下方案实现的:
6.本技术一方面提供了一种用于免疫检测的组合物,包括第一探针和第二探针,
7.所述第一探针包括第一核苷酸序列连接于第一蛋白;
8.所述第二探针包括第二核苷酸序列连接于第二蛋白;
9.所述第一蛋白和第二蛋白能够同时识别并结合于目标分子,所述第一核苷酸序列和所述第二核苷酸序列能够通过dna连接酶连接。
10.本技术提供的免疫检测组合物中,其可用于目标分子(一般为抗原或抗体)的免疫检测,当第一蛋白和第二蛋白均同时识别同一目标分子时,第一核苷酸序列探针和第二核苷酸序列将在空间位置上相互邻近,通过dna连接酶,形成一段可扩增的dna序列(本技术称为邻位连接反应),然后以实时pcr进行放大和检测。通过本技术提供的免疫检测组合物,可以将对目标分子的检测转变成为对dna的检测,实现定量分析。
11.本技术中,只有在一对探针均与目标分子结合,且相互间距离足够贴近时,邻近连接反应才能够发生,因此这种方法的非特异性检测极少,这一优点使得与常规方法相比,具有更高的特异性和检测灵敏度。
12.在本发明的一个具体实施方式中,所述第一蛋白、所述第二蛋白为抗体或抗原,也
可以是含有双识别位点或多识别位点的抗体片段或抗原片段。
13.在本发明的一个具体实施方式中,还包括模板connector,所述模板connector的第一部分序列与所述第一核苷酸序列中远离所述第一蛋白的一端互补配对,所述模板connector的第二部分序列与所述第二核苷酸序列中远离所述第二蛋白的一端互补配对。
14.在本发明的一个具体实施方式中,所述第一蛋白与所述第二蛋白相同或不同。例如,第一蛋白和第二蛋白相同:均为可以与待检测抗体特异性结合的抗原,或者均为待检测抗体的二抗;或者第一蛋白和第二蛋白不同:第一蛋白为可以与待检测抗体特异性结合的抗原,第二蛋白为待检测抗体的二抗;或者第一蛋白为待检测抗体的二抗,第二蛋白为可以与待检测抗体特异性结合的抗原。
15.在本发明的一个具体实施方式中,所述组合物还包括固相载体。所述固相载体可以为塑料制品,例如聚苯乙烯微量板(包被板);可以为微粒,例如磁珠;可以为膜载体,例如硝酸纤维素膜(nc)、玻璃纤维素膜及尼龙膜等。
16.在本发明的一个具体实施方式中,所述固相载体为磁珠。
17.在本发明的一个具体实施方式中,所述固相载体为包被板。
18.在本发明的一个具体实施方式中,所述磁珠选自m-270环氧基磁珠或连接有链霉亲和素的磁珠。
19.在本发明的一个具体实施方式中,所述目标分子通过第一蛋白或第二蛋白连接于所述固相载体,形成固相载体-第一蛋白/第二蛋白-目标分子复合物,进而利用固相载体更简单方便地分离目标分子。
20.在本发明的一个具体实施方式中,所述目标分子为抗体,所述第一蛋白为与所述目标分子特异性结合的抗原,所述第二蛋白为所述目标分子的二抗,所述固相载体含有链霉亲和素;所述第一蛋白能够特异性识别并与目标分子特异性结合;所述第二蛋白与目标分子特异性结合;所述第一蛋白通过生物素-亲和素固定于所述固相载体上。
21.在本发明的一个具体实施方式中,所述组合物还包括第三蛋白,所述目标分子通过所述第三蛋白连接于所述固相载体。所述目标分子通过所述第三蛋白连接于所述固相载体,形成固相载体-第三蛋白-目标分子复合物,进而通过固相载体,简单方便地分离目标分子。
22.在本发明的一个具体实施方式中,当目标分子为抗体时,所述第三蛋白可以是与目标分子特异性结合的抗原或蛋白a/g。
23.在本发明的一个具体实施方式中,所述目标分子为抗体,所述第一蛋白为针对目标分子的二抗,所述第二蛋白与所述第三蛋白相同,均为抗原,所述第一蛋白能够特异性识别并结合于目标分子;所述第二蛋白与目标分子特异性结合;所述第三蛋白共价固定于所述固相载体上,且所述第三蛋白能够特异性识别并结合目标分子。
24.在本发明的一个具体实施方式中,所述目标分子为抗体,所述第一蛋白为针对目标分子的二抗,所述第二蛋白为抗原,所述第三蛋白为生物素标记抗原,所述固相载体上连接有链霉亲和素;所述第一蛋白能够特异性识别并结合于目标分子;所述第二蛋白与目标分子特异性结合;所述第三蛋白通过生物素-亲和素固定于所述固相载体上,且所述第三蛋白与目标分子特异性结合。
25.在本发明的一个具体实施方式中,所述目标分子为抗体,所述第一蛋白和所述第
二蛋白相同,均为抗原,所述第三蛋白为蛋白a/g;所述第一蛋白、第二蛋白能够特异性识别并结合于目标分子;所述第三蛋白固定于所述固相载体上,并特异性识别并结合于所述目标分子。
26.在本发明的一个具体实施方式中,所述目标分子为抗体,所述第一蛋白和所述第二蛋白相同,均为针对目标分子的二抗,所述第三蛋白为生物素标记抗原,所述固相载体上连接有链霉亲和素;所述第一蛋白、第二蛋白能够特异性识别并结合于目标分子;所述第三蛋白通过生物素-亲和素固定于所述固相载体上,并特异性识别并结合于所述目标分子。
27.本技术中,所述第一核苷酸序列和/或所述第二核苷酸序列可以连接有样本标签(index primer)序列,用于标记每个样本以实现高通量反应。所述标签序列可以是所述第一核苷酸序列和/或所述第二核苷酸序列中的一段序列,也可以通过互补配对的方式连接于所述第一核苷酸序列和/或所述第二核苷酸序列。
28.本技术另一方面提供了一种邻近连接免疫检测方法,其包括如下步骤:
29.s1:将第一探针、第二探针加入到含有目标分子的待测样品中混合均匀,孵育;
30.s2:在步骤s1中,加入模板connector、atp、dna连接酶孵育;
31.s3:在步骤s2中,加入pcr引物、dna聚合酶、dntp进行pcr反应。
32.在本发明的一个具体实施方式中,所述检测方法还包括在步骤s1前的步骤s0:在固相载体中,加入含有目标分子的待测样品,孵育,使目标分子连接于固相载体上。
33.在本发明的一个具体实施方式中,所述目标分子为抗体,所述第三蛋白可以为与目标分子特异性结合的抗原或蛋白a/g。
34.在本发明的一个具体实施方式中,所述步骤s1和s2中均还包括磁性分离。
35.在本发明的一个具体实施方式中,所述步骤s2之后,还包括蛋白酶分离蛋白和磁珠。
36.在本发明的一个具体实施方式中,所述蛋白酶选自蛋白酶k(proteinase k)、glu-c蛋白酶、lys-c蛋白酶、lysn蛋白酶、asp-n蛋白酶、胰凝乳蛋白酶中的一种或多种。
37.在本发明的一个具体实施方式中,所述固相载体为磁珠,所述邻近连接免疫检测方法具体包括如下步骤:
38.s0:在连接有第三蛋白的磁珠中,加入含有目标分子的待测样品,孵育,使目标分子连接于固相载体上;
39.s1:将第一探针和第二探针加入到含有目标分子的待测样品中混合均匀,在旋转混合仪上室温孵育1h;
40.磁性分离:用pbst洗涤磁珠3次;
41.s2:在步骤s1中,加入模板connector、atp、t4连接酶,在旋转混合仪上室温孵育15min;
42.磁性分离:用pbst洗涤磁珠3次;
43.蛋白酶分离蛋白和磁珠:加入10μl蛋白酶混合液(终浓度为0.4μg/μl proteinase k,1
×
dream taq dna polymerase buffer),置于pcr仪器中,50℃15min,90℃10min进行反应。
44.s3:进行pcr反应:将步骤s2中磁性分离后的产物转移到qpcr板中,加入qpcr混合物混合(终浓度分别为400μm dntp,0.5μm pcr-fwd和0.5μm pcr-rev,0.2
×
sybr green,
0.05u/μl dream taq hot start dna polymerase,0.02u/μl uracil-dna glycosylase in 1
×
dream taq dna polymerase buffer),然后将板放进qpcr仪器中,首先反应条件95℃2min,然后在95℃15s,58℃30s,72℃30s条件下进行40个循环。
45.在本发明的一个具体实施方式中,所述固相载体为磁珠,所述第二探针连接有样本标签(index primer)序列,样本标签(index primer)序列通过互补配对的方式连接于所述第二探针,所述邻近连接免疫检测方法具体包括如下步骤:
46.s0:在连接有第三蛋白的磁珠中,加入含有目标分子的待测样品,孵育,使目标分子连接于固相载体上;
47.s1:将第一探针和第二探针加入到含有目标分子的待测样品中混合均匀,在旋转混合仪上室温孵育1h;
48.磁性分离:用pbst洗涤磁珠3次;
49.s2:在步骤s1中,加入模板connector、atp、t4连接酶,在旋转混合仪上室温孵育15min;
50.磁性分离:用pbst洗涤磁珠3次;
51.s2-a:在步骤s2中,加入phi29 dna聚合酶和dntp,37℃孵育15min;
52.磁性分离:用pbst洗涤磁珠3次;
53.蛋白酶分离蛋白和磁珠:加入10μl蛋白酶混合液(终浓度为0.4μg/μl proteinase k,1
×
dream taq dna polymerase buffer),置于pcr仪器中,50℃15min,90℃10min进行反应。
54.s3:pcr检测:将步骤s2中磁性分离后的产物转移到qpcr板中,加入qpcr混合物混合(终浓度为400μm dntp,0.5μm pcr-fwd2和0.5μm pcr-rev2,0.2
×
sybr green,0.05u/μl dream taq hot start dna polymerase,0.02u/μl uracil-dna glycosylase in 1
×
dream taq dna polymerase buffer),然后将板放进qpcr仪器中,首先反应条件95℃2min,然后在95℃15s,58℃30s,72℃30s条件下进行40个循环。
55.在本技术的一个具体实施方式中,所述固相载体为包被板,所述邻近连接免疫检测方法具体包括如下步骤:
56.s0:在包被板中,加入含有目标分子的待测样品,使目标分子固定于包被板上;
57.s1:将第一探针和第二探针加入到含有目标分子的待测样品中混合均匀,在旋转混合仪上室温孵育1h;
58.s2:在步骤s1中,加入模板connector、atp、t4连接酶,在旋转混合仪上室温孵育15min;
59.s3:pcr检测:步骤s2中,加入qpcr混合物混合(终浓度为200μm dntp,0.25μm pcr-fwd和0.25μm pcr-rev,0.1
×
sybr green,0.025u/μl dream taq hot start dna polymerase,0.01u/μl uracil-dna glycosylase in 1
×
dream taq dna polymerase buffer),然后将板放进qpcr仪器中,首先反应条件95℃2min,然后在95℃15s,58℃30s,72℃30s条件下进行40个循环。
60.本技术第三方面提供一种试剂盒,所述试剂盒包括第一探针和第二探针。
61.在本技术的一个具体实施方式中,所述试剂盒还包括磁珠,所述磁珠上连接有能够特异性结合于所述目标分子的第三蛋白。
62.本技术第四方面提供上述组合物,上述检测方法,以及上述试剂盒在抗体检测中的应用。
63.在本技术的一个具体实施方式中,所述抗体为新型冠状病毒抗体或人乳头瘤病毒hpv抗体。
64.本技术提供的组合物至少具有以下有益效果之一:
65.本技术提供的组合物用于免疫检测时,特异性高,灵敏度高,将第一核苷酸序列和/或第二核苷酸序列标记上不同的样本标签,可以实现高通量检测,具有广泛的应用价值。
附图说明
66.图1为本技术实施例中提供的第一种技术路线示意图。
67.图2为本技术实施例中提供的第二种技术路线示意图。
68.图3为本技术实施例中提供的基于m-270环氧基磁珠或基于链霉亲和素的磁珠检测分析中抗原、抗体和探针的结合方式示意图;其中,代表固相载体;
●
代表抗原;代表抗原;代表抗原;表抗体;代表左探针核苷酸序列、右探针核苷酸序列分别与connecter互补配对并连接;代表未配对的核苷酸序列。
69.图5为本技术实施例中提供的基于链霉亲和素的磁珠检测抗体时抗原、抗体和探针的结合方式示意图,其中引入了样本标签序列;代表固相载体;
·
代表抗原;代代代表左探针核苷酸序列、右探针核苷酸序列分别与connecter互补配对并连接;代表未配对的核苷酸序列;图7中,代表固相载体;
●
代表抗原;代表抗体;代表代表左探针核苷酸序列、右探针核苷酸序列分别与connecter互补配对并连接;代表未配对的核苷酸序列;图8中,代表固相载体;
●
代表抗原;代表抗体;代表代表左探针核苷酸序列、右探针核苷酸序列分别与connecter互补配对并连接;代表未配对的核苷酸序列。
70.图9为本技术实施例中提供的目标分子通过第一蛋白连接于磁珠,并基于链霉亲和素的磁珠检测抗体时抗原、抗体和探针的结合方式示意图。其中,代表固相载体;
solution;型号am2546,thermofisher scientific);atp溶液(atp solution;型号r0441,thermofisher scientific);phi29 dna聚合酶(phi29dna polymerase;型号ep0091,thermofisher scientific)。
77.本技术的实施例中涉及到核酸序列如下:
78.第一探针(左探针)的核苷酸序列:
79.cgcatcgcccttggactacgactgacgaaccgctttgcctgactgatcgctaaatcgtg
80.第二探针(右探针)的核苷酸序列:
81.tcgtgtctaaagtccgttaccttgattcccctaaccctcttgaaaaattcggcatcggtga
82.pcr-fwd:catcgcccttggactacga
83.pcr-rev:gggaatcaaggtaacggactttag
84.connector:tacttagacacgacacgatttagttt
85.pcr-fwd2:catcgcccttggactacga
86.pcr-rev2:acactctttccctacacgac
87.index primer 1:acactctttccctacacgacctctctatgagggttaggggaatcaaggtaac
88.index primer 2:acactctttccctacacgactatcctctgagggttaggggaatcaaggtaac
89.index primer 3:acactctttccctacacgacgtaaggaggagggttaggggaatcaaggtaac
90.index primer 4:acactctttccctacacgacactgcatagagggttaggggaatcaaggtaac
91.index primer 5:acactctttccctacacgacaaggagtagagggttaggggaatcaaggtaac
92.index primer 6:acactctttccctacacgacctaagcctgagggttaggggaatcaaggtaac
93.index primer 7:acactctttccctacacgaccgtctaatgagggttaggggaatcaaggtaac
94.index primer 8:acactctttccctacacgactctctccggagggttaggggaatcaaggtaac
95.index primer 9:acactctttccctacacgactcgactaggagggttaggggaatcaaggtaac
96.index primer 10:acactctttccctacacgacttctagctgagggttaggggaatcaaggtaac
97.index primer 11:acactctttccctacacgaccctagagtgagggttaggggaatcaaggtaac
98.index primer 12:acactctttccctacacgacgcgtaagagagggttaggggaatcaaggtaac
99.本技术以下实施例中以固相载体为磁珠和包被板为例进行说明。
100.实施例1新型冠状病毒2019-ncov抗体检测
101.方案一:基于m-270环氧基磁珠检测新冠抗体免疫分析法
102.本方案中的技术路线见图1所示,抗原、抗体和探针的结合方式见图3所示。
103.第一蛋白为新型冠状病毒2019-ncov抗体的二抗。
104.第二蛋白为抗原2019-ncov spike rbd-mfc(rbd)和2019-ncov spike s1-his(s1)的重组蛋白,记为s1&rbd。
105.第三蛋白为抗原2019-ncov spike rbd-mfc(rbd)和2019-ncov spike s1-his(s1)的重组蛋白,记为s1&rbd。
106.磁珠:m-270环氧基磁珠。
107.1.邻位探针的制备
108.将第二探针的核苷酸序列与抗原s1&rbd重组蛋白结合制备出右探针,第一探针的核苷酸序列直接与二抗人igg结合形成左探针。根据需要,可以在第一探针或第二探针上连接上具有识别功能的tag标签序列。
109.蛋白/抗体与核苷酸共价键偶联:10ug s1&rbd和二抗人igg分别与33.3的二苯并环辛烯-琥珀酰亚胺酯(dibenzyl cyclooctyne nhs ester)(af-206-na,r&d systems)、33.3mol磺基琥珀酰亚胺-6-(生物素)己酸(sulfo-nhs-lc-biotin)(dbco-nhs ester;jena bioscience)室温反应1小时。然后被激活的重组蛋白s1&rbd和二抗人igg分别经过7k mwco zeba spin columns自旋柱除去过量的生物素和二苯并环辛烯-琥珀酰亚胺酯,得到纯化后被激活的重组蛋白s1&rbd和二抗人igg。纯化后的s1&rbd中加入2.5倍摩尔过量的叠氮化物azide修饰的第二探针的核苷酸序列,在4℃孵育过夜制备出右探针;纯化后的二抗人igg中加入2.5倍摩尔的叠氮化物azide修饰的第一探针的核苷酸序列,分别在4℃孵育过夜制备出左探针。
110.2.样品的制备
111.将人鼠嵌合2019-ncov spike抗体(目标分子)溶于pbs中作为模拟已经产生抗体的新冠患者样本,对照组只加入不含抗体的pbs。
112.3.抗原与磁珠的偶联
113.抗原s1&rbd重组蛋白(第三蛋白)与m-270环氧基磁珠共价偶联,参照m-270环氧基磁珠抗体偶联试剂盒说明书,按5μg抗原/mg磁性微珠比例偶联,磁珠定容至10mg/ml,4℃保存。
114.4.邻近连接反应
115.(1)准备4个96孔板,2个96孔板中加入包被有s1&rbd的磁珠和spike抗体结合(记为试验1和试验2),2个96孔板加入包被有s1&rbd的磁珠和pbs结合作为对照(记为对照1和对照2)。试验1和试验2中,每孔分别加入5μl样品(3μlpbs、1μl 5%bsa缓冲液和1μl 0.005μg/μl spike抗体),加入浓度为30ng/μl人igg左探针和30ng/μl s1&rbd右探针各2.5μl,对照1和对照2中,每孔分别加入5μl样品(3μlpbs、1μl 5%bsa缓冲液和1μl 0.005μg/μl pbs,浓度为30ng/μl人igg左探针和30ng/μl s1&rbd右探针各2.5μl。
116.(2)混匀后在旋转混合仪上室温孵育1h。
117.(3)分别将每个板中96孔的混合液收集于1个离心管中,共4管,磁性分离,用pbst洗涤磁珠3次。
118.(4)每管加入25μl t4连接混合液(终浓度为100μm atp,0.1μm connector),0.05u/μl t4连接酶,1
×
dream taq dna polymerase buffer),在旋转混合仪上室温孵育15min。
119.(5)磁性分离,用pbst洗涤磁珠3次。
120.5.蛋白酶分离蛋白和磁珠
121.在每管中加入10μl蛋白酶混合液(终浓度为0.4μg/μl proteinase k,1
×
dream taq dna polymerase buffer,),置于pcr仪器中,50℃15min,90℃10min。
122.6.pcr反应
123.磁性分离后,将10μl上述产物转移到qpcr板中,并与10μl qpcr混合物混合(终浓度为400μm dntp,0.5μm pcr-fwd和0.5μm pcr-rev),0.2
×
sybr green,0.05u/μl dream taq hot start dna polymerase,0.02u/μl uracil-dna glycosylase in 1
×
dream taq dna polymerase buffer(都来自thermo scientific),然后将板放进qpcr仪器中,首先反应条件95℃2min,然后在95℃15s,58℃30s,72℃30s条件下进行40个循环。
124.7.实验结果如表1所示。
125.表1 m-270环氧基磁珠检测新冠抗体的实时荧光pcr
126.项目样品中抗体含量(μg/孔)qpcr ct值对照1020.83对照2019.35试验10.00512.13试验20.00511.94
127.由表1可以看出,2个96孔板中分别加入包被有抗原的磁珠和0.005μl spike抗体结合(试验1和试验2),2个96孔板中分别加入包被有抗原的磁珠和pbs结合作为对照(对照1和对照2),将96孔样本混成1管后,加入抗体2019-ncov spike测得的ct值分别为12.13和11.94,明显小于加入pbs的空白对照组的ct值20.83和19.35,可表明通过方案一抗体检测方法能够检测出2019-ncov spike抗体。
128.方案二:基于链霉亲和素的磁珠检测新冠抗体免疫分析法
129.本方案中的技术路线见图10所示,抗原、抗体和探针的结合方式见图3所示。
130.第一蛋白为新型冠状病毒2019-ncov抗体的二抗。
131.第二蛋白为生物素化抗原s1&rbd的重组蛋白,记为生物素化s1&rbd。
132.第三蛋白为抗原2019-ncov spike rbd-mfc(rbd)和2019-ncov spike s1-his(s1)的重组蛋白,记为s1&rbd。
133.固相载体:链霉亲和素包被板(96透明孔)
134.1.邻位探针的制备
135.将第二探针的核苷酸序列与抗原s1&rbd重组蛋白结合制备出右探针,第一探针的核苷酸直接与二抗人igg结合形成与s1&rbd蛋白探针成对的左探针,制备方法同方案一中的1。
136.2.生物素标记抗原
137.(1)按照ez-link sulfo-nhs-biotin试剂盒说明书公式计算,每管sulfo-nhs-biotin加入231μl的ddh2o,配置为10mm的母液。
138.(2)按照ez-link sulfo-nhs-biotin试剂盒说明书,将抗原s1&rbd溶液与sulfo-nhs-biotin溶液混合均匀(每10μg抗原加入1μl 10mm sulfo-nhs-biotin溶液)。
139.(3)在室温孵育30分钟。
140.(4)使用thermo fisher zeba tm spin desalting column试剂盒将生物素化抗原过滤纯化(具体纯化步骤按照说明书进行)。
141.3.生物素化的抗原与链霉亲和素包被板偶联
142.(1)在链霉亲和素包被板中加入每孔加入10μl蛋白浓度为5ng/μl的生物素化抗原s1&rbd,室温孵育1h。
143.(2)加入pbst洗涤链霉亲和素包被板3次(自动洗板机)。
144.4.样品的制备
145.收集健康人的血浆,将不同浓度梯度的人鼠嵌合抗体sars-cov spike分别稀释于pbs和血浆中,模拟新冠样本。
146.5.链霉亲和素包被板与样品反应
147.链霉亲和素包被板,每个孔中加入10μl分别溶于血浆和pbs中的不同浓度梯度的spike抗体样品,混匀后在旋转混合仪上室温孵育1h。
148.6.邻近连接反应
149.(1)用pbst洗涤链霉亲和素包被板3次。
150.(2)每个孔加入10μl抗体浓度为10ng/μl的人二抗igg左探针和10μl蛋白浓度为10ng/μl s1&rbd蛋白右探针。混匀后室温孵育1h。
151.(3)加入pbst洗涤链霉亲和素包被板3次(自动洗板机)。
152.(4)每个反应加入20μl t4连接混合液(同上),静置室温孵育15min。
153.(5)加入pbst洗涤链霉亲和素包被板3次(自动洗板机)。
154.7.pcr检测
155.对于qpcr检测,加入20μl qpcr混合物混合(终浓度为200μm dntp,0.25μm pcr-fwd和0.25μm pcr-rev),0.1
×
sybr green,0.025u/μl dream taq hot start dna polymerase,0.01u/μl uracil-dna glycosylase in 1
×
dream taq dna polymerase buffer(都来自thermo scientific)),然后将板放进qpcr仪器中,首先反应条件95℃2min,然后在95℃15s,58℃30s,72℃30s条件下进行40个循环。
156.8.实验结果如表2所示。
157.表2链霉亲和素包被板检测新冠抗体的实时荧光pcr结果
[0158][0159]
从表2中可以看出,将抗体2019-ncov spike以不同浓度梯度加入到不同管中,可看出随着加入抗体2019-ncov spike的浓度降低,ct值逐渐增大,表明方案二抗体检测方法检测抗体2019-ncov spike有效。
[0160]
方案三:基于蛋白a/g的磁珠检测新冠抗体免疫分析法
[0161]
本法案的技术路线见图2所示,抗原、抗体和探针的结合方式见图4所示。
[0162]
第一蛋白、第二蛋白均为抗原rbd&s1重组蛋白。
[0163]
第三蛋白为蛋白a/g。
[0164]
磁珠:能够连接蛋白a/g的普通磁珠。
[0165]
本方案中直接购买市面上连接有蛋白a/g的磁珠。
[0166]
1.邻位探针的制备
[0167]
第一探针为抗原s1&rbd重组蛋白结合第一核苷酸序列制备而成;第二探针为抗原s1&rbd重组蛋白结合第二核苷酸序列制备而成,制备方法同方案一中的1。
[0168]
2.蛋白a/g磁珠的洗涤
[0169]
(1)将50μl(0.50mg)的蛋白a/g磁珠放入1.5ml的离心管中,加入150μl的洗涤缓冲液,轻轻涡旋混合。
[0170]
(2)将离心管放入磁力架中,使珠子聚集在试管的侧面。除去并丢弃上清液。
[0171]
(3)在离心管加入1ml的洗涤缓冲液。将试管离心管轻轻涡旋混合1min。用磁力架收集珠子,然后除去并丢弃上清液。
[0172]
(4)在离心管中加入50μl洗涤缓冲液,使得磁珠浓度为10mg/ml。
[0173]
3.样品的制备
[0174]
收集健康人的血浆,将不同浓度梯度的抗体sars-cov spike兔抗稀释于血浆或pbs中,模拟新冠样本。
[0175]
4.样品中的抗体与磁珠偶联
[0176]
准备96孔板,每个孔中分别加入5μl样品(血浆/pbs 不同浓度梯度的spike抗体),5μl磁珠混合液(洗涤后的蛋白a/g磁珠10mg/ml 1μl 1%bsa缓冲液4μl),混匀后在旋转混合仪上室温孵育1h。
[0177]
5.邻近连接反应
[0178]
(1)将96孔板放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0179]
(2)每个孔中加入20μl 10ng/μl左右探针混合液(10μl 10ng/μl s1&rbd左探针 10μl10ng/μl s1&rbd右探针)。混匀后在旋转混合仪上室温孵育1h。
[0180]
(3)放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0181]
(4)每个孔中加入25μl t4连接混合液(终浓度为100μm atp,0.1μm connector,0.05u/μl t4连接酶,1
×
dream taq dna polymerase buffer),在旋转混合仪上室温孵育15min。
[0182]
6.同方案一的5。
[0183]
7.同方案一的6。
[0184]
8.实验结果见表3所示。
[0185]
表3蛋白a/g的磁珠检测新冠抗体的实时荧光pcr ct值
[0186]
[0187][0188]
从表3中可以看出,将抗体兔抗spike以不同浓度梯度溶于pbs和血浆中,并加入到不同反应管中,随着加入抗体兔抗spike的浓度降低ct值逐渐增大,表明方案三抗体检测方法检测兔抗spike有效。
[0189]
方案四:基于链霉亲和素的磁珠检测新冠抗体免疫分析法(引入index primer)
[0190]
本方案的技术路线见图1所示,抗原、抗体和探针的结合方式见图5所示。
[0191]
第一蛋白为抗原rbd&s1重组蛋白。
[0192]
第二蛋白为新型冠状病毒2019-ncov抗体的二抗:驴抗兔igg(h l)抗体。
[0193]
第三蛋白为抗原s1&rbd重组蛋白。
[0194]
磁珠:链霉亲和素的磁珠。
[0195]
1.邻位探针的制备
[0196]
抗原s1&rbd重组蛋白与第一探针的核苷酸序列形成左探针,二抗兔igg与第二探针的核苷酸序列形成右探针,制备方法同方案一中的1。
[0197]
2.右探针与index primer相连
[0198]
80nm index primer(1,2,3...12)分别和80nm兔igg右探针按比例1:1混合室温孵育1h,index primer与右探针以互补的形式结合,形成带有index primer的右探针。
[0199]
3.生物素标记抗原
[0200]
具体步骤同本实施例中方案二中的2相同。
[0201]
4.生物素化的抗原与涂覆有链霉亲和素的磁珠偶联
[0202]
具体步骤同本实施例中方案二中的3相同。
[0203]
5.样品的制备
[0204]
收集健康人的血浆,将不同浓度梯度的兔抗sars-cov spike分别稀释于pbs和血浆中,模拟新冠样本。
[0205]
6.磁珠与样品反应
[0206]
准备96孔板,每个孔中加入结合有生物素化s1&rbd的磁珠混合液5μl(10mg/ml磁珠0.5μl 1%bsa缓冲液4.5μl),分别加入5μl样品分别溶于血浆和pbs中的不同浓度梯度的兔spike抗体,混匀后在旋转混合仪上室温孵育1h。
[0207]
7.聚合反应和邻近连接反应
[0208]
(1)将96孔板放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0209]
(2)每个孔中加入20μl 10ng/μl左、右探针混合液(10μl 10ng/μl连有index primer的兔igg右探针和10μl 10ng/μl s1&rbd蛋白左探针),混匀后在旋转混合仪上室温孵育1h。
[0210]
(3)将分别连有12个index primer(1,2,3...12)的同一浓度的12个样本汇聚到一个离心管。
[0211]
(4)放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0212]
(5)每个孔中加入25μl t4连接混合液(终浓度为100μm atp,0.1μm connector,0.05u/μl t4连接酶,1
×
dream taq dna polymerase buffer),在旋转混合仪上室温孵育15min。
[0213]
(6)放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0214]
(7)每个孔中加入25μl phi29 dna聚合酶混合液(终浓度为0.1u/μl phi29 dna polymerase,200μm dntp,10
×
reaction buffer,),37℃孵育15min。
[0215]
8.蛋白酶分离蛋白和磁珠
[0216]
在每个孔中加入10μl蛋白酶混合液(终浓度为0.4μg/μl proteinase k,1
×
dream taq dna polymerase buffer),置于pcr仪器中,50℃ 15min,90℃10min。
[0217]
9.pcr反应
[0218]
磁性分离后,将上述10μl连接产物转移到qpcr板中,并与10μl qpcr混合物混合(400μm dntp,0.5μm pcr-fwd2和0.5μm pcr-rev2),0.2
×
sybr green,0.05u/μl dream taq hot start dna polymerase,0.02u/μl uracil-dna glycosylase in 1
×
dream taq dna polymerase buffer(都来自thermo scientific),然后将板放进qpcr仪器中,首先反应条件95℃2min,然后在95℃15s,58℃30s,72℃30s条件下进行40个循环。
[0219]
10.实验结果如表4所示。
[0220]
表4蛋白a/g的磁珠检测新冠抗体的实时荧光pcr ct值
[0221]
兔抗spike抗体含量(μg/孔)抗体溶于pbs中抗体溶于血浆中5
×
10-2
15.7013.385
×
10-3
23.8716.215
×
10-4
28.0822.74028.7727.20
[0222]
从表4中可以看出将抗体兔抗spike以不同浓度梯度分别溶于pbs和血浆中,同一个浓度梯度反应孔有12个重复,并混为1管,随着加入抗体兔抗spike的浓度降低,ct值逐渐增大,表明方案四抗体检测方法检测兔抗spike有效。index primer的引入对于抗体的检测没有影响,带有不同index primer的pcr产物送去检测,可以实现不同样本的高通量检测。
[0223]
方案五:基于不同探针的链霉亲和素的磁珠检测新冠抗体免疫分析法
[0224]
本方案的技术路线见图1所示,抗原、抗体和探针的结合方式见图6-8所示。
[0225]
1.邻位探针的制备
[0226]
a.如图6所示,第一蛋白和第二蛋白为为兔igg,第三蛋白为抗原s1&rbd重组蛋白;第一探针(左探针)为兔igg与第一核苷酸序列连接形成左探针;第二探针(右探针)为兔igg与第二核苷酸序列形成右探针。
[0227]
b.如图7所示,第一蛋白抗原s1&rbd重组蛋白;和第二蛋白为兔igg,第三蛋白为抗原s1&rbd重组蛋白;第一探针为抗原s1&rbd重组蛋白与第一核苷酸序列形成左探针,第二探针为兔igg与第二核苷酸序列形成右探针。
[0228]
c.如图8所示,第一蛋白为兔igg;和第二蛋白为抗原s1&rbd重组蛋白,第三蛋白为抗原s1&rbd重组蛋白;第一探针为兔igg与第一核苷酸序列形成左探针,第二探针为抗原s1&rbd重组蛋白与第二核苷酸序列形成右探针。
[0229]
2.生物素标记抗原
[0230]
具体步骤同本实施例方案二中的2相同。
[0231]
3.生物素化的抗原与涂覆有链霉亲和素的磁珠偶联
[0232]
具体步骤同本实施例中方案二中的3相同。
[0233]
4.样品的制备
[0234]
收集健康人的血浆,将不同浓度梯度的兔抗sars-cov spike分别稀释于pbs和血浆中,模拟新冠样本。
[0235]
5.磁珠与样品反应
[0236]
准备96孔板,每个孔中加入结合有生物素化s1&rbd的磁珠混合液5μl(10mg/ml磁珠0.5μl 1%bsa缓冲液4.5μl),分别加入5μl样品分别溶于血浆和pbs中的不同浓度梯度的spike抗体,混匀后在旋转混合仪上室温孵育1h。
[0237]
6.邻近连接反应
[0238]
(1)将96孔板放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0239]
(2)每个孔中加入20μl 10ng/μl左、右探针混合液(a、b、c分别加入到不同的孔中)。混匀后在旋转混合仪上室温孵育1h。
[0240]
(3)放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0241]
(4)每个孔中加入25μl t4连接混合液(同上),在旋转混合仪上室温孵育15min。
[0242]
7.同本实施例方案一中的5。
[0243]
8.同本实施例方案一中的6。
[0244]
9.实验结果如表5所示。
[0245]
表5不同组合检测新冠抗体的实时荧光pcr ct值
[0246][0247]
从表5中可以看出,将抗体兔抗spike以不同浓度梯度分别溶于pbs和血浆中,用探针a、b、c分别检测,可看出随着加入抗体兔抗spike的浓度降低,ct值逐渐增大,表明方案五中不同探针检测兔抗spike有效。
[0248]
方案六:基于链霉亲和素的磁珠检测新冠抗体免疫分析法
[0249]
本方案中的技术路线见图1所示,抗原、抗体和探针的结合方式见图9所示。
[0250]
第一蛋白为抗原2019-ncov spike rbd-mfc(rbd)和2019-ncov spike s1-his
(s1)的重组蛋白,记为s1&rbd。
[0251]
第二蛋白为新型冠状病毒2019-ncov抗体的二抗。
[0252]
磁珠:链霉亲和素磁珠。
[0253]
1.第二探针的制备
[0254]
第二探针的核苷酸序列直接与二抗人igg结合形成右探针,制备方法同方案一中的1。
[0255]
2.生物素标记抗原
[0256]
具体步骤同本实施例方案二中的2相同。
[0257]
3.第一探针的制备
[0258]
按照上述dna连接蛋白的方法和步骤,将生物素化标记后的抗原与第一探针的核苷酸序列连接制备第二探针,制备方法同方案一中的1。
[0259]
4.生物素化的抗原与涂覆有链霉亲和素的磁珠偶联
[0260]
具体步骤与本实施例方案二中的3相同。
[0261]
向步骤3中加入2.5倍摩尔过量的叠氮化物(azide)修饰的第一探针的核苷酸序列,反应过夜。
[0262]
5.样品的制备
[0263]
将不同浓度梯度的人鼠嵌合抗体sars-cov spike分别稀释于pbs中,模拟新冠样本。
[0264]
6.磁珠与样品反应
[0265]
准备96孔板,每个孔中加入结合有生物素化s1&rbd的磁珠混合液5μl(10mg/ml磁珠0.5μl 1%bsa缓冲液4.5μl),分别加入5μl样品分别溶于血浆和pbs中的不同浓度梯度的spike抗体,混匀后在旋转混合仪上室温孵育1h。
[0266]
7.邻近连接反应
[0267]
(1)将96孔板放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0268]
(2)每个孔中加入20μl人二抗igg右探针溶液,探针反应浓度为10ng/μl。混匀后在旋转混合仪上室温孵育1h。
[0269]
(3)放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0270]
(4)每个孔中加入25μl t4连接混合液(同上),在旋转混合仪上室温孵育15min。
[0271]
8.蛋白酶分离蛋白和磁珠
[0272]
在每个孔中加入10μl蛋白酶混合液(终浓度为0.4μg/μl proteinase k,1
×
dream taq dna polymerase buffer),置于pcr仪器中,50℃15min,90℃10min。
[0273]
9.pcr检测
[0274]
对于qpcr检测,将10μl连接产物转移到qpcr板中,并与10μl qpcr混合物混合(终浓度为400μm dntp,0.5μm pcr-fwd和0.5μm pcr-rev),0.2
×
sybr green,0.05u/μl dream taq hot start dna polymerase,0.02u/μl uracil-dna glycosylase in 1
×
dream taq dna polymerase buffer(都来自thermo scientific),然后将板放进qpcr仪器中,首先反应条件95℃2min,然后在95℃15s,58℃30s,72℃30s条件下进行40个循环。
[0275]
10.实验结果见表8所示。
[0276]
表8链霉亲和素的磁珠检测新冠抗体的实时荧光pcr结果
[0277]
spike抗体含量(μg/孔)抗体溶于血浆中抗体溶于pbs中2.5
×
10-1
19.0721.272.5
×
10-2
20.0522.162.5
×
10-3
22.2722.61023.5025.20
[0278]
从表8中可以看出,将抗体兔抗spike以不同浓度梯度溶于pbs和血浆中,并加入到不同反应管中,随着加入抗体兔抗spike的浓度降低,ct值逐渐增大,表明方案六抗体检测方法检测spike有效。
[0279]
实施例2人乳头瘤病毒hpv抗体检测
[0280]
方案一:基于不同探针检测hpv16抗体免疫分析法
[0281]
本方案的技术路线见图1所示,抗原、抗体和探针的结合方式见图6-7所示。
[0282]
1.邻位探针的制备
[0283]
a.如图6所示,第一蛋白和第二蛋白为人igg;第三蛋白为hpv 16l1抗原;第一探针为人igg与第一核苷酸序列连接形成的左探针;第二探针为人igg连接的第二核苷酸序列形成的右探针。
[0284]
b.如图7所示,第一蛋白为hpv 16l1抗原,第二蛋白为人igg;第三蛋白为hpv 16l1抗原;第一探针为hpv 16l1抗原与第一核苷酸序列形成的左探针;第二探针为anti-人igg与第二核苷酸序列形成的右探针。
[0285]
c.如图8所示,第一蛋白为人igg,第二蛋白为hpv 16l1抗原;第三蛋白为hpv 16l1抗原;第一探针为人igg与第一核苷酸序列形成的左探针;第二探针为hpv 16l1抗原与第二核苷酸序列形成的右探针。
[0286]
2.生物素标记抗原
[0287]
具体步骤同本实施例方案二中的2相同。
[0288]
3.生物素化的抗原与涂覆有链霉亲和素的磁珠偶联
[0289]
具体步骤同本实施例中方案二中的3相同。
[0290]
4.样品的制备
[0291]
收集两名接种过hpv四价疫苗(含有hpv6、11、16和18型蛋白)和两名未接种过hpv四价疫苗的志愿者的全血,2000g,2min离心后取上清血清。四名志愿者的基本信息如下:
[0292]
编号性别年龄是否接种接种日期是否有其它病症a男36岁否无无b女25岁否无无c男25岁是2018-01无d女30岁是2020-04无
[0293]
5.磁珠与样品反应
[0294]
准备96孔板,每个孔中加入结合有生物素化hpv16 l1的磁珠混合液5μl(10mg/ml磁珠0.5μl和1%bsa缓冲液4.5μl),分别加入血清样品5μl,混匀后在旋转混合仪上室温孵育1h。
[0295]
6.邻近连接反应
[0296]
(1)将96孔板放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0297]
(2)每个孔中加入20μl浓度为10ng/μl左、右探针混合液(探针a、b和c分别加入不同孔中)。混匀后在旋转混合仪上室温孵育1h。
[0298]
(3)放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0299]
(4)每个反应加入25μl t4连接混合液(100μm atp,0.1μm connector,0.05u/μl t4连接酶,1
×
dream taq dna polymerase buffer),在旋转混合仪上室温孵育15min。
[0300]
7.同方案一的5。
[0301]
8.同方案一的6。
[0302]
9.实验结果如表6所示。
[0303]
表6不同组合检测hpv 16抗体的实时荧光pcr ct值
[0304][0305]
从表6中可以看出,用探针组合a、b、c分别检测4个人体血浆样本,接种了hpv四价疫苗的人ct值明显低于没有接种hpv四价疫苗的人,表明人体中接种了疫苗后hpv16抗体升高,符合规律,由此说明本实施例方案一抗体探针组合a、b、c检测方法检测人体血液中hpv16抗体有效。
[0306]
方案二:基于蛋白a/g的磁珠检测hpv16抗体免疫分析法
[0307]
本方案的技术路线见图2所示,抗原、抗体和探针的结合方式见图4所示。
[0308]
1.邻位探针的制备
[0309]
第一探针为抗原hpv16 l1重组蛋白结合第一核苷酸序列制备而成;第二探针为抗原hpv16 l1重组蛋白结合第二核苷酸序列制备而成。
[0310]
2.蛋白a/g磁珠的洗涤
[0311]
具体步骤同实施例1中方案三的2相同。
[0312]
3.样品的制备
[0313]
收集两名接种过hpv四价疫苗和两名未接种过hpv四价疫苗的志愿者的全血,2000g,2min离心后取上清血清(四名志愿者同上)。
[0314]
4.样品中的抗体与磁珠偶联
[0315]
每个反应分别加入5μl样品,5μl磁珠混合液(洗涤后的蛋白a/g磁珠10mg/ml 1μl和1%bsa缓冲液4μl),混匀后在旋转混合仪上室温孵育1h。
[0316]
5.邻近连接反应
[0317]
(1)将96孔板放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0318]
(2)每个反应加入20μl 10ng/μl左、右探针混合液(10μl 10ng/μl hpv16 l1左探针 10μl10ng/μl hpv16 l1右探针)。混匀后在旋转混合仪上室温孵育1h。
[0319]
(3)放入磁力板中,磁性分离,用pbst洗涤磁珠3次。
[0320]
每个反应加入25μl t4连接混合液(终浓度为100μm atp,0.1μm connector,0.05u/μl t4连接酶,1
×
dream taq dna polymerase buffer),在旋转混合仪上室温孵育15min。
[0321]
6.同实施例1中方案一的5。
[0322]
7.同实施例1中方案一的6。
[0323]
8.实验结果见表7所示。
[0324]
表7蛋白a/g的磁珠检测hpv 16抗体的实时荧光pcr ct值
[0325]
样本编号是否接种hpv四价疫苗qpcr ct值a是16.55b是17.34c否20.36d否19.44
[0326]
从表7中可以看出,蛋白a/g的磁珠检测分别检测4个人体血浆样本,接种了hpv四价疫苗的人ct值明显低于没有接种hpv四价疫苗的人,表明人体中接种了疫苗后hpv16抗体升高,符合规律,由此说明本实施例方案二抗体检测方法检测人体血液中hpv16抗体有效。
[0327]
应用例
[0328]
本应用例中,以小鼠人乳头瘤病毒16型l1单克隆抗体hpv16作为标准样品制作标准曲线为例说明利用本技术中的组合物定量检测抗体的浓度。
[0329]
本应用例中,第一探针为亲和纯化驴抗鼠igg(h l)抗体结合第一核苷酸序列,第二为抗原hpv16 l1重组蛋白结合第二核苷酸序列。以图4中抗原、抗体和探针的结合方式,以实施例2的方案二中的方法进行试验。
[0330]
其中,方案二中步骤3中样品的制备如下,其他实验步骤同实施例2中的方案二。
[0331]
3.样品的制备:收集健康人的血浆,将不同浓度梯度的小鼠hpv16抗体分别稀释于血浆中,模拟hpv样本,5μl样本中hpv16抗体浓度分别是0、0.0002、0.002、0.02、0.2μg/μl。其实验结果见表9。
[0332]
表9蛋白a/g的磁珠检测血浆hpv 16抗体的实时荧光pcr ct值
[0333]
样品中抗体含量(μg/μl)qpcr ct值0.211.460.0214.020.00216.310.000219.11021.20
[0334]
根据标准样品的浓度建立标准曲线,如图11所示,r2为0.9986,符合要求,根据标准曲线,可以测定待测样本的抗体浓度。
[0335]
本技术实施例中给出的均为对于抗体的检测,对于抗原的检测,本领域技术人员可根据本技术中的思路合理设计。
[0336]
终上所述,本技术提供的组合物,将其应用于抗原、抗体检测,基于组合物中第一核苷酸序列和第二核苷酸序列在空间位置上相互邻近,才能通过连接反应形成一段可扩增的dna序列,再以实时pcr进行放大和检测,将对抗原、抗体的检测转变成为对dna的检测,实
现定量抗原、抗体的分析,其特异性和灵敏度更高,且无需昂贵的仪器设备,能够大幅度降低成本,在探针上连接上样本标签序列,再经测序可以实现高通量检测,可用于大规模筛查等。
[0337]
本具体实施例仅仅是对本技术的解释,其并不是对本技术的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本技术的权利要求范围内都受到专利法的保护。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。