聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法
技术领域
1.本发明属于药物杂质分析技术领域,具体涉及一种聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法。
背景技术:
2.聚乙二醇(peg)是经环氧乙烷聚合生成的一类高分子物质,它具有中性、无毒、无免疫原性、有良好的生物相容性等特点。同时它具有高度的亲水性,在水溶液中有较大的水动力学体积。当peg耦联到蛋白药物分子表面时,可改变其生物分配行为和溶解性,产生空间屏障挡住蛋白质分子表面的抗原决定簇,避免了抗体的产生,同时空间屏障也保护了蛋白质不易被蛋白酶水解;另一方面蛋白药物分子与peg耦联后,相对分子量增加,肾小球的滤过减少。这些都有助于蛋白药物的半衰期延长,从而达到提高药效,减少用药次数的目的。因此,peg被广泛用于蛋白药物的修饰,以改善药物的体内性质。
3.蛋白药物的peg化通常以其分子中的氨基、羧基和巯基等官能团为活性位点进行修饰。其中氨基修饰是最为常用的peg修饰方法,以人促红素(epo)的peg修饰为例,epo一般分子量在35~40kd左右,在适当的反应条件下,甲氧基聚乙二醇(mpeg-sba)和epo的n末端α-氨基或赖氨酸ε-氨基反应生成mpeg-epo及n-羟基琥珀酰亚胺。反应式如下:
[0004][0005]
其中n-羟基琥珀酰亚胺(nhs)为反应的副产物,nhs是一种化学合成常用的医药中间体,该物质化学品安全技术说明书中有关毒理学影响的信息暂无数据资料,为了更好的对药品质量进行控制,需要对产品中的n-羟基琥珀酰亚胺残留量进行监控。
[0006]
李增礼等发表了题目为《高效液相色谱法检测聚乙二醇化重组人干扰素α2b注射液中n-羟基琥珀酰亚胺含量》的论文,该检测方法的色谱条件为:流动相:20mmol/l pb(ph 7.0)-145mmol/l nacl-5%异丙醇;流速:0.6ml/min;色谱柱:tsk g3000sw(7.8mm
×
300mm,10μm);柱温:25℃;检测波长:260nm;进样体积:200μl。建立检测peg-ifnα2b注射液中nhs含量的hplc方法,具有专属性、系统适应性及准确性良好;线性范围宽的优点。但是该检测方法的检测范围较窄,对蛋白质选择性较高,对于蛋白分子量《15kd时可能会出现蛋白峰与目标峰无法分离的情况,而且该方法无法排除药物中可能存在的其他小分子物质对于nhs检
测的干扰。
[0007]
因此,有必要提供一种塔板数高,检测范围宽,对蛋白质分子量无限制,出峰时间快,峰型对称性好的peg化蛋白药物中n-羟基琥珀酰亚胺残留量的检测方法。
技术实现要素:
[0008]
为解决现有技术中的不足,本发明提供一种准确、可靠的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法。该检测方法对蛋白质分子量无限制,适用于所有乙二醇化蛋白药物使用;具有塔板数高,塔板数大约为16000;约5min即可出峰,而且峰型对称性好的优点。
[0009]
本发明提供了一种聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法,包括以下步骤:
[0010]
s1样品制备:取聚乙二醇化蛋白药物反应液或各步骤纯化液作为样品溶液;
[0011]
s2标准品制备:取100mgn-羟基琥珀酰亚胺,溶于10ml超纯水中,得10mg/ml的标准贮备液,将标准贮备液用磷酸盐缓冲液进行稀释,得标准品溶液;
[0012]
s3取步骤s1得到的样品溶液和步骤s2得到的标准品溶液各10ul,分别注入高效液相色谱仪进行n-羟基琥珀酰亚胺残留量检测;所述色谱条件为:所述色谱柱为极性基团修饰的反相色谱柱,以磷酸盐缓冲液为流动相进行等度洗脱。
[0013]
进一步地,所述步骤s2中标准贮备液的稀释浓度为:将标准贮备液用磷酸盐缓冲液稀释到160μg/ml,80μg/ml,40μg/ml,20μg/ml,10μg/ml和5μg/ml。
[0014]
进一步地,所述步骤s3中所述高效液相色谱仪为:品牌为thermo,型号为u3000的高效液相色谱仪,所述色谱柱为:品牌为welch,型号为ultimate polar-rp,规格为4.6*300mm的色谱柱,流动相为:磷酸二氢钾溶液。
[0015]
进一步地,所述色谱条件为:流速0.9~1.1ml/min,柱温为38~42℃,上样量10ul,采集时间30min,检测器为dad检测器或紫外检测器,检测波长为255~265nm。
[0016]
进一步地,所述色谱条件为:流速1.0ml/min,柱温为40℃,上样量10ul,采集时间30min,检测器为dad检测器,检测波长为260nm。
[0017]
进一步地,所述步骤s2和步骤s3中的磷酸盐缓冲液为20mmol/l磷酸二氢钾溶液,ph 6.5
±
0.1。
[0018]
进一步地,所述磷酸二氢钾溶液的制备方法为:称取磷酸二氢钾2.72g,加注射用水800ml溶解,并用氢氧化钠溶液调节至ph 6.5
±
0.1,加注射用水定容至1000ml,用0.22um膜过滤,即得。
[0019]
目前,对于乙二醇化蛋白药物中n-羟基琥珀酰亚胺残留量的研究比较少,现有技术仅有采用尺寸排阻色谱法,分离原理是依据分子大小不同分离,分子量大的先洗脱,分子量小的后洗脱。但该检测方法仅适用于部分分量子蛋白质,当蛋白分子量《15kd时可能会出现蛋白峰与目标峰无法分离的情况,而且塔板数较低,大大限制了其使用。
[0020]
本领域公知:色谱柱,柱温,流动相,流速,进样体积等参数的选择对于高效液相色谱法检测结果的准确性具有较大影响。而且从众多的影响因素中筛选和摸索出一种合适的检测方法是需要经过大量的摸索和研究试验的。为了解决上述缺陷,本发明人首次提出了一种对蛋白质分子量无限制,适用于所有乙二醇化蛋白药物使用,塔板数高,出峰快,峰型
对称性好的乙二醇化蛋白药物中n-羟基琥珀酰亚胺残留量检测方法。本发明的检测方法是采用反相高效液相色谱法,其分离原理是:依据物质与固定性极性大小不同分离,极性大的物质先洗脱,极性小的物质后洗脱。
[0021]
本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法具体是:采用品牌为thermo,型号为u3000的高效液相色谱仪,品牌为welch,型号为ultimate polar-rp,规格为4.6*300mm的色谱柱,流动相为:20mmol/l磷酸二氢钾溶液,ph 6.5
±
0.1,色谱条件为:流速0.9~1.1ml/min,柱温为38~42℃,上样量10ul,采集时间30min,检测器为dad检测器或紫外检测器,检测波长为255~265nm。该检测方法具有塔板数高达16000,5min出峰,峰型对称性好,具有较高的广谱性,合适所有分子量蛋白质的聚乙二醇化蛋白药物使用的优点。
[0022]
与现有技术相比,本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法具有专属性强,线性关系优良且稳定,准确度和精密度高,耐用性好的优点,是一种较为理想的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法,可以有效的对peg化蛋白药物中n-羟基琥珀酰亚胺残留量进行监控,提高产品安全性。
附图说明:
[0023]
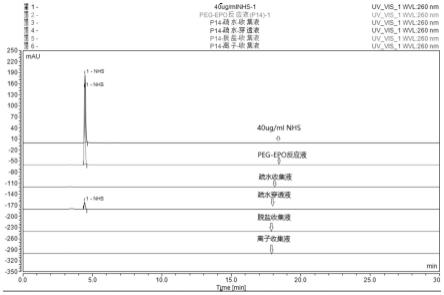
图1为peg-epo反应液及各步骤纯化液的nhs含量检测图;
[0024]
图2为不同批peg-epo反应液的nhs含量检测图;
[0025]
图3为不同批次peg-epo原液的nhs含量检测图;
[0026]
图4为聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法(peg-epo反应液和nhs)的专属性图谱;
[0027]
图5为聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法(peg-epo原液、epo原液和peg)的专属性图谱;
[0028]
图6为聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的线性标准品图谱。
具体实施方式
[0029]
以下通过具体实施方式的描述对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。在实施例中所使用的peg来自北京键凯科技有限公司,为35kd的葡萄糖基聚乙二醇nhs酯。所用的epo原液、peg-epo反应液和peg-epo原液,由深圳赛保尔生物药业有限公司制备。n-羟基琥珀酰亚胺(nhs)来自sigma公司。其他试剂均为分析级。
[0030]
实施例1、一种聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法
[0031]
s1样品制备:取聚乙二醇化蛋白药物反应液或各步骤纯化液作为样品溶液;
[0032]
s2标准品制备:取100mgn-羟基琥珀酰亚胺,溶于10ml超纯水中,得10mg/ml的标准贮备液,将标准贮备液用磷酸盐缓冲液进行稀,所述磷酸盐缓冲液为20mmol/l磷酸二氢钾溶液,ph=6.5,将标准贮备液稀释到160μg/ml,80μg/ml,40μg/ml,20μg/ml,10μg/ml和5μg/ml,得标准品溶液;
[0033]
s3取步骤s1得到的样品溶液和步骤s2得到的标准品溶液各10ul,分别注入高效液
相色谱仪进行n-羟基琥珀酰亚胺残留量检测;所述色谱条件为:所述色谱柱为极性基团修饰的反相色谱柱,以磷酸盐缓冲液为流动相进行等度洗脱;具体为:
[0034]
所述高效液相色谱仪为:品牌为thermo,型号为u3000的高效液相色谱仪,所述色谱柱为:品牌为welch,型号为ultimate polar-rp,规格为4.6*300mm的色谱柱,
[0035]
流动相为:20mmol/l磷酸二氢钾溶液,ph 6.5
±
0.1,制备方法为:称取磷酸二氢钾2.72g,加注射用水800ml溶解,并用氢氧化钠溶液调节至ph 6.5
±
0.1,加注射用水定容至1000ml,用0.22um膜过滤,即得;
[0036]
所述色谱条件为:流速1.0ml/min,柱温为40℃,上样量10ul,采集时间30min,检测器为dad检测器,检测波长为260nm。
[0037]
实施例2聚乙二醇化人促红素(peg-epo)反应液及各步骤纯化液的制备
[0038]
(1)peg-epo反应液制备:将100mg peg溶于5ml 2mmol/l ph3.0的pbs缓冲液中,混匀,制成peg溶液,再取epo原液,用ph 7.2的40mmol/l磷酸盐缓冲液稀释得到1mg/ml的epo溶液,将peg溶液和epo溶液混合,置于振荡器上,室温震荡反应30min,得peg-epo反应液;
[0039]
(2)将peg-epo反应液进行纯化,得到高纯度的peg-epo,主要纯化步骤参考“重组人促红素的连续聚乙二醇化反应方法(专利申请公布号为cn102746405a)”说明书中第[0071]段的纯化方法进行,分别收集:疏水收集液,疏水穿透液,脱盐收集液和离子收集液。
[0040]
试验例一、聚乙二醇化人促红素反应液及各步骤纯化液的nhs含量检测试验
[0041]
1、试验方法:
[0042]
采用实施例1的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法对实施例2制得的peg-epo反应液,疏水收集液,疏水穿透液,脱盐收集液和离子收集液进行nhs含量检测。
[0043]
2、试验结果:
[0044]
试验结果如表1和图1所示:
[0045]
2.1、peg-epo反应液及各步骤纯化液检测结果如表1所示:
[0046]
表1 peg-epo反应液及各步骤纯化液检测结果
[0047]
样品名称nhs含量(ug/ml)peg-epo反应液46.7疏水收集液未检出疏水穿透液3.9脱盐收集液未检出离子收集液未检出
[0048]
由表1可知,在peg-epo反应液中,由于peg和epo发生反应,生成了nhs,所测得nhs含量为46.7ug/ml。在各步骤纯化液样品中,疏水收集液中未检出nhs,疏水穿透液中检出3.9ug/ml的nhs,后续脱盐和离子收集液均未检出nhs,表明作为反应产物的nhs,在疏水层析中即因为与层析柱无结合而全部穿透,并被去除。
[0049]
2.2、peg-epo反应液及各步骤纯化液检测结果图谱如图1所示,其中纵坐标为吸收值(absorbtion),横坐标为保留时间(remaining time)。
[0050]
试验例二、不同批次聚乙二醇化人促红素反应液及各步骤纯化液的nhs含量检测试验
[0051]
1、试验方法:
[0052]
实施例2在制备过程中采取不同批次的3批epo原液,分别与peg溶液反应,并纯化,得到3个批次的peg-epo反应液和纯化后peg-epo原液。采用实施例1的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法对实施例2制得的3个批次的peg-epo反应液和纯化后peg-epo原液进行nhs含量检测。
[0053]
2、试验结果:
[0054]
试验结果如表2和图2~图3所示:
[0055]
2.1、3个批次的peg-epo反应液和纯化后peg-epo原液的nhs含量检测结果如表2所示。
[0056]
表2不同批次的peg-epo反应液和peg-epo原液的nhs含量检测结果
[0057]
批号nhs含量(ug/ml)p14反应液46.7p16反应液45.2p17反应液20.9p14原液未检出p16原液未检出p17原液未检出
[0058]
由表2可知,不同批次的peg-epo反应液中均含有nhs,浓度在20~47ug/ml之间,而纯化后的peg-epo原液均未检出nhs,说明在纯化步骤中nhs均得到了有效的去除。
[0059]
2.2、3个批次的peg-epo反应液的nhs含量检测结果图谱如图2所示,3个批次的纯化后peg-epo原液的nhs含量检测结果图谱如图3所示,其中纵坐标为吸收值(absorbtion),横坐标为保留时间(remaining time)。
[0060]
试验例三、聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法验证
[0061]
1、色谱条件:
[0062]
所述高效液相色谱仪为:品牌为thermo,型号为u3000的高效液相色谱仪,所述色谱柱为:品牌为welch,型号为ultimate polar-rp,规格为4.6*300mm的色谱柱,
[0063]
流动相为:20mmol/l磷酸二氢钾溶液,ph 6.5
±
0.1,制备方法为:称取磷酸二氢钾2.72g,加注射用水约800ml使溶解,并用氢氧化钠溶液调节至ph 6.5
±
0.1,加注射用水定容至1000ml,用0.22um膜过滤,即得。
[0064]
所述色谱条件为:流速1.0ml/min,柱温为40℃,上样量10ul,采集时间30min,检测器为dad检测器,检测波长为260nm。
[0065]
2、聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的专属性测定:
[0066]
2.1、测定方法:
[0067]
在高效液相色谱仪中分别注入peg-epo原液、epo原液、peg-epo反应液、100μg/mlnhs、100μg/mlpeg标准溶液,按上述色谱条件进样检测。
[0068]
2.2、检测结果:
[0069]
检测结果如表3和图4~图5所示。
[0070]
2.2.1、专属性检测结果如表3所示:
[0071]
表3专属性检测结果
[0072][0073]
2.2.2、专属性检测结果图谱如图4和图5所示:其纵坐标为吸收值(absorbtion),横坐标为保留时间(remaining time),其中图4显示,peg-epo反应液、100μg/mlnhs均有nhs峰。图5显示,peg-epo原液、epo原液均无nhs峰,100μg/mlpeg有nhs峰。根据已知peg的性质,peg在水中易水解生成微量的nhs,100μg/mlpeg也有nhs峰。由此可见,epo和peg化epo均对检测无干扰,本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法具有良好的专属性,可以有效的检测peg化蛋白药物中nhs的含量。
[0074]
3、聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的线性测定:
[0075]
3.1、测定方法:
[0076]
用100μg/ml nhs标准溶液进行梯度稀释,制备6个浓度的nhs标准溶液,连续稀释3次,制备3批标准溶液,按上述色谱条件分别进样检测。以nhs峰面积对其浓度绘图,建立标准曲线,并计算相关系数(r2)。
[0077]
3.2、检测结果:
[0078]
检测结果如表4和图6所示:
[0079]
3.2.1、3批标准溶液的检测线性结果如表4所示:
[0080]
表4线性标准曲线数据
[0081][0082]
3.2.2、3批标准溶液色谱图如图6所示,其中:纵坐标为吸收值(absorbtion),横坐标为保留时间(remaining time),线性标准曲线1的5个标准品色谱图的叠加。结果表明,3条标准曲线的r2均大于等于0.9999,并且相同浓度标准品峰面积的cv均小于5%,证明本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的线性关系优良且稳定。
[0083]
4、聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的准确度测定:
[0084]
4.1、试验方法:
[0085]
依据试验例一和试验例二的试验结果,peg-epo原液中均未检出nhs,因此本试验选取peg-epo原液作为空白样品,在peg-epo原液中加入一定量的nhs标准品作为加标样品,同时制备5、10、20、40、80、160μg/ml的nhs标准溶液,按上述色谱条件分别进样检测。以标准溶液峰面积对nhs浓度作线性标准曲线,并根据该标准曲线,计算peg-epo原液加标样品中的nhs含量值,并分别计算加标样品的加标回收率。加标回收率计算公式如下所示:
[0086][0087]
重复上述操作3次,计算得到加标回收率。
[0088]
4.2、试验结果:
[0089]
试验结果如表5所示。
[0090]
表5回收率计算结果
[0091][0092]
由表5可知,本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的加标回收率均在99%-103%之间,证明本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法准确度良好。
[0093]
5、聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的精密度测定:
[0094]
5.1、试验方法:
[0095]
5.1.1、重复性:由检测人员a取peg-epo反应液,同时制备5、10、20、40、80、160μg/ml的nhs标准溶液,按上述色谱条件别进样检测。以标准溶液峰面积对nhs浓度作线性标准曲线,并根据该标准曲线,计算peg-epo反应液样品中的nhs含量值。重复操作6次,制备6组标准溶液。
[0096]
5.1.2、中间精密度:由检测人员b在不同于检测人员a的时间,重复检测人员a的操作。
[0097]
5.2、试验结果:
[0098]
试验结果如表6所示。
[0099]
表6重复性和中间精密度检测结果
[0100][0101]
由表6结果可知,单人连续6次检测样品结果的cv《2%,双人人共计12次检测样品结果的cv《3,证明本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法重复性以及中间精密度良好。
[0102]
6、聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的检测限测定:
[0103]
6.1、试验方法:
[0104]
对100μg/ml nhs标准品进行梯度稀释,并进样检测,使样品图谱主峰s/n值在3-10之间,最终得到当nhs浓度为0.025ug/ml左右时,符合要求。
[0105]
6.2、试验结果:
[0106]
试验结果如表7所示。
[0107]
表7检测限检测结果
[0108][0109]
由表7可知,当样品nhs浓度为0.025μg/ml时,仍可被有效检出。考虑到进样量为10μl,因此,本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的检测限度为0.25ng。
[0110]
7、聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法的耐用性测定:
[0111]
7.1、试验方法:
[0112]
本发明使用的色谱柱为极性基团修饰的反相色谱柱,反相色谱柱在不同ph条件下,末端的硅醇基可能与检测样品发生相互作用,造成样品峰发生前延或者拖尾,从而使峰面积发生变化,导致可能无法准确检测。因此本次验证考察了流动相ph在发生一定变化时,本发明提供的检测方法是否还能准确检出样品的nhs含量。
[0113]
按上述20mmol/l磷酸二氢钾溶液,ph 6.5
±
0.1为流动相,并分别将流动相ph分别调节到6.0,6.5,7.0。制备5、10、20、40、80、160μg/ml的nhs标准溶液,按上述色谱条件分别进样检测同一批peg-epo反应液。以标准溶液峰面积对nhs浓度作线性标准曲线,并根据该标准曲线,计算peg-epo反应液中的nhs含量值。
[0114]
7.2、试验结果:
[0115]
试验结果如表8所示。
[0116]
表8耐用性验证结果
[0117]
[0118][0119]
由表8可知,在流动相中ph在6.0~7.0之间时,检测结果的cv《5%,本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法耐用性良好。
[0120]
此外,本发明提供的聚乙二醇化蛋白药物中n-羟基琥珀酰亚胺的检测方法也适用于分子量《15kd的蛋白质的聚乙二醇化蛋白药物使用,例如:聚乙二醇化溶菌酶和聚乙二醇化胰岛素。
[0121]
上述实施例仅例示性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。