1.本发明涉及干细胞生物学领域中,一种多能干细胞诱导产生兴奋性和抑制性神经元的方法。
背景技术:
2.人类大脑皮层在健康和疾病方面的研究受到模型系统的限制。建立从人胚胎干细胞和诱导多能干细胞(统称作为多能干细胞,pscs)的分化方法,为研究皮层发育,构建皮层发育疾病的体外模型,具有相当大的潜力。根据对啮齿类动物皮质发育的了解,研发了一个强大的、多步骤的诱导过程来研究多能干细胞的皮层发育,定向诱导人胚胎干细胞或者诱导多能干细胞的分化。
3.大脑皮层主要包含两种类型的神经元,80%的为兴奋性神经元,谷氨酸能的神经元,是由皮层干/祖细胞产生的;抑制性神经元(gaba)大约占有20%,在皮层发育中产生和迁移。一旦产生,不同等级的皮质投射神经元在皮层之间形成局部微电路,以及更长的皮层内和皮层外连接,包括皮质脊髓束,皮质丘脑和胼胝体投射。
技术实现要素:
4.本发明所要解决的技术问题是如何制备兴奋性神经元以及抑制性神经元。
5.本发明首先提供了一种制备兴奋性神经元的方法,所述方法包括:
6.1)将人多能干细胞在培养基ii中进行培养,得到培养基ii培养后的组织;
7.所述培养基ii由在人多潜能干细胞培养基中添加y-27632得到;其中,y-27632在所述培养基ii中的含量为10μm;
8.2)将所述培养基ii培养后的组织在n2培养基中进行培养,得到n2培养基培养后的组织;
9.所述n2培养基由在dmem-f12培养基中添加n2 supplement(100x)和100x neaa得到,n2 supplement(100x)在所述n2培养基中的体积百分含量为1%,100x neaa在所述n2培养基中的体积百分含量为1%;
10.3)将所述n2培养基培养后的组织在n2 lamin培养基中进行培养,得到n2 lamin培养基培养后的组织;
11.所述n2 lamin培养基由在所述n2培养基中添加lamin得到,lamin在所述n2 lamin培养基中的浓度为1μg/ml;
12.4)利用胶原酶iv处理所述n2 lamin培养基培养后的组织,得到胶原酶iv处理后的组织;将所述胶原酶iv处理后的组织利用n2b27培养基进行培养,得到n2b27培养基培养后的组织;
13.所述n2b27培养基由在dmem-f12培养基中添加n2 supplement(100x)、b27 supplement(50x)、ra和人成纤维细胞生长因子-2得到,其中,n2 supplement(100x)在所述n2b27培养基中的体积百分含量为1%,b27 supplement(50x)在所述n2b27培养基中的体积
含量为1/50,ra在所述n2b27培养基中的含量为0.2μm,人成纤维生长因子-2在所述n2b27培养基中的含量为20ng/ml;
14.5)将所述n2b27培养基培养后的组织进行消化,得到消化后的细胞;将所述消化后的细胞在所述在神经元培养基中进行培养,得到兴奋性神经元;
15.所述神经元培养基由向dmem-f12培养基中添加n2 supplement(100x)、b27 supplement(50x)、bdnf、gdnf、camp、抗坏血酸得到,其中,n2 supplement(100x)在所述神经元培养基中的体积百分含量为1%,b27 supplement(50x)在所述神经元培养基中的体积含量为1/50,bdnf在所述神经元培养基中的含量为10ng/ml,gdnf在所述神经元培养基中的含量为10ng/ml,camp在所述神经元培养基中的含量为1μm,抗坏血酸在所述神经元培养基中的含量为200nm。
16.其中,所述兴奋性神经元可为map2和vglut1阳性兴奋性神经元。
17.上述方法步骤1)中,在所述多能干细胞培养前,还可包括对所述干细胞进行消化的步骤。
18.步骤3)中所述培养可在基质胶包被的培养板中进行。
19.步骤5)中所述培养可在鸟氨酸和laminin包被的培养板中进行。
20.所述人多能干细胞可为诱导性多能干细胞(hipsc)、成体(adult)干细胞、体性(somatic)干细胞、癌症干细胞或具有分化能力的任何其他多能干细胞。
21.上述方法步骤1)-5)中培养均可在37℃,5%co2的条件下进行。
22.上述方法步骤1)中培养的时间可为3天。
23.步骤2)中培养的时间可为4天。
24.步骤3)中培养的时间可为7天。
25.步骤4)中培养的时间可为6天。
26.步骤5)中培养的时间可为19-20天。
27.本发明还提供了一种制备抑制性神经元的方法,所述方法包括:
28.1)将人胚胎干细胞在hes培养基中进行培养,得到hes培养基培养后的组织;
29.所述hes培养基由向dmem-f12培养基中添加100x neaa、血清替代物和β-巯基乙醇得到,100x neaa在所述hes培养基中的体积百分含量为1%,血清替代物在所述hes培养基中的体积百分比浓度为20%,β-巯基乙醇在所述hes培养基中的浓度为0.1mm;
30.2)将所述hes培养基培养后的组织在nim培养基中进行培养,得到nim培养基培养后的组织1;
31.所述nim培养基由向dmem-f12培养基中添加n2 supplement(100x)、100x neaa和肝素得到,其中,n2 supplement(100x)在所述nim培养基中的体积百分含量为1%,100x neaa在所述nim培养基中的体积百分含量为1%,肝素在所述nim培养基中的含量为2μg/ml;
32.3)将所述nim培养基培养后的组织1在基质胶包被的培养板中利用所述nim培养基进行培养,得到nim培养基培养后的组织2;
33.4)利用胶原酶iv处理步骤3)所得所述nim培养基培养后的组织2,得到胶原酶iv处理后的组织;将所述胶原酶iv处理后的组织利用nim pur培养基进行培养,得到nim pur培养基培养后的组织;
34.所述nim pur培养基由向所述nim培养基中添加purmorphamine得到,
purmorphamine在所述nim pur培养基中的含量为0.65μm;
35.5)将所述nim pur培养基培养后的组织进行消化,得到消化后的细胞;将所述消化后的细胞在vpa培养基中进行培养,得到vpa培养基培养后的细胞;
36.所述vpa培养基由向neurobasal培养基中添加100x glutamax和丙戊酸得到,其中,100x glutamax在所述vpa培养基中的体积百分含量为1%,丙戊酸在所述vpa培养基中的含量为10μm;
37.6)将所述vpa培养基培养后的细胞在ndm培养基进行培养,得到抑制性神经元;
38.所述ndm培养基由向neurobasal培养基中添加n2 supplement(100x)、b27supplement(50x)、100x glutamax、bdnf、gdnf、camp和igf1得到,其中,n2 supplement(100x)在所述ndm培养基中的体积百分含量为1%,b27 supplement(50x)在所述ndm培养基中的体积含量为1/50,100x glutamax在所述ndm培养基中的体积百分含量为1%,bdnf在所述ndm培养基中的含量为10ng/ml,gdnf所述ndm培养基中的含量为10ng/ml,camp所述ndm培养基中的含量为1μm,igf1所述ndm培养基中的含量为10ng/ml。
39.上述方法步骤1)中,在所述多能干细胞培养前,还可包括对所述干细胞进行消化的步骤。
40.步骤5)中所述培养可在鸟氨酸和laminin包被的培养板中进行。
41.上述方法步骤1)-6)中培养均可在37℃,5%co2的条件下进行。
42.上述方法步骤1)中培养的时间可为4天。
43.步骤2)中培养的时间可为3天。
44.步骤3)中培养的时间可为5天。
45.步骤4)中培养的时间可为14天。
46.步骤5)中培养的时间可为6天。
47.步骤6)中培养的时间可为15天。
48.所述抑制性神经元可为gaba抑制性神经元。
49.所述抑制性神经元具体可为nkx2.1和foxg1阳性抑制性神经元。
50.本发明还提供了一种试剂盒,所述试剂盒包括所述培养基ii、所述n2培养基、所述n2 lamin培养基、所述n2b27培养基与所述神经元培养基,或,包括所述hes培养基、所述nim培养基、所述nim pur培养基,所述vpa培养基与所述ndm培养基。
51.所述试剂盒在制备兴奋性神经元或抑制性神经元中的应用,或在制备诱导产生兴奋性神经元或抑制性神经元产品中的应用,也属于本发明的保护范围。
52.上文中,人多潜能干细胞培养基可为北京赛贝生物技术有限公司产品,#ca1007500。
53.y-27632可为selleck产品,cat.no.s1049。
54.dmem-f12培养基可为gibco-brl产品,cat.no.11330。
55.lamin可为invitrogen产品,cat.no.23017-015。
56.胶原酶iv可为gibio产品,cat.no.17104019。
57.b27 supplement(50x)可为gibco-brl产品,cat.no.17504044。
58.ra可为sigma产品,cat.no.r2625。
59.kosr可为gibco-brl产品,cat.no.10828。
60.purmorphamine可为calbiochem产品,cat.no.540220。
61.neurobasal培养基可为gibco-brl产品,cat.no.21103049。
62.n2 supplement(100x)可为gibco-brl产品,货号为17502-048。
63.100x neaa,即100xmem non-essential amino acids solution(neaa),gibco-brl产品,货号为11140。
64.100x glutamax可为gibco-brl产品,货号为35050。
65.本发明提供了产生兴奋性神经元和产生的抑制性神经元的方法,本发明的方法简单,能够有效减少诱导时间,同时能定向分化为单一方向的神经元,指向性明确。为研究人类大脑皮层发育做出贡献。
66.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
附图说明
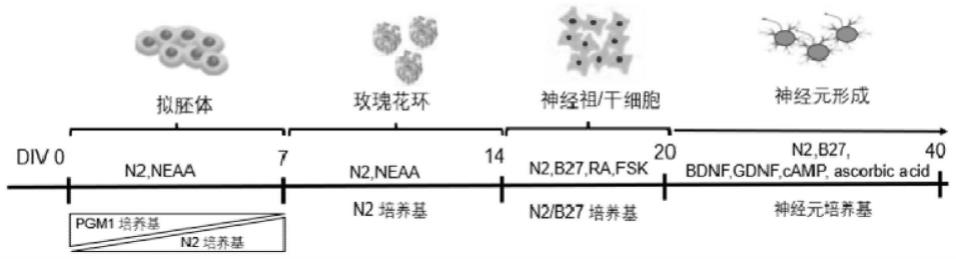
67.图1为人诱导多能干细胞诱导产生成熟兴奋性神经元的流程图。
68.图2为分化为神经干细胞阶段的免疫荧光染色图。其中,dapi(蓝色)染色细胞核(左侧第一幅图),nestin(绿色)染色神经干细胞(左侧第二幅图),brdu(红色)染色增殖细胞(左侧第三幅图)。
69.图3为分化为兴奋性神经元阶段的免疫荧光染色图。其中dapi(蓝色)染色细胞核(左侧第一幅图),map2(绿色)染色神经元(左侧第二幅图),vglut1(红色)染色兴奋性神经元(左侧第三幅图)。最右侧图为兴奋性神经元的分化效率统计结果。
70.图4为人诱导多能干细胞诱导产生成熟抑制性神经元的流程图。
71.图5为前脑gaba中间神经元前体细胞免疫荧光染色图。其中,dapi(蓝色)染色细胞核(左侧第一幅图),foxg1(绿色)染色前脑(左侧第二幅图),nkx2.1(红色)染色内侧神经节的隆起(mge)(左侧第三幅图)。
72.图6为分化为抑制性神经元阶段的免疫荧光染色图。其中dapi(蓝色)染色细胞核(左侧第一幅图),map2(绿色)染色神经元(左侧第二幅图),gaba(红色)染色抑制性神经元(左侧第三幅图)。最右侧图为抑制性性神经元分化效率统计结果。
具体实施方式
73.以下实施例中的试验,均设置三次重复实验。
74.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。
75.下述实施例中,加湿培养箱的湿度为95%。
76.下述实施例中所用的材料、试剂、仪器等,如无特殊说明,均可从商业途径得到。
77.1、下述实施例中所用的试剂:
78.(1)人多潜能干细胞培养基(pgm1培养基)(北京赛贝生物技术有限公司,#ca1007500)。
79.(2)1
×
磷酸盐缓冲液(pbs)(磷酸二氢钾144mg/l,氯化钠9000mg/l,磷酸氢二钠
795mg/l,ph7.4)(invitrogen,#10010023)。
80.(3)accutase细胞消化液(bd,#561527)。
81.(4)抗坏血酸(ascorbic acid)(sigma,cat.no.a4403)。
82.(5)b27 supplement(50x)(gibco-brl,cat.no.17504044)。
83.(6)脑源性生长因子(bdnf)(peprotech,cat.no.450-02)。
84.(7)β-巯基乙醇(2-me,14.3m,sigma,cat.no.m7522)。
85.(8)环磷酸腺苷(camp)(sigma,cat.no.d-0260)。
86.(9)dulbecco’s modified eagle培养基/nutrient mixture f-12(dmem-f12)(1:1)(gibco-brl,cat.no.11330)。
87.(10)人成纤维细胞生长因子-2(fgf2)(peprotech,cat.no.100-18b)。
88.(11)胶质细胞源性神经营养因子(gdnf)(peprotech,cat.no.450-10)。
89.(12)肝素(sigma,cat.no.h3149)。
90.(13)胰岛素样生长因子(igf1)(peprotech,cat.no.100-11)。
91.(14)血清替代物(kosr)(gibco-brl,cat.no.10828)。
92.(15)100x glutamax(200mm l-丙氨酰-l-谷氨酰胺二肽,0.85%nacl)(gibco-brl,cat.no.35050)。
93.(16)100xmem non-essential amino acids solution(neaa)(甘氨酸10mm,左旋丙氨酸10mm,左旋天冬酰胺酶10mm,左旋天门冬氨酸10mm,左旋谷氨酸10mm,左旋脯氨酸10mm,左旋丝氨酸10mm)(gibco-brl,cat.no.11140)。
94.(17)n2 supplement(100x)(人转铁蛋白(整体)10000mg/l,重组胰岛素全链500mg/l,黄体酮0.63mg/l,腐胺1611mg/l,亚硒酸盐0.52mg/l)(gibco-brl,cat.no.17502-048)。
95.(18)purmorphamine(calbiochem,cat.no.540220)。
96.(19)ra(sigma,cat.no.r2625)。
97.(20)neurobasal培养基(gibco-brl,cat.no.21103049)。
98.(21)y-27632(selleck,cat.no.s1049)。
99.(22)4%多聚甲醛溶液(北京润泽康生物科技有限公司,cat.no.b1057-100)。
100.(23)大鼠抗brdu抗体(abcam,cat.no.ab6326)。
101.(24)鼠抗nestin抗体(santacruz,cat.no.sc-23927)。
102.(25)兔抗foxg1抗体(abcam,cat.no.ab18259)。
103.(26)鼠抗nkx2.1抗体(millipore,cat.nomab5460)。
104.(27)鸡抗map2抗体(bio-legend,cat.no822501)。
105.(28)兔抗vgult1抗体(abcam,cat.noab227805)。
106.(29)兔抗gaba抗体(abcam,cat.noab230136)。
107.(30)alexa fluor 568标记羊抗大鼠igg(h l)二抗(life,cat.no.a11077)。
108.(31)alexa fluor 488标记羊抗鼠igg(h l)二抗(life,cat.no.a11001)。
109.(32)alexa fluor 568标记羊抗兔igg(h l)二抗(life,cat.no.a11011)。
110.(33)alexa fluor 488标记羊抗兔igg(h l)二抗(life,cat.no.a11034)。
111.(34)alexa fluor 568标记羊抗鼠igg(h l)二抗(life,cat.no.a11004)。
112.(35)alexa fluor 488标记羊抗鸡igg(h l)二抗(life,cat.no.a11039)。
113.(36)鸟氨酸(poly-l-ornithine hydrobromide)(sigma-aldrich,cat.no.p3655)。
114.(37)lamin 1mg/ml(invitrogen,cat.no.23017-015)。
115.(38)基质胶(matrigel)(bd,cat.no.356234)。
116.(39)tritonx-100(sigma-aldrich,#hpa014518)。
117.(40)胶原酶iv(gibio,cat.no.17104019)。
118.(41)丙戊酸(mce,cat.no.hy-10585)。
119.(42)人胚胎干细胞(北京赛贝生物技术有限公司,#ca4001106)。
120.2.下述实施例中所用的培养基以及相关试剂的配置:
121.培养基i:人多潜能干细胞培养基(pgm1培养基)。
122.培养基ii:培养基ii由在pgm1培养基中添加y-27632得到;其中,y-27632在培养基ii中的含量为10μm。
123.n2培养基:n2培养基由在dmem-f12培养基中添加n2 supplement(100x)和100xneaa得到,n2 supplement(100x)在n2培养基中被稀释100倍,100x neaa在n2培养基中被稀释100倍。在n2培养基中,n2 supplement(100x)的体积百分含量为1%;100x neaa中的甘氨酸、左旋丙氨酸、左旋天冬酰胺酶、左旋天门冬氨酸、左旋谷氨酸、左旋脯氨酸和左旋丝氨酸的浓度均为0.1mm。
124.n2 lamin培养基:n2 lamin培养基由在n2培养基中添加lamin得到,lamin在n2 lamin培养基中的浓度为1μg/ml。
125.n2b27培养基:n2b27培养基由在dmem-f12培养基中添加n2 supplement(100x)、b27supplement(50x)、ra和人成纤维细胞生长因子-2得到,其中,n2 supplement(100x)在n2b27培养基中被稀释100倍,b27 supplement(50x)在n2b27培养基中被稀释50倍,ra在n2b27培养基中的含量为0.2μm,人成纤维生长因子-2在n2b27培养基中的含量为20ng/ml。在n2b27培养基中,n2 supplement(100x)的体积百分含量为1%,b27 supplement(50x)的体积含量为1/50。
126.神经元培养基:神经元培养基由向dmem-f12培养基中添加n2 supplement(100x)、b27supplement(50x)、脑源性生长因子(bdnf)、胶质细胞源性神经营养因子(gdnf)、环磷酸腺苷(camp)、抗坏血酸(ascorbic acid)得到,其中,n2 supplement(100x)在神经元培养基中被稀释100倍,b27 supplement(50x)在神经元培养基中被稀释50倍,bdnf在神经元培养基中的含量为10ng/ml,gdnf在神经元培养基中的含量为10ng/ml,camp在神经元培养基中的含量为1μm,抗坏血酸在神经元培养基中的含量为200nm。在神经元培养基中,n2 supplement(100x)的体积百分含量为1%,b27 supplement(50x)的体积含量为1/50。
127.hes培养基:hes培养基由向dmem-f12培养基中添加100xneaa、kosr和β-巯基乙醇得到,100xneaa在hes培养基中被稀释100倍,kosr在hes培养基中的体积百分比浓度为20%,β-巯基乙醇在hes培养基中的浓度为0.1mm。在hes培养基中,100x neaa中的甘氨酸、左旋丙氨酸、左旋天冬酰胺酶、左旋天门冬氨酸、左旋谷氨酸、左旋脯氨酸和左旋丝氨酸的浓度均为0.1mm。
128.nim培养基:nim培养基由向dmem-f12培养基中添加n2 supplement(100x)、
100xneaa和肝素得到,其中,n2 supplement(100x)在nim培养基中被稀释100倍,100xneaa在nim培养基中被稀释100倍,肝素在nim培养基中的含量为2μg/ml。在nim培养基中,n2supplement(100x)的体积百分含量为1%;100x neaa中的甘氨酸、左旋丙氨酸、左旋天冬酰胺酶、左旋天门冬氨酸、左旋谷氨酸、左旋脯氨酸和左旋丝氨酸的浓度均为0.1mm。
129.nim pur培养基:nim pur培养基由向nim培养基中添加purmorphamine得到,purmorphamine在nim pur培养基中的含量为0.65μm。
130.vpa培养基:vpa培养基由向neurobasal培养基中添加100x glutamax和丙戊酸得到,其中,100xglutamax在vpa培养基中被稀释100倍,丙戊酸在vpa培养基中的含量为10μm。在vpa培养基中,100x glutamax的l-丙氨酰-l-谷氨酰胺二肽的浓度为2mm,0.0085%nacl。
131.ndm培养基:该培养基由向neurobasal培养基中添加n2 supplement(100x)、b27supplement(50x)、100x glutamax、脑源性生长因子(bdnf)、胶质细胞源性神经营养因子(gdnf)、环磷酸腺苷(camp)、胰岛素样生长因子(igf1)得到,其中,n2 supplement(100x)在ndm培养基中被稀释100倍,b27 supplement(50x)在ndm培养基中被稀释50倍,100xglutamax在ndm培养基中被稀释100倍,bdnf在ndm培养基中的含量为10ng/ml,gdnf在ndm培养基中的含量为10ng/ml,camp的含量为1μm,igf1在ndm培养基中的含量为10ng/ml。在ndm培养基中,n2 supplement(100x)的体积百分含量为1%;100x glutamax的l-丙氨酰-l-谷氨酰胺二肽的浓度为2mm,0.0085%nacl,b27 supplement(50x)的体积含量为1/50。
132.人成纤维生长因子(fgf2)(100μg/ml):溶解1mgbfgf于10ml hesc培养基,分装500μl
×
20管,每次取出一管加hescm至5ml,分装,每管200μl。
133.肝素(1mg/ml):溶解10mg heparin于10ml dmem/f12,0.22um滤膜过滤,分装后存储于-20度冰箱,可存储3个月以上。
134.基质胶(matrigel):冰上分装200μl/每管。使用时,加入49.8ml冷的dmem-f12,混匀后铺在板上。
135.purmorphamine(10mm):将5mg purmorphamine溶于480μl 100%乙醇和480μldmso,分装后存储于-20度,可储存8周以上。
136.ra(100mm):溶解50mg ra于1.67ml dmso中。分装50μl每管,避光保存于-80度六周以上。用4.95ml 100%乙醇稀释浓储为工作浓度。可置于-20度保存两周以上。注意工作液不要超过两周。
137.胶原酶iv collagenase分装:每管1000mg的胶原酶中加入50mldmem-f12培养基,轻轻旋涡震荡使其充分溶解,制备成20mg/ml(即20
×
)的储存液。然后用低蛋白结合性的0.22μm的滤膜过滤除菌,分装成小份量,然后于-20℃避光冻存。使用前于冰上解冻,避免反复冻融。其用于组织和细胞分散的常用浓度为:0.5-2.5mg/ml,需要根据特定的实验条件或者参考相应的文献资料确定所需的最佳工作浓度。
138.鸟氨酸过夜包被50μg/ml,鸟氨酸可溶于水(50mg/ml),产生澄清溶液。
139.laminin原液浓度为500μg/ml,用dmem/f12稀释,每100μl用2.5ml的dmem/f12稀释。
140.封闭液的配制方法如下:取40ml1
×
磷酸盐缓冲液,称取1g牛血清白蛋白,振荡混匀至完全溶解后,加入0.15mltriton x-100,再加入1
×
磷酸盐缓冲液定容至50ml,混合均匀后0.22μm过滤器过滤,4℃保存。
141.实施例1、诱导hescs分化为兴奋性神经元
142.本实施例诱导hescs向兴奋性神经元方向分化,示意图如图1所示,具体步骤如下:
143.一.hescs分化为兴奋性神经元的诱导
144.(1)接种:培养人胚胎干细胞,待细胞长至可以传代时,pbs轻柔的洗一遍,加1ml accutase细胞消化液在37℃、5%co2的加湿培养箱中消化细胞消化5min,消化2-3min时拿出来拍一下,如未脱落可轻轻吹打,先加一半的pgm1培养基,220g 3min离心,后弃上清液。
145.(2)成球:加入培养基ii重悬细胞进新的六孔板中,再补加1ml培养基ii,放入37℃、5%co2的加湿培养箱中静置成球,当天记作day0(即第0天),培养至day3。
146.(3)拟胚体形成:day3吸走原有的培养基,加入n2培养基37℃、5%co2的加湿培养箱中培养。用n2培养基隔天换液直至day7,得到拟胚体(eb球)。注:倾斜静置1min,直接吸走上清即可。
147.(4)形成玫瑰花环:day7准备好用基质胶包被的六孔板,将之前六孔板中所有成的eb球重悬至基质胶包被的板子中,自然沉降后弃上清,用n2 lamin培养基重悬后继续在37℃、5%co2的加湿培养箱中培养,隔天会形成玫瑰花环(类似荷包蛋样),从day7开始用n2 lamin培养基培养隔天换液直至day14。
148.(5)神经祖/干细胞形成:day14弃掉部分培养基,在剩余培养基中加入胶原酶iv(胶原酶iv在培养体系中的浓度为20mg/ml),然后放入37℃、5%co2的加湿培养箱消化20-30min(每5min轻轻拍一下,10min后可见中央厚实球体—蛋黄开始脱落),当每个eb球中央的球体慢慢脱落后,用n2b27培养基将所有球重悬至低吸附的六孔板中,放入37℃、5%co2的加湿培养箱培养,用n2b27培养基隔天换液至day20。胶原酶iv消化20min,每5min拍一下,吸到离心管沉降3min后去上清重悬,1:1传代。
149.(6)神经元的形成:day20,将步骤(5)培养结束后六孔板中所有的神经球收集于ep管中,吸走上清,用预热的accutase细胞消化液消化8min后,吸走accutase细胞消化液,用pbs清洗一遍,然后用1mln2b27培养基吹打所有球体4-5下,接种到六孔板中,在n2b27培养基中培养1天,24h后收集小的神经球,弃掉上清,用预热的accutase细胞消化液消化8min后,吸走accutase细胞消化液,用pbs清洗一遍,然后用1mln2b27培养基吹打所有球体4-5下,将吹打的单细胞计数,然后重悬到包被过鸟氨酸和laminin的六孔板中(六孔板需提前用鸟氨酸和laminin包被至少4h以上)培养,板中提前加入2ml神经元培养基。之后隔天换入新鲜的神经元培养基。
150.(7)day40检测检测兴奋性神经元,统计分化效率(见图3)。
151.二.对神经干细胞进行免疫荧光染色
152.步骤一的(5)培养结束后,吸弃上清培养基,加入500μl4%多聚甲醛溶液固定20分钟。用500μl 1
×
磷酸盐缓冲液漂洗三次,每次5分钟,吸弃上清。加入500μl封闭液,室温封闭1小时。吸弃封闭液,加入200μl新的封闭液,按1:1000加入大鼠抗brdu抗体和鼠抗nestin抗体(两种抗体稀释相同倍数同步加入),4℃孵育12小时。吸弃上清,用500μl1
×
磷酸盐缓冲液漂洗三次,每次5分钟。吸弃上清,加入200μl新的封闭液,按1:1000比例同时加入dapi,alexa fluor 488标记羊抗鼠igg(h l)二抗和alexa fluor 568羊抗大鼠igg(h l)二抗(两种抗体稀释相同倍数同步加入),避光孵育两小时后,吸弃上清,用500μl 1
×
磷酸盐缓冲液避光漂洗三次,每次5分钟。将玻片挑起,用抗淬灭封片剂封片后,利用荧光显微镜观察染色
情况,能够成功染出来神经祖/干细胞的标记基因(即brdu和nestin基因,见图2),说明,成功分化出brdu和nestin阳性神经祖/干细胞。
153.三.对成熟兴奋性神经元进行免疫荧光染色
154.步骤一的(7)培养结束后,将所得培养产物按照步骤二的方法进行免疫荧光染色,将“大鼠抗brdu抗体和鼠抗nestin抗体”替换为“鸡抗map2抗体和兔抗vglut1抗体”,将“alexa fluor 488标记羊抗鼠igg(h l)二抗和alexa fluor 568羊抗大鼠igg(h l)二抗”替换为“alexa fluor 568标记羊抗兔igg(h l)二抗和alexa fluor 488标记羊抗鸡igg(h l)二抗”。封片后,利用荧光显微镜观察染色情况,能够成功染色出来兴奋性神经元的标记基因(即map2和vglut1基因,见图3)。说明,本实施例成功获得了map2和vglut1阳性兴奋性神经元,所得兴奋性神经元占总细胞的80%以上。
155.实施例2、诱导hescs分化为抑制性神经元
156.本实施例诱导hescs向抑制性神经元方向分化,示意图如图4所示,具体步骤如下:
157.一.hescs分化为抑制性神经元的诱导
158.(1)接种:培养人胚胎干细胞,待细胞长至可以传代时,pbs轻柔的洗一遍,加1ml accutase细胞消化液在37℃、5%co2的加湿培养箱中消化细胞消化5min,消化2-3min时拿出来拍一下,如未脱落可轻轻吹打,先加一半的pgm1培养基,220g 3min离心,后弃上清液。
159.(2)拟胚体形成:加入hes培养基重悬细胞进新的六孔板中,再补加1mlhes培养基,放入37℃、5%co2的加湿培养箱中静置成球(即eb球),当天记作day0(即第0天)。day4吸走原有的培养基,加入nim培养基37℃、5%co2的加湿培养箱中培养。用nim培养基隔天换液直至day7。注:倾斜静置1min,直接吸走上清即可。
160.(3)玫瑰花环形成:day7准备好用基质胶包被的六孔板,将之前六孔板中所有成的eb球重悬至基质胶包被的板子中,自然沉降后弃上清,用nim培养基重悬后继续在37℃、5%co2的加湿培养箱中培养,隔天会形成玫瑰花环(类似荷包蛋样),从day7开始用nim培养基培养隔天换液直至day12。
161.(4)gaba中间神经前体细胞形成:day12,弃掉部分培养基,在剩余培养基中加入胶原酶iv(胶原酶iv在培养体系中的浓度为20mg/ml),放入37℃、5%co2的加湿培养箱消化20-30min(每5min轻轻拍一下,10min后可见中央厚实球体—蛋黄开始脱落),当每个eb球中央的球体(即神经球)慢慢脱落后,用nim pur培养基将所有球重悬至低吸附的六孔板中,放入37℃、5%co2的加湿培养箱培养,用nim pur培养基隔天换液至day26。
162.(5)gaba中间神经元前体形成:day26准备好预热的accutase细胞消化液,提前用50μg/ml鸟氨酸和laminin包被六孔板,鸟氨酸和laminin都必须包被过4hr以上。将步骤(4)培养结束后六孔板中所有的神经球收集于ep管中,吸走上清,用预热的accutase细胞消化液消化8min后,吸走accutase细胞消化液,用pbs清洗一遍,然后用1mlvpa培养基吹打所有球体4-5下,将吹打的单细胞计数,然后重悬到包被过鸟氨酸和laminin的板子中培养至day32,板中提前加入2mlvpa培养基。之后隔天换液,培养一周。
163.(6)gaba抑制性神经元形成:day32换成ndm培养基继续培养,day47检测抑制性神经元,并统计分化效率(见图6)。
164.二.前脑gaba中间神经元前体细胞免疫荧光染色
165.步骤一的(5)培养结束后,吸弃上清培养基,加入500μl4%多聚甲醛溶液固定20分
钟。用500μl 1
×
磷酸盐缓冲液漂洗三次,每次5分钟,吸弃上清。加入500μl封闭液,室温封闭1小时。吸弃封闭液,加入200μl新的封闭液,按1:1000比例同步加入鼠抗nkx2.1抗体和兔抗foxg1抗体(两种抗体稀释相同的倍数),4℃孵育12小时。吸弃上清,用500μl1
×
磷酸盐缓冲液漂洗三次,每次5分钟。吸弃上清,加入200μl新的封闭液,按1:1000比例同步加入dapi,alexa fluor 488标记羊抗兔igg(h l)二抗和alexa fluor 568羊抗鼠igg(h l)二抗(两种抗体稀释相同的倍数),避光孵育两小时后,吸弃上清,用500μl1
×
磷酸盐缓冲液避光漂洗三次,每次5分钟。将玻片挑起,用抗淬灭封片剂封片后,利用荧光显微镜观察染色情况,能够成功染色出gaba中间神经元前体细胞的标记基因(即nkx2.1和foxg1基因,见图5),即说明成功分化出nkx2.1和foxg1阳性的gaba中间神经元前体细胞。
166.三.对gaba抑制性神经元进行免疫荧光染色
167.步骤一的(6)培养结束后,将所得培养产物按照步骤二的方法进行免疫荧光染色,将“鼠抗nkx2.1抗体和兔抗foxg1抗体”替换为“鸡抗map2抗体和兔抗gaba抗体”,将“alexa fluor 488标记羊抗兔igg(h l)二抗和alexa fluor 568羊抗鼠igg(h l)二抗”替换为“alexa fluor 568标记羊抗兔igg(h l)二抗和alexa fluor 488标记羊抗鸡igg(h l)二抗”。封片后,利用荧光显微镜观察染色情况,能够成功染色出gaba抑制性神经元细胞的标记基因(即map2和gaba基因,见图6)。说明,本实施例成功获得了map2和gaba阳性的gaba抑制性神经元细胞,分化效率统计结果显示gaba抑制性神经元细胞的分化效率达85%以上(见图6)。
168.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。