1.本发明属于吲哚酮类衍生物技术领域,具体涉及一种吲哚酮类化合物及其制备方法和应用。
背景技术:
2.癌症对人类生命造成威胁,其发病率随着年龄的增长而显著升高,而随着我国步入老龄化社会,癌症患者的数量势必会逐年增长。
3.p53基因是迄今为止已发现的与人肿瘤发生相关性最高的抑癌基因,其通过调控dna修复、细胞周期停滞和诱导细胞凋亡,来维持基因组和细胞稳定,进而抑制肿瘤生长。鼠双微体(murine double minute,mdm)家族中的mdm2及mdmx在肿瘤发生、发展中具有重要作用,尤其是在p53的调节中,能与p53蛋白结合从而抑制p53的功能。mdm2与mdmx具有相似的蛋白结构域,两者都有p53结合域、酸性域、锌指结构、环状结构域,使设计mdm2-p53及mdmx-p53蛋白-蛋白相互作用的双重抑制剂成为了可能。阻断mdm2-p53及mdmx-p53的相互作用,激活p53,恢复其功能,是一种很有前途的恶性肿瘤治疗策略。
4.因此,研究具有mdm2及mdmx双重抑制作用的抑制剂剂,对多种癌症(例如结直肠癌、胃癌、食道癌、乳腺癌、肺癌、肝癌、卵巢癌等)及其并发症的治疗具有重要意义。
技术实现要素:
5.为了解决上述技术问题,本发明提供了一种吲哚酮类化合物及其制备方法和应用,该吲哚酮类化合物能够显著的抑制mdm2及mdmx的活性,从而激活p53功能,有效的抑制肿瘤细胞的增殖,具有一定的抗肿瘤价值。
6.本发明具体是通过如下技术方案来实现的。
7.本发明的第一个目的是提供一种吲哚酮类化合物,其结构式如式i-a或式i-b所示:
[0008][0009]
其中,r1选自氢、卤素、硝基或c1~c6烷基,优选的,r1为氢;
[0010]
r2和r3分别独立的选自氢、卤素、羟基、硝基、c1~c6烷基、甲氧基、氰基或三氟甲基,优选的,r2和r3分别独立的选自氢、卤素、c1~c6烷基;
[0011]
优选的,当r2和r3分别独立的选自卤素时,其为氟、氯或溴,更优选的,为氯;
[0012]
优选的,当r2和r3分别独立的选自c1~c6烷基时,其为甲基或乙基,更优选的,为甲基。
[0013]
优选的,当r1选自c1~c6烷基时,其为甲基。
[0014]
优选的,当r1选自卤素时,其为氯或溴。
[0015]
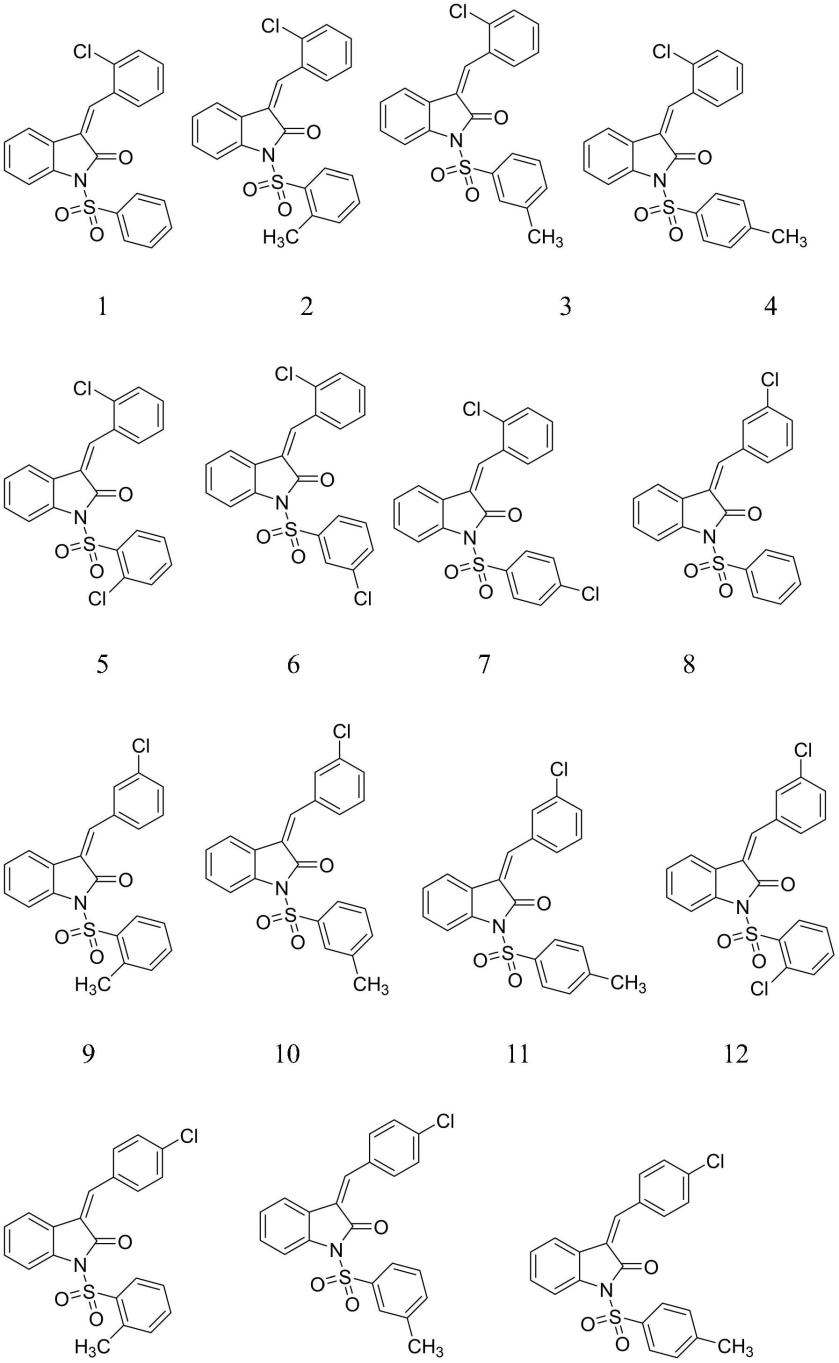
优选的,所述式i-a和式i-b具体为以下化合物:
[0016]
[0017][0018]
本发明的第二个目的是提供上述吲哚酮类化合物的制备方法,所述式i-a化合物或所述i-b化合物通过以下方法制备:
[0019]
s1、以式ia化合物和式iia化合物为原料,通过缩合反应制备式iiia化合物;
[0020]
s2、式iiia化合物和式iva化合物为原料,通过磺酰化反应制备式i-a化合物;或:
[0021]
式iiia化合物和式ivb化合物为原料,通过酰化反应制备式i-b化合物;
[0022]
其合成路线如下:
[0023][0024]
优选的,s1中,反应在氢氧化钠碱性条件下进行,且式ia化合物和氢氧化钠的摩尔比为1:1,所述式ia化合物和式iia化合物的摩尔比为1:1。
[0025]
优选的,s2中,所述iiia化合物和式iva化合物或式ivb化合物的摩尔比为1:2,所述磺酰化反应或所述酰化反应均在氢氧化钠碱性条件下进行,且所述式iiia化合物和氢氧化钠的摩尔比均为1:1。
[0026]
本发明的第三个目的是提供上述吲哚酮类化合物在制备mdm2及mdmx双重活性抑制剂中的应用。优选的,上述化合物6、7、8、12、16和17在制备mdm2及mdmx双重活性抑制剂中的应用。
[0027]
本发明与现有技术相比具有如下有益效果:
[0028]
(1)基于背景技术中所阐述的,目前阻断mdm2-p53及mdmx-p53的相互作用,激活p53,恢复其功能,是一种很有前途的恶性肿瘤治疗策略;基于此研究机理,本发明提供了一种吲哚酮类衍生物,该吲哚酮类化合物能够显著的抑制mdm2及mdmx的活性,从而激活p53功能,有效的抑制肿瘤细胞的增殖,具有一定的抗肿瘤价值;
[0029]
(2)本发明提供的上述化合物合成方法简单,原料易得,反应条件温和,且后处理简单,适合进一步研究使用。
具体实施方式
[0030]
为了使本领域技术人员更好地理解本发明的技术方案能予以实施,下面结合具体实施例和数据对本发明作进一步说明,但所举实施例不作为对本发明的限定。
[0031]
下述各实施例中所述实验方法和检测方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可在市场上购买得到。
[0032]
一种吲哚酮类化合物,其结构式如式i-a或式i-b所示:
[0033][0034]
r1选自氢、氯、溴、硝基、甲基、乙基,r2和r3独立的选自氢、氟、氯、溴、羟基、硝基、甲基、乙基、甲氧基、氰基、三氟甲基。
[0035]
所述式i-a化合物或所述i-b化合物通过以下方法制备:
[0036]
s1、以式ia化合物和式iia化合物为原料,通过缩合反应制备式iiia化合物;
[0037]
s2、式iiia化合物和式iva化合物为原料,通过磺酰化反应制备式i-a化合物;或:
[0038]
式iiia化合物和式ivb化合物为原料,通过酰化反应制备式i-b化合物;
[0039]
其合成路线如下:
[0040][0041]
所述式i-a和式i-b具体为以下化合物:
[0042]
[0043][0044]
下面首先提供中间体的制备方法
[0045]
中间体25的合成
[0046]
将2-吲哚酮(5.00g,37.55mmol)置于250ml三颈瓶中,加入150ml无水乙醇搅拌溶解,加入氢氧化钠(1.50g,37.55mmol)搅拌30min,再加入邻氯苯甲醛(5.28g,37.55mmol),60℃条件下搅拌4h。将反应液倒入到冰水中搅拌,析出固体,抽滤,得到黄色固体8.18g,收率85.2%。1h nmr(400mhz,dmso):δ7.77-7.74(m,1h),7.63(dd,j=7.8,1.9hz,1h),7.57(s,1h),7.52-7.47(m,2h),7.22(td,j=7.7,1.0hz,1h),7.12(d,j=7.6hz,1h),6.86(d,j
=7.7hz,1h),6.79(td,j=7.6,0.9hz,1h);
13
c nmr(100mhz,dmso):δ167.90,143.06,132.66,131.19,131.03,130.42,130.01,129.61,129.38,127.21,122.34,121.02,120.31,110.07;ms(esi):[m h]
m/z256.05.
[0047][0048]
中间体26的合成
[0049]
将2-吲哚酮(5.0g,37.55mmol)置于250ml三颈瓶中,加入150ml无水乙醇搅拌溶解,加入氢氧化钠(1.50g,37.55mmol)搅拌30min,再加入间氯苯甲醛(5.28g,37.55mmol),60℃条件下搅拌4h。将反应液倒入到冰水中搅拌,析出固体,抽滤,得到黄色固体7.61g,收率79.3%。1h nmr(400mhz,dmso):δ10.64(s,1h),7.78-7.64(m,2h),7.57-7.47(m,2h),7.38(d,j=7.5hz,1h),7.24-6.96(m,2h),6.87-6.80(m,2h);
13
c nmr(100mhz,dmso):δ165.82,144.72,141.08,138.51,138.03,131.95,131.62,130.37,128.75,127.14,126.47,124.24,122.48,114.21,110.57;hrms calcd for c
15h11
clno(m h)
256.0529,found 256.0531.
[0050][0051]
中间体27的合成
[0052]
将2-吲哚酮(5.0g,37.55mmol)置于250ml三颈瓶中,加入150ml无水乙醇搅拌溶解,加入氢氧化钠(1.50g,37.55mmol)搅拌30min,再加入对氯苯甲醛(5.28g,37.55mmol),60℃条件下搅拌4h。将反应液倒入到冰水中搅拌,析出固体,抽滤,得到黄色固体7.73g,收率80.5%。1h nmr(400mhz,dmso):δ10.64(s,1h),7.72(d,j=8.4hz,2h),7.57(d,j=8.2hz,3h),7.47(d,j=7.6hz,1h),7.23(t,j=7.6hz,1h),6.88-6.83(m,2h);
13
c nmr(100mhz,dmso):δ168.35,142.95,134.21,134.01,133.23,131.02,130.29,128.75,128.07,122.36,121.13,120.53,110.11;hrms calcd for c
15h11
clno(m h)
256.0529,found 256.0520.
[0053][0054]
实施例1
[0055]
化合物1的合成:将中间体25(0.50g,1.96mmol)置于25ml茄型瓶中,加入10ml干燥四氢呋喃搅拌溶解,再加入氢氧化钠(0.078g,1.96mmol)搅拌10min,分批次加入苯磺酰氯(0.69g,3.92mmol),冰浴条件下搅拌2h,反应液直接用硅胶拌样,柱层析分离纯化(pe:ea=20:1),得淡黄色固体0.36g,收率为46.9%。1h nmr(600mhz,dmso):δ8.11(d,j=7.6hz,2h),7.92(d,j=8.3hz,1h),7.82(t,j=7.5hz,1h),7.75-7.70(m,4h),7.66(d,j=7.7hz,1h),7.55(t,j=7.2hz,1h),7.47(m,2h),7.23(d,j=7.7hz,1h),7.10(t,j=7.7hz,1h);
13
c nmr(150mhz,dmso):δ165.12,138.61,137.49,135.39,135.28,132.89,132.09,132.03,131.35,130.23,130.01,129.93,127.65,127.45,127.31,126.09,124.88,122.86,120.76,113.50;hrms calcd for c
21h14
clnnao3s(m na)
418.0281,found418.0263.
[0056]
实施例2
[0057]
化合物2的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和邻甲基苯磺酰氯(0.75g,3.92mmol)制备得到化合物2(0.48g,59.3%yield)。1h nmr(600mhz,dmso):δ8.08-7.99(m,1h),7.89(d,j=8.4hz,1h),7.79(d,j=7.1hz,1h),7.76-7.73(m,1h),7.71(s,1h),7.69-7.66(m,1h),7.57-7.56(m,2h),7.52-7.48(m,3h),7.26(dd,j=7.5hz 1h),7.12(q,j=7.7,7.5,6.8hz,1h),2.52(s,3h);
13
c nmr(150mhz,dmso):δ139.69,135.89,135.35,133.41,133.29,132.52,132.47,131.68,131.17,130.75,130.70,130.44,128.08,127.92,127.23,126.39,125.15,123.40,114.06,113.91;hrms calcd for c
22h16
clnnao3s(m na)
432.0437,found432.0417.
[0058]
实施例3
[0059]
化合物3的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和间甲基苯磺酰氯(0.75g,3.92mmol)制备得到化合物3(0.39g,49.1%yield)。1h nmr(600mhz,dmso):δ7.89(t,j=3.9hz,2h),7.73-7.71(m,2h),7.64-7.61(m,2h),7.59-7.52(m,3h),7.48-7.44(m,2h),7.20(d,j=7.7hz,1h),7.08(t,j=7.7hz,1h),2.40(s,3h);
13
c nmr(150mhz,dmso):δ165.50,140.29,139.03,137.85,136.36,135.79,133.28,132.48,132.45,131.78,130.61,130.42,130.18,128.07,127.80,126.53,125.26,125.07,123.24,121.10,112.93,21.24;hrms calcd for c
22h16
clnnao3s(m na)
432.0437,found 432.0417.
[0060]
实施例4
[0061]
化合物4的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和间甲基苯磺酰氯(0.75g,3.92mmol)制备得到化合物4(0.32g,40.4%yield)。1h nmr(600mhz,dmso):δ7.98(d,j=8.4hz,2h),7.90(d,j=8.3hz,1h),7.73(d,j=7.6hz,1h),7.71(s,1h),7.64(d,j=8.0hz,1h),7.55-7.52(m,1h),7.50-7.46(m,4h),7.21(d,j=7.7hz,1h),7.09(t,j=7.7hz,1h),2.39(s,3h);
13
c nmr(150mhz,dmso):δ165.50,146.62,139.09,135.69,135.03,133.31,132.53,132.42,131.74,130.74,130.64,130.43,128.06,127.93,126.56,125.22,123.25,121.13,113.90,21.65;hrms calcd for c
22h16
clnnao3s(m na)
432.0437,found 432.0416.
[0062]
实施例5
[0063]
化合物5的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和邻氯苯磺酰氯(0.83g,3.92mmol)制备得到化合物5(0.55g,65.2%yield)。1h nmr(600mhz,
dmso):δ8.35(dd,j=8.0hz,1.4hz,1h),7.82-7.79(m,2h),7.76-7.70(m,4h),7.65(d,j=8.2hz,1h),7.56-7.54(m,1h),7.50-7.44(m,2h),7.26(d,j=7.8hz,1h),7.11(t,j=7.7hz,1h);
13
c nmr(150mhz,dmso):δ165.4,139.64,136.92,136.16,135.37,133.38,133.29,132.62,132.52,132.42,131.80,131.62,130.65,130.46,128.65,128.11,126.13,125.23,123.30,120.91,114.44;hrms calcd for c
21h13
cl2nnao3s(m na)
451.9891,found 451.9874.
[0064]
实施例6
[0065]
化合物6的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和间氯苯磺酰氯(0.83g,3.92mmol)制备得到化合物6(0.38g,45.2%yield)。1h nmr(600mhz,dmso):δ8.11(t,j=1.8hz,1h),8.08(d,j=8.0hz,1h),7.91(d,j=8.2hz,2h),7.75-7.72(m,3h),7.65(d,j=8.0hz,1h),7.56-7.53(m,1h),7.50-7.46(m,2h),7.23(d,j=7.6hz,1h),7.11(t,j=7.4hz,1h);
13
c nmr(150mhz,dmso):δ165.58,138.84,135.91,135.67,134.67,133.34,132.51,132.48,132.40,131.75,130.64,130.45,128.08,127.52,126.76,126.48,125.39,123.28,121.33,113.94;hrms calcd for c
21h13
cl2nnao3s(m na)
451.9891,found 451.9875.
[0066]
实施例7
[0067]
化合物7的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和对氯苯磺酰氯(0.83g,3.92mmol)制备得到化合物7(0.37g,43.6%yield)。1h nmr(600mhz,dmso):δ8.11(d,j=8.7hz,1h),7.98(d,j=8.6hz,1h),7.89(d,j=8.3hz,1h),7.77(d,j=8.7hz,2h),7.71-7.70(m,2h),7.65(d,j=8.0hz,1h),7.59(d,j=8.4hz,1h),7.56-7.53(m,1h),7.36(d,j=8.3hz,1h),7.23(d,j=7.7hz,1h),7.10(t,j=7.7hz,1h);
13
c nmr(150mhz,dmso):δ165.56,139.93,139.57,135.84,133.33,132.47,131.75,130.63,130.49,130.44,129.95,129.91,128.15,128.07,127.94,125.36,123.29,113.87;hrms calcd for c
21h14
cl2no3s(m h)
430.0071,found 430.1069.
[0068]
实施例8
[0069]
化合物8的合成:参照化合物1的合成方法,由中间体26(0.30g,1.17mmol)和苯磺酰氯(0.41g,2.34mmol)制备得到化合物8(0.28g,60.2%yield)。1h nmr(600mhz,dmso):δ8.07(d,j=7.7hz,2h),8.04(d,j=7.7hz,1h),7.98(s,1h),7.91(d,j=8.2hz,1h),7.86-7.84(m,1h),7.79(t,j=7.4hz,1h),7.72(s,1h),7.70-7.68(m,1h),7.63-7.61(m,1h),7.51(d,j=7.7hz,2h),7.44(t,j=7.6hz,1h),7.10(t,j=7.7hz,1h);
13
c nmr(150mhz,dmso):δ165.20,138.37,137.84,137.35,135.57,135.01,134.88,133.43,130.97,130.59,130.03,129.91,129.68,129.65,128.77,127.44,124.59,122.39,120.75,113.30;hrms calcd for c
21h15
clno3s(m h)
396.0461,found 396.0459.
[0070]
实施例9
[0071]
化合物9的合成:参照化合物1的合成方法,由中间体26(0.30g,1.17mmol)和邻甲基苯磺酰氯(0.45g,2.34mmol)制备得到化合物9(0.24g,50.7%yield)。1h nmr(400mhz,dmso):δ8.20-8.13(m,1h),8.05(s,1h),8.00-7.93(m,1h),7.92-7.90(m,1h),7.74-7.71(m,2h),7.66(d,j=7.5hz,1h),7.56-7.51(m,3h),7.49-7.44(m,2h),7.16-7.10(m,1h);
13
c nmr(100mhz,dmso):δ137.94,135.62,134.53,133.44,132.75,130.89,130.63,130.06,
129.93,128.79,127.51,127.27,126.57,124.45,120.73,120.59,19.46;hrms calcd for c
22h16
clnnao3s(m na)
432.0437,found432.0428.
[0072]
实施例10
[0073]
化合物10的合成:参照化合物1的合成方法,由中间体26(0.30g,1.17mmol)和间甲基苯磺酰氯(0.45g,2.34mmol)制备得到化合物10(0.29g,59.6%yield)。1h nmr(600mhz,dmso):δ8.11(d,1h),7.91-7.85(m,4h),7.72(m,1h),7.63-7.59(m,1h),7.57-7.50(m,3h),7.48-7.43(m,2h),7.29-7.10(m,1h),2.37(d,3h);
13
c nmr(150mhz,dmso):δ165.76,139.02,138.41,137.94,136.27,136.21,136.15,134.03,131.57,131.31,131.21,131.00,130.65,130.51,130.11,129.38,128.05,127.81,127.63,125.23,125.16,125.06,125.02,122.99,113.55,21.25;hrms calcd for c
22h16
clnnao3s(m na)
432.0437,found 432.0428.
[0074]
实施例11
[0075]
化合物11的合成:参照化合物1的合成方法,由中间体26(0.30g,1.17mmol)和对甲基苯磺酰氯(0.45g,2.34mmol)制备得到化合物11(0.25g,51.5%yield)。1h nmr(600mhz,dmso):δ8.00(d,j=5.5hz,1h),7.96(d,j=8.2hz,1h),7.91(t,j=8.3hz,1h),7.86(q,j=8.3hz,1h),7.73(d,j=5.0hz,1h),7.65-7.55(m,2h),7.53-7.49(m,3h),7.48-7.44(m,2h),7.30-7.12(m,1h);
13
c nmr(150mhz,dmso):δ165.36,146.13,137.94,130.87,130.80,130.27,130.24,130.08,128.96,127.63,127.45,127.38,127.74,124.13,120.89,113.48,21.19;hrms calcd for c
22h17
clno3s(m h)
410.0618,found 410.0612.
[0076]
实施例12
[0077]
化合物12的合成:参照化合物1的合成方法,由中间体26(0.30g,1.17mmol)和邻氯苯磺酰氯(0.49g,2.34mmol)制备得到化合物8(0.23g,45.3%yield)。1h nmr(400mhz,dmso):δ8.34(t,j=6.7,1.2hz,1h),7.81(t,j=8.1hz,2h),7.72(m,4h),7.55(d,j=7.0hz,3h),7.48-7.44(m,2h),7.15(t,j=7.7hz,1h);
13
c nmr(100mhz,dmso):δ165.01,139.04,138.19,137.54,136.20,135.50,134.86,133.45,132.78,131.95,131.18,130.81,130.63,130.34,130.00,128.82,127.94,127.49,124.51,122.42,120.45,113.83,113.46;hrms calcd for c
21h14
cl2no3s(m h)
430.0071,found430.0065.
[0078]
实施例13
[0079]
化合物13的合成:参照化合物1的合成方法,由中间体26(0.50g,1.96mmol)和邻甲基苯磺酰氯(0.75g,3.92mmol)制备得到化合物13(0.33g,41.2%yield)。1h nmr(400mhz,dmso):δ8.17-8.10(m,2h),7.98-7.89(m,1h),7.87-7.82(m,1h),7.73-7.68(m,2h),7.58-7.49(m,3h),7.42(t,j=8.1hz,3h),7.15-7.09(m,1h),2.43(d,3h);
13
c nmr(100mhz,dmso):δ165.18,138.92,138.34,134.88,134.58,133.52,132.71,132.23,131.12,131.06,130.69,130.52,130.03,128.82,128.30,127.23,1265.52,124.51,124.41,122.55,122.39,113.38,113.23,19.43;hrms calcd for c
22h16
clnnao3sn3o2(m na)
432.0437,found 432.0431.
[0080]
实施例14
[0081]
化合物14的合成:参照化合物1的合成方法,由中间体27(0.50g,1.96mmol)和间甲基苯磺酰氯(0.75g,3.92mmol)制备得到化合物14(0.41g,50.9%yield)。1h nmr(400mhz,
7.51(m,3h),7.50-7.46(m,2h),7.33(d,j=7.7hz,1h),7.17(t,j=7.6hz,1h);
13
c nmr(100mhz,dmso):δ165.68,139.39,135.81,134.45,132.80,132.46,132.14,131.77,131.36,130.87,130.70,130.50,130.01,129.88,129.17,129.02,128.54,127.51,127.21,127.10,126.52,125.23,122.28,121.42,115.72;hrms calcd for c
22h13
cl2nnao2(m na)
416.0221,found416.0213.
[0092]
实施例20
[0093]
化合物20的合成:参照化合物1的合成方法,由中间体25(0.20g,0.78mmol)和间氯苯甲酰氯(0.27g,1.56mmol)制备得到化合物20(0.12g,37.3%yield)。1h nmr(400mhz,dmso):δ8.26(d,j=8.1hz,1h),7.79-7.77(m,1h),7.69-7.63(m,3h),7.56-7.54(m,3h),7.53-7.51(m,2h),7.49-7.47(m,1h),7.33(d,j=7.5hz,1h),7.17(t,j=7.6hz,1h);
13
c nmr(100mhz,dmso):δ165.65,139.36,135.78,134.41,132.78,132.11,131.72,131.32,130.82,130.68,130.47,129.97,129.84,128.99,128.50,127.46,127.17,127.06,125.18,122.24,121.39,115.69;hrms calcd for c
22h13
cl2nnao2(m na)
416.0221,found 416.0204.
[0094]
实施例21
[0095]
化合物21的合成:参照化合物1的合成方法,由中间体25(0.20g,0.78mmol)和对氯苯甲酰氯(0.27g,1.56mmol)制备得到化合物21(0.10g,33.5%yield)。1hnmr(400mhz,dmso):δ8.36(dd,j=7.8,1.4hz,1h),7.83-7.79(m,2h),7.77-7.70(m,4h),7.65(dd,j=8.0,1.1hz,1h),7.56-7.53(m,1h),7.51-7.44(m,2h),7.27(d,j=7.6hz,1h),7.11(td,j=7.7,0.68hz,1h);
13
c nmr(100mhz,dmso):δ164.78,139.07,136.27,135.51,134.81,132.78,132.71,132.00,131.88,131.84,131.21,130.98,130.05,129.84,128.02,127.47,125.53,124.59,122.69,120.32,113.84;hrms calcd for c
22h13
cl2nnao2(m na)
416.0221,found 416.0205.
[0096]
实施例22
[0097]
化合物22的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和邻甲基苯甲酰氯(0.60g,3.92mmol)制备得到化合物22(0.27g,36.7%yield)。1h nmr(600mhz,dmso):δ8.09(d,j=7.7hz,1h),7.74(d,j=7.0hz,1h),7.62(s,1h),7.52(d,j=7.0hz,1h),7.50-7.41(m,5h),7.30(d,j=7.7hz,2h),7.29-7.26(m,1h),7.13-6.98(m,1h),2.29(s,3h);
13
c nmr(150mhz,dmso):δ166.40,140.43,136.20,135.46,134.55,133.33,132.75,132.29,131.29,130.98,130.81,130.55,130.43,128.06,127.87,127.48,126.02,125.39,122.76,121.85,116.07;hrms calcd for c
23h16
clnnao2(m na)
396.0767,found 396.0750.
[0098]
实施例23
[0099]
化合物23的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和对甲基苯甲酰氯(0.60g,3.92mmol)制备得到化合物23(0.13g,17.6%yield)。1h nmr(400mhz,dmso):δ7.79-7.74(m,4h),7.72(s,1h),7.68-7.50(m,3h),7.49-7.44(m,1h),7.42(t,j=7.1hz,3h),7.36(d,j=7.5hz,1h),2.35(s,3h);
13
c nmr(100mhz,dmso):δ167.28,137.75,133.31,130.57,129.59,128.30,126.31;hrms calcd for c
23h16
clnnao2(m na)
396.0767,found 396.0763.
[0100]
实施例24
[0101]
化合物24的合成:参照化合物1的合成方法,由中间体25(0.50g,1.96mmol)和对甲基苯甲酰氯(0.60g,3.92mmol)制备得到化合物24(0.15g,20.7%yield)。1hnmr(400mhz,dmso):δ7.80(d,j=6.6hz,1h),7.76-7.72(m,3h),7.68(s,2h),7.54(t,j=7.7,6.6hz,2h),7.42(t,j=7.6hz,1h),7.34-7.29(m,3h),7.10(t,j=7.6hz,1h),2.41(s,3h);
13
c nmr(100mhz,dmso):δ157.01,133.73,131.65,130.52,129.71,128.65,127.50,124.26,122.28,114.65,21.24;hrms calcd for c
23h16
clnnao2(m na)
396.0767,found 396.0760.
[0102]
应用实施例1
[0103]
化合物对mdm2及mdmx的抑制活性测试
[0104]
将药物加入到盛有50μl的mdm2或mdmx(50nm)的96孔板中,蛋白缓冲液为含500mm nacl的100mm pbs(ph=7.5),随后加入50μl荧光标记肽(10nm),检测终体积为125μl,测量缓冲液为含0.2%nan3和0.1%bsa的100mm pbs(ph=7.5)。孵育30min后,测定荧光偏振值,激发波长为530nm,发射波长为580nm。依据浓度-偏振值曲线计算化合物的ki值。
[0105]
表1化合物对mdm2及mdmx的抑制活性
[0106][0107][0108]
由表1可得,对于mdm2,与作为阳性对照组的nutlin-3a相比,本发明提供的化合物显示出抑制效果,可作为mdm2抑制活性成分,进行进一步的研究;对于mdmx,由于目前还没有有效的抑制剂,因此开发研究对其具有抑制活性的化合物,可为进一步开发效果更好的抑制剂奠定理论基础,而本发明提供的上述化合物显示了对mdmx具有抑制作用,因此也可
作为mdmx抑制活性成分,对其做进一步研究。而其中化合物6、7、8、12、16和17显示出对mdm2和mdmx同时具有较好的抑制活性,可有望作为mdm2和mdmx双重抑制剂。
[0109]
应用实施例2
[0110]
部分化合物抗肿瘤活性
[0111]
将肿瘤细胞培养至对数期,0.25%trypsin-edta消化收集细胞并计数,以细胞数4
×
103个/孔,体积200μl接种于96孔细胞培养板,贴壁过夜后,依次用培养基稀释化合物进行上样,对所有样品进行梯度筛选,起始终浓度为50μm,3倍梯度稀释,共检测8个浓度梯度,每个浓度设3个平行孔。co2培养箱孵育48h,加入终浓度为0.5mg/ml的mtt,再孵4h后,轻轻吸去上清,加入150μl/孔dmso,振荡至充分溶解,酶标仪540nm检测并记录各孔吸光值。抑制率按照以下计算公式计算:抑制率%=(化合物组平均od值-对照组平均od值)/对照组平均od值
×
100%,计算ic
50
值。
[0112]
表2部分化合物抗肿瘤活性
[0113][0114]
hct116:人结肠癌细胞株
[0115]
mcf7:人乳腺癌细胞株
[0116]
a549:人肺癌细胞株
[0117]
由表2可得,与作为阳性对照组的nutlin-3a相比,本技术化合物6、7、8、12、16和17均具有抗hct116、mcf7、a549活性的作用,其中对于hct116,化合物6、12、17抑制活性高于对照组,对于mcf7,化合物12抑制活性高于对照组,对于a549,化合物6、12抑制活性高于对照组,其余化合物抑制活性与对照组效果相当,可以进行进一步研究,从而为研发效果更好的抑制剂奠定基础。
[0118]
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内也意图包含这些改动和变型在内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。