1.本发明涉及酶工程技术领域,具体涉及一种新的蛋白重组策略及其在酶改造中的应用。
背景技术:
2.随着生物技术的快速发展,酶蛋白已广泛应用于食品、化工、环境、能源等各领域,推动了工业与能源的可持续发展。但天然酶一般难以满足工业需求,需要通过定向进化这一手段对其性能进行改造,如:提高酶的活性、稳定性、底物特异性和立体选择性等。
3.定向进化是在实验室模拟自然进化的过程,在这过程中重要的一步就是建立一个高质量的突变库,供下游筛选。目前,虽然突变库构建方法已得到广泛开发,如:易错pcr、基因重组、casting、序列饱和突变等,但突变库质量较低,存在很多无义突变或重组,因此需要筛选较大容量的突变库才能得到目标突变体。这很大程度上限制了定向进化的高效进行。因此构建容量较小但高质量的突变库尤为重要。
4.结构域是因多肽链上相邻的超二级结构紧密联系,进一步折叠而成的一个或多个相对独立的致密三维实体。从功能角度看,多结构域的酶蛋白活性中心往往都位于结构域之间,主要可能是因为通过结构域容易构建具有特定三维排布的活性中心,而且各个结构域之间常只有一段柔性肽链相连,使结构域间容易发生相对运动,有利于活性中心结合底物、别构中心结合调节物和发生别构效应,利于酶对反应的催化。
5.在多结构域蛋白质中,一些蛋白质的各结构域没有明确的功能分工或各结构域共同存在才得以行使功能。本领域技术人员通常认为各结构域之间的联系是不能被破坏的,即替换掉任意结构域很可能会使蛋白质整体失去功能。漆酶(ec 1.10.3.2)是一类多功能氧化酶,属于蓝多铜氧化酶家族,能够氧化多达250多种底物,具有广阔的工业应用前景,如:木质素的降解、染料脱色、有机污染物的降解、生物检测、高分子合成和食品工业等领域。漆酶对富含木质素的农作物秸秆的有效降解作用,不但可以解决环境问题,并且可得到木质素来源的多种芳香族化合物用作化学品合成的前体。漆酶利用分子氧通过自由基-催化反应机制氧化各种芳香族和非芳香族化合物,唯一副产物是水,被认为是绿色环保的生物催化剂。然而,天然来源的漆酶活力比较低,而且难以在工业应用环境下保持稳定,从而限制了漆酶的商业化生产以及用于大规模木质素降解和环境治理等。因此如何生产廉价、高效的漆酶(高活力,高稳定性)越来越受到国内外众多学者的关注。大部分漆酶具有三个结构域,4个铜离子参与反应,1个t1铜,位于结构域3,负责从底物上得电子;t1铜附近,分别位于结构域2和结构域3的4个loops区在蛋白结构表面形成浅壑供底物结合;2个t3铜和1个t2铜组成的三核中心区,位于结构域1和3的界面上,负责将来自t1铜的电子传递给o2,生成水。漆酶的三个结构域结合在一起形成了界面间的活性中心,使漆酶获得生化活性。
技术实现要素:
6.本发明申请人认为结构域间界面上氨基酸的相互作用会对酶催化功能影响很大,
因此对结构域进行组合、重构将会很大程度上改变酶蛋白的催化性能及其稳定性等。因此,本发明首次提出了一种通过对结构域进行重构而对蛋白进行设计改造的理念,构建高质量、小容量的聪明突变库,达到快速改造目标蛋白的目的。
7.本发明要求保护一种多结构域蛋白重组方法。
8.本发明要求保护的多结构域蛋白重组方法,可包括如下步骤:将若干个结构相似的多结构域蛋白进行结构域间的重组,得到重组蛋白;所述结构相似为利用tm-align(https://zhanglab.ccmb.med.umich.edu/tm-align/)软件进行在线结构比对,两两比对tm score均》0.5(如两两比对tm score均》0.9,具体如0.95)。
9.本发明还要求保护一种多结构域蛋白突变体库的构建方法。
10.本发明要求保护的多结构域蛋白突变体库的构建方法,可包括如下步骤:将若干个结构相似的多结构域蛋白进行结构域间的随机重组,得到不同的重组蛋白,组成所述突变体库;所述结构相似为利用tm-align(https://zhanglab.ccmb.med.umich.edu/tm-align/)软件进行在线结构比对,两两比对tm score均》0.5(如两两比对tm score均》0.9,具体如0.95)。
11.其中,所述重组蛋白所含有的结构域类型和结构域数量与重组前的原始的所述多结构域蛋白一致。
12.所述方法中,所述多结构域蛋白具有n个结构域,将任意小于n个的结构域替换成其它的所述结构相似的所述多结构域蛋白中与其对应的结构域,得到所述重组蛋白;n为大于等于2的正整数。
13.在所述方法中,所述多结构域蛋白可为:
①
不同结构域没有明确功能或多结构域协同性行使某一特定功能的多结构域蛋白(例如:漆酶,大部分漆酶含有三个结构域,活性中心含有4个铜,其中3个铜在结构域的界面上,结构域功能划分不明确);
②
也可为不同结构域具有明确特定功能的多结构域蛋白(例如:多糖裂解单加氧酶,具有明确的底物结合域cbm、连接区域linker和催化域三个部分)。
14.在本发明的具体实施方式中,所述多结构域蛋白具体为漆酶蛋白。
15.在本发明的具体实施方式中,所述漆酶蛋白选自如下中的至少两个:来自于白腐真菌的漆酶蛋白lcc1、来自于白腐真菌的漆酶蛋白lcc2和来自于担子菌的漆酶蛋白mrl2。
16.进一步地,所述漆酶蛋白的重组方法可包括如下步骤:将所述lcc1、所述lcc2和所述mrl2的氨基酸序列一起进行序列对比,得到氨基酸比对序列矩阵;以所述氨基酸比对序列矩阵的第123-141位之间的某个位置作为重组位点1,以所述氨基酸比对序列矩阵的第286-345位之间的某个位置作为重组位点2;通过所述重组位点1和/或所述重组位点2将所述lcc1、所述lcc2和所述mrl2这三个漆酶蛋白中的至少两个进行重组,得到重组后漆酶蛋白。
17.所述氨基酸比对序列矩阵具体可为采用序列比对软件(如clustalw等)将所述lcc1、所述lcc2和所述mrl2的氨基酸序列放在一起进行比对,软件直接输出的比对结果图谱(图谱上所标注的位置信息即为在氨基酸比对序列矩阵中的位置,如图1)。
18.更进一步地,所述漆酶蛋白的重组方式可为如下任一:
19.(a1)所述lcc1和所述lcc2仅在所述重组位点1处发生重组;
20.(a2)所述lcc1和所述lcc2仅在所述重组位点2处发生重组;
21.(a3)所述lcc1和所述lcc2在所述重组位点1和所述重组位点2处同时发生重组;
22.(a4)所述lcc1和所述mrl2仅在所述重组位点1处发生重组;
23.(a5)所述lcc1和所述mrl2仅在所述重组位点2处发生重组;
24.(a6)所述lcc1和所述mrl2在所述重组位点1和所述重组位点2处同时发生重组;
25.(a7)所述lcc2和所述mrl2在所述重组位点1处发生重组;
26.(a8)所述lcc2和所述mrl2仅在所述重组位点2处发生重组;
27.(a9)所述lcc2和所述mrl2在所述重组位点1和所述重组位点2处同时发生重组;
28.(a10)所述lcc1、所述lcc2和所述mrl2在所述重组位点1和所述重组位点2处同时发生重组。
29.在本发明中,所述(a1)具体为:1)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分和所述lcc2在所述氨基酸比对序列矩阵中位于所述重组位点1后面的部分重组(得到l1l2l2);或,2)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点1后面的部分和所述lcc2在所述氨基酸比对序列矩阵中位于所述重组位点1前面的部分重组(得到l2l1l1)。
30.在本发明中,所述(a2)具体为:1)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点2前面的部分和所述lcc2在所述氨基酸比对序列矩阵中位于所述重组位点2后面的部分重组(得到l1l1l2);或,2)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分和所述lcc2在所述氨基酸比对序列矩阵中位于所述重组位点2前面的部分重组(得到l2l2l1)。
31.在本发明中,所述(a3)具体为:1)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述lcc2在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到l1l2l1);或,2)所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述lcc1在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到l2l1l2)。
32.在本发明中,所述(a4)具体为:1)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分和所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点1后面的部分重组(得到l1mm);或,2)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点1后面的部分和所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点1前面的部分重组(得到ml1l1)。
33.在本发明中,所述(a5)具体为:1)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点2前面的部分和所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点2后面的部分重组(得到l1l1m);或,2)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分和所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点2前面的部分重组(得到mml1)。
34.在本发明中,所述(a6)为:1)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分
重组(得到l1ml1);或,2)所述mrl2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述lcc1在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述mrl2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到ml1m)。
35.在本发明中,所述(a7)具体为:1)所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分和所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点1后面的部分重组(得到l2mm);或,2)所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点1后面的部分和所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点1前面的部分重组(得到ml2l2)。
36.在本发明中,所述(a8)具体为:1)所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点2前面的部分和所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点2后面的部分重组(得到l2l2m);或,2)所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分和所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点2前面的部分重组(得到mml2)。
37.在本发明中,所述(a9)具体为:1)所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到l2ml2);或,2)所述mrl2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述lcc2在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述mrl2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到ml2m)。
38.在本发明中,所述(a10)具体为:1)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述lcc2在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述mrl2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到l1l2m);或,2)所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到l1ml2);或,3)所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述lcc1在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述mrl2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到l2l1m);或,4)所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述mrl2在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到l2ml1);或,5)所述mrl2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述lcc1在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述lcc2位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到ml1l2);或,6)所述mrl2位于所述氨基酸比对序列矩阵中所述重组位点1前面的部分、所述lcc2在所述氨基酸比对序列矩阵中位于所述重组位点1和所述重组位点2之间的部分和所述lcc1位于所述氨基酸比对序列矩阵中所述重组位点2后面的部分重组(得到ml2l1)。
39.对于重组突变体取代,使用下述命名法:漆酶分为三个结构域,重组子abc代表结构域1来源于a,结构域2来源于b,结构域3来源于c;l1,l2,m代表了结构域分别来源于lcc1,lcc2,mrl2;重组位置(即在所述氨基酸比对序列矩阵中的位置)。
40.在本发明中,所述lcc1的氨基酸序列具体如seq id no.1所示,其中第1-123位为结构域i,第124-320位为结构域ii,第321-498位为结构域iii。所述lcc2的氨基酸序列具体如seq id no.2所示,其中第1-123位为结构域i,第124-320位为结构域ii,第321-499位为结构域iii。所述mrl2的氨基酸序列具体如seq id no.3所示,其中第1-123位为结构域i,第124-318位为结构域ii,第319-494位为结构域iii。
41.在本发明的具体实施方式中,所述重组位点1具体为所述氨基酸比对序列矩阵的第123位和124位之间;所述重组位点2具体为所述氨基酸比对序列矩阵中的第321位和322位之间。
42.在所述方法中,将若干个所述多结构域蛋白的编码基因分别构建到同一个原始载体的相同位置,得到若干个重组表达载体(一个结构域蛋白构建一个重组表达载体)。将若干个所述重组表达载体中所述原始载体的自身序列均在同一位置分为两个部分;将若干个所述多结构域蛋白的编码基因均依据结构域不同分为n个部分,一个部分对应一个结构域;将自5’端起的第一个结构域的编码核酸序列和位于其上游的那部分载体骨架序列合并成为第一个片段,将自5’端起的最后一个结构域的编码核酸序列和位于其下游的那部分载体骨架序列合并成为最后一个片段,位于中间的各结构域的编码核酸序列均各自自成一个片段,自此将每个所述重组表达载体均分成了n个片段。然后将若干个所述重组表达载体的n个片段进行重组或随机重组,得到用于表达所述重组蛋白的重组载体或由若干个所述重组载体组成的库。其中,n为大于等于2的正整数。
43.在本发明的具体实施方式中,所述lcc1的编码核酸序列如seq id no.4所示。seq id no.4的第1-369位为结构域i的编码核酸,第370-960位为结构域ii的编码核酸,第961-1497位为结构域iii的编码核酸。所述lcc2的编码核酸序列如seq id no.5所示。seq id no.5的第1-369位为结构域i的编码核酸,第370-960位为结构域ii的编码核酸,第961-1500位为结构域iii的编码核酸。所述mrl2的编码核酸序列如seq id no.6所示。seq id no.6的第1-369位为结构域i的编码核酸,第370-954位为结构域ii的编码核酸,第955-1485位为结构域iii的编码核酸。
44.在本发明的具体实施方式中,所述原始载体具体为ppiczα-a载体。所述多结构域蛋白的编码基因构建到ppiczα-a载体的酶切位点xhoi和xbai之间。
45.进一步地,所述方法还包括将所述重组载体导入宿主细胞中进行表达的步骤。所述宿主细胞可如酵母细胞,进一步可如毕赤酵母。
46.在所述方法中,在将所述重组载体导入毕赤酵母后,还包括对重组酵母进行发酵培养的步骤;进行所述发酵培养的培养基可为bmm培养基,培养条件可为20℃、220r/min培养5d,每天向发酵体系中补加1%总体积的甲醇。
47.在本发明的具体实施方式中,是将所述重组菌接种于bmg种子培养基中,以30℃、220r/min培养20h,然后以起始od600为1.0的接种量接种于bmm发酵培养基中,以20℃、220r/min培养5d,每天向发酵体系中补加1%总体积的甲醇。
48.本发明通过对酶蛋白结构域进行重新组合构建的方法,快速高效地获得目标突变
体。与传统的随机突变、定点饱和突变、dna shuffling等获得蛋白质重组体或突变体的方法相比,多结构域重构法,针对性更强,更聚焦,突变库容量极小,筛选负担小。本发明通过定向改造的方法获得了酶活力和稳定性均提高的漆酶突变体,有望提高其在木质素降解、有机合成和染料脱色应用中的效率。
附图说明
49.图1为野生型漆酶氨基酸比对序列矩阵。
50.图2为野生型漆酶及重组变体上清液sds-page。
51.图3为野生型漆酶及重组变体粗酶液热稳定性。
52.图4为野生型漆酶及重组变体粗酶液有机溶剂稳定性。
具体实施方式
53.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
54.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
55.实施例1、多结构域蛋白结构域重构方法的提出
56.经过文献和数据库检索,本发明的发明人发现多结构域蛋白活性中心都位于结构域之间,这种情况下结构域之间界面上氨基酸的相互作用会对酶催化功能及其稳定性等有很大影响。而且大部分多结构域蛋白内各结构域功能划分并不明确。因此,本发明第一次提出了对这种结构相似(利用tm-align(https://zhanglab.ccmb.med.umich.edu/tm-align/)软件进行在线结构比对,比对tm score》0.5)的多结构域蛋白进行结构域重组构建高质量突变库的理念。由于漆酶具有广泛的应用,是一种重要的工业用酶,且其具有多结构域,各结构域功能划分不明确,因此选择漆酶为目标酶。由于来自白腐真菌的漆酶lcc1和lcc2具有较高氧化还原电势,拥有较广泛的底物谱,且lcc2稳定性较高,来源于担子菌的漆酶mrl2酶活力较高,为获得活力高、稳定性好、底物谱广的突变体,本发明欲将此三种漆酶进行结构域重组。以上三种漆酶均为三结构域蛋白,利用tm-align(https://zhanglab.ccmb.med.umich.edu/tm-align/)软件进行在线结构比对,发现其结构两两比对,tm score均大于0.95,说明三种漆酶三维结构极其相似,猜测对其进行结构域重组对整体结构破坏较小。最终选择lcc1、lcc2、mrl2为模板,进行结构域重构。
57.其中lcc1的氨基酸序列如seq id no.1所示,结构域i为从氮端起的前123个氨基酸,结构域ii为第124-320位之间的197个氨基酸,结构域iii为第321-498位之间的178个氨基酸。lcc2的氨基酸序列如seq id no.2所示,结构域i为从氮端起的前123个氨基酸,结构域ii为第124-320位之间的197个氨基酸,结构域iii为第321-499位之间的179个氨基酸。mrl2的氨基酸序列如seq id no.3所示,结构域i为从氮端起的前123个氨基酸,结构域ii为第124-318位之间的195个氨基酸,结构域iii为319-494位之间的176个氨基酸。
58.将所述lcc1、所述lcc2和所述mrl2的氨基酸序列(seq id no.1、seq id no.2和
seq id no.3)一起进行序列对比,得到氨基酸比对序列矩阵(图1);以所述氨基酸比对序列矩阵的第123位和124位之间作为重组位点1,以所述氨基酸比对序列矩阵中的第321位和322位之间作为重组位点2;通过所述重组位点1和/或所述重组位点2将所述lcc1、所述lcc2和所述mrl2这三个漆酶蛋白中的至少两个进行重组,得到重组后漆酶蛋白。
59.在所述氨基酸比对序列矩阵中,针对seq id no.1至seq id no.3所示的lcc1、lcc2和mrl2而言,其结构域i对应的氨基酸序列均位于所述重组位点1的上游,结构域ii对应的氨基酸序列均位于所述重组位点1和所述重组位点2之间,结构域iii对应的氨基酸序列均位于所述重组位点2的下游。
60.对于重组突变体取代,使用下述命名法:漆酶分为三个结构域,重组子abc代表结构域i来源于a,结构域ii来源于b,结构域iii来源于c;l1,l2,m代表了结构域分别来源于lcc1,lcc2,mrl2。
61.实施例2、漆酶的基因克隆
62.委托苏州金唯智生物技术有限公司人工合成白腐真菌的来源的漆酶lcc1基因(序列如seq id no.4所示)和lcc2基因(序列如seq id no.5所示),以及担子菌来源的漆酶mrl2基因(序列如seq id no.6所示),然后连接到ppiczα-a载体(new england biolabs公司)酶切位点xhoi和xbai之间后得到的重组质粒,然后转化入大肠杆菌bl-21gold(de3),于含博来霉素的lb平板上筛选阳性克隆并培养,抽提质粒,测序确定载体构建成功,分别命名为ppiczα-a-lcc1、ppiczα-a-lcc2、ppiczα-a-mrl2。
63.实施例3、漆酶重组变体构建
64.为了提高上述漆酶蛋白的活力和稳定性,分别以实施例2中构建得到的重组质粒ppiczα-a-lcc1、ppiczα-a-lcc2和ppiczα-a-mrl2为模板,进行结构域重组,由于漆酶具有三个结构域,再加上载体总共四个片段。同源重组方法中,片段越少成功率越大。因此,本发明实验中设计了三片段重组法,以提高重组成功率。在载体上设计一段引物,将载体分为两部分,一部分与结构域i组成一个片段(片段1),一部分与结构域iii组成一个片段(片段3),结构域ii为一个片段(片段2)。
65.分别利用三对引物对三个片段进行扩增,对三片段重组构成一个完整重组质粒。由于三个不同基因上的同一片段用同一对引物扩增,在设计引物时,引物结合的位置可根据设计需要进行一定程度的调整。(片段1对应的上游引物:5
′‑
cgttgctggcgtttttccatag-3
′
和下游引物:5
′‑
ccagaaagtaccagcttg-3
′
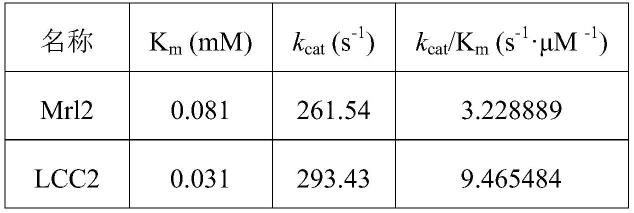
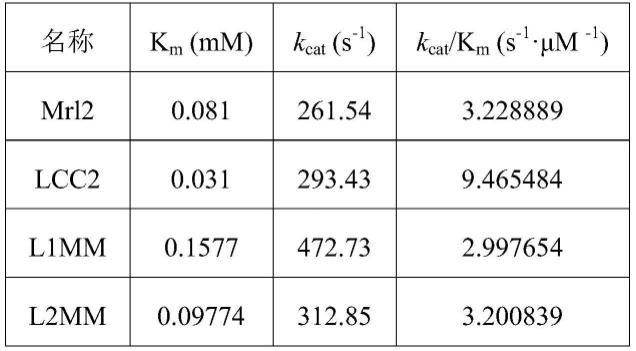
;片段2对应的上游引物:5
′‑
caagctggtactttctgg-3
′
和下游引物:5
′‑
gcswartcaacaccacc-3
′
(s为g或c,w为a或t,r为g或a);片段3对应的上游引物:5
′‑
ggtggtgttgaytwsgc-3
′
(y为t或c,w为a或t,s为g或c)和下游引物:5
′‑
ctatggaaaaacgccagcaacg-3
′
),最终获得24个重组质粒,经测序验证序列正确。
66.将重组产物电转到大肠杆菌感受态细胞中,37℃过夜培养得到重组菌之后,将长出的单克隆分别用无菌牙签接种到3ml lb液体培养基中(25μg/ml博来霉素),37℃、220rpm摇床培养16h后,抽提质粒。利用saci对质粒进行线性化,将线性化产物电转化至毕赤酵母感受态细胞,30℃72h培养得到重组菌单克隆。
67.实施例4、漆酶蛋白及重组变体在毕赤酵母中的表达
68.将长出的单克隆分别用无菌牙签接种3ml ypd培养基(25μg/ml博来霉素),30℃、220rpm摇床培养20h后,转接至10ml bmg培养基(终od 0.2)(25μg/ml博来霉素)30℃、
220rpm摇床培养20h后,转接至50ml bmm培养基(终od 1.0)(25μg/ml博来霉素)20℃、220rpm摇床培养5d,每天向发酵体系中补加500μl甲醇。培养完成后,离心收集上清(漆酶为分泌表达)。
69.bmg培养基:13.4g/l ynb,10g/l甘油,0.0004g/l生物素,余量为100mm ph6.0磷酸钾缓冲液。
70.bmm培养基:13.4g/l ynb,0.0004g/l生物素,10mm cuso4,8g/l l-丙氨酸,余量为100mm ph6.0磷酸钾缓冲液。
71.实施例5、野生型漆酶及重组变体性质检测
72.取40μl实施例4所得上清与10μl 5
×
上样染料(配方:1.25ml 1m tris-hcl(ph6.8)、sds 0.5g、溴酚蓝25mg、甘油2.5ml、β-巯基乙醇0.25ml)混匀,100℃处理10min,取10μl上样,利用sds-page检测蛋白表达量与分子大小。
73.检测上清酶活力:ph 3.0、100mm的柠檬酸-磷酸缓冲液100μl,上清液60μl,abts(10mm)40μl,30℃,在吸收光420nm条件下30℃孵育20min中进行连续性检测,10s检测一次。
74.对重组子和野生型进行温度稳定性检测:上清100μl,在60℃孵育10min,取60μl检测剩余酶活力,方法同上一段所述。
75.对重组子和野生型进行有机溶剂稳定性检测:50%的乙醇(溶于ph 3.0、100mm的柠檬酸-磷酸缓冲液)100μl,上清液60μl,abts(10mm)40μl,30℃,在吸收光420nm条件下30℃孵育20min中进行连续性检测,10s检测一次,相对残余酶活为在乙醇条件下的酶活力/在纯缓冲液条件下的酶活力。
76.如图2,目标蛋白大小在75kda左右。如图3,热处理后的酶活力与未热处理的酶活力比值为相对残余酶活,通过比较各重组子热处理后的相对残余酶活,发现重组子l1l2l2、l2l2m、l2ml2、l1mm热稳定性高于野生型lcc2;l2mm、l1l2m热稳定性高于野生型mrl2;l1l1m稳定性高于与之最相近的野生型lcc1。如图4,ml2l2对乙醇耐受性好于与之最相近的野生型lcc2;l1l2m、l2l2m、l2ml2、l1l2l2、l1mm对乙醇耐受性好于mrl2;mml1对乙醇耐受性好于lcc1。利用此方法,仅筛选24个重组突变体,就可获得9个稳定性提高的突变体。通过此重组方法获得优势突变体的几率(37.5%)远高于一般的突变库构建方法(eppcr、dna shuffling等)。
77.其中,l1l2l2的氨基酸序列如seq id no.7所示,编码基因如seq id no.16所示。l2l2m的氨基酸序列如seq id no.8所示,编码基因如seq id no.17所示。l2ml2的氨基酸序列如seq id no.9所示,编码基因如seq id no.18所示。l1mm的氨基酸序列如seq id no.10所示,编码基因如seq id no.19所示。l2mm的氨基酸序列如seq id no.11所示,编码基因如seq id no.20所示。l1l2m的氨基酸序列如seq id no.12所示,编码基因如seq id no.21所示。l1l1m的氨基酸序列如seq id no.13所示,编码基因如seq id no.22所示。ml2l2的氨基酸序列如seq id no.14所示,编码基因如seq id no.23所示。mml1的氨基酸序列如seq id no.15所示,编码基因如seq id no.24所示。
78.实施例6、野生型漆酶及重组变体蛋白纯化
79.选择表达量较高的漆酶重组子进行纯化分析。实施例4中收集的上清,通过阴离子交换层析、疏水层析和分子筛三步法进行蛋白纯化。首先通过0.22μm孔径过滤器对上清进行过滤,并用quixstand benchtop system浓缩为50ml,浓缩的上清液再用0.22μm孔径过滤
器过滤后,用deae ff阴离子交换层析柱对其进行纯化。用三个柱体积的20mmol
·
l-1
、ph7.0磷酸钾缓冲液对柱进行洗涤,用20mmol
·
l-1
、ph7.0磷酸钾缓冲液和500mmol
·
l-1
nacl(溶于ph7.0、20mmol
·
l-1
磷酸钾缓冲液)梯度洗脱蛋白,并利用96孔深孔板收集洗脱下的蛋白,2ml/孔。检测每个孔内收集的洗脱液的abts酶活力,将有活力的液体收集,利用疏水交换层析(hitrap butyl ff)进一步纯化,用20mmol
·
l-1
、ph7.0磷酸钾缓冲液和2mol
·
l-1
硫酸铵(溶于ph7.0、20mmol
·
l-1
磷酸钾缓冲液)对柱进行梯度洗脱,将洗脱后有活性的部分,进一步进行分子筛(superdex 200)纯化,利用ph7.0的20mmol
·
l-1
磷酸钾缓冲液进行洗脱,最终获得纯酶。以牛血清白蛋白(bsa)为标准,采用braford法测定纯化后酶蛋白的蛋白浓度。并将纯化的酶液冷冻干燥成粉末保存于-80℃,待进一步使用。
80.实施例7、野生型漆酶及重组变体纯酶的动力学参数测定
81.将相同浓度的实施例6得到的纯酶加入到反应体系中,取不同浓度的底物进行吸光度值检测,确定每个反应的初始速率。具体检测方法如下:
82.1、用ddh2o将纯化后的酶蛋白稀释至2.5ng/μl的浓度。
83.2、加入不同浓度的abts溶液作为底物(终浓度分别为0-2mm)到上述的反应体系中。ph 3.0、100mm的柠檬酸-磷酸缓冲液150μl,酶液10μl,abts(0-10mm)40μl,30℃,在吸收光420nm条件下30℃孵育20min中进行检测。
84.3、根据检测结果计算出不同底物浓度下酶促反应的初速度,计算km值和vmax,进一步计算得出kcat值,计算结果如表1所示。重组变体l2l2m、l1mm、l2mm的kcat值均高于野生型mrl2和lcc2,说明重组子l2l2m、l1mm、l2mm的催化效率均高于野生型。
85.表1、野生型漆酶及重组变体的动力学参数
[0086][0087][0088]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。