1.本发明涉及药物化学技术领域,具体涉及一种糖基供体及其在制备糖苷中的用途。
背景技术:
2.糖类物质是生物体(包括动物、植物、微生物)的重要组成部分。多糖、寡糖及其与蛋白质、酯类等结合成的糖复合物涉及到细胞,特别是多细胞生命的全部时间和空间过程,它们作为信息分子参与细胞的各种识别过程:传递生物信息、参与机体的免疫调节,并与细胞分化、受精、胚胎发育、血液系统、感染、衰老等多方面功能密切相关。近年来,由于糖类化合物显著的生理活性,越来越引起化学家们广泛的研究兴趣。糖苷(glycosides)是糖在自然界存在的重要形式,它广泛存在于生物体内,具有特殊的生物活性,担负着重要的生理功能。糖苷是糖的半缩醛羟基与配基缩合失去一分子水或其它小分子化合物而形成的一类非常重要的化合物,其中糖部分称为糖基,非糖部分称为配基。根据糖苷化合物分子结构中的配基与糖环碳原子相连的原子类型可把糖苷化合物分为氧苷化合物、氮苷化合物、硫苷化合物和碳苷化合物,它们大都表现出很好的生物学功能,如糖苷酶抑制活性抗菌、抗病毒和抗肿瘤活性等。
3.目前已有很多构建糖苷类化合物的方法,但是,这些方法条件不够温和、官能团兼容性差。同时,大部分现有方法很难高立体选择性地制备α构型的糖苷化合物。
4.因此,研究结构新颖的、制备方法简单的糖基供体,对进一步制备各种糖苷化合物(比如氧苷化合物、氮苷化合物、硫苷化合物和碳苷化合物)具有非常大的应用价值。
技术实现要素:
5.为了解决上述问题,本发明提供了一种结构新颖的糖基供体,并以该糖基供体为原料制得了糖苷(比如碳苷)。
6.本发明提供了一种糖基供体、或其盐、或其立体异构体、或其旋光异构体,所述糖基供体的结构如式i所示:
[0007][0008]
其中,a环选自r
0a
、r
1a
、r
2a
、r
3a
、r
0b
、r
1b
、r
2b
、r
3b
、r4b
各自独立地选自h、c
1-6
烷基、芳基或者杂芳基取代的c
1-12
烷基、芳基或者杂芳基取代的c
1-12
烷氧基、c
2-8
炔基、c
2-8
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs、m1coor9、、或者r
0a
、r
1a
、r
2a
、r
3a
中的任意2个连接成环,或者r
0b
、r
1b
、r
2b
、r
3b
、r
4b
中的任意2个连接成环;其中,r1、r2、r3、r4各自独立地选自h、c
1-6
烷基、芳基或者杂芳基取代的c
1-12
烷基、芳基或者杂芳基取代的c
1-12
烷氧基、c
2-8
炔基、c
2-8
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs;r9选自c
1-6
烷基,m1选自0-3个亚甲基;m2、m3、m4选自h、c
1-6
烷基、芳基或者杂芳基取代的c
1-12
烷基、芳基或者杂芳基取代的c
1-12
烷氧基、c
2-8
炔基、c
2-8
烯基、芳基、杂芳基,或者m3、m4连接成环;
[0009]
w为o、s、so或so2;
[0010]
r5、r6、r7、r8各自独立地选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-8
炔基、c
2-8
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基,或者,r6与r7连接形成环,所述环为5~6元芳环;
[0011]
r0为卤素。
[0012]
进一步地,所述糖基供体的结构如式ii-1、式ii-2或式ii-3所示:
[0013][0014]
其中,a环选自r
0a
、r
1a
、r
2a
、r
3a
、r
0b
、r
1b
、r
2b
、r
3b
、r
4b
各自独立地选自h、c
1-6
烷基、芳基或者杂芳基取代的c
1-6
烷基、芳基或者杂芳基取代的c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs、m1coor9、、或者r
0a
、r
1a
、r
2a
、r
3a
中的任意2个连接成环,或者r
0b
、r
1b
、r
2b
、r
3b
、r4b
中的任意2个连接成环;其中,r1、r2、r3、r4各自独立地选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs;r9选自c
1-4
烷基,m1选自0-1个亚甲基;m2、m3、m4选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳基、杂芳基,或者m3、m4连接成环;
[0015]
r5、r6、r7、r8各自独立地选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基。
[0016]
进一步地,所述糖基供体的结构如式iii-1或iiii-2所示:
[0017][0018]
其中,r
0a
、r
1a
、r
2a
、r
3a
、r
0b
、r
1b
、r
2b
、r
3b
、r
4b
各自独立地选自h、c
1-6
烷基、芳基或者杂芳基取代的c
1-6
烷基、芳基或者杂芳基取代的c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs、m1coor9、或者r
0a
、r
1a
、r
2a
、r
3a
中的任意2个连接成环,或者r
0b
、r
1b
、r
2b
、r
3b
、r
4b
中的任意2个连接成环;
[0019]
r1、r2、r3、r4各自独立地选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs;r9选自c
1-4
烷基,m1选自0-1个亚甲基;m2、m3、m4选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳基、杂芳基,或者m3、m4连接成环。
[0020]
进一步地,所述糖基供体的结构如iv-1或iv-2所示:
[0021][0022]
其中,r
0a
、r
1a
、r
2a
、r
3a
、r
0b
、r
1b
、r
2b
、r
3b
、r
4b
各自独立地选自h、c
1-6
烷基、芳基或者杂芳基取代的c
1-6
烷基、芳基或者杂芳基取代的c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs、m1coor9、或者r
0a
、r
1a
、r
2a
、r
3a
中的任意2个连
接成环,或者r
0b
、r
1b
、r
2b
、r
3b
、r
4b
中的任意2个连接成环;
[0023]
r1、r2、r3、r4各自独立地选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs;r9选自c
1-4
烷基,m1选自0-1个亚甲基;m2、m3、m4选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳基、杂芳基,或者m3、m4连接成环。
[0024]
进一步地,所述糖基供体的结构如v-1或v-2所示:
[0025][0026]
其中,r
0a
、r
1a
、r
2a
、r
3a
、r
0b
、r
1b
、r
2b
、r
3b
、r
4b
各自独立地选自h、c
1-6
烷基、芳基或者杂芳基取代的c
1-6
烷基、芳基或者杂芳基取代的c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs、m1coor9、或者r
0a
、r
1a
、r
2a
、r
3a
中的任意2个连接成环,或者r
0b
、r
1b
、r
2b
、r
3b
、r
4b
中的任意2个连接成环;
[0027]
r1、r2、r3、r4各自独立地选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳香基、杂芳基、饱和环烷基、饱和杂环基、m1oh、m1nh2、m1nhac、m1oac、m1obz、m1obn、m1n3、m1otms、m1otbs;r9选自c
1-4
烷基,m1选自0-1个亚甲基;m2、m3、m4选自h、c
1-6
烷基、c
1-6
烷氧基、c
2-4
炔基、c
2-4
烯基、芳基、杂芳基,或者m3、m4连接成环。
[0028]
进一步地,所述糖基供体选自以下结构之一:
[0029][0030]
进一步地,所述糖基供体选自以下结构之一:
[0031][0032]
其中,表示或二者的任意比例混合物;其中,表示或二者的任意比例混合物。
[0033]
本发明还提供了上述糖基供体在制备硫苷化合物、氧苷化合物和/或碳苷化合物中的用途。
[0034]
本发明还提供了一种制备式i’所示糖基供体的方法,
[0035]
所述方法为方法一,包括以下步骤:
[0036][0037]
(1)化合物t-1与ac2o反应,得到t-2;
[0038]
(2)化合物t-2与反应,得到式i’所示化合物;
[0039]
其中,a环、r0、r5、r6、r7、r8如上所述;
[0040]
优选的,步骤(1)中,化合物t-1中羟基的摩尔数与ac2o的摩尔数之比为1:(1.0~1.5),优选为1:1.2;所述反应的溶剂为有机溶剂,优选为二氯甲烷;所述反应的温度为室温;所述反应是在dmap和三乙胺的存在下进行的;
[0041]
和/或,步骤(2)中,化合物t-2与的摩尔比为1:(1.0~1.5),优选为1:1.2;所述反应的溶剂为有机溶剂,优选为二氯甲烷;所述反应的温度为0~室温;所述反应是在eto2·
bf3的存在下进行的;
[0042]
或者,所述方法为方法二,包括以下步骤:
[0043][0044]
(1’)化合物t-1与ac2o反应,得到t-2;
[0045]
(2’)化合物t-2与acsh反应,得到t-3;
[0046]
(3’)化合物t-3与反应,得到t-4;
[0047]
(4’)化合物t-4与化合物t-4a反应,得到式i’所示化合物;化合物t-4a为
[0048]
其中,a环、r0、r5、r6、r7、r8如上所述,rx为卤素,优选为碘或溴;
[0049]
优选的,步骤(1’)中,化合物t-1中羟基的摩尔数与ac2o的摩尔数之比为1:(1.0~1.5),优选为1:1.2;所述反应的溶剂为有机溶剂,优选为二氯甲烷;所述反应的温度为室温;所述反应是在dmap和三乙胺的存在下进行的;
[0050]
和/或,步骤(2’)中,化合物t-2与acsh的摩尔比为1:(2~4),优选为1:3;所述反应的溶剂为有机溶剂,优选为二氯甲烷;所述反应的温度为0~室温;所述反应是在tmsotf的存在下进行的;
[0051]
和/或,步骤(3’)中,化合物t-3与的摩尔数之比为1:(1.0~1.5),优选为1:1.2;所述反应的溶剂为有机溶剂,优选为二氯甲烷;所述反应的温度为10℃~室温;所述反应是在碱的存在下进行的;
[0052]
和/或,步骤(4’)中,化合物t-4与化合物t-4a的摩尔数之比为1:(1.0~1.5),优选为1:1.2;所述反应的溶剂为有机溶剂、水或其混合物,优选为丙酮与水的混合物;所述反应的温度为10℃~室温;所述反应是在碱的存在下进行的;
[0053]
或者,所述方法为方法三,包括以下步骤:
[0054][0055][0056]
(1”)化合物t-1与ac2o反应,得到t-2;
[0057]
(2”)化合物t-2与hbr反应,得到t-5;
[0058]
(3”)化合物t-5与反应,得到t-6;
[0059]
(4”)化合物t-6与反应,得到式i’所示化合物;
[0060]
其中,a环、r0、r5、r6、r7、r8如上所述,rx为卤素,优选为碘或溴;
[0061]
优选的,步骤(1”)中,化合物t-1中羟基的摩尔数与ac2o的摩尔数之比为1:(1.0~1.5),优选为1:1.2;所述反应的溶剂为有机溶剂,优选为二氯甲烷;所述反应的温度为室温;所述反应是在dmap和三乙胺的存在下进行的;
[0062]
和/或,步骤(2”)中,hbr为浓度33%的hbr醋酸溶液,化合物t-2与hbr醋酸溶液的质量体积比为1:10g/ml,所述反应的温度为0℃~室温;
[0063]
和/或,步骤(3”)中,化合物t-5与的摩尔数之比为1:(1.0~2.0),优选为1:1.5;所述反应的溶剂为有机溶剂,优选为丙酮;所述反应的温度为室温~60℃;
[0064]
和/或,步骤(4”)中,化合物t-6与的摩尔数之比为1:(1.0~1.5),优选为1:1.2;所述反应的溶剂为有机溶剂、水或其混合物,优选为丙酮与水的混合物;所述反应的温度为10℃~室温;所述反应是在碱的存在下进行的。
[0065]
本发明还提供了一种制备式i”所示糖基供体的方法,所述方法包括以下步骤:式i’与m-cpba反应,得到式i”所示化合物;
[0066][0067]
其中,a环、r0、r5、r6、r7、r8如上所述;式i’如上所述;
[0068]
优选的,式i’与m-cpba的摩尔比为1:(1.0~2.0),优选为1:1.3;所述反应的溶剂为有机溶剂,优选为二氯甲烷;所述反应的温度为0~-80℃,优选为-78℃。
[0069]
糖基供体是指合成糖苷时,含有糖苷键的原料,或含有参加反应的端基异头碳的原料;而与之反应的另一种原料被称为糖基受体。
[0070]
本发明的糖基供体可以采用糖基供体的合成实施例中的路线一~路线六中的至少一条路线制得,也可以采用其他的方法来制备。
[0071]
试验证明,本发明提供的糖基供体结构新颖,并且其制备方法简单;以本发明的糖基供为原料,可以制备得到了具有特殊α构型的糖苷(比如碳苷),而且该制备方法简单、反应条件温和、收率高,具有非常好的应用前景。
[0072]
本发明中,ac表示乙酰基,结构为ph表示苯基,结构为bz表示苯甲酰基,结构为boc表示叔丁氧羰基,结构为me表示甲基。
[0073]“m-cpba”为间氯过氧苯甲酸。
[0074]“dmap”为4-二甲氨基吡啶。
[0075]“et3n”为三乙胺。
[0076]“et2o”为乙醚。
[0077]“acsh”为ac-sh。
[0078]“tmsotf”为三甲硅基三氟甲磺酸脂。
[0079]
室温为25
±
2℃。
[0080]
ar表示芳基,是芳烃分子的芳核碳上去掉一个氢原子后,剩下基团的总称,包括单环、双环或多环的芳基;杂芳基是含杂原子的芳核上去掉一个氢原子后,剩下基团的总称,包括单环、双环或多环的杂芳基。
[0081]
糖基供体是指合成糖苷时,含有糖苷键的原料,或含有参加反应的端基异头碳的原料;而与之反应的另一种原料被称为糖基受体。
[0082]
本发明中,碳氢基团中碳原子含量的最小值和最大值通过前缀表示,例如,前缀ca~b烷基表明任何含“a”至“b”个碳原子的烷基,包括直链烷基和支链烷基。因此,例如,c
1-6
烷基是指包含1-6个碳原子的直链烷基和支链烷基。
[0083]
类似的,c
1-6
烷氧基是指包含1-6个碳原子的直链烷基和支链烷氧基。
[0084]“芳基”指具有共轭的π电子体系的全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,例如苯基和萘基。所述芳基环可以稠合于其它环状基团(包括饱和和不饱和环),但不能含有杂原子如氮,氧,或硫,同时连接母体的点必须在具有共轭的π电子体系的环上的碳原子上。芳基可以是取代的或未取代的。
[0085]“杂芳基”指包含一个到多个杂原子的杂芳族基团。这里所指的杂原子包括氧、硫和氮。例如呋喃基、噻吩基、吡啶基、吡唑基、吡咯基、n-烷基吡咯基、嘧啶基、吡嗪基、咪唑基、四唑基等。所述杂芳基环可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环。杂芳基可以是任选取代的或未取代的。
[0086]“环烷基”指饱和或不饱和的环状烃取代基;环状烃可以是单环也可以是多环。“饱和环烷基”指饱和的环烷基。
[0087]“杂环基”指饱和或不饱和的环状烃取代基;环状烃可以是单环也可以是多环,且携带至少一个环杂原子(包括但不限于o、s或n)。“饱和杂环基”指饱和的杂环基。
[0088]
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
[0089]
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
具体实施方式
[0090]
本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
[0091]
以下为本发明糖基供体的合成实施例。
[0092]
实施例1、化合物3的合成
[0093]
根据以下合成路线一,得到化合物3。
[0094][0095]
反应条件1:
[0096]
氮气保护下,将box配体(0.1equiv.)和催化剂(0.05equiv.)加入反应瓶中,然后加入三乙胺(3.0equiv.)和干燥甲苯溶剂。在氮气保护下,80℃下搅拌15分钟。然后冷却至室温,在氮气保护下,依次加入全ac-保护的巯基葡萄糖底物1(1.0equiv)和高碘试剂2(1.5equiv.)并在氮气保护下反应。
[0097]
反应条件2:
[0098]
将全ac-保护的巯基葡萄糖底物1(1.0equiv)和高碘试剂2(1.5equiv.)加入圆底烧瓶中,在氮气保护下加入干燥甲苯,cu催化剂(0.2equiv.),和三乙胺(3.0equiv.),在氮气保护下加热反应。反应结束后,硅藻土过滤,然后将滤液减压浓缩,用硅胶柱层析分离纯化,得到白色固体的糖基硫醚产物3(50
–
60%的分离产率)。
[0099]
反应条件3:
[0100]
在氮气保护下,将催化剂pd(0.1equiv.),配体xantphos(4,5-双(二苯基膦)-9,9-二甲基氧杂蒽,0.2equiv.),和干燥四氢呋喃溶剂加入干燥的圆底烧瓶中,在氮气保护下活化20分钟,然后再氮气保护下依次加入三乙胺,全ac-保护的巯基葡萄糖底物1和高碘试剂2,氮气保护在室温下反应。反应结束后,硅藻土过滤,然后将滤液减压浓缩,用硅胶柱层析分离纯化,得到白色固体的糖基硫醚产物3(50%的分离产率)。其系统命名及结构表征如下:
[0101]
(2r,3r,4s,5r)-2-(acetoxymethyl)-6-((2'-iodo-[1,1'-biphenyl]-2-yl)thio)tetrahydro-2h-pyran-3,4,5-triyl triacetate
[0102]1h nmr(400mhz,cdcl3)δ:7.90(ddt,j=8.1,2.7,1.3hz,1h),7.82
–
7.65(m,1h),7.43
–
7.33(m,3h),7.24
–
7.12(m,2h),7.05(td,j=7.7,1.5hz,1h),5.26
–
5.00(m,2.2h),4.93(tdd,j=10.7,9.0,1.3hz,0.9h),4.76(dd,j=10.2,1.3hz,0.5h),4.53(dd,j=10.2,1.3hz,0.3h),4.37
–
4.15(m,1.8h),3.94(dd,j=12.9,1.3hz,0.1h),3.83(d,j=12.9hz,0.1h),3.79
–
3.71(m,0.4h),3.69
–
3.54(m,0.4h),2.10(td,j=3.6,1.2hz,3h),2.02
–
1.94(m,6h),1.88(d,j=1.3hz,2h),1.79(d,j=1.3hz,1h).
[0103]
采用与实施例1中化合物3相同的合成方法,分别将合成路线中的原料1替换,得到本发明的化合物4和化合物5,所得化合物的结构与表征如下:
[0104]
实施例2、化合物4的合成
[0105][0106]
(3r,4r,5s,6s)-2-((2'-iodo-[1,1'-biphenyl]-2-yl)thio)-6-methyltetrahydro-2h-pyran-3,4,5-triyl triacetate
[0107]1h nmr(400mhz,cdcl3)δ:7.94(dd,j=8.0,1.3hz,1h),7.69(dd,j=7.7,1.5hz,0.5h),7.62(dd,j=7.6,1.5hz,0.5h),7.45
–
7.30(m,3h),7.21(ddd,j=11.0,7.6,1.7hz,1h),7.15(ddd,j=7.4,4.4,1.7hz,1h),7.08(tt,j=7.7,1.9hz,1h),5.42(d,j=1.7hz,0.5h),5.38(dd,j=2.9,1.7hz,0.5h),5.34(d,j=1.7hz,0.5h),5.24(dd,j=3.2,1.6hz,0.5h),5.17
–
4.95(m,2h),4.23(dq,j=9.2,6.2hz,0.5h),4.08
–
3.98(m,0.5h),2.13(d,j=2.7hz,3h),2.03(d,j=5.9hz,3h),1.96(d,j=2.5hz,3h),1.20(dd,j=6.2,3.3hz,3h).
[0108]
实施例3、化合物5的合成
[0109][0110]
(3s,4r,5r)-2-((2'-iodo-[1,1'-biphenyl]-2-yl)thio)tetrahydro-2h-pyran-3,4,5-triyl triacetate
[0111]1h nmr(400mhz,cdcl3)δ:7.92(dd,j=7.9,1.3hz,1h),7.74(dd,j=7.1,1.8hz,0.6h),7.70
–
7.65(m,0.4h),7.43
–
7.31(m,3h),7.22(ddd,j=7.7,6.1,1.7hz,1h),7.18
–
7.12(m,1h),7.06(td,j=7.6,1.7hz,1h),5.26(ddq,j=13.8,5.4,2.5hz,1h),5.18(t,j=8.3hz,0.6h),5.10(t,j=7.6hz,0.4h),5.01(ddd,j=10.7,8.2,3.4hz,1h),4.82(d,j=8.0hz,0.6h),4.72(d,j=7.1hz,0.4h),4.08(ddd,j=14.2,12.6,4.5hz,1h),3.63(ddd,j=17.5,12.6,2.4hz,1h),2.11(d,j=6.0hz,3h),1.97(d,j=2.1hz,3h),1.91(d,j=8.7hz,3h).
[0112]
实施例4和5、化合物7和8的合成
[0113]
根据以下合成路线二,得到化合物7和化合物8:
[0114][0115]
步骤1:化合物5(2.0g,5.0mmol,1.0equiv.)和化合物6(1.6g,6.0mmol,1.2equiv.)溶于二氯甲烷(10ml)中,在0℃下加入eto2·
bf3(1.9ml,15.0mmol,3.0equiv.),形成的反应混合物在室温下搅拌,直到化合物1消耗完毕(反应过程中,通过tlc点板对反应进行监测)。反应结束后,在0℃下向反应体系中缓慢加入et3n(6ml)淬灭反应。反应体系中加入20ml二氯甲烷,并依次用等体积的1n盐酸、饱和nahco3溶液、饱和nacl溶液洗涤,最后用无水硫酸钠干燥,减压蒸馏,然后通过硅胶柱层析分离纯化(300目
–
400目硅胶,石油醚/乙酸乙酯=3:1),得到白色固体糖基硫醚产物7(2.55g,4.3mmol,86%)。其系统命名及结构表征如下:2-(2-iodophenyl)ethyl 2,3,4,6-tetra-o-acetyl-β-d-1-thioglucopyranoside1h nmr(cdcl3,400mhz)δ:7.82(dd,j=7.9,1.3hz,1h),7.29(td,j=7.3,1.3hz,1h),7.25(dd,j=7.6,2.1hz,1h),6.92(ddd,j=7.9,7.0,2.1hz,1h),5.23(t,j
=9.3hz,1h),5.10(dd,j=9.4hz,1h),5.06(dd,j=10.1,9.2hz,1h),4.58(d,j=10.1hz,1h),4.27(dd,j=12.3,5.0hz,1h),4.17(dd,j=12.3,2.4hz,1h),3.73(ddd,j=10.0,5.0,2.4hz,1h),3.08
–
3.02(m,2h),3.01
–
2.92(m,1h),2.87
–
2.78(m,1h),2.058(s,3h),2.057(s,3h),2.03(s,3h),2.01(s,3h).
[0116]
步骤2:用15ml的二氯甲烷将化合物7(3.04g,5.0mmol,1.0equiv)溶于50ml的圆底烧瓶中,并将其冷却到-78℃,在此温度下,搅拌10min后,往瓶中缓慢加入m-cpba(1.12g,6.5mmol,1.3equiv.),在-78℃的温度下搅拌,直到化合物3消耗完毕(反应过程中,通过tlc点板检测反应)。反应结束后,在-78℃下,往反应液中加入饱和nahco3水溶液,随即加入30ml二氯甲烷。之后将反应混合物转移到分液漏斗中,分层后,有机层依次用1n盐酸、饱和nacl溶液洗涤,然后用无水硫酸钠干燥,减压蒸馏,硅胶柱层析分离纯化(300目
–
400目硅胶,石油醚/乙酸乙酯=2:1
–
1:1),得到白色固体糖基亚砜产物8(2.73g,5.4mmol,90%)。其系统命名及结构表征如下:
[0117]
1-[(2-iodophenethyl)thio]-2,3,4,6-tetra-o-acetyl-β-d-glucopyranosid
[0118]1h nmr(400mhz,cdcl3)δ:7.82(dd,j=7.9,1.3hz,1h),7.33
–
7.22(m,2h),6.92(ddd,j=7.9,7.0,2.1hz,1h),5.23(t,j=9.3hz,1h),5.10(dd,j=9.4hz,1h),5.06(dd,j=10.1,9.2hz,1h),4.58(d,j=10.1hz,1h),4.27(dd,j=12.3,5.0hz,1h),4.17(dd,j=12.3,2.4hz,1h),3.73(ddd,j=10.0,5.0,2.4hz,2h),3.08
–
3.02(m,2h),3.01
–
2.92(m,1h),2.87
–
2.78(m,1h),2.06(s,3h),2.06(s,3h),2.03(s,3h),2.01(s,3h).
[0119]
采用与实施例4和5中化合物7和化合物8相同的合成方法,分别将步骤1中的原料5替换,得到本发明的化合物9~24,所得化合物的结构与表征如下:
[0120]
实施例6、化合物9的合成
[0121][0122]
1-((2-iodophenethyl)thio)-2,3,4,6-tetra-o-acetyl-(α/β)-d-mannopyranoside
[0123]1h nmr(cdcl3,400mhz)δ:7.82(dd,j=8.0,1.2hz,0.17h),7.81(dd,j=7.9,1.1hz,0.83h),7.35
–
7.26(m,1.17h),7.23(dd,j=7.6,1.9hz,0.83h),6.94(td,j=7.6,1.9hz,0.17h),6.92(td,j=7.6,1.9hz,0.83h),5.51(dd,j=3.5,1.1hz,0.17h),5.36(dd,j=3.1,1.5hz,0.83h),5.35
–
5.22(m,2.66h),5.04(dd,j=10.1,3.6hz,0.17h),4.79(d,j=1.2hz,0.17h),4.38(ddd,j=8.9,5.4,2.1hz,0.83h),4.32(dd,j=12.0,5.4hz,0.83h),4.29(dd,j=12.3,6.0hz,0.17h),4.18(dd,j=12.2,2.6hz,0.17h),4.09(dd,j=12.0,2.1hz,0.83h),3.71(ddd,j=10.0,6.0,2.6hz,0.17h),3.18
–
2.97(m,2h),2.97
–
2.77(m,2h),2.19(s,0.51h),2.17(s,2.49h),2.05(s,6h),1.99(s,2.49h),1.98(s,0.51h).
[0124]
实施例7、化合物10的合成
[0125][0126]
2-(2-iodophenyl)ethyl 2,3,4,6-tetra-o-acetyl-α-d-1-thiomannopyranoside s-oxide
[0127]1h nmr(cdcl3,400mhz)δ:7.84(d,j=7.7hz,1h),7.36
–
7.31(m,2h),6.96(ddd,j=8.0,5.6,3.5hz,1h),5.88(dd,j=3.7,1.9hz,1h),5.58(dd,j=9.7,3.7hz,1h),5.33(t,j=9.8hz,1h),4.71(d,j=2.0hz,1h),4.26(dd,j=12.5,5.8hz,1h),4.13
–
4.01(m,2h),3.30
–
3.16(m,3h),3.14
–
3.03(m,1h),2.18(s,3h),2.06(s,3h),2.05(s,3h),2.03(s,3h).
[0128]
实施例8、化合物11的合成
[0129][0130]
2-(2-iodophenyl)ethyl 2,3,4-tri-o-acetyl-α/β-l-1-thiorhamnopyranoside
[0131]1h nmr(cdcl
3,
400mhz)δ:7.82(dd,j=8.0,1.3hz,0.22h),7.81(dd,j=7.9,1.2hz,0.78h),7.34
–
7.20(m,2h),6.99
–
6.83(m,1h),5.49(dd,j=3.4,1.0hz,0.22h),5.36(dd,j=3.4,1.6hz,0.78h),5.23(dd,j=9.4,4.1hz,0.78h),5.22(d,j=1.3hz,0.78h),5.10(t,j=9.8hz,0.78h),5.09(t,j=9.7hz,0.22h),4.99(dd,j=10.1,3.5hz,0.22h),4.75(d,j=1.1hz,0.22h),4.21(dq,j=9.6,6.2hz,0.78h),3.55(dq,j=9.5,6.2hz,0.22h),3.18
–
2.98(m,2h),2.97
–
2.75(m,2h),2.18(s,0.66h),2.16(s,2.34h),2.05(s,2.34h),2.05(s,0.66h),1.98(s,2.34h),1.98(s,0.66h),1.31(d,j=6.1hz,0.66h),1.24(d,j=6.3hz,2.34h)
[0132]
实施例9、化合物12的合成
[0133][0134]
2-(2-iodophenyl)ethyl 2,3,4-tri-o-acetyl-α-l-1-thiorhamnopyranoside s-oxide
[0135]1h nmr(cdcl3,400mhz)δ:7.86(d,j=7.9hz,1h),7.39
–
7.31(m,2h),6.98(tdd,j=10.1,4.5,3.2hz,1h),5.89(dd,j=3.8,1.8hz,0.74h),5.87(dd,j=3.0,1.3hz,0.26h),5.53(dd,j=9.9,3.7hz,0.74h),5.16(t,j=9.7hz,0.74h),5.12(d,j=9.0hz,0.26h),5.09(dd,j=10.0,3.1hz,0.26h),4.67(d,j=1.9hz,0.74h),4.45(d,j=1.4hz,0.26h),3.92(dq,j=9.5,6.1hz,0.74h),3.62(dq,j=8.9,6.1hz,0.26h),3.35
–
3.17(m,3h),3.16
–
3.03(m,1h),2.21(s,0.78h),2.19(s,2.22h),2.08(s,0.78h),2.07(s,2.22h),2.04(s,2.22h),2.01(s,0.78h),1.31(d,j=6.2hz,0.78h),1.26(d,j=6.2hz,2.22h).
[0136]
实施例10、化合物13的合成
[0137][0138]
2-(2-iodophenyl)ethyl 2,3,4-tri-o-acetyl-β-l-1-thiofucopyranoside
[0139]1h nmr(cdcl3,400mhz)δ:7.87(dd,j=7.9,1.2hz,1h),7.50
–
7.22(m,2h),6.97(ddd,j=8.0,6.8,2.3hz,1h),5.34(dd,j=3.4,1.1hz,1h),5.29(t,j=10.0hz,1h),5.10(dd,j=10.0,3.5hz,1h),4.58(d,j=10.0hz,1h),3.89(q,j=6.4hz,1h),3.18
–
3.06(m,2h),3.07
–
3.00(m,1h),2.95
–
2.80(m,1h),2.23(s,3h),2.12(s,3h),2.04(s,3h),1.30(d,j=6.6hz,3h).
[0140]
实施例11、化合物14的合成
[0141][0142]
2-(2-iodophenyl)ethyl 2,3,4-tri-o-acetyl-β-l-1-thiofucopyranoside s-oxide
[0143]1h nmr(cdcl3,400mhz)δ:8.02
–
7.61(m,1h),7.56
–
7.29(m,2h),7.06
–
6.79(m,1h),5.66(t,j=10.0hz,0.3h),5.42(t,j=10.0hz,0.7h),5.31(dd,j=3.4,1.2hz,0.7h),5.30(dd,j=3.5,1.2hz,0.3h),5.16(dd,j=10.2,3.4hz,0.3h),5.13(dd,j=10.0,3.3hz,0.7h),4.36(d,j=10.1hz,0.7h),4.04(d,j=9.9hz,0.3h),3.92(qd,j=6.7,1.2hz,0.7h),3.91(qd,j=6.7,1.2hz,0.3h),3.39
–
3.02(m,4h),2.18(s,0.9h),2.17(s,2.1h),2.07(s,3h),2.00(s,0.9h),1.99(s,2.1h),1.28(d,j=6.4hz,0.9h),1.24(d,j=6.4hz,2.1h).
[0144]
实施例12、化合物15的合成
[0145][0146]
2-(2-iodophenyl)ethyl(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)-(1
→
4)-2,3,6-tri-o-acetyl-β-d-1-thioglucopyranoside
[0147]1h nmr(cdcl3,400mhz)δ:7.82(dd,j=7.9,1.2hz,1h),7.29(td,j=7.4,1.1hz,1h),7.24(dd,j=7.6,2.0hz,1h),6.93(td,j=7.5,2.0hz,1h),5.41(d,j=4.0hz,1h),5.37(dd,j=10.6,9.5hz,1h),5.29(t,j=9.0hz,1h),5.05(t,j=9.9hz,1h),4.90(t,j=9.8hz,1h),4.87(dd,j=10.5,4.1hz,1h),4.65(d,j=10.1hz,1h),4.51(dd,j=12.1,
2.7hz,1h),4.26(dd,j=4.4,3.4hz,1h),4.23(dd,j=4.4,3.1hz,1h),4.05(dd,j=12.7,2.5hz,1h),4.00(t,j=9.4hz,1h),3.96(dd,j=4.0,2.4hz,1h),3.73(ddd,j=9.8,4.7,2.6hz,1h),3.11
–
2.96(m,2h),2.94(ddd,j=13.1,10.0,5.9hz,1h),2.80(ddd,j=13.1,9.4,6.7hz,1h),2.105(s,3h),2.101(s,3h),2.05(s,3h),2.031(s,3h),2.025(s,3h),2.01(s,3h),2.00(s,3h).
[0148]
实施例13、化合物16的合成
[0149][0150]
2-(2-iodophenyl)ethyl(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)-(1
→
4)-2,3,6-tri-o-acetyl-β-d-1-thioglucopyranoside s-oxide
[0151]1h nmr(cdcl3,400mhz)δ:7.85(dd,j=7.8,2.8hz,1h),7.32(dd,j=6.2,4.3hz,2h),6.96(dtd,j=7.9,5.4,4.0hz,1h),5.46
–
5.21(m,4h),5.07(t,j=9.9hz,0.63h),5.03(t,j=9.8hz,0.37h),4.88(dt,j=10.6,3.9hz,1h),4.54(dd,j=12.3,2.8hz,0.37h),4.53(dd,j=12.4,2.4hz,0.63h),4.45(d,j=8.1hz,0.63h),4.29
–
4.13(m,2.37h),4.10
–
3.90(m,3h),3.81(ddd,j=9.6,4.8,2.3hz,0.63h),3.77(dq,j=7.7,2.6hz,0.37h),3.36
–
3.17(m,2h),3.17
–
3.03(m,2h),2.17
–
1.93(m,21h).
[0152]
实施例14、化合物17的合成
[0153][0154]
(3s,4s,5r)-2-((2-iodophenethyl)thio)tetrahydro-2h-pyran-3,4,5-triyl triacetate
[0155]1h nmr(400mhz,cdcl3)δ7.81(dd,j=7.9,1.4hz,1h),7.34
–
7.17(m,2h),7.01
–
6.82(m,1h),5.34
–
5.22(m,2h),5.19
–
5.04(m,2h),4.01
–
3.83(m,2h),3.09
–
2.94(m,2h),2.94
–
2.72(m,2h),2.13(d,j=9.8hz,3h),2.07(s,3h),2.04(s,3h).
[0156]
实施例15、化合物18的合成
[0157][0158]
(3s,4s,5r)-2-((2-iodophenethyl)sulfinyl)tetrahydro-2h-pyran-3,4,5-triyl triacetate
[0159]1h nmr(400mhz,cdcl3)δ:7.84(d,j=7.9hz,1h),7.31(t,j=4.1hz,2h),6.98
–
6.90(m,1h),5.36
–
5.17(m,2h),4.96(td,j=8.6,5.0hz,1h),4.42(d,j=8.4hz,1h),4.26(dd,j=11.7,5.0hz,1h),3.46(ddd,j=23.7,11.5,9.3hz,1h),3.38
–
3.20(m,2h),3.19
–
3.00(m,2h),2.11
–
2.01(m,9h).
[0160]
实施例16、化合物19的合成
[0161][0162]
(3s,4r,5r)-2-((2-iodophenethyl)thio)tetrahydro-2h-pyran-3,4,5-triyl triacetate
[0163]1h nmr(400mhz,cdcl3)δ7.81(dd,j=7.9,1.4hz,1h),7.34
–
7.17(m,2h),7.01
–
6.82(m,1h),5.34
–
5.22(m,2h),5.19
–
5.04(m,2h),4.01
–
3.83(m,2h),3.09
–
2.94(m,2h),2.94
–
2.72(m,2h),2.13(d,j=9.8hz,3h),2.07(s,3h),2.04(s,3h).
[0164]
实施例17、化合物20的合成
[0165][0166]
(3s,4r,5r)-2-((2-iodophenethyl)sulfinyl)tetrahydro-2h-pyran-3,4,5-triyl triacetate
[0167]1h nmr(400mhz,cdcl3)δ:7.91
–
7.74(m,1h),7.36
–
7.28(m,2h),6.95(ddt,j=8.7,6.1,3.1hz,1h),5.73(d,j=3.6hz,0.1h),5.64(t,j=9.3hz,0.2h),5.54(t,j=4.1hz,0.2h),5.48(t,j=8.2hz,0.5h),5.43
–
5.37(m,0.2h),5.34(dt,j=3.8,1.8hz,0.7h),5.28
–
5.11(m,1h),4.63(d,j=2.0hz,0.3h),4.38(d,j=8.0hz,0.5h),4.36
–
4.16(m,0.4h),4.16
–
4.07(m,0.5h),4.04(d,j=9.1hz,0.2h),3.94(dd,j=11.1,4.8hz,0.3h),3.82
–
3.58(m,1h),3.39
–
2.91(m,4h),2.37
–
1.88(m,9h).
[0168]
实施例18、化合物21的合成
[0169][0170]
(3s,4s,5r)-2-((2-iodophenethyl)sulfinyl)tetrahyro-2h-pyran-3,4,5-triyl triacetate
[0171]1h nmr(400mhz,cdcl3)δ:7.81(dd,j=7.9,1.1hz,1h),7.32
–
7.21(m,2h),6.91(td,j=7.6,1.9hz,1h),5.18(t,j=8.4hz,1h),5.04
–
4.93(m,2h),4.60(d,j=8.6hz,1h),4.24(dd,j=11.6,5.1hz,1h),3.39(dd,j=11.6,9.1hz,1h),3.07
–
2.87(m,3h),2.81(ddd,j=12.8,8.4,7.4hz,1h),2.07(s,3h),2.05(d,j=0.8hz,6h).
[0172]
实施例19、化合物22的合成
[0173][0174]
(3r,4s,5r)-2-((2-iodophenethyl)sulfinyl)tetrahydro-2h-pyran-3,4,5-triyl triacetate
[0175]1h nmr(400mhz,cdcl3)δ:7.84(d,j=7.9hz,1h),7.31(t,j=4.1hz,2h),7.02
–
6.84(m,1h),5.41(t,j=9.2hz,0.2h),5.34
–
5.25(m,1h),5.21(t,j=8.2hz,0.8h),5.06(td,j=9.3,5.4hz,0.2h),4.96(td,j=8.6,5.0hz,0.8h),4.42(d,j=8.4hz,0.8h),4.37(dd,j=11.4,5.4hz,0.2h),4.26(dd,j=11.6,5.0hz,0.8h),4.09(d,j=9.4hz,0.2h),3.49(dd,j=11.7,9.0hz,0.8h),3.43(dd,j=11.5,9.8hz,0.2h),3.36
–
3.00(m,4h),2.10
–
2.00(m,9h).
[0176]
实施例20、化合物23的合成
[0177][0178]
2-(2-iodophenyl)ethyl-2,3,5-tri-o-acetyl-β-d-1-thioribofuranoside
[0179]1h nmr(cdcl3,400mhz)δ:7.81(dd,j=7.9,1.2hz,1h),7.31
–
7.21(m,2h),6.92(ddd,j=8.0,6.6,2.4hz,1h),5.59(d,j=9.4hz,1h),5.15(t,j=9.4hz,1h),5.10(t,j=9.4hz,1h),4.63(d,j=10.4hz,1h),4.25(dd,j=12.3,5.1hz,1h),4.17(dd,j=12.3,2.5hz,1h),4.12(q,j=9.7hz,1h),3.71(ddd,j=9.4,5.1,2.4hz,1h),3.13
–
3.03(m,2h),3.03
–
2.92(m,1h),2.83(ddd,j=12.5,9.0,6.0hz,1h),2.06(s,3h),2.03(s,3h),2.03(s,3h),1.96(s,3h).
[0180]
实施例21、化合物24的合成
[0181][0182]
2-(2-iodophenyl)ethyl 2,3,5-tri-o-acetyl-α/β-d-1-thioribofuranoside s-oxide
[0183]1h nmr(cdcl3,400mhz)δ:7.87
–
7.78(m,1h),7.47
–
7.23(m,2h),7.00
–
6.91(m,1h),5.84(t,j=2.9hz,0.37h),5.72(d,j=2.6hz,0.20h),5.67(t,j=3.0hz,0.43h),5.30(td,j=8.9,3.0hz,0.80h),5.24(t,j=3.6hz,0.20h),5.22
–
5.17(m,0.20h),5.11(ddd,j=10.1,5.3,2.8hz,0.37h),5.05(ddd,j=9.6,4.9,2.8hz,0.43h),4.63(d,j=8.8hz,0.43h),4.45(d,j=1.9hz,0.20h),4.25(d,j=9.5hz,0.37h),4.19(dd,j=10.4,2.7hz,0.20h),4.17(dd,j=10.8,5.2hz,0.37h),4.05(dd,j=11.1,4.9hz,0.43h),3.82(dd,j=13.0,1.8hz,0.20h),3.78(dd,j=11.3,9.6hz,0.43h),3.76(t,j=10.5hz,0.37h),3.36(ddd,j=12.3,9.0,4.8hz,0.43h),3.30
–
3.01(m,3.57h),2.17(s,0.6h),2.17(s,1.29h),2.16(s,1.11h),2.14(s,0.6h),2.06(s,1.29h),2.05(s,1.11h),2.04(s,1.29h),2.03(s,0.6h),2.03(s,1.11h).
[0184]
实施例22和23、化合物30和化合物31的合成
[0185]
根据以下合成路线三,得到化合物30和化合物31:
[0186][0187]
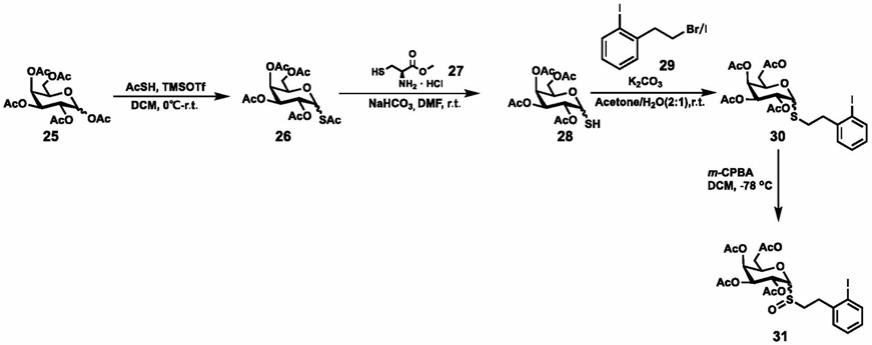
步骤1:将acsh(1.1ml,15.0mmol,3.0equiv.)在0℃的条件下加入到溶有全乙酰基保护的半乳糖(2.1g,5.0mmol,1.0equiv.)的dcm的溶液中,再分批加入tmsotf(1.1ml,6.0mmol,1.2equiv.)溶液。反应溶液提至室温搅拌过夜。点板监测(石油醚/乙酸乙酯:3:2,rf=0.5)。在冰浴中,向反应体系中缓慢加入水(6ml)以淬灭反应,dcm萃取水相,分液,有机相依次用饱和nahco3(20ml*2)、饱和nacl溶液(30ml*1)洗,最后用无水硫酸钠干燥,减压蒸馏。产品不需进一步纯化,得到乙酰基保护的ac-巯基糖。
[0188]
步骤2:将上一步得到的ac-巯基糖(1.8g,5.0mmol,1.0equiv.)和半胱氨酸甲酯盐酸盐(1.03g,6.0mmol,1.2equiv.)溶于dmf(10ml)中,再加入nahco3(504mg 6.0mmol,1.2equiv.),并在室温下(10℃)搅拌过夜,点板监测(石油醚/乙酸乙酯:3:1,rf=0.3)。反应结束后,反应体系中加入30ml ea,有机相用半饱和nacl溶液(30ml*3)、饱和nacl溶液(30ml)洗涤,最后用无水硫酸钠干燥,减压蒸馏,硅胶柱纯化(石油醚/乙酸乙酯=3:1),得到黄色固体产物sh-巯基糖。
[0189]
步骤3:将sh-巯基糖(1.82g,5.0mmol,1.0equiv.)、k2co3(2.07g,15.0mmol,3.0equiv.)溶于acetone/h2o(20:10ml)的混合溶剂中,再加入化合物29(2.14g,6.0mmol,1.2equiv.),随后将反应室温搅拌,点板监测(石油醚/乙酸乙酯:2:1,rf=0.5)。反应结束后,体系中加入dcm(40ml)和水(15ml),分液后,有机相用饱和nacl溶液(30ml*1)洗涤,最后用无水硫酸钠干燥,减压蒸馏。硅胶柱纯化(石油醚/乙酸乙酯=3:1),得到白色固体糖基硫醚产物30(2.55g,4.3mmol,86%)。其结构与表征如下:
[0190]
1-((2-iodophenethyl)thio)-2,3,4,6-tetra-o-acetyl-β-d-galactopyranoside
[0191]1h nmr(400mhz,cdcl3)δ:7.82(dd,j=7.9,1.1hz,1h),7.34
–
7.22(m,2h),6.92(ddd,j=8.0,6.9,2.2hz,1h),5.44(dd,j=3.5,1.1hz,1h),5.26(t,j=10.0hz,1h),5.06(dd,j=10.0,3.4hz,1h),4.57(d,j=9.9hz,1h),4.20(dd,j=11.3,6.8hz,1h),4.13(dd,j=11.3,6.5hz,1h),3.96(td,j=6.6,1.2hz,1h),3.15
–
3.03(m,2h),3.02
–
2.92(m,1h),2.84(ddd,j=13.0,9.4,6.5hz,1h),2.17(d,j=16.3hz,3h),2.16(s,3h),2.07(s,3h),2.03(s,3h),1.99(s,3h).
[0192]
步骤4:用15ml的二氯甲烷将化合物3(2.550g,4.29mmol,1.0equiv)溶于50ml的圆底烧瓶中,并将其冷却到-78℃,在此温度下,搅拌10min后,往瓶中缓慢加入m-cpba(0.965g,6.80mmol,1.6equiv.),在-78℃的温度下搅拌,直到上述合成的糖基硫醚消耗完
毕(反应过程中,通过tlc点板检测反应)。反应结束后,在-78℃下,往反应液中加入饱和nahco3水溶液,随即加入30ml二氯甲烷。之后将反应混合物转移到分液漏斗中,分层后,有机层依次用1n盐酸、饱和nacl溶液洗涤,然后用无水硫酸钠干燥,减压蒸馏,硅胶柱层析分离纯化(300目
–
400目硅胶,石油醚/乙酸乙酯=2:1
–
1:1),得到白色固体糖基亚砜产物31(1.930g,3.16mmol,74%)。其系统命名及结构表征如下:
[0193]
2-(2-iodophenyl)ethyl 2,3,4,6-tetra-o-acetyl-β-d-1-thiogalacopyranoside s-oxide
[0194]1h nmr(cdcl3,400mhz)δ:7.85(d,j=7.9hz,1h),7.36
–
7.23(m,2h),7.01
–
6.88(m,1h),5.68(t,j=10.0hz,0.37h),5.53
–
5.40(m,1.63h),5.16(ddd,j=13.2,10.1,3.3hz,1h),4.38(d,j=10.0hz,0.63h),4.31
–
3.95(m,3.37h),3.41
–
3.30(m,0.37h),3.30
–
2.99(m,3.63h),2.17(s,1.11hf),2.15(s,1.89h),2.07(s,3h),2.02
–
1.96(m,6h).
[0195]
采用与实施例22和23中化合物30和化合物31相同的合成方法,分别将步骤1中的原料25替换,得到本发明的化合物32和化合物33,所得化合物的结构与表征如下:
[0196]
实施例24、化合物32的合成
[0197][0198]
2-(2-iodophenyl)ethyl(2,3,4,6-tetra-o-acetyl-α-d-galactopyranosyl)-(1
→
4)-2,3,6-tri-o-acetyl-β-d-1-thioglucopyranoside
[0199]1h nmr(cdcl3,400mhz)δ:7.81(dd,j=7.9,1.3hz,1h),7.28(td,j=7.0,6.5,1.3hz,1h),7.24(dd,j=7.6,2.0hz,1h),6.92(td,j=7.5,2.0hz,1h),5.35(dd,j=3.5,1.3hz,1h),5.22(t,j=9.2hz,1h),5.11(dd,j=10.4,7.8hz,1h),5.01
–
4.88(m,2h),4.57(d,j=10.0hz,1h),4.51(dd,j=12.0,1.9hz,1h),4.49(d,j=7.9hz,1h),4.17
–
4.01(m,3h),3.88(td,j=6.9,1.3hz,1h),3.80(dd,j=9.9,9.1hz,1h),3.65(ddd,j=9.9,5.5,2.1hz,1h),3.11
–
2.97(m,2h),2.92(ddd,j=13.1,9.8,5.9hz,1h),2.81(ddd,j=13.2,9.3,6.8hz,1h),2.15(s,3h),2.08(s,3h),2.06(s,3h),2.051(s,6h),2.048(m,3h),1.96(s,3h).
[0200]
实施例25、化合物33的合成
[0201][0202]
2-(2-iodophenyl)ethyl(2,3,4,6-tetra-o-acetyl-α-d-galactopyranosyl)-(1
→
4)-2,3,6-tri-o-acetyl-α/β-d-1-thioglucopyranoside s-oxide
[0203]1h nmr(cdcl3,400mhz)δ:7.84(d,j=7.9hz,1h),7.34
–
7.26(m,2h),7.02
–
6.89(m,1h),5.69(dd,j=5.9,3.7hz,0.2h),5.43(ddd,j=5.8,4.8,0.8hz,0.2h),5.41
–
5.22(m,2.6h),5.11(ddd,j=10.3,7.9,2.4hz,1h),4.98(ddt,j=10.4,7.2,3.5hz,1h),4.83(d,j
=4.8hz,0.2h),4.65(d,j=7.8hz,0.2h),4.59
–
4.46(m,1.6h),4.38(d,j=8.8hz,0.4h),4.24(dd,j=12.0,2.3hz,0.2h),4.18
–
4.01(m,3.2h),4.01
–
3.94(m,0.4h),3.93
–
3.78(m,1.8h),3.72(dddd,j=9.9,7.7,4.9,2.0hz,0.8h),3.66(dd,j=8.5,3.7hz,0.2h),3.34
–
2.94(m,4h),2.18
–
1.91(m,21h).
[0204]
实施例26和27、化合物38和化合物39的合成
[0205]
根据以下合成路线四,得到化合物38和化合物39:
[0206][0207]
步骤1:将胺基糖的盐酸盐(1.07g,5.0mmol,1.0equiv.)溶于dcm(20ml)中,于室温下依次加入et3n(5.6ml,40.0mmol,8.0equiv)、ac2o(4.3ml,45.0mmol,9.0equiv),室温搅拌,点板监测(pe/ea:1:2,rf=0.1)。反应结束后,体系加入20ml dcm稀释,用饱和nahco3淬灭反应直至无气泡产生,分离水层并用dcm萃取,合并有机相,饱和nacl溶液洗涤,无水硫酸钠干燥,减压蒸馏。产品不需进一步纯化,得到ac-n-glu 35(1.9g,5.0mmol,100%).
[0208]
步骤2:将上一步得到的ac-n-glu(1.9g,5.0mmol,1.0equiv.)溶于dcm(15ml)中,于0℃下加入hbr(33%in acoh)19ml,并在0℃搅拌5个小时,点板监测(石油醚/乙酸乙酯:1:3,rf=0.5)依然有反应物剩余。将反应直接倒入冰水(65ml)中,分液后,有机相用饱和na2hco3溶液中和至无气泡产生,用冰的nacl溶液洗涤有机相,无水硫酸钠干燥,减压蒸馏,产物无需进一步纯化,得到黄色油状产物ac-n-glu-br 36。
[0209]
步骤3:将ac-n-glu-br(2.1g,5.0mmol,1.0equiv.)、硫脲(456mg,6.0mmol,1.5equiv.)溶于丙酮(25ml)中,60℃搅拌回流2个小时,反应体系中有白色沉淀,点板监测(石油醚/乙酸乙酯:1:3),反应完全。过滤固体,并用丙酮洗固体,无需进一步纯化,即得白色固体产物得巯基糖37(2.2g,4.55mmol,91%).
[0210]
步骤4:将巯基糖(2.2g,4.55mmol,1.0equiv.)、k2co3(1.88g,13.65mmol,
3.0equiv.)溶于acetone/h2o(20:10ml)的混合溶剂中,再加入1-碘-2-(2-碘-乙基)苯(1.95g,5.46mmol,1.2equiv),随后室温搅拌过夜,点板监测(石油醚/乙酸乙酯:1:3,rf=0.35)。反应中固体产生。反应结束后,体系中加入dcm(40ml)和水(15ml),分液后,有机相用饱和nacl溶液(50ml*1)洗涤,有机层过滤后,减压蒸馏,固体用正己烷打浆,得到白色固体产物38(2.51g,4.23mmol,93%)。其结构与表征如下:
[0211]
1-((2-iodophenethyl)thio)-2-acetamido-2-deoxy-3,4,6-tri-o-acetyl-β-d-glucopyranoside
[0212]1h nmr(400mhz,cdcl3)δ:7.85
–
7.77(m,1h),7.31
–
7.21(m,2h),6.92(ddd,j=8.0,6.6,2.4hz,1h),5.59(d,j=9.4hz,1h),5.22
–
5.03(m,2h),4.63(d,j=10.4hz,1h),4.32
–
4.01(m,3h),3.71(ddd,j=9.4,5.1,2.4hz,1h),3.03(m 3h),2.83(ddd,j=12.5,9.0,6.0hz,1h),2.06(s,3h),2.03(d,j=1.8hz,6h),1.96(s,3h).
[0213]
步骤5:用15ml的二氯甲烷将化合物3(1.160g,4.29mmol,1.0equiv)溶于50ml的圆底烧瓶中,并将其冷却到-78℃,在此温度下,搅拌10min后,往瓶中缓慢加入m-cpba(0.438g,3.08mmol,1.6equiv.),在-78℃的温度下搅拌,直到上述合成的糖基硫醚消耗完毕(反应过程中,通过tlc点板检测反应)。反应结束后,在-78℃下,往反应液中加入饱和nahco3水溶液,随即加入30ml二氯甲烷。之后将反应混合物转移到分液漏斗中,分层后,有机层依次用1n盐酸、饱和nacl溶液洗涤,然后用无水硫酸钠干燥,减压蒸馏,硅胶柱层析分离纯化(300目
–
400目硅胶,石油醚/乙酸乙酯=2:1
–
1:1),得到白色固体糖基亚砜产物39(1.130g,1.86mmol,95%)。其系统命名及结构表征如下:
[0214]
2-(2-iodophenyl)ethyl 2-acetamido-3,4,6-tri-o-acetyl-2-deoxyl-β-d-thioglucopyrano
--
side s-oxide
[0215]1h nmr(cdcl3,400mhz)δ:7.84(dd,j=7.8,1.1hz,1h),7.32(m,2h),6.94(ddd,j=7.9,6.6,2.4hz,1h),6.47(d,j=8.7hz,1h),5.32(t,j=9.8hz,1h),5.11(t,j=9.6hz,1h),4.61(d,j=10.6hz,1h),4.28(dd,j=12.6,4.2hz,1h),4.25
–
4.13(m,1h),4.20(dd,j=12.6,2.0hz,1h),3.84(ddd,j=10.0,4.1,1.9hz,1h),3.31
–
3.06(m,4h),2.04(s,3h),2.031(s,3h),2.029(s,3h),1.95(s,3h).
[0216]
实施例28、化合物43的合成
[0217]
根据以下合成路线五,得到化合物43:
[0218][0219]
步骤1:40(1.55g,5.0mmol,1.0equiv.)溶于干燥的meoh(40ml)中,缓慢加入cf3cooh(1.2ml,16.0mmol,3.2equiv.)溶液,并在室温下搅拌过夜。将反应加热至60℃,搅拌12个小时,核磁监测反应。反应结束后,减压蒸馏,不需要进一步纯化,得到白色固体41。
[0220]
步骤2:将上述得到的41(1.62g,5.0mmol,1.0equiv.)、dmap(122mg,1.0mmol,0.2equiv.)溶于dcm(10ml)中,于室温下依次加入et3n(5.6ml,40.0mmol,8.0equiv)、ac2o(4.3ml,45.0mmol,9.0equiv),室温搅拌,点板监测(dcm/ea:1:2,rf=0.33)。反应结束后,体系加入20ml dcm稀释,用饱和nahco3淬灭反应直至无气泡产生,分离水层并用dcm萃取,合并有机相,饱和nacl溶液洗涤,无水硫酸钠干燥,减压蒸馏。硅胶柱纯化(二氯甲烷/乙酸
乙酯=1:1),得到黄色泡沫状产物42(2.37g,4.45mmol,89%)。
[0221]
步骤3:在n2保护条件下,将上一步得到的42(2.37g,4.4mmol,1.0equiv.)和化合物6(1.41g,5.34mmol,1.2equiv.)溶于干燥的dcm(10ml)中,于0℃下加入et2·
bf3(1.6ml,13.3mmol,3.0equiv.)溶液,并在室温下搅拌,点板监测。反应结束后,在冰浴中向反应体系中缓慢加入冰水(20ml)淬灭反应。反应体系中加入20ml dcm,并依次用等体积的饱和nahco3溶液、饱和nacl溶液洗涤,无水硫酸钠干燥,减压蒸馏。硅胶柱纯化(二氯甲烷/乙酸乙酯=2:1),得到白色固体αorβ-糖基硫醚产物43(958mg,1.3mmol,30%)。其表征如下:
[0222]
(1s,2r)-1-((2r,3r,4s)-3-acetamido-4-acetoxy-6-((2-iodophenethyl)thio)-6-(methoxycarbon-yl)tetrahydro-2h-pyran-2-yl)propane-1,2,3-triyl triacetate
[0223]1h nmr(400mhz,cdcl3)δ:7.81(d,j=7.9hz,1h),7.49
–
7.15(m,2h),6.92(t,j=7.8hz,1h),5.58(d,j=10.2hz,1h),5.46(d,j=2.6hz,1h),5.27(td,j=11.1,4.8hz,1h),5.16(d,j=7.7hz,1h),4.87
–
4.75(m,1h),4.44
–
4.32(m,1h),4.26
–
4.02(m,2h),3.81(s,3h),3.03
–
2.66(m,4h),2.55(dd,j=13.9,4.9hz,1h),2.13(s,3h),2.04(d,j=11.0hz,6h).
[0224]
实施例29、化合物45的合成
[0225]
根据以下合成路线六,得到化合物45。
[0226][0227]
将ac-葡萄糖亚砜底物8和naome加入圆底烧瓶中,然后加入甲醇溶剂。然后室温搅拌,薄层色谱检测反应。反应结束够直接,直接加压浓缩、柱层析分离纯化得到全脱ac的糖基亚砜产物45。表征数据如下:
[0228]1h nmr(cd3od,400mhz)δ:7.86(d,j=7.9hz,1h),7.48
–
7.37(m,1h),7.35(t,j=7.4hz,1h),6.98(t,j=7.5hz,1h),4.43(d,j=9.7hz,0.6h),4.07(d,j=9.8hz,0.4h),3.91(app dd,j=12.5,1.0hz,0.4h),3.88(dd,j=12.2,1.9hz,0.6h),3.74(dd,j=12.5,3.3hz,0.4h),3.72
–
3.59(m,1.6h),3.59
–
3.36(m,4h),3.30
–
3.05(m,3h).
[0229]
采用与实施例29中化合物45相同的合成方法,分别将步骤中的原料8替换,得到本发明的化合物46~51,所得化合物的结构与表征如下:
[0230]
实施例30、化合物46的合成
[0231][0232]
h nmr(cd3od,400mhz)δ:7.86(dd,j=7.9,1.2hz,1h),7.40(dd,j=7.7,1.9hz,
1h),7.35(td,j=7.4,1.2hz,1h),6.98(td,j=7.5,1.9hz,1h),4.74(d,j=1.8hz,1h),4.40(dd,j=3.5,1.8hz,1h),3.84(dd,j=8.0,3.5hz,1h),3.82(dd,j=9.5,2.9hz,1h),3.72(t,j=9.4hz,1h),3.64(dd,j=12.2,6.1hz,1h),3.48
–
3.36(m,2h),3.27(t,j=7.8hz,2h),3.12
–
2.99(m,1h).
[0233]
实施例31、化合物47的合成
[0234][0235]1h nmr(cd3od,400mhz)δ:7.85(dd,j=8.1,1.4hz,1h),7.40(dt,j=7.7,2.2hz,1h),7.34(td,j=7.4,1.2hz,1h),6.97(td,j=7.5,1.9hz,1h),4.40(d,j=9.8hz,0.6h),4.08
–
3.97(m,0.6h),3.94
–
3.63(m,4.8h),3.59(dd,j=9.2,3.3hz,1h),3.51
–
3.36(m,1.2h),3.19(tdd,j=17.0,9.9,5.3hz,2.8h).
[0236]
实施例32、化合物48的合成
[0237][0238]1h nmr(cd3od,400mhz)δ:7.86(d,j=7.9hz,1h),7.41(dd,j=7.7,1.8hz,1h),7.35(t,j=7.5hz,1h),6.97(t,j=7.0hz,1h),4.50(d,j=10.8hz,1h),3.91(dd,j=12.3,2.0hz,1h),3.81(t,j=10.3hz,1h),3.73(dd,j=12.4,6.4hz,1h),3.54(t,j=9.3hz,1h),3.48
–
3.40(m,1h),3.40
–
3.33(m,2h),3.29
–
3.09(m,3h),1.97(s,3h).
[0239]
实施例33、化合物49的合成
[0240][0241]1h nmr(cd3od,400mhz)δ:7.85(ddd,j=7.9,3.2,1.7hz,1h),7.46
–
7.13(m,2h),7.01
–
6.90(m,1h),4.31(d,j=9.8hz,0.8h),3.98
–
3.92(m,0.4h),3.91
–
3.81(m,0.8h),3.82
–
3.73(m,1h),3.66(d,j=3.4hz,0.8h),3.64(d,j=3.2hz,0.2h),3.60
–
3.54(m,1h),3.40(dd,j=9.0,5.6hz,0.4h),3.37(dd,j=10.0,3.6hz,0.4h),3.25
–
3.00(m,3.2h),1.32(d,j=6.4hz,0.6h),1.29(d,j=6.4hz,2.4h).
[0242]
实施例34、化合物50的合成
[0243]
[0244]1h nmr(cd3od,400mhz)δ:7.85(ddd,j=7.9,2.6,1.2hz,1h),7.39(dt,j=7.7,2.2hz,1h),7.34(tdd,j=7.5,2.2,1.3hz,1h),6.97(tt,j=7.4,2.3hz,1h),5.21(t,j=3.7hz,1h),4.46(d,j=9.3hz,0.5h),4.12(d,j=9.4hz,0.5h),3.97
–
3.90(m,1h),3.87(dd,j=12.7,3.6hz,0.5h),3.85
–
3.78(m,1.5h),3.78
–
3.60(m,5.5h),3.59
–
3.44(m,3h),3.43
–
3.36(m,0.5h),3.29
–
3.10(m,4h).
[0245]
实施例35、化合物51的合成
[0246][0247]
(2r,3s,4s,5r)-2-(hydroxymethyl)-6-((2'-iodo-[1,1'-biphenyl]-2-yl)thio)tetrahydro-2h-pyran-3,4,5-triol
[0248]1h nmr(cd3od,400mhz)δ:7.97
–
7.84(m,1h),7.77
–
7.64(m,1h),7.38(dddd,j=13.0,9.3,7.6,1.8hz,2h),7.32
–
7.21(m,2h),7.12
–
6.93(m,2h),4.65(dd,j=30.8,9.8hz,1h),3.87(ddd,j=12.1,7.2,1.7hz,1h),3.67(dt,j=11.7,5.3hz,1h),3.43
–
3.29(m,3h),3.19(dt,j=9.8,7.1hz,1h).
[0249]
然后利用以上制得的糖基供体为原料,与糖基受体反应,合成本发明的碳苷化合物。以下为以糖基供体52和45为原料,合成相应的碳苷化合物的路线。
[0250]
合成路线七:将化合物52(即上述化合物8,1.0equiv)、糖基受体53(2.0equiv)、化合物54加入到反应试管中,加入二氯甲烷,然后再加入三乙基硼(1m正己烷溶液),在空气下搅拌24小时,即得碳苷化合物55。
[0251][0252]
其中,ewg选自其中,ewg选自
[0253]
合成路线八:将化合物45(2.0equiv)、糖基受体56(1.0equiv)、化合物57加入到反应试管中,加入乙腈然后再加入三乙基硼(1m正己烷溶液),然后加入水,在空气下搅拌24小时,即得碳苷化合物58。
[0254][0255]
其中,表示
[0256]
合成路线九:将dna底物59(10nmol,1.0equiv)、糖基供体45(60equiv)、化合物57(90equiv.)、三乙基硼(90equiv.)加入到ep管中,加入dmso然后再加入然后加入水,在空气下搅拌24小时,即得dna糖基衍生物60。
[0257][0258]
其中,表示
[0259]
上述合成路线不限于以化合物52和45为原料,采用相同的方法,将原料化合物52和45替换为本发明上述制得的任一糖基供体,可以得到对应的碳苷化合物。以下为本发明具体碳苷化合物的合成实施例。
[0260]
采用上述合成路线七相同的方法,制得本发明各碳苷化合物52a~52o。结构及表征如下:
[0261]
实施例36、碳苷化合物52a的合成
[0262][0263]
methyl 3-(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)propanoate
[0264]1h nmr(cdcl3,400mhz)δ:5.32(t,j=9.2hz,1h,h-3),5.10(dd,j=9.6,5.8hz,1h),5.00(t,j=9.1hz,1h,h-4),4.25(dd,j=12.2,5.2hz,1h,h-6a),4.18(ddd,j=12.0,5.7,3.3hz,1h),4.05(dd,j=12.2,2.5hz,1h,h-6b),3.86(ddd,j=9.4,5.1,2.5hz,1h),3.70(s,3h),2.51
–
2.32(m,2h),2.17
–
2.03(m,1h),2.10(s,3h),2.07(s,3h),2.04(s,3h),2.03(s,3h),1.88(dtd,j=15.4,8.6,8.0,3.2hz,1h).
[0265]
实施例37、碳苷化合物52b的合成
[0266][0267]
phenyl 3-(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)propanoate
[0268]1h nmr(cdcl3,400mhz)δ:7.38(t,j=7.8hz,2h),7.29
–
7.20(m,1h),7.08(d,j=7.9hz,2h),5.33(t,j=9.0hz,1h),5.12(dd,j=9.4,5.7hz,1h),5.01(t,j=9.0hz,1h),4.27(dd,j=12.2,5.1hz,2h),4.07(dd,j=12.2,2.6hz,1h),3.91(ddd,j=8.3,5.2,2.6hz,1h),2.97
–
2.47(m,2h),2.22(ddt,j=13.7,11.9,6.9hz,1h),2.09(s,3h),2.07(s,3h),2.04(s,3h),2.03(s,3h),2.01
–
1.95(m,1h).
[0269]
实施例38、碳苷化合物52c的合成
[0270][0271]
3-(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)propionitrile
[0272]1h nmr(cdcl3,400mhz)δ:5.24(t,j=8.3hz,1h),5.09(dd,j=8.6,5.2hz,1h),4.98(t,j=8.2hz,1h),4.32(dd,j=12.2,5.8hz,1h),4.23(ddd,j=11.8,5.3,3.3hz,1h),4.12(dd,j=12.3,2.9hz,1h),3.88(ddd,j=8.6,5.8,2.9hz,1h),2.66
–
2.33(m,2h),2.21
–
2.00(m,1h),2.10(s,3h),2.09(s,3h),2.05(s,6h),1.89(dtd,j=15.5,7.9,3.3hz,1h).
[0273]
实施例39、碳苷化合物52d的合成
[0274][0275]
methyl 3-(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)propyl ketone
[0276]1h nmr(cdcl3,400mhz)δ:7.94(d,j=7.4hz,2h),7.70(t,j=7.4hz,1h),7.61(t,j=7.6hz,2h),5.26(t,j=8.7hz,1h),5.05(dd,j=9.0,5.5hz,1h),4.94(t,j=8.6hz,1h),4.21(dd,j=12.3,5.9hz,1h),4.20
–
4.12(m,1h),4.04(dd,j=12.2,2.8hz,1h),3.76(ddd,j=8.8,5.9,2.8hz,1h),3.21(ddd,j=13.9,11.1,4.4hz,1h),3.10(ddd,j=14.0,10.6,5.7hz,1h),2.40
–
2.15(m,1h),2.09
–
1.92(m,3h),2.05(s,3h),2.04(s,3h),2.03(s,3h).
[0277]
实施例40、碳苷化合物52e的合成
[0278][0279]
diethyl 3-(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)ethylphosphonate
[0280]1h nmr(cdcl3,400mhz)δ:5.31(t,j=9.1hz,1h),5.10(dd,j=9.4,5.8hz,1h),4.98(t,j=9.0hz,1h),4.23(dd,j=12.2,5.4hz,1h),4.18
–
3.98(m,6h),3.80(ddd,j=8.9,5.5,2.6hz,1h),2.16
–
2.03(m,1h),2.09(s,3h),2.06(s,3h),2.04(s,3h),2.03(s,
3h),1.95
–
1.79(m,2h),1.75
–
1.59(m,1h),1.34(td,j=7.1,3.1hz,6h).
[0281]
实施例41、碳苷化合物52f的合成
[0282][0283]
n,n-dimethyl 3-(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)propioamide
[0284]1h nmr(cdcl3,400mhz)δ:5.35(t,j=9.2hz,1h),5.09(dd,j=9.6,5.8hz,1h),5.00(t,j=9.2hz,1h),4.31
–
4.14(m,2h),4.06(dd,j=12.2,2.7hz,1h),3.88(ddd,j=9.7,5.0,2.7hz,1h),3.02(s,3h),2.96(s,3h),2.51
–
2.28(m,2h),2.22
–
2.11(m,1h),2.08(s,3h),2.06(s,3h),2.03(s,3h),2.02(s,3h),1.94(dddd,j=15.2,8.7,6.9,3.2hz,1h).
[0285]
实施例42、碳苷化合物52g的合成
[0286][0287]
n-phenyl 3-(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)propioamide
[0288]1h nmr(cdcl3,400mhz)δ:7.57(s,1h),7.51(d,j=7.9hz,2h),7.32(t,j=7.9hz,2h),7.11(t,j=7.4hz,1h),5.34(t,j=9.0hz,1h),5.10(dd,j=9.4,5.7hz,1h),5.00(t,j=9.0hz,1h),4.26(dd,j=12.3,4.8hz,1h),4.22
–
4.17(m,1h),4.06(dd,j=12.3,2.8hz,1h),3.97
–
3.87(m,1h),2.67
–
2.33(m,2h),2.23(ddt,j=13.7,11.3,5.8hz,1h),2.07(s,3h),2.06(s,3h),2.04(s,3h),2.02(s,3h),2.00
–
1.93(m,1h).
[0289]
实施例43、碳苷化合物52h的合成
[0290][0291]
n-i
propyl 3-(2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl)propioamide
[0292]1h nmr(cdcl3,400mhz)δ:5.38(d,j=7.8hz,1h),5.33(t,j=9.2hz,1h),5.08(dd,j=9.6,5.8hz,1h),5.00(t,j=9.2hz,1h),4.23(dd,j=12.2,4.7hz,1h),4.15(ddd,j=11.1,5.5,3.4hz,1h),4.09(dd,j=12.3,2.5hz,1h),4.10
–
4.01(m,1h),3.88(ddd,j=9.5,4.7,2.8hz,1h),2.28
–
2.11(m,3h),2.10(s,3h),2.06(s,3h),2.03(s,3h),2.02(s,3h),1.97
–
1.79(m,1h),1.16(dd,j=6.5,2.3hz,6h).
[0293]
实施例44、碳苷化合物52i的合成
[0294][0295]
methyl 3-(2,3,4,6-tetra-o-acetyl-α-d-mannopyranosyl)propanoate
[0296]1h nmr(cdcl3,400mhz)δ:5.25(dd,j=8.4,3.3hz,1h),5.18(t,j=7.9hz,1h),5.15(t,j=3.3hz,1h),4.38(dd,j=12.1,6.3hz,1h),4.06(dd,j=12.1,3.1hz,1h),3.98(dt,j=11.0,3.7hz,1h),3.89(ddd,j=7.4,6.3,3.0hz,1h),3.69(s,3h),2.58
–
2.32(m,2h),2.15
–
2.02(m,1h),2.12(s,3h),2.10(s,3h),2.07(s,3h),2.04(s,3h),1.92(dtd,j=14.8,7.8,3.8hz,1h).
[0297]
实施例45、碳苷化合物52j的合成
[0298][0299]
methyl 3-(2,3,4,6-tetra-o-acetyl-α-d-galactopyranosyl)propanoate
[0300]1h nmr(cdcl3,400mhz)δ:5.41(t,j=2.8hz,1h),5.28(dd,j=9.4,5.1hz,1h),5.20(dd,j=9.4,3.3hz,1h),4.27
–
4.15(m,2h),4.11
–
4.01(m,2h),3.69(s,3h),2.54
–
2.28(m,2h),2.15
–
1.96(m,1h),2.12(s,3h),2.09(s,3h),2.06(s,3h),2.03(s,3h),1.83(dtd,j=15.2,7.8,3.2hz,1h).
[0301]
实施例46、碳苷化合物52k的合成
[0302][0303]
methyl 3-(2,3,4-tri-o-acetyl-α-l-rhamnopyranosyl)propanoate
[0304]1h nmr(ccl3,400mhz)δ:5.19(dd,j=8.8,3.4hz,1h),5.16(dd,j=3.4,2.7hz,1h),5.03(t,j=8.5hz,1h),3.90(ddd,j=11.2,4.0,3.1hz,1h),3.76(dq,j=8.4,6.3hz,1h),3.69(s,3h),2.53
–
2.35(m,2h),2.24
–
2.14(m,1h),2.12(s,3h),2.06(s,3h),2.02(s,3h),1.93
–
1.80(m,1h),1.23(d,j=6.3hz,3h).
[0305]
实施例47、碳苷化合物52l的合成
[0306][0307]
methyl 3-(2,3,4-tri-o-acetyl-α-l-fucopyranosyl)propanoate
[0308]1h nmr(cdcl3,400mhz)δ:5.33(dd,j=10.2,5.8hz,1h),5.26(dd,j=3.4,1.8hz,1h),5.20(dd,j=10.3,3.4hz,1h),4.18(ddd,j=11.9,5.8,3.3hz,1h),3.96(qd,j=6.4,1.8hz,1h),3.69(s,3h),2.51
–
2.30(m,2h),2.16(s,3h),2.13
–
2.05(m,1h),2.07(s,3h),2.00(s,3h),1.81(dddd,j=15.2,8.5,7.1,3.4hz,1h),1.13(d,j=6.4hz,3h).
[0309]
实施例48、碳苷化合物52m的合成
[0310][0311]
methyl 3-(2-acetamido-3,4,6-tri-o-acetyl-2-deoxyl-α-d-glucopyranosyl)propanoate
[0312]1h nmr(cdcl3,400mhz)δ:6.04(d,j=8.6hz,1h),5.05(dd,j=8.6,7.2hz,1h),4.97(t,j=7.2hz,1h),4.32(dd,j=12.0,6.2hz,1h),4.28(dd,j=8.7,4.9hz,1h),4.15(dt,j=11.5,4.0hz,1h),4.08(dd,j=12.1,3.5hz,1h),3.87(td,j=6.6,3.4hz,1h),3.69(s,3h),2.54
–
2.28(m,2h),2.10(s,3h),2.08(s,3h),2.07(s,3h),2.03
–
1.95(m,1h),1.98(s,3h),1.81(dddd,j=14.5,9.0,6.8,3.4hz,1h).
[0313]
实施例49、碳苷化合物52n的合成
[0314][0315]
methyl 3-[2,3,4,6-tetra-o-acetyl-α-d-galactopyranosyl-(1
→
4)-2,3,6-tri-acetyl-α-d-gluco-pyranosyl]propanoate
[0316]1h nmr(cdcl3,400mhz)δ:5.38
–
5.29(m,2h),5.12(dd,j=10.4,7.9hz,1h),4.98(dd,j=9.2,5.8hz,1h),4.97(dd,j=10.6,3.4hz,1h),4.51(d,j=7.8hz,1h),4.33(dd,j=11.8,2.7hz,1h),4.19
–
4.04(m,4h),3.90(td,j=6.8,1.2hz,1h),3.78(ddd,j=8.5,5.7,2.6hz,1h),3.69(s,3h),3.68
–
3.63(m,1h),2.59
–
2.30(m,2h),2.15(s,3h),2.12(s,3h),2.072(s,3h),2.066(s,3h),2.06(s,6h),1.97(s,3h),1.91
–
1.78(m,2h).
[0317]
实施例50、碳苷化合物52o的合成
[0318][0319]
methyl 3-[2,3,4,6-tetra-o-acetyl-α-d-glucopyranosyl-(1
→
4)-2,3,6-tri-acetyl-α-d-gluco-pyranosyl]propanoate
[0320]1h nmr(cdcl3,400mhz)δ:5.38(dd,j=10.5,9.5hz,1h),5.33(d,j=3.9hz,1h),5.21(t,j=6.8hz,1h),5.06(t,j=9.7hz,1h),4.94(dd,j=7.5,4.9hz,1h),4.88(dd,j=10.5,3.9hz,1h),4.34
–
4.26(m,2h),4.23(dd,j=12.8,4.7hz,1h),4.12
–
4.04(m,3h),3.96(dd,j=7.9,4.4hz,1h),3.77(dd,j=7.6,6.2hz,1h),3.70(s,3h),2.43(dtt,j=24.1,16.4,8.0hz,2h),2.12(s,3h),2.11(s,3h),2.09(d,j=4.8hz,3h),2.09
–
2.02(m,1h),2.07(s,3h),2.05(s,3h),2.02(d,j=4.4hz,3h),2.00(s,3h),1.85(dtd,j=15.0,7.8,3.3hz,1h).
[0321]
采用上述合成路线八相同的方法,制得本发明各c-linked糖肽类化合物58a
–
58j和化合物58k。结构及表征如下:
[0322]
实施例51、本发明碳苷化合物58a的合成
[0323][0324]
n-[3-(α-d-glucopyranosyl)propionyl-l-phenylalanine ethyl ester
[0325]1h nmr(cdcl3,400mhz)δ:7.33
–
7.26(m,2h),7.25
–
7.17(m,3h),4.64(dd,j=8.8,6.0hz,1h),4.13(q,j=7.1hz,2h),3.85(ddd,j=11.8,5.8,3.6hz,1h),3.81(dd,j=11.6,2.3hz,1h),3.62(dd,j=11.7,6.3hz,1h),3.57(dd,j=9.4,5.7hz,1h),3.50(t,j=8.9hz,1h),3.40(ddd,j=9.0,6.3,2.4hz,1h),3.21(dd,j=9.5,8.4hz,1h),3.14(dd,j=13.8,6.0hz,1h),2.96(dd,j=13.8,8.8hz,1h),2.32(ddd,j=14.4,9.3,5.5hz,1h),2.20(ddd,j=14.1,8.8,7.2hz,1h),1.97
–
1.75(m,2h),1.20(t,j=7.1hz,3h).
[0326]
实施例52、本发明碳苷化合物58b的合成
[0327][0328]
n-[3-(α-d-glucopyranosyl)propionyl-l-glycyl-l-phenylalanine ethyl ester
[0329]1h nmr(cdcl3,400mhz)δ:7.32
–
7.26(m,2h),7.25
–
7.15(m,3h),4.66(dd,j=7.9,6.2hz,1h),4.12(q,j=7.1hz,2h),3.91(dt,j=10.7,5.3hz,1h),3.84(d,j=1.3hz,2h),3.81(dd,j=11.7,2.5hz,1h),3.67
–
3.56(m,2h),3.53(t,j=8.8hz,1h),3.43(ddd,j=9.0,6.2,2.4hz,1h),3.22(t,j=8.9hz,1h),3.13(dd,j=13.8,6.2hz,1h),3.02(dd,j=13.8,7.9hz,1h),2.40(ddd,j=14.3,8.2,6.1hz,1h),2.29(dt,j=14.3,7.9hz,1h),2.07
–
1.91(m,2h),1.19(t,j=7.1hz,3h).
[0330]
实施例53、本发明碳苷化合物58c的合成
[0331][0332]
n-[3-(α-d-glucopyranosyl)propionyl-l-leucyl-l-glycyl-l-phenylalanine ethyl ester
[0333]1h nmr(cd3od,400mhz)δ:7.31
–
7.24(m,2h),7.23
–
7.16(m,3h),4.64(dd,j=8.0,6.3hz,1h),4.34(dd,j=8.9,6.1hz,1h),4.12(q,j=7.1hz,2h),3.95
–
3.87(m,2h),3.82(dd,j=11.7,2.4hz,1h),3.76(d,j=16.8hz,1h),3.65
–
3.56(m,2h),3.55
–
3.49(m,1h),
3.44(ddd,j=9.1,6.3,2.4hz,1h),3.22(dd,j=9.5,8.2hz,1h),3.13(dd,j=13.8,6.3hz,1h),3.05(dd,j=13.8,8.0hz,1h),2.41(ddd,j=14.2,8.4,5.6hz,1h),2.29(dt,j=14.4,8.0hz,1h),2.07
–
1.88(m,2h),1.78
–
1.61(m,1h),1.60(ddd,j=10.3,6.0,2.9hz,2h),1.18(t,j=7.1hz,3h),0.95(dd,j=14.4,6.4hz,6h).
[0334]
实施例54、本发明碳苷化合物58d的合成
[0335][0336]
n-[3-(α-d-mannopyranosyl)propionyl-l-phenylalanine ethyl ester
[0337]1h nmr(cd3od,400mhz)δ:7.33
–
7.26(m,2h),7.24
–
7.18(m,3h),4.65(dd,j=8.9,6.0hz,1h),4.13(q,j=7.1hz,2h),3.80(td,j=5.7,3.3hz,1h),3.78(t,j=3.2hz,1h),3.73(dd,j=11.7,6.3hz,1h),3.67(dd,j=5.8,3.1hz,1h),3.65(dd,j=14.1,3.0hz,1h),3.59(t,j=8.1hz,1h),3.43(ddd,j=8.0,6.3,3.0hz,1h),3.14(dd,j=13.8,6.0hz,1h),2.96(dd,j=13.8,8.9hz,1h),2.36
–
2.28(m,1h),2.27
–
2.17(m,1h),1.87(dddd,j=14.0,11.0,8.2,5.7hz,1h),1.75
–
1.60(m,1h),1.20(t,j=7.1hz,3h).
[0338]
实施例55、本发明碳苷化合物58e的合成
[0339][0340]
n-[3-(α-d-mannopyranosyl)propionyl-l-glycyl-l-phenylalanine ethyl ester
[0341]1h nmr(cd3od,400mhz)δ:7.32
–
7.25(m,2h),7.25
–
7.16(m,3h),4.66(dd,j=7.9,6.2hz,1h),4.12(q,j=7.1hz,2h),3.90
–
3.82(m,3h),3.81
–
3.71(m,3h),3.69(dd,j=8.3,3.2hz,1h),3.61(t,j=8.3hz,1h),3.47(ddd,j=8.6,6.1,3.1hz,1h),3.13(dd,j=13.8,6.2hz,1h),3.02(dd,j=13.8,7.9hz,1h),2.45
–
2.27(m,2h),2.02(dddd,j=13.7,10.9,7.8,5.8hz,1h),1.80(dtd,j=14.2,8.0,3.9hz,1h),1.19(t,j=7.1hz,3h).
[0342]
实施例56、本发明碳苷化合物58f的合成
[0343][0344]
n-[3-(α-d-mannopyranosyl)propionyl-l-leucyl-l-glycyl-l-phenylalanineethyl ester
[0345]1h nmr(cd3od,4003mhz)δ:7.31
–
7.25(m,2h),7.23
–
7.17(m,3h),4.64(dd,j=8.0,6.2hz,1h),4.33(dd,j=8.7,6.1hz,1h),4.12(q,j=7.1hz,2h),3.93(d,j=16.8hz,1h),3.87
–
3.64(m,6h),3.59(t,j=8.1hz,1h),3.46(ddd,j=8.7,6.6,2.9hz,1h),3.13(dd,j=13.8,6.3hz,1h),3.04(dd,j=13.8,8.0hz,1h),2.47
–
2.28(m,2h),2.09
–
1.93(m,1h),1.86
–
1.75(m,1h),1.70(dq,j=13.2,6.7hz,1h),1.64
–
1.52(m,2h),1.18(t,j=7.2hz,3h),0.95(dd,j=14.9,6.4hz,6h).
[0346]
实施例57、本发明碳苷化合物58g的合成
[0347][0348]
n-[3-(α-d-galactopyranosyl)propionyl-l-phenylalanine ethyl ester
[0349]1h nmr(cd3od,400mhz)δ:7.32
–
7.26(m,2h),7.24
–
7.18(m,3h),4.65(dd,j=8.8,6.0hz,1h),4.13(q,j=7.1hz,2h),3.94
–
3.74(m,4h),3.72
–
3.58(m,3h),3.14(dd,j=13.8,6.1hz,1h),2.97(dd,j=13.8,8.8hz,1h),2.35
–
2.15(m,2h),1.92
–
1.73(m,2h),1.20(t,j=7.1hz,3h).
[0350]
实施例58、本发明碳苷化合物58h的合成
[0351][0352]
n-[3-(α-d-galactopyranosyl)propionyl-l-glycyl-l-phenylalanine ethyl ester1h nmr(cd3od,400mhz)δ:7.32
–
7.25(m,2h),7.21(t,j=8.1hz,3h),4.66(dd,j=7.9,6.2hz,1h),4.12(qd,j=7.1,1.2hz,2h),3.96(dt,j=10.1,5.0hz,1h),3.92
–
3.87(m,2h),3.84(app bs,2h),3.83
–
3.77(m,1h),3.73
–
3.63(m,3h),3.13(dd,j=13.8,6.2hz,1h),3.02(dd,j=13.8,7.9hz,1h),2.39(ddd,j=14.3,8.1,6.1hz,1h),2.31(dt,j=14.5,7.9hz,1h),2.05
–
1.86(m,2h),1.19(td,j=7.1,1.3hz,3h).
[0353]
实施例59、本发明碳苷化合物58i的合成
[0354][0355]
n-[3-(α-d-galactopyranosyl)propionyl-l-leucyl-l-glycyl-l-phenylalanine ethyl ester
[0356]1h nmr(cd3od,400mhz)δ:7.32
–
7.24(m,2h),7.24
–
7.15(m,3h),4.64(t,j=7.1hz,
1h),4.33(dd,j=8.5,5.9hz,1h),4.11(q,j=7.1hz,2h),3.99
–
3.73(m,6h),3.72
–
3.57(m,3h),3.13(dd,j=13.8,6.4hz,1h),3.05(dd,j=13.8,7.9hz,1h),2.45
–
2.36(m,1h),2.32(dt,j=14.7,7.9hz,1h),2.06
–
1.87(m,2h),1.78
–
1.63(m,1h),1.63
–
1.53(m,2h),1.18(t,j=7.1hz,3h),0.95(dd,j=14.2,6.3hz,6h).
[0357]
实施例60、本发明碳苷化合物58j的合成
[0358][0359]
n-[3-(α-d-maltopyranosyl)propionyl-l-leucyl-l-glycyl-l-phenylalanine ethyl ester
[0360]1h nmr(cd3od,400mhz)δ:7.32
–
7.25(m,2h),7.24
–
7.14(m,3h),5.13(d,j=3.8hz,1h),4.63(dd,j=8.0,6.3hz,1h),4.32(dd,j=8.3,6.7hz,1h),f 4.12(q,j=7.1hz,2h),3.96
–
3.85(m,2h),3.86
–
3.64(m,7h),3.64
–
3.57(m,2h),3.54(ddd,j=8.0,5.0,2.6hz,1h),3.48
–
3.41(m,2h),3.27(d,j=9.1hz,1h),3.13(dd,j=13.8,6.3hz,1h),3.05(dd,j=13.8,8.0hz,1h),2.40(dt,j=14.2,7.1hz,1h),2.29(dt,j=14.8,7.8hz,1h),2.03
–
1.93(m,2h),1.69(tt,j=12.5,6.2hz,1h),1.61(d,j=6.5hz,1h),1.59(dd,j=4.0,2.0hz,1h),1.18(t,j=7.1hz,3h),0.95(dd,j=14.6,6.4hz,6h).
[0361]
实施例61、本发明碳苷化合物58k的合成
[0362][0363]
glu-ibrutinib conjugate
[0364]1h nmr(cd3od,400mhz)δ:8.24(d,j=14.5hz,1h),7.65(dd,j=8.7,2.0hz,2h),7.39(dd,j=8.6,7.4hz,2h),7.22
–
6.92(m,5h),4.80
–
4.72(m,1h),4.60(dd,j=12.6,4.2hz,0.5h),4.35(d,j=13.3hz,0.5h),4.16(dd,j=13.9,4.1hz,0.5h),4.02(d,j=13.7hz,0.5h),3.94
–
3.85(m,1h),3.83(dd,j=11.8,2.3hz,0.5h),3.74(dd,j=13.4,9.9hz,0.5h),3.68
–
3.48(m,3.5h),3.45
–
3.36(m,1h),3.33
–
3.28(m,0.5h),3.25
–
3.16(m,1.5h),3.00
–
2.93(m,0.5h),2.66(ddd,j=15.0,8.7,5.7hz,0.5h),2.47(p,j=8.8,8.0hz,1.5h),2.39
–
2.24(m,1h),2.24
–
2.22(m,1h),2.06
–
1.85(m,3h),1.85
–
1.59(m,1h).
[0365]
采用上述合成路线九相同的方法,制得本发明各dna糖基化衍生物60-63。结构及表征如下:
[0366]
实施例62、本发明碳苷化合物60的合成
[0367][0368]
exact mass:5400.1036,observed:5406.6.
[0369]
实施例63、本发明碳苷化合物61的合成
[0370][0371]
exact mass:5441.1301,observed:5445.5.
[0372]
实施例64、本发明碳苷化合物62的合成
[0373][0374]
exact mass:5384.1086,observed:5388.2.
[0375]
实施例65、本发明碳苷化合物63的合成
[0376][0377]
exact mass:5562.1564,observed:5566.6.
[0378]
综上所述,本发明提供了一种式i所示的糖基供体,该糖基供体结构新颖,制备方法简单;以本发明的糖基供为原料,可以制备得到具有特殊α构型的糖苷(比如碳苷),而且该制备方法简单、反应条件温和、收率高,具有非常好的应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。