用il-7蛋白和双特异性抗体的组合治疗肿瘤的方法
1.相关申请的交叉引用
2.此pct申请要求2020年1月13日提交的美国临时申请号62/960,593;2020年11月2日提交的美国临时申请号63/108,760;以及2020年11月4日提交的美国临时申请号63/109,475的优先权,每个所述临时申请以引用的方式整体并入本文。
3.对通过efs-web电子递交的序列表的引用
4.与本技术一起提交的ascii文本文件(名称:4241_004pc03_sequencelisting_st25.txt;大小:87,920字节;且创建日期:2021年1月12日)中的电子提交序列表的内容以引用的方式整体并入本文。
背景技术:
5.近年来,已很好地建立了癌症免疫疗法(例如抗体),并且其现在已成为可用于许多癌症患者的更成功的治疗选择之一。scott,a.m.,等人,cancer immun 12:14(2012)。除了靶向参与癌细胞增殖和存活的抗原外,抗体还可以激活或拮抗在癌症免疫监视中重要的免疫途径。并且,经过大量努力,已成功开发了若干种免疫检查点途径抑制剂,其中一些已获得食品和药物管理局(food and drug administration)的批准,例如抗ctla-4抗体:伊匹单抗(ipilimumab)抗pd-1抗体:纳武单抗(nivolumab)帕博利珠单抗(pembrolizumab)西米普利单抗(cemiplimab)和抗pd-l1抗体:阿特珠单抗(atezolizumab)度伐利尤单抗(durvalumab)阿维鲁单抗(avelumab)
6.尽管取得了这些进步,但患有某些恶性肿瘤(例如,转移性或难治性实体瘤)的患者的预后仍然很差。此类患者中只有一小部分确实经历了长期的癌症缓解,而许多患者要么没有反应,要么开始有反应但最终发展出对抗体的抗性。sharma,p.,等人,cell 168(4):707-723(2017)。此外,许多癌症患者淋巴细胞减少,因为已知许多可用的护理标准癌症治疗(例如,化学疗法和放射疗法)会引起淋巴细胞减少症。grossman,s.a.,等人,j natl compr canc netw 13(10):1225-31(2015)。检查点抑制剂,诸如抗pd-1抗体,已经显示在此类癌症患者中的功效有限。yarchoan,m.,等人,j clin oncol 35:e14512(2017)。因此,仍然需要在癌症患者(包括患有淋巴细胞减少症的患者)中具有可接受的安全性和高功效的新治疗选择。
技术实现要素:
7.本文提供了一种治疗有需要的受试者的肿瘤的方法,其包括向所述受试者施用有效量的修饰的il-7蛋白和双特异性抗体。在一些方面,与参考肿瘤体积(例如,施用前受试者中的肿瘤体积和/或单独施用修饰的il-7蛋白或双特异性抗体后受试者中的肿瘤体积)相比,受试者中的肿瘤体积在施用后减小。在某些方面,与参考肿瘤体积相比,在施用后肿瘤体积减小至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至
少约60%、至少约70%、至少约80%、至少约90%或约100%。
8.在一些方面,与参考体重(例如,施用前受试者的体重和/或单独施用修饰的il-7蛋白或双特异性抗体后受试者的体重)相比,在施用后受试者的体重不减轻。在某些方面,与参考体重相比,在施用后受试者的体重减轻不超过约1%、不超过约2%、不超过约3%、不超过约4%、不超过约5%、不超过约6%、不超过约7%、不超过约8%、不超过约9%或不超过约10%。
9.本文还提供了一种增强有需要的受试者中的双特异性抗体的抗肿瘤活性的方法,其包括向受试者施用有效量的双特异性抗体与修饰的il-7蛋白的组合。在一些方面,抗肿瘤活性包括受试者中肿瘤体积的减小和/或体重不减轻。
10.在一些方面,与参考肿瘤体积(例如,施用前受试者中的肿瘤体积和/或单独施用修饰的il-7蛋白或双特异性抗体后受试者中的肿瘤体积)相比,在施用后肿瘤体积减小至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或至少约100%。
11.在一些方面,与参考体重(例如,施用前受试者的体重和/或单独施用修饰的il-7蛋白或双特异性抗体后受试者的体重)相比,在施用后受试者的体重减轻不超过约1%、不超过约2%、不超过约3%、不超过约4%、不超过约5%、不超过约6%、不超过约7%、不超过约8%、不超过约9%或不超过约10%。
12.在一些方面,修饰的il-7蛋白包含由1至10个氨基酸残基组成的寡肽。在某些方面,寡肽包括甲硫氨酸(m)、甘氨酸(g)、甲硫氨酸-甲硫氨酸(mm)、甘氨酸-甘氨酸(gg)、甲硫氨酸-甘氨酸(mg)、甘氨酸-甲硫氨酸(gm)、甲硫氨酸-甲硫氨酸-甲硫氨酸(mmm)、甲硫氨酸-甲硫氨酸-甘氨酸(mmg)、甲硫氨酸-甘氨酸-甲硫氨酸(mgm)、甘氨酸-甲硫氨酸-甲硫氨酸(gmm)、甲硫氨酸-甘氨酸-甘氨酸(mgg)、甘氨酸-甲硫氨酸-甘氨酸(gmg)、甘氨酸-甘氨酸-甲硫氨酸(ggm)、甘氨酸-甘氨酸-甘氨酸(ggg)、甲硫氨酸-甘氨酸-甘氨酸-甲硫氨酸(mggm)(seq id no:41)、甲硫氨酸-甲硫氨酸-甘氨酸-甘氨酸(mmgg)(seq id no:42)、甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸(ggmm)(seq id no:43)、甲硫氨酸-甘氨酸-甲硫氨酸-甘氨酸(mgmg)(seq id no:44)、甘氨酸-甲硫氨酸-甲硫氨酸-甘氨酸(gmmg)(seq id no:45)、甘氨酸-甘氨酸-甘氨酸-甲硫氨酸(gggm)(seq id no:46)、甲硫氨酸-甘氨酸-甘氨酸-甘氨酸(mggg)(seq id no:47)、甘氨酸-甲硫氨酸-甘氨酸-甘氨酸(gmgg)(seq id no:48)、甘氨酸-甘氨酸-甲硫氨酸-甘氨酸(ggmg)(seq id no:49)、甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸-甲硫氨酸(ggmmm)(seq id no:50)、甘氨酸-甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸(gggmm)(seq id no:51)、甘氨酸-甘氨酸-甘氨酸-甘氨酸-甲硫氨酸(ggggm)(seq id no:52)、甲硫氨酸-甘氨酸-甲硫氨酸-甲硫氨酸-甲硫氨酸(mgmmm)(seq id no:53)、甲硫氨酸-甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸(mggmm)(seq id no:54)、甲硫氨酸-甘氨酸-甘氨酸-甘氨酸-甲硫氨酸(mgggm)(seq id no:55)、甲硫氨酸-甲硫氨酸-甘氨酸-甲硫氨酸-甲硫氨酸(mmgmm)(seq id no:56)、甲硫氨酸-甲硫氨酸-甘氨酸-甘氨酸-甲硫氨酸(mmggm)(seq id no:57)、甲硫氨酸-甲硫氨酸-甘氨酸-甘氨酸-甘氨酸(mmggg)(seq id no:58)、甲硫氨酸-甲硫氨酸-甲硫氨酸-甘氨酸-甲硫氨酸(mmmgm)(seq id no:59)、甲硫氨酸-甘氨酸-甲硫氨酸-甘氨酸-甲硫氨酸(mgmgm)(seq id no:60)、甘氨酸-甲硫氨酸-甘氨酸-甲硫氨酸-甘氨酸(gmgmg)(seq id no:61)、甘氨酸-甲硫氨酸-甲硫氨酸-甲硫氨酸-甘氨酸(gmmmg)
1,gpc1)、磷脂酰肌醇蛋白聚糖-2(gpc2)、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1 mage1、hla-a1 ny-eso-1、il-13rcc2、lewis-y、kdr、mcsp、间皮素、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psc1、psca、psma、ror1、ror2、sp17、surviving、tag72、tem、癌胚抗原、hmw-maa、vegf、cldn18.2或其组合。
18.在一些方面,肿瘤抗原包括免疫检查点分子。在某些方面,免疫检查点分子包括pd-1配体(例如,pd-l1)、lag3配体、tim-3配体(例如,半乳凝素9)、ctla-4配体(例如,cd28)、ox40配体、cd28配体(例如,b7h3或b7h4)或其组合。
19.在一些方面,免疫细胞包括t细胞。在某些方面,t细胞包括肿瘤浸润淋巴细胞(til)。
20.在一些方面,修饰的il-7蛋白和双特异性抗体同时施用。在某些方面,修饰的il-7蛋白和双特异性抗体循序施用。在另外的方面,il-7蛋白在施用双特异性抗体前施用至受试者。
21.在一些方面,修饰的il-7蛋白以大于约600μg/kg、大于约700μg/kg、大于约800μg/kg、大于约900μg/kg、大于约1,000μg/kg、大于约1,100μg/kg、大于约1,200μg/kg、大于约1,300μg/kg、大于约1,400μg/kg、大于约1,500μg/kg、大于约1,600μg/kg、大于约1,700μg/kg、大于约1,800μg/kg、大于约1,900μg/kg或大于约2,000μg/kg的剂量施用。
22.在一些方面,修饰的il-7蛋白以约610μg/kg与约1,200μg/kg之间、约650μg/kg与约1,200μg/kg之间、约700μg/kg与约1,200μg/kg之间、约750μg/kg与约1,200μg/kg之间、约800μg/kg与约1,200μg/kg之间、约850μg/kg与约1,200μg/kg之间、约900μg/kg与约1,200μg/kg之间、约950μg/kg与约1,200μg/kg之间、约1,000μg/kg与约1,200μg/kg之间、约1,050μg/kg与约1,200μg/kg之间、约1,100μg/kg与约1,200μg/kg之间、约1,200μg/kg与约2,000μg/kg之间、约1,300μg/kg与约2,000μg/kg之间、约1,500μg/kg与约2,000μg/kg之间、约1,700μg/kg与约2,000μg/kg之间、约610μg/kg与约1,000μg/kg之间、约650μg/kg与约1,000μg/kg之间、约700μg/kg与约1,000μg/kg之间、约750μg/kg与约1,000μg/kg之间、约800μg/kg与约1,000μg/kg之间、约850μg/kg与约1,000μg/kg之间、约900μg/kg与约1,000μg/kg之间或者约950μg/kg与约1,000μg/kg之间的剂量施用。
23.在一些方面,修饰的il-7蛋白以约700μg/kg与约900μg/kg之间、约750μg/kg与约950μg/kg之间、约700μg/kg与约850μg/kg之间、约750μg/kg与约850μg/kg之间、约700μg/kg与约800μg/kg之间、约800μg/kg与约900μg/kg之间、约750μg/kg与约850μg/kg之间或约850μg/kg与约950μg/kg之间的剂量施用。
24.在一些方面,修饰的il-7蛋白以约650μg/kg、约680μg/kg、约700μg/kg、约720μg/kg、约740μg/kg、约750μg/kg、约760μg/kg、约780μg/kg、约800μg/kg、约820μg/kg、约840μg/kg、约850μg/kg、约860μg/kg、约880μg/kg、约900μg/kg、约920μg/kg、约940μg/kg、约950μg/kg、约960μg/kg、约980μg/kg、约1000μg/kg、约1100μg/kg、约1200μg/kg、约1,300μg/kg、约1,400μg/kg、约1,440μg/kg、约1,500μg/kg、约1,600μg/kg、约1,700μg/kg、约1,800μg/kg、约1,900μg/kg或约2,000μg/kg的剂量施用。
25.在一些方面,修饰的il-7蛋白以一周一次、两周一次、三周一次、四周一次、五周一次、六周一次、七周一次、八周一次、九周一次、10周一次、11周一次或12周一次的给药频率施用。
26.在一些方面,双特异性抗体以约0.1mg/kg至约20mg/kg的剂量施用至受试者。
27.在一些方面,修饰的il-7蛋白经肠胃外、肌肉内、皮下、眼部、静脉内、腹膜内、皮内、眶内、脑内、颅内、脊柱内、心室内、鞘内、脑池内、囊内或瘤内施用至所述受试者。在一些方面,双特异性抗体经肠胃外、肌肉内、皮下、眼部、静脉内、腹膜内、皮内、眶内、脑内、颅内、脊柱内、心室内、鞘内、脑池内、囊内或瘤内施用至受试者。在某些方面,双特异性抗体是瘤内施用的。
28.在一些方面,本文所公开的治疗受试者的肿瘤的方法或增强受试者中双特异性抗体的抗肿瘤活性的方法还包括向受试者施用至少一种另外的治疗剂。
29.在一些方面,肿瘤来源于癌症,癌症包括乳腺癌、头颈癌、子宫癌、脑癌、皮肤癌、肾癌(renal cancer)、肺癌、结直肠癌、前列腺癌、肝癌、膀胱癌、肾癌(kidney cancer)、胰腺癌、甲状腺癌、食道癌、眼癌、胃癌(stomach(gastric)cancer)、胃肠癌、卵巢癌、癌症(carcinoma)、肉瘤、白血病、淋巴瘤、骨髓瘤或其组合。
附图说明
30.图1a、图1b和图1c示出了抗pd-l1/cd3双特异性t细胞接合剂(“bsab”)施用对小鼠腺癌模型的影响。图1a是肿瘤接种和治疗施用时间表的图。图1b和图1c是分别示出不同治疗组在用bsab治疗后的肿瘤体积(mm3)和体重的比较结果的图。治疗组包括:(1)对照组磷酸盐缓冲盐水;(2)0.2μg bsab;(3)1.0μg bsab;和(4)5.0μgbsab。数据示出为平均值
±
sem。所有比较均使用以bonferroni事后检验(bonferroni posts-test)的双因素anova进行。“*”、“**”和“***”指示与对照动物相比的统计学上的显著差异(分别为p<0.05、p<0.001和p<0.0001)。
31.图1d、图1e和图1f示出了抗pd-l1/cd3 bsab对与野生型或pd-l1缺陷型mc38肿瘤细胞一起体外培养的cd8 t细胞的细胞毒性和激活状态的影响。图1d提供了如通过流式细胞术所测量的野生型(左图)和pd-l1缺陷型(右图)mc38肿瘤细胞上pd-l1表达的比较。图1e提供了在不同浓度的bsab下cd8 t细胞杀伤肿瘤细胞的能力(即,细胞毒性)的比较。细胞毒性如下进行计算:[1-活靶细胞(样品)/活靶细胞(对照)]
×
100。图1f提供了在不同浓度的bsab(即0ng、0.1ng、1ng、10ng和100ng)中与以下一起培养时,cd8 t细胞上cd69(上排)和cd25(下排)(即,激活标志物)表达的比较:(i)没有肿瘤细胞(左栏);(ii)野生型mc-38肿瘤细胞(中栏);和(iii)pd-l1缺陷型mc-38肿瘤细胞(右栏)。
[0032]
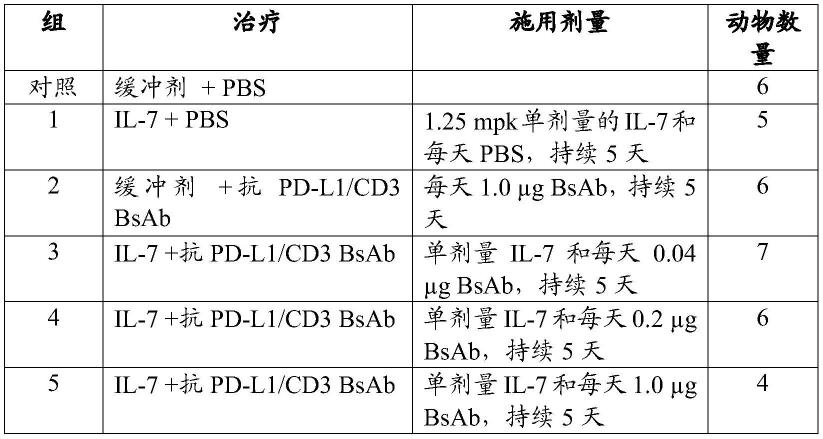
图2a、图2b和图2c示出了il-7蛋白施用对小鼠腺癌模型中静脉内施用的抗pd-l1/cd3 bsab的抗肿瘤作用的影响。图2a是肿瘤接种和治疗施用时间表的图。图2b和图2c是分别示出不同治疗组中肿瘤体积(mm3)和体重(初始的%)的比较结果的图。治疗组包括:(1)缓冲剂 pbs;(2)il-7蛋白 pbs;(3)缓冲剂 1.0μg抗pd-l1/cd3 bsab;(4)il-7蛋白 0.04μg抗pd-l1/cd3 bsab;(5)il-7蛋白 0.2μg抗pd-l1/cd3 bsab;和(6)il-7蛋白 1.0μg抗pd-l1/cd3 bsab。数据示出为平均值
±
s.e.m。所有比较均使用以bonferroni事后检验的双因素anova进行。“*”、“**”和“***”指示与对照动物相比的统计学上的显著差异(分别为p<0.05、p<0.001和p<0.0001)。
[0033]
图3a、图3b、图3c、图3d、图3e和图3f提供了在用下列之一治疗的小鼠腺癌模型中观察到的肿瘤浸润t细胞的比较:(1)缓冲剂 pbs;(2)il-7蛋白 pbs;(3)缓冲剂 0.2μg抗
pd-l1/cd3bsab;和(4)il-7蛋白 0.2μg抗pd-l1/cd3 bsab。图3b至图3f中示出的组的图例提供于图3b中。图3a提供肿瘤接种和治疗施用时间表的示意图。图3b提供了来自不同治疗组的动物的肿瘤中以下t细胞的频率的比较:(i)cd8 t细胞,(ii)foxp3-cd4 辅助性t细胞;和(iii)foxp3 cd4 调节性t细胞。不同t细胞群的频率显示为总cd45 细胞的百分比。图3c提供了在来自不同治疗组的动物的肿瘤中观察到的在总cd4 t细胞中的foxp3 细胞的比较。图3d提供了来自不同治疗组的动物的cd8 t细胞与调节性t细胞的比率。图3e提供了在来自不同动物的肿瘤中观察到的在总cd8 t细胞中的pd-1细胞频率的比较。图3f示出了在来自不同治疗组的动物的肿瘤中观察到的在pd-1 或pd-1-的cd8 t细胞中颗粒酶b表达细胞的频率。数据表示为平均值
±
sd。通过以bonferroni氏多重比较的单因素anova分析统计显著性。*p<0.05;**p<0.001;***p<0.0001。
[0034]
图4a、图4b和图4c示出了il-7蛋白施用对小鼠腺癌模型中瘤内施用的抗pd-l1/cd3 bsab的抗肿瘤作用的影响。图4a是肿瘤接种和治疗施用时间表的图。图4b和图4c是分别示出不同治疗组中肿瘤体积(mm3)和体重(初始的%)的比较结果的图。治疗组包括:(1)缓冲剂 pbs;(2)il-7蛋白 pbs;(3)缓冲剂 1μg抗pd-l1/cd3bsab;(4)il-7蛋白 0.2μg抗pd-l1/cd3 bsab;和(5)il-7蛋白 1.0μg抗pd-l1/cd3 bsab(第5组)。数据示出为平均值
±
s.e.m。所有比较均使用以bonferroni事后检验的双因素anova进行。“*”、“**”和“***”指示与对照动物相比的统计学上的显著差异(分别为p<0.05、p<0.001和p<0.0001)。
[0035]
图5a、图5b和图5c示出了抗pd-l1/cd3 bsab在小鼠腺癌模型中瘤内施用后的效果。图5a提供了肿瘤接种和bsab施用时间表的示意图。图5b和图5c是分别示出不同治疗组中肿瘤体积(mm3)和体重(初始的%)的比较结果的图。治疗组包括:(1)单独pbs;(2)0.2μg抗pd-l1/cd3 bsab;(3)1μg抗pd-l1/cd3 bsab;和(4)5μg抗pd-l1/cd3 bsab。图5b和图5c中示出的组的图例提供于图5b中。数据表示为平均值
±
sem。通过针对肿瘤生长曲线图的以bonferroni氏多重比较的双因素anova分析统计显著性。*p<0.05,**p<0.001,***p<0.0001。
具体实施方式
[0036]
i.定义
[0037]
为了更容易理解本公开,首先定义某些术语。如本技术中所用,除非本文另外明确提供,否则以下术语中的每一个应具有下文阐述的含义。另外的定义在整个申请中阐述。
[0038]
在整个本公开中,术语“一个”或“一种”实体是指一个(种)或多个(种)所述实体;例如,“一种抗体”应理解为表示一种或多种抗体。因此,术语“一个”(或“一种”)、“一个(种)或多个(种)”和“至少一个(种)”在本文中可互换使用。
[0039]
此外,在本文中使用时将“和/或”视为对两个指定特征或组分中的每一个具有或不具有另一者的具体公开。因此,如本文中诸如“a和/或b”的短语中所使用的术语“和/或”旨在包括“a和b”、“a或b”、“a”(单独)和“b”(单独)。同样,如诸如“a、b和/或c”的短语中所使用的术语“和/或”旨在涵盖以下方面中的每一个:a、b和c;a、b或c;a或c;a或b;b或c;a和c;a和b;b和c;a(单独);b(单独);以及c(单独)。
[0040]
应理解,无论如本文语言“包含”来描述方面的情况如何,都还提供以“由
……
组成”和/或“基本上由
……
组成”的术语描述的另外相似方面。
[0041]
除非另外定义,否则本文所使用的所有技术和科学术语均具有与本公开内容相关的领域的普通技术人员通常所理解相同的含义。例如,concise dictionary of biomedicine and molecular biology,juo,pei-show,第2版,2002,crc press;the dictionary of cell and molecular biology,第3版,1999,academic press;以及oxford dictionary of biochemistry and molecular biology,revised,2000,oxford university press,为本领域技术人员提供本公开中所使用的许多术语的一般解释。
[0042]
单位、前缀和符号均以其国际单位制(syst
è
me international de unites,si)可接受的形式表示。数值范围包括限定范围的数字。除非另外指明,否则氨基酸序列是以氨基至羧基定向自左至右书写。本文提供的标题不是对本公开的各个方面的限制,这些方面可以通过参考整个说明书来获得。因此,即将在下文定义的术语通过参考说明书全文来更充分地定义。
[0043]
本文使用的术语“约”意指大约、大体上、左右或在
……
范围内。当术语“约”连同数值范围一起使用时,它通过使边界延伸高于及低于所述数值来修饰那个范围。一般而言,术语“约”可以通过例如上或下(高或低)10%的变化来修饰高于及低于所述值的数值。
[0044]
如本文所用,“施用”是指使用本领域技术人员已知的各种方法和递送系统中的任一种将治疗剂或包含治疗剂的组合物以物理方式引入至受试者。本文所述的治疗剂的不同施用途径包括静脉内、腹膜内、肌肉内、皮下、脊髓或其他肠胃外施用途径,例如通过注射或输注进行。如本文所用的短语“肠胃外施用”意指除肠内和外用(topical)施用以外的施用模式,通常通过注射进行,并且包括但不限于静脉内、腹膜内、肌肉内、动脉内、鞘内、淋巴内、病灶内、囊内、眶内、心脏内、皮内、经气管、气管内、肺、皮下、表皮下、关节内、囊下、蛛网膜下、心室内、玻璃体内、硬膜外和胸骨内注射和输注,以及体内电穿孔。替代地,本文所述的治疗剂可经由非肠胃外途径施用,诸如外用、表皮或粘膜施用途径,例如鼻内、口服、阴道、直肠、舌下或外用施用。施用还可以例如进行一次、多次和/或在一个或多个延长时间段内进行。
[0045]
如本文所用,术语“抗原”是指任何天然或合成的免疫原性物质,诸如蛋白质、肽或半抗原。
[0046]
术语“抗体(antibody/antibodies)”是本领域的术语,并且在本文中可互换使用,并且是指具有特异性结合抗原的抗原结合位点的分子。如本文所用的术语包括完整抗体及其任何抗原结合片段(即,“抗原结合部分”)或单链。在一些方面,“抗体”是指至少包含通过二硫键相互连接的两条重(h)链和两条轻(l)链的糖蛋白,或其抗原结合部分。在另一方面,“抗体”是指包含单个可变结构域例如vhh结构域的单链抗体。每条重链包含重链可变区(本文中缩写为vh)和重链恒定区。在某些天然存在的抗体中,重链恒定区包含三个结构域:ch1、ch2和ch3。在某些天然存在的抗体中,每条轻链包含轻链可变区(本文中缩写为vl)和轻链恒定区。轻链恒定区包含一个结构域cl。
[0047]
vh和vl区可进一步细分为高变区,称为互补决定区(cdr),其间散布着较保守的区域,称为框架区(fr)。每个vh和vl包含三个cdr和四个fr,以下列顺序从氨基末端向羧基末端排列:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。抗体的恒定区可以介导免疫球蛋白与宿主组织或因子的结合,宿主组织或因子包括各种免疫系统细胞(例如,效应细胞)和经典补体系统的第一组分(c1q)。
[0048]
抗体通常以高亲和力特异性结合它们的同源抗原,高亲和力反映在10-5
至10-11
m或更小的解离常数(kd)上。一般认为任何大于约10-4
m的kd指示非特异性结合。如本文所用,与抗原“特异性结合”的抗体是指以高亲和力与抗原和大致上相同的抗原结合,但不以高亲和力与不相关的抗原结合的抗体,高亲和力意味着kd为10-7
m或更小、10-8
m或更小、5x10-9
m或更小、或在10-8
m与10-10
m之间或更小。如果抗原与给定抗原表现出高度的序列同一性,例如,如果它与给定抗原的序列表现出至少80%、至少90%、至少95%、至少97%或至少99%的序列同一性,则抗原与给定抗原“大致上相同”。举例来说,在某些方面,与pd-1特异性结合的抗体还可以与来自某些灵长类物种的pd-1抗原具有交叉反应性(例如食蟹猴抗pd-1抗体),但不能与来自其他物种的pd-1分子或与除pd-1以外的分子交叉反应。
[0049]
免疫球蛋白可来源于任何通常已知的同种型,包括但不限于iga、分泌型iga、igg和igm。igg亚类也为本领域技术人员熟知的并且包括但不限于人igg1、igg2、igg3和igg4。“同种型”是指由重链恒定区基因编码的抗体类别或亚类(例如,igm或igg1)。在某些方面,同种型的一个或多个氨基酸可以被突变以改变效应子功能。举例来说,术语“抗体”包括天然存在的和非天然存在的ab;单克隆和多克隆ab;嵌合和人源化ab;人或非人ab;全合成ab;和单链抗体。非人抗体可以通过重组方法进行人源化以降低其在人中的免疫原性。在没有明确说明的情况下,并且除非上下文另外指示,否则术语“抗体”还包括上述免疫球蛋白中任一种的抗原结合片段或抗原结合部分,并且包括单价和二价片段或部分,以及单链抗体。
[0050]“分离的抗体”是指大致上不含具有不同抗原特异性的其他抗体的抗体(例如,与pd-1特异性结合的分离的抗体大致上不含与除pd-1以外的抗原特异性结合的抗体)。然而,与pd-1特异性结合的分离的抗体可以与其他抗原(诸如来自不同物种的pd-1分子)具有交叉反应性。另外,分离的抗体可以大致上不含其他细胞物质和/或化学物质。
[0051]
术语“单克隆抗体”(“mab”)是指单一分子组成的抗体分子的非天然存在的制备剂,即,其主要序列基本相同,并且对特定表位表现出单一结合特异性和亲和力的抗体分子。mab是分离的抗体的实例。mab可以通过杂交瘤、重组、转基因或本领域技术人员已知的其他技术来产生。
[0052]“人”抗体(humab)是指具有其中框架区和cdr区均来源于人种系免疫球蛋白序列的可变区的抗体。此外,如果抗体含有恒定区,那么恒定区也来源于人种系免疫球蛋白序列。本发明的人抗体可包括不由人种系免疫球蛋白序列编码的氨基酸残基(例如,通过体外随机或位点特异性诱变或者通过体内体细胞突变引入的突变)。然而,如本文所用,术语“人抗体”不旨在包括其中来源于另一哺乳动物物种(诸如小鼠)的种系的cdr序列已接枝到人框架序列上的抗体。术语“人”抗体和“完全人”抗体同义地使用。
[0053]“人源化抗体”是指其中非人抗体的cdr结构域外部的一些、大部分或全部氨基酸被来源于人免疫球蛋白的相应氨基酸替换的抗体。在人源化形式的抗体的一方面中,cdr结构域外部的一些、大部分或全部氨基酸已经被来自人免疫球蛋白的氨基酸替换,而一个或多个cdr区内的一些、大部分或全部氨基酸没有变化。氨基酸的少量添加、缺失、插入、取代或修饰是允许的,只要它们不消除抗体与特定抗原结合的能力即可。“人源化”抗体保留了与原始抗体相似的抗原特异性。
[0054]“嵌合抗体”是指可变区来源于一种物种而恒定区来源于另一物种的抗体,诸如可变区来源于小鼠抗体而恒定区来源于人抗体的抗体。
[0055]
如本文所用,术语“多特异性抗体”是指具有与多个(例如,多于一个)不同表位结合的能力的抗体。如本文所用,术语“双特异性抗体”是指能够与两个不同的表位结合的多特异性抗体。在一些方面,多个不同表位在单一抗原上(例如,双特异性抗体与单一蛋白质的两个不同区域结合)。在其他方面,多个不同的表位在不同的抗原上(例如,双特异性抗体与蛋白a上的表位和蛋白b上的表位结合)。除非另有说明,否则术语“多特异性抗体”和“双特异性抗体”在本公开中可互换使用。因此,与双特异性抗体有关的公开可同样适用于多特异性抗体。
[0056]
可与本公开一起使用的双特异性抗体的非限制性实例包括:t细胞接合剂(例如,双特异性t细胞接合剂(bsab)抗体)、双亲和重靶向分子(dart)、crossmab抗体、dutamab
tm
抗体、duobody抗体、triomab、tandab、双特异性纳米抗体、串联scfv、双抗体、单链双抗体、hsa抗体、(scfv)2hsa抗体、scfv-igg抗体、对接和锁定双特异性抗体、dvd-igg抗体、tbti dvd-igg、igg-fynomer、四价双特异性串联igg抗体、双靶向结构域抗体、化学连接双特异性(fab')2分子、交联mab、双作用fab igg(daf-igg)、邻fab-igg、双特异性covx-body、双特异性六价三聚体、连接至白喉毒素的2scfv、art-ig、igm t细胞接合剂或其组合。
[0057]
双特异性抗体可以通过本领域已知的多种方法制备,所述方法例如完整igg或f(ab')2片段的混合物的二硫键裂解和重新形成、多于一种杂交瘤融合以形成产生具有多于一种特异性的抗体的多瘤以及通过基因工程。已通过氧化裂解由不同抗体的还原裂解产生的fab'片段来制备双特异性抗体。这有利地如下进行:将通过对两种不同的抗体的胃蛋白酶消化所产生的两种不同的f(ab')2片段混合,还原裂解以形成fab'片段混合物,接着氧化重新形成二硫键以产生f(ab')2片段混合物,其包括含有对每个原始表位(例如,在免疫细胞上表达的抗原和本文所公开的肿瘤抗原)有特异性的fab'部分的双特异性抗体。用于制备多价抗体的一般技术可见于例如nisonhoff等人,arch biochem.biophys.93:470(1961);hammerling等人,j.exp.med.128:1461(1968);和美国专利号4,331,647。
[0058]
替代地,可以通过融合两种杂交瘤细胞系来产生此类双特异性抗体,所述杂交瘤细胞系产生针对免疫细胞上的抗原(例如,cd3)的抗体和针对肿瘤抗原(例如,pd-l1)的抗体。例如milstein等人,nature 305:537(1983)和pohl等人,int.j.cancer 54:418(1993)描述了用于产生畸胎瘤(tetradoma)的技术。
[0059]
最后,可以通过基因工程来产生此类双特异性抗体。例如,可以将含有编码针对免疫细胞上的抗原的抗体(例如,抗cd3)的可变结构域的dna的质粒引入分泌抗肿瘤抗原抗体的杂交瘤中。所得的“转染瘤”产生与免疫细胞上的抗原和肿瘤抗原结合的双特异性抗体。替代地,可以设计出编码针对免疫细胞上表达的抗原和肿瘤抗原的结合结构域两者的嵌合基因。通过基因工程产生双特异性抗体的一般技术描述于例如songsivlai等人,biochem.biophys.res.commun.164:271(1989);traunecker等人,embo j.10:3655(1991);和weiner等人,j.immunol.147:4035(1991)中。
[0060]
通过将各种抗体组分添加到如上产生的双特异性抗体中,可以获得更高阶的多价、多特异性分子。例如,双特异性抗体可以与2-亚氨基硫杂环戊烷反应以引入一个或多个巯基,用于使用上述双-马来酰亚胺激活程序将双特异性抗体与结合靶抗原的相同或不同表位的另一抗体衍生物偶联。这些产生多价抗体的技术是本领域技术人员熟知的。参见,例如,美国专利号4,925,648和goldenberg,国际公开号wo 92/19273,其以引用的方式并入。
[0061]
如本文所用,术语“表位”或“抗原决定簇”是指抗体(例如本文所公开的双特异性抗体)结合的抗原上的位点。表位可以由邻接氨基酸(线性表位)形成或通过蛋白质的三级折叠并置(juxtaposed)的非邻接氨基酸(构象表位)形成。由邻接氨基酸形成的表位通常在暴露于变性溶剂时得以保留,而通过三级折叠形成的表位通常在用变性溶剂处理时丧失。表位通常包括独特空间构象中的至少3个,并且更通常至少5个或8-10个氨基酸。确定表位的空间构象的方法包括例如x射线晶体学和二维核磁共振。参见,例如,epitope mapping protocols in methods in molecular biology,第66卷,glenn e.morris,编(1996)。
[0062]“抗抗原”抗体是指特异性结合至抗原的抗体。例如,抗pd-l1抗体与pd-l1特异性结合,而抗cd3ε抗体与cd3ε特异性结合。
[0063]
抗体的“抗原结合部分”(也称为“抗原结合片段”)是指抗体的一个或多个片段,其保留了与整个抗体所结合的抗原特异性结合的能力。
[0064]
如本文所用,术语“特异性结合(specific binding)”、“选择性结合(selective binding)”、“选择性地结合(selectively binds)”和“特异性地结合(specifically binds)”是指抗体与预定抗原上的表位结合。通常,抗体(i)当通过例如在biacore
tm 2000仪器中使用预定抗原作为分析物并且使用抗体作为配体的表面等离子体共振(spr)技术,或对抗体与抗原阳性细胞的结合的scatchard分析来确定时,以大约小于10-7
m,诸如大约小于10-8
m、10-9
m或10-10
m或者甚至更小的平衡解离常数(kd)结合,并且(ii)以比其与除预定抗原或密切相关的抗原以外的非特异性抗原(例如bsa、酪蛋白)结合的亲和力大至少两倍的亲和力与预定抗原结合。
[0065]
如本文所用的术语“天然存在的”当应用于对象时是指对象可见于自然界中的事实。例如,存在于生物体(包括病毒)中的可从自然界中的来源分离并且不是人在实验室中有意修饰的多肽或多核苷酸序列为天然存在的。
[0066]“多肽”是指包含至少两个连续连接的氨基酸残基的链,链的长度没有上限。蛋白质中的一个或多个氨基酸残基可以包含修饰,诸如但不限于糖基化、磷酸化或二硫键形成。“蛋白质”可以包含一种或多种多肽。除非另外说明,否则术语“蛋白质”和“多肽”可互换使用。
[0067]
如本文所用的术语“核酸分子”,旨在包括dna分子和rna分子。核酸分子可以是单链或双链的,并且可以是cdna。
[0068]“保守氨基酸取代”是指氨基酸残基被具有相似侧链的氨基酸残基取代。具有相似侧链的氨基酸残基的家族在本领域中已被定义。这些家族包括:具有碱性侧链的氨基酸(例如,赖氨酸、精氨酸、组氨酸);具有酸性侧链的氨基酸(例如,天冬氨酸、谷氨酸);具有不带电荷的极性侧链的氨基酸(例如,甘氨酸、天冬酰胺、谷氨酰胺、丝氨酸、苏氨酸、酪氨酸、半胱氨酸、色氨酸);具有非极性侧链的氨基酸(例如,丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、甲硫氨酸);具有β-支化侧链的氨基酸(例如,苏氨酸、缬氨酸、异亮氨酸);以及具有芳族侧链的氨基酸(例如,酪氨酸、苯丙氨酸、色氨酸、组氨酸)。在某些方面,抗体中预测的非必需氨基酸残基被来自同一侧链家族的另一氨基酸残基替换。鉴定不消除抗原结合的核苷酸和氨基酸保守取代的方法是本领域熟知的(参见,例如,brummell等人,biochem.32:1180-1187(1993);kobayashi等人protein eng.12(10):879-884(1999);和burks等人proc.natl.acad.sci.usa 94:412-417(1997))。
[0069]
对于核酸,术语“大致同源性”指示两种核酸或其指定序列在最佳对齐并且比较时,在适当的核苷酸插入或缺失的情况下,至少约80%的核苷酸、至少约90%至95%或至少约98%至99.5%的核苷酸为相同的。替代地,当区段将在选择性杂交条件下与所述链的互补链杂交时,存在大致同源性。
[0070]
对于多肽,术语“大致同源性”指示两种多肽或其指定序列在最佳对齐并且比较时,在适当的氨基酸插入或缺失的情况下,至少约80%的氨基酸、至少约90%至95%或至少约98%至99.5%的氨基酸为相同的。
[0071]
两个序列之间的百分比同一性是由序列共享的相同位置的数量的函数(即,%同源性=相同的位置的数量/位置的总数x 100),考虑了为优化两个序列的对齐而需要引入的空位的数量和各空位的长度。序列的比较两个序列之间的和百分比同一性的确定可以使用数学算法来完成,例如以下在非限制性实例中所述。
[0072]
可以使用gcg软件包(可在worldwideweb.gcg.com获得)中的gap程序,使用使用nwsgapdna.cmp矩阵以及空间权重40、50、60、70或80和长度权重1、2、3、4、5或6来确定两个核苷酸序列之间的百分比同一性。还可使用已并入align程序(2.0版)中的e.meyers和w.miller(cabios,4:11-17(1989))的算法,使用pam120权重残基表、空位长度罚分12和空位罚分4来确定两个核苷酸或氨基酸序列之间的百分比同一性。此外,可使用已并入gcg软件包(可在worldwideweb.gcg.com获得)中的gap程序中的needleman和wunsch(j.mol.biol.(48):444-453(1970))算法,使用blossum 62矩阵或pam250矩阵以及空位权重16、14、12、10、8、6或4和长度权重1、2、3、4、5或6来确定两个氨基酸序列之间的百分比同一性。
[0073]
本文所述的核酸和蛋白质序列可进一步作为“查询序列”用于相对于公共数据库进行搜索以例如鉴定相关序列。此类搜索可使用altschul,等人(1990)j.mol.biol.215:403-10的nblast和xblast程序(2.0版)进行。blast核苷酸搜索可用nblast程序(计分=100,字长=12)来进行以获得与本文所述的核酸分子同源的核苷酸序列。blast蛋白质搜索可用xblast程序(计分=50,字长=3)来进行以获得与本文所述的蛋白质分子同源的氨基酸序列。为了出于比较目的获得空位比对,可以如altschul等人,(1997)nucleic acids res.25(17):3389-3402中所述利用空位blast。当使用blast和空位blast程序时,可以使用各个程序(例如,xblast和nblast)的默认参数。参见worldwideweb.ncbi.nlm.nih.gov。
[0074]
核酸可以存在于完整细胞中,存在于细胞溶解物中或以部分纯化或大致上纯的形式存在。当通过标准技术,包括碱/sds处理、cscl显带(banding)、柱层析、琼脂糖凝胶电泳和其他本领域熟知的技术,从其他细胞组分或其他污染物例如其他细胞核酸(例如染色体的其他部分)或蛋白质中纯化出来时,核酸是“分离的”或“呈现为大致上纯的”。参见f.ausubel,等人,编current protocols in molecular biology,greene publishing and wiley interscience,new york(1987)。
[0075]
核酸,例如cdna,可以根据标准技术进行突变以提供基因序列。对于编码序列,这些突变可根据需要影响氨基酸序列。具体地,考虑了与本文所述的天然v、d、j、恒定、转换和其他此类序列大致上同源或来源于这些序列的dna序列(其中“来源于”表示序列与另一序列相同或从另一序列修饰)。
[0076]
如本文所用,术语“载体”旨在指能够转运已与其连接的另一核酸的核酸分子。一
种类型的载体是“质粒”,其是指可将额外dna区段连接到其中的环状双链dna环。另一类型的载体是病毒载体,其中额外的dna区段可连接到病毒基因组中。某些载体能够在引入了它们的宿主细胞中自主复制(例如,具有细菌复制起点的细菌载体和附加型(episomal)哺乳动物载体)。其他载体(例如,非附加型哺乳动物载体)可在引入到宿主细胞中之后整合到宿主细胞的基因组中,并且由此与宿主基因组一起复制。此外,某些载体能够指导它们可操作地连接的基因的表达。此类载体在本文中称为“重组表达载体”(或简称为“表达载体”)。一般而言,在重组dna技术中有用的表达载体通常呈质粒的形式。在本说明书中,“质粒”和“载体”可互换使用,因为质粒是最常使用的载体形式。然而,还包括提供等效功能的其他形式的表达载体,诸如病毒载体(例如,复制缺陷型逆转录病毒、腺病毒和腺相关病毒)。
[0077]
如本文所用,术语“重组宿主细胞”(或简称“宿主细胞”)旨在指以下细胞,其包含不天然存在于细胞中的核酸,并且可以是已引入重组表达载体的细胞。应理解,此类术语不仅旨在指特定的主题细胞,而且旨在指这种细胞的后代。因为某些修饰可以由于突变或环境影响而在下一代中出现,所以此类后代可能实际上与亲代细胞不相同,但仍然包括在如本文中所用的术语“宿主细胞”的范围内。
[0078]
如本文所用,术语“连接”是指两个或更多个分子的缔合。连接可以是共价或非共价的。连接也可以是遗传的(即重组融合)。可以使用多种本领域公认的技术,诸如化学缀合和重组蛋白生产,来实现此类连接。
[0079]“癌症”是指特征在于体内异常细胞不受控制地生长的各种各样的疾病。不受调控的细胞分裂和生长导致恶性肿瘤的形成,所述恶性肿瘤侵入邻近组织,并且还可以通过淋巴系统或血流转移到身体的远侧部分。如本文所用,“癌症”是指原发性、转移性和复发性癌症。
[0080]
术语“融合蛋白”是指通过将两个或多个最初编码单独的蛋白质的基因连接起来所产生的蛋白质。这种融合基因的翻译产生具有来源于每个原始蛋白质的功能特性的单个多肽或多个多肽。在一些方面,两个或更多个基因可以在其核苷酸序列中包含取代、缺失和/或添加。
[0081]“fc受体”或“fcr”是与免疫球蛋白的fc区结合的受体。与igg抗体结合的fcr包含fcγr家族的受体,包括这些受体的等位基因变体和替代的剪接形式。fcγr家族由三种激活性受体(小鼠中为fcγri、fcγriii和fcγriv;人中为fcγria、fcγriia和fcγriiia)和一种抑制性受体(fcγriib)组成。人fcγr的各种特性是本领域已知的。大多数先天效应细胞类型共表达一种或多种激活性fcγr和抑制性fcγriib,而自然杀伤(nk)细胞选择性表达一种激活性fc受体(小鼠中为fcγriii,而人中为fcγriiia),但不表达小鼠和人中的抑制性fcγriib。人igg1与大多数人fc受体结合,并且就其结合的激活性fc受体的类型而言,认为它等效于鼠igg2a。
[0082]“fc区”(片段可结晶区)或“fc结构域”或“fc”是指抗体重链的c末端区,其介导免疫球蛋白与宿主组织或因子的结合,包括与位于免疫系统的各种细胞(例如效应细胞)上的fc受体或经典补体系统的第一组分(c1q)的结合。因此,fc区包含除第一恒定区免疫球蛋白结构域(例如,ch1或cl)以外的抗体恒定区。在igg、iga和igd抗体同种型中,fc区包含两个相同的蛋白质片段,其来源于抗体的两条重链的第二(ch2)和第三(ch3)恒定结构域;igm和ige fc区包含每条多肽链中的三个重链恒定结构域(ch结构域2-4)。对于igg,fc区包含免
疫球蛋白结构域ch2和ch3以及ch1与ch2结构域之间的铰链。虽然免疫球蛋白重链的fc区边界的定义可能有所不同,但如本文所定义,人igg重链fc区定义为从igg1的氨基酸残基d221、igg2的氨基酸残基v222、igg3的氨基酸残基l221和igg4的氨基酸残基p224延伸到重链的羧基末端,其中编号是根据如kabat中的eu索引进行的。人igg fc区的ch2结构域从氨基酸237延伸到氨基酸340,并且ch3结构域位于fc区中ch2结构域的c末端侧,即其从igg的氨基酸341延伸到氨基酸447或446(如果不存在c末端赖氨酸残基)或445(如果不存在c末端甘氨酸和赖氨酸残基)。如本文所用,fc区可以是天然序列fc,包括任何同种异型变体,或变体fc(例如,非天然存在的fc)。fc也可以单独地或在包含fc的蛋白质多肽(诸如“包含fc区的结合蛋白”,也称为“fc融合蛋白”(例如,抗体或免疫粘附))的上下文中指此区域。
[0083]“天然序列fc区”或“天然序列fc”包含与天然存在的fc区的氨基酸序列相同的氨基酸序列。天然序列人fc区包括天然序列人igg1 fc区、天然序列人igg2 fc区、天然序列人igg3 fc区和天然序列人igg4 fc区以及其天然存在的变体。天然序列fc包括fc的各种同种异型(参见,例如,jefferis等人(2009)mabs 1:1)。
[0084]
另外,本发明的fc(天然或变体)可以呈与天然形式相比,具有天然糖链、增加的糖链或减少的糖链的形式,或者可以呈脱糖基化的形式。免疫球蛋白fc糖链可以通过常规方法,诸如化学法、酶法和使用微生物的基因工程方法进行修饰。从fc片段中去除糖链导致与第一补体组分c1的c1q部分的结合亲和力急剧减小,以及adcc或cdc的减小或丧失,从而不会在体内诱导任何不必要的免疫反应。在这点上,脱糖基化或无糖基化(aglycosylated)形式的免疫球蛋白fc区作为药物载剂可能更适合本发明的目的。如本文所用,术语“脱糖基化”是指其中糖从fc片段中被酶促去除的fc区。另外,术语“无糖基化”意指fc片段由原核生物以非糖基化形式产生,并且优选地在大肠杆菌(e.coli)中产生。
[0085]
如本文所用,术语“免疫反应”是指脊椎动物内针对外来剂的生物学反应,所述反应保护生物体免受这些剂和由它们引起的疾病的影响。免疫反应是由免疫系统的细胞(例如,t淋巴细胞、b淋巴细胞、自然杀伤(nk)细胞、巨噬细胞、嗜酸性粒细胞、肥大细胞、树突细胞或中性粒细胞)和由这些细胞中的任一种或肝产生的可溶性大分子(包括抗体、细胞因子和补体)的作用介导的,所述免疫反应导致选择性靶向、结合、损伤、破坏侵入病原体、感染了病原体的细胞或组织、癌细胞或其他异常细胞或者(在自身免疫或病理性炎症的情况下)正常的人细胞或组织和/或将它们从脊椎动物体内消除。免疫反应包括例如t细胞的激活或抑制,例如效应t细胞或th细胞,诸如cd4
或cd8
t细胞,或treg细胞的抑制。
[0086]“免疫调节剂”或“免疫调控剂”是指可以参与调节、调控或修饰免疫反应的剂,例如信号通路的组分。“调节”、“调控”或“修饰”免疫反应是指免疫系统的细胞或此类细胞(例如,效应t细胞)的活性的任何改变。此类调节包括对免疫系统的刺激或抑制,其可以通过各种细胞类型数量的增加或减少、这些细胞的活性的增加或减少或免疫系统内可能发生的任何其他变化来体现。已鉴定了抑制性和刺激性免疫调节剂,其中一些可在肿瘤微环境中具有增强的功能。在优选的方面,免疫调节剂位于t细胞表面上。“免疫调节靶标”或“免疫调控靶标”是被靶向用于与物质、剂、部分、化合物或分子的结合并且其活性通过所述结合而改变的免疫调节剂。免疫调节靶标包括例如细胞表面上的受体(“免疫调节受体”)和受体配体(“免疫调节配体”)。
[0087]
术语“免疫疗法”是指通过包括诱导、增强、抑制或以其他方式修饰免疫反应的方
法来治疗患有疾病或者处于感染疾病或遭受疾病复发的风险中的受试者。对受试者的“治疗”或“疗法”是指对受试者进行的任何类型的干预或处理,或者向受试者施用活性剂,目的是逆转、缓解、改善、抑制、减缓或预防与疾病相关的症状、并发症或病状或者生化指标的发作、进展、发展、严重性或复发。
[0088]“免疫刺激疗法”或“免疫刺激性疗法”是指导致增加(诱导或增强)受试者的免疫反应以用于例如治疗癌症的疗法。
[0089]
术语“效应t细胞”(teff)是指具有细胞溶解活性的t细胞(例如cd4
和cd8
t细胞)以及以及辅助性t(th)细胞(其分泌细胞因子并激活和引导其他免疫细胞)但不包括调节性t细胞(treg细胞)。il-7蛋白和免疫检查点抑制剂(例如抗pd-1抗体)的组合激活和/或增加受试者肿瘤或血液中teff细胞(例如cd4
和cd8
t细胞)的频率。
[0090]
如本文所用,术语“调节性t细胞”(treg)是指具有减少或抑制效应t细胞的诱导和增殖并由此调节免疫反应的能力的t细胞群。在一些方面,treg可以通过分泌抗炎细胞因子诸如il-10、tgf-β和il-35来抑制免疫反应,所述抗炎细胞因子可以干扰初始t细胞的活化和初始t细胞向效应t细胞的分化。在一些方面,treg还可以产生细胞溶解性分子诸如颗粒酶b,细胞溶解性分子可以诱导效应t细胞的凋亡。在一些方面,调节性t细胞是天然调节性t细胞(ntreg)(即,在胸腺内发育)。在一些方面,调节性t细胞是诱导性调节性t细胞(itreg)(即,在暴露于某些刺激后在外周组织中分化成treg的初始t细胞)。用于鉴定treg的方法是本领域已知的。例如,treg表达可以使用流式细胞术测量的某些表型标志物(例如,cd25、foxp3或cd39)。参见例如国际公开号wo 2017/062035 a1;gu j,等人,cell mol immunol 14(6):521-528(2017)。在一些方面,treg是cd45ra-cd39
t细胞。
[0091]
如本文所用,术语“肿瘤浸润淋巴细胞”或“til”是指已从外周(例如,从血液)迁移到肿瘤中的淋巴细胞(例如,效应t细胞)。在一些方面,肿瘤浸润淋巴细胞是cd4 til。在其他方面,肿瘤浸润淋巴细胞是cd8 til。
[0092]
刺激免疫反应或免疫系统的能力增强可能由t细胞共刺激受体的激动活性增强和/或抑制性受体的拮抗活性增强引起。刺激免疫反应或免疫系统的能力增强可以通过在测量免疫反应的测定(例如,测量细胞因子或趋化因子释放、细胞溶解活性(直接在靶细胞上或间接地通过检测cd107a或颗粒酶确定)和增殖方面的变化的测定)中ec50或最大活性水平的倍数增加来反映。刺激免疫反应或免疫系统活性的能力可以增强至少10%、30%、50%、75%、2倍、3倍、5倍或更多。
[0093]
如本文所用,术语“白介素-7”或“il-7”是指il-7多肽及其衍生物和类似物,例如,在标准生物测定或对il-7受体结合亲和力的测定中,其与野生型成熟哺乳动物il-7具有实质的氨基酸序列同一性和大致上等效的生物学活性。例如,il-7是指具有以下氨基酸序列的重组或非重组多肽的氨基酸序列:i)il-7多肽的天然或天然存在的等位基因变体,ii)il-7多肽的生物活性片段,iii)il-7多肽的生物活性多肽类似物,或iv)il-7多肽的生物活性变体。本发明的il-7多肽可获自任何物种,例如人、母牛或绵羊。il-7核酸和氨基酸序列是本领域熟知的。例如,人il-7氨基酸序列的genbank登录号为p13232(seq id no:1);小鼠il-7氨基酸序列的genbank登录号为p10168(seq id no:3);大鼠il-7氨基酸序列的genbank登录号为p56478(seq id no:2);猴il-7氨基酸序列的genbank登录号为np_001279008(seq id no:4);母牛il-7氨基酸序列的genbank登录号为p26895(seq id no:
5);并且绵羊il-7氨基酸序列的genbank登录号为q28540(seq id no:6)。在一些方面,本公开的il-7多肽是il-7蛋白的变体。
[0094]
il-7蛋白的“变体”被定义为由一个或多个氨基酸改变的氨基酸序列。所述变体可以具有“保守”变化,其中取代的氨基酸具有类似的结构或化学特性,例如,用异亮氨酸替换亮氨酸。更罕见地,变体可具有“非保守”变化,例如用色氨酸替换甘氨酸。相似的微小变化还可包括氨基酸缺失或插入,或两者兼有。可以使用本领域熟知的计算机程序(例如用于分子建模或用于产生对齐的软件)找到确定哪些和多少个氨基酸残基可以被取代、插入或缺失而不丧失生物活性的指导。本发明中包括的变体il-7蛋白包括保留il-7活性的il-7蛋白。还包括添加、取代或缺失的il-7多肽也包括在本发明中,只要蛋白质保留大致上等效的生物il-7活性即可。例如,保留与il-7蛋白的全长形式相当的生物活性的il-7的截短物包括在本发明中。il-7蛋白的活性可以使用诸如下文实施例6中所述的体外细胞增殖测定来测量。与野生型il-7相比,本发明的il-7变体的活性保持至少10%、20%、40%、60%,但更优选地80%、90%、95%,并且甚至更优选地99%的生物活性。
[0095]
变体il-7蛋白还包含与野生型il-7具有至少约70%、75%、80%、85%、90%、92%、95%、96%、97%、98%、99%或更大的序列同一性的多肽。为了确定两个氨基酸序列或两个核酸的百分比同一性,将序列对齐以达到最佳比较目的(例如,可以在第一个氨基酸或核酸序列的序列中引入空位以实现与第二个氨基酸或核酸序列的最佳对齐)。两个序列之间的百分比同一性是由序列共享的相同位置的数量的函数(即,%同源性=相同位置的数量/位置的总数x 100)。两个序列之间的百分比同源性的确定可以使用数学算法来完成。用于比较两个序列的数学算法的优选的非限制性实例是如karlin和altschul(1990)proc.natl.acad.sci.usa 87:2264-68的算法,如karlin和altschul(1993)proc.natl.acad.sci.usa 90:5873-77中所修改。这种算法被并入altschul,等人,(1990)j.mol.biol.215:403-10的nblast和xblast程序中。blast核苷酸搜索可以用nblast程序进行,得分=100,字长=12。blast蛋白质搜索可以用xblast程序进行,得分=50,字长=3。为了出于比较目的获得空位对齐,可以如altschul等人,(1997)nucleic acids research.25(17):3389-3402中所述利用空位blast。当使用blast和空位blast程序时,可以使用各个程序(例如,xblast和nblast)的默认参数。
[0096]
如本文所用,术语“程序性死亡-1(pd-1)”是指属于cd28家族的免疫抑制受体。pd-1主要在体内先前激活的t细胞上表达,并与两种配体pd-l1和pd-l2结合。如本文所用,术语“pd-1”包括人pd-1(hpd-1);hpd-1的变体、同工型和物种同源物;以及与hpd-1具有至少一个共同表位的类似物。完整的hpd-1序列可以在genbank登录号u64863下找到。
[0097]
如本文所用,术语“程序性死亡配体-1(pd-l1)”是指pd-1的两种细胞表面糖蛋白配体之一(另一种是pd-l2),其在与pd-1结合后下调t细胞激活和细胞因子分泌。如本文所用,术语“pd-l1”包括人pd-l1(hpd-l1);hpd-l1的变体、同工型和物种同源物;以及与hpd-l1具有至少一个共同表位的类似物。完整的hpd-l1序列可以在genbank登录号q9nzq7下找到。
[0098]
如本文所用,术语“鸟苷酸环化酶c(gc-c)”是指主要存在于哺乳动物(例如人)的肠腔内并有助于维持胃肠道的正常生理功能的膜结合酶。gc-c的配体是本领域已知的。参见waldman,s.a.,等人,gut 67(8):1543-1552(2018)。在一些方面,gc-c充当肠道细菌分泌
的热稳定毒素(st)肽的受体。在一些方面,gc-c充当鸟苷肽和尿鸟苷肽的受体,其在胃肠道内自然产生。gc-c也称为鸟苷酸环化酶2c、肠鸟苷酸环化酶、鸟苷酸环化酶-c受体或热稳定肠毒素受体(hstar)。人gc-c的全长序列是已知的,可以在genbank登录号p25092.2下找到。
[0099]“受试者”包括任何人或非人动物。术语“非人动物”包括但不限于脊椎动物(诸如非人灵长类动物、绵羊、狗)和啮齿动物(诸如小鼠、大鼠和豚鼠)。在一些方面,受试者是人。术语“受试者”和“患者”在本文中可互换使用。
[0100]
术语“治疗有效量”或“治疗有效剂量”是指提供所需生物、治疗和/或预防结果的剂的量。所述结果可以是疾病的一种或多种体征、症状或病因的减少、改善、缓和、减轻、延迟和/或缓解,或者生物系统的任何其他所需的改变。关于实体瘤,有效量包括足以引起肿瘤缩小和/或降低肿瘤生长速率(诸如抑制肿瘤生长)或者预防或延迟其他不需要的细胞增殖的量。在一些方面,有效量是足以延迟肿瘤发展的量。在一些方面,有效量是足以预防或延迟肿瘤复发的量。有效量可以在一次或多次施用中施用。有效量的药物或组合物可以:(i)减少癌细胞的数量;(ii)减小肿瘤大小;(iii)在一定程度上抑制、延缓、减慢并可以阻止癌细胞浸润到外周器官;(iv)抑制(即,在一定程度上减慢并可以阻止肿瘤转移;(v)抑制肿瘤生长;(vi)防止或延迟肿瘤的发生和/或复发;和/或(vii)在一定程度上缓解一种或多种与癌症相关的症状。在一些方面,“治疗有效量”是经临床证实实现癌症的显著减少或癌症(诸如晚期实体瘤)的进展(消退)的减慢的il-7蛋白的量与双特异性抗体的量的组合。治疗剂促进疾病消退的能力可使用熟练从业者已知的多种方法来评估,诸如在临床试验期间在人受试者中,在预测在人中的功效的动物模型系统中,或通过在体外测定中测定剂的活性。
[0101]
术语“给药频率”是指在特定时间段内向受试者施用治疗剂(例如,il-7蛋白或双特异性抗体)的次数。给药频率可以表示为每给定时间的剂量数,例如,每天一次、每周一次或每两周一次。如本文所用,“给药频率”适用于受试者接受治疗剂的多次(或重复)施用的情况。
[0102]
如本文所用,术语“护理标准”是指被医学专家接受为对某种类型的疾病的适当治疗并且被医疗保健专业人员广泛使用的治疗。所述术语可以与以下术语中的任一者互换使用:“最佳实践”、“标准医疗护理”和“标准疗法”。
[0103]
如本文所用,术语“药物”是指旨在施用至人或非人哺乳动物以预防或治疗疾病或其他不期望的病状的任何生物活性剂(例如,本文所公开的il-7蛋白或双特异性抗体)。药物包括激素、生长因子、蛋白质、肽和其他化合物。在一些方面,本文所公开的药物是抗癌剂。
[0104]
例如,“抗癌剂”促进受试者的癌症消退或预防进一步的肿瘤生长。在某些方面,治疗有效量的药物促进癌症消退至消除癌症的程度。“促进癌症消退”意指单独或与抗肿瘤剂组合施用有效量的药物导致肿瘤生长或大小减少、肿瘤坏死、至少一种疾病症状的严重性降低、疾病无症状期的频率和持续时间增加或预防由疾病折磨引起的损伤或残疾。此外,关于治疗的术语“有效”和“有效性”包括药理有效性和生理安全性。药理有效性是指药物促进患者的癌症消退的能力。生理安全性是指由药物施用引起的在细胞、器官和/或生物体水平上的毒性或其他不良生理反应(不良反应)的水平。
[0105]
例如,对于肿瘤的治疗,相对于未经治疗的受试者,或在某些方面,相对于用护理
标准疗法治疗的患者,治疗有效量的抗癌剂可以抑制细胞生长或肿瘤生长至少约10%、至少约20%、至少约40%、至少约60%或至少约80%。在本发明的其他方面,可以观察到肿瘤消退并且其持续至少约20天、至少约40天或至少约60天的时间段。虽然对治疗有效性进行了这些最终测量,但免疫治疗药物的评估也必须考虑到“免疫相关”的反应模式。
[0106]
如本文所用,术语“免疫检查点抑制剂”是指完全地或部分地减少、抑制、干扰或调节一种或多种免疫检查点蛋白的分子。免疫检查点蛋白调控t细胞激活或功能。许多检查点蛋白是已知的,诸如ctla-4及其配体cd80和cd86;和pd-1及其配体pd-l1和pd-l2。pardoll,d.m.,nat rev cancer 12(4):252-64(2012)。这些蛋白质负责t细胞反应的共刺激或抑制性相互作用。免疫检查点蛋白调控并维持自身耐受性以及生理免疫反应的持续时间和幅度。免疫检查点抑制剂包括抗体或来源于抗体。
[0107]
如本文所用,术语“参考”是指未接受il-7蛋白和双特异性抗体的组合的相应受试者(例如癌症受试者),例如,单独接受il-7蛋白或单独接受双特异性抗体的受试者。在一些方面,参考受试者既没有接受il-7蛋白也没有接受双特异性抗体。术语“参考”还可以指同一位但在施用il-7蛋白和双特异性抗体的组合之前的癌症受试者。在某些方面,术语“参考”是指受试者(例如癌症受试者)群体的平均值。
[0108]
如本文所用,术语“ug”和“um”可分别与“μg”和“μμ”互换使用。
[0109]
本文所述的各个方面更详细描述于以下小节中。
[0110]
ii.本公开的方法
[0111]
本公开涉及一种用于治疗有需要的受试者的肿瘤(或癌症)的方法,其包括向受试者施用有效量的白介素-7(il-7)蛋白和有效量的双特异性抗体的组合。在一些方面,可用于本公开的双特异性抗体可结合肿瘤抗原和免疫细胞上表达的抗原。在某些方面,施用il-7蛋白和双特异性抗体的组合可以增加双特异性抗体的抗癌作用。在一些方面,施用il-7蛋白和双特异性抗体的组合改善了与如本文所述的肿瘤(或癌症)相关的一种或多种症状。在本文其他地方还提供了有关可与本公开一起使用的示例性双特异性抗体的另外公开。
[0112]
在一些方面,本文所公开的il-7蛋白和双特异性抗体的组合抑制和/或减少受试者中的肿瘤生长(例如,肿瘤体积或重量)。在一些方面,与参考(例如,单独施用il-7蛋白或单独施用双特异性抗体后对应的受试者的肿瘤体积)相比,肿瘤生长减少至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或约100%。
[0113]
在一些方面,il-7蛋白和双特异性抗体的组合在施用至受试者时不会引起毒性。在某些方面,没有毒性可以对应于体重减轻的最小减轻。因此,在一些方面,与参考体重(例如,施用前受试者的体重和/或单独施用il-7蛋白或双特异性抗体后受试者的体重)相比,在施用il-7蛋白和双特异性抗体后,il-7蛋白和双特异性抗体的组合不引起受试者的体重减轻。在某些方面,与参考体重(例如,施用前受试者的体重)相比,接受il-7蛋白和双特异性抗体的组合的受试者的体重减轻不超过约1%、约2%、约3%、约4%、约5%、约6%、约7%、约8%、约9%、约10%、约15%或约20%。
[0114]
在一些方面,本文所公开的il-7蛋白和双特异性抗体的组合在施用至受试者时可以增加受试者的绝对淋巴细胞计数。在某些方面,与参考(例如,单独施用il-7蛋白或单独施用双特异性抗体后对应的受试者的值)相比,绝对淋巴细胞计数增加了至少约5%、至少
约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约100%或更多。
[0115]
在一些方面,本文所公开的il-7蛋白和双特异性抗体的组合可以促进和/或增强针对肿瘤抗原的免疫反应。在一些方面,施用il-7蛋白和双特异性抗体的组合增加受试者的肿瘤中肿瘤浸润淋巴细胞(til)(例如cd4
或cd8
)的数量和/或百分比。在一些方面,与参考(例如,单独施用il-7蛋白或单独施用双特异性抗体后对应的受试者的值)相比,在施用后til的数量和/或百分比增加了至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约125%、至少约150%、至少约200%、至少约250%或至少约300%。
[0116]
在一些方面,施用il-7蛋白和双特异性抗体的组合减少受试者的肿瘤中调节性t细胞(treg)的数量和/或百分比。在一些方面,调节性t细胞是cd4
调节性t细胞。在一些方面,调节性t细胞是foxp3
。在某些方面,与参考(例如,单独施用il-7蛋白或单独施用双特异性抗体后对应的受试者中的值)相比,肿瘤中调节性t细胞的数量和/或百分比减少至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或约100%。
[0117]
在一些方面,施用il-7蛋白和双特异性抗体的组合增加受试者的肿瘤中cd8
til与treg的比率。在某些方面,与参考(例如,单独施用il-7蛋白或单独施用双特异性抗体后对应的受试者中的值)相比,在施用后cd8
til与treg的比率增加了至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约125%、至少约150%、至少约200%、至少约250%或至少约300%。
[0118]
在一些方面,施用il-7蛋白和双特异性抗体的组合降低受试者中til上的免疫检查点抑制剂分子(例如pd-1)的表达。在一些方面,施用il-7蛋白和双特异性抗体的组合增加受试者中til上的与效应子(例如抗肿瘤)活性相关的标志物的表达。与效应子活性相关的标志物的非限制性实例包括cd69、cd25和颗粒酶b。
[0119]
如前文所述,许多癌症患者淋巴细胞减少,因为已知许多可用的护理标准癌症治疗(例如,化学疗法和放射疗法)会引起淋巴细胞减少症。因此,本文所公开的方法也可用于治疗淋巴细胞减少的受试者的癌症。
[0120]
如本文所用,术语“淋巴细胞减少的受试者”是指患有淋巴细胞减少症的受试者。如本文所用,术语“淋巴细胞减少症(lymphopenia)”和“淋巴细胞减少症(lymphocytopenia)”可互换使用,并且指以循环免疫细胞(例如淋巴细胞)的数量异常低为特征的病状。在患有淋巴细胞减少症的患者中,所有类型的淋巴细胞或淋巴细胞亚群(例如,cd4
t细胞)的外周循环可能被耗尽或异常低。参见例如lymphopenia description,the merck manual(第18版,2006,merck&co.)。在一些方面,与正常受试者(例如,健康个体)相比,淋巴细胞减少的受试者的t淋巴细胞(“t淋巴细胞减少症”)、b淋巴细胞(“b淋巴细胞减少症”)和/或nk细胞(“nk淋巴细胞减少症”)的数量减少。
[0121]
在数量上,淋巴细胞减少症可以通过各种截止值来描述。在一些方面,与未表现出淋巴细胞减少症的对应受试者的循环血总淋巴细胞计数相比,淋巴细胞减少的受试者的循
环血总淋巴细胞计数小至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或至少约100%。在一些方面,如果受试者的循环血总淋巴细胞计数小于约1,500个淋巴细胞/μl、小于约1,000个淋巴细胞/μl、小于约800个淋巴细胞/μl、小于约500个淋巴细胞/μl或小于约200个淋巴细胞/μl,则受试者患有淋巴细胞减少症。
[0122]
淋巴细胞减少症有多种可能的原因。在一些方面,淋巴细胞减少由肿瘤引起或与肿瘤相关。在一些方面,淋巴细胞减少症是由先前用于肿瘤的疗法(例如,化学疗法或放射疗法)引起或与之相关。在一些方面,淋巴细胞减少症由以下引起或与之相关:感染,包括病毒感染(例如hiv或肝炎感染)、细菌感染(例如活动性肺结核感染)和真菌感染;心脏右心室的慢性衰竭;霍奇金氏病和淋巴系统癌症;白血病;胸导管渗漏或破裂;处方药(包括抗癌剂、抗病毒剂和糖皮质激素)的副作用;低蛋白饮食导致的营养不良;放射疗法;尿毒症;自身免疫性疾病;免疫缺陷综合征;高压力水平;和创伤。
[0123]
在一些方面,淋巴细胞减少症是特发性的(即,病因不明)。特发性淋巴细胞减少症的非限制性实例包括特发性cd4阳性t淋巴细胞减少症(icl)、急性放射综合征(ars)或其组合。
[0124]
可以用本文所公开的方法治疗的癌症(或肿瘤)的非限制性实例包括鳞状细胞癌、小细胞肺癌(sclc)、非小细胞肺癌、鳞状非小细胞肺癌(nsclc)、非鳞状nsclc、胃肠癌、肾癌(例如透明细胞癌)、卵巢癌、肝癌(例如肝细胞癌)、结直肠癌、子宫内膜癌、肾癌(例如肾细胞癌(rcc))、前列腺癌(例如激素难治性前列腺腺癌)、甲状腺癌、胰腺癌、宫颈癌、胃癌、膀胱癌、肝细胞瘤(hepatoma)、乳腺癌、结肠癌,和头颈癌(或癌(carcinoma))、胃癌、生殖细胞肿瘤、小儿肉瘤、鼻窦自然杀伤、黑色素瘤(例如转移性恶性黑色素瘤,诸如皮肤或眼内恶性黑色素瘤)、骨癌、皮肤癌、子宫癌、肛门区域癌、睾丸癌、输卵管癌、子宫内膜癌、宫颈癌、阴道癌、外阴癌、食道癌(例如食管胃结合部癌(gastroesophageal junction cancer))、小肠癌、内分泌系统癌、甲状旁腺癌、肾上腺癌、软组织肉瘤、尿道癌、阴茎癌、儿童实体瘤、输尿管癌、肾盂癌、肿瘤血管生成、垂体腺瘤、卡波西氏肉瘤(kaposi'ssarcoma)、表皮样癌、鳞状细胞癌、t细胞淋巴瘤、环境诱导的癌症包括石棉诱导的癌症、病毒相关的癌症或病毒起源的癌症(例如人乳头瘤病毒(hpv相关或hpv起源的肿瘤)),和来源于两种主要血细胞谱系即髓样细胞系(其产生粒细胞、红细胞、血小板、巨噬细胞和肥大细胞)或淋巴样细胞系(其产生b细胞、t细胞、nk细胞和浆细胞)中的任一种的血液系统恶性肿瘤,诸如所有类型的白血病、淋巴瘤和骨髓瘤,例如急性、慢性、淋巴细胞和/或骨髓性白血病,诸如急性白血病(all)、急性骨髓性白血病(aml)、慢性淋巴细胞白血病(cll)和慢性骨髓性白血病(cml)、未分化的aml(mo)、原始粒细胞性白血病(myeloblastic leukemia)(ml)、原始粒细胞性白血病(m2;伴有细胞成熟)、早幼粒细胞白血病(promyelocytic leukemia)(m3或m3变体[m3v])、粒单核细胞白血病(myelomonocytic leukemia)(m4或具有嗜酸性粒细胞增多症的m4变体[m4e])、单核细胞白血病(monocytic leukemia)(m5)、红白血病(erythroleukemia)(m6)、巨核细胞白血病(megakaryoblastic leukemia)(m7)、孤立性粒细胞肉瘤(isolated granulocytic sarcoma)和绿色瘤(chloroma);淋巴瘤,诸如霍奇金氏淋巴瘤(hl)、非霍奇金氏淋巴瘤(nhl)、b细胞血液系统恶性肿瘤例如b细胞淋巴瘤、t细胞淋巴瘤、淋巴浆细胞样淋巴瘤(lymphoplasmacytoid lymphoma)、单核细胞样b细胞淋巴瘤、粘膜相关淋巴样组织
(malt)淋巴瘤、间变性(例如ki1
)大细胞淋巴瘤、成人t细胞淋巴瘤/白血病、套细胞淋巴瘤、血管免疫母细胞性t细胞淋巴瘤(angio immunoblastic t-cell lymphoma)、血管中心性淋巴瘤(angiocentric lymphoma)、肠t细胞淋巴瘤、原发性纵隔b细胞淋巴瘤、前体t淋巴母细胞淋巴瘤、t淋巴母细胞;和淋巴瘤/白血病(t-lbly/t-all)、外周t细胞淋巴瘤、淋巴母细胞淋巴瘤、移植后淋巴增生性病症、真性组织细胞性淋巴瘤(true histiocytic lymphoma)、原发性渗出性淋巴瘤、b细胞淋巴瘤、淋巴母细胞淋巴瘤(lbl)、淋巴样谱系造血肿瘤、急性淋巴母细胞白血病(acute lymphoblastic leukemia)、弥漫性大b细胞淋巴瘤、伯基特氏淋巴瘤(burkitt's lymphoma)、滤泡性淋巴瘤、弥漫性组织细胞性淋巴瘤(dhl)、免疫母细胞性大细胞淋巴瘤、前体b淋巴母细胞淋巴瘤、皮肤t细胞淋巴瘤(ctlc)(也称为蕈样肉芽肿或塞扎里综合征(sezary syndrome))和淋巴浆细胞样淋巴瘤(lpl)伴华氏巨球蛋白血症(waldenstrom's macroglobulinemia);骨髓瘤,诸如igg骨髓瘤、轻链骨髓瘤、非分泌性骨髓瘤、阴燃性骨髓瘤(smoldering myeloma)(也称为惰性骨髓瘤(indolent myeloma))、孤立性浆细胞瘤(solitary plasmocytoma)和多发性骨髓瘤、慢性淋巴细胞白血病(cll)、毛细胞淋巴瘤;髓样谱系造血肿瘤、间质起源的肿瘤,包括纤维肉瘤和横纹肌肉瘤;精原细胞瘤、畸胎瘤、间质起源的肿瘤,包括纤维肉瘤、横纹肌肉瘤和骨肉瘤;以及其他肿瘤,包括黑色素瘤、着色性干皮病、角化棘皮瘤、精原细胞瘤、甲状腺滤泡癌(thyroid follicular cancer)和畸胎瘤、淋巴样谱系造血肿瘤,例如t细胞和b细胞肿瘤,包括但不限于t细胞病症,诸如t幼淋巴细胞白血病(t-prolymphocytic leukemia,t-pll),包括小细胞和脑形细胞(cerebriform cell)类型;t细胞类型的大颗粒淋巴细胞白血病(lgl);和t-nhl肝脾淋巴瘤;外周/胸腺后t细胞淋巴瘤(多形性和免疫母细胞亚型);血管中心性(鼻)t细胞淋巴瘤;头或颈部癌症、肾癌、直肠癌、甲状腺癌;急性髓样淋巴瘤及其任何组合。
[0125]
在一些方面,可以治疗的癌症(或肿瘤)包括乳腺癌、头颈癌、子宫癌、脑癌、皮肤癌、肾癌、肺癌、结直肠癌、前列腺癌、肝癌、膀胱癌、肾癌、胰腺癌、甲状腺癌、食道癌、眼癌、胃癌、胃肠癌、癌、肉瘤、白血病、淋巴瘤、骨髓瘤或其组合。在某些方面,可以用本发明的方法治疗的癌症(或肿瘤)是乳腺癌。在一些方面,乳腺癌是三阴性乳腺癌(tnbc)。在一些方面,可以治疗的癌症(或肿瘤)是脑癌。在某些方面,脑癌是胶质母细胞瘤。在一些方面,可以用本发明的方法治疗的癌症(或肿瘤)是皮肤癌。在一些方面,皮肤癌是基底细胞癌(bcc)、皮肤鳞状细胞癌(cscc)、黑色素瘤、默克尔细胞癌(mcc)或其组合。在某些方面,头颈癌是头颈部鳞状细胞癌。在另外的方面,肺癌是小细胞肺癌(sclc)。在一些方面,食道癌是食管胃结合部癌。在某些方面,肾癌是肾细胞癌。在一些方面,肝癌是肝细胞癌。
[0126]
在一些方面,本文所述的方法还可用于治疗转移性癌症、不可切除的难治性癌症(例如,先前的癌症疗法(例如免疫疗法,例如,用阻断性抗pd-1抗体)难治的癌症)和/或复发性癌症。在某些方面,先前的癌症疗法包括化学疗法。在一些方面,化学疗法包括铂基(platinum-based)疗法。在一些方面,铂基疗法包括选自由顺铂、卡铂、奥沙利铂、奈达铂(nedaplatin)、四硝酸三铂(triplatin tetranitrate)、菲铂(phenanthriplatin)、吡铂(picoplatin)、沙铂(satraplatin)及其任何组合组成的组的铂基抗肿瘤药。在某些方面,铂基疗法包括顺铂。在另外的方面,铂基疗法包括卡铂。
[0127]
在一些方面,待用本文所公开的方法治疗的受试者已经接受了一种、两种、三种、四种、五种或更多种先前的癌症治疗。在其他方面,受试者是未经治疗的(即,从未接受过先
前的癌症治疗)。在一些方面,受试者已在其他癌症治疗方面取得了进展。在某些方面,先前的癌症治疗包括免疫疗法(例如,用抗pd-1抗体)。在其他方面,先前的癌症治疗包括化学疗法。在一些方面,肿瘤已经复发。在一些方面,肿瘤是转移性的。在其他方面,所述肿瘤不是转移性的。
[0128]
在一些方面,本文所公开的方法有效地增加有需要(例如,患有肿瘤)的受试者的存活期持续时间。例如,在一些方面,当与参考个体(例如,单独用il-7蛋白或单独用双特异性抗体治疗的对应的受试者)相比时,受试者的存活期持续时间增加了至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月或至少约1年或更长时间。在其他方面,本文所公开的方法以比参考受试者(例如,单独用il-7蛋白或单独用双特异性抗体治疗的对应的受试者)的存活期持续时间高一定水平(高约一个月、高约两个月、高约三个月、高约四个月、高约五个月、高约六个月、高约七个月、高约八个月、高约九个月、高约十个月、高约十一个月或高约一年)地增加受试者的存活期持续时间。
[0129]
在一些方面,本公开的方法有效地增加受试者(例如,癌症患者)的无进展存活期持续时间。例如,当与参考受试者(例如,单独用il-7蛋白或单独用双特异性抗体治疗的对应的受试者)相比时,受试者的无进展存活期增加了至少约1个月、至少约2个月、至少约3个月、至少约4个月、至少约5个月、至少约6个月、至少约7个月、至少约8个月、至少约9个月、至少约10个月、至少约11个月或至少约1年。
[0130]
在一些方面,本文所公开的方法有效地增加了一组受试者的缓解率。例如,当与参考受试者(例如,单独用il-7蛋白或单独用双特异性抗体治疗的对应的受试者)相比时,一组受试者的缓解率增加了至少约2%、至少约3%、至少约4%、至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%、至少约99%或至少约100%。
[0131]
在一些方面,所述方法中所治疗的受试者是非人动物,诸如大鼠或小鼠。在一些方面,所述方法中所治疗的受试者是人。
[0132]
在一些方面,本文所公开的il-7蛋白的单位剂量(例如,用于人)可以在0.001mg/kg至10mg/kg的范围内。在某些方面,il-7蛋白的单位剂量在0.01mg/kg至2mg/kg的范围内。在一些方面,单位剂量在0.02mg/kg至1mg/kg的范围内。单位剂量可以根据治疗的受试者的疾病和不良反应的存在而变化。il-7蛋白的施用可以通过定期弹丸式注射或外部储器(例如,静脉注射袋)或者通过从内部(例如,生物腐蚀植入物)连续静脉内、皮下或腹膜内施用来进行。在某些方面,本文所公开的il-7蛋白通过肌肉内注射施用。
[0133]
在一些方面,本文所公开的il-7蛋白可以以基于重量的剂量施用至受试者。在某些方面,il-7蛋白可以以约20μg/kg与约600μg/kg之间的基于重量的剂量施用。在另外的方面,本公开的il-7蛋白可以以约20μg/kg、约60μg/kg、约120μg/kg、约240μg/kg、约360μg/kg、约480μg/kg或约600μg/kg的基于重量的剂量施用。
[0134]
在一些方面,本文所公开的il-7蛋白可以以大于约600μg/kg的剂量施用至受试者。在某些方面,il-7蛋白以大于约600μg/kg、大于约700μg/kg、大于约800μg/kg、大于约900μg/kg、大于约1,000μg/kg、大于约1,100μg/kg、大于约1,200μg/kg、大于约1,300μg/kg、
大于约1,400μg/kg、大于约1,500μg/kg、大于约1,600μg/kg、大于约1,700μg/kg、大于约1,800μg/kg、大于约1,900μg/kg或大于约2,000μg/kg的剂量施用至受试者。
[0135]
在一些方面,本公开的il-7蛋白以610μg/kg与约1,200μg/kg之间、650μg/kg与约1,200μg/kg之间、约700μg/kg与约1,200μg/kg之间、约750μg/kg与约1,200μg/kg之间、约800μg/kg与约1,200μg/kg之间、约850μg/kg与约1,200μg/kg之间、约900μg/kg与约1,200μg/kg之间、约950μg/kg与约1,200μg/kg之间、约1,000μg/kg与约1,200μg/kg之间、约1,050μg/kg与约1,200μg/kg之间、约1,100μg/kg与约1,200μg/kg之间、约1,200μg/kg与约2,000μg/kg之间、约1,300μg/kg与约2,000μg/kg之间、约1,500μg/kg与约2,000μg/kg之间、约1,700μg/kg与约2,000μg/kg之间、约610μg/kg与约1,000μg/kg之间、约650μg/kg与约1,000μg/kg之间、约700μg/kg与约1,000μg/kg之间、约750μg/kg与约1,000μg/kg之间、约800μg/kg与约1,000μg/kg之间、约850μg/kg与约1,000μg/kg之间、约900μg/kg与约1,000μg/kg之间或约950μg/kg与约1,000μg/kg之间的剂量施用。
[0136]
在一些方面,本公开的il-7蛋白以610μg/kg与约1,200μg/kg之间的剂量施用。在某些方面,il-7蛋白以650μg/kg与约1,200μg/kg之间的剂量施用。在一些方面,il-7蛋白以约700μg/kg与约1,200μg/kg之间的剂量施用。在另外的方面,il-7蛋白以750μg/kg与约1,200μg/kg之间的剂量施用。在某些方面,il-7蛋白以约800μg/kg与约1,200μg/kg之间的剂量施用。在一些方面,il-7蛋白以约850μg/kg与约1,200μg/kg之间的剂量施用。在一些方面,il-7蛋白以约900μg/kg与约1,200μg/kg之间的剂量施用。在另外的方面,il-7蛋白以约950μg/kg与约1,200μg/kg之间的剂量施用。在一些方面,本文所公开的il-7蛋白以约1,000μg/kg与约1,200μg/kg之间的剂量施用。在一些方面,il-7蛋白以约1,050μg/kg与约1,200μg/kg之间的剂量施用。在一些方面,il-7蛋白以约1,100μg/kg与约1,200μg/kg之间的剂量施用。在一些方面,il-7蛋白以约1,200μg/kg与约2,000μg/kg之间的剂量施用。在另外的方面,il-7蛋白以约1,300μg/kg与约2,000μg/kg之间的剂量施用。在一些方面,il-7蛋白以约1,500μg/kg与约2,000μg/kg之间的剂量施用。在一些方面,il-7蛋白以约1,700μg/kg与约2,000μg/kg之间的剂量施用。在某些方面,il-7蛋白以约610μg/kg与约1,000μg/kg之间的剂量施用。在一些方面,il-7蛋白以约650μg/kg与约1,000μg/kg之间的剂量施用。在另外的方面,il-7蛋白以约700μg/kg与约1,000μg/kg之间的剂量施用。在又另外的方面,il-7蛋白以约750μg/kg与约1,000μg/kg之间的剂量施用。在某些方面,il-7蛋白以约800μg/kg与约1,000μg/kg之间的剂量施用。在一些方面,il-7蛋白以约850μg/kg与约1,000μg/kg之间的剂量施用。在一些方面,本公开的il-7蛋白以约900μg/kg与约1,000μg/kg之间的剂量施用。在一些方面,il-7蛋白以约950μg/kg与约1,000μg/kg之间的剂量施用。
[0137]
在一些方面,il-7蛋白以约700μg/kg与约900μg/kg之间、约750μg/kg与约950μg/kg之间、约700μg/kg与约850μg/kg之间、约750μg/kg与约850μg/kg之间、约700μg/kg与约800μg/kg之间、约800μg/kg与约900μg/kg之间、约750μg/kg与约850μg/kg之间或约850μg/kg与约950μg/kg之间的剂量施用。在一些方面,il-7蛋白以约700μg/kg与约900μg/kg之间的剂量施用。在某些方面,il-7蛋白以约750μg/kg与约950μg/kg之间的剂量施用。在另外的方面,il-7蛋白以约700μg/kg与约850μg/kg之间的剂量施用。在一些方面,il-7蛋白以约750μg/kg与约850μg/kg之间的剂量施用。在其他方面,il-7蛋白以约700μg/kg与约800μg/kg之间的剂量施用。在一些方面,il-7蛋白以约800μg/kg与约900μg/kg之间的剂量施用。在
一些方面,il-7蛋白以约750μg/kg与约850μg/kg之间的剂量施用。在某些方面,il-7蛋白以约850μg/kg与约950μg/kg之间的剂量施用。
[0138]
在一些方面,il-7蛋白以约650μg/kg、约680μg/kg、约700μg/kg、约720μg/kg、约740μg/kg、约750μg/kg、约760μg/kg、约780μg/kg、约800μg/kg、约820μg/kg、约840μg/kg、约850μg/kg、约860μg/kg、约880μg/kg、约900μg/kg、约920μg/kg、约940μg/kg、约950μg/kg、约960μg/kg、约980μg/kg、约1,000μg/kg、约1,020μg/kg、约1,020μg/kg、约1,040μg/kg、约1,060μg/kg、约1,080μg/kg、约1,100μg/kg、约1,120μg/kg、约1,140μg/kg、约1,160μg/kg、约1,180μg/kg、约1,200μg/kg、约1,220μg/kg、约1,240μg/kg、约1,260μg/kg、约1,280μg/kg、约1,300μg/kg、约1,320μg/kg、约1,340μg/kg、约1,360μg/kg、约1,380μg/kg、约1,400μg/kg、约1,420μg/kg、约1,440μg/kg、约1,460μg/kg、约1,480μg/kg、约1,500μg/kg、约1,520μg/kg、约1,540μg/kg、约1,560μg/kg、约1,580μg/kg、约1,600μg/kg、约1,620μg/kg、约1,640μg/kg、约1,660μg/kg、约1,680μg/kg、约1,700μg/kg、约1,720μg/kg、约1,740μg/kg、约1,760μg/kg、约1,780μg/kg、约1,800μg/kg、约1,820μg/kg、约1,840μg/kg、约1,860μg/kg、约1,880μg/kg、约1,900μg/kg、约1,920μg/kg、约1,940μg/kg、约1,960μg/kg、约1,980μg/kg或约2,000μg/kg的剂量施用。
[0139]
在一些方面,il-7蛋白以约650μg/kg的剂量施用。在其他方面,本文所公开的il-7蛋白以约680μg/kg的剂量施用。在一些方面,il-7蛋白以约700μg/kg的剂量施用。在一些方面,il-7蛋白以约720μg/kg的剂量施用。在某些方面,il-7蛋白以约740μg/kg的剂量施用。在一些方面,il-7蛋白以约750μg/kg的剂量施用。在一些方面,il-7蛋白以约760μg/kg的剂量施用。在某些方面,il-7蛋白以约780μg/kg的剂量施用。在一些方面,il-7蛋白以约800μg/kg的剂量施用。在另外的方面,il-7蛋白以约820μg/kg的剂量施用。在某些方面,il-7蛋白以约840μg/kg的剂量施用。在一些方面,il-7蛋白以约850μg/kg的剂量施用。在某些方面,il-7蛋白以约860μg/kg的剂量施用。在一些方面,il-7蛋白以约880μg/kg的剂量施用。在一些方面,il-7蛋白以约900μg/kg的剂量施用。在另外的方面,il-7蛋白以约920μg/kg的剂量施用。在一些方面,il-7蛋白以约940μg/kg的剂量施用。在另外的方面,il-7蛋白以约950μg/kg的剂量施用。在一些方面,il-7蛋白以约960μg/kg的剂量施用。在某些方面,il-7蛋白以约980μg/kg的剂量施用。在一些方面,il-7蛋白以约1,000μg/kg的剂量施用。在某些方面,il-7蛋白以约1,020μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,040μg/kg的剂量施用。在一些方面,il-7蛋白以约1,060μg/kg的剂量施用。在其他方面,il-7蛋白以约1,080μg/kg的剂量施用。在一些方面,il-7蛋白以约1,100μg/kg的剂量施用。在某些方面,il-7蛋白以约1,120μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,140μg/kg的剂量施用。在一些方面,il-7蛋白以约1,160μg/kg的剂量施用。在其他方面,il-7蛋白以约1,180μg/kg的剂量施用。在某些方面,il-7蛋白以约1,200μg/kg的剂量施用。在某些方面,il-7蛋白以约1,220μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,240μg/kg的剂量施用。在一些方面,il-7蛋白以约1,260μg/kg的剂量施用。在其他方面,il-7蛋白以约1,280μg/kg的剂量施用。在一些方面,il-7蛋白以约1,300μg/kg的剂量施用。在某些方面,il-7蛋白以约1,320μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,340μg/kg的剂量施用。在一些方面,il-7蛋白以约1,360μg/kg的剂量施用。在其他方面,il-7蛋白以约1,380μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,400μg/kg的剂量施用。在某些方面,il-7蛋白以约1,420μg/kg的
剂量施用。在一些方面,il-7蛋白以约1,440μg/kg的剂量施用。在一些方面,il-7蛋白以约1,460μg/kg的剂量施用。在其他方面,il-7蛋白以约1,480μg/kg的剂量施用。在某些方面,il-7蛋白以约1,500μg/kg的剂量施用。在某些方面,il-7蛋白以约1,520μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,540μg/kg的剂量施用。在一些方面,il-7蛋白以约1,560μg/kg的剂量施用。在其他方面,il-7蛋白以约1,580μg/kg的剂量施用。在一些方面,il-7蛋白以约1,600μg/kg的剂量施用。在某些方面,il-7蛋白以约1,620μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,640μg/kg的剂量施用。在一些方面,il-7蛋白以约1,660μg/kg的剂量施用。在其他方面,il-7蛋白以约1,680μg/kg的剂量施用。在某些方面,il-7蛋白以约1,700μg/kg的剂量施用。在某些方面,il-7蛋白以约1,720μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,740μg/kg的剂量施用。在一些方面,il-7蛋白以约1,760μg/kg的剂量施用。在其他方面,il-7蛋白以约1,780μg/kg的剂量施用。在一些方面,il-7蛋白以约1,800μg/kg的剂量施用。在某些方面,il-7蛋白以约1,820μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,840μg/kg的剂量施用。在一些方面,il-7蛋白以约1,860μg/kg的剂量施用。在其他方面,il-7蛋白以约1,880μg/kg的剂量施用。在一些方面,il-7蛋白以约1,900μg/kg的剂量施用。在某些方面,il-7蛋白以约1,920μg/kg的剂量施用。在另外的方面,il-7蛋白以约1,940μg/kg的剂量施用。在一些方面,il-7蛋白以约1,960μg/kg的剂量施用。在其他方面,il-7蛋白以约1,980μg/kg的剂量施用。在另外的方面,il-7蛋白以约2,000μg/kg的剂量施用。
[0140]
在一些方面,il-7蛋白可以以固定剂量施用。在某些方面,il-7蛋白可以约0.25mg至约9mg的固定剂量施用。在一些方面,il-7蛋白可以以约0.25mg、约1mg、约3mg、约6mg或约9mg的固定剂量施用。
[0141]
在一些方面,本文所公开的il-7蛋白以多剂量(即,重复施用)施用至受试者。在某些实施方案中,向受试者施用il-7蛋白至少两次、至少三次、至少四次、至少五次、至少六次、至少七次、至少八次、至少至少九次或至少十次或更多。在其他实施方案中,受试者接受il-7蛋白的单次施用(例如,在施用免疫检查点抑制剂之前、同时或之后)。
[0142]
在一些方面,il-7蛋白以约每周一次、约两周一次、约三周一次、约四周一次、约五周一次、约六周一次、约七周一次、约八周一次、约九周一次、约10周一次、约11周一次或约12周一次的给药频率施用。在某些方面,il-7蛋白以约每10天一次、约每20天一次、约每30天一次、约每40天一次、约每50天一次、约每60天一次、约每70天一次、约每80天一次、约每90天一次或约每100天一次的给药频率施用。在一些方面,il-7蛋白三周施用一次。在一些方面,il-7蛋白每周施用一次。在一些方面,il-7蛋白两周施用一次。在某些方面,il-7蛋白三周施用一次。在一些方面,il-7蛋白四周施用一次。在某些方面,il-7蛋白六周施用一次。在另外的方面,il-7蛋白八周施用一次。在一些方面,il-7蛋白九周施用一次。在某些方面,il-7蛋白12周施用一次。在一些方面,il-7蛋白每10天施用一次。在某些方面,il-7蛋白每20天施用一次。在其他方面,il-7蛋白每30天施用一次。在一些方面,il-7蛋白每40天施用一次。在某些方面,il-7蛋白每50天施用一次。在一些方面,il-7蛋白每60天施用一次。在另外的方面,il-7蛋白每70天施用一次。在一些方面,il-7蛋白每80天施用一次。在某些方面,il-7蛋白每90天施用一次。在一些方面,il-7蛋白每100天施用一次。
[0143]
在一些方面,il-7蛋白以约720μg/kg的量以约1周、约2周、约3周或约4周的间隔施用两次或更多次。在一些方面,il-7蛋白以约840μg/kg的量以约2周、约3周、约4周或约5周
的间隔施用两次或更多次。在一些方面,il-7蛋白以约960μg/kg的量以约2周、约3周、约4周、约5周或约6周的间隔施用两次或更多次。在一些方面,il-7蛋白以约1200μg/kg的量以约3周、约4周、约5周、约6周、约7周或约8周的间隔施用两次或更多次。在一些方面,il-7蛋白以约1440μg/kg的量以约3周、约4周、约5周、约6周、约7周、约8周、约2个月、约8周、约10周、约12周或约3个月的间隔施用两次或更多次。
[0144]
在一些方面,il-7蛋白以60μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每周一次的给药频率施用。
[0145]
在一些方面,il-7蛋白以60μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以两周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以两周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以两周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以两周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以两周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以两周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以两周一次的给药频率施用。
[0146]
在一些方面,il-7蛋白以60μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/
kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以三周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以三周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以三周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以三周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以三周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以三周一次的给药频率施用。
[0147]
在一些方面,il-7蛋白以60μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以四周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以四周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以四周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以四周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以四周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以四周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以四周一次的给药频率施用。
[0148]
在一些方面,il-7蛋白以60μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以五周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以五周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以五周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以五周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以五周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以五周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以五周一次的给药频率施用。
[0149]
在一些方面,il-7蛋白以60μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以六周
一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以六周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以六周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以六周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以六周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以六周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以六周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以六周一次的给药频率施用。
[0150]
在一些方面,il-7蛋白以60μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以七周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以七周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以七周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以七周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以七周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以七周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以七周一次的给药频率施用。
[0151]
在一些方面,il-7蛋白以60μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以八周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以八周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以八周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以八周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以八周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以八周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以八周一次的给药频率施用。
[0152]
在一些方面,il-7蛋白以60μg/kg的剂量以九周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以九周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以九周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以九周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以九周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以九周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以九周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以三周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以三周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以九周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以三周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以三周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以三周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以九周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以九周一次的给药频率施用。
[0153]
在一些方面,il-7蛋白以60μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以10周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以10周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以10周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以10周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以10周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以10周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以10周一次的给药频率施用。
[0154]
在一些方面,il-7蛋白以60μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以11周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以11周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以11周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以11周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量
以11周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以11周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以11周一次的给药频率施用。
[0155]
在一些方面,il-7蛋白以60μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以12周一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以12周一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以12周一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以12周一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以12周一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以12周一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以12周一次的给药频率施用。
[0156]
在一些方面,il-7蛋白以60μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每10天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每10天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每10天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每10天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每10天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每10天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每10天一次的给药频率施用。
[0157]
在一些方面,il-7蛋白以60μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以1,400μ
g/kg的剂量以每20天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每20天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每20天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每20天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每20天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每20天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每20天一次的给药频率施用。
[0158]
在一些方面,il-7蛋白以60μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每30天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每30天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每30天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每30天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每30天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每30天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每30天一次的给药频率施用。
[0159]
在一些方面,il-7蛋白以60μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每40天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每40天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每40天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每40天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每40天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每40天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每40天一次的给药频率施用。
[0160]
在一些方面,il-7蛋白以60μg/kg的剂量以每50天一次的给药频率施用。在一些方
面,il-7蛋白以120μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每50天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每50天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每50天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每50天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每50天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每50天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每50天一次的给药频率施用。
[0161]
在一些方面,il-7蛋白以60μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每60天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每60天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每60天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每60天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每60天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每60天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每60天一次的给药频率施用。
[0162]
在一些方面,il-7蛋白以60μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每70天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每70天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每70天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每70天一次的给药频率施
用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每70天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每70天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每70天一次的给药频率施用。
[0163]
在一些方面,il-7蛋白以60μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每80天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每80天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每80天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每80天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每80天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每80天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每80天一次的给药频率施用。
[0164]
在一些方面,il-7蛋白以60μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每90天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每90天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每90天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每90天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每90天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每90天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每90天一次的给药频率施用。
[0165]
在一些方面,il-7蛋白以60μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以120μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以240μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以480μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以720μg/kg的剂量以每100天一
次的给药频率施用。在一些方面,il-7蛋白以960μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以1,200μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以1,300μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以1,400μg/kg的剂量以每100天一次的给药频率施用。在其他方面,il-7蛋白以1,420μg/kg的剂量以每100天一次的给药频率施用。在某些方面,il-7蛋白以1,440μg/kg的剂量以每100天一次的给药频率施用。在另外的方面,il-7蛋白以1,460μg/kg的剂量以每100天一次的给药频率施用。在某些方面,il-7蛋白以1,480μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以1,500μg/kg的剂量以每100天一次的给药频率施用。在另外的方面,il-7蛋白以1,600μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以1,700μg/kg的剂量以每100天一次的给药频率施用。在一些方面,il-7蛋白以2,000μg/kg的剂量以每100天一次的给药频率施用。
[0166]
在一些方面,本文所公开的方法(例如,施用il-7蛋白和双特异性抗体的组合)可以与一种或多种另外的抗癌剂和/或免疫调节剂组合使用。此类剂可以包括例如化学疗法药物、小分子药物或刺激对给定癌症的免疫反应的抗体。在一些方面,本文所述的方法与护理标准(例如,手术、放射和化学疗法)组合使用。本文所述的方法还可用作维持疗法,例如,旨在预防肿瘤发生或复发的疗法。
[0167]
在一些方面,本文所公开的用于治疗肿瘤的方法可以包括施用il-7蛋白和双特异性抗体与一种或多种另外的免疫肿瘤剂的组合,使得可以靶向免疫途径的多个元件。非限制性的此类组合包括:增强肿瘤抗原呈递的疗法(例如,树突状细胞疫苗、分泌gm-csf的细胞疫苗、cpg寡核苷酸、咪喹莫特);抑制负免疫调控的疗法,例如,通过抑制ctla-4和/或pd1/pd-l1/pd-l2途径和/或耗尽或阻断treg或其他免疫抑制细胞(例如,骨髓源性抑制细胞);刺激正免疫调控的疗法,例如使用刺激cd-137、ox-40和/或cd40或gitr途径和/或刺激t细胞效应子功能的激动剂;全身性增加抗肿瘤t细胞频率的疗法;耗尽或抑制treg(诸如肿瘤中的treg)的疗法,例如,使用cd25的拮抗剂(例如,达利珠单抗(daclizumab))或通过离体抗cd25珠的耗尽;影响肿瘤中抑制性髓样细胞功能的疗法;增强肿瘤细胞免疫原性的疗法(例如蒽环类药物);过继性t细胞或nk细胞转移,包括基因修饰的细胞,例如由嵌合抗原受体修饰的细胞(car-t疗法);抑制代谢酶(诸如吲哚胺双加氧酶(ido)、双加氧酶、精氨酸酶或一氧化氮合成酶)的疗法;逆转/预防t细胞无能(anergy)或耗竭(exhaustion)的疗法;在肿瘤部位触发先天免疫激活和/或炎症的疗法;施用免疫刺激性细胞因子;或阻断免疫抑制性细胞因子。
[0168]
在一些方面,可以与本公开一起使用的免疫肿瘤剂包括免疫检查点抑制剂(即,阻断通过特定免疫检查点途径的信号传导)。可用于本方法的免疫检查点抑制剂的非限制性实例包括ctla-4拮抗剂(例如,抗ctla-4抗体)、pd-1拮抗剂(例如,抗pd-1抗体、抗pd-l1抗体)、tim-3拮抗剂(例如抗tim-3抗体)或其组合。
[0169]
在一些方面,免疫肿瘤剂包括免疫检查点激活剂(即,促进通过特定免疫检查点途径的信号传导)。在某些方面,免疫检查点激活剂包括ox40激动剂(例如抗ox40抗体)、lag-3激动剂(例如抗lag-3抗体)、4-1bb(cd137)激动剂(例如抗cd137抗体)、gitr激动剂(例如,抗gitr抗体)或其任何组合。
[0170]
在一些方面,il-7蛋白和本文讨论的第二种剂(例如,双特异性抗体)的组合可以
作为单一组合物在药学上可接受的载剂中同时施用。在其他方面,il-7蛋白和本文讨论的第二种剂(例如,双特异性抗体)的组合可以作为分开的组合物同时施用。在另外的方面,il-7蛋白和本文讨论的第二种剂(例如,双特异性抗体)的组合可循序施用。在一些方面,il-7蛋白在施用第二种剂(例如,双特异性抗体)之前施用。在其他方面,il-7蛋白在施用第二种剂(例如,双特异性抗体)之后施用。
[0171]
iiia.可用于本公开的il-7蛋白
[0172]
本文公开了可与双特异性抗体组合使用以治疗癌症(或肿瘤)的il-7蛋白。在一些方面,可用于本发明的用途的il-7蛋白可以是野生型il-7或修饰的il-7(即,非野生型il-7蛋白)(例如,il-7变体、il-7功能片段、il-7衍生物或其任何组合,例如融合蛋白、嵌合蛋白等),只要il-7蛋白含有il-7的一种或多种生物活性,例如能够与il-7r结合,例如诱导早期t细胞发育,促进t细胞稳态即可。参见elkassar和gress.j immunotoxicol.2010年3月;7(1):1
–
7。在一些方面,本公开的il-7蛋白不是野生型il-7蛋白(即,包含一个或多个修饰)。此类修饰的非限制性实例可以包括寡肽和/或半衰期延长部分。参见wo 2016/200219,其以引用的方式整体并入本文。
[0173]
il-7与其受体结合,所述受体由与胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,tslp)(ziegler和liu,2006)共享的两条链il-7rα(cd127),以及il-2、il-15、il-9和il-21的共用γ链(cd132)构成。γc由大多数造血细胞表达,而il-7rα几乎仅在淋巴样细胞上表达。在与其受体结合后,il-7通过两种不同的途径发出信号:分别为负责分化和存活的jak-stat(janus激酶信号转导子和转录激活剂)和pi3k/akt。如在已接受抗il-7中和单克隆抗体(mab)的小鼠(grabstein等人,1993)、il-7-/-小鼠(von freeden-jeffry等人,1995)、il-7rα-/-小鼠(peschon等人,1994;maki等人,1996)、γc-/-小鼠(malissen等人,1997)和jak3-/-小鼠(park等人,1995)中所观察到的,不存在il-7信号传导导致胸腺细胞减少。在不存在il-7信号传导的情况下,小鼠缺乏t细胞、b细胞和nk-t细胞。il-7α-/-小鼠(peschon等人,1994)具有与il-7-/-小鼠(von freeden-jeffry等人,1995)相似但更严重的表型,可能是因为在il-7α-/-小鼠中tslp信号传导也被废除。il-7是γδ细胞(maki等人,1996)和nk-t细胞(boesteanu等人,1997)发育所必需的。
[0174]
在一些方面,可用于本公开的il-7蛋白包含如在seq id no:1至6中任一者中所示的氨基酸序列。在其他方面,il-7蛋白包含与序列seq id no:1至6具有约70%、约75%、约80%、约85%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%或约99%或更高的序列同一性的氨基酸序列。
[0175]
在一些方面,il-7蛋白包括修饰的il-7或其片段,其中修饰的il-7或片段保留野生型il-7的一种或多种生物活性。在一些方面,il-7蛋白可以来源于人、大鼠、小鼠、猴、母牛或绵羊。
[0176]
在一些方面,人il-7可具有由seq id no:1(genbank登录号p13232)表示的氨基酸序列;大鼠il-7可具有由seq id no:2(genbank登录号p56478)表示的氨基酸序列;小鼠il-7可具有由seq id no:3(genbank登录号p10168)表示的氨基酸序列;猴il-7可具有由seq id no:4(genbank登录号np 001279008)表示的氨基酸序列;母牛il-7可具有由seq id no:5(genbank登录号p26895)表示的氨基酸序列;并且绵羊il-7可具有由seq id no:6(genbank登录号q28540)表示的氨基酸序列。
[0177]
在一些方面,可用于本公开的il-7蛋白包括il-7融合蛋白。在某些方面,il-7融合蛋白包含(i)寡肽和(i)il-7或其变体。在一些方面,寡肽连接至il-7或其变体的n末端区域。
[0178]
在一些方面,本文所公开的寡肽由1至10个氨基酸组成。在某些方面,寡肽由至少1个、至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个或10个氨基酸组成。在一些方面,寡肽的一个或多个氨基酸选自由甲硫氨酸、甘氨酸及其组合组成的组。在某些方面,寡肽选自由以下组成的组:甲硫氨酸(m)、甘氨酸(g)、甲硫氨酸-甲硫氨酸(mm)、甘氨酸-甘氨酸(gg)、甲硫氨酸-甘氨酸(mg)、甘氨酸-甲硫氨酸(gm)、甲硫氨酸-甲硫氨酸-甲硫氨酸(mmm)、甲硫氨酸-甲硫氨酸-甘氨酸(mmg)、甲硫氨酸-甘氨酸-甲硫氨酸(mgm)、甘氨酸-甲硫氨酸-甲硫氨酸(gmm)、甲硫氨酸-甘氨酸-甘氨酸(mgg)、甘氨酸-甲硫氨酸-甘氨酸(gmg)、甘氨酸-甘氨酸-甲硫氨酸(ggm)、甘氨酸-甘氨酸-甘氨酸(ggg)、甲硫氨酸-甘氨酸-甘氨酸-甲硫氨酸(mggm)(seq id no:41)、甲硫氨酸-甲硫氨酸-甘氨酸-甘氨酸(mmgg)(seq id no:42)、甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸(ggmm)(seq id no:43)、甲硫氨酸-甘氨酸-甲硫氨酸-甘氨酸(mgmg)(seq id no:44)、甘氨酸-甲硫氨酸-甲硫氨酸-甘氨酸(gmmg)(seq id no:45)、甘氨酸-甘氨酸-甘氨酸-甲硫氨酸(gggm)(seq id no:46)、甲硫氨酸-甘氨酸-甘氨酸-甘氨酸(mggg)(seq id no:47)、甘氨酸-甲硫氨酸-甘氨酸-甘氨酸(gmgg)(seq id no:48)、甘氨酸-甘氨酸-甲硫氨酸-甘氨酸(ggmg)(seq id no:49)、甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸-甲硫氨酸(ggmmm)(seq id no:50)、甘氨酸-甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸(gggmm)(seq id no:51)、甘氨酸-甘氨酸-甘氨酸-甘氨酸-甲硫氨酸(ggggm)(seq id no:52)、甲硫氨酸-甘氨酸-甲硫氨酸-甲硫氨酸-甲硫氨酸(mgmmm)(seq id no:53)、甲硫氨酸-甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸(mggmm)(seq id no:54)、甲硫氨酸-甘氨酸-甘氨酸-甘氨酸-甲硫氨酸(mgggm)(seq id no:55)、甲硫氨酸-甲硫氨酸-甘氨酸-甲硫氨酸-甲硫氨酸(mmgmm)(seq id no:56)、甲硫氨酸-甲硫氨酸-甘氨酸-甘氨酸-甲硫氨酸(mmggm)(seq id no:57)、甲硫氨酸-甲硫氨酸-甘氨酸-甘氨酸-甘氨酸(mmggg)(seq id no:58)、甲硫氨酸-甲硫氨酸-甲硫氨酸-甘氨酸-甲硫氨酸(mmmgm)(seq id no:59)、甲硫氨酸-甘氨酸-甲硫氨酸-甘氨酸-甲硫氨酸(mgmgm)(seq id no:60)、甘氨酸-甲硫氨酸-甘氨酸-甲硫氨酸-甘氨酸(gmgmg)(seq id no:61)、甘氨酸-甲硫氨酸-甲硫氨酸-甲硫氨酸-甘氨酸(gmmmg)(seq id no:62)、甘氨酸-甘氨酸-甲硫氨酸-甘氨酸-甲硫氨酸(ggmgm)(seq id no:63)、甘氨酸-甘氨酸-甲硫氨酸-甲硫氨酸-甘氨酸(ggmmg)(seq id no:64)、甘氨酸-甲硫氨酸-甲硫氨酸-甘氨酸-甲硫氨酸(gmmgm)(seq id no:65)、甲硫氨酸-甘氨酸-甲硫氨酸-甲硫氨酸-甘氨酸(mgmmg)(seq id no:66)、甘氨酸-甲硫氨酸-甘氨酸-甘氨酸-甲硫氨酸(gmggm)(seq id no:67)、甲硫氨酸-甲硫氨酸-甘氨酸-甲硫氨酸-甘氨酸(mmgmg)(seq id no:68)、甘氨酸-甲硫氨酸-甲硫氨酸-甘氨酸-甘氨酸(gmmgg)(seq id no:69)、甘氨酸-甲硫氨酸-甘氨酸-甘氨酸-甘氨酸(gmggg)(seq id no:70)、甘氨酸-甘氨酸-甲硫氨酸-甘氨酸-甘氨酸(ggmgg)(seq id no:71)、甘氨酸-甘氨酸-甘氨酸-甘氨酸-甘氨酸(ggggg)(seq id no:72)或其组合。在一些方面,寡肽是甲硫氨酸-甘氨酸-甲硫氨酸(mgm)。
[0179]
在一些方面,il-7融合蛋白包含(i)il-7或其变体,和(ii)半衰期延长部分。在一些方面,半衰期延长部分延长了il-7或其变体的半衰期。在一些方面,半衰期延长部分连接
至il-7或其变体的c末端区域。
[0180]
在一些方面,il-7融合蛋白包含:(i)il-7(第一结构域);(ii)第二结构域,其包含具有1至10个由甲硫氨酸、甘氨酸或其组合(例如mgm)组成的氨基酸残基的氨基酸序列;以及(iii)包含半衰期延长部分的第三结构域。在一些方面,半衰期延长部分可以连接至第一结构域或第二结构域的n末端或c末端。另外,包含第一结构域和第二结构域的il-7可以连接至第三结构域的两个末端。
[0181]
半衰期延长部分的非限制性实例包括:fc、白蛋白、白蛋白结合多肽、pro/ala/ser(pas)、人绒毛膜促性腺激素β亚基的c末端肽(ctp)、聚乙二醇(peg)、长的非结构化亲水氨基酸序列(xten)、羟乙基淀粉(hes)、白蛋白结合小分子及其组合。
[0182]
在一些方面,半衰期延长部分是fc。在某些方面,fc来自修饰的免疫球蛋白,其中由于与fc受体和/或补体的结合亲和力的改变,抗体依赖性细胞毒性(adcc)或补体依赖性细胞毒性(cdc)减弱。在一些方面,修饰的免疫球蛋白可以选自由igg1、igg2、igg3、igg4、iga1、iga2、igd、ige及其组合组成的组。在一些方面,fc是杂合fc(“hfc”或“hyfc”),其包含铰链区、ch2结构域和ch3结构域。在某些方面,本文所公开的杂合fc的铰链区包含人igd铰链区。在某些方面,杂合fc的ch2结构域包含人igd ch2结构域的一部分和人igg4 ch2结构域的一部分。在某些方面,杂合fc的ch3结构域包含人igg4 ch3结构域的一部分。因此,在一些方面,本文所公开的杂合fc包含铰链区、ch2结构域和ch3结构域,其中铰链区包含人igd铰链区,其中ch2结构域包含人igd ch2结构域的一部分和人igg4 ch2结构域的一部分,并且其中ch3结构域包含人igg4 ch3结构域的一部分。
[0183]
在一些方面,本文所公开的fc可以是fc变体。如本文所用,术语“fc变体”是指通过取代fc区中的一部分氨基酸或通过组合不同种类的fc区而制备的fc。fc区变体可以防止在铰链区被切断。具体地,在一些方面,fc变体包含seq id no:9的第144个氨基酸和/或第145个氨基酸处的修饰。在某些方面,第144个氨基酸(k)和/或第145个氨基酸酸(k)被g或s取代。
[0184]
在一些方面,本文所公开的fc或fc变体可由下式表示:n'-(z1)p-y-z2-z3-z4-c,其中:
[0185]
n'包含n末端;
[0186]
z1包含具有在seq id no:7的位置90至98处的氨基酸残基中的从位置98处的氨基酸残基至n末端的5至9个连续的氨基酸残基的氨基酸序列;
[0187]
y包含具有在seq id no:7的位置99至162处的氨基酸残基中的从位置162处的氨基酸残基至n末端的5至64个连续的氨基酸残基的氨基酸序列;
[0188]
z2包含具有在seq id no:7的位置163至199处的氨基酸残基中的从位置163处的氨基酸残基至c末端的4至37个连续的氨基酸残基的氨基酸序列;
[0189]
z3包含具有在seq id no:8的位置115至220处的氨基酸残基中的从位置220处的氨基酸残基至n末端的71至106个连续的氨基酸残基的氨基酸序列;并且
[0190]
z4包含具有在seq id no:8的位置221至327处的氨基酸残基中的从位置221处的氨基酸残基至c末端的80至107个连续的氨基酸残基的氨基酸序列。
[0191]
在一些方面,本文所公开的fc区可以包括氨基酸序列seq id no:9(hyfc)、seq id no:10(hyfcm1)、seq id no:11(hyfcm2)、seq id no:12(hyfcm3)或seq id no:13
(hyfcm4)。在一些方面,fc区可包含氨基酸序列seq id no:14(非裂解性小鼠fc)。
[0192]
可以与本公开一起使用的fc区的其他非限制性实例描述于美国专利号7,867,491中,所述专利以引用的方式整体并入本文。
[0193]
在一些方面,本文所公开的il-7融合蛋白包含寡肽和半衰期延长部分两者。
[0194]
在一些方面,il-7蛋白可以与白蛋白、其变体或片段融合。il-7-白蛋白融合蛋白的实例可见于国际申请公布号wo 2011/124718 a1。在一些方面,il-7蛋白任选地通过柔性接头与前祖b细胞生长刺激因子(ppbsf)融合。参见us 2002/0058791a1。在其他方面,可用于本公开的il-7蛋白是具有特定三维结构的il-7构象体。参见us 2005/0249701 a1。在一些方面,il-7蛋白可以与ig链融合,其中il-7蛋白中的氨基酸残基70和91被糖基化,il-7蛋白中的氨基酸残基116未被糖基化。参见us 7,323,549 b2。在一些方面,不包含潜在t细胞表位(从而减少抗il-7t细胞反应)的il-7蛋白也可用于本公开。参见us 2006/0141581 a1。在其他方面,在羧基末端螺旋d区具有一个或多个氨基酸残基突变的il-7蛋白可用于本公开。尽管对受体的结合亲和力较低,但il-7突变体仍可充当il-7r部分激动剂。参见us 2005/0054054a1。上文列出的专利或出版物中描述的任何il-7蛋白均以引用的方式整体并入本文。
[0195]
此外,可用于本公开的另外的il-7蛋白的非限制性实例描述于:us 7708985;us 8034327;us 8153114;us 7589179;us 7323549;us 7960514;us 8338575;us 7118754;us 7488482;us 7670607;us 6730512;wo0017362;gb2434578a;wo 2010/020766 a2;wo91/01143;beq等人,blood,第114卷(4),816,2009年7月23日;kang等人,j.virol.doi:10.1128/jvi.02768-15;martin等人,blood,第121卷(22),4484,2013年5月30日;mcbride等人,acta oncologica,34:3,447-451,2009年7月8日;和xu等人,cancer science,109:279-288,2018,所述参考以引用的方式整体并入本文。
[0196]
本公开涉及一种用于治疗有需要的受试者的肿瘤(或癌症)的方法,其包括向受试者施用有效量的白介素-7(il-7)蛋白和有效量的免疫检查点抑制剂的组合。可以与当前方法一起使用的免疫检查点抑制剂的非限制性实例包括抗pd-1抗体、抗pd-l1抗体、抗ctla-4抗体及其组合。
[0197]
在一些方面,本文所公开的寡肽直接连接至il-7或其变体的n末端区域。在其他方面,寡肽通过接头连接至n末端区域。在一些方面,本文所公开的半衰期延长部分直接连接至il-7或其变体的c末端区域。在某些方面,半衰期延长部分通过接头连接至c末端区域。在一些方面,接头是肽接头。在某些方面,肽接头包含由gly和ser残基组成的10至20个氨基酸残基的肽。在一些方面,接头是白蛋白接头。在一些方面,接头是化学键。在某些方面,化学键包括二硫键、二胺键、硫-胺键、羧-胺键、酯键、共价键或其组合。当接头是肽接头时,在一些方面,所述连接可以发生在任何连接区域中。它们可以使用本领域已知的交联剂进行偶联。在一些方面,交联剂的实例可以包括:n-羟基琥珀酰亚胺酯,诸如1,1-双(重氮乙酰基)-2-苯基乙烷、戊二醛和4-叠氮水杨酸;亚胺酸酯,包括二琥珀酰亚胺酯,诸如3,3'-二硫代双(琥珀酰亚胺丙酸酯);以及双官能马来酰亚胺,诸如双-n-马来酰亚胺-1,8-辛烷,但不限于此。
[0198]
在一些方面,本文所公开的il-7融合蛋白的il-7(或其变体)部分包含与在seq id no:15-20中所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至
少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少98%或至少99%同一性的氨基酸序列。在某些方面,本文所公开的il-7融合蛋白的il-7(或其变体)部分包含在seq id no:15-20中所示的氨基酸序列。
[0199]
在一些方面,il-7融合蛋白包含:第一结构域,其包含具有il-7活性或其相似活性的多肽;第二结构域,其包含由甲硫氨酸、甘氨酸或其组合组成的1至10个氨基酸残基的氨基酸序列;以及第三结构域,其是与第一结构域的c末端偶联的修饰的免疫球蛋白的fc区。
[0200]
在一些方面,可与本方法一起使用的il-7融合蛋白包含与在seq id no:21-25中所示的氨基酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少98%或至少99%同一性的氨基酸序列。在某些方面,本公开的il-7融合蛋白包含在seq id no:21-25中所示的氨基酸序列。在另外的方面,本文所公开的il-7融合蛋白包含在seq id no:26和27中所示的氨基酸序列。
[0201]
在一些方面,可用于本公开il-7蛋白在施用至受试者时可以增加受试者的绝对淋巴细胞计数。在某些方面,受试者患有本文所述的疾病或病症(例如,癌症)。在其他方面,受试者是健康个体(例如未患有本文所述的疾病或病症,例如癌症)。在某些方面,与参考(例如,未接受il-7蛋白的受试者的对应水平)相比,绝对淋巴细胞计数增加了至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约100%或更多。
[0202]
在一些方面,本文所公开的il-7蛋白可以增加受试者的t细胞增殖(例如,cd8
t细胞)。在某些方面,t细胞增殖的增加发生在外周(例如,不在肿瘤内)。在某些方面,与参考(例如,未接受il-7蛋白的受试者的对应水平)相比,t细胞增殖增加了至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约100%或更多。在某些方面,响应于il-7施用而增殖的t细胞(例如,cd8
t细胞)表达以下标志物中的一种或多种:脱中胚蛋白(eomesodermin,eomes)、颗粒酶b、cxcr3、ifn-γ或其组合。
[0203]
在一些方面,本公开的il-7蛋白可以增加效应t细胞(例如,细胞毒性cd8
t淋巴细胞)向肿瘤的募集。在某些方面,与参考(例如,未接受il-7蛋白的受试者的对应水平)相比,效应t细胞向肿瘤的募集增加至少约5%、至少约10%、至少约15%、至少约20%、至少约25%、至少约30%、至少约35%、至少约40%、至少约45%、至少约50%、至少约55%、至少约60%、至少约65%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%或至少约100%或更多。
[0204]
在一些方面,本公开的il-7蛋白可以减少受试者的肿瘤中髓源性抑制细胞(mdsc)的数量和/或百分比。在某些方面,与参考(例如,未接受il-7蛋白的受试者的对应水平)相比,肿瘤中mdsc的数量和/或百分比减少至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%或约100%。
[0205]
在一些方面,可与本公开一起使用的il-7蛋白在施用至受试者时可以增加肿瘤中cd8
til与mdsc的比率。在某些方面,与参考(例如,未接受il-7蛋白的受试者的对应水平)
相比,在施用后cd8
til与mdsc的比率增加了至少约5%、至少约10%、至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约100%、至少约125%、至少约150%、至少约200%、至少约250%或至少约300%。
[0206]
iiib.双特异性抗体
[0207]
可与本公开一起使用的双特异性抗体包含第一抗原结合部分和第二抗原结合部分。在一些方面,第一抗原结合部分和第二抗原结合部分中的每一个与抗原上的不同(distinct)(即,不同(different))表位结合。在某些方面,第一抗原结合部分和第二抗原结合部分与单一抗原上的不同表位结合(例如,双特异性抗体与单一蛋白质的两个不同区域结合)。在其他方面,第一抗原结合部分和第二抗原结合部分与在不同抗原上的不同表位结合(例如,双特异性抗体与蛋白a上的表位和蛋白b上的表位结合)。
[0208]
在一些方面,第一和/或第二抗原结合部分能够特异性结合免疫细胞上表达的抗原。如本文所用,术语“免疫细胞”是指在免疫反应中起作用的细胞。在某些方面,免疫细胞包括t淋巴细胞(例如,效应cd4
t细胞或效应cd8
t细胞)、b淋巴细胞、自然杀伤(nk)细胞、单核细胞、巨噬细胞、嗜酸性粒细胞、肥大细胞、嗜碱性粒细胞、粒细胞、树突细胞或其组合。在一些方面,免疫细胞包括肿瘤浸润淋巴细胞(til),诸如cd4 til或cd8 til。
[0209]
在一些方面,免疫细胞上表达的抗原包括免疫细胞上表达的任何分子。此类抗原的非限制性实例包括cd2、cd3、cd4、cd5、cd8、cd11b、cd14、cd16、cd19、cd28、cd32、cd45、cd56、cd64、klrg-1、nkg2d、nkp30、dnam-1或其组合。在某些方面,免疫细胞上表达的抗原是cd3。在某些方面,免疫细胞上表达的抗原是nkg2d。在另外的方面,免疫细胞上表达的抗原是nkp30。在又另外的方面,免疫细胞上表达的抗原是klrg-1。
[0210]
在一些方面,可用于本公开的双特异性抗体的第一和/或第二抗原结合部分能够特异性结合肿瘤抗原。肿瘤抗原的非限制性实例包括鸟苷酸环化酶c(gc-c)、表皮生长因子受体(egfr或erbb-1)、人表皮生长因子受体2(her2或erbb2)、erbb-3、erbb-4、muc-1、黑色素瘤相关硫酸软骨素蛋白聚糖(mcsp)、间皮素(msln)、叶酸受体1(folr1)、cd4、cd19、cd20、cd22、cd30、cd33、cd38、cd44、cd44v6、cd44v7/8、cd70、cd123、cd138、cd171、cea、cspg4、cxcr5、c-met、herv-包膜蛋白、eriostin、bigh3、sparc、bcr、cd79、cd37、egfrviii、egp2、egp40、igfr、l1cam、axl、组织因子(tf)、cd74、epcam、epha2、mrp3钙粘蛋白19(cdh19)、表皮生长因子2(her2)、5t4、8h9、αvβ6整合素、bcma、b7-h3、b7-h6、caix、ca9、fap、fbp、胎儿型achr、frcc、gd2、gd3、磷脂酰肌醇蛋白聚糖-1(gpc1)、磷脂酰肌醇蛋白聚糖-2(gpc2)、磷脂酰肌醇蛋白聚糖-3(gpc3)、hla-a1 mage1、hla-a1 ny-eso-1、il-13rcc2、lewis-y、kdr、mcsp、间皮素、muc1、muc16、ncam、nkg2d配体、ny-eso-1、prame、psc1、psca、psma、ror1、ror2、sp17、surviving、tag72、tem、癌胚抗原、hmw-maa、vegf、cldn18.2或其组合。在一些方面,肿瘤抗原包含鸟苷酸环化酶c(gc-c)。
[0211]
在一些方面,肿瘤抗原包括免疫检查点分子。在某些方面,免疫检查点分子包括pd-1配体(例如,pd-l1或pd-l2)、lag3配体、tim-3配体(例如,半乳凝素9)、ctla-4配体(例如,cd28)、ox40配体、cd28配体(例如,b7h3或b7h4)或其组合。
[0212]
在一些方面,第一抗原结合部分和第二抗原结合部分不靶向相同的抗原。因此,在某些方面,可用于本公开的双特异性抗体包含第一抗原结合部分和第二抗原结合部分,其中(i)第一抗原结合部分特异性结合免疫细胞上表达的抗原,并且第二抗原结合部分特异
性结合肿瘤抗原;或(ii)第一抗原结合部分特异性结合肿瘤抗原,并且第二抗原结合部分特异性结合免疫细胞上表达的抗原。在一些方面,一个抗原结合部分与pd-l1配体(例如pd-l1)结合,而另一个抗原结合部分与cd3结合。在某些方面,可与本公开一起使用的抗pd-l1/cd3双特异性抗体包含在seq id no:73中所示的氨基酸序列。
[0213]
在一些方面,可用于本公开的双特异性抗体可以包括本领域已知的任何双特异性抗体。在某些方面,双特异性抗体包含双可变结构域抗体(dvd-ig),其中每条轻链和重链含有通过短肽键串联的两个可变结构域(wu等人,generation and characterization of a dual variable domain immunoglobulin(dvd-ig
tm
)molecule,antibody engineering,springer berlin heidelberg(2010))。在一些方面,双特异性抗体是化学连接的双特异性(fab')2片段。在某些方面,双特异性抗体包含tandab(即,两个单链双抗体的融合,产生具有针对每个靶抗原的两个结合位点的四价双特异性抗体)。在另外的方面,双特异性抗体是柔性抗体,其是scfv与双抗体的组合,产生多价分子。在更进一步的方面,双特异性抗体包含基于蛋白激酶a中的“二聚化和对接结构域”的“对接和锁定”分子,当应用于fab时,其可产生与不同fab片段连接的两个相同fab片段组成的三价双特异性结合蛋白。在一些方面,双特异性抗体包含“scorpion分子”,其包含例如与人fab臂的两个末端融合的两个scfv。在某些方面,双特异性抗体包含双抗体。
[0214]
在一些方面,双特异性抗体的类别包括但不限于:igg样分子,其具有互补ch3结构域以强制异源二聚化;igg融合分子,其中全长igg抗体与额外的fab片段或fab片段的一部分融合;fc融合分子,其中单链fv分子或稳定的双抗体与重链恒定结构域、fc区或其一部分融合;fab融合分子,其中不同的fab片段融合在一起;重组igg样双重靶向分子,其中分子的两侧各含有至少两种不同抗体的fab片段或fab片段的一部分;基于scfv和双抗体的抗体和重链抗体(例如结构域抗体、纳米抗体),其中不同的单链fv分子、或不同的双抗体、或不同的重链抗体(例如结构域抗体、纳米抗体)彼此融合或与另一种蛋白质或载体分子融合。
[0215]
fab融合双特异性抗体的实例包括但不限于f(ab)2(medarex/amgen)、双重作用(dual-action)或bis-fab(genentech)、对接和锁定(dnl)(immunomedics)、二价双特异性(biotecnol)和fab-fv(ucb-celltech)。
[0216]
基于scfv、基于双抗体的抗体和结构域抗体的实例包括但不限于双特异性t细胞接合剂(bite)(micromet)、串联双抗体(tandab)(affimed)、双亲和重靶向技术(dart)(macrogenics)、单链双抗体(academic)、tcr样抗体(ait,receptorlogics)、人血清白蛋白scfv融合物(merrimack)和(epigen biotech)、双重靶向纳米抗体(ablynx)和双重靶向仅重链域抗体。
[0217]
在一些方面,可用于本公开的双特异性抗体包含具有一个或多个修饰(例如,通过氨基酸取代、缺失和/或插入)的fc区,其中修饰产生抗体的一种或多种功能特性(例如,结合fc受体、释放炎性细胞因子、血清半衰期、补体固定和/或抗原依赖性细胞毒性)。在一些方面,双特异性抗体可以被化学修饰(例如,一个或多个化学部分可以连接至抗体)或被修饰以改变其糖基化,从而改变抗体的一种或多种功能特性。此类修饰的实例是本领域已知的。参见,例如,美国公布号2018/0371086 a1;美国专利号2015/0210763 a1号;和美国专利号9,505,826 b2,所述每个专利都整体并入本文。
[0218]
在一些方面,可与本公开一起使用的双特异性抗体可以连接至治疗剂以形成免疫
缀合物,诸如抗体-药物缀合物(adc)。合适的治疗剂包括抗代谢物、烷化剂、dna小沟结合剂、dna嵌入剂、dna交联剂、组蛋白脱乙酰酶抑制剂、核输出抑制剂、蛋白酶体抑制剂、拓扑异构酶i或ii抑制剂、热休克蛋白抑制剂、酪氨酸激酶抑制剂、抗生素、抗有丝分裂剂或其他抗癌剂。adc可以如美国专利号7,087,600、6,989,452和7,129,261;pct公布号wo 02/096910、wo 07/038658、wo 07/051081、wo 07/059404、wo 08/083312和wo 08/103693;美国专利公布号20060024317、20060004081和20060247295制备,所述每个专利都整体并入本文。可以与双特异性抗体连接的剂的其他实例包括大分子物质,诸如聚合物(例如,聚乙二醇(peg)、用peg修饰的聚乙烯亚胺(pei)(pei-peg)、聚谷氨酸(pga)(n-(2-羟丙基)甲基丙烯酰胺(hpma)共聚物)、透明质酸、放射性物质(例如,
90
y、
131
i、
125
i、
35
s、3h、
121
in、
99
tc)、荧光物质(例如,荧光素和罗丹明)、发光物质(例如鲁米诺)、半抗原、酶(例如葡萄糖氧化酶)、金属螯合物、生物素、抗生物素蛋白和药物。
[0219]
iv.核酸、载体和宿主细胞
[0220]
本文所述的另外的方面涉及编码本文所述治疗剂(例如il-7蛋白)的一种或多种核酸分子。核酸可以存在于完整细胞中,存在于细胞溶解物中或以部分纯化或大致上纯的形式存在。当通过标准技术(包括碱性/sds处理、cscl显带、柱层析、限制性内切酶、琼脂糖凝胶电泳和其他本领域熟知的方法)从其他细胞组分或其他污染物例如其他细胞核酸(例如其他染色体dna,例如,连接至自然界中分离的dna的染色体dna)或蛋白质中纯化出来时,核酸是“分离的”或“呈现为大致上纯的”。参见,f.ausubel等人.编(1987)current protocols in molecular biology,greene publishing and wiley interscience,new york。本文所述的核酸可以是例如dna或rna,并且可以包含或可以不包含内含子序列。在某些方面,核酸是cdna分子。本文所述的核酸可以使用本领域已知的标准分子生物学技术获得。
[0221]
本文所公开的某些核酸分子是编码il-7蛋白的那些核酸分子(例如,本文所公开的)。编码本文所公开的il-7蛋白的示例性核酸序列在seq id no:29-39中示出。
[0222]
在一些方面,本公开提供了一种载体,其包含编码本文所公开的治疗剂(例如,il-7蛋白)的分离的核酸分子。在一些方面,载体可以用于基因疗法。
[0223]
当用作基因疗法时(例如,在人中),编码本文所公开的治疗剂(例如il-7蛋白)的核酸可以以在0.1mg至200mg的范围内的剂量施用。在某些方面,剂量在0.6mg至100mg的范围内。在另外的方面,剂量在1.2mg至50mg的范围内。
[0224]
用于本公开的合适的载体包括表达载体、病毒载体和质粒载体。在一些方面,载体是病毒载体。
[0225]
如本文所用,表达载体是指任何核酸构建体,其含有用于插入的编码序列的转录和翻译所必需的元件,或者对于rna病毒载体而言,被引入到适当的宿主细胞中时,用于复制和翻译所必需的元件。表达载体可以包括质粒、噬菌粒、病毒及其衍生物。
[0226]
如本文所用,病毒载体包括但不限于来自以下病毒的核酸序列:逆转录病毒,诸如莫洛尼(moloney)鼠白血病病毒、哈维(harvey)鼠肉瘤病毒、鼠乳腺肿瘤病毒和劳氏(rous)肉瘤病毒;慢病毒;腺病毒;腺相关病毒;sv40型病毒;多瘤病毒;爱泼斯坦-巴尔(epstein-barr)病毒;乳头状瘤病毒;疱疹病毒;牛痘病毒;脊髓灰质炎病毒;以及rna病毒,诸如逆转录病毒。人们可以容易地使用本领域熟知的其他载体。某些病毒载体基于其中非必需基因
已被感兴趣的基因替换的非致细胞病变真核病毒。非致细胞病变病毒包括逆转录病毒,其生命周期包括将基因组病毒rna逆转录为dna,随后将原病毒整合到宿主细胞dna中。
[0227]
在一些方面,载体来源于腺相关病毒。在其他方面,载体来源于慢病毒。慢病毒载体的实例公开于wo9931251、w09712622、w09817815、w09817816和wo9818934中,所述专利各自以引用的方式整体并入本文。
[0228]
其他载体包括质粒载体。质粒载体已在本领域中广泛描述,并且是本领域技术人员熟知的。参见,例如,sambrook等人,molecular cloning:a laboratory manual,第二版,cold spring harbor laboratory press,1989。在最近几年中,已经发现质粒载体由于其不能在宿主基因组内复制并整合到宿主基因组中而特别有利于在体内将基因递送至细胞。然而,这些具有与宿主细胞相容的启动子的质粒可以从在质粒内可操作地编码的基因表达肽。可从商业供应商处获得的一些常用质粒包括pbr322、puc18、puc19、各种pcdna质粒、prc/cmv、各种pcmv质粒、psv40和pbluescript。特定质粒的另外的实例包括:pcdna3.1,目录号v79020;pcdna3.1/hygro,目录号v87020;pcdna4/myc-his,目录号v86320;和pbudce4.1,目录号v53220,其全部来自invitrogen(carlsbad,ca.)。其他质粒是本领域普通技术人员熟知的。另外,可以使用标准分子生物学技术来定制设计质粒,以去除和/或添加特定dna片段。
[0229]
本公开还涵盖一种用于制备本文所公开的治疗剂(例如il-7蛋白)的方法。在一些方面,这种方法可以包括在细胞中表达治疗剂(例如,il-7蛋白),所述细胞包含编码治疗剂的核酸分子,例如,seq id no:29-39。在例如wo 2016/200219中提供了关于用于制备本文所公开的il-7蛋白的方法的另外的细节,所述专利以引用的方式整体并入本文。本文涵盖包含这些核苷酸序列的宿主细胞。可以使用的宿主细胞的非限制性实例包括永生杂交瘤细胞、ns/0骨髓瘤细胞、293细胞、中国仓鼠卵巢(cho)细胞、hela细胞、人羊水来源的细胞(capt细胞)、cos细胞或其组合。
[0230]
v.药物组合物
[0231]
本文还提供了组合物,其包含在生理上可接受的载剂、赋形剂或稳定剂中的具有所需纯度的一种或多种治疗剂(例如il-7蛋白和/或双特异性抗体)(remington's pharmaceutical sciences(1990)mack publishing co.,easton,pa)。在一些方面,本文所公开的组合物包含il-7蛋白或双特异性抗体。如本文所公开,此类组合物可以组合使用(例如,包含il-7蛋白的第一组合物和包含双特异性抗体的第二组合物)。在其他方面,本文所公开的组合物可包含il-7蛋白和双特异性抗体两者。
[0232]
可接受的载剂、赋形剂或稳定剂在采用的剂量和浓度下对接受者是无毒的,并且包括:缓冲剂,诸如磷酸盐、柠檬酸盐和其他有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如十八烷基二甲基苄基氯化铵;氯化六甲双铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苄醇;对羟基苯甲酸烷基酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇;和间甲酚);低分子量(小于约10个残基)的多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖和其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,诸如edta;糖类,诸如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐抗衡离子,诸如钠离子;金属络合物(例如,zn-蛋白质络合物);和/或非离子型表面活性剂,诸如
或聚乙二醇(peg)。
[0233]
在一些方面,本文所公开的组合物(例如,包含il-7蛋白或免疫检查点抑制剂)包含一种或多种选自以下的另外的组分:增量剂、稳定剂、表面活性剂、缓冲剂或其组合。
[0234]
可用于本公开的缓冲剂可以是用于在添加另一种酸或碱后将溶液的酸度(ph)维持在选定值附近的弱酸或弱碱。合适的缓冲剂可以通过维持组合物的ph控制来最大化药物组合物的稳定性。合适的缓冲剂还可以确保生理相容性或优化溶解度。流变学、粘度和其他特性也可取决于组合物的ph。常见的缓冲剂包括但不限于tris缓冲剂、tris-cl缓冲剂、组氨酸缓冲剂、tae缓冲剂、hepes缓冲剂、tbe缓冲剂、磷酸钠缓冲剂、mes缓冲剂、硫酸铵缓冲剂、磷酸钾缓冲剂、硫氰酸钾缓冲剂、琥珀酸盐缓冲剂、酒石酸盐缓冲剂、dipso缓冲剂、heppso缓冲剂、popso缓冲剂、pipes缓冲剂、pbs缓冲剂、mops缓冲剂、乙酸盐缓冲剂、磷酸盐缓冲剂、二甲胂酸盐缓冲剂、甘氨酸缓冲剂、硫酸盐缓冲剂、咪唑缓冲剂、盐酸胍缓冲剂、磷酸盐-柠檬酸盐缓冲剂、硼酸盐缓冲剂、丙二酸盐缓冲剂、3-甲基吡啶缓冲剂、2-甲基吡啶缓冲剂、4-甲基吡啶缓冲剂、3,5-二甲基吡啶缓冲剂、3,4-二甲基吡啶缓冲剂、2,4-二甲基吡啶缓冲剂、aces、丙二酸二乙酯缓冲剂、n-甲基咪唑缓冲剂、1,2-二甲基咪唑缓冲剂、taps缓冲剂、bis-tris缓冲剂、l-精氨酸缓冲剂、乳酸盐缓冲剂、乙醇酸盐缓冲剂或其组合。
[0235]
在一些方面,本文所公开的组合物还包含增量剂。可以将增量剂添加到药物产品中以增加产品的体积和质量,从而促进其精确计量和处理。可与本公开一起使用的增量剂包括但不限于氯化钠(nacl)、甘露醇、甘氨酸、丙氨酸或其组合。
[0236]
在一些方面,本文所公开的组合物还可包含稳定剂。可与本公开一起使用的稳定剂的非限制性实例包括:蔗糖、海藻糖、棉子糖、精氨酸或其组合。
[0237]
在一些方面,本文所公开的组合物包含表面活性剂。在某些方面,表面活性剂可选自以下:烷基乙氧基化物、壬基酚乙氧基化物、胺乙氧基化物、聚环氧乙烷、聚环氧丙烷、脂肪醇如鲸蜡醇或油醇、椰油酰胺mea、椰油酰胺dea、聚山梨酯、十二烷基二甲胺氧化物或其组合。在一些方面,表面活性剂是聚山梨酯20或聚山梨酯80。
[0238]
在一些方面,可以使用双特异性抗体的相同配方(例如,其将与il-7蛋白组合使用)来配制包含il-7蛋白的组合物。在其他方面,使用不同的配方来配制il-7蛋白和双特异性抗体。
[0239]
在一些方面,本文所公开的il-7蛋白被配制在组合物中,所述组合物包含(a)基础缓冲剂、(b)糖和(c)表面活性剂。在某些方面,基础缓冲剂包含组氨酸-乙酸盐或柠檬酸钠。在一些方面,基础缓冲剂的浓度为约10至约50nm。在一些方面,糖包括蔗糖、海藻糖、右旋糖或其组合。在一些方面,糖以约2.5至约5.0重量/体积%的浓度存在。在另外的方面,表面活性剂选自聚山梨酯、聚氧乙烯烷基醚、聚氧乙烯硬脂酸酯、烷基硫酸盐、聚乙烯基吡啶酮、泊洛沙姆(poloxamer)或其组合。在一些实施方案中,表面活性剂的浓度为约0.05%至约6.0重量/体积%。
[0240]
在一些方面,配制il-7的组合物中还包含氨基酸。在某些实施方案中,氨基酸选自精氨酸、谷氨酸、甘氨酸、组氨酸或其组合。在某些方面,组合物还包含糖醇。糖醇的非限制性实例包括:山梨糖醇、木糖醇、麦芽糖醇、甘露糖醇或其组合。
[0241]
在一些方面,本文所公开的il-7蛋白被配制在组合物中,所述组合物包含以下:(a)柠檬酸钠(例如约20mm),(b)蔗糖(例如约5%),(c)山梨糖醇(例如约1.5%),以及(d)
tween 80(例如约0.05%)。
[0242]
在一些方面,如wo 2017/078385 a1中所述配制本公开的il-7蛋白,所述专利整体并入本文。
[0243]
药物组合物可以被配制用于向受试者的任何施用途径。施用途径的具体实例包括肌肉内、皮下、眼部、静脉内、腹膜内、皮内、眶内、脑内、颅内、脊柱内、心室内、鞘内、脑池内、囊内或瘤内。本文还预期了以皮下、肌肉内或静脉内注射为特征的肠胃外施用。在一些方面,使用相同的施用途径来施用il-7蛋白和双特异性抗体。在其他方面,使用不同的施用途径来施用il-7蛋白和双特异性抗体。在一些方面,双特异性抗体是静脉内或瘤内施用的。在某些方面,双特异性抗体是瘤内施用的。
[0244]
可以制备呈常规形式的注射剂,作为液体溶液或混悬液、适合用于在注射前在液体中溶解或悬浮的固体形式或作为乳剂。注射剂、溶液和乳剂还含有一种或多种赋形剂。合适的赋形剂是例如水、盐水、右旋糖、甘油或乙醇。此外,如果需要,待施用的药物组合物还可以包含微量无毒的辅助物质,诸如润湿剂或乳化剂、ph缓冲剂、稳定剂、溶解增强剂和其他此类剂,例如像乙酸钠、脱水山梨糖醇单月桂酸酯、三乙醇胺油酸酯和环糊精。
[0245]
用于肠胃外制备剂的药学上可接受的载剂包括水性媒介物、非水性媒介物、抗微生物剂、等渗剂、缓冲剂、抗氧化剂、局部麻醉剂、悬浮剂和分散剂、乳化剂、多价螯合剂或螯合剂以及其他药学上可接受的物质。水性媒介物的实例包括氯化钠注射液、林格氏(ringers)注射液、等渗右旋糖注射液、无菌水注射液、葡萄糖和乳酸林格氏注射液。非水性肠胃外媒介物包括植物来源的固定油、棉籽油、玉米油、芝麻油和花生油。可将抑菌或抑真菌浓度的抗微生物剂添加到包装在多剂量容器中的肠胃外制备剂中,所述抗微生物剂包括苯酚或甲酚、汞、苯甲醇、氯丁醇、对羟基苯甲酸甲酯和对羟基苯甲酸丙酯、硫柳汞、苯扎氯铵和苄索氯铵。等渗剂包括氯化钠和右旋糖。缓冲剂包括磷酸盐和柠檬酸盐。抗氧化剂包括硫酸氢钠。局部麻醉剂包括盐酸普鲁卡因。悬浮剂和分散剂包括羧甲基纤维素钠、羟丙基甲基纤维素和聚乙烯吡咯烷酮。乳化剂包括聚山梨酯80(80)。金属离子的多价螯合剂或螯合剂包括edta。药物载剂还包括用于水混溶性媒介物的乙醇、聚乙二醇和丙二醇;以及用于调节ph的氢氧化钠、盐酸、柠檬酸或乳酸。
[0246]
用于肠胃外施用的制备剂包括:准备用于注射的无菌溶液;准备在使用前与溶剂组合的无菌干燥可溶性产品,诸如冻干粉末,包括皮下注射片剂;准备用于注射的无菌混悬液;准备在使用前与媒介物组合的无菌干燥不溶性产品;以及无菌乳剂。溶液可以是水性的或非水性的。
[0247]
如果静脉内施用,则合适的载剂包括生理盐水或磷酸盐缓冲盐水(pbs)以及含有增稠剂和增溶剂(诸如葡萄糖、聚乙二醇和聚丙二醇及其混合物)的溶液。
[0248]
如用于局部和全身施用所述来制备包含抗体的外用混合物。所得混合物可以是溶液、悬浮液、乳液等,并且可以配制成霜剂、凝胶、软膏、乳剂、溶液、酏剂、洗剂、混悬液、酊剂、糊剂、泡沫剂、气雾剂、冲洗剂、喷雾剂、栓剂、绷带、皮肤贴剂或适用于外用施用的任何其他制剂。
[0249]
本文所述的治疗剂(例如,il-7蛋白或双特异性抗体)可以配制成气雾剂,以用于外用应用,诸如通过吸入(参见,例如,美国专利号4,044,126、4,414,209和4,364,923,所述专利描述了用于递送可用于治疗炎性疾病(特别是哮喘)的类固醇的气雾剂)。这些用于施
用至呼吸道的制剂可以呈用于雾化器的气雾剂或溶液形式,或者作为单独或与惰性载剂(诸如乳糖)组合的用于吹入的微细粉末。在这种情况下,制剂的颗粒的直径在一方面将小于50微米,在一方面小于10微米。
[0250]
本文所公开的治疗剂(例如,il-7蛋白或双特异性抗体)可以被配制用于局部或外用应用,诸如以凝胶、霜剂和洗剂的形式外用应用至皮肤和粘膜(诸如眼),以及用于应用至眼或用于脑池内或脊柱内应用。外用施用预期用于透皮递送,并且还用于施用至眼或粘膜,或用于吸入疗法。还可以单独或与其他药学上可接受的赋形剂组合施用抗体的鼻溶液。
[0251]
包括离子电渗和电泳装置的透皮贴剂是本领域技术人员熟知的,并且可用于施用抗体。例如,此类贴剂公开于美国专利号6,267,983、6,261,595、6,256,533、6,167,301、6,024,975、6,010715、5,985,317、5,983,134、5,948,433和5,860,957中,所述专利各自以引用的方式整体并入本文。
[0252]
在某些方面,包含本文所述的治疗剂(例如,il-7蛋白或双特异性抗体)的药物组合物是冻干粉末,所述冻干粉末可被复原以用于作为溶液、乳剂和其他混合物施用。其还可以被复原并配制成固体或凝胶。通过将本文所述的抗体或其抗原结合部分或其药学上可接受的衍生物溶解在合适的溶剂中来制备冻干粉末。在一些方面,冻干粉末是无菌的。溶剂可含有赋形剂,所述赋形剂改善粉末或由粉末制备的复原溶液的稳定性或其他药理组分。可以使用的赋形剂包括但不限于右旋糖、山梨糖醇、果糖、玉米糖浆、木糖醇、甘油、葡萄糖、蔗糖或其他合适的剂。溶剂还可含有缓冲剂,诸如柠檬酸盐、磷酸钠或磷酸钾或本领域技术人员已知的其他此类缓冲剂,在一方面,为约中性ph。随后对溶液进行无菌过滤,然后在本领域技术人员已知的标准条件下冻干,从而提供所需的制剂。在一些方面,可以将所得溶液分配到小瓶中用于冻干。每个小瓶可以包含单剂量或多剂量的化合物。冻干粉末可以在适当的条件下储存,诸如在约4℃至室温下储存。
[0253]
用注射用水复原此冻干粉末提供用于肠胃外施用的制剂。为了复原,将冻干粉末添加到无菌水或其他合适的载剂中。精确的量取决于所选的化合物。此类量可以凭经验确定。
[0254]
还可以将本文提供的组合物配制为靶向待治疗受试者的特定组织、受体或身体的其他区域。许多此类靶向方法是本领域技术人员熟知的。本文预期了用于本发明组合物的所有此类靶向方法。对于靶向方法的非限制性实例,参见,例如,美国专利号6,316,652、6,274,552、6,271,359、6,253,872、6,139,865、6,131,570、6,120,751、6,071,495、6,060,082、6,048,736、6,039,975、6,004,534、5,985,307、5,972,366、5,900,252、5,840,674、5,759,542和5,709,874。在一个具体方面,本文所述的抗fam19a5抗体或其抗原结合部分可用于治疗纤维化和/或与纤维化相关的疾病或病状。
[0255]
待用于体内施用的组合物可以是无菌的。这易于通过例如无菌过滤膜的过滤来实现。
[0256]
以下实施例仅是说明性的,并且不应解释为以任何方式限制本公开的范围,因为在阅读本公开后,许多改变和等效物对于本领域技术人员而言将变得清楚。
[0257]
实施例
[0258]
实施例1:抗pd-l1/cd3双特异性t细胞接合剂(bsab)的抗肿瘤作用分析
[0259]
为了评估抗pd-l1/cd3双特异性t细胞接合剂(“bsab”)抗体(seq id no:73)的抗
肿瘤作用,使用了结肠腺癌小鼠模型。简而言之,将mc-38结肠腺癌肿瘤细胞(1x105,皮下)移植到c57bl/6小鼠中。在肿瘤接种后第5天检测到可触知的肿瘤。在肿瘤接种后第5天,每天向动物静脉内施用磷酸盐缓冲盐水(“pbs”)(对照组)或0.2μgbsab、1.0μg bsab或5.0μg bsab,持续5天。参见图1a。在最后一次治疗后定期测量肿瘤体积和体重。测量体重作为抗体体内毒性的标志物。图1a提供了给药时间表的图形描述,并且表1(下文)提供了不同的治疗组。
[0260]
表1.治疗组
[0261]
组施用剂量动物数量磷酸盐缓冲盐水(对照) 5抗pd-l1/cd3 bsab每天0.2μg,持续5天5抗pd-l1/cd3 bsab每天1.0μg,持续5天5抗pd-l1/cd3 bsab每天5.0μg,持续5天4
[0262]
如图1b中所示,与在1.0μg bsab和5.0μg bsab治疗组中的动物相比,对照组和每天用0.2μg bsab治疗持续5天的动物的肿瘤体积显著增加。对照组和0.2μg bsab治疗组动物的肿瘤体积增加到约1300mm3。相比之下,1.0μg bsab和5.0μg bsab治疗组动物的肿瘤体积显著减小,这表明0.2μg剂量的bsab对治疗肿瘤无效。在1.0μg bsab与5.0μg bsab之间,肿瘤体积似乎没有显著差异。
[0263]
与缺乏抗肿瘤功效相一致,0.2μg bsab治疗组在治疗后表现出最小的体重减轻。参见图1c。在1.0μg bsab和5.0μg bsab治疗组中,治疗后不久体重显著减轻,但动物最终回到正常体重。然而,在5.0μg bsab治疗组中,体重的减轻要大得多,并且动物需要更长的时间来回到正常体重。此结果表明,过高剂量的bsab可能具有毒性,而治疗效果的增加却很小。
[0264]
接下来,为了确认抗pd-l1/cd3 bsab能够靶向肿瘤细胞上表达的pd-l1,从pd-l1敲除的小鼠分离出脾细胞(包括cd8 t细胞)并将其与mc-38野生型(“mc-38
wt”;表达pd-l1,参见图1d)或pd-l1耗尽的(“mc-38
δpd-l1”)肿瘤细胞一起在存在不同浓度的bsab(即,0ng、0.1ng、1ng、10ng、100ng或1000ng)的情况下共培养48小时。然后,评估细胞毒性和cd8 t细胞的激活。
[0265]
如图1e中所示,在存在bsab(例如,从约1-10ng开始)的情况下,cd8 t细胞能够特异性靶向野生型mc-38肿瘤细胞。作为支持,在存在bsab的情况下与野生型mc-38肿瘤细胞一起培养的cd8 t细胞也具有活化的表型(如由cd69和cd25表达增加所证明)(参见图1f)。
[0266]
总体而言,本实施例中提供的结果表明了本文所述的抗pd-l1/cd3 bsab的抗肿瘤作用。
[0267]
实施例2:抗pd-l1/cd3 bsab和il-7蛋白组合疗法的抗肿瘤作用分析
[0268]
为了评估本文所公开的il-7蛋白是否可以改善抗pd-l1/cd3bsab的抗肿瘤作用,将mc-38结肠腺癌肿瘤细胞(1x105,皮下)再次移植到c57bl/6小鼠中。在肿瘤接种后第7天检测到可触知的肿瘤。在肿瘤接种后第7天,动物皮下接受单剂量(1.25mpk)修饰的il-7蛋白(例如,本文所公开的)或单独的缓冲剂。三天后(肿瘤接种后第10天),动物每天用不同剂量的bsab或pbs静脉内治疗,持续五天。不同的治疗组在表2(下文)中示出。在最后一次治疗后,在大约十三天的过程中监测动物,并且测量动物的肿瘤体积和体重。
[0269]
表2.组合疗法治疗组
[0270][0271]
与前面的实施例一致,单独用1μg bsab治疗的动物的肿瘤体积减小,并且体重适度减轻,最终回到正常。参见图2b和图2c。出人意料的是,用0.2μg bsab(当单独施用时,其显示不具有抗肿瘤作用)与修饰的il-7蛋白组合治疗的动物表现出显著的抗肿瘤作用(图2b),体重减轻最小(图2c)。与单独用1μg bsab治疗的组相比,用0.2μgbsab和il-7蛋白的组合治疗的动物不仅抗肿瘤作用适度改善,而且更重要的是体重减轻明显更少。在用0.2μg bsab和il-7蛋白治疗的动物中观察到毒性最小的最有利的抗肿瘤作用。
[0272]
为了进一步评估以上作用,mc-38肿瘤动物如图3a中所示用以下中的一种治疗:(i)无治疗;(ii)单独il-7蛋白(皮下);(iii)单独bsab(0.2μg;静脉内);以及(iv)il-7蛋白(皮下)与bsab(0.2μg;静脉内)的组合。在肿瘤接种后第5天,向相关动物施用单剂量的il-7蛋白(1.25mpk)。在肿瘤接种后第8、9、10和11天向相关动物施用bsab,总计施用四次(每次施用=0.2μg)。然后,在肿瘤接种后第12天处死动物,并评估不同t细胞群的频率和表型特征。
[0273]
如图3b至图3f中所示,与未接受治疗或单独用bsab治疗的动物相比,用il-7和bsab的组合治疗的动物表现出肿瘤中的cd8 t细胞(包括旁观者cd8 t细胞)的频率增加。来自组合组的动物的foxp3 调节性cd4 t细胞的数量似乎也减少(参见图3b至图3d)。除了频率增加外,用il-7和bsab两者治疗的动物肿瘤中的cd8 t细胞(以及旁观者cd8 t细胞)也主要是pd-1-并且具有更高的颗粒酶b表达(参见图3e和图3f),说明它们的效应子表型改善。此外,旁观者cd8 t细胞的激活表明观察到的抗肿瘤反应可能部分是由旁观者cd8 t细胞的靶向激活介导的。
[0274]
以上结果表明本文所公开的il-7蛋白可以极大地改善全身施用的双特异性抗体诸如bsab的抗肿瘤作用,同时引起最小的毒性。
[0275]
实施例3:瘤内施用之后抗pd-l1/cd3 bsab和il-7蛋白组合疗法的抗肿瘤作用
[0276]
为了评估施用途径是否可能对pd-l1/cd3 bsab和il-7蛋白组合治疗的抗肿瘤作用产生影响,再次使用结肠腺癌小鼠模型。简而言之,如以上在实施例1和实施例2中所述,将mc-38结肠腺癌细胞移植到小鼠体内。一旦确认了可触知的肿瘤(肿瘤直径在5mm-7mm之间和/或肿瘤体积约为100
±
30mm3)(即,在肿瘤接种后第12天左右),动物接受单独的缓冲
剂或修饰的il-7蛋白(例如,本文所公开的)的单次皮下施用。三天后,动物每天接受不同剂量的抗pd-l1/cd3bsab瘤内注射,持续五天。在最后一次施用后,测量动物的肿瘤体积和体重。图4a提供了给药时间表的图形描述,并且表3(下文)提供了不同的治疗组。
[0277]
表3.组合疗法治疗组
[0278][0279][0280]
与实施例1和实施例2(其中bsab静脉内施用至动物)中观察到的结果相反,与对照动物(例如,单独接受il-7蛋白的动物,参见图4b)相比,单独接受瘤内施用1μg bsab的动物并没有表现出肿瘤体积减小。对于单独瘤内施用bsab,要观察到抗肿瘤作用,需要更高剂量的bsab(例如,5μg)(参见图5a至图5c)。然而,当与il-7蛋白组合施用时,用1μg bsab治疗的动物的肿瘤体积显著减小,表现出组合治疗的协同作用。至于体重,在任何治疗组中都没有观察到明显的减轻,这表明bsab的瘤内施用没有全身毒性(参见图4c)。以上结果表明,本文所公开的il-7蛋白可以极大地改善双特异性抗体诸如bsab的抗肿瘤作用,通过瘤内施用没有毒性。
[0281]
总体而言,上述结果表明本文所述的组合治疗(il-7蛋白和双特异性抗体的组合)可能是癌症免疫疗法的有希望的策略。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。