使用生物标志物以评估组合物在减少癌症治疗剂对皮肤的影响方面的功效
1.本专利申请要求2019年12月19日提交的美国临时申请序列号62/950,624的优先权,该申请的内容据此全文以引用方式并入本文。
技术领域
2.本发明涉及评估癌症治疗剂产生皮肤相关的副作用的可能性的方法。本发明还涉及用于评估组合物在减少癌症治疗剂对皮肤的影响方面的功效的方法。
背景技术:
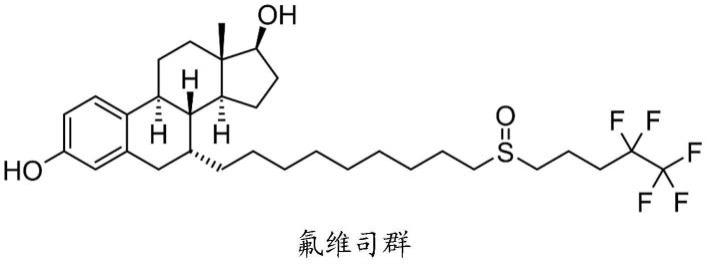
3.阿法替尼是设计用于克服用第一代药物治疗后的抗性的第二代egfri,其经开发用于不可逆地抑制egfr和her2信号通路(li等人,2008)。参见下文的结构。
4.阿法替尼
[0005][0006]
egfr/her2的选择性双重抑制剂
[0007]
即使在很大程度上了解药物诱导的egfr抑制的机制,但对导致cadr出现的机制尚不清楚。
[0008]
分化的角质细胞存活的候选途径是组合磷脂酰肌醇3-激酶(pi3k)(具有脂质激酶活性的细胞内信号转导子(whitman等人,1988))和下游丝氨酸-苏氨酸激酶akt效应子的信号通路。pi3k/akt复合物通过控制抗凋亡机制引发涉及细胞生长、增殖、分化和细胞存活的多种细胞应答(calautti等人,2005;vivanco和sawyers,2002)。pi3k/akt通路的下游调节由若干蛋白质介导,包括肿瘤抑制磷酸酶和张力蛋白同源物(pten)(ali等人,2018)和caspase3(等人,1998),它们驱动角质细胞分化和最终的角质化,而不是驱动它们的凋亡(lippens等人,2005)。其他蛋白质,包括细胞周期蛋白依赖性激酶(cdk)抑制剂p21cip1/waf1,延缓细胞生长并促进分化(missero等人,1996)。
[0009]
维生素d3(vd3)或胆钙化醇是通常被忽略的因素,尽管其在表皮发育中起到关键作用。vd3是经由7-脱氢胆固醇的合成(这导致其前体(前vd3)的形成)通过uvb诱导的光解在角质细胞中合成的开环甾类激素。然后通过细胞色素p450(cyp),并且更具体地,cyp2r1和cyp27a1,将后者酶促羟基化成钙二醇。值得注意的是,前vd3对cyp2r1的调节很差,这与cyp27a1相反,cyp27a1被前vd3高度活化(cheng等人,2004;mehlig等人,2015)。vd3对肌肉、骨骼和免疫生理具有公认的影响,并且能够促进细胞凋亡和上皮分化(shaurova等人,2020)。cyp27a1还通过经典途径和酸性途径参与胆汁酸中胆固醇的降解(norlin等人,2003)。
[0010]
极化免疫应答(涉及th1/th2平衡)的发展由cd4 th细胞亚群和它们的细胞因子产物的活性来协调。th2相关细胞因子,包括白介素(il)4、il5和il13,通过抵消th1介导的微生物作用,经由嗜酸性反应产生ige(howell等人,2008)。皮肤中的变应性炎症导致特应性皮炎(ad),这是一种特征在于局部病变的强烈瘙痒、干燥和红斑的慢性疾病(bieber,2008)。th2细胞因子表达有助于减少s100蛋白的表达,该s100蛋白参与通过与各种靶蛋白的相互作用来调节增殖、分化、凋亡、ca2 稳态、能量代谢、炎症和迁移/侵袭,各种靶蛋白包括酶、细胞骨架亚基、受体、转录因子和核酸(howell等人,2008)。
[0011]
先前报道了egfri促进角质细胞分化并减少增殖(joly-tonetti等人,2020)。然而,仍不清楚与cadr相关的分子机制,cadr包括皮肤皮疹或更严重的反应,例如手足综合征或史提芬强生症候群(steven johnson syndrome,sjs)。阿法替尼是第二代egfri药物,其通过减少表皮厚度、减少角质细胞增殖并增加分化标志物如丝聚蛋白、内披蛋白和桥粒芯糖蛋白-1的表达,损害皮肤屏障结构(joly-tonetti等人,2020)。
技术实现要素:
[0012]
对暴露于治疗学上相关浓度的阿法替尼的重建人表皮(reconstructed human epidermis,rhe)组织进行磷酸化-蛋白质组学和转录物组学测定,以揭示与cadr相关的分子特征。
[0013]
在药物暴露之后,观察到与基因家族的表达增加相关的pi3k/akt通路的激活参与角质细胞分化、衰老、氧化应激和表皮免疫相关标志物的变化。
[0014]
结果表明,阿法替尼可干扰维生素d3(vd3)代谢,经由cyp27a1和cyp24a1作用以调节通过pi3k/akt通路的钙浓度。因此,基底层角质细胞从促增殖程序到促分化程序的转换的特征在于与角质化、角化、th2应答增加以及先天免疫降低相关的生物标志物的上调。此类效应可以增加对刺激物和病原体的皮肤渗透的皮肤敏感性。
[0015]
综上所述,这些发现证明了egfri诱导的cadr的分子机制。这些途径提供新的生物标志物以评估组合物在减少疗法(包括癌症疗法)的不良反应方面的功效。
附图说明
[0016]
图1:示出与对照相比,在暴露于阿法替尼后rhe角质细胞中的功能微扰。
[0017]
考虑了时间与处理之间的相互作用的广义线性模型(在100nm下的阿法替尼与对照相比较)。
[0018]
(a)描绘对磷酸化阵列执行的蛋白质差异分析的结果的火山图。使用1.2-倍变化的临界值,识别出它们的磷酸化状态发生变化的62种蛋白质,包括磷酸化状态显著增加的44种蛋白质(绿色)和磷酸化状态显著减少的18种蛋白质(红色)。以时间依赖性方式,在暴露于阿法替尼20分钟后,6种蛋白质的磷酸化状态增加并且3种蛋白质的磷酸化状态减少。在24小时时,观察到18种蛋白质的磷酸化状态增加并且23种蛋白质的磷酸化状态减少。在72小时时,6种蛋白质的磷酸化状态减少并且6种其他蛋白质的磷酸化状态增加。
[0019]
(b)描绘对基因表达执行的差异分析的结果的火山图(临界值:50%)。在6小时时,170个基因的表达减少,并且201个基因的表达增加。在24小时时,335个基因是下调的并且281个基因是上调的。在72小时时,2888个基因的基因表达增加,并且1728个基因的基因表
达减少。
[0020]
(c)集合富集分析在暴露于阿法替尼后24小时时识别出pi3k-akt通路的显著富集。磷酸化状态增加的蛋白质显示为绿色,并且磷酸化状态减少的蛋白质显示为红色。
[0021]
(d)与细胞衰老相关的途径,涉及伴随表型改变的不可逆生长停滞,显示出基于蛋白质磷酸化状态改变的显著富集。衰老途径在pi3k/akt途径的下游。
[0022]
图2:聚类揭示了阿法替尼对角质细胞分化、氧化应激和先天免疫应答的功能影响。
[0023]
(a)热图和(b)是描绘基于时间进程期间的磷酸化状态的k-均值聚类的结果的箱图。热图中的数据表示为行z-分数。在箱图中,中心线描绘中值,箱的下边缘和上边缘对应于第一四分位数和第三四分位数。上须从箱边缘延伸到距边缘最多1.5
×
四分位数范围(iqr)的最大值,而下须从箱边缘延伸到在边缘1.5
×
iqr处的最小值。
[0024]
(c)热图和(d)箱图描绘基于时间进程期间的基因表达的k-均值聚类的结果。考虑处理和对照的对比,将基因分为6个簇以对基因表达进行分类。热图中的数据表示为行z-分数。在箱图中,中心线描绘中值,箱的下边缘和上边缘对应于第一四分位数和第三四分位数。上须从箱边缘延伸到距边缘最多1.5
×
四分位数范围(iqr)的最大值,而下须从箱边缘延伸到在边缘1.5
×
iqr处的最小值。
[0025]
图3:基于kegg的过表达分析证实阿法替尼对角质细胞分化、氧化应激和先天免疫应答的功能影响。
[0026]
功能过表达图描绘了与每个磷酸化(a)和转录组(b)簇相关的kegg基因集。基于超几何分布,根据fdr校正的p值对点进行颜色编码。大小与属于该簇的基因集中的基因百分比成比例
[0027]
图4:egfr信号通路及其依赖性。阿法替尼抑制egfr,但激活pi3k/akt通路。
[0028]
egfr通路的激活触发3种不同的通路:pi3k/akt、ras/raf/erk和stat。在对rhe角质细胞进行阿法替尼处理时,可替代地增加pi3k/akt通路。因此,pi3k/akt通路下游的参与增殖、存活和衰老的基因受到影响,导致皮肤屏障功能受损。
具体实施方式
[0029]
这些示例显示rhe角质细胞中的蛋白质磷酸化状态和基因表达在暴露于egfri后发生动态改变。
[0030]
使用磷酸化抗体微阵列鉴定在暴露于100nm阿法替尼20分钟、24小时和72小时后来自rhe组织的蛋白质的磷酸化状态的差异。在该测定中,筛选了1318种蛋白质,包括615种磷酸蛋白,并在每个时间点记录它们的磷酸化状态的变化(补充表s1)。总共62个磷酸蛋白的磷酸化状态改变超过20%(图1a)。在暴露于阿法替尼20分钟、24小时和72小时后,与对照相比,显示磷酸化增加的蛋白质的数量分别为6个、18个和6个,并且与对照相比,显示磷酸化减少的蛋白质的数量分别为3个、23个和6个。
[0031]
取决于它们的磷酸化状态的变化水平和检测事件的时间点,进行无监督聚类以将蛋白质归类成簇(c)。这种聚类允许更精确地确定富集的生物功能、相互作用或途径。在定义最佳数量的簇之后,将蛋白质分成两个簇,第一簇(c1)表示在24小时时磷酸化水平降低的蛋白质,并且第二簇(c2)表示在24小时时磷酸化水平提高的那些蛋白质(图2a和图2b)。
[0032]
通过筛选36,000个基因和非编码长rna(lncrna)的表达来评估用阿法替尼处理的rhe角质细胞的转录组分析(补充表s2)。倍数变化表达中50%的临界值表明在不同时间点的2,182个基因的失调。在暴露于100nm阿法替尼6小时后,与对照相比,170个基因是下调的,并且201个基因是上调的。在暴露24小时后,335个基因的表达减少,并且281个基因的表达增加。在暴露72小时后,2,888个基因的表达减少,并且1,728个基因的表达增加(图1b)。
[0033]
对转录组数据进行无监督聚类,以将基因归类为簇,这取决于在暴露于阿法替尼后它们的表达水平的变化和检测事件发生的时间点。在定义最佳数量的簇之后,数据如下分组(图2c和图2d):
[0034]
c1,表示早期(20分钟)的下调基因,它们在所有三个测试时间点保持它们的状态;c2,表示早期(20分钟)的上调基因,它们在所有三个时间点保持它们的状态;c3,表示在24小时时瞬时上调的基因;c4,表示在24小时时瞬时上调的基因,与c3相比具有更高的上调幅度;c5,表示早期上调,随后在72小时时下调的基因,以及c6,表示在24小时时下调,随后在72小时时上调的基因。
[0035]
蛋白质磷酸化阵列分析证明了pi3k/akt通路的激活对细胞衰老有影响
[0036]
基于磷酸化状态的改变,集合富集分析(set enrichment analysis,sea)识别pi3k/akt通路作为主要富集途径(图1c),并且更具体地作为衰老途径(图1d)。在pi3k的上游,磷酸化增加的蛋白质包括rac1和fak。在pi3k的下游,p21(cdkn1)参与细胞周期进程、bad参与细胞凋亡,p53参与细胞存活。磷酸化减少的蛋白质主要是抑制剂,诸如ten、gsk3和bcl2,并且因此促进此途径的激活。有趣的是,pi3k/akt通路下游的多个重要调节蛋白通过激活foxo3、细胞周期蛋白基因家族(cycb、cycd、cyce),而且还激活mtor通路以及4ebp1的去磷酸来参与细胞衰老。功能过表达测试显示与akt磷酸化相关的蛋白质活性增加(图3a)。
[0037]
转录组学测定结果证实了pi3k/akt通路的激活,如通过与该通路相关的基因上调所指示的(c6,图3b)。
[0038]
基因表达阵列分析突出显示cyp作为角质细胞分化的潜在氧化应激诱导剂
[0039]
蛋白质磷酸化和基因表达阵列均表明,参与细胞应激、氧化应激和衰老的基因家族在暴露于阿法替尼后受到影响(图3)。例如,由于激活了pi3k/akt通路,foxo3磷酸化减少。foxo3转录因子影响细胞调节细胞凋亡和程序性细胞死亡的能力。
[0040]
阿法替尼动态地影响与氧化应激相关的基因表达。大量金属硫蛋白(mt1e、mt1l、mt1hl1、mt1x、mt1b、mt1a)在24小时时减少并在72小时时增加(图3b)。参与呼吸道电子传递和线粒体翻译终止的基因家族在24小时时瞬时上调(图3b)。更具体地,减少抗氧化酶prdx2和prdx3的表达,并在72小时时增加sirt4的表达(补充表s2)。值得注意的是,与氧化应激相关的脂肪酸代谢有关的基因首先在24小时时上调,然后在72小时时下调(图3b)。
[0041]
令人感兴趣的是,还鉴别出在24小时时和72小时时cyp表达的变化。cyp的表达增加(lnc-cyp24a1-1、cyp27a1、cyp4f12)并且其他cyp的表达减少(cyp4b1、cyp3a7、cyp3a5、cyp2j2、cyp4a11、cyp1a1、cyp4f22)(补充表s2)。cyp27a1表达可以与涉及簇c1中胆固醇生物合成和脂肪酸代谢的转录组数据相关。
[0042]
除了氧化应激相关的基因之外,功能过表达测试(图3)显示角质化和角化途径的富集,其与krt2、krt9、krt13、krt15和晚期角化包膜(late cornified envelop,lce)基因(lce2a、lce1b、lce2b、lce1c、lce2d)在24小时时的表达增加相关。
[0043]
暴露于阿法替尼干扰先天免疫标志物的表达并促进了与th2应答有关的细胞因子的产生
[0044]
pi3k/akt通路直接影响先天免疫和适应性表皮免疫。转录组数据的分析显示,参与先天免疫的基因受到负面调节(补充表s2),包括与s100家族(s100a2、s100a6、s100a7、s100a8、s100a9、s100a10、s100a12)、富含脯氨酸的小蛋白2b(sprr2b)和β-防御素b1(defb1)相关的基因(图3a)。
[0045]
与th2应答相关的基因家族受到影响,如通过与il4和il13信号传导相关的基因的过表达所证明的(c2)。有趣的是,这些结果显示在pi3k激活后的结果的动力学,其涉及在24小时时首先激活tcr信号传导,随后在72小时时th2极化。
[0046]
另一方面,与th1应答相关的炎症途径几乎不会被激活。转录组数据不显示与炎症相关的基因表达的任何增加。蛋白质磷酸化测定和基因表达阵列显示经由tlr、nlr和il1家族的炎症小体应答减少。
[0047]
讨论
[0048]
用小分子egfri治疗的患者的大多数临床报告的皮肤症状包括皮疹(63%的患者)、干燥(30%)和肉芽肿(30%)。在阿法替尼治疗的患者中,除了较频繁的出现肉芽肿之外,尚未报道cadr症状与特定egfri之间有关联(annunziata等人,2019)。这些数据在cadr研究中加强了阿法替尼作为综合模型药物的针对性。
[0049]
除了小分子治疗之外,还存在靶向egfr的细胞外部分的免疫疗法。尽管单克隆抗体(mab)已经显示出更少的脱靶效应,但是它们仍然可能诱发严重的皮疹(tischer等人,2017),严重的皮疹通常与免疫系统组分的激活有关。通过关注肿瘤学疗法对表皮生理学的直接影响及其对皮肤屏障功能的影响后果,在我们的模型中有意地消除与经激活的免疫系统有关的影响。
[0050]
此外,为了更好地关注阿法替尼的作用,除了其已知用作egfri之外,外源egf不包括在溶媒中。与阿法替尼相关的egf的存在将突出显示egfr下游的药物结果。
[0051]
维持角质细胞的增殖表型需要特异性细胞培养条件。对细胞代谢的任何改变迅速诱导角质细胞分化(bakondi等人,2003;tsuchisaka等人,2014;vessey等人,1995;zhang等人,2002)。暴露于阿法替尼可能通过角质细胞代谢的单个变化或组合变化来影响表皮形成。
[0052]
pi3k-akt通路促进角质细胞衰老并且抑制角质细胞增殖
[0053]
在角质细胞暴露于阿法替尼之后,与pi3k/akt通路相关的活性显著增加。这是令人惊讶的,因为此通路在egfr的下游(图4),并且预期被egfri下调。
[0054]
尽管pi3k/akt通路被上调,但是为egfr激活的另一独立通路下游的raf/ras/erk1/2通路在24小时时用阿法替尼处理后未被正向激活(图4)(wee和wang,2017)。raf1(phospho-ser338)、eif4e(phospho-ser209)的磷酸化减少,并且raf1(phospho-tyr341)、mek1(phospho-ser221)、mek1(phospho-ser217)的磷酸化不受影响(补充表s1)。这些结果示出阿法替尼在egfr下游的预期效应。假设pi3k/akt激活是替代机制的结果。
[0055]
pi3k/akt通路影响与细胞生长、细胞分化、衰老和细胞凋亡有关的角质细胞基因表达,以及导致分化的增加的氧化应激。阿法替尼通过诱导炎症和减少先天免疫应答来影响皮肤屏障的形成(calautti等人,2005;janes等人,2009)。结果表明,衰老途径(图1d)通
过涉及puk、c-myc、p53和mtor蛋白来特异性地激活。已知调节这些蛋白质的活性增加直接诱导细胞周期停滞并促进衰老(demidenko等人,2010;iglesias-bartolome等人,2012)。
[0056]
先前报道了在阿法替尼暴露后,表皮分化标志物的表达增加(joly-tonetti等人,2020)。有趣的是,pi3k/akt通路调节丝聚蛋白、兜甲蛋白和钙粘蛋白相连的连环蛋白的增加(calautti等人,2005),这证实了先前的观察结果。
[0057]
此外,pi3k/akt通路的激活有利于减少导致细胞凋亡的细胞附着(janes等人,2009),并导致分化标志物表达的增加,并因此诱导角质细胞分化。与终末分化相关的基因在暴露于阿法替尼24小时时瞬时增加,并且在暴露于阿法替尼72小时时减少。这些结果表明阿法替尼快速诱导角质细胞的分化,并且可能是pi3k的激活增加的结果。
[0058]
总之,pi3k/akt通路的激活促进角质细胞分化并抑制角质细胞增殖。在某些情况下,细胞凋亡的诱导可能涉及更严重的病症,例如手足综合征。
[0059]
阿法替尼诱导细胞氧化应激,其触发角质细胞分化
[0060]
在暴露于阿法替尼时,改变akt下游的若干蛋白质的表达模式,包括减少的foxo3a表达,该蛋白是已知由akt直接下调的一种蛋白质(brunet等人,1999),并且因此增加与氧化应激有关的细胞周期蛋白d1(cdkn1)的表达(markinkovic等人,2007)。
[0061]
p53蛋白在调节角质细胞生命周期中起到核心作用:它控制细胞增殖的速率并有利于克服细胞凋亡的细胞分化。活性p53触发成熟的促衰老靶的表达。p21蛋白控制与细胞老化和衰老相关的途径(herbig等人,2008)。就这一点而言,提高的p53水平能够限制氧化损伤并涉及促凋亡和促衰老活性(rufini等人,2013)。然而,磷酸化抗体微阵列结果在任何时间点均未显示caspase 3活性的提高(补充表s1),这也证实了先前的结果(joly-tonetti等人,2020),即,轻度至中度cadr与角质细胞凋亡无关。然而,在更严重的病症如ten情况下,p53激活可能是更严重的症状的原因(ido y.2015)。
[0062]
egfri影响角质细胞中的维生素d3代谢
[0063]
在egf的存在下,通过与egfr的cys797、her2的cys805和erbb-4的cys803的共价结合,阿法替尼可逆地抑制egfr细胞内信号传导(solca等人,2012)。已经通过导致细胞过程受到干扰的非特异性共价结合(如cdk复合物)来证明药物的脱靶活性(klaeger等人,2017)。这些结果表明,共价激酶抑制剂具有特异性地或非特异性地与其激酶组之外的蛋白质交叉反应的可能性。此类活性使激酶在化学生物学实验中的生物学功能分配复杂化,并且可通过触发凋亡和/或衰老来导致非预期的毒性(lanning等人,2014)。tki的脱靶结合已经显示增强钙代谢并有助于角质细胞分化(kroschwald等人,2018)。
[0064]
维生素d3(vd3)代谢的并行激活因此可能干扰细胞外钙水平以诱导角质细胞分化(teichert和bikle,2011)。近期研究(shaurova等人,2020)已经显示egfri对一种参与上皮分化的vd3代谢物,1,25-二羟基维生素d3(1,25(oh)2d3)(1,25(oh)2vd3)的直接影响。
[0065]
结果表明在阿法替尼暴露后,改变了若干中cyp的表达。这些包括参与vd3代谢以及在经典途径及酸性途径中胆固醇降解为胆汁酸的cyp27a1。先前的研究(kroschwald等人,2018)已经显示tki直接调节cyp24a1活性。结果是钙代谢发生改变,这可能影响角质细胞分化(elsholz等人,2014)。
[0066]
此外,低水平的关键维生素d代谢酶24-羟化酶已与cyp24a1基因表达产生关联(shaurova等人,2020)。有趣的是,结果显示lnc-cyp24a1的增加,并且因此表明cyp24a1的
表达减少。这两种cyp都已显示诱导了钙代谢改变(dinour等人,2013)。此外,1,25(oh)2d3诱导的转录响应包括增加的cyp24a1的mrna水平、维生素d受体(vdr)的良好表征的直接靶标(shaurova等人,2020)。所有这些结果表明与cyp24a1的上调相关的1,25(oh)2d3的表达增强,这两者都促进上皮分化。
[0067]
已知1,25(oh)2d3诱导多个细胞粘附分子的转录(p
á
lmer等人,2001)并证实了先前的结果,显示阿法替尼影响表皮尺寸和体积,并增加分化标志物的表达(丝聚蛋白、内披蛋白和桥粒芯糖蛋白)(joly-tonetti等人,2020)。关于氧化应激,已知vd3是金属硫蛋白(mt)的强诱导剂,能够捕获有害的氧化剂如超氧化物和羟基自由基(nzengue等人,2008)(图3b)。mt可以用作氧介导的cyp活性的自由基清除剂。
[0068]
有趣的是,研究已经证明pi3k/akt通路的失调与vd3的抗增殖信号传导协同作用以诱导细胞衰老(axanova等人,2010;da silva teixeira等人,2020),并且证实vd3的参与和衰老途径都是cadr的可能机制。
[0069]
已知一般来讲tki,特别是阿法替尼诱导光敏性(dai等人,2017)。非常可能的是,暴露于太阳紫外线辐射可以与影响vd3代谢并且与增加的皮肤光敏性有关的此类疗法相互作用。
[0070]
egfri治疗后的免疫改变损害皮肤屏障保护
[0071]
免疫应答受tki疗法影响的机制仍然知之甚少。在此工作中,蛋白质和基因表达测定表明,由于相关il-4和il-13基因表达的组合增加、以及经由s100蛋白和炎症小体的th1应答和先天免疫应答两者的减少,发生了th2应答(howell等人,2008)。有趣的是,在特应性皮炎中观察到相同的变化(howell等人,2008)。此外,失调的vd3代谢负面影响了角质细胞中的免疫应答(kroschwald等人,2018)。
[0072]
与先天免疫应答受损相关的表皮功能受损增加了个体对常常在临床上观察到的复发性细菌和病毒皮肤感染的易感性。使用四环素补偿在阿法替尼暴露后的先天免疫应答受损已经显示cadr症状的改善(arrieta等人,2015)。
[0073]
这些新的标志物可用于设计更好策略来预防肿瘤疗法引起的皮肤损伤。
[0074]
最后,这项工作表明pi3k/akt通路通过快速驱动角质细胞分化在cadr的发病机理中起到关键作用。这一机制可以解释cadr症状的表现。这些结果还指示vd3在cadr中起重要作用。已知tki影响vd3代谢。失调的vd3途径通过细胞内钙活性的变化、增加的分化蛋白表达、减少的先天应答和cyp21a1的过表达来影响角质细胞分化。综上所述,这些结果在cadr的机制中带来了新的分子机理,这可用于临床诊断以及评估cadr治疗方案的功效。
[0075]
材料和方法
[0076]
药物制备
[0077]
如先前所报道,以100nm的亚细胞毒性水平选择实验中使用的阿法替尼浓度(joly-tonetti等人,2020)。阿法替尼购自caymanchem(ann arbor,michigan,usa),并且由溶解于dmso中的10mm原液(sigma,st.quentin fallavier,france)制备。因此,最终dmso浓度为0.001%,100nm。对照由与阿法替尼溶液相同的dmso体积构成。
[0078]
重建人表皮模型
[0079]
尺寸为4cm2的rhe购自episkin(lyon,france),并且在暴露于阿法替尼之前在没有egf的情况下培养24小时。rhe治疗在无egf且无蛋白质的epilife培养基(mepi500ca,
thermo fisher scientific,waltham,ma,usa)中进行。对于蛋白质磷酸化测定,分别选择20分钟、24小时、72小时的短期、中期和长期药物暴露时间,对于基因分析测定,分别选择6小时、24小时和72小时的短期、中期和长期药物暴露时间。对所有时间点和条件进行四次平行重复测定。
[0080]
用于蛋白质磷酸化和表达谱分析的抗体微阵列
[0081]
通过tebubio(le perray-en-yvelines,france)实施phospho explorer antibody array(full moon biosystems,inc.,sunnyvale,ca,usa),使用1330个重复点匹配1318种蛋白(磷酸化的和未磷酸化的),分析管家蛋白(beta actin,gapdh)、阴性对照(n=4)、空点(n=4)和阳性标记(n=2)。简而言之,将rhe在冷的pbs中洗涤并直接在-80℃下储存。按照制造商的方案处理样品。将60μg样品体积与生物素一起温育2小时,随后在终止试剂中温育30分钟(full moon biosystems,sunnyvale,ca,usa)。将含有打印抗体的膜在搅拌下用封闭试剂封闭40分钟,然后将其洗涤并在偶联室中温育2小时。在移除样品并连续洗涤三次之后,加入30μl的cy3-链霉亲和素(1mg/ml),在室温下避光温育20分钟,然后进行检测步骤。然后洗涤玻片,通过离心干燥并在微阵列扫描仪(innopsys innoscan 710)上扫描。
[0082]
基因表达谱分析
[0083]
通过genex(longjumeau,france)进行转录组分析。将rhe从其支持聚碳酸酯膜中取出,并且立即转移到含有1%β-巯基乙醇的rlt缓冲液中。刮拭聚碳酸酯膜以去除附着的基底细胞,并且转移到含有rhe的对应小瓶中。将样品立即在-80℃储存。
[0084]
使用来自qiagen(hilden,germany)的allprep dna/rna/mirna通用试剂盒提取包含mirna的总rna。通过experion(biorad,marnes-la-coquette,france)评估rna质量。所有rna质量指标均高于7。使用rna low input quick amp labeling kit one color(agilent technologies,les ulis,france),根据制造商的说明,转录100ng的总rna并用花青3(cy3)染色。所有比活性均高于6pmol cy3/μg crna,并且产率高于1.65μg。等量(600ng)的cy3标记的crna经片段化,并随后在65℃下杂交17小时,杂交到人sureprint 8x60k v3微阵列(agilent technologies)上。然后洗涤微阵列,并用scanner g2505c(agilent technologies)根据制造商的说明扫描微阵列。使用feature extraction(10.7版)软件进一步处理基因表达数据。
[0085]
数据处理
[0086]
对于蛋白质磷酸化和转录组阵列数据,使用在limma包中实现的rma框架进行背景校正,然后进行分位数归一化(qn)。此程序旨在归一化阵列之间的中值表达(补充图s1和补充图s2)。
[0087]
执行质量检查以使用归一化之前和之后的图形数据可视化来正确评估qn和过滤的影响,与箱图、无监督聚类、主成分分析和多维缩放变换相关联(补充图s1和补充图s2)。
[0088]
在应用10%错误发现率之后,基于转化q-值的-log10的显著差异表达来确定火山图,然后进行benjamini-hochberg后分析(y轴)。x轴指示两组之间的差异(阿法替尼与对照作对比)。蛋白质磷酸化和基因表达值进行log2转化以确保正态分布。
[0089]
为了鉴定在任何时间点受阿法替尼影响的磷酸化位点和基因,在考虑时间和治疗相互作用的情况下,使用limma包进行依赖一般线性模型的差异分析。
enhancing insulin signaling and rapid depolarizing effects.j.steroid biochem.mol.biol.elsevier ltd;2020;200:105690
[0131]
solca f,dahl g,zoephel a,bader g,sanderson m,klein c,et al.target binding properties and cellular activity of afatinib(bibw 2992),an irreversible erbb family blocker.j.pharmacol.exp.ther.american society for pharmacology and experimental therapeutics;2012;343(2):342
–
50
[0132]
teichert a,bikle dd.regulation of keratinocyte differentiation by vitamin d and its relationship to squamous cell carcinoma.signal.pathways squamous cancer.springer newyork;2011.p.283
–
303
[0133]
tischer b,huber r,kraemer m,lacouture me.dermatologic events from egfr inhibitors:the issue of the missing patient voice.support.care cancer.supportive care in cancer;2017;25(2):651
–
60,可得自:http://dx.doi.org/10.1007/s00520-016-3419-4
[0134]
tsuchisaka a,furumura m,hashimoto t.cytokine regulation during epidermal differentiation and barrier formation.j.invest.dermatol.nature publishing group;2014.p.1194
–6[0135]
vessey da,lee kh,boyer td.differentiation-induced enhancement of the ability of cultured human keratinocytes to suppress oxidative stress.j.invest.dermatol.nature publishing group;1995;104(3):355
–8[0136]
vivanco i,sawyers cl.the phosphatidylinositol 3-kinase
–
akt pathway in human cancer.nat.rev.cancer.2002;2(7):489
–
501
[0137]
wee p,wang z.epidermal growth factor receptor cell proliferation signaling pathways.cancers(basel).mdpi ag;2017.p.52
[0138]
whitman m,downes cp,keeler m,keller t,cantley l.type i phosphatidylinositol kinase makes a novel inositol phospholipid,phosphatidylinositol-3-phosphate.nature.nature;1988;332(6165):644
–6[0139]
zhang t,woods tl,elder jt.differential responses of s100a2 to oxidative stress and increased intracellular calcium in normal,immortalized,and malignant human keratinocytes.j.invest.dermatol.blackwell publishing inc.;2002;119(5):1196
–
201
[0140]
表1(excel文件)
[0141]
[0142]
[0143]
[0144]
[0145]
[0146][0147]
表2(excel文件)
[0148]
[0149]
[0150]
[0151]
[0152]
[0153]
[0154]
[0155]
[0156]
[0157]
[0158]
[0159]
[0160]
[0161]
[0162]
[0163]
[0164]
[0165]
[0166]
[0167]
[0168]
[0169]
[0170]
[0171]
[0172]
[0173]
[0174]
[0175]
[0176]
[0177]
[0178]
[0179]
[0180]
[0181]
[0182]
[0183]
[0184]
[0185]
[0186]
[0187]
[0188]
[0189]
[0190]
[0191]
[0192]
[0193]
[0194]
[0195]
[0196]
[0197]
[0198]
[0199]
[0200]
[0201]
[0202]
[0203]
[0204]
[0205]
[0206]
[0207]
[0208]
[0209]
[0210]
[0211]
[0212]
[0213]
[0214]
[0215]
[0216]
[0217]
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224]
[0225]
[0226]
[0227]
[0228]
[0229]
[0230]
[0231]
[0232]
[0233]
[0234]
[0235]
[0236]
[0237]
[0238]
[0239]
[0240]
[0241]
[0242]
[0243]
[0244]
[0245]
[0246]
[0247]
[0248]
[0249]
[0250]
[0251]
[0252]
[0253][0254]
[0255][0256]
[0257][0258]
[0259][0260]
[0261][0262]
[0263][0264]
[0265][0266]
[0267][0268]
[0269][0270]
[0271][0272]
[0273][0274]
[0275][0276]
[0277][0278]
[0279][0280]
[0281][0282]
[0283][0284]
[0285][0286]
[0287][0288]
[0289][0290]
[0291][0292]
[0293][0294]
[0295][0296]
[0297][0298]
[0299][0300]
[0301][0302]
[0303][0304]
[0305][0306]
[0307][0308]
[0309][0310]
[0311][0312]
[0313][0314]
[0315][0316]
[0317][0318]
[0319][0320]
[0321][0322]
[0323][0324]
[0325][0326]
[0327][0328]
[0329][0330]
[0331][0332]
[0333][0334]
[0335][0336]
[0337][0338]
[0339][0340]
[0341][0342]
[0343][0344]
[0345][0346]
[0347][0348]
[0349][0350]
[0351][0352]
[0353][0354]
[0355]
[0356]
[0357]
[0358]
[0359]
[0360]
[0361]
[0362]
[0363]
[0364]
[0365]
[0366]
[0367]
[0368]
[0369]
[0370]
[0371]
[0372]
[0373]
[0374]
[0375]
[0376]
[0377]
[0378]
[0379]
[0380]
[0381]
[0382]
[0383]
[0384]
[0385]
[0386]
[0387]
[0388]
[0389]
[0390]
[0391]
[0392]
[0393]
[0394]
[0395]
[0396]
[0397]
[0398]
[0399]
[0400]
[0401]
[0402]
[0403]
[0404]
[0405]
[0406]
[0407]
[0408]
[0409]
[0410]
[0411]
[0412]
[0413]
[0414]
[0415]
[0416]
[0417]
[0418]
[0419]
[0420]
[0421]
[0422]
[0423]
[0424]
[0425]
[0426]
[0427]
[0428]
[0429]
[0430]
[0431]
[0432]
[0433]
[0434]
[0435]
[0436]
[0437]
[0438]
[0439]
[0440]
[0441]
[0442]
[0443]
[0444]
[0445]
[0446]
[0447]
[0448]
[0449]
[0450]
[0451]
[0452]
[0453]
[0454]
[0455]
[0456]
[0457]
[0458]
[0459]
[0460][0461]
[0462][0463]
[0464][0465]
[0466][0467]
[0468][0469]
[0470][0471]
[0472][0473]
[0474][0475]
[0476][0477]
[0478][0479]
[0480][0481]
[0482][0483]
[0484][0485]
[0486][0487]
[0488][0489]
[0490][0491]
[0492][0493]
[0494][0495]
[0496][0497]
[0498][0499]
[0500][0501]
[0502][0503]
[0504][0505]
[0506][0507]
[0508][0509]
[0510][0511]
[0512][0513]
[0514][0515]
[0516][0517]
[0518][0519]
[0520][0521]
[0522][0523]
[0524][0525]
[0526][0527]
[0528][0529]
[0530][0531]
[0532][0533]
[0534][0535]
[0536][0537]
[0538][0539]
[0540][0541]
[0542][0543]
[0544][0545]
[0546][0547]
[0548][0549]
[0550][0551]
[0552][0553]
[0554][0555]
[0556][0557]
[0558][0559]
[0560][0561]
[0562]
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。