1.本发明属于微生物降解技术领域。更具体地,涉及一种可降解拟除虫菊酯类杀虫剂的嗜吡啶红球菌及其应用。
背景技术:
2.拟除虫菊酯是提取自chrysanthemum cinerariaefolium的天然除虫菊酯(pyrethrums)的相似物,是一种广谱杀虫剂,对双翅目、膜翅目害虫具有很好的杀灭效果。同时,拟除虫菊酯是一种神经毒剂,其作用机理主要是引起反复的神经放电,从而影响电压门控的钠离子和钙离子通道。此外,它可以抑制γ-氨基丁酸(gaba)门控氯化物通道的功能,从而阻止神经递质在细胞之间的传递。除神经毒性外,拟除虫菊酯还具有生殖毒性和内分泌毒性。研究表明,人体暴露于拟除虫菊酯的途径主要是通过非饮食途径(61%),还有摄入(26%)、吸入(8%)和暴露(5%)等途径。拟除虫菊酯具有高度疏水性,进入水体后会迅速吸附在沉积物中,随后,其中一些被本地微生物利用,另一部分进入水生食物网,最终可能通过生物放大作用在人体中积累。
3.大量结果证实了拟除虫菊酯对水生生物具有高度毒性,据报道人类和昆虫体内的线粒体/微粒体细胞色素p450参与体内拟除虫菊酯的代谢。3-苯氧基苯甲酸(3-pba)是拟除虫菊酯的代表性中间代谢产物,已在牛奶和人体液中被广泛检测到。近十年来,由于不合理使用拟除虫菊酯引起的一系列生态问题已引起了公众的重视。
4.拟除虫菊酯的大规模应用已引起土壤、沉积物和地表水的生态污染,也导致了严重的室内残留。在环境中应用拟除虫菊酯后,只要少部分活性成分抵达靶标生物,大部分残留在植物和土壤表面。拟除虫菊酯的频繁使用,导致其母体和中间代谢产物在世界范围内被广泛检测到,尤其在城市地区的水体中。越南北部地区频繁在鱼类和蔬菜样品上检测到氟氯氰菊酯和氯氰菊酯,并超过了每日允许摄入量(adi)。为了监测农药污染程度,美国加利福尼亚州展开了一项城市监测计划。结果显示,加利福尼亚州地表水的农药含量极高,其中检出频次最多的是联苯菊酯。此外,还调查了加利福尼亚州主要流域的淡水甲壳类动物,从中高频发现拟除虫菊酯抗性等位基因的出现,这暗示着抗药性的普遍存在。
5.农药降解微生物因其独特的优势经过30年的发展已成为科学研究热点和治理农药残留问题的有效策略。微生物可以通过各种方式将残留在环境中的异源污染物分解代谢成无毒或低毒的无机小分子化合物。
6.现有技术中有公开农药降解微生物降解拟除虫菊酯的相关技术内容,如中国专利《一株高效降解氰戊菊酯的酯香微杆菌及其应用》公开了一株酯香微杆菌能降解氰戊菊酯,中国专利《一株高效降解氯氟氰菊酯的玫瑰色红球菌及其应用》公开了一株玫瑰色红球菌能降解氯氟氰菊酯。然而上述酯香微杆菌和玫瑰色红球菌仅公开了对一种拟除虫菊酯(氰戊菊酯或氯氟氰菊酯)具有降解作用,其降解效果也有限;且对于不同浓度的氰戊菊酯或氯氟氰菊酯,降解效果差距较大。
技术实现要素:
7.本发明提供了一株新的能降解拟除虫菊酯类杀虫剂的优良菌种,对于多种拟除虫菊酯类杀虫剂具有优异的降解作用,30小时内对浓度为50mg/l的右旋苯醚氰菊酯降解率为100%,在72小时内对多达7种拟除虫菊酯类杀虫剂降解率高于95%,且降解效果稳定。本发明提供的优良菌种在对拟除虫菊酯类农药的污染和环境保护中具有很好的应用价值。
8.本发明的第一个目的是提供一株可高效降解拟除虫菊酯类杀虫剂的嗜吡啶红球菌(rhodococcus pyridinivorans)菌株y6。
9.本发明的第二个目的是提供所述菌株y6的应用。
10.本发明的第三个目的是提供一种可用于降解拟除虫菊酯类杀虫剂的菌剂。
11.本发明的第四个目的是提供嗜吡啶红球菌(rhodococcus pyridinivorans)菌株y6降解右旋苯醚氰菊酯的生物代谢途径。
12.本发明上述目的通过以下技术方案实现:
13.一种可降解拟除虫菊酯类杀虫剂的嗜吡啶红球菌(rhodococcus pyridinivorans)菌株y6,该菌株于2021年7月21日保藏于广东省微生物菌种保藏中心,保藏编号为gdmcc no:61812。
14.该菌株分离自采集于广东省某化工厂附近的活性污泥,经形态学特征、16srdna系统发育分析和全基因组分析鉴定为嗜吡啶红球菌(rhodococcus pyridinivorans)。超高分辨场发射扫描电镜(u-r sem)显示菌株y6早期为长杆状,中后期分裂成短杆状或近似球形,长度约为0.5~2μm。菌株y6在lb琼脂平板上培养48小时后,菌落呈圆形、凸起、表面光滑、不透明、边缘整齐。生理生化测试结果为:接触酶、硝酸盐还原测试、脲酶测试、七叶苷水解、脂酶测试、硫化氢试验、果糖发酵、甘油发酵、甘露醇发酵、水杨素发酵和核糖发酵测试反应呈阳性;氧化酶、淀粉水解、v-p测定、甲基红试验、葡萄糖发酵、麦芽糖发酵测试呈阴性反应。
15.进一步地,所述菌株y6具有显著降解各种拟除虫菊酯类杀虫剂的能力。因此,所述菌株y6或其菌悬液在降解拟除虫菊酯类杀虫剂中的应用应在本发明的保护范围之内。
16.进一步地,所述菌株y6或其菌悬液在制备降解拟除虫菊酯类杀虫剂的产品中的应用,也应在本发明的保护范围之内。所述产品可以是菌剂或其他形式涉及拟除虫菊酯杀虫剂降解生物制品。
17.进一步地,本发明还提供所述菌株y6在修复拟除虫菊酯类杀虫剂污染的自然环境或人工环境中的应用。
18.优选地,所述自然环境包括自然水体和/或土壤;所述人工环境包括农业生产区域、工业生产区域、城市绿化区域和住宅区域中的一种或多种。
19.进一步地,所述拟除虫菊酯类杀虫剂包括右旋苯醚氰菊酯、胺菊酯、氰戊菊酯、氯菊酯、丙烯菊酯、氯烯炔菊酯、高效氯氰菊酯、炔丙菊酯和溴氰菊酯中的一种或多种。
20.优选地,所述拟除虫菊酯类杀虫剂包括右旋苯醚氰菊酯、丙烯菊酯、高效氯氰菊酯、氰戊菊酯、炔丙菊酯、胺菊酯和氯菊酯中的一种或多种。
21.进一步优选地,所述拟除虫菊酯类杀虫剂包括右旋苯醚氰菊酯、丙烯菊酯、氰戊菊酯、炔丙菊酯和胺菊酯中的一种或多种。
22.最优选地,所述拟除虫菊酯类杀虫剂为右旋苯醚氰菊酯。
23.一种可用于降解拟除虫菊酯类杀虫剂的菌剂,包含上述菌株y6,也应在本发明的
保护范围之内。
24.优选地,所述菌株y6的菌体数量od
600
值不低于1.04。
25.基于此,利用上述菌剂降解拟除虫菊酯类杀虫剂或处理修复其污染环境的方法,也应在本发明的保护范围之内。
26.具体为了控制更好更稳定的效果,优选地,利用上述菌剂降解或处理条件控制在:温度为30-35℃,ph为7-8为最佳。
27.进一步地,在降解拟除虫菊酯类杀虫剂或修复拟除虫菊酯类杀虫剂污染的自然环境或人工环境时,所述菌株y6的接种温度为30-35℃,ph为7-8,所述菌株y6的菌体数量od
600
值不低于1.04。
28.进一步优选地,所述菌株y6的接种温度30-32℃,ph为7.5-8,所述菌株y6的菌体数量od
600
值为1.04-1.1。
29.最优选地,所述菌株y6的接种温度31.76℃,ph为7.85,所述菌株y6的菌体数量od
600
值为1.04。
30.在实验室条件下,直接在msm液体培养基中添加嗜吡啶红球菌y6,在30小时内可使50mg/l的右旋苯醚氰菊酯降解率达到100%。
31.本发明具有以下有益效果:
32.(1)本发明提供了一株可高效降解拟除虫菊酯类杀虫剂的菌株,嗜吡啶红球菌菌株y6。所述菌株y6可以利用右旋苯醚氰菊酯等拟除虫菊酯类杀虫剂作为唯一碳源生长,在短时间内可有效降解拟除虫菊酯类杀虫剂。30小时内对msm液体培养基中浓度为50mg/l的右旋苯醚氰菊酯降解率为100%,在72小时内对丙烯菊酯、高效氯氰菊酯和氰戊菊酯的降解率达到100%,炔丙菊酯为98.62%,胺菊酯为97.94%,氯菊酯为93.07%。表明该菌株具有优异的拟除虫菊酯类杀虫剂降解能力和良好的拟除虫菊酯生物修复能力。
33.(2)所述菌株y6可用于修复拟除虫菊酯类杀虫剂污染的水体、土壤等自然环境,对污染土壤也具有高效的生物修复作用。可用于处理农业生产中拟除虫菊酯类杀虫剂残留超标及环境污染问题,从而生产绿色无公害的健康农产品,保护生态环境和人类健康。
34.(3)本发明为解决农业生产中拟除虫菊酯类杀虫剂残留污染问题提供一种新思路,也丰富了农药降解菌的种质资源库,对生产无毒无公害的绿色农产品,具有重要的实际应用价值。
附图说明
35.图1为菌株y6的16s rdna系统进化分析。
36.图2为菌株y6的菌落形态和扫描电镜图;其中a为扫描电镜图(2.5
×
10k);b为菌株y6在lb培养板的形态。
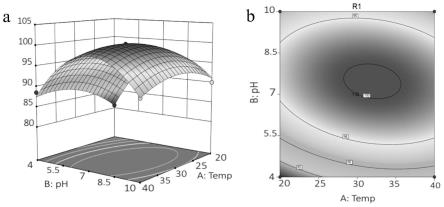
37.图3为菌株y6降解右旋苯醚氰菊酯的响应曲面设计;其中a为温度响应曲面设计,b为ph响应曲面设计;c为接种量响应曲面设计。
38.图4为温度和ph交互作用对右旋苯醚氰菊酯降解的影响;其中a为响应曲面图,b为等温线图。
39.图5为菌株y6在右旋苯醚氰菊酯降解过程中的生长与降解动态。
40.图6为菌株y6对其他浓度为50mg/l的其他拟除虫菊酯类杀虫剂的降解能力。
41.图7为菌株y6对其他浓度为200mg/l的其他拟除虫菊酯类杀虫剂的降解能力。
42.图8为菌株y6对不同浓度的右旋苯醚氰菊酯的降解能力。
43.图9为菌株y6降解不同浓度右旋苯醚氰菊酯过程中的抑制曲线。
44.图10为菌株y6在土壤环境中对右旋苯醚氰菊酯的降解能力。
45.图11为菌株y6代谢右旋苯醚氰菊酯的生物代谢途径。
具体实施方式
46.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
47.除非特别说明,以下实施例所用试剂和材料均为市购。
48.以下实施例中所述培养基配方如下:
49.基础盐培养基(msm,g/l):(nh4)2so
4 2.0g;cacl2·
2h2o 0.01g;feso4·
7h2o 0.001g;na2hpo4·
12h2o 1.5g;mgso4·
7h2o 0.2g;kh2po
4 1.5g。
50.luria-bertani培养基(lb,g/l):酵母提取物5.0g;蛋白胨10.0g;氯化钠10.0g。
51.以上培养基以蒸馏水配成,ph为7.2,于高压湿热灭菌锅121℃灭菌20分钟。
52.固体培养基:每1l培养基加入15g琼脂粉。
53.实施例1菌株的分离与鉴定
54.1、菌株的分离筛选
55.样品:采集自广东省某化工厂附近的活性污泥。
56.分离筛选方法采用富集培养法,具体如下:
57.取活性污泥样品10g加入50ml基础培养基中,同时加入右旋苯醚氰菊酯母液(丙酮为溶剂),使右旋苯醚氰菊酯最终质量浓度为50mg/l,于30℃,200r/min摇床下进行耐受菌富集培养。培养7天后,按10%的接种量转接到第二批含100mg/l右旋苯醚氰菊酯的msm培养基中。相同条件培养7天后,再按10%的接种量转接到含右旋苯醚氰菊酯浓度为200mg/l的msm培养基中,继续培养7天。以此类推,不断成倍增加右旋苯醚氰菊酯的质量浓度,连续富集培至800mg/l。将富集培养液逐步稀释成不同浓度的稀释液,取20μl稀释液均匀涂到含50mg/l右旋苯醚氰菊酯的msm固体lb平板中,30℃培养,直至长出单菌落,把分离出来的耐受菌在lb固体培养基上反复划线3次以纯化菌株,最终利用30%的甘油在-80℃条件下保存菌种。随后对样品进行萃取处理后使用高效液相色谱仪(hplc)验证其降解效果。
58.采用上述方法从环境样品中成功分离获得一株右旋苯醚氰菊酯高效降解菌株,编号为y6,该菌株可以利用右旋苯醚氰菊酯作为唯一碳源生长,30小时内对浓度为50mg/l的右旋苯醚氰菊酯降解率达到100%。
59.2、菌株鉴定
60.将分离获得的菌株y6在lb固体平板上30℃培养48小时后,菌落呈圆形、凸起、表面光滑、不透明、边缘整齐。超高分辨场发射扫描电镜(u-r sem)显示菌株y6早期为长杆状,中后期分裂成短杆状或近似球形,长度约为0.5~2μm,繁殖方式为裂殖。
61.16s rdna分子生物学鉴定:
62.提取菌株y6基因组dna,以基因组dna为模板,采用16s rdna细菌通用引物(27f:
5'-agagtttgatcctggctcag-3';1429r:5'-ggttaccttgttacgactt-3')进行pcr扩增,pcr产物委托金唯智(广州)生物科技有限公司进行测序。并将菌株测得的16s rdna序列在genbank数据库中利用blast进行比对分析,并选择同源性较高的相关序列利用mage软件构建系统进化树及分析进化关系。
63.16s rdna
…
的系统发育树如图1所示,本发明分离纯化得到的菌株与嗜吡啶红球菌(rhodococcus pyridinivorans)菌株pdb9的相似度达到99%以上。菌株y6的菌落形态及其扫描电镜图如图2所示。并于2021年7月21日保存于广东省微生物菌种保藏中心,保藏号为gdmcc no:61812,保藏地址:广州市先烈中路100号大院59号楼5楼。
64.生理生化特征:
65.在菌株y6 16s rdna测序分析结果的基础上,参考1984年《伯杰细菌鉴定手册(第八版)》的有关红球菌属的生化测试内容,选择以下项目进行生理生化测试,具体结果如表1所示。菌株y6为革兰氏阳性细菌,好氧,在接触酶、硝酸盐还原测试、脲酶测试、七叶苷水解、脂酶测试、硫化氢试验、果糖发酵、甘油发酵、甘露醇发酵、水杨素发酵和核糖发酵测试中反应呈阳性;在氧化酶、淀粉水解、v-p测定、甲基红试验、葡萄糖发酵、麦芽糖发酵测试中呈阴性反应。根据生理生化测试结果,与《伯杰细菌鉴定手册(第八版)》进行比对。基于形态学、16s rdna和生理生化特性分析,菌株y6被鉴定为嗜吡啶红球菌(rhodococcus pyridinivorans)。
66.表1菌株y6的生理生化测试
67.生理生化试验结果生理生化实验结果厌氧生长-甲基红试验-接触酶 脂酶测试 氧化酶-果糖发酵 v-p测定-甘油发酵 淀粉水解-麦芽糖利用-硝酸盐还原 甘露醇发酵 柠檬酸盐利用 水杨素发酵 七叶苷水解 葡萄糖发酵-脲酶 核糖发酵
68.实施例2菌株y6最佳降解条件的优化
69.1.实验方法
70.基于响应曲面技术(rsm)的box-behnken设计来优化菌株y6的右旋苯醚氰菊酯降解条件。基于单因素实验的初步结果,选定了三个独立变量,分别为温度(x1),ph(x2)和接种量(x3),以预测菌株y6对右旋苯醚氰菊酯的最佳降解参数(表2)。右旋苯醚氰菊酯(y1)残留量由hplc分析所得,代表了三个变量在不同水平下对菌株y6的影响。
71.表2基于box
–
behnken设计的三个自变量及其编码和未编码水平
[0072][0073]
2.结果
[0074]
表3列出了与右旋苯醚氰菊酯降解相对应的实验设计变量。在design expert软件中通过响应曲面对相关降解数据进行了多项式回归分析,并将右旋苯醚氰菊酯降解的实验值进行拟合从而得到以下二次多项式回归方程:
[0075]
y1=100.00 1.49x1 3.36x2–
0.21x3–
1.86x1x2 0.55x1x3–
0.16x2x3–
3.05x
12
–
9.53x
22
–
2.6x
32
[0076]
其中:x1为相关因子温度,x2为ph值,x3为接菌量,y1为响应值。
[0077]
表3 box-behnken实验设计矩阵及对应的右旋苯醚氰菊酯降解率
[0078]
[0079][0080]
注:y1为右旋苯醚氰菊酯降解率(%);x1、x2和x3分别是温度、ph和接种量的编码值;y1值为平均数
±
s.e.,数值后面的字母表示拥有相同字母序列间在5%水平上无显著差异(dmrt法)。
[0081]
表4给出了二次多项式模型的方差分析(anova)。注意到模型项的f值为36.75,p值《0.0001,表明该方程极显著的拟合了右旋苯醚氰菊酯的降解过程。统计分析结果表明,其决定系数r2为0.9793,表明本项试验的实际值与模型预测值具有高度的拟合性。此外该模型的校正决定系数r2为0.9526,以及较低的变异系数(c.v.=1.45%)也表明该模型是准确可靠的。回归分析结果表明,温度(x1)和ph(x2)的单因素项和平方项,即x1、x2、x1x2、x
12
和x
22
对菌株y6降解右旋苯醚氰菊酯具有显着影响(p《0.05)(图3)。其中,平方项x
22
对菌株y6降解右旋苯醚氰菊酯具有极显着影响水平(p《0.0001)。而接种量大小(x3)和接种量与ph(x2)的相互作用项对菌株y6的代谢活性并无显著影响(p》0.05)。
[0082]
表4右旋苯醚氰菊酯降解过程拟合二次多项式模型及其方差分析(anova)
[0083]
[0084][0085]
注:p《0.0001表明该因素对菌株具有极显著影响。
[0086]
为了使各因素及其相互作用对菌株y6代谢右旋苯醚氰菊酯的影响以更加直观的多维度视觉模型呈现,将接种量(x3)编码值固定为0,即od
600
值1.0,绘制了三维响应曲面图和等高线图,如图4所示。右旋苯醚氰菊酯降解在响应曲面图中的最大理论值为100.23%,这与菌株y6的实际值相符合。而三个变量x1,x2和x3的最佳水平在编码水平下分别为0.176、0.282和0.085,即未编码水平的最佳温度和ph分别为31.76℃和7.85,接种量的od600值为1.04。
[0087]
实施例3菌株y6对拟除虫菊酯类杀虫剂的降解效果实验
[0088]
1、实验方法
[0089]
(1)接种菌体制备:将实施例1纯化后的菌株y6接入10ml lb液体培养基中过夜活化培养至对数期(24~48小时),调节od值为1.0,取1ml菌液6000rpm离心3分钟后,菌体用无菌生理盐水(0.9%nacl)冲洗两次,所得菌体作为接种体。
[0090]
(2)降解性能测定:将上述重悬的菌液分别转移至50ml含有50mg/l右旋苯醚氰菊酯、胺菊酯、氰戊菊酯、氯菊酯、丙烯菊酯、氯烯炔菊酯、高效氯氰菊酯、炔丙菊酯、溴氰菊酯、氟氯苯菊酯和氯氟醚菊酯的msm培养基中,于30℃和200rpm条件下持续培养,实验设3次重复,以未接种的msm培养基作为空白对照,并通过hplc测定上述各类拟除虫菊酯的残留量。
[0091]
紫外/可见光分光光度计在600nm条件下被用于监测菌株y6在含有右旋苯醚氰菊酯的msm培养基中的生长情况,并通过一级动力学模型分析了菌株y6对右旋苯醚氰菊酯的降解过程:
[0092]ct
=c0×
e-kt
[0093]
式中,c0是右旋苯醚氰菊酯的初始浓度(mg/l),c
t
是在时间t的右旋苯醚氰菊酯的含量,k是降解常数(h-1
),t是降解时间(h)。
[0094]
下列公式用于计算右旋苯醚氰菊酯的理论半衰期(t
1/2
):
[0095]
t
1/2
=ln(2)/k
[0096]
式中,ln(2)是2的自然对数,k是降解常数。
[0097]
(3)色谱条件:用配备有phenomenex c
18
反相色谱柱(250nm
×
4.60mm,5μm)和uv检测器的waters 2690hplc系统对各类拟除虫菊酯进行定量。流动相由乙腈和去离子水(75:25)组成,流速为1.0ml
·
min-1
。进样量和检测波长分别为10μl和253nm。右旋苯醚氰菊酯、胺菊酯、氰戊菊酯、氯菊酯、丙烯菊酯、氯烯炔菊酯、高效氯氰菊酯、炔丙菊酯、溴氰菊酯、氟氯
苯菊酯和氯氟醚菊酯的保留时间分别为13.229、6.801、13.579、14.302、7.304、11.127、11.473、5.559、12.785、21.393和9.706min。
[0098]
按照下式计算各类拟除虫菊酯的降解率:降解率(%)=(1-a1/a0)
×
100,
[0099]
其中:a1为菌株y6处理后拟除虫菊酯残留数量,a0为对照处理后的拟除虫菊酯残留数量。
[0100]
质量控制:采用外标法校正标准物质制作标准曲线。
[0101]
2、实验结果
[0102]
菌株y6在以右旋苯醚氰菊酯为生长底物的msm培养基中的生长和降解过程如图5所示。菌株y6在早期(0~6h)显示出快速生长,表明在菌株y6的生长过程中没有滞后期,并能有效地利用了右旋苯醚氰菊酯,在6小时内降解了77.51%的50mg/l右旋苯醚氰菊酯。培养至24小时,细胞生长达到顶峰,随后开始衰退,表明在右旋苯醚氰菊酯被大部分代谢之后,菌株y6的种群数量由于生长能源的缺乏开始下降。处理30小时后,菌株y6完全降解了最初添加的50mg/l右旋苯醚氰菊酯。值得注意的是,msm培养基除了右旋苯醚氰菊酯作为唯一碳源和能源外并不含有额外的碳源,这说明菌株y6能以右旋苯醚氰菊酯作为唯一能源生长,以及代谢右旋苯醚氰菊酯。而菌株y6的生长对数期为24~48h,该菌株能在30h内彻底代谢右旋苯醚氰菊酯,表明菌株y6还有很大的降解空间。如表5所示,为菌株y6降解右旋苯醚氰菊酯的动力学参数,表明菌株y6对右旋苯醚氰菊酯的降解过程遵循一阶动力学模型。菌株y6和对照的降解常数(k)分别为0.1114和0.0012。通过2.3.1所述公式分别计算菌株y6处理和对照的右旋苯醚氰菊酯理论半衰期(t
1/2
)。菌株y6和对照的相关系数(r2)分别为0.9643和0.7627,表明降解数据与一阶动力学模型吻合良好。由菌株y6降解右旋苯醚氰菊酯的理论半衰期(t
1/2
)为6.22小时,明显短于未接菌对照的577.62小时,即24天。
[0103]
表5菌株y6处理msm培养基中右旋苯醚氰菊酯的动力学参数
[0104][0105]
注:c
t
为右旋苯醚氰菊酯降解率(mg/l);k为降解率常数;t
1/2
为处理时间;r2为决定系数。
[0106]
为了研究菌株y6在多种胁迫环境下的降解潜力,测试了菌株y6对不同拟除虫菊酯类杀虫剂的降解能力测试。在避光条件下在恒温培养箱中振荡培养72h后,收集并分析样品。结果如图6所示,在50mg/l浓度水平下,丙烯菊酯、高效氯氰菊酯和氰戊菊酯的降解率最高,达到100%。其次为炔丙菊酯98.62%、胺菊酯97.94%和氯菊酯93.07%。随后,氯烯炔菊酯和溴氰菊酯的降解率分别为60.93%和50.10%。最低的降解发生在氯氟醚菊酯和氟氯苯菊酯中,降解率为0(数据未在图6中显示)。
[0107]
结果如图7所示,当浓度水平提升至200mg/l后,菌株y6对某些菊酯的降解率明显下降,尤其是氯烯炔菊酯和溴氰菊酯,分别由61.78和50.13%迅速下降至0和17.61%。表明随着浓度的提高,氯烯炔菊酯对菌株y6的抑制作用得到明显增强,溴氰菊酯次之。氯菊酯和高效氯氰菊酯的降解率随着浓度的提高呈现出接近18%的下降,而丙烯菊酯、胺菊酯、炔丙
菊酯和氰戊菊酯并没有明显的变化。菌株y6降解不同拟除虫菊酯类杀虫剂农药的能力表明,该菌株具有从复杂环境中去除拟除虫菊酯残留的潜力和优势。
[0108]
实施例4菌株y6对右旋苯醚氰菊酯的降解浓度测试
[0109]
1、实验方法
[0110]
将实施例1纯化后的菌株y6接入10ml lb液体培养基中过夜活化培养至对数期(24~48小时),调节od
600
值为1.0,取1ml菌液离心(6000rpm,3分钟)后,菌体用无菌生理盐水(0.9%nacl)冲洗两次。然后将菌体分别接种至50ml含有不同浓度右旋苯醚氰菊酯(100、200、300、400、500、600、700和800mg/l)的msm培养基中,以不接菌作为对照,每组三个重复。在30℃,200rpm恒温摇床培养至第48小时,期间定期取样,采用hplc测定其对不同浓度右旋苯醚氰菊酯的降解情况。由于拟除虫菊酯类杀虫剂既能作为菌株y6的生长底物,同时也能作为一种生长抑制物,因此采用andrews方程对菌株y6降解不同浓度的右旋苯醚氰菊酯的过程进行拟合。方程如下所示:
[0111][0112]
其中:s为右旋苯醚氰菊酯浓度(mg/l);q为右旋苯醚氰菊酯比降解速率(h-1
);q
max
为右旋苯醚氰菊酯的最大比降解速率(h-1
);ks为半速率常数(mg/l);ki为右旋苯醚氰菊酯对菌株y6的抑制系数(mg/l)。
[0113]
2、实验结果
[0114]
在含有50ml无菌msm培养基的三角瓶中分别加入右旋苯醚氰菊酯母液使之初始浓度分别为100、200、300、400、500、600、700和800mg/l。如图8所示,当浓度为100和200mg/l时,菌株y6能迅速利用右旋苯醚氰菊酯,在48小时内完全代谢右旋苯醚氰菊酯;当浓度提高到300mg/l至800mg/l后,观察到菌株y6对右旋苯醚氰菊酯的降解有所变缓,但仍然保持较高的降解速率。尤其是在12小时内,菌株y6快速代谢了50%左右的右旋苯醚氰菊酯,而无明显的滞后期。处理72小时后,300mg/l浓度的右旋苯醚氰菊酯降解率达到97%左右,而400~800mg/l浓度的处理组降解率分别为83.92、83.40、78.83、79.74和71.53%。菌株y6在高达800mg/l的浓度下仍能迅速降解右旋苯醚氰菊酯,并将其作为唯一的碳源和能源生长。这表明菌株y6可以在右旋苯醚氰菊酯污染区域作为有效的候选菌株。
[0115]
本试验表明,随着右旋苯醚氰菊酯浓度的提高,菌株y6的降解率相对下降,这说明在生物修复过程中,右旋苯醚氰菊酯既能作为菌株y6生长的底物,在高浓度下,同时也起到抑制菌株生长的作用。因此本试验采用andrews方程式来模拟不同浓度下右旋苯醚氰菊酯生物降解过程中的动力学分析。通过matlab软件处理实验原始数据,并根据andrews方程对原始数据进行非线性拟合。如图9所述,该模型的理论值与实际值拟合程度高(r2=0.9093),其中右旋苯醚氰菊酯的最大比降解速率(q
max
)为0.8095h-1
;半速率常数(ks)为568.7754mg/l;抑制系数(ki)为18.7006mg/l。随后通过对andrews方程进一步求导,可得到q
max
所对应的右旋苯醚氰菊酯浓度(s
max
)为103.1329mg/l,该浓度即为菌株y6降解右旋苯醚氰菊酯的最佳预测浓度值。
[0116]
实施例5土壤修复实验
[0117]
1、供试土样
[0118]
本实验的土壤样品采自于华南农业大学一个5年内无农药使用记录的菜地3~20cm深度的表土。该土样的物理化学参数为:有机质含量10.5g/kg;硝酸根离子含量20mg/kg;有效磷和有效钾含量分别为37.5mg/kg和105mg/kg;土壤电导率和ph值分别为375μs/cm和6.9;土壤由65.0%砂土、28.0%壤土和7.0%黏土组成。
[0119]
将土壤样品在室内自然风干并过筛(2mm)以进行接下来的生物修复模拟研究。将部分土壤在121℃下高压灭菌1小时,以完全去除土著微生物群落。然后,将250g无菌和非无菌土壤样品分别分装入500ml锥形瓶中。在每个锥形瓶中加入右旋苯醚氰菊酯溶液使终浓度为50mg/kg。用无菌去离子水将土壤含水量调整为20~40%。将实施例1分离的菌株y6接入液体lb培养基培养24小时后调节od
600
值至1.0,分别将5ml细菌悬浮液接种到无菌和非无菌土壤中,以未接种的土样作为对照,实验设三次重复。充分混合后,将处理组和空白组置于人工气候箱中,于避光条件下30℃进行土壤修复实验。随后定期间隔1天分别于2、4、6、8、10和12d收集10g土壤样品进行萃取。
[0120]
土壤萃取方法:10g样品添加到50ml离心管中,并添加10ml丙酮。将离心管涡旋10s,然后超声处理20min。然后,将30ml乙酸乙酯加入到离心管中并涡旋2min。将离心管保持在室温下大约30min,直到水相和有机相分层为止。随后将上层有机相通过无水硫酸钠除水后转移进250ml平底烧瓶中,舍弃原50ml离心管。最后,将装有有机相的平底烧瓶置于水泵循环式真空浓缩仪中进行浓缩。加入10ml色谱乙腈进行涡旋回收。取1ml回收液利用1ml注射器和0.22μm滤膜进一步纯化回收样品,并在进行hplc检测之前将其保存在4℃的棕色瓶中。
[0121]
2、实验结果
[0122]
如图10所示,土壤修复实验以灭菌土壤和未灭菌土壤作为两组处理,分别以未接菌土壤作为对照。在经过菌株y6持续处理12天后,灭菌处理和未灭菌处理的降解率分别为76.25和67.33%,而灭菌和未灭菌对照中的自然降解率约为30%。菌株y6在土壤降解过程中符合一级动力学模型,灭菌和未灭菌处理的降解率常数(k)值分别为0.1129和0.0900d-1
;降解半衰期(t
1/2
)分别为6.14d和7.70d。具体动力学参数见表6。此外,在实验过程中没有观察到明显的滞后期。而在未接菌的对照中,灭菌和未灭菌处理的降解率常数分别为0.0309和0.0307d-1;降解半衰期分别为22.43和22.58d。说明菌株y6在拟除虫菊酯污染场地的生物修复中发挥了生物增强作用。研究结果表明,菌株y6在土壤中也能发挥高效的降解能力,可用于拟除虫菊酯污染土壤或水体的修复应用。
[0123]
表6菌株y6在右旋苯醚氰菊酯污染土壤中的降解动力学参数
[0124]
处理回归方程kr2t
1/2
灭菌土壤 y6c
t
=51.6933e-0.1129t
0.11290.92346.1395未灭菌土壤 y6c
t
=50.1078e-0.0900t
0.09000.97167.7016灭菌土壤c
t
=50.3710e-0.0309t
0.03090.936922.4319未灭菌土壤c
t
=50.5159e-0.0307t
0.03070.865822.5781
[0125]
注:k表示降解常数;r2是决定系数;t
1/2
是指降解半衰期(h)。
[0126]
实施例6菌株y6对右旋苯醚氰菊酯的生物代谢途径
[0127]
1、实验方法
[0128]
为了研究右旋苯醚氰菊酯降解过程中菌株y6的代谢途径,分别在第6、12、18、24和
30小时定期从msm培养基中收集样品。最后使用色谱甲醇回收浓缩液,并过0.22μm有机相滤膜,通过气相色谱-质谱法(gc/ms)(agilent6890n/5975,美国)检测代谢产物,并将结果与美国国家标准技术研究院(nist)数据库中的标准化合物进行比对。
[0129]
气相色谱联用分析方法:在配备自动进样器、分流/不分流毛细管进样系统和hp-5ms石英毛细管柱(30.0m
×
250μm
×
0.25μm)和阵列检测器的agilent6890n/5977b gc/ms系统中鉴定了右旋苯醚氰菊酯的代谢产物。以高纯度氦气(纯度≥99.99%)作为载气,流速为1.5ml
·
min-1
。分析模式设为30~500nm范围内扫描。升温程序:色谱柱温度首先在90℃下保持2分钟,以6℃
·
min-1
上升到150℃维持1min,随后以10℃
·
min-1
上升到180℃维持4min,最后以20℃
·
min-1
保持在260℃10min(表7)。ms传输线温度:280℃;离子源温度:230℃;四级杆温度:150℃;电离电压:70ev;进样量:1.0μl。
[0130]
表7 gc-ms升温程序
[0131]
温度速度(℃
·
min-1
)温度(℃)保持时间(min)累计时间(min)-9022615011310180420202601034
[0132]
2、实验结果
[0133]
基于gs-ms对右旋苯醚氰菊酯的产物鉴定结果,分析了右旋苯醚氰菊酯的代谢途径。代谢途径如图11所示。菌株y6首先通过裂解羧酸酯键将右旋苯醚氰菊酯水解,得到α-羟基-3-苯氧基苯乙腈和菊醇。中间产物α-羟基-3-苯氧基苯乙腈在环境中的稳定性较差,快速转化为3-苯氧基苄醇。随后,3-苯氧基苄醇被进一步氧化成间苯氧基苯甲醛。在菌株y6水解酶的作用下,间苯氧基苯甲醛进一步降解形成邻苯二甲酸和苯酚。与此同时,菊醇被氧化菊醛,菊醛随后进一步氧化为菊酸。在降解48小时后,右旋苯醚氰菊酯的中间产物最终被降解为无毒小分子,如水和二氧化碳。
[0134]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。