1.本发明涉及口膜剂,具体地涉及奥氮平氟西汀复方口溶膜及其制备方法。
背景技术:
2.奥氮平是一种非典型抗精神病药物,具有五羟色胺、去甲肾上腺素和多巴胺多重拮抗作用,适用于精神分裂症及其它有严重阳性症状和/或阴性症状的精神病的急性期和维持期的治疗,也可缓解精神分裂症及相关疾病的继发性情感症状。奥氮平不良反应少,很少出现运动障碍,其主要不良反应是嗜睡和体重增加。偶见用药初期出现肝脏氨基转移酶alt和ast的一过性轻度升高,但不伴临床症状。奥氮平口服吸收良好,5-8小时达到血浆峰值浓度,并且不受进食影响。
3.盐酸氟西汀是一种选择性的5-羟色胺再摄取抑制剂(ssri),其能有效地抑制神经元从突触间隙中摄取5-羟色胺,增加间隙中可供实际利用的神经递质,从而改善情感状态,治疗抑郁性精神障碍。
4.小剂量奥氮平合并氟西汀对于治疗重度抑郁症患者是一个值得推荐的治疗方案,不仅起效快,克服了氟西汀本身起效慢及苯二氮卓类抗焦虑剂易成瘾的缺点,而且大大减少了氟西汀治疗中的脱落率,并能迅速改善睡眠及焦虑症状,显著提高抗抑郁及焦虑的疗效,值得临床推广。
5.奥氮平、盐酸氟西汀均由美国礼来公司(eli lilly and company)首先研制合成。1996年9月美国fda批准了礼来公司奥氮平片(商品名:zyprexa)上市,销售额持续增长,成为全球最畅销的抗精神病药物之一。但由于普通片必须在胃肠道溶解吸收,起效较慢,且精神病患者依从性较差、服用不便,一定程度上影响了疗效。为解决该问题,礼来公司于2000年4月在fda上市了奥氮平口腔崩解片(商品名:zyprexazydis),该剂型可快速在口腔中崩解释放,吸收速度快,一定程度上解决了患者顺应性问题,但该剂型采用冷冻干燥的制备工艺,需匹配特殊的冻干工艺设备,且生产周期较长、成本高。另外,冻干片也存在易吸潮、易碎的缺点,影响了该制剂的应用。
6.1986年12月,礼来公司的盐酸氟西汀在比利时获批上市,随后又在美国、法国、英国上市。迄今为止,上市品种主要有盐酸氟西汀片剂、盐酸氟西汀口服胶囊,但普通片剂及胶囊需送水服用,不适合吞咽困难的老人、小孩服用。
7.2003年12月24日,奥氮平氟西汀胶囊在美国获批上市,商品名为“symbyax”共四个规格,分别为奥氮平6mg/氟西汀25mg,奥氮平6mg/氟西汀50mg,奥氮平12mg/氟西汀25mg,奥氮平12mg/氟西汀50mg;2007年4月9日,更小规格的奥氮平氟西汀胶囊于美国获批上市,商品名为“symbyax”,规格为奥氮平3mg/氟西汀25mg。
8.综上,目前临床上使用的奥氮平、盐酸氟西汀制剂主要为片剂和胶囊剂,奥氮平、盐酸氟西汀通过胃肠道吸收,起效需要一定时间,难以迅速控制精神分裂症急性期症状,而且精神分裂症患者急性期和双向情感障碍躁狂期时,常常出现患者拒绝服药,口腔中藏药及吐药的常见问题,精神分裂症患者用药依从性问题普遍存在。此外,在临床实践中也经常
发现,当前国内已上市的相关片剂和胶囊剂不适合精神病患者使用,导致该部分人群的用药可及性得不到保障,存在临床用药的空白区。因此,片剂和胶囊剂这种体积较大的剂型常常无法对这类患者发挥作用,对于精神分裂症患者应考虑使用易于使用的剂型。
9.口溶膜属于药物剂型中的膜剂,是一种口服固体速释制剂,其在舌头上可以快速溶解,并随正常吞咽动作咽下,既实现了在不方便喝水或者没有饮用水供应的情况下,方便、快速、准确地服药,而且与常见的盒装或瓶装药品相比,体积更小,便于携带,可以更好地满足快节奏、高压力都市人群的需求,尤其适合儿童、老年人及危重患者使用。
10.目前已上市了十几种口溶膜剂,例如昂丹司琼口溶膜、右美沙芬口溶膜、利培酮口溶膜、盐酸多奈哌齐口溶膜、西地那非口溶膜等。而奥氮平氟西汀复方口溶膜的开发研究正处于空窗期,无直接的技术信息参考,相关技术仅涉及奥氮平单方口溶膜、盐酸氟西汀口崩片制备工艺技术等。国内外无奥氮平氟西汀复方口溶膜相关报道。
11.奥氮平原料是淡黄色至黄色无味结晶性粉末,几乎不溶于水,易溶于氯仿,溶于二氯甲烷,极微溶于甲醇,在水性介质中的溶解度随ph的增加而降低。盐酸氟西汀为白色或类白色结晶性粉末,具有强烈的苦麻感,在甲醇或乙醇中易溶,在水和三氯甲烷中微溶,在乙醚中不溶。因此,将奥氮平、盐酸氟西汀制备成复方膜剂,解决奥氮平、盐酸氟西汀在水性基质中均匀分散,以及膜剂强烈的苦麻感、高载药量膜剂的机械性能是亟需解决的技术问题。
12.背景技术中的信息仅仅在于说明本发明的总体背景,不应视为承认或以任何形式暗示这些信息构成本领域一般技术人员所公知的现有技术。
技术实现要素:
13.本发明旨在提供一种奥氮平氟西汀口溶膜剂,实现快速崩解吸收、方便服用,提高患者用药依从性和生物利用度。具体地,本发明包括以下内容。
14.本发明的第一方面,提供一种奥氮平氟西汀复方口溶膜,其由包含以下成分的原料制备得到:
15.奥氮平10-15重量份
16.盐酸氟西汀50-60重量份
17.羟丙基倍他环糊精100-120重量份
18.羟丙甲纤维素e5 60-70重量份
19.羟丙甲纤维素e50 5.5-6.5重量份
20.聚乙二醇400 35-45重量份
21.山梨醇30-40重量份
22.吐温80 1-4重量份
23.非电荷性矫味剂2-6重量份。
24.在示例性实施方案中,本技术的奥氮平氟西汀复方口溶膜中各原料的用量为:
25.奥氮平12重量份
26.盐酸氟西汀55.9重量份
27.羟丙基倍他环糊精112重量份
28.羟丙甲纤维素e5 64重量份
29.羟丙甲纤维素e50 6.1重量份
30.聚乙二醇400 40重量份
31.山梨醇2重量份
32.吐温80 2重量份
33.非电荷性矫味剂4重量份。
34.本技术的第二方面,提供一种奥氮平氟西汀复方口溶膜的制备方法,其包括以下步骤:
35.(a)将盐酸氯西汀加入羟丙基倍他环糊精溶液分散均匀得到包含液的步骤;
36.(b)向包含液中加入山梨醇、聚乙二醇400、吐温80和非电荷性矫味剂得到溶解液的步骤;
37.(c)向溶解液中加入复合成膜材料和奥氮平,分散均匀,经高速剪切得到胶液;和
38.(d)将胶液脱气后经涂布干燥后得到所需膜片。
39.在示例性实施方案中,根据本技术的奥氮平氟西汀复方口溶膜的制备方法,其中,步骤(a)包括将处方量羟丙基倍他环糊精加入部分纯化水中,搅拌至溶解;加入适量盐酸氟西汀控制羟丙基倍他环糊精与盐酸氟西汀的重量比为1.5-3:1,再次加入剩余纯化水搅拌,得包合液。
40.在示例性实施方案中,根据本技术的奥氮平氟西汀复方口溶膜的制备方法,其中,步骤(b)中天然薄荷脑乙醇溶液通过使用无水乙醇溶解天然薄荷脑得到。
41.在示例性实施方案中,根据本技术的奥氮平氟西汀复方口溶膜的制备方法,其中,所述非电荷性矫味剂包括三氯蔗糖和/或天然薄荷脑。
42.在示例性实施方案中,根据本技术的奥氮平氟西汀复方口溶膜的制备方法,其中,步骤(c)中的复合成膜材料包括羟丙甲纤维素e5和羟丙甲纤维素e50,且两者重量之比为9-11:1。
43.在示例性实施方案中,根据本技术的奥氮平氟西汀复方口溶膜的制备方法,其中,步骤(c)中控制胶液使其浓度比为0.5-0.6。
44.在示例性实施方案中,根据本技术的奥氮平氟西汀复方口溶膜的制备方法,其中,步骤(d)中涂布时控制厚度在0.2-1mm之间。
45.在示例性实施方案中,根据本技术的奥氮平氟西汀复方口溶膜的制备方法,其中,步骤(d)的涂布包括将胶液涂布在玻璃板上,控制厚度0.6mm涂布,将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%以上至小于5%。
46.本技术提供的奥氮平氟西汀口溶膜剂,相比于奥氮平氟西汀胶囊,进一步提高患者用药依从性和生物利用度。通过采用羟丙基倍他环糊精包合盐酸氟西汀,联合使用矫味剂三氯蔗糖、天然薄荷脑,极大改善膜剂苦麻感,使膜剂口感可接受。此外,以羟丙甲纤维素e5、羟丙甲纤维素e50为成膜材料,以聚乙二醇400、山梨醇为增塑剂,制备的胶液体系稳定、静态放置不分层。制备方法既简单、方便,又可确保制备的高载药量(规格奥氮平6mg,盐酸氟西汀25mg)膜剂外观光滑平整、机械性能良好、溶解迅速,符合产品质量标准。
附图说明
47.图1不同制备条件得到的膜剂外观图。
具体实施方式
48.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
49.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为具体公开了该范围的上限和下限以及它们之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
50.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。除非另有说明,否则“%”为基于重量的百分数。
51.本技术的奥氮平氟西汀复方口溶膜,其原料包括奥氮平、盐酸氟西汀、羟丙基倍他环糊精、羟丙甲纤维素e5、羟丙甲纤维素e50、聚乙二醇400、山梨醇、吐温80和非电荷性矫味剂。
52.本技术中,奥氮平的用量一般为10-15重量份,优选11-14重量份,更优选12-13重量份,例如12
±
0.5重量份、12
±
0.3重量份。盐酸氟西汀的用量一般为50-60重量份,优选51-59重量份,更优选52-58重量份,还优选53-57重量份,进一步优选54-56重量份,例如56
±
0.5重量份、56
±
0.3重量份。如果盐酸氟西汀的用量过大,则由于其具有强烈的苦麻感,严重影响口感,致使膜剂倾向不利于制成口膜剂。另一方面,如果用量过小,倾向于达不到有效治疗效果。盐酸氟西汀与奥氮平的用量比基于重量一般为9-11:1。
53.本技术中,羟丙基倍他环糊精的用量一般为100-120重量份,优选102-118重量份,更优选104-116重量份,还优选106-114重量份,例如112
±
2重量份、112
±
1重量份、112
±
0.5重量份、112
±
0.3重量份。如果羟丙基倍他环糊精用量过大,则倾向于使制备的膜面积过大,并且也不能进一步提升包合效果。另一方面,如果用量过小,则倾向于不能实现良好的包合效果,致使膜剂口感变差。此外,一般情况下控制羟丙基倍他环糊精与盐酸氟西汀的重量比为1.5-3:1,优选2
±
0.5:1,如2:1。本技术发现羟丙基倍他环糊精不仅能够实现有效包合,而且还能与其他成分构成良好的胶液体系。而其他包合剂如树脂类包合剂则容易导致胶液体系分层,进而导致膜剂出现裂纹。其原因可能在于树脂会分解产生离子,使树脂带有电荷,从而使胶液体系中的zeta电位不稳定,由此引起胶液分层。
54.本技术中,羟丙基倍他环糊精的包合需要首先将其溶解于部分纯化水中,然后加入剩余纯化水的方法进行。其中部分纯化水的比例对于充分包合是重要的。部分纯化水的比例一般为总纯化水的0.3
±
0.1倍,优选0.3
±
0.05倍。纯化水的总使用重量与羟丙基倍他环糊精的重量比为一般为5-6:1之间。
55.本技术中,羟丙甲纤维素e5与羟丙甲纤维素e50两者共同作为成膜材料。其中,羟丙甲纤维素e5的用量一般为60-70重量份,优选61-68重量份,更优选62-66重量份,还优选64-65重量份,如64
±
0.5重量份、64
±
0.3重量份。羟丙甲纤维素e50的用量一般为5.5-6.5重量份,优选5.7-6.3重量份,更优选5.9-6.1重量份,例如6
±
0.5重量份、6
±
0.3重量份、6
±
0.2重量份、6
±
0.1重量份。
56.本技术中,需要在反应体系中进一步引入增塑剂。一般为非离子增塑剂如,聚乙二醇400、山梨醇。本发明可以使用两者或其中之一。在使用两者的情况下,聚乙二醇400的用量一般为35-45重量份,优选36-44重量份,更优选38-42重量份。山梨醇的用量一般为30-40重量份,优选32-38重量份,更优选34-36重量份。
57.本技术中,由于羟丙基倍他环糊精的表面活性较低,需要进一步添加额外的表面活性剂吐温80,其用量一般为1-4重量份,优选2-3重量份。该用量范围是根据例如羟丙基倍他环糊精等而确定的范围。
58.本技术中,仅通过羟丙基倍他环糊精的包合并不能完全解决药物的苦麻感,还需要进一步组合使用矫味剂,然而一般矫味剂的使用对于胶液体系会产生不利影响,特别是影响胶液的稳定性。本技术通过使用特定的非电荷性矫味剂在不影响胶液体系的情况下,实现进一步掩味的目的。非电荷性矫味剂包括三氯蔗糖和天然薄荷脑。两者的用量比基于重量一般为1:1。矫味剂的整体用量一般为2-6重量份,优选3-5重量份,更优选4-5重量份。本技术中,三氯蔗糖用于调节苦味,天然薄荷脑用于调节麻味。另外,三氯蔗糖、天然薄荷脑不带电荷,故胶液不发生分层。
59.实施例1
60.本实施例为奥氮平氟西汀口溶膜(6mg/25mg)及其制备工艺:
61.奥氮平氟西汀口溶膜处方组成:2000片
[0062][0063]
奥氮平氟西汀口溶膜制备方法包括:
[0064]
(1)将处方量羟丙基倍他环糊精加入至200g纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0065]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚
乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0066]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0067]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0068]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0069]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-4%进行干燥;
[0070]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小得矩形膜片。
[0071]
实施例2
[0072]
本实施例为奥氮平氟西汀口溶膜(6mg/25mg)制备工艺:
[0073]
奥氮平氟西汀口溶膜处方组成:2000片
[0074][0075][0076]
奥氮平氟西汀口溶膜制备方法包括:
[0077]
(1)将处方量羟丙基倍他环糊精加入至200g纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0078]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0079]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0080]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0081]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0082]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分4%-5%进行干燥;
[0083]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小的矩形膜片。
[0084]
对比例1
[0085]
对比例1为使用树脂包合制备奥氮平氟西汀口溶膜(6mg/25mg)的工艺:
[0086]
奥氮平氟西汀口溶膜处方组成:2000片
[0087][0088][0089]
奥氮平氟西汀口溶膜制备方法:
[0090]
(1)将处方量聚克立林钾加入至200g纯化水中,在室温下搅拌分散均匀;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得树脂包合液;
[0091]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0092]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0093]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0094]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0095]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-5%进行干燥;
[0096]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小的矩形膜片。
[0097]
对比例2
[0098]
对比例2为未包合盐酸氯西汀的奥氮平氟西汀口溶膜(6mg/25mg)制备工艺:
[0099]
奥氮平氟西汀口溶膜处方组成:2000片
[0100][0101]
奥氮平氟西汀口溶膜制备方法:
[0102]
(1)将处方量盐酸氟西汀加入至全量的纯化水中,室温下搅拌40min以上分散均匀;
[0103]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述溶液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0104]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0105]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0106]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0107]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-5%进行干燥;
[0108]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为109mg/片的适宜大小的矩形膜片。
[0109]
对比例3
[0110]
对比例3为奥氮平氟西汀口溶膜(6mg/25mg)制备工艺:
[0111]
奥氮平氟西汀口溶膜处方组成:2000片
[0112][0113]
奥氮平氟西汀口溶膜制备方法:
[0114]
(1)将处方量羟丙基倍他环糊精加入至166g纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0115]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0116]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0117]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0118]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0119]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-5%进行干燥;
[0120]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为137mg/片的适宜大小的矩形膜片。
[0121]
对比例4
[0122]
对比例4中奥氮平氟西汀口溶膜(6mg/25mg)的制备工艺:
[0123]
奥氮平氟西汀口溶膜处方组成:2000片
[0124][0125]
奥氮平氟西汀口溶膜制备方法:
[0126]
(1)将处方量羟丙基倍他环糊精加入至全量的纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,得环糊精包合液;
[0127]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0128]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0129]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0130]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0131]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-5%进行干燥;
[0132]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小的矩形膜片。
[0133]
对比例5
[0134]
对比例5中奥氮平氟西汀口溶膜(6mg/25mg)的制备工艺如下:
[0135]
奥氮平氟西汀口溶膜处方组成:2000片
[0136][0137]
奥氮平氟西汀口溶膜制备方法:
[0138]
(1)将处方量羟丙基倍他环糊精加入至1/2比例(300g)的纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0139]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
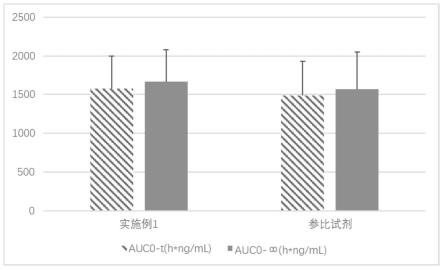
[0140]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0141]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0142]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0143]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-5%进行干燥;
[0144]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小的矩形膜片。
[0145]
对比例6
[0146]
对比例6中奥氮平氟西汀口溶膜(6mg/25mg)的制备工艺如下:
[0147]
奥氮平氟西汀口溶膜处方组成:2000片
[0148][0149]
奥氮平氟西汀口溶膜制备方法:
[0150]
(1)将处方量羟丙基倍他环糊精加入至1/3比例(275g)的纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0151]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0152]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,控制胶液浓度比为0.4;
[0153]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0154]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0155]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-5%进行干燥;
[0156]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小的矩形膜片。
[0157]
对比例7
[0158]
对比例7中奥氮平氟西汀口溶膜(6mg/25mg)的制备工艺如下:
[0159]
奥氮平氟西汀口溶膜处方组成:2000片
[0160][0161][0162]
奥氮平氟西汀口溶膜制备方法:
[0163]
(1)将处方量羟丙基倍他环糊精加入至1/3比例(157g)的纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0164]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0165]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,控制胶液浓度比为0.7;
[0166]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0167]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0168]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-5%进行干燥;
[0169]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小的矩形膜片。
[0170]
对比例8
[0171]
对比例8中奥氮平氟西汀口溶膜(6mg/25mg)的制备工艺如下:
[0172]
奥氮平氟西汀口溶膜处方组成:2000片
[0173][0174][0175]
奥氮平氟西汀口溶膜制备方法:
[0176]
(1)将处方量羟丙基倍他环糊精加入至1/3比例(188g)的纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0177]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0178]
(3)继续向上述溶液中加入聚乙烯醇pva18-88,加热至80℃搅拌溶解;溶解后降至室温,继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0179]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0180]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0181]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分3%-5%进行干燥;
[0182]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为155mg/片的适宜大小的矩形膜片。
[0183]
对比例9
[0184]
对比例9中奥氮平氟西汀口溶膜(6mg/25mg)的制备工艺如下:
[0185]
奥氮平氟西汀口溶膜处方组成:2000片
[0186][0187]
奥氮平氟西汀口溶膜制备方法:
[0188]
(1)将处方量羟丙基倍他环糊精加入至200g纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0189]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0190]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0191]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0192]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0193]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分<2%进行干燥;
[0194]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小的矩形膜片。
[0195]
对比例10
[0196]
对比例10中奥氮平氟西汀口溶膜(6mg/25mg)制备工艺:
[0197]
奥氮平氟西汀口溶膜处方组成:2000片
[0198][0199]
奥氮平氟西汀口溶膜制备方法:
[0200]
(1)将处方量羟丙基倍他环糊精加入至200g纯化水中,在室温下搅拌至溶解;加入处方量盐酸氟西汀,搅拌40min以上分散均匀,再加入剩余纯化水搅拌,得环糊精包合液;
[0201]
(2)使用无水乙醇溶解天然薄荷脑,备用;向上述包合液中加入处方量山梨醇、聚乙二醇400、吐温80、三氯蔗糖、天然薄荷脑乙醇溶液,室温搅拌至溶解;
[0202]
(3)继续向上述溶液中加入羟丙甲纤维素e5、羟丙甲纤维素e50,室温搅拌溶解;继续加入处方量奥氮平,搅拌40min以上分散均匀,再采用高速剪切机剪切10min(2min
×
5次),转速8000rpm-10000rpm,得胶液;
[0203]
(4)将胶液放入真空干燥箱中,抽真空脱气;
[0204]
(5)将胶液均匀涂布在光滑玻璃板上,控制厚度0.6mm涂布;
[0205]
(6)将涂有胶液的玻璃板放置在烘箱内60-70℃,控制水分5%-6%进行干燥;
[0206]
(7)将干燥后药膜从玻璃板上剥离,并裁切成重量为165mg/片的适宜大小的矩形膜片。
[0207]
测试例
[0208]
一、极大改善了因高剂量盐酸氟西汀(27.95mg/片)导致的膜剂苦麻感,使膜剂口感可接受,同时确保高载药量膜剂外观性状优良。
[0209]
本发明的奥氮平氟西汀口溶膜,采用羟丙基倍他环糊精包合盐酸氟西汀技术(包合用量比例为2:1),同时联合使用矫味剂三氯蔗糖、天然薄荷脑,以此达到改善膜剂苦麻感,使膜剂口感可接受,同时确保高载药量膜剂外观性状优良的目的。
[0210]
对实施例1、实施例2、对比例1、对比例2、对比例3制备的奥氮平氟西汀口溶膜进行外观性状比较及口感调查实验。考察结果如下:
[0211]
表1膜剂外观性状对比及口感调查结果
[0212][0213]
结果显示:实施例1、实施例2中膜剂外观性状优良、口感可接受;对比例1中膜剂成膜性差、有裂纹,口感较差;对比例2、对比例3中膜剂外观性状优良,但口感差、有苦麻感。
[0214]
二、控制羟丙基倍他环糊精溶于纯化水中的浓度,确保盐酸氟西汀被充分包合,最大限度上改善膜剂苦麻感
[0215]
本发明的奥氮平氟西汀口溶膜在制备过程中,将羟丙基倍他环糊精溶于1/3比例的纯化水中配制成一定浓度的溶液,加入盐酸氟西汀搅拌分散均匀,再加入剩余纯化水搅拌,以此达到充分包合盐酸氟西汀,进而最大限度上改善膜剂苦麻感的目的。
[0216]
对实施例1、实施例2、对比例4、对比例5制备的奥氮平氟西汀口溶膜进行外观性状比较及口感调查实验。考察结果如下:
[0217]
表2膜剂外观性状对比及口感调查结果
[0218][0219]
结果显示:实施例1、实施例2中膜剂外观性状优良、口感可接受;对比例4中膜剂外观性状优良、有苦麻感;对比例5中膜剂外观性状优良、稍有苦麻感。
[0220]
以上表明,将羟丙基倍他环糊精溶于1/3比例的纯化水中配制成一定浓度的溶液,加入盐酸氟西汀搅拌分散均匀,再加入剩余纯化水搅拌,可确保盐酸氟西汀被充分包合,进而最大限度上改善膜剂苦麻感。
[0221]
三、制备的胶液体系稳定、不易分层,制备的膜剂外观性状优良、口感可接受、溶解迅速
[0222]
本发明的奥氮平氟西汀口溶膜在制备过程中,采用环糊精包合盐酸氟西汀技术,控制胶液浓度比(处方量:纯化水用量)为0.55,制备的胶液体系稳定、不易分层,制备的膜剂光滑平整、机械性能良好、口感可接受、溶解迅速。
[0223]
对实施例1、实施例2、对比例6、对比例7、对比例8制备的奥氮平氟西汀口溶膜进行胶液粘度测定及膜剂外观性状、口感、溶化时限考察。考察结果如下:
[0224]
表3膜剂外观性状对比及口感调查结果
[0225][0226]
结果显示:实施例1、实施例2制备的胶液粘度相当,制备的膜剂外观性状优良、口感可接受,且溶解迅速;对比例6制备的胶液粘度较小,制备的膜剂厚度小、易拉断,稍有苦麻感;对比例7制备的胶液粘度大,制备的膜剂厚度大、表面粗糙,膜剂入口有粘稠感和砂砾感,且溶解较慢;对比例8制备的膜剂成膜性差、表面粗糙,入口有砂砾感、苦麻感,且溶解较慢。
[0227]
将实施例1制备的胶液静置24h后,考察胶液上、中、下层中奥氮平、氟西汀的含量均匀度及有关物质,并同0h对比。考察结果如下:
[0228]
表4胶液静置24h后含量均匀度变化
[0229][0230]
表5胶液静置24h后有关物质变化
[0231]
[0232]
结果显示:实施例1制备的胶液,在0h、静置24h时,胶液上、中、下层中奥氮平、氟西汀的含量均匀度均小于1%,未发生分层;在0h、静置24h时,胶液均未检出有关物质。
[0233]
综合以上结果表明,本品制备过程中,可确保制备的胶液体系稳定、不易分层,制备的膜剂光滑平整、机械性能良好、口感可接受、溶解迅速。
[0234]
四、控制膜剂干燥水分为3%-5%,制备的膜剂易揭、机械性能良好
[0235]
本发明的奥氮平氟西汀口溶膜在制备过程中,控制膜剂干燥水分为3%-5%,以此达到制备的膜剂易揭、机械性能良好的目的。
[0236]
对实施例1、实施例2、对比例9、对比例10制备的奥氮平氟西汀口溶膜进行外观性状考察及拉伸性能测试,具体操作如下:
[0237]
将以上各案例中干燥后膜剂从玻璃板上剥离,对比各膜剂成膜性、揭膜难易性、耐折性;将切割成一定面积的膜剂放置在拉断测定仪上下两个夹具中,使样品与上下夹具的中心连线重合、夹具松紧适宜,两夹具间距为60mm。以100
±
10mm/min的速度开动仪器,样品断裂后,读取拉伸强度和拉伸率。考察结果如下:
[0238]
表6膜剂外观性状对比、机械性能测试结果
[0239][0240]
结果显示:实施例1、实施例2制备的膜剂易揭,外观性状及机械性能均良好;对比例9制备的膜剂较脆、易碎,耐折性差;对比例10制备的膜剂成膜性较差、难剥离、发粘。
[0241]
以上表明,控制膜剂干燥水分为3%-5%,制备的膜剂易揭、机械性能良好。
[0242]
五、同市售品奥氮平氟西汀胶囊对比,具有更快的溶解速度及更高的生物利用度
[0243]
本发明的奥氮平氟西汀口溶膜同市售品奥氮平氟西汀胶囊(商品名symbyax,美国礼来公司研发,规格为奥氮平6mg/氟西汀25mg)对比,具有更快的溶解速度及更高的生物利用度。
[0244]
对本发明实施例1(规格为奥氮平6mg/氟西汀25mg)、市售品奥氮平氟西汀胶囊(商品名symbyax,批号c910406a批,规格为奥氮平6mg/氟西汀25mg)进行溶出曲线检测对比,以水、0.1mol/l盐酸、ph4.5磷酸盐缓冲液、ph6.8磷酸盐缓冲液为溶出介质,桨法(沉降篮)、转速为50r/min,按照《中国药典》2020年四部“9031溶出度与释放度测定法”进行测定。考察结果如下:
[0245]
表7溶出曲线考察结果对比-奥氮平累积溶出度
[0246][0247]
表8溶出曲线考察结果对比-氟西汀累积溶出度
[0248][0249][0250]
结果显示:实施例1制备的奥氮平氟西汀口溶膜,相对于市售品奥氮平氟西汀胶囊,在水、0.1mol/l盐酸、ph4.5磷酸盐缓冲液、ph6.8磷酸盐缓冲液介质中溶出更迅速,其中10min溶出量均大于85%。
[0251]
对本发明实施例1(受试制剂,规格为奥氮平6mg/氟西汀25mg)、市售品奥氮平氟西汀胶囊(参比制剂,商品名symbyax,批号c910406a批,规格为奥氮平6mg/氟西汀25mg)开展比格犬体内的生物利用度试验。试验采用双周期交叉试验设计,两周期间清洗期为7天。收集给药后不同时间点血浆样本,采用液相色谱-串联质谱法测定血浆中奥氮平、氟西汀的浓度,计算药动学参数。考察结果如下:
[0252]
表9生物利用度试验-奥氮平药动学参数
[0253]
药动学参数受试制剂(口溶膜)参比制剂(胶囊)tmax(h)1.52
±
0.253.30
±
1.22cmax(ng/ml)23.4
±
6.010.9
±
2.4auc 0-t(ng.h/ml)471
±
22.6252
±
50.6auc 0-∞(ng.h/ml)489
±
24.3273
±
42.4t1/2(h)3.88
±
0.212.86
±
0.35
[0254]
表10生物利用度试验-氟西汀药动学参数
[0255]
药动学参数受试制剂(口溶膜)参比制剂(胶囊)tmax(h)2.28
±
0.414.44
±
1.06cmax(ng/ml)40.3
±
7.218.1
±
3.3auc 0-t(ng.h/ml)1028
±
35.6724
±
80.2
auc 0-∞(ng.h/ml)1133
±
27.5736
±
76.1t1/2(h)6.13
±
0.215.01
±
0.47
[0256]
结果显示:比格犬分别给予奥氮平氟西汀口溶膜和奥氮平氟西汀胶囊后,口溶膜相对于胶囊制剂,具有更低的tmax、更高的cmax和更高的auc,表明奥氮平氟西汀口溶膜吸收更快、生物利用度更高。
[0257]
综合以上结果,可表明,本发明技术方案中制备的奥氮平氟西汀口溶膜,同市售品奥氮平氟西汀胶囊(商品名symbyax,美国礼来公司研发,规格为奥氮平6mg/氟西汀25mg)对比,具有更快的溶解速度及更高的生物利用度。
[0258]
尽管本发明已经参考示例性实施方案进行了描述,但应理解本发明不限于公开的示例性实施方案。在不背离本发明的范围或精神的情况下,可对本发明说明书的示例性实施方案做多种调整或变化。权利要求的范围应基于最宽的解释以涵盖所有修改和等同结构与功能。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。