1.本发明涉及油脂加工技术领域,特别是涉及一种漆酶交联甜菜果胶-大豆油脂体复合乳液及其制备方法和应用。
背景技术:
2.大豆(soybean)是极为重要的油料作物之一,也是蛋白和油脂的重要来源。大豆蛋白所含的人体必需氨基酸,可降低心脑血管疾病发生率。大豆脂肪中的不饱和脂肪酸,具有有益的营养特性,这些特性使其成为食品、保健和药物产品中的理想成分。大豆中还含有大量磷脂,是一种具有亲水基和疏水基的双亲分子基团的结构。大豆油脂体即是由一个磷脂单层和一层双亲性油蛋白包围的中央脂质组成。油脂蛋白可以保护油脂体抵抗环境压力,如水分变化、温度波动和氧化剂的影响。此外,大豆中还含有强抗氧化性的生育酚和可以降低血压的大豆多肽。随着对大豆制品的创新加工,大豆深得消费者喜爱,使得大豆产业不断高速发展。在食品加工过程中,大豆油脂体易受矿物元素、热循环和酸性调节的影响,降低其油脂体体系的稳定性,导致油脂体絮凝情况多见,严重影响了它们可用于食品、医疗和制药行业的产品范围。
3.目前,一些研究者通过用多糖改变液滴的界面组成来改善油脂体的物理稳定性。matsuyama等发现黄原胶分子可能与油脂体表面蛋白分子相互作用,产生具有改进表面活性的杂交结合物。此外,wang发现吸附在油脂体表面蛋白上的阿拉伯树胶可以在不同nacl浓度下稳定油水界面。su等通过分析颗粒电荷、粒径和分布,研究了阴离子多糖海藻酸钠在不同环境条件下(包括nacl、ph和冻融循环)对大豆油体乳液稳定性的影响。结果表明,用多糖海藻酸钠涂覆油脂体可以显著提高天然油脂体乳液的稳定性。mohammadi研究橄榄叶提取物在大豆油脂体中被纳米乳液包裹的抗氧化活性。通过过氧化值、tbars值和酸败热稳定性试验,纳米包覆橄榄叶提取物比未包覆橄榄叶提取物能更好地控制过氧化值。但由于酚类化合物在分散的乳化液滴中被堵塞,封装的橄榄叶提取物的热稳定性较低。wu等研究发现ph值为3和7的卡拉胶涂层的大豆油脂体乳液在蔗糖存在下经过三次冻融循环后,液滴很少聚集。这些结果表明,卡拉胶包覆大豆油脂体乳液与未包覆乳液相比具有较高的稳定性。
4.大豆品种繁多,按含量区分主要归因于两大类,即高油脂及高蛋白大豆,在当前阶段,关于油脂体的研究颇多,但是对比这两种大豆品种的油脂体研究较少。另外,随着人们生活水平的提高,消费者不仅仅只关注油脂类产品的口感和风味,更注重健康水平,因此开发一种既具有较高稳定性又能保证消化速度慢的健康油脂类产品是非有必要的。
技术实现要素:
5.本发明的目的是提供一种漆酶交联甜菜果胶-大豆油脂体复合乳液及其制备方法和应用,以解决上述现有技术存在的问题,该复合乳液易于长期稳定保存,并且其具有更慢的消化速率,容易产生饱腹感,在食品加工应用中具有重要价值。
6.为实现上述目的,本发明提供了如下方案:
7.本发明提供一种漆酶交联甜菜果胶-大豆油脂体复合乳液的制备方法,包括以下步骤:
8.(1)提取大豆油脂体:大豆种子置于水中浸泡,之后将浸泡后的种子加入nacl混合溶液,进行研磨过滤离心,收集上层乳状物,再将其分散于缓冲溶液中离心,收集上层油脂体乳状物;再将其加热,获得所述大豆油脂体;
9.(2)配制浓度为0.1wt%或0.075wt%的甜菜果胶溶液,向其中加入所述大豆油脂体后,再加入漆酶,之后高速搅拌均匀制成乳液,静置后,将所述乳液调ph至6-8,获得所述漆酶交联甜菜果胶-大豆油脂体复合乳液。
10.进一步地,在步骤(1)中,所述大豆种子与水的体积比为1:5;所述浸泡温度为4-5℃,时间为18-22h。
11.进一步地,在步骤(1)中,所述nacl混合溶液由50mmol/l tris-hcl、0.4mol/l蔗糖和0.5mol/l nacl组成,所述浸泡后的种子与所述nacl混合溶液的质量体积比为1:5。
12.进一步地,在步骤(2)中,所述大豆油脂体的加入量为所述甜菜果胶溶液的10v%。
13.进一步地,在步骤(2)中,所述大豆油脂体包括高油大豆油脂体(hosob)和高蛋白大豆油脂体(hpsob)。
14.进一步地,所述高油大豆油脂体加入至浓度为0.1wt%的甜菜果胶溶液中,所述高蛋白大豆油脂体加入至浓度为0.075wt%的甜菜果胶溶液中。
15.进一步地,在步骤(2)中,在加入所述漆酶前,先调ph至4.5;所述漆酶加入量为0.4-0.5u。
16.进一步地,在步骤(2)中,所述高速搅拌为10000rpm/min搅拌10min;所述静置时间为24h。
17.本发明还提供一种如上述的制备方法制备获得的漆酶交联甜菜果胶-大豆油脂体复合乳液。
18.本发明还提供一种如上述的漆酶交联甜菜果胶-大豆油脂体复合乳液在制备油脂产品中的应用。
19.本发明公开了以下技术效果:
20.本发明通过漆酶交联甜菜果胶-hosob以及甜菜果胶hpsob可得知,漆酶的添加使得甜菜果胶快速吸附并充分覆盖蛋白质化的脂质体表面,负电荷量增加,ζ-电势得到显著提升,同时甜菜果胶分子交联使得结构重排导致大豆油脂体复合乳液的粒径显著降低(p《0.05)。ζ-电势的增加也产生较强的斥力和空间位阻使得表面疏水性得以改善,形成了更加稳定均匀的乳液。并且通过调控乳液ph值,发现ph在6-8之间,更易于漆酶交联甜菜果胶-大豆油脂体复合乳液的长期稳定保存。最后,将制得的乳液进行模拟体外消化实验,结果表明,添加漆酶甜菜果胶的油脂体乳液经胃和肠道消化后,相比于未添加漆酶和甜菜果胶的乳液,保留了更多的液滴,可以更好的保护油脂体,并且游离脂肪酸的释放量显著降低,证明本发明的复合乳液具有更慢的消化速率,容易产生饱腹感,其在食品加工应用中具有重要价值。
附图说明
21.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
22.图1为不同浓度的甜菜果胶对大豆油脂体乳液稳定性的影响;
23.图2为甜菜果胶吸光度的测定结果;
24.图3为漆酶活性的测定结果;
25.图4为漆酶交联甜菜果胶对大豆油脂体乳液电位的影响;
26.图5为漆酶交联甜菜果胶对大豆油脂体乳液平均粒径的影响;
27.图6为漆酶交联甜菜果胶对大豆油脂体乳液表面疏水性的影响;
28.图7为漆酶交联甜菜果胶对大豆油脂体乳液乳化活性的影响;
29.图8为漆酶交联甜菜果胶对大豆油脂体乳液乳化稳定性的影响;
30.图9为漆酶交联甜菜果胶对大豆油脂体乳液稳定性的影响;
31.图10为漆酶交联甜菜果胶对大豆油脂体乳液过氧化值的影响;
32.图11为ph对漆酶交联甜菜果胶-大豆油脂体复合乳液ζ-电势的影响;
33.图12为ph对漆酶交联甜菜果胶-大豆油脂体复合乳液粒径的影响;
34.图13为ph对漆酶交联甜菜果胶-大豆油脂体复合乳液稳定性的影响;
35.图14为ph对漆酶交联甜菜果胶-大豆油脂体复合乳液过氧化值的影响;
36.图15为漆酶交联甜菜果胶对大豆油脂体模拟体外消化后ζ-电势的影响;
37.图16为漆酶交联甜菜果胶对大豆油脂体模拟体外消化后粒径的影响;
38.图17为漆酶交联甜菜果胶对大豆油脂体模拟胃消化超高分辨显微镜图像;
39.图18为漆酶交联甜菜果胶对大豆油脂体模拟肠消化超高分辨显微镜图像;
40.图19为漆酶交联甜菜果胶对大豆油脂体模拟体外消化后游离脂肪酸释放量的影响。
具体实施方式
41.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
42.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
43.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
44.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见的。本发明说明书和实施例仅是示例性的。
45.本发明所使用的材料、仪器及试剂如无特殊说明,均可由商业途径获得;所使用的实验方法如无特殊说明,均为本领域常规实验方法。
46.1实验方法
47.1.1大豆油脂体的制备
48.油脂体的提取参考tzen等和ding等的研究。大豆种子与蒸馏水体积比1:5浸泡20h(4-5℃)。与溶液(50mmol/l tris-hcl,0.4mol/l蔗糖,0.5mol/l nacl,ph 7.5,1:5w/v)混合,研磨后过滤离心30min(10000rpm/min,4℃),重复两次;收集上层乳状物后,分散于tris-hcl缓冲溶液(50mmol/l tris-hcl,ph 7.5,1:5w/v)中离心;重复三次,上层乳状物即为油脂体。将油脂体乳状液放置80℃水浴锅中加热20min,待冷却后加入0.01%nan3并置于4℃冰箱保存备用。
49.1.2油脂体基本成分的测定
50.1.2.1脂肪含量的测定
51.参照gb 5009.6—2016中的索氏抽提法。
52.1.2.2.2蛋白质含量的测定
53.参照gb 5009.5—2016中的燃烧法。
54.1.2.2.3水分含量的测定
55.参照gb 5009.3—2016中的直接干燥法。
56.1.2.2.4油脂体提取率的计算
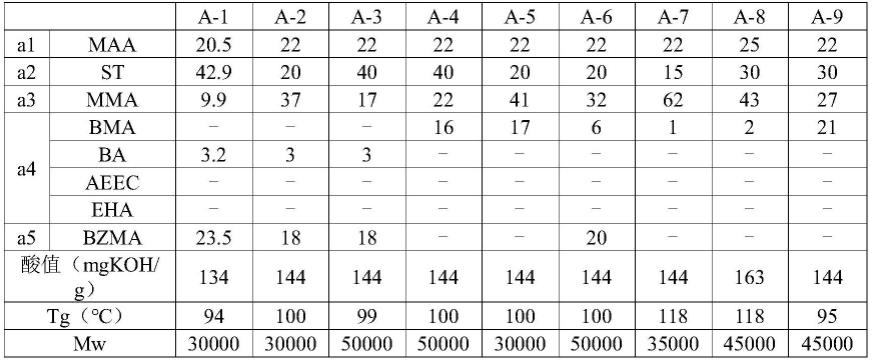
[0057][0058]
式中:
[0059]
w1——种子重量(g);w2——油脂体重量(g)。
[0060]
1.3不同浓度甜菜果胶对大豆油脂体乳液特性的影响
[0061]
1.3.1制备甜菜果胶-油脂体复合乳液
[0062]
分别配制浓度为0.025%、0.05%、0.075%、0.1%、0.15%、0.2%的甜菜果胶溶液,加热搅拌加速溶解,冷却后分别加入一定量的高油大豆油脂体(hosob)(10%)或高蛋白大豆油脂体(hpsob)乳膏(10%),调节溶液ph至4.5,使用高速分散器10000rpm/min,30min,制成均匀的乳液,室温静置24h后,乳液调ph至7,密封保存。
[0063]
1.3.2ζ-电势和平均粒径的测定
[0064]
ζ-电势和平均粒径的测定均参照zhao等的试验。
[0065]
ζ-电势的测定:稀释乳液(pbs稀释)的体积分数约为1:1000,用电位分析仪测定。
[0066]
粒径的测定:稀释乳液(pbs稀释)达到遮光度后用激光粒度仪测定。折射率:1.08。
[0067]
1.3.3表面疏水性的测定
[0068]
油脂体表面疏水性(h0)测定参照boyer的方法。样品梯度稀释0.25%、0.50%、1.00%、1.50%和2.00%(w/v)。ans(100μl,8mmol/l)加入10ml样品混匀,避光15min。激发和发射波长分别为390nm、470nm。表面疏水性指数为荧光强度与蛋白溶液质量的回归曲线
斜率。
[0069]
1.3.4乳化性质的测定
[0070]
参照pearce等的试验,将20μl乳液与4.98ml sds(0.1%)混匀。在500nm波长下测定吸光度a0,静置30min后测定吸光度a30,以sds溶液作为空白,根据公式计算:
[0071][0072][0073]
eai——乳化活性指数,m2/g
[0074]
esi——乳化稳定性指数
[0075]
n——稀释倍数,取250
[0076]
c——乳状液形成前蛋白质水溶液中蛋白质质量浓度,g/ml
[0077]
——乳状液中油相体积分数
[0078]
1.3.5乳液絮凝稳定性的测定
[0079]
取10ml样品放入样品瓶中,室温放置0d和14d后观察。
[0080]
1.3.6过氧化值的测定
[0081]
参照gb5009.227-2016中的滴定法,取1ml乳液加入5ml异辛烷:异丙醇(体积比2:1),混匀后离心,取上清液1ml加入20μl氯化亚铁、20μl硫氰酸钾溶液和5ml甲醇:正丁醇(体积比2:1),避光20min,510nm下测定,按下式计算过氧化值(peroxide value,pv):
[0082]
pv=(0.5
×a×k×
n)/(55.86
×2×
m)
[0083]
a——样品的吸光度
[0084]
k——fe3 标注曲线的斜率
[0085]
m——称取的样品中油脂的含量
[0086]
n——吸取上清液的体积分数
[0087]
1.4漆酶交联甜菜果胶对大豆油脂体乳液特性的影响
[0088]
1.4.1阿魏酸吸光度的测定
[0089]
将适量甜菜果胶稀释至1%,使用不含果胶的缓冲溶液作为空白。测量波长为200~400nm甜菜果胶的吸收光谱。
[0090]
1.4.2漆酶活性的测定
[0091]
将不同量的漆酶(0-0.5u)添加到甜菜果胶(0.075%及0.1%)样品中。25℃下325nm处测定3000s内吸光值。
[0092]
1.4.3样品前处理
[0093]
配制含有0.1%及0.075%的甜菜果胶溶液,加热搅拌加速溶解,分别加入hosob乳膏(加入量为甜菜果胶溶液体积的10%)或hpsob乳膏(10%),将ph调至4.5,再加入漆酶,用高速分散器,10000rpm/min充分搅拌10min制成均匀的乳液。室温静置24h后,乳液调ph至7,密封保存。
[0094]
1.4.4ζ-电势和平均粒径的测定
[0095]
方法同1.3.2
[0096]
1.4.5表面疏水性的测定
[0097]
方法同1.3.3
[0098]
1.4.6乳化性质的测定
[0099]
方法同1.3.4
[0100]
1.4.7乳液絮凝稳定性的测定
[0101]
方法同1.3.5
[0102]
1.4.8过氧化值的测定
[0103]
方法同1.3.6
[0104]
1.5环境因素对漆酶交联甜菜果胶-大豆油脂体复合乳液稳定性的影响
[0105]
1.5.1样品前处理
[0106]
配制含有0.1%及0.075%的甜菜果胶溶液,加热搅拌加速溶解,分别加入hosob乳膏(10%)或hpsob乳膏(10%),再加入漆酶,用高速分散器,10000rpm/min充分搅拌10min制成均匀的乳液。
[0107]
控制ph:将样品分别调至ph 2.5,6,7,8,定期取样进行测定。
[0108]
1.5.2ζ-电势和平均粒径的测定
[0109]
方法同1.3.2
[0110]
1.5.3乳液絮凝稳定性的测定
[0111]
方法同1.3.5
[0112]
1.5.4过氧化值的测定
[0113]
方法同1.3.6
[0114]
1.6漆酶交联甜菜果胶对大豆油脂体模拟体外消化特性的影响
[0115]
1.6.1乳液的配制
[0116]
分别配置含有甜菜果胶-油脂体复合乳液,以及加入漆酶后的甜菜果胶-油脂体复合乳液,以未添加甜菜果胶的油脂体乳液作为对照。
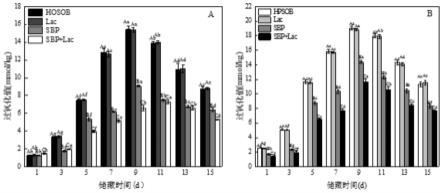
[0117]
1.6.2模拟消化液的配制
[0118]
根据chen等的静态体外消化方法,并加以改进,配制模拟消化液。
[0119]
模拟唾液:1.594g/l氯化钠、0.328g/l硝酸铵、0.636g/l磷酸二氢钾、0.202g/l氯化钾、0.308g/l二水合柠檬酸三钠盐、0.198g/l尿素、0.146g/l乳酸钠、30g/l粘液素,调节ph 6.8。
[0120]
模拟胃液:2g/l氯化钠、0.82g/l氯化钾、0.27g/l磷酸二氢钠、0.0176g/l抗坏血酸、0.65g/l葡萄糖、3.2g/l胃蛋白酶,调节ph 2.0。
[0121]
模拟肠液:218.7g/l氯化钠、36.7g/l氯化钙、1g/l牛血清白蛋白、3.4g/l碳酸氢钠、24g/l胰酶、24g/l脂肪酶、54g/l胆汁盐,调节ph 7.0。
[0122]
1.6.3模拟口腔消化
[0123]
将制备好的乳液与模拟唾液1:1混合,37℃恒温摇床(100rpm/min)消化5min。
[0124]
1.6.4模拟胃消化
[0125]
将模拟口腔消化液与模拟胃液1:1混合,37℃恒温摇床(100rpm/min)消化1h。
[0126]
1.6.5模拟肠消化
[0127]
将模拟胃消化液迅速用2m氢氧化钠调节ph 7.0,与模拟肠液1:3混合,37℃恒温摇床(100rpm/min)消化2h,定时取样进行游离脂肪酸测定。
[0128]
1.6.6游离脂肪酸测定
[0129]
参照chen等的方法采用ph-stat法对肠消化(每20min直至120min)中释放的游离脂肪酸(ffa)进行定量。由于在消化过程中ph值的变化是由于ffa的释放引起的,因此通过计算naoh中和消化液ph值的量来确定ffa的定量。ffa的释放百分比公式:
[0130]
ffa(%)=100
×
((v_naoh
×
m_naoh
×
m_lipid)/(2
×
w_lipid))
[0131]
v naoh——ph 7.0时的naoh体积(ml)
[0132]
m naoh——naoh的摩尔浓度(m)
[0133]
m lipid——大豆油的平均分子量(g/mol)
[0134]
w lipid——大豆油的总质量(g)
[0135]
1.6.7消化后油脂体超高分辨显微镜观察
[0136]
消化后的油脂体结构采用ge delta vision omx sr超高分辨显微镜进行观察。2ml稀释样品加入80μl含有0.02%nile red和0.1%nile blue a的染色液,混匀后取样于载玻片上。采用ar/k和he/ne双通道激光模式于488nm和630nm的激发波长下进行观察,acquiresr进行图像采集。
[0137]
1.6.8数据统计分析
[0138]
所得数据用spss statistics 20(spss inc.,chicago,il,usa)进行方差分析(anova);通过duncan的多重范围检验显著差异(p《0.05表示差异显著,p》0.05表示差异不显著);使用origin 2017(originlab corporation,northampton,ma,usa)作图。
[0139]
2结果与分析
[0140]
2.1甜菜果胶对大豆油脂体乳液理化稳定性的影响
[0141]
2.1.1大豆油脂体的基本组成
[0142]
hosob和hpsob的基本组成及其提取率见表1。由表可知,hpsob的提取率(5.85
±
0.06%)显著低于hosob(8.24
±
0.09%)(p《0.05),这可归因于hosob的脂肪含量较高。
[0143]
另外,由表1可知,hpsob与hosob之间的脂肪含量,蛋白质含量和水分含量均存在显著性差异(p《0.05)。hpsob和hosob的脂肪含量分别为(30.38
±
0.47)%和(42.76
±
0.44)%(p《0.05)。hpsob的蛋白质含量和水分含量分别为(8.99
±
0.02)%和(59.24
±
0.27)%,均显著高于hosob(p《0.05)。
[0144]
表1大豆油脂体基本组成及提取率
[0145][0146]
注:小写字母不同表示差异显著(p《0.05);字母相同表示差异不显著(p》0.05)。
[0147]
2.1.2甜菜果胶对大豆油脂体乳液ζ-电势的影响
[0148]
不同浓度的甜菜果胶对大豆油脂体乳液ζ-电势有影响。甜菜果胶的添加可以显著提升hosob和hpsob乳液的ζ-电势。空白对照组的hosob乳液的ζ-电势为-20.19
±
0.83mv,hpsob乳液为-21.31
±
0.55mv,两者无显著影响(p》0.05)。添加甜菜果胶的浓度为0.05%时,hosob和hpsob乳液的ζ-电势分别为-31.44
±
0.63mv和-28.13
±
0.54mv,均显著高于空白对照组的油脂体乳液(p《0.05),且二者也有显著性差异(p《0.05);随着甜菜果胶浓度的增加,hosob和hpsob乳液的ζ-电势基本呈现递增的情况。当添加量为0.2%时,hosob乳液的
ζ-电势为-35.74
±
0.42mv,显著高于hpsob乳液(-32.41
±
0.32mv)(p《0.05)。
[0149]
2.1.3甜菜果胶对大豆油脂体乳液表面疏水性的影响
[0150]
不同浓度的甜菜果胶对大豆油脂体乳液表面疏水性(h0)有影响。添加甜菜果胶可以显著提高大豆油脂体乳液的表面疏水性,当添加0.025%的甜菜果胶时,hosob和hpsob乳液的表面疏水性分别为484.80
±
8.65和454.25
±
17.07,均显著高于空白对照组的油脂体乳液(334.80
±
15.70和318.17
±
12.94)(p《0.05)。随着甜菜果胶浓度的升高,大豆油脂体乳液的表面疏水性显著增加(p《0.05)。
[0151]
2.1.4甜菜果胶对大豆油脂体乳液平均粒径的影响
[0152]
不同浓度的甜菜果胶对大豆油脂体乳液平均粒径有影响,添加甜菜果胶可以降低大豆油脂体乳液的平均粒径,当添加0.025%的甜菜果胶时,hosob和hpsob乳液的平均粒径分别为1.68
±
0.12μm和2.18
±
0.15μm,均显著低于空白对照组的油脂体乳液(7.26
±
0.20μm和8.04
±
0.13μm)(p《0.05),且二者也有显著性差异(p《0.05)。随着浓度的升高,hosob和hpsob乳液的平均粒径都逐渐变大,当添加0.2%的甜菜果胶时,hosob和hpsob乳液的平均粒径为7.34
±
0.25μm和8.17
±
0.13μm,与空白对照组的油脂体乳液无显著性差异(p》0.05)。
[0153]
2.1.5甜菜果胶对大豆油脂体乳液乳化性质的影响
[0154]
不同浓度的甜菜果胶对大豆油脂体乳液乳化性质有影响。添加甜菜果胶可以显著提高大豆油脂体乳液的乳化活性,当添加0.025%的甜菜果胶时,hosob和hpsob乳液的乳化活性分别为13.58
±
0.11m2/g和10.33
±
0.18m2/g均显著高于空白对照组的油脂体乳液(12.51
±
0.33m2/g和9.14
±
0.23m2/g)(p《0.05)。hosob乳液在添加0.1%的甜菜果胶时,eai达到最大值(15.67
±
0.41m2/g)。hpsob乳液在添加0.075%时,eai达到最大值(11.83
±
0.24m2/g)。
[0155]
不同浓度的甜菜果胶对大豆油脂体乳液乳化稳定性有影响。添加甜菜果胶可以显著提高大豆油脂体乳液的乳化稳定性,当添加0.025%的甜菜果胶时,hosob和hpsob乳液的乳化稳定性分别为123.86
±
2.86和119.30
±
3.30、均显著高于空白对照组的大豆油脂体乳液(112.67
±
3.44和102.46
±
2.80)(p《0.05)。随着多糖浓度的升高,大豆油脂体乳液的乳化稳定性呈现先增加后降低的趋势。hosob乳液在添加0.1%的甜菜果胶时,esi达到最大值(161.60
±
3.46)。hpsob乳液在添加0.075%时,esi达到最大值(144.24
±
3.31)。在同等添加量下,hosob乳液的乳化稳定性显著高于hpsob(p《0.05)。
[0156]
2.1.6甜菜果胶对大豆油脂体乳液稳定性的影响
[0157]
不同浓度的甜菜果胶对大豆油脂体乳液稳定性的影响如图1所示。由图可知,随储存时间的延长,hosob和hpsob乳液均发生了不同程度的絮凝现象。室温下贮藏15d后,两种未添加甜菜果胶的大豆油脂体乳液絮凝十分明显,添加甜菜果胶的油脂体乳液絮凝程度较低,且随着甜菜果胶添加量的增加,絮凝的现象先减弱后增强。
[0158]
2.1.7甜菜果胶对大豆油脂体乳液过氧化值的影响
[0159]
不同浓度的甜菜果胶对大豆油脂体乳液过氧化值有影响。在0-15d中,hosob和hpsob乳液的过氧化值呈现先增加后减少的趋势。从整体上看,添加甜菜果胶的油脂体乳液的氧化程度小于未添加的。
[0160]
空白对照组的hosob乳液的过氧化值在9d达到最大值15.43
±
0.38mmol/kg,添加
0.025%、0.05%、0.075%、0.1%、0.15%、0.2%甜菜果胶的hosob乳液的过氧化值同样在9d达到最大值10.63
±
0.53、11.54
±
0.27、10.36
±
0.32、9.07
±
0.08、10.88
±
0.39、11.41
±
0.40mmol/kg均显著低于空白对照组的hosob乳液(p《0.05)。
[0161]
添加0.025%、0.05%、0.075%、0.1%、0.15%、0.2%甜菜果胶的hpsob乳液的过氧化值在9d达到最大值17.47
±
0.42、16.06
±
0.23、15.38
±
0.21、16.07
±
0.37、16.39
±
0.18、16.52
±
0.32mmol/kg均显著低于空白对照组的hpsob乳液(18.98
±
0.25mmol/kg)(p《0.05)。
[0162]
综合上述,添加甜菜果胶均显著提高两种大豆油脂体的ζ-电势(p《0.05),显著降低油脂体的粒径(p《0.05)。甜菜果胶的添加可以显著改善油脂体乳液的表面疏水性、乳化性质以及絮凝现象(p《0.05),并且显著降低了0-15d内油脂体乳液的氧化程度。结合上述数据,可确定hosob的最佳添加量为0.1%的甜菜果胶,hpsob的最佳添加量为0.075%的甜菜果胶。
[0163]
2.2漆酶交联甜菜果胶对大豆油脂体乳液特性的影响
[0164]
2.2.1甜菜果胶吸光度的测定
[0165]
甜菜果胶吸光度的测定如图2所示。由图可知,甜菜果胶一个吸收光谱的最大值是在一个波长范围处(320-330nm)观察到,这是归因于阿魏酸的存在。因此,我们以325nm这个波长来测定漆酶对果胶的交联能力。
[0166]
2.2.2漆酶活性的测定
[0167]
漆酶活性的测定如图3所示。
[0168]
由图a可知,在没有漆酶的情况下,0.1%甜菜果胶溶液的吸光度没有显著变化。当将漆酶添加到0.1%甜菜果胶溶液中时,吸光度随着时间的推移而降低,这归因于酶催化的阿魏酸基团的交联。吸光度在最初的0-500s内急剧下降,然后逐渐下降。初始相对吸光度随时间的斜率(a(t)/a(0))随着漆酶浓度的增加而增加,因此我们在剩余的实验中使用了0.5u。
[0169]
由图b可知,在没有漆酶的情况下,0.075%甜菜果胶溶液的吸光度没有显著变化。当将漆酶添加到0.075%甜菜果胶溶液中时,吸光度随着时间的推移而降低,这归因于酶催化的阿魏酸基团的交联。吸光度在最初的0-500s内急剧下降,然后逐渐下降。初始相对吸光度随时间的斜率(a(t)/a(0))随着漆酶浓度的增加而增加。但在0.4u和0.5u之间,反应速率变化不大,因此我们在剩余的实验中使用了0.4u。
[0170]
2.2.3漆酶交联甜菜果胶对大豆油脂体乳液ζ-电势的影响
[0171]
漆酶交联甜菜果胶对大豆油脂体乳液电位的影响如图4所示。由图可知,漆酶交联甜菜果胶可以提高大豆油脂体复合乳液的ζ-电势。空白对照组的hosob乳液的ζ-电势为-19.27
±
0.92mv,hpsob乳液为-18.43
±
0.61mv,两者无显著影响(p》0.05)。添加漆酶后hosob乳液的ζ-电势为-19.49
±
0.56mv,hpsob乳液为-18.27
±
0.44mv,两者无显著影响(p》0.05)。添加甜菜果胶的hosob的ζ-电势为-32.83
±
0.83mv,hpsob乳液的ζ-电势为-30.41
±
0.79mv,均显著高于空白对照组的油脂体乳液(p《0.05),且二者也有显著性差异(p<0.05)。漆酶交联甜菜果胶hosob复合乳液和漆酶交联甜菜果胶hpsob复合乳液的ζ-电势分别为-41.36
±
0.94mv和-40.99
±
0.83mv,均显著高于添加甜菜果胶的油脂体乳液(p《0.05),二者无显著性差异(p》0.05)。
[0172]
2.2.4漆酶交联甜菜果胶对大豆油脂体乳液平均粒径的影响
[0173]
漆酶交联甜菜果胶对大豆油脂体乳液平均粒径的影响如图5所示。由图可知,漆酶交联甜菜果胶可以降低大豆油脂体复合乳液的平均粒径,空白对照组的hosob乳液的平均粒径为7.04
±
0.28μm,hpsob乳液为7.84
±
0.29μm,两者有显著影响(p《0.05)。添加漆酶后hosob乳液的平均粒径为7.21
±
0.30μm,hpsob乳液为7.96
±
0.27μm,均未显著高于空白对照组的油脂体乳液(p》0.05),而二者有显著性差异(p《0.05)。添加甜菜果胶的hosob的平均粒径为4.03
±
0.24μm,hpsob乳液的平均粒径为4.59
±
0.19μm,均显著高于空白对照组的油脂体乳液(p《0.05),且二者也有显著性差异(p《0.05)。漆酶交联甜菜果胶hosob复合乳液和漆酶交联甜菜果胶hpsob复合乳液的平均粒径分别为2.61
±
0.11μm和2.89
±
0.12μm,均显著高于添加甜菜果胶的油脂体乳液(p《0.05),二者有显著性差异(p《0.05)。
[0174]
2.2.5漆酶交联甜菜果胶对大豆油脂体乳液表面疏水性的影响
[0175]
漆酶交联甜菜果胶对大豆油脂体乳液表面疏水性(h0)的影响如图6所示。由图可知,漆酶交联甜菜果胶可以提高大豆油脂体复合乳液的表面疏水性,空白对照组的hosob乳液的表面疏水性为346.27
±
13.13,hpsob乳液为322.21
±
11.24,两者有显著影响(p《0.05)。添加漆酶后hosob乳液的表面疏水性为335.42
±
15.62,hpsob乳液为312.62
±
10.27,均未显著高于空白对照组的油脂体乳液(p》0.05),而二者有显著性差异(p《0.05)。添加甜菜果胶的hosob的表面疏水性为564.46
±
14.83,hpsob乳液的表面疏水性为534.74
±
12.29,均显著高于空白对照组的油脂体乳液(p《0.05),且二者也有显著性差异(p《0.05)。漆酶交联甜菜果胶hosob复合乳液和漆酶交联甜菜果胶hpsob复合乳液的表面疏水性分别为678.85
±
23.84和668.56
±
21.47,均显著高于添加甜菜果胶的油脂体乳液(p《0.05),二者无显著性差异(p》0.05)。
[0176]
2.2.6漆酶交联甜菜果胶对大豆油脂体乳液乳化性质的影响
[0177]
漆酶交联甜菜果胶对大豆油脂体乳液乳化性质的影响如图7和图8所示。由图7可知,漆酶交联甜菜果胶可以显著提高大豆油脂体复合乳液的乳化活性,空白对照组的hosob乳液的乳化活性为12.39
±
0.43,hpsob乳液为10.03
±
0.32,两者有显著影响(p《0.05)。添加漆酶后hosob乳液的乳化活性为12.55
±
0.32,hpsob乳液为10.09
±
0.25,均未显著高于空白对照组的油脂体乳液(p》0.05),而二者有显著性差异(p《0.05)。添加甜菜果胶的hosob的乳化活性为15.76
±
0.42,hpsob乳液的乳化活性为14.16
±
0.32,均显著高于空白对照组的油脂体乳液(p《0.05),且二者也有显著性差异(p《0.05)。漆酶交联甜菜果胶hosob复合乳液和漆酶交联甜菜果胶hpsob复合乳液的乳化活性分别为17.49
±
0.40和16.35
±
0.44,均显著高于添加甜菜果胶的油脂体乳液(p《0.05),且二者也有显著性差异(p《0.05)。
[0178]
漆酶交联甜菜果胶对大豆油脂体乳液乳化稳定性的影响如图8所示。由图可知,漆酶交联甜菜果胶可以显著提高大豆油脂体复合乳液的乳化稳定性。添加漆酶后hosob乳液的乳化稳定性为117.42
±
3.76,hpsob乳液为98.85
±
3.12,均未显著高于空白对照组的油脂体乳液(115.26
±
4.01和97.15
±
2.77)(p》0.05),而二者有显著性差异(p《0.05)。添加甜菜果胶的hosob的乳化稳定性为159.85
±
3.35,hpsob乳液的乳化稳定性为144.16
±
4.013,均显著高于空白对照组的油脂体乳液(p《0.05),且二者也有显著性差异(p《0.05)。漆酶交联甜菜果胶hosob复合乳液和漆酶交联甜菜果胶hpsob复合乳液的乳化稳定性分别为182.89
±
3.69和174.71
±
2.28,均显著高于添加甜菜果胶的油脂体乳液(p《0.05),且二者
也有显著性差异(p《0.05)。
[0179]
2.2.7漆酶交联甜菜果胶对大豆油脂体乳液稳定性的影响
[0180]
漆酶交联甜菜果胶对大豆油脂体乳液稳定性的影响如图9所示。以无任何添加物的油脂体乳液作为空白对照组,由图可知,随储存时间的延长,hosob和hpsob乳液均发生了不同程度的聚集和絮凝现象。室温下贮藏15d后,只添加漆酶(lac)的油脂体乳液絮凝现象与无任何添加物的油脂体乳液无明显差异,添加了甜菜果胶(sbp)的大豆油脂体乳液出现轻微的乳析,漆酶交联甜菜果胶(lac sbp)的油脂体乳液絮凝程度最低。
[0181]
2.2.8漆酶交联甜菜果胶对大豆油脂体乳液过氧化值的影响
[0182]
漆酶交联甜菜果胶对大豆油脂体乳液过氧化值的影响如图10所示。由图可知,在0-15d中,漆酶交联甜菜果胶-大豆油脂体复合乳液的过氧化值呈现先增加后减少的趋势。从整体上看,漆酶交联甜菜果胶-大豆油脂体复合乳液的氧化程度小于只添加甜菜果胶的大豆油脂体乳液。
[0183]
空白对照组的hosob乳液的过氧化值在9d达到最大值15.27
±
0.40mmol/kg,添加漆酶后hosob乳液的过氧化值在9d达到最大值15.39
±
0.24mmol/kg,添加甜菜果胶的hosob乳液的过氧化值在9d达到最大值9.04
±
0.095mmol/kg,漆酶交联甜菜果胶hosob复合乳液在10d达到最大值7.24
±
0.22mmol/kg,显著低于添加甜菜果胶的hosob乳液(p《0.05)。
[0184]
空白对照组的hpsob乳液的过氧化值在9d达到最大值19.06
±
0.26mmol/kg,添加漆酶后hpsob乳液的过氧化值在9d达到最大值18.86
±
0.21mmol/kg,添加甜菜果胶的hpsob乳液的过氧化值在9d达到最大值14.40
±
0.23mmol/kg,漆酶交联甜菜果胶hpsob复合乳液在9d达到最大值11.68
±
0.36mmol/kg,显著低于添加甜菜果胶的hpsob乳液(p《0.05)。
[0185]
2.3ph对漆酶交联甜菜果胶-大豆油脂体复合乳液理化性质影响
[0186]
2.3.1ph对漆酶交联甜菜果胶-大豆油脂体复合乳液ζ-电势的影响
[0187]
ph对漆酶交联甜菜果胶-大豆油脂体复合乳液ζ-电势的影响如图11所示,以ph 7条件为对照组。由图可知,ph 2.5、ph 6条件下的漆酶交联甜菜果胶-高油大豆油脂体复合乳液ζ-电势分别为-24.66
±
0.53mv、-35.20
±
0.99mv,均显著低于对照组(-41.66
±
0.96mv)(p《0.05),ph 8条件下复合乳液的电位为-42.41
±
0.66mv,与对照组的电位无显著性差异(p》0.05)。
[0188]
漆酶交联甜菜果胶-高蛋白大豆油脂体复合乳液在ph 2.5、ph 6条件下ζ-电势为-20.69
±
0.30mv、-27.47
±
0.64mv,均显著低于对照组(-37.21
±
0.86)(p《0.05),ph 8条件下复合乳液的电位为-36.45
±
0.49mv,与对照组的ζ-电势无显著性差异(p》0.05)。
[0189]
2.3.2ph对漆酶交联甜菜果胶-大豆油脂体复合乳液粒径的影响
[0190]
ph对漆酶交联甜菜果胶-大豆油脂体复合乳液粒径的影响如图12所示,以ph 7条件为对照组。由图可知,ph 2.5、ph 6条件下的漆酶交联甜菜果胶hosob复合乳液粒径分别为19.61
±
0.95μm、7.51
±
0.30μm,均显著低于对照组(2.80
±
0.36μm)(p《0.05),ph 8条件下复合乳液的粒径为3.19
±
0.12μm,与对照组的粒径无显著性差异(p》0.05)。
[0191]
漆酶交联甜菜果胶hpsob复合乳液在ph 2.5、ph 6条件下粒径为-23.45
±
1.03μm、8.71
±
0.20μm,均显著低于对照组(3.13
±
0.20μm)(p《0.05),ph 8条件下复合乳液的粒径为4.11
±
0.12μm,与对照组的粒径无显著性差异(p》0.05)。
[0192]
2.3.3ph对漆酶交联甜菜果胶-大豆油脂体复合乳液稳定性的影响
[0193]
ph对漆酶交联甜菜果胶-大豆油脂体复合乳液稳定性的影响如图13所示,以ph 7为对照组,由图可知室温贮存15d后,ph 2.5的大豆油脂体复合乳液发生均较为明显的絮凝现象,但ph 6、ph 8与对照组相比,复合乳液的絮凝现象差异不显著。
[0194]
2.3.4ph对漆酶交联甜菜果胶-大豆油脂体复合乳液过氧化值的影响
[0195]
ph对漆酶交联甜菜果胶-大豆油脂体复合乳液的过氧化值的影响如图14所示。以ph 7条件为对照组。由图可知,在0-15d中,漆酶交联甜菜果胶-大豆油脂体复合乳液的过氧化值呈先升高后降低的趋势。
[0196]
由图a可知,ph 2.5、ph 6、ph 8及对照组均在第11d时达到最大值,分别为13.32
±
0.30mmol/kg、8.87
±
0.20mmol/kg、7.79
±
0.14mmol/kg及7.25
±
0.22mmol/kg。
[0197]
由图b可知,ph 2.5、ph 6及对照组均在第9d时达到最大值,分别为16.45
±
0.40mmol/kg、12.85
±
0.17mmol/kg及11.67
±
0.36mmol/kg。ph 8条件下的hpsob复合乳液则在第11d达到最大值为10.74
±
0.35mmol/kg。
[0198]
综合上述,将漆酶交联甜菜果胶-大豆油脂体复合乳液调ph至6-8,更利于乳液的稳定性保存。
[0199]
2.4漆酶交联甜菜果胶对大豆油脂体模拟体外消化特性的影响
[0200]
2.4.1漆酶交联甜菜果胶对大豆油脂体模拟体外消化后ζ-电势的影响
[0201]
漆酶交联甜菜果胶对大豆油脂体模拟体外消化后ζ-电势的影响如图15所示,图a表示模拟胃液消化后油脂体复合乳液的ζ-电势。由图可知,未添加甜菜果胶的hosob及hpsob复合乳液经胃消化后表面均带正电荷,其ζ-电势分别为12.20
±
0.19mv及9.36
±
0.26mv,在添加甜菜果胶后的hosob及hpsob复合乳液的ζ-电势均由正变为负,分别为-20.02
±
0.45mv及-15.91
±
0.16mv,显著高于未添加的(p《0.05)。漆酶交联甜菜果胶hosob及hpsob复合乳液的ζ-电势分别为-25.76
±
0.19mv及-19.40
±
0.17mv,显著高于只添加甜菜果胶的(p《0.05)。
[0202]
图b表示模拟肠液消化后油脂体的ζ-电势。由图可知,未添加甜菜果胶的hosob及hpsob复合乳液经肠消化后的ζ-电势分别为-8.27
±
0.33mv及-6.43
±
0.11mv,在添加甜菜果胶后的hosob及hpsob复合乳液的ζ-电势分别为-11.33
±
0.46mv及-10.41
±
0.39mv,显著高于未添加的(p《0.05)。漆酶交联甜菜果胶hosob及hpsob复合乳液的ζ-电势分别为-14.36
±
0.44mv及-12.69
±
0.33mv,显著高于只添加甜菜果胶的(p《0.05)。
[0203]
2.4.2漆酶交联甜菜果胶对大豆油脂体模拟体外消化后粒径的影响
[0204]
漆酶交联甜菜果胶对大豆油脂体模拟体外消化后粒径的影响如图16所示,图a表示模拟胃液消化后油脂体复合乳液的粒径。由图可知,未添加甜菜果胶的hosob及hpsob复合乳液经胃消化后的粒径分别为0.46
±
0.05μm及0.63
±
0.01μm。在添加甜菜果胶后的hosob及hpsob复合乳液的粒径分别为0.65
±
0.03μm及0.83
±
0.03μm,显著高于未添加的(p《0.05),漆酶交联甜菜果胶hosob及hpsob复合乳液的粒径分别为0.83
±
0.01μm及0.97
±
0.04μm,显著高于只添加甜菜果胶的(p《0.05)。
[0205]
图b表示模拟肠液消化后油脂体复合乳液的粒径。由图可知,未添加甜菜果胶的hosob及hpsob复合乳液经肠消化后的粒径分别为0.11
±
0.00μm及0.15
±
0.00μm。在添加甜菜果胶后的hosob及hpsob复合乳液的粒径分别为0.21
±
0.01μm及0.24
±
0.01μm,显著高于未添加的(p《0.05),漆酶交联甜菜果胶hosob及hpsob复合乳液的粒径分别为0.31
±
0.01μm
及0.33
±
0.00μm,显著高于只添加甜菜果胶的(p《0.05)。
[0206]
2.4.3漆酶交联甜菜果胶对大豆油脂体模拟体外消化后微观结构
[0207]
漆酶交联甜菜果胶对大豆油脂体模拟体外消化后微观结构如图17和图18所示。图17表示经过胃消化后大豆油脂体复合乳液的超高分辨显微镜图像,其中,红色表示油脂体表面蛋白,绿色为液滴中的脂质。由图可知,与未添加甜菜果胶的油脂体相比,甜菜果胶hosob复合乳液及甜菜果胶hpsob复合乳液经1h的模拟胃消化后均能保留较多的液滴;与未添加漆酶的油脂体相比,漆酶交联甜菜果胶hosob复合乳液及漆酶交联甜菜果胶hpsob复合乳液保留更多的液滴,并且大多数脂质液滴仍然包裹在蛋白质中,结构未被破坏。其中,漆酶交联甜菜果胶hosob复合乳液的液滴比漆酶交联甜菜果胶hpsob复合乳液的更加密集。综上可知漆酶交联甜菜果胶-大豆油脂体在胃消化过程中可以更好的保护油脂体。
[0208]
图18表示经过肠消化后大豆油脂体复合乳液的超高分辨显微镜图像,其中,红色表示油脂体表面蛋白,绿色为液滴中的脂质。由图可知,hosob复合乳液及hpsob复合乳液经肠道消化2h后油脂体液滴数量明显减少。与未添加漆酶的油脂体相比,漆酶交联甜菜果胶hosob复合乳液及漆酶交联甜菜果胶hpsob复合乳液保留更多的液滴,这与胃消化结果相似。
[0209]
2.4.4漆酶交联甜菜果胶对大豆油脂体模拟体外消化后游离脂肪酸释放量的影响
[0210]
漆酶交联甜菜果胶对大豆油脂体模拟体外消化后游离脂肪酸释放量的影响如图19所示。由图可知,在模拟肠消化过程中,0-40min游离脂肪酸释放速率较快,随后逐渐减慢,80-120min游离脂肪酸释放量趋于平稳。
[0211]
由图a可知,模拟肠消化120min后,添加甜菜果胶的hosob复合乳液游离脂肪酸释放量为22.82
±
0.48%,显著低于未添加甜菜果胶的(24.64
±
0.51%)(p《0.05)。漆酶交联甜菜果胶的hosob复合乳液游离脂肪酸释放量为21.03
±
0.35%,显著低于未添加漆酶的(p《0.05)。
[0212]
由图b可知,模拟肠消化120min后,添加甜菜果胶的hpsob复合乳液游离脂肪酸释放量为20.69
±
0.50%,显著低于未添加甜菜果胶的(22.24
±
0.53%)(p《0.05)。漆酶交联甜菜果胶的hpsob复合乳液游离脂肪酸释放量为19.34
±
0.43%,显著低于未添加漆酶的(p《0.05)。
[0213]
3结论
[0214]
经过模拟胃液消化后,由于乳液的ph低于蛋白的等电点(ph 4.3左右),使得乳液中含有大量的h
,中和了油脂体表面的负电荷,乳液的ζ-电势由负转正。由于甜菜果胶属于阴离子多糖,与油脂体表面蛋白共价交联后乳液的ζ-电势仍呈现负值,添加漆酶后大豆油脂体复合乳液的ζ-电势(绝对值)更高。经过模拟肠液消化后,所有样品的ζ-电势均呈现负值,并且添加甜菜果胶的油脂体乳液的ζ-电势(绝对值)显著高于未添加的(p《0.05),添加漆酶甜菜果胶油脂体乳液的ζ-电势(绝对值)显著高于未添加漆酶的(p《0.05)。与消化前相比,所有样品的ζ-电势(绝对值)都是降低的。这可能是由于强酸条件下,当ph改变、酶水解等引起乳液环境异常,乳液体系稳定性下降。
[0215]
与未添加甜菜果胶的相比,添加甜菜果胶的油脂体复合乳液的粒径显著增大(p《0.05),而本发明制备的酶交联甜菜果胶-大豆油脂体复合乳液的粒径显著高于未添加漆酶的(p《0.05)。这可能是因为甜菜果胶共价交联油脂体表面蛋白形成双层或多层的保护涂
层,以阻止胃蛋白酶与油脂体表面的酶作用位点接触。但是,未添加甜菜果胶的油脂体表面蛋白会被胃蛋白酶水解成小分子多肽,导致乳液网络结构破坏,易引起乳液发生絮凝。经过消化后,所有样品的粒径会进一步降低,这是因为脂肪酶会酶解大豆油脂体里面的三酰甘油酯,生成单甘油酯以及游离脂肪酸,粒径大的油脂体更易被分解,从而导致粒径变小。有甜菜果胶保护涂层的油脂体乳液粒径高于未添加的,这是因为涂层保护了部分油脂体被水解。
[0216]
与未添加甜菜果胶相比,添加甜菜果胶的大豆油脂体乳液经胃消化后保留了更多的液滴;添加漆酶甜菜果胶油脂体乳液保留的液滴多于未添加漆酶的,且大多数蛋白仍然包裹着脂质,油脂体结构并未破坏。经过肠道消化后,液滴会被进一步变小,这是由于油脂体表面蛋白被酶解后,肠液里的各种酶类可以直接作用在脂类上;另外,由于油脂体表面蛋白被破坏,肠液里的胆盐和其他矿物离子会导致油滴之间发生聚集,从图中绿点分布可以看出。添加漆酶甜菜果胶的油脂体可以看到更多的红色蛋白信号,这表明甜菜果胶与油脂体表面蛋白相互作用影响蛋白的消化,表明该方式下的乳液具有良好的抗水解稳定性。
[0217]
肠液消化时会降低游离脂肪酸释放率,这由于释放出的脂肪酸会堆积在油脂体表面限制了脂肪酶与脂质的接触。与未添加甜菜果胶相比,添加甜菜果胶的油脂体乳液的脂肪酸释放率会显著降低,这归因于甜菜果胶在液滴表面形成双层或多层的保护涂层,降低了胃蛋白酶以及脂肪酶与蛋白和脂质的结合,减缓了脂肪酸的释放。此外,甜菜果胶还会与乳液中的钙离子结合,阻止了钙离子去除油脂体表面堆积的长链脂肪酸,从而降低了脂肪酸的释放。脂肪消化速率的降低会影响胃肠道的生理功能,可能会产生饱腹感。因此,漆酶交联甜菜果胶大豆油脂体复合乳液有着广泛的应用价值。
[0218]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。