ada应答特异性化测定
1.本发明属于确定和定量对治疗性抗体(药物)的抗药物应答的测定领域。利用本文所报道的测定,能够确定样品(尤其是血浆样品)中抗药物抗体(ada)的空间结合区。
背景技术:
2.当今开发中的许多生物治疗药物旨在实现多种功能和复杂的作用机制。这可以通过掺入多个功能结构域和/或特定氨基酸序列的工程化来达成。
3.然而,所有治疗性蛋白质都有可能在受体动物(临床前)或人类(临床)生物体中诱导抗药物抗体(ada)。临床相关的ada可能会影响生物治疗剂的功效和/或安全性。免疫原性评估策略评估结合和中和ada,并使用基于风险的方法确定对于额外的表征(例如,表位、滴度等)的需要。
4.ada表征可以影响对给定治疗剂的风险状况的解释,并提供对风险缓解和管理机会的深刻理解。
5.这对于慢性疾病的治疗具有特定相关性,该慢性疾病例如amd和dme,因为该治疗旨在应用数月或甚至数年。如果发生免疫应答,则重要的是理解该应答针对的是分子的哪个区或结构域。这样,信息得以收集,无论例如分子的可以被再工程化(例如去除潜在的t细胞表位)的工程化的部分是否是免疫原性的,或者该免疫原性应答是否针对生物治疗剂的抗原结合部分(hvr),即分子的基本内在特性。然后可以开发适当的风险缓解策略。
6.已建立的用于免疫原性应答或抗药物抗体(ada)表征的方法是经典的结构域竞争测定和结构域检测测定(dca、dda;参见例如hoofring,s.a.等人,bioanal.5(2013)1041-1055;gorovits,b.等人,j.immunol.meth.408(2014)1-12;stubenrauch,k.等人,j.pharm.biomed.anal.114(2015)296-304)。在此,药物候选物被切割成单个结构域或者特定的亚片段被重组表达,以允许开发结构域特异性ada测定。这些广泛使用的方法对于大型蛋白质分子(例如igg或igg样形式和融合蛋白)具有特别的价值。对于较小的生物治疗剂,例如单链fv片段(scfv)、fab片段或双特异性fab,以上方法具有局限性,因为这些分子通常不容易切割成亚结构域或者这些亚结构域具有稳定性倾向(stability liability)。因此,需要替代的、更普遍适用的方法。
7.基于竞争/抑制的ada检测方法的缺点,尤其是考虑到混合亲和力和混合互补位ada应答已经由hoofring等人(bioanal.5(2013)1041-1055)和stubenrauch等人(j.pharm.biomed.anal.10(2015)296-304)报道。
8.wo 2018/178307报告了改进的免疫原性测定,该测定能够将中和性抗药物抗体和非中和性抗药物抗体进行区分。更详细地,其报道了一种测定/方法,其在存在足量、且优选过量的基于免疫球蛋白单可变结构域(isv)的药物的无效变体的情况下进行,使得大多数,且优选所有的非中和性ada,尤其是与存在于基于isv的药物中的isv框架序列结合的ada,与测定反应混合物中的无效变体结合,而不是与基于isv的药物结合,因此基本上只检测或测量了针对基于isv的药物的中和ada(即使当样品还包含针对基于isv的药物的非中和ada时)。在无效变体中,只有个别残基已经改变,但没有完整的cdr序列。
9.stubenrauch等人报道了关于针对靶向免疫细胞因子的ada应答的表位表征(j.pharmaceut.biochem.anal.114(2015)296-304)。
10.stubenrauch等人报道了关于生物传感器免疫测定的评估,其用于以替换标准进行对照而同时表征人抗托珠单抗tocilizumab抗体的同种型和结合区(anal.biochem.390(2009)189-196)。
11.zhu等人报道了关于通过一步克隆构建大型初始人噬菌体展示的fab文库(methods.mol.biol.1045(2009)129-142)。
技术实现要素:
12.为广泛的适应症提供量身定制的特性和功能的许多生物制剂目前正在开发中。在治疗性抗体的临床前开发期间,尤其重要的是评估针对该化合物的免疫应答,以及关于其对药代动力学特征、靶标结合特性、安全性和有效性的潜在影响。
13.本发明涉及一种分析方法,该分析方法允许将在诸如食蟹猴的实验动物中的治疗性抗体(例如双特异性fab)的不同结构域的免疫原性进行分类。在根据本发明的方法中,分子工程方法与结构域检测测定相结合。本发明至少部分基于以下发现:通过以人种系序列替换fab中的单个抗原结合区,即互补位,可以区分针对两个靶标结合互补位中的任一者的抗药物抗体(ada)以及双特异性fab的恒定部分。根据本发明的方法尤其是对于较小的生物治疗剂,例如fab或scfv片段,具有有利的特性。该方法允许使用易于产生的工具变体抗体对ada应答进行可靠的表征并对临床前的免疫原性更好的理解。
14.不受该理论束缚,考虑到现有已知方法,根据本发明的方法提供了改进,尤其是提供了更简单的可行性以及关于假阴性结果的更高可靠性。第二个优点至少部分基于直接捕获治疗性抗体的变体,在该治疗性抗体的变体中至少一个完整的hvr已经由完整的非结合hvr替换,由此阻止了相应抗hvr抗药物抗体,即在错误的位置的结合。使用变体的方法,其中替换了hvr中仅部分残基或仅个别残基以产生非靶标结合治疗性抗体,并因此其中尽管消除了靶标结合但保持了部分互补位,更容易出现假阴性结果。这是因为与治疗性抗体互补位的剩余残基特异性结合的中和抗体仍然可能会干扰。
15.本发明的一个方面在于一种生物分析方法,该方法用于在将治疗性抗体应用给诸如食蟹猴的实验动物之后的免疫原性应答表征。
16.本发明至少部分基于以下发现:通过将分子工程化方法与有效且易于设置的结构域检测测定相结合,可以以简单且可靠的方式确定和定量对治疗性抗体的抗药物应答的空间位置。已经发现,通过由人种系序列替换个别抗原结合区,该测定能够对针对靶标结合互补位的抗药物抗体(ada)以及治疗性抗体的恒定部分进行区分。已经进一步发现,与及时和全面的试剂开发相结合,根据本发明的测定尤其对于诸如scfvs和fabs的较小的治疗性抗体是有利的。使用根据本发明的测定,可以实现ada应答的可靠表征和对临床前免疫原性的更好的理解。根据本发明的方法可以应用于任何治疗性抗体或抗体形式以获得ada表位信息,只要互补位由vh/vl对形成,借此与本领域已知的方法相比,减少了产生具有去除的互补位所需的参考抗体的努力。
17.更详细地,本文报道了一种新颖的生物分析方法,该方法用于通过将相应抗原结合位点/互补位回复突变为人种系序列来表征针对治疗性抗体(尤其是双特异性抗体fab片
段)的免疫原性应答,从而消除了即例如针对抗原1、抗原2或该两种抗原的结合特异性。根据本发明的结构域检测测定基于治疗性抗体的这些变体。通过使用这些变体,可以对针对第一种特异性和第二种特异性、两种特异性的抗药物抗体(ada),以及分子的恒定部分进行区分。除此以外,改进在于减少了产生治疗性抗体的互补位变体所需的努力。
18.本发明的一个方面在于一种用于确定与治疗性抗体(抗药物抗体)特异性结合的抗体的表位的方法,该方法包括以下步骤:
19.a)将包括血清和与治疗性抗体特异性结合的抗体的样品分别与以下项进行培养
20.i)所述治疗性抗体的至少一个fab片段,和
21.ii)治疗性抗体的至少一个fab片段,其中至少一个(完整的)
22.hvr已经由(完整的)非结合hvr替换,
23.检测与治疗性抗体特异性结合的抗体与i)至ii)任一项中的至少一个fab片段的结合或非结合,
24.以及
25.b)确定与治疗性抗体特异性结合的抗体的表位
[0026]-在已经在ii)中被替换的至少一个(完整的)hvr中,前提是
[0027]
在i)中检测到结合
[0028]
以及
[0029]
在ii)中检测到非结合,
[0030]-在已经在ii)中被替换的至少一个(完整的)hvr的hvr框架结中、或在框架区中、或在恒定结构域中,前提是
[0031]
在i)和ii)中检测到结合。
[0032]
在根据本发明的方法的一个实施例中,步骤a)进一步包括
[0033]
iii)治疗性抗体的至少一个fab片段,其中全部hvr已经由非结合hvr(完整地)替换,
[0034]
并且检测与治疗性抗体特异性结合的抗体与至少一个fab片段在i)至iii)的任一项中的结合或非结合,
[0035]
且步骤b)为
[0036]
确定与治疗性抗体特异性结合的抗体的表位
[0037]-在已经在ii)中被替换的至少一个(完整的)hvr中,前提是
[0038]
在i)中检测到结合
[0039]
以及
[0040]
在ii)和iii)中检测到非结合,
[0041]-在已经在ii)中被替换的至少一个(完整的)hvr的hvr框架区结中,前提是
[0042]
在i)和ii)中检测到结合
[0043]
以及
[0044]
在iii)中检测到非结合。
[0045]-在框架区和/或恒定结构域中,前提是
[0046]
在i)至iii)中检测到结合。
[0047]
在根据本发明的方法的一个实施例中,步骤a)进一步包括
[0048]
iv)治疗性抗体的一个或多个其他至少fab片段,其中与ii)的hvr不同的至少一个(完整的)hvr已经由(完整的)非结合hvr替换,
[0049]
并且检测与治疗性抗体特异性结合的抗体与至少一个fab片段在i)、ii)和iv)以及如果存在的iii)的任一项中的结合或非结合,
[0050]
且步骤b)为
[0051]
确定与治疗性抗体特异性结合的抗体的表位
[0052]-在已经在ii)或iv)中被替换的至少一个(完整的)hvr中,前提是
[0053]
在i)中检测到结合,
[0054]
以及
[0055]
在ii)或iv)以及如果存在的iii)之一中检测到非结合,
[0056]-在已经在ii)或iv)中被替换的至少一个hvr的hvr的框架区结中,前提是
[0057]
在i)、以及ii)或iv)之一中检测到结合,
[0058]
以及
[0059]
在如果存在的iii)中检测到非结合,
[0060]-任选地在框架区和/或恒定结构域中,前提是
[0061]
在i)、ii)、iv)以及如果存在的iii)中检测到结合。
[0062]
在根据本发明的方法的一个实施例中,步骤a)进一步包括
[0063]
v)来自种系的非结合抗体的至少一个fab片段,其不同于治疗性抗体的框架区的fab片段,
[0064]
且步骤b)为
[0065]
确定与治疗性抗体特异性结合的抗体的表位
[0066]-在已经在ii)或如果存在的iv)中被替换的至少一个(完整的)hvr中,前提是
[0067]
在i)中检测到结合
[0068]
以及
[0069]
在ii)和v)、如果存在的iii)以及如果存在的iv)中检测到非结合,
[0070]-在已经在ii)或如果存在的iv)中被替换的至少一个(完整的)hvr的hvr的框架区结中,前提是
[0071]
在i)以及ii)或者如果存在的iv)之一中检测到结合,
[0072]
以及
[0073]
在v)和如果存在的iii)中检测到非结合,
[0074]-在框架区和/或恒定结构域中,前提是
[0075]
在i)和ii)以及如果存在的iii)和如果存在的iv)中检测到结合,
[0076]
以及
[0077]
在v)中检测到非结合。
[0078]
在根据本发明的方法的一个实施例中,(完整的)非结合hvr是从与治疗性抗体的框架区相同的种系获得的(完整的)种系hvr。
[0079]
在根据本发明的方法的一个实施例中,治疗性抗体是单特异性fab或双特异性fab。
[0080]
在根据本发明的方法的一个实施例中
[0081]-所述治疗性抗体是双特异性fab,其中第一互补位由hvr h-1、h-3和l-2形成,且第二互补位由hvr h-2、l-1和l-3形成,
[0082]-在步骤a)中步骤ii)为
[0083]
治疗性抗体,其中(完整的)hvr h-1、h-3和l-2已经由(完整的)非结合hvr替换,
[0084]-步骤a)进一步包括
[0085]
vi)治疗性抗体,其中(完整的)hvr h-2、l-1和l-3已经由(完整的)非结合hvr替换,
[0086]-步骤b)为
[0087]
确定与治疗性抗体特异性结合的抗体的表位
[0088]-在所述双特异性fab的所述第一互补位中,前提是
[0089]
在i)和vi)中检测到结合,
[0090]
以及
[0091]
在ii)、如果存在的iii)和如果存在的v)中检测到非结合,
[0092]-在所述双特异性fab的所述第二互补位中,前提是
[0093]
在i)和ii)中检测到结合,
[0094]
以及
[0095]
在vi)、如果存在的iii)和如果存在的v)中检测到非结合,
[0096]-在所述第一互补位的hvr框架区结中,前提是
[0097]
在i)和vi)中检测到结合
[0098]
以及
[0099]
在ii)、如果存在的iii)和如果存在的v)中检测到非结合,
[0100]-在所述第二互补位的hvr框架区结中,前提是
[0101]
在i)和ii)中检测到结合
[0102]
以及
[0103]
在vi)、如果存在的iii)和如果存在的v)中检测到非结合,
[0104]-在框架区和/或恒定结构域中,前提是
[0105]
在i)和ii)和iv)以及如果存在的iii)中检测到结合,
[0106]
以及
[0107]
在如果存在的v)中检测到非结合。
[0108]
在本发明的所有方面和实施例中,在步骤a)之前,即在与治疗性抗体的固定的至少fab或其互补位修改的变体进行孵育之前,并未将治疗性抗体或其片段的可溶性变体添加到样品或样品的等分试样中。
[0109]
在所有方面和实施例中,治疗性抗体包括形成治疗性靶标结合互补位的vh/vl对。
[0110]
在所有方面和实施例中,与治疗性靶标结合的治疗性抗体的互补位是不单一结构域抗体。
附图说明
[0111]
图1在imgt/ligm-db数据库中公布的人(n=9340)ig序列的vh结构域观察到的基因使用频率。根据imgt/高v-quest统计分析报告,每个映射的ighv基因使用计算为生产性
和框内序列的总唯一群体的百分比(转自b.shi等人,ther.biol.med.model.11(2014)30,补充图1a)。
[0112]
图2种系化方案重链可变结构域。用“f”、“c”和
“‑”
以及“j”表示的重可变结构域的相应片段用作与人imgt种系组库比对中的查询序列,以识别最相同的种系序列。
“‑”
表示比对中使用的空位,而已识别种系的对应序列用于替换抗体的相应hvr序列。
[0113]
图3种系化方案轻链可变结构域。用“f”、“c”和
“‑”
以及“j”表示的轻可变结构域的相应片段用作与人imgt种系组库比对的查询序列,以识别最相同的种系序列。
“‑”
表示比对中使用的空位,而已识别种系的对应序列用于替换抗体的相应hvr序列。
[0114]
图4用于检测结构域特异性抗药物抗体(ada)而产生的双特异性fab生物治疗剂、工程化fab变体和对照分子的示意图。构建体2至构建体4是原始duta原始药物分子的修改版本。
[0115]
图5:结构域检测测定原理:不同结构域(图4中所描述的)直接包覆到nunc maxisorp
tm
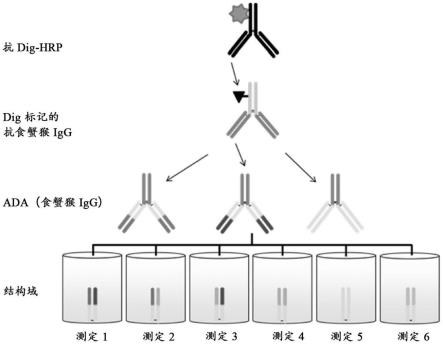
板上,并用于捕获结构域特异性ada。结合的ada由dig标记的抗食蟹猴igg进行检测。使用与辣根过氧化物酶(hrp)偶联的抗dig抗体产生信号,导致底物/abts颜色转换。
[0116]
图6:如在实例5中使用的根据本发明的示例性结构域检测测定的示意图。将代表不同结构域的五种不同fab变体固定在表面上。具有不同特异性的ada可以附接至不同的结构域。ada的进一步识别由抗食蟹猴抗体完成。
[0117]
图7:如在实例5中使用的根据本发明的方法的示例性测定设置的预期阳性模式。
[0118]
图8:利用根据本发明的测定而确定的ada应答“8型”。
[0119]
图9:利用根据本发明的测定而确定的ada应答“9型”。
[0120]
图10:利用根据本发明的测定而确定的ada应答“10型”。
[0121]
图11:利用根据本发明的测定而确定的ada应答“11型”。
具体实施方式
[0122]
定义
[0123]
除非本文另有定义,否则与本发明相关的科学和技术术语应具有本领域普通技术人员通常理解的含义。此外,除非上下文另有要求,否则单数术语应包括复数,而复数术语应包括单数。本公开的方法和技术通常根据本领域公知的常规方法进行。通常,与本文所述的生物化学、酶学、分子和细胞生物学、微生物学、遗传学以及蛋白质和核酸化学和杂交相关的术语和技术是本领域公知的和常用的。
[0124]
除非本文另有定义,否则术语“包括”应包括术语“由
……
组成”。
[0125]
如本文结合特定值(例如温度、浓度、时间等)使用的术语“约”应指术语“约”指的特定值的 /-1%的变化。
[0126]
本文所使用的术语“抗体”在最广泛意义上使用并且涵盖各种抗体结构,包括但不限于单克隆抗体、多特异性抗体(例如,双特异性抗体)以及抗体片段,只要它们表现出所需的抗原结合活性即可。
[0127]“抗体片段”是指除了完整抗体以外的分子,其包含完整抗体的一部分且结合完整抗体结合的抗原。抗体片段的实例包括但不限于fv、fab、fab'、fab'-sh、f(ab')2;双体抗体;线性抗体;单链抗体分子(例如,scfv和scfab);单结构域抗体(dab);以及由抗体片段形
成的多特异性抗体。
[0128]
抗体的“类别”是指抗体的重链所具有的恒定结构域或恒定区的类型。存在五大类抗体:iga、igd、ige、igg和igm,并且这些抗体中的一些可以进一步分为亚类(同种型),例如igg1、igg2、igg3、igg4、iga1和iga2。在某些方面,抗体是igg1同种型。在某些方面,抗体是具有p329g、l234a和l235a突变以降低fc区效应子功能的igg1同种型。在其他方面,抗体是igg2同种型。在某些方面,抗体是在铰链区具有s228p突变的igg4同种型,以改善igg4抗体的稳定性。对应于不同类别的免疫球蛋白的重链恒定结构域分别称为α、δ、ε、γ和μ。抗体的轻链基于其恒定结构域的氨基酸序列,可以归属于两种类型中的一种,这两种类型称为卡帕(κ)和兰姆达(λ)。
[0129]“框架”或“fr”是指除互补决定区(cdr)之外的可变结构域残基。可变结构域的fr通常由以下四个fr结构域组成:fr1、fr2、fr3和fr4。因此,cdr和fr序列通常在vh(或vl)中以如下序列出现:fr1-cdr-h1(cdr-l1)-fr2-cdr-h2(cdr-l2)-fr3-cdr-h3(cdr-l3)-fr4。
[0130]
术语“全长抗体”、“完整抗体”及“全抗体”在本文中可互换地用于指代具有基本上类似于天然抗体结构的结构或具有含有如本文所定义的fc区的重链的抗体。
[0131]
术语“可变区”或“可变结构域”是指抗体重链或轻链的参与抗体与抗原结合的结构域。天然抗体的重链和轻链的可变结构域(分别为vh和vl)通常具有相似的结构,其中每个结构域包含四个保守框架区(fr)和三个互补决定区(cdr)。单个vh或vl结构域可足以赋予抗原结合特异性。此外,结合特定抗原的抗体可分别使用来自结合该抗原的抗体的vh或vl结构域来进行分离,以筛选互补vl或vh结构域的文库。
[0132]
如本文所用的术语“高变区”或“hvr”是指抗体可变结构域中在序列上高变并确定抗原结合特异性的各个区域,例如“互补决定区”(“cdr”)。这些区域形成互补位或结合位点。
[0133]
通常,抗体包括六个抗原结合特异性决定区:三个在vh中(h1、h2、h3),三个在vl中(l1、l2、l3)。本文的示例性抗原结合特异性决定区包括:
[0134]
(a)存在于氨基酸残基26-32(l1)、50-52(l2)、91-96(l3)、26-32(h1)、53-55(h2)和96-101(h3)处的高变环(hvr)(chothia和lesk,j.mol.biol.196:901-917(1987));
[0135]
(b)存在于氨基酸残基24-34(l1)、50-56(l2)、89-97(l3)、31-35b(h1)、50-65(h2)和95-102(h3)处的互补决定区cdr(kabat等人,sequences of proteins of immunological interest,第5版,public health service,national institutes of health,bethesda,md(1991));
[0136]
(a b)存在于氨基酸残基24-34(l1)、50-56(l2)、89-97(l3)、26-35(h1)、50-65(h2)和95-102(h3)处的hvr(chothia和lesk,j.mol.biol.196:901-917(1987) kabat等人,sequences of proteinsof immunological interest,第5版,public health service,nationalinstitutes of health,bethesda,md(1991));
[0137]
以及
[0138]
(c)存在于氨基酸残基27c-36(l1)、46-55(l2)、89-96(l3)、30-35b(h1)、47-58(h2)和93-101(h3)处的抗原接触点(maccallum等人,j.mol.biol.262:732-745(1996))。
[0139]
除非另有说明,否则hvr根据kabat等人所述的方法(同上)进行确定。本领域的技术人员将理解,也可以根据chothia(同上)、mccallum(同上)所述的方法或任何其他在科学
上接受的命名系统来确定抗原结合特异性决定区名称。
[0140]
如本文可互换使用的,“互补位”或“抗原结合位点”是指识别并结合抗原的抗体的一部分。互补位是由来自抗体重链和轻链可变结构域中的几个单个氨基酸残基形成的,这些残基在fv区的三级结构中空间邻近排列。内源性人抗体的互补位由6个cdr(互补决定区)环形成,它们识别其抗原表面上的互补表位。在特异性针对小抗原(例如小分子)的抗体的情况下,只有来自一些cdr的少数氨基酸,但并非全部参与抗原识别。参与直接抗原接触的cdr氨基酸残基被称为特异性决定区(sdr)。通过分析抗原-抗体复合氨基酸残基的3维结构,可以基于它们的距离来识别直接接触的抗原。在cdr之间隔的fr(框架)残基也可以参与抗原识别,但是是在较小的程度上(此类区域的表面可能占抗原和抗体接触表面的高达15%)(参见,例如,altshuler,e.p.,chemie 50(2010)203-258;bujotzek,a.等人,mabs 8(2016)288-305)。
[0141]
在一个实施例中,根据本发明的方法中的治疗性抗体是双特异性fab。在一个实施例中,双特异性fab包括在一个同源的vh/vl对中的两个“非重叠”互补位。“非重叠”是指包含在两个互补位之一中的氨基酸都不包含在另一个互补位中。
[0142]“双特异性fab”是如在wo 2012/163520中所公开的双特异性抗体。在双特异性fab中,单一vh结构域和vl结构域对与两个不同的表位特异性结合,其中一个互补位包括来自cdr-h2、cdr-l1和cdr-l3的氨基酸残基,另一个互补位包括来自cdr-h1、cdr-h3和cdr-l2的氨基酸残基。双特异性fab包括在同源vh/vl对内的两个非重叠的互补位,并且可以同时与两个不同的表位结合。wo 2012/163520中公开了双特异性fab及其通过筛选包括单特异性fab片段的文库而产生的方法。
[0143]
在一个实施例中,根据本发明的方法中的治疗性抗体是双特异性fab。在一个实施例中,双特异性fab与第一抗原(抗原1)和第二抗原(抗原2)特异性结合。在一个实施例中,双特异性fab通过其第一互补位与第一抗原(抗原1)特异性结合并通过其第二互补位与第二抗原(抗原2)特异性结合。在一个实施例中,双特异性fab包括在可变轻链结构域(vl结构域)和可变重链结构域(vh结构域)的一个同源对内的第一互补位和第二互补位,其中第一互补位包括来自抗体的cdr-h2、cdr-l1和cdr-l3的氨基酸残基,其中第二互补位包括来自抗体的cdr-h1、cdr-h3和cdr-l2的氨基酸残基。
[0144]
在一个实施例中,双特异性fab结合第一抗原和第二抗原,并且包括在vl结构域和vh结构域的一个同源对内的第一互补位和第二互补位,其中可变轻链结构域和可变轻链结构域对可以同时结合第一抗原和第二抗原。
[0145]
在一个实施例中,双特异性fab结合第一抗原和第二抗原,并且包括在vl结构域和vh结构域的一个同源对内的第一互补位和第二互补位,其中第一互补位中包括的氨基酸都不包含在第二互补位中。
[0146]
如本文所使用的,术语“样品”表示可以任何生物基质,从该生物基质中能够确定ada应答。示例性的但非限制性的样品是血清、血浆、房水、玻璃体液、视网膜组织裂解物和肿瘤组织。在一个优选的实施例中,样品是血浆。
[0147]
术语“表位”表示抗原结合的蛋白质或非蛋白质抗原上的位点。表位既可以由连续的氨基酸伸长段(线性表位)形成,也可以通过包含非连续的氨基酸(构象表位)形成,例如由于抗原折叠,即由于蛋白质抗原的三级折叠而在空间上接近。在蛋白质抗原暴露于变性
剂后,线性表位通常仍被抗体结合,而构象表位通常在用变性剂处理后被破坏。表位包含独特的立体构象中的至少3个、至少4个、至少5个、至少6个、至少7个或8-10个氨基酸。
[0148]
如本文所使用的,术语“抗药物抗体”表示由治疗性抗体的受体的先天免疫系统在施用治疗性抗体后针对所述治疗性抗体产生的抗体。
[0149]
如本文所使用的,术语“免疫原性”表示治疗性抗体在人或动物中诱导免疫应答的可能性。在药物开发过程中,主要通过测量结合和中和抗药物抗体来评估免疫原性。
[0150]
非结合(种系)cdr表示从人种系氨基酸序列获得的cdr,治疗性抗体的框架区与该人种系氨基酸序列具有最高的同源性,并且该人种系氨基酸序列不单独或与治疗性抗体的其他cdr结合地与治疗性抗体的靶标特异性结合。
[0151]
根据本发明的方法
[0152]
1.一种用于确定与治疗性抗体(抗药物抗体)特异性结合的抗体的表位(的空间位置)的方法,该方法包括以下步骤:
[0153]
a)将包括血清和特异性结合治疗性抗体的抗体的样品(该样品是从已经施用了治疗性抗体的(实验)动物获取的)分别与以下项进行培养,
[0154]
i)所述治疗性抗体的至少一个fab片段,和
[0155]
ii)治疗性抗体的至少一个fab片段,其中至少一个cdr已经由非结合(种系)cdr替换,并且
[0156]
检测与治疗性抗体特异性结合的抗体与i)至ii)任一项中的至少一个fab片段的结合或非结合,
[0157]
以及
[0158]
b)确定与治疗性抗体特异性结合的抗体的表位(的空间位置)
[0159]-在已经在ii)中被替换的至少一个cdr中,前提是
[0160]
在i)中检测到结合
[0161]
以及
[0162]
在ii)中检测到非结合,
[0163]-在已经在ii)中被替换的至少一个cdr的cdr框架结中、或在框架区中、或在恒定结构域中,前提是
[0164]
在i)和ii)中检测到结合。
[0165]
2.根据项目1所述的方法,其中
[0166]
步骤a)进一步包括
[0167]
iii)治疗性抗体的至少一个fab片段,其中全部cdr已经由非结合(种系)cdr替换,
[0168]
且步骤b)为
[0169]
确定与治疗性抗体特异性结合的抗体的表位(的空间位置)
[0170]-在已经在ii)中被替换的至少一个cdr中,前提是
[0171]
在i)中检测到结合
[0172]
以及
[0173]
在ii)和iii)中检测到非结合,
[0174]-在已经在ii)中被替换的至少一个cdr的cdr框架区结中,前提是
[0175]
在i)和ii)中检测到结合
[0176]
以及
[0177]
在iii)中检测到非结合。
[0178]-在框架区和/或恒定结构域中,前提是
[0179]
在i)至iii)中检测到结合。
[0180]
3.根据项目1至2中任一项所述的方法,其中
[0181]
步骤a)进一步包括
[0182]
iv)治疗性抗体的一个或多个其他至少fab片段,其中与ii)的cdr不同的至少一个cdr已经由非结合(种系)cdr替换,
[0183]
且步骤b)为
[0184]
确定与治疗性抗体特异性结合的抗体的表位(的空间位置)
[0185]-在已经在ii)或iv)中被替换的至少一个cdr中,前提是
[0186]
在i)中检测到结合
[0187]
以及
[0188]
在ii)或iv)之一中、且可选地在iii)中检测到非结合,
[0189]-在已经在ii)或iv)中被替换的至少一个cdr的cdr的框架区结中,前提是
[0190]
在i)、以及ii)或iv)之一中检测到结合
[0191]
以及
[0192]
在iii)中检测到非结合,
[0193]-任选地在框架区和/或恒定结构域中,前提是
[0194]
在i)至iv)中检测到结合。
[0195]
4.根据项目1至3中任一项所述的方法,其中
[0196]
步骤a)进一步包括
[0197]
v)来自种系的非结合(种系)抗体的至少一个fab片段,其不同于治疗性抗体的框架区的fab片段,
[0198]
且步骤b)为
[0199]
确定与治疗性抗体特异性结合的抗体的表位(的空间位置)
[0200]-在已经在ii)中或任选地在iv)中被替换的至少一个cdr中,前提是
[0201]
在i)中检测到结合
[0202]
以及
[0203]
在ii)和v)中、任选地在iii)中、任选地在iv)中检测到非结合,
[0204]-在已经在ii)中或任选地在iv)中被替换的至少一个cdr的cdr的框架区结中,前提是
[0205]
在i)和ii)中、或任选地在iv)中检测到结合
[0206]
以及
[0207]
在v)中且任选地在iii)中检测到非结合,
[0208]-任选地在框架区和/或恒定结构域中,前提是
[0209]
在i)和ii)中、且任选地在iii)中、且任选地在iv)中检测到结合
[0210]
以及
[0211]
在v)中检测到非结合。
102。选择在相同位置的hvr外具有最高数量的相同残基且具有相同hvr长度的序列。如果识别出两个或多个种系序列,则选择在天然人抗体组库中具有较高使用频率的序列。作为使用频率的基础,使用b.shi等人提供的列表(ther.biol.med.model.11(2014)30,补充图1a;如图1所重现的)。尽管相应的hvr的序列并不用于比对以识别相应的最相同的种系框架序列,但是所识别的种系序列中的相应的hvr序列用于替换待种系化的抗体的hvr。
[0223]
重链hvr-h3是vdj重排的结果,该vdj重排是在由1)一部分v元件、2)d元件和3)部分j元件形成的抗体成熟期间而发生的。更详细地,重链hvr-h3是通过将来自可变(vh)基因片段、多样性(d)基因片段和接合(j)基因片段的残基进行组合而产生的。尽管通过使用不同的结构单元已经产生了这种多样性,但可以通过以下方式而在接合过程期间产生额外的多样性:利用将短的回文核苷酸添加到编码序列的末端、或通过从编码片段的末端删除可变数量的核苷酸、或通过由末端脱氧核苷酸转移酶或由引入点突变以改变氨基酸密码子的超突变机制而在vh-d和d-j结后续插入可变数量的非模板化的核苷酸,(参见rosner,k.等人,免疫学103(2001)179-187)。
[0224]
在图2a和图3a中概述了种系化的一般方案。
[0225]
因此,本文提供了一种易于使用的互补位种系化的方法作为当前方法的一个优势。
[0226]
本实例中使用的示例性双特异性fab包括与两个不同表位特异性结合的单一vh结构域和vl结构域对。一个互补位包括来自hvr-h2、hvr-l1和hvr-l3的氨基酸残基,而另一个互补位包括来自hvr-h1、hvr-h3和hvr-l2的氨基残基。
[0227]
因此,在该示例性情况下,对于第一互补位如图2c和图3e中以及对于第二互补位如图2e和图3c中所示的hvr和fr仅部分是种系化的。
[0228]
因此,为了创建其中仅保留了抗原1结合互补位且去除(即种系化)了抗原2结合互补位的germ1对照构建体,进行了以下修改:
[0229]-hc-fr1 n末端部分由种系序列vh3-21(imgt)替换,
[0230]-hc-fr1 c末端部分、hvr1和hc-fr2 n末端部分由种系序列vh3-23(imgt)替换,
[0231]-hc-fr3由种系序列vh3-23(imgt)替换,
[0232]-根据所使用的实践,诸如已经在丙氨酸扫描中通过非免疫原性a将潜在的免疫原性残基96d替换,
[0233]-hc-hvr3残基98-102和fr4由ighj4(imgt)替换,
[0234]-lc-hvr2由igkv1-33(imgt)替换,
[0235]
因此,为了创建其中仅保留了抗原2结合互补位且去除(即种系化)了抗原1结合互补位的germ2对照构建体,进行了以下修改:
[0236]-hc-fr2 c末端部分、hvr2和hc-fr3 n末端部分由种系序列vh3-23(imgt)替换,
[0237]-lc-fr1 n末端部分由种系序列igkv1-6(imgt)替换,
[0238]-lc-fr1 c末端部分、hvr1和lc-fr2 n末端部分由种系序列vgkv1-27(imgt)替换,
[0239]-lc-fr3由种系序列igkv1d-43(imgt)替换,
[0240]-lc-hvr3残基97和fr4由igkj2(imgt)替换。
[0241]
为了创建germgerm对照构建体,将对于germ1对照和germ2对照构建体的以上概述的所有替换进行结合,从而从双特异性fab中消除抗原1结合互补位和抗原2结合互补位。
[0242]
在图4中示意性地示出了在本研究中产生的并应用于免疫原性应答表征的所有构建体。
[0243]
根据本发明的结构域检测测定(dda)采用与常规桥接ada测定相同的原理。本发明的区别在于使用确定的药物结构域作为捕获试剂。因此,可以选择性地确定结构域特异性ada分数。
[0244]
在根据本发明的方法的一个优选实施例中,特异性的结构域直接固定在固体表面上(见图5)。因此,示例性材料是nunc maxisorp
tm
mtp。在一个优选实施例中,异羟基洋地黄毒苷标记的抗食蟹猴igg用于检测结构域特异性ada应答。
[0245]
除了根据本发明的ada结构域检测测定之外,还将几种其他测定设置应用于样品分析和评估数据可靠性。
[0246]
在结构域竞争测定(dca)设置中,图4和图5中描述的不同结构域的生物素和异羟基洋地黄毒苷的变体用于形成药物/药物变体:ada复合物,其可以固定在链霉亲和素包覆的mtp上并通过抗dig-hrp抗体进行检测。相应的构建体的非标记版本用作特异性竞争试剂。与根据本发明的结构域检测测定相比,该测定产生了可比较的结果,然而,但是在试剂生产和执行方面要费力得多。由于其间接工作模式(信号减少对应于结构域特异性ada的检测),它的灵敏度也较低。就工作量和结果质量而言,证明dca对于ada表征要逊于根据本发明的dda。
[0247]
应用于ada表征的进一步测定是ada桥接测定。在该测定中,在样品中存在抗药物抗体的情况下,使用对于不同对照构建体相应的药物候选物的生物素标记的和异羟基洋地黄毒苷标记的版本来产生信号。为了确认ada的特异性,掺入大量过剩的未标记药物相应的对照构建体。认为未标记分子的显著信号猝灭能力是特异性ada存在的阳性。在本实例中,该原理作用于原始双特异性fab以及两种部分种系化的变体(一种是结合特异性活性,另一种是结合非功能性),但不适用于germgerm变体和其他对照构建体,这表明没有特意于常数部分的ada。这一发现被视为ada桥接测定设计的缺陷/弱点,它可能无法完全解决针对恒定抗体部分的备用和较低亲和力ada(参见图4)。
[0248]
应用于食蟹猴研究样品的ada表征的第三种测定是免疫复合物测定(参见例如wessels,u.等人,bioanal.10(2018)803-814),其使用抗人fab抗体作为捕获物和抗食蟹猴igg抗体作为检测试剂的组合来检测生物样品中的ada:药物复合物。由于该测定对药物的耐受性不是很强,即使使用仍存在于样品中的微量残留药物(fab原始),也会产生阳性信号,因此使其无法区分不同的构建物。
[0249]
根据本发明的结构域检测测定,即测定和相应的分子工程化方法(原始药物化合物的种系化变体的产生)的组合,缺乏全部之前概述的限制,因为不同结构域直接固定在固体表面上,诸如例如mtp,并被相应的ada识别。这使得该测定非常特异性且灵敏。该测定还显示出高度的药物耐受性,因为与给药后第35天样品中存在的残留药物水平相比,捕获物抗体的浓度至少高出200倍。滴定实验也证实了这一点,表明了当药物从样品中稀释出来时,特异性ada识别信号仍然是高度阳性的。
[0250]
就生物学相关性和进一步发展而言,发现对(绝大多数)双特异性fab分子的具有较低普遍率的抗原结合部分和恒定部分所区分的免疫应答支持了在非人灵长类动物背景下针对完全人药物候选物的复杂多克隆抗药物抗体应答的假设。针对双特异性fab分子的
恒定部分的ada的发现也与非结合的人fab交叉反应,并且兰尼单抗关于预期的人体应用尤其值得注意,因为兰尼单抗是玻璃体内应用的药品,其对于人类耐受性良好。因此,获得的结果没有提供双特异性fab模态中分子内在的免疫原性特性的提示。
[0251]
总结与展望
[0252]
本文报道了一种新颖且创造性的概念,以促进在临床前环境中对针对生物治疗性药物候选物的免疫应答的表征。这是通过将分子工程化方法与高效且易于执行的结构域检测测定设置相结合来实现的。
[0253]
通过用人种系序列替换生物治疗性药物候选物的个别hvr和构架区序列,已经产生了一种新颖的且创造性的测定工具,其能够开发根据本发明的高度特异性和灵敏的ada结构域表征测定。根据本发明的这种方法可用于评估来自临床前非人动物,诸如例如灵长类动物研究的样品的免疫原性应答。
[0254]
该测定能够区分针对生物治疗剂的所有主要结构域(即不同恒定部分或互补位)的抗药物抗体,并且还通过使用包括批准用于人类治疗的商业fab分子的不同对照分子提供对抗药物抗体的交叉反应行为的深刻理解。
[0255]
所描述的方法适用于所有类型的治疗性抗体,尤其适用于较小尺寸的蛋白质生物治疗剂,诸如scfv或fab,因为在ada表征之前无需将分子酶切裂解成亚片段。就数据质量、稳健性和易用性方面,证明该测定相比于其他生物分析方法是优越的。
[0256]
从项目的角度来看,作为可开发性活动的一部分,早期纳入临床先导候选的种系化变体可以在免疫原性理解和风险缓解方面增加巨大价值,因为可以在早期识别具有内在免疫学风险的分子并将其排除在更有希望的候选物的开发之外。
[0257]
***
[0258]
提供以下实例、序列和附图来辅助理解本发明,本发明的真实范畴在所附权利要求书中阐述。应当理解,在不脱离本发明的精神的情况下,可对所阐述的程序进行修改。
[0259]
实例
[0260]
化学品、试剂和设备
[0261]
治疗性抗体和特异性测定试剂全部由罗氏诊断有限公司(roche diagnostics gmbh),潘茨堡,德国提供,并等分保存在-80℃下直至使用。双特异性治疗性fab(“fab-原始”,药物)由针对可从重组表达中获得的两种不同抗原的单克隆fab组成。其在纯化和分析表征后使用。在桥接ada测定中,双特异性构建体“fab-原始”的生物素化(fab-原始-bi)和异羟基洋地黄毒苷化(fab-原始-dig)版本分别用作捕获物和检测试剂。
[0262]
对于结构域检测测定(dda)和结构域竞争测定(dca),使用以下未标记试剂进行捕获:“fab-原始”(双特异性治疗性fab)、“germ1-对照”(双特异性治疗性fab,其中第一互补位是完整的且第二互补位已回复突变为种系序列)和“germ2-对照”(双特异性治疗性fab,其中第二互补位是完整的且第一互补位回复突变为种系序列)、“germgerm-对照”(双特异性治疗性fab,其中两个互补位回复突变为相应的种系序列)、兰尼单抗(批准用于眼内应用的商业人fab生物治疗剂)、非结合人fab(dp47)。异羟基洋地黄毒苷化单克隆抗食蟹猴igg抗体用作检测试剂。与辣根过氧化物酶(hrp)(pab-dig-s-fab-hrp)缀合的针对异羟基洋地黄毒苷的多克隆绵羊抗体fab用作所有ada测定中第二检测试剂。
[0263]
阳性对照,pc=在体内或通过噬菌体展示产生
[0264]
捕获对照,cc=当pc不可用时的pc替代
[0265]
以下化合物用作阳性对照(pc),例如作为(功能性的(克隆、产生、固定)捕获物对照(cc):总ada筛选测定:针对人iggκ的单克隆小鼠抗体(mab-抗-hu-κ,罗氏诊断有限公司,曼海姆,德国);dda:异羟基洋地黄毒苷化重组抗原1和异羟基洋地黄毒苷化重组抗原2用作捕获物对照(通过抗cκ检测),来自每只动物的给药前食蟹猴ctad(ctad=柠檬酸盐-茶碱-腺嘌呤-双嘧达莫;抗凝剂)的血浆样品用作阴性对照。
[0266]
合并的食蟹猴ctad血浆由40只单独的未接受药物的雌性和雄性动物制备。血浆样品获自天时国际实验室有限公司(sera laboratory international,ltd.),海沃兹希思,英国。洗涤缓冲液(磷酸盐缓冲盐水(pbs)/0.05%吐温20/0.002%bronidox)和2,2'-次偶氮基-双-3-乙基苯并噻唑啉-6-磺酸(abts)底物由罗氏诊断有限公司,曼海姆,德国提供。即用型低交叉反应缓冲液获自candor生物科学有限公司(candor bioscience gmbh),旺根,德国,并在桥接ada测定(elisa)中用作稀释液和测定缓冲液。所有化学品为分析级。
[0267]
四只动物(成年猴;食蟹猴)的三个剂量组,每个剂量组用0(安慰剂)、5和10mg/眼睛治疗长达43天。在第29天施用第二次治疗。从这项研究中,将39个双特异性fab原始构建体给药动物的血浆样品用于ada测试。其中,发现31个样品在总ada筛选测定中呈阳性(以1:20的稀释倍数测试的样品)。最后,由于反映高ada浓度的显著信号强度(》1.0au),因此选择了来自8只不同动物的16个样品(来自每只动物的给药前样品作为特异性的阴性对照和治疗后第35天的样品)通过结构域特异性方法来进一步进行评估。
[0268]
用于桥接ada测定的链霉亲和素包覆的微量滴定板(sa-mtp)获自美固涂生物技术有限公司(microcoat biotechnologie gmbh),贝恩里德,德国。用于dda的未包覆的nunc maxisorp
tm
微量滴定板获自赛默飞世尔科技(thermo fisher scientific),德国。
[0269]
实例1
[0270]
用于检测整体ada应答的桥接ada测定(ada筛选测定)
[0271]
桥接ada测定应用于分析从食蟹猴研究(见上文)获得的血浆样品,以检测针对双特异性《ag1/ag2》fab(抗抗原1/抗原2双特异性fab)的ada应答。样品在1:20的稀释倍数下进行测试。桥接ada测定用作结构域特异性方法的参考。
[0272]
桥接ada测定是夹心酶联免疫吸附测定(elisa)。通常,抗体制剂在稀释缓冲液(低交叉反应缓冲液,candor生物科学有限公司,旺根,德国)中制备。试剂和样品在室温下以500rpm的速度振荡孵育。洗涤步骤包括三个循环,该三个循环是应用300μl洗涤缓冲液,然后是最终抽吸步骤。通常,将15μl样品添加到聚丙烯预孵育板中的285μl孵育混合物中,该孵育混合物包含duta-原始-bi和duta-原始-dig各0.5μg/ml。并行处理pc(mab-抗-hu-κm-1.7.10)。孵育1小时后,将100μl每种样品混合物一式两份转移到sa-mtp中进一步孵育1小时。在用pbs/吐温洗涤以去除未结合的材料并进行最终抽吸后,加入100μl多克隆抗dig-s-fab-hrp缀合物(12.5mu/ml)。孵育1小时后,将sa-mtp洗涤3次,然后进行最终抽吸。然后加入底物溶液abts,并且hrp催化显色反应,读数为405nm波长(参考波长:490nm)。只有包含桥接复合物的样品(即与duta-原始-bi和duta-原始-dig二者结合的抗体)能产生信号。信号强度与存在的ada的量成正比。对于每个样品,在两个孔中确定吸光度值。如果平均值的精度≤20%cv,则平均并接受吸光度值。根据shankar等人的方法,使用适用于40个未接受药物的供体样品的95%百分位数评估筛选切割点(cp)。通过计算板特异性cp(合并的血浆空
白乘以归一化因子),识别了阴性样品(《板特异性cp)和阳性样品(》板特异性cp)。在本文的上下文中,应该提及的是,不认为药物耐受性是一个关键参数。药物在玻璃体内施用,该公式中的研究样品在低药物水平的时间点进行采样,即在随后给药之前。由于样品中的fab原始水平是b.l.q.,因此认为没有必要对药物耐受性进行评估。
[0273]
实例2
[0274]
双特异性和变体fab片段的产生
[0275]
从geneart购买了编码双特异性构建体duta-原始和单特异性、部分种系化的构建体germ1对照和germ2对照以及完全种系化的、非结合构建体germgerm对照的合成基因。
[0276]
将合成抗体基因克隆到载体中,该载体是用于在大肠杆菌中周质表达fab片段的双顺反子载体,并带有包括lacz启动子、lc核糖体结合位点、lc信号肽、vk可变结构域、ck恒定结构域、hc核糖体结合位点、hc信号肽、vh可变结构域、igg1 ch1恒定结构域和igg1上铰链的表达盒。
[0277]
将编码fab片段的质粒转化到tg1大肠杆菌细胞(zymo research)中,并在tb培养基中在37℃下预培养单菌落,该tb培养基中补充有2%葡萄糖以抑制抗体表达。在达到滞后期时,将预培养物在锥形摇瓶中稀释到补充有最终浓度0.05%葡萄糖的tb表达培养基中,并在达到对数期时通过补充iptg而将表达培养物诱导至1mm的最终浓度。fab片段在30℃下表达16小时,并通过离心澄清培养物上清液。
[0278]
为了确保在ada分析中仅使用具有完整重链和轻链恒定结构域的全长fab片段,fab片段分两步进行双亲和纯化,首先使用captureselect igg-ch1树脂,然后使用captureselectκxl树脂,二者均购自通用电气医疗集团(ge healthcare)。纯化的fab片段的蛋白质浓度通过分光光度法使用280nm 处的吸光度进行确定。
[0279]
实例3
[0280]
用于检测结构域特异性ada应答的结构域检测测定(dda)
[0281]
结构域检测测定(dda)代表了四步夹心酶联免疫吸附测定(elisa)。
[0282]
每孔各3.33μg/ml且150μl的fab-原始、germ1-对照、germ2-对照、germgerm-对照、兰尼单抗和非结合人fab在作为捕获试剂的nunc maxisorp
tm
mtp上孵育1小时。用pbs/吐温将板清洗3次以去除未结合的材料后,使用150μl测定缓冲液封闭板30分钟,以避免在下一步中样品的非特异性结合。清洗板后,用297μl测定缓冲液稀释3μl每个样品,并将每个样品100μl一式两份孵育1小时。并行处理捕获物对照(重组抗原1-dig和重组抗原2-dig)。每只动物的给药前样品代表阴性对照。异羟基洋地黄毒苷化单克隆抗食蟹猴igg用作检测试剂(100μl/孔)。带有捕获物对照的孔填充了100μl测定缓冲液。与辣根过氧化物酶(hrp)(pab-dig-s-fab-hrp)缀合的针对dig的多克隆绵羊抗体fab片段用作所有ada测定中第二检测试剂(100μl/孔)。将abts添加到每个孔中,并通过405nm(参考波长490nm)的光度读数监测随后的显色反应。
[0283]
为了区分阳性样品和阴性样品,对5种dda中的每一种用食蟹猴研究的一组8个给药前样品进行切割点(cp)测定。
[0284]
表:用于具有预期阳性/阴性的5种不同dda的捕获物对照测定。
[0285][0286]
所有样品3次稀释(1至100/1至1000/1至10000)进行测量。样品在低交叉反应缓冲液
tm
中进行稀释,并在所有5次测定中并行测量。
[0287]
实例4
[0288]
捕获物对照测定(cca)
[0289]
为了测试5种不同dda的包覆过程的可重复性,建立了三种不同的结合对照测定。首先,nunc maxisorp
tm
板按照dda中的描述进行包覆。随后,异羟基洋地黄毒苷标记的抗人κ轻链抗体或异羟基洋地黄毒苷标记的抗原1或抗原2以50ng/ml的浓度进行孵育。与hrp(pab《dig》s-fab-hrp)缀合的针对异羟基洋地黄毒苷的多克隆绵羊抗体fab片段用作第二检测试剂。将abts添加到每个孔中,并通过405nm(参考波长490nm)的光度读数监测随后的显色反应。这些测定用于检查包覆物的再现性和包覆的蛋白质的功能性。此外,在样品测量期间,在测量板上执行了捕获物对照1测定作为准阳性对照(“替代pc”),以确保不同板上的个体测量的可比性。监测该cca的信号并在1.8-2.2od
405 nm
的信号强度处停止测定。
[0290]
实例5
[0291]
根据本发明的结构域检测测定(dda)的表征
[0292]
所用样品采集自以双特异性抗抗原1/抗原2fab作为药物的食蟹猴临床前耐受性研究。基于用于ada筛选的初始桥接测定中的ada阳性(wessels,u.等人,bioanal.10(2018)803-814),选择来自用双特异性抗抗原1/抗原2fab处理的8只不同动物的16个血浆样品以使用根据本发明的方法进行ada表征。来自每只动物,对作为特异性阴性对照的给药前样品和第35天给药后样品进行测试。将来自每只动物的给药前食蟹猴柠檬酸盐-茶碱-腺嘌呤-双嘧达莫(ctad)血浆样品用作用于dda的阴性对照。
[0293]
测定定性
[0294]
本实例中描述的根据本发明的方法的实例用于表征ada应答,并且基于对彼此相关的5个单独dda进行分析的结果(参见图6和图7,显示了本实例中使用的设置和预期的阳性模式)。这需要产生5个不同的阳性对照。这是使用dda的普遍挑战,并且不限于本公布文本中所描述的测定(gorovits,b.等人,j.immunol.meth.408(2014)1-12;hock,m.b.等人,aaps j.17(2015)35-43)。对于这些测定的最佳定性,必须产生特异性阳性对照,这可以通过利用完整的化合物和良好的筛选概念对小鼠进行免疫来实现。另一种可能性是使用针对个别结构域已经可用的抗体(stubenrauch,k.等人,j.pharm.biomed.anal.114(2015)296-304)。由于本实例中使用的fab治疗剂的特性,第二种方法是不可行的,并且不幸的是,特异性免疫是非常耗时且费力的。在没有阳性对照的情况下,用于对这些测定进行定性的标准方法是不可行的。因此,将捕获物对照测定和测定特异性切割点确定组合用作产生可靠数据的实用方法。
[0295]
捕获物一致性
[0296]
来自捕获物对照测定的数据允许对精度值的确定。该精度值反映了包覆物的再现性。基于抗κigg抗体的cca是显示fab表面包覆物的效率的测量。该值是针对所有5个单独的
dda确定的。基于ag1和ag2的cca还显示了结合的fab片段的cdr对于抗原或潜在ada是否可用。精度数据显示,在3个不同的内在测定运行中,所有3个cca的变化非常小,只有1%到3%。
[0297]
表:五个结构域检测测定中所有3个捕获物对照测定的精度数据。
[0298][0299]
可以看出,包覆的抗体的量以及它们结合抗原的能力是恒定的。包覆物的这种稳健性是数据可比性的先决条件。该数据还显示所使用的构建体全部具有或不再具有所需的功能。
[0300]
dda切割点确定
[0301]
针对所有5个dda计算研究特异性切割点,以通过测量相应的给药前样品(n=8只动物)来评估ada阳性。为了计算切割点,使用了99%的百分位数。下表列出了所有测定的乘法归一化因子以及对应的切割点。
[0302][0303]
通过使用异羟基洋地黄毒苷标记的抗原(抗原1和抗原2)来确定测定范围。在50ng/ml的抗原1-dig或抗原2-dig浓度下,开展该测定直到达到1.8-2.2od
405 nm
的信号。该信号范围用作停止真实样品测量中反应的标准。真实样品在测定缓冲液中按1:100进行稀释。在达到高于2.2od
405nm
的信号的情况下,以1:10的步骤进一步稀释样品。
[0304]
对于每个单独的构建体,利用相应的给药前样品执行切割点确定。
[0305]
表:切割点确定:获取dda测定中给药前样品的信号。如下所示,使用99%百分位数来计算测定特异性切割点。
[0306][0307]
dda的药物耐受性
[0308]
所使用的样品来自较晚的时间点(药物施用后第35天)。因此,所测量的残留药物水平非常低,预计残留的药物不会对这些测定产生影响。为了从理论上讨论这一点,不得不说在该测定中,标记的药物以非常高的浓度进行包覆,这与样品中的残留药物直接竞争。因此,理论上的药物耐受性应该至少与标准桥接测定一样好。如有必要,这可以通过类似于桥接ada测定的方式进行改进。例如,可以用酸对样品进行预处理以溶解存在的药物ada复合物(参见,例如,kavita,u.等人,j.immunol.meth.448(2017)91-104)。
[0309]
该测定已经显示出高度的药物耐受性,因为与给药后第35天样品中存在的残留药物水平相比,捕获物抗体/结构域的质量浓度高出几个数量级。滴定实验也证实了这一点,表明了当药物从样品中稀释出来时,特异性ada识别信号仍然是高度阳性的。
[0310]
使用结构域检测测定进行样品分析
[0311]
在下表中可以发现所使用的3次稀释的全部样品的数值数据。
[0312]
表:数值ada结构域检测测定结果。图8至11中用于图示说明的值以粗体表示。
[0313][0314]
如图8至图11所示,选择不同的稀释度来相互比较数据。显色abts底物的线性范围有限,并且样品必须被稀释到不同程度以使信号高度清晰可辨。对于8只动物中的6只,使用1到1000的稀释度。在动物3中,免疫应答弱,选择了1到100的稀释度,而在动物1中,选择了1到10000的稀释度,因为免疫应答非常强。
[0315]
可以区分四种ada应答模式(以下称为8、9、10和11,与图8至图11中的对应的结果一致),它们代表研究的所有8只ada阳性动物。
[0316]
模式8:动物1和动物2揭示了针对分子不同部分(cdr和骨架)的混合ada应答。可以看到针对完全结合的感受态《ag1/ag2》双特异性f(ab)、germ《ag1》-对照和germ《ag2》-对照的强烈应答。检测到针对完全种系化对照构建体(germgerm-对照)和兰尼单抗的温和的应答,表明存在针对分子恒定区的ada。大多数ada似乎以相似的比例针对两个cdr。
[0317]
模式9:动物3和动物4仅显示对cdr区的识别,而没有针对恒定区的ada。在动物3中,此处针对两个cdr的信号低于模式a,表明ada应答更温和,而动物4揭示了与模式a类似的信号强度。在这两只动物中,也似乎存在类似数量的针对两种cdr的ada。
[0318]
模式10:动物5和动物6与模式8相似,表明了针对cdr和恒定区二者的混合应答。然
而,与模式8相比,检测到针对分子恒定区的ada的比例要低很多。
[0319]
模式11:动物7和动物8未显示针对恒定区的ada,仅显示针对cdr的ada。与模式9和所有其他动物不同,我们看到针对抗原1和抗原2的两个cdr之间的ada分布不同。似乎有更多针对ag1结合位点的ada。
[0320]
总体而言,所有的给药前样品在所有五个dda中为ada阴性。因此,我们得出结论,从第35天给药后食蟹猴研究样品中观察到的所有免疫原性应答都是与治疗相关的ada应答。
[0321]
给药前样品的信号也与所有5个dda的微小变化具有很好的可比性。因此,这些值用于计算特异于研究切割点的dda(见上文:dda切割点确定)。对于该程序,使用的基线样品的数量是相关的,并且建议(shankar,g.等人,j.pharm.biomed.anal.48(2008)1267-1281;amaravadi,l.等人,bioanal.7(2015)3107-3124)是使用至少50个给药前样品。在诸如此类的许多临床前研究中,动物数量显着减少,这是不可行的。然而,考虑到这种测量的探索性质,选择了这种方法。
[0322]
综上所述,利用根据本发明的方法,发现所有八只动物显示出针对cdrs的ada,并且在八只动物的中仅两只动物中,这些应答略有不同。由于这种混合的免疫应答,双特异性分子的两个cdr区之一不太可能主要负责所观察到的免疫应答。没有观察到个别的结构域展示出强烈不同的免疫原性。
[0323]
还有一点需要解决的问题是,这里使用的工程化的双特异性f(ab)片段(与野生型fab片段相比其结构略有不同)是否具有更高的免疫原性风险。八只动物中的四只显示出针对恒定区的抗体。与带有兰尼单抗的dda相比,在具有germ-germ变体的dda中没有发现样品的更高信号。这将是针对仅存在于germ-germ变体上而不存在于兰尼单抗上的新表位的免疫应答的证据,兰尼单抗是一种以其低免疫原性而著名的眼部治疗剂,如在几项临床研究所示出的(figurska,m.等人,klin.oczna.112(2010)147-150)。
[0324]
基于上述发现,来自上述食蟹猴研究的所有免疫原性应答都是治疗相关的ada应答。确认了治疗诱导的ada的双重/双特异性fab特异性。总体而言,免疫原性应答是针对hvr和恒定的fab部分的。在50%的动物中,观察到针对hvr的纯“单特异性”应答,而在另一半中,则看出针对hvr和骨架二者的混合应答。
[0325]
在没有hvr贡献的情况下没有观察到针对恒定骨架的ada应答。值得注意的是,针对双特异性fab恒定部分的抗药物抗体与典型人fab分子(如非结合(dp47)对照分子和兰尼单抗)具有交叉反应性。这是对潜在人类应用的一个重要结果,因为在双特异性fab中没有对于分子内在的免疫原性特性的提示。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。