1.本发明属于生物催化技术领域,具体地说,涉及一种利用单胺氧化酶催化制备手性药物中间体(1r,2s,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-磺酸钠的方法。
背景技术:
[0002]
2021年12月,辉瑞公司的口服新冠药“paxlovid”经fda认证成为美国首个获批的口服抗新冠病毒药物。辉瑞paxlovid由300mg(两片150mg片剂)的pf-07321332和一片100mg的利托那韦片组成,每天给药2次,持续5天为一疗程。pf-07321332为主要成分、且用量大。化合物(1r,2s,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-磺酸钠是其合成的关键手性中间体,同时也是丙肝蛋白酶抑制剂博昔普韦(boceprevir)的关键手性中间体。
[0003][0004]
文献(j.am.chem.soc.2012,134,6467-6472)公开了利用来自黑曲霉(aspergillusniger)的单胺氧化酶(maon)的氧化反应,并在亚硫酸氢钠存在下由6,6-二甲基-3-氮杂双环[3.1.0]己烷出发制备出(1r,2s,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-磺酸钠。专利文献cn102131813a中也报道了的黑曲霉(aspergillus niger)来源的单胺氧化酶(maon) 及其多种突变体也具有该功能。
技术实现要素:
[0005]
发明人对于生物催化法制备(1r,2s,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-磺酸钠的工业化可行性进行了研究,发现所使用的单胺氧化酶(maon)是本工艺的决定性因素,其酶活力和反应环境中稳定性是制约现有技术应用的限制性障碍。为了解决该技术问题,发明人对众多微生物来源的单胺氧化酶进行了筛选,通过实验比较,筛选出较为理想的单胺氧化酶,其催化6,6-二甲基-3-氮杂双环[3.1.0]己烷转化为手性亚胺时具有反应底物/产物耐受性高、稳定性好、产品光学纯度高等优点。因此,本发明包括如下技术方案。
[0006]
一种酶催化制备(1r,2s,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-磺酸钠的方法,包括如下步骤:
[0007]
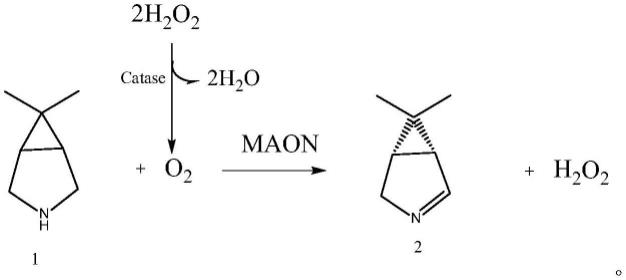
a.以式1所示的6,6-二甲基-3-氮杂双环[3.1.0]己烷为底物,使用单胺氧化酶(maon) seq id no:1或者其同源性≥80%、同源性≥85%、同源性≥90%、同源性≥95%的酶活力提高的突变体催化氧化反应,得到式2所示的(1r,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-烯;
[0008]
b.使式2所示化合物与亚硫酸氢钠反应,得到式3所示(1r,2s,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-磺酸钠:
[0009][0010]
其中单胺氧化酶seq id no:1来源于可可毛色二孢菌(lasiodiplodia theobromae), genbank:xp_035363195.1,简写为maon-lt,氨基酸序列为:
[0011]
mtsrdgyswteqtglrpgvpsigvitpvtnvvssnvlydvvvigagycgltaarda slsglnvllleardriggrswssniggypfemggtwvhwgqphvwreisryqmqnelk nsfdfsygvnhfqlnttggsstmshdeedsllasalekfvnvdgasgrnimpqpanmfy vpeardldslsaqdridaiasslspseravlegfvllcsggtlkgmsfleflhwwaicgy tyqgcldylitykfsggqssfainffrealytkrlsyafnspiqsvndmgnkvevttrdg rtyqaariictvplnvlstvsfnpplpdgklaaigvghvnqcvkvhaevsdknmrswt gvtypsnkliyaigdgttpagnthivafgshqyhmqpeekldetfaavkalapgkmdvq rlvfhnwskdefakgawffsppnlladhledmrarhgnvffassdwallwrsfidgaie egaraamavktelaetgkispql(seq id no:1)。
[0012]
上述方法可以是一锅法进行酶-化学组合反应。即,在一个反应器中由化合物1直接制备出化合物3,不进行化合物2的提取分离。
[0013]
优选地,上述方法中,步骤a完成后,直接将亚硫酸氢钠加入到步骤a完成后的酶反应液中,进行步骤b的化学反应。其中,步骤b的化学反应是将亚硫酸氢钠溶液滴加/ 分批加入至酶反应液中,同时用氢氧化钠溶液控制ph保持在7.4左右。
[0014]
可选地,上述方法中,在步骤a进行过程中,直接将亚硫酸氢钠加入到步骤a的酶反应液中,同步进行步骤a的酶促反应和步骤b的化学反应。
[0015]
上述步骤a的反应体系中优选存在过氧化氢酶,并且通氧气或者加入过氧化氢:
[0016][0017]
上述步骤a的反应体系中,所述单胺氧化酶seq id no:1或者其突变体呈酶形式或者表达微生物菌体形式。
[0018]
在一种实施方式中,上述单胺氧化酶seq id no:1或者所述突变体可以为纯酶或者粗酶,可以为游离酶或者固定化酶。
[0019]
可替代地,在反应体系中,所述单胺氧化酶seq id no:1或者所述突变体还可以呈其表达微生物菌体细胞形式。
[0020]
当上述单胺氧化酶seq id no:1或者其突变体呈微生物菌体形式时,所述微生物优选是增殖速度快、适合于表达外源重组蛋白的微生物,例如选自枯草芽孢杆菌、短乳杆菌、大肠杆菌、木兰假丝酵母、毕赤酵母、酿酒酵母。优选微生物是大肠杆菌,更优选是大肠杆菌bl21(de3)。
[0021]
当单胺氧化酶seq id no:1通过大肠杆菌表达时,其编码基因的核苷酸序列可以为 seq id no:2。
[0022]
优选地,步骤a的反应体系为缓冲液体系,优选磷酸盐缓冲液,其ph值为6.5-8.5、优选ph 6.9-8.2、优选ph 7.1-8.0、优选ph 7.2-7.8、优选ph 7.3-7.6,例如ph 7.4左右。
[0023]
上述步骤b的反应体系ph值为6.5-8.5、优选ph 6.9-8.2、优选ph 7.1-8.0、优选ph 7.2-7.8、优选ph 7.3-7.6,例如ph 7.4左右。
[0024]
上述步骤a和步骤b的反应温度为15-40℃、优选20-38℃、优选22-35℃、优选 25-30℃。
[0025]
相比现有技术的单胺氧化酶,本发明筛选出的单胺氧化酶seq id no:1具有更高的酶活和反应稳定性,底物和产物耐受能力更高,能够高度立体选择性地催化底物1生成高光学纯度的化合物2,进而一锅法通过简单的化学反应即可得到产物3,产物ee值不低于99%。
附图说明
[0026]
图1是本发明的方法合成的化合物3的核磁共振氢谱图。
[0027]
图2是实施例中选用的两种单胺氧化酶重组表达后的sds-page凝胶电泳照片。泳带 1是单胺氧化酶maon-lt,泳带2是另一种单胺氧化酶maon11(cn102131813a中报道的变体单胺氧化酶seq id no:11),m是marker。
具体实施方式
[0028]
为了筛选出符合本发明设计要求的单胺氧化酶(maon),按照第一步根据ncbi信息
构建出能够催化化合物1反应速度快的高酶活力酶集合、第二步从该酶集合中挑选建立能够催化化合物1反应生成光学活性化合物2的酶子集、第三步考察酶子集中产物2光学活性高的酶成员、第四步从这些酶成员中筛选出底物/产物浓度环境中热稳定性高的目标酶的筛选方案,发明人经过对多种微生物来源的单胺氧化酶(maon)进行筛选和实验验证,最终从三百多种已知氨基酸序列的单胺氧化酶(包括文献中报道的突变酶)中挑选出符合本发明设计要求的目标酶,其来源于可可毛色二孢菌(lasiodiplodia theobromae),能够催化高底物浓度的化合物1反应生成化合物2,并且在反应体系中保持高稳定性。
[0029]
本文中,有时将术语“式x所示(化合物)”表述为“式x”、“底(产)物x”或“化合物x”,这是本领域技术人员能够理解的。比如,式1所示化合物和底物1都是指代相同的化合物6,6-二甲基-3-氮杂双环[3.1.0]己烷。
[0030]
容易理解,氨基酸序列与野生酶seq id no:1具有高度同源性、基本相同3d模型结构(三级结构)的突变体预期也可以催化底物1氧化反应并得到化合物2,优选突变体是相比野生型单胺氧化酶seq id no:1的酶活力提高的突变体。
[0031]
上述所用术语“(酶活力)提高”或“增加”表示相较于参考水平提高至少10%,例如相较于参考水平提高至少约20%、或至少约30%、或至少约40%、或至少约50%、或至少约60%、或至少约70%、或至少约80%、或至少约90%、或最高达并包括100%的提高,或者在10%-100%之间的任意提高,或相较于参考水平的至少约2倍、或至少约3倍、或至少约4倍、或至少约5倍、或至少约10倍的提高,或2倍-10倍之间或更多的任意提高。
[0032]
所述的“突变”包括但不限于氨基酸残基的替换、删除、插入、化学修饰,优选是正向突变即酶活力提高的突变。所述取代可以是非保守取代、保守取代或非保守取代和保守取代的组合。“保守的”氨基酸取代或突变是指具有相似侧链的残基的可互换性,并且因此通常包括用相同或相似的氨基酸定义类别中的氨基酸取代多肽中的氨基酸。然而,如本文所用,如果保守的突变可以代替地为脂肪族至脂肪族、非极性至非极性、极性至极性、酸性至酸性、碱性至碱性、芳族至芳族、或限制残基至限制残基的取代,则保守的突变不包括亲水至亲水、疏水至疏水、含羟基至含羟基或小残基至小残基的取代。此外,如本文所用,a、v、l或i可以保守地突变为另一脂肪族残基或另一非极性残基。示例性的保守取代例如为:
[0033]
[0034]“非保守取代”是指用具有显著不同的侧链特性的氨基酸进行的多肽中氨基酸的取代或突变。非保守取代可以使用上面所列的定义组之间而不是之内的氨基酸。在一个实施方案中,非保守突变影响(a)取代区域中肽主链的结构(例如,脯氨酸取代甘氨酸)、(b) 电荷或疏水性、或(c)侧链体积。
[0035]“缺失”是指通过从参考多肽移除一个或多个氨基酸而对多肽进行的修饰。缺失可以包括移除1个或多个氨基酸、2个或更多个氨基酸、5个或更多个氨基酸、10个或更多个氨基酸、15个或更多个氨基酸、或20个或更多个氨基酸、多达构成参考酶的氨基酸总数的10%或多达构成参考酶的氨基酸总数的20%,同时保留酶活性和/或保留工程化单胺氧化酶的改良特性。缺失可以针对多肽的内部和/或端部。在多个实施方案中,缺失可以包含连续的区段或者可以是不连续的。
[0036]“插入”是指通过从参考多肽添加一个或多个氨基酸而对多肽进行的修饰。在一些实施方案中,改良的工程化单胺氧化酶包括将一个或多个氨基酸插入天然存在的单胺氧化酶中以及将一个或多个氨基酸插入其他改良的单胺氧化酶多肽中。插入可以是在多肽的内部,或羧基端或氨基端。如本文所用的插入包括如本领域中已知的融合蛋白。插入可以是连续氨基酸区段或者被天然存在的多肽中的一个或多个氨基酸分隔开。
[0037]
在本文中,术语“野生(型)”、“野生酶”表示相同的意义,都是指氨基酸序列为seqid no:1的单胺氧化酶maon-lt。相应地,野生酶的突变体可以称为“突变酶”。为了表述方便起见,在本文中可以将野生型单胺氧化酶与其突变体统称为“单胺氧化酶”。
[0038]
单胺氧化酶maon及其突变体可以通过基因工程菌发酵方法得到,基于seq id no:1 或其突变体的氨基酸序列,本领域技术人员很容易获得其编码基因、包含这些基因的表达盒和质粒、以及包含该质粒的转化体。
[0039]
本领域技术人员通过所熟知的基因工程构建方式可以容易地获得这些基因、表达盒、质粒、转化体。
[0040]
为了在微生物宿主例如基因工程中最常用的大肠杆菌中最佳地表达单胺氧化酶seqid no:1,本发明对其表达基因进行了密码子优化。
[0041]
密码子优化是可用于通过增加感兴趣基因的翻译效率使生物体中蛋白质表达最大化的一种技术。不同的生物体由于突变倾向和天然选择而通常示出对于编码相同氨基酸的一些密码子之一的特殊偏好性。例如,在生长快速的微生物如大肠杆菌中,优化密码子反映出其各自的基因组trna库的组成。因此,在生长快速的微生物中,氨基酸的低频率密码子可以用用于相同氨基酸的但高频率的密码子置换。因此,优化的dna序列的表达在快速生长的微生物中得以改良。例如,经过密码子优化,单胺氧化酶seq id no:1的编码基因可以是seq id no:2。
[0042]
在催化底物1进行手性氧化的反应体系中,单胺氧化酶maon既可以呈现酶的形式,也可以呈现菌体的形式。所述酶的形式包括游离酶、固定化酶,包括纯化酶、粗酶、发酵液、载体固定的酶等;所述菌体的形式包括存活菌体和死亡菌体。
[0043]
生物催化领域公知,与游离酶法相比,应用固定化酶技术具有生产过程简化、生产效率提高等优点。同时,由于酶可多次使用,且酶的稳定性提高,从而有效提高了单位酶的生产力;其次,固定化酶极易与底物、产物分开,简化了提纯工艺,产率较高,产品质量较好。
[0044]
以下结合具体实施例对本发明做进一步详细说明。应理解,以下实施例仅用于说
明本发明而非用于限定本发明的范围。
[0045]
实施例中涉及到多种物质的添加量、含量及浓度,其中所述的百分含量,除特别说明外,皆指质量百分含量。
[0046]
实施例
[0047]
材料和方法
[0048]
实施例中的全基因合成、引物合成及测序皆由南京金斯瑞生物科技有限公司完成。
[0049]
实施例中的分子生物学实验包括质粒构建、酶切、感受态细胞制备、转化等主要参照《分子克隆实验指南》(第三版),j.萨姆布鲁克,d.w.拉塞尔(美)编著,黄培堂等译,科学出版社,北京,2002)进行。必要时可以通过简单试验确定具体实验条件。
[0050]
pcr扩增实验根据质粒或dna模板供应商提供的反应条件或试剂盒说明书进行。必要时可以通过简单试验予以调整。
[0051]
lb培养基:10g/l胰蛋白胨、5g/l酵母提取物、10g/l氯化钠,ph7.2,121℃高温高压灭菌20min。(lb固体培养基另加20g/l琼脂粉。)
[0052]
tb培养基:24g/l酵母提取物、12g/l胰蛋白胨、16.43g/l k2hpo4.3h2o、2.31g/l kh2po4、5g/l甘油,ph7.0-7.5(tb固体培养基另加20g/l琼脂粉),121℃高温高压灭菌20min。
[0053]
斜面培养基:10g/l胰蛋白胨、5g/l酵母提取物、10g/l氯化钠、20g/l琼脂粉,混匀后按30-40ml装液量分装到茄子瓶,竖立放置于121℃高温高压灭菌20min,降温后加入 100μg/ml硫酸卡那霉素,摆放成斜面,待冷凝成固体即可。
[0054]
化合物2的含量检测方法(hplc法)
[0055]
仪器:高效液相色谱仪(安捷伦1200),色谱柱aglent zorbax eclipse xdb-c18 (2.1*75mm,3.5μm)紫外可见检测器,全自动进样器,四元泵,ph计,超声波,分析天平(max:120g,d=0.1mg),溶剂过滤器,磁力搅拌、旋涡震荡仪,0.45μm滤膜,烧杯、量筒、容量瓶和移液器等。
[0056]
试剂:醋酸铵(ar)、乙腈(色谱级)、双蒸水。
[0057]
操作步骤:
[0058]
流动相的制备:a:配制1l 40mm醋酸铵溶液,以0.45μm滤膜减压过滤,超声波脱气15min。b:取1l乙腈,以0.45μm滤膜减压过滤,超声波脱气15min。
[0059]
色谱条件:色谱柱:aglent zorbax eclipse xdb-c18(2.1*75mm,3.5μm),柱温度: 40℃,流动相:a/b=60:40(v/v),流速:0.5ml/min,检测波长为254nm,进样量:5μl;
[0060]
样品稀释剂为:乙腈:水=55:45。
[0061]
化合物2的手性检测方法(hplc法)
[0062]
仪器:高效液相色谱仪(安捷伦1200),色谱柱大赛璐chiralpak ad-h(4.6*250mm, 5um)紫外可见检测器,全自动进样器,四元泵,ph计,超声波,分析天平(max:120g, d=0.1mg),溶剂过滤器,磁力搅拌、旋涡震荡仪,0.45μm滤膜,烧杯、量筒、容量瓶和移液器等。
[0063]
试剂:乙醇(色谱及)、三氟乙酸(色谱级)、正庚烷(色谱级)。
[0064]
操作步骤:
[0065]
流动相的制备:流动相a:取900ml正庚醇和100ml乙醇混合后,再加入1ml的三氟乙酸。以0.45μm滤膜减压过滤,超声波脱气15min。
nacl,30mm咪唑,ph 7.4)冲洗,再采用15ml洗脱缓冲液(20mm pbs,0.5m nacl, 500mm咪唑,ph 7.4)洗脱蛋白,收集洗脱蛋白液。将蛋白洗脱液置于透析袋中,置于20mmpbs(ph 7.4)中,于4℃透析过夜得到纯化酶液。
[0079]
纯化酶液采用sds-page聚丙烯酰胺凝胶(金斯瑞蛋白预制胶,catno.:m00667)做电泳检测。参见图2,泳道1是maon-lt纯化酶液蛋白条带,泳道2是maon11纯化酶液蛋白条带,泳道m是蛋白marker。纯化酶液采用考马斯亮蓝法(bradford蛋白含量试剂盒,上海翊圣生物科技有限公司)测定蛋白含量,maon-lt纯化酶液蛋白含量是6.4g/l,maon11 纯化酶液蛋白含量是11.2g/l。
[0080]
实施例4:单胺氧化酶的酶活测定及产物2光学纯度测定
[0081]
将4.5ml磷酸盐缓冲液(ph 7.5,100mm)、40μl过氧化氢酶(novozym,750000 ciu/ml)、900μl化合物1水溶液(ph7.5,0.4m)、3.56ml水加入到50ml摇瓶中,25℃摇床200rpm预热10min,然后加入1ml纯化后的酶maon-lt或者maon11,反应30min,取200μl反应液加入500μl 50%乙腈水溶液中,离心(12000rpm,5min)取上清进行hplc 检测。
[0082]
加入maon-lt酶溶液时,产生的化合物2峰面积为229.8(以峰面积代表酶活),比活力是35.9u/mg蛋白,产物的ee值为99.4%。加入maon11酶溶液时,产生的化合物2峰面积为318.8(以峰面积代表酶活),比活力是28.5u/mg,产物2的ee值为98.2%。这一结果表明,maon-lt的酶活力和立体选择性高于现有技术的单胺氧化酶。
[0083]
实施例5:单胺氧化酶的稳定性考察
[0084]
将30ml纯化后的单胺氧化酶maon-lt溶液置于100ml烧杯中,45℃水浴12h,测定酶活,化合物2峰面积为229.5;相对于原始酶活几乎没有下降。
[0085]
将30g单胺氧化酶maon-lt和4.2ml过氧化氢酶(novozym,750000ciu/ml)和0.4g 消泡剂置于100ml烧杯中,45℃水浴,同时向其中流加10%过氧化氢1h,测定酶活,化合物2峰面积为221.2;相对于原始酶活,酶活下降较少。
[0086]
该实验表明,单胺氧化酶maon-lt具有出色的热稳定性,适合于在较高温度下催化化合物1反应,有利于提高反应速度。
[0087]
实施例6:单胺氧化酶催化合成化合物3
[0088]
将115ml磷酸盐缓冲液(ph 7.0,20mm)加入到转化器(氧气通过底部通入并分散),控制温度在25℃左右,搅拌下依次加入30ml纯化后的单胺氧化酶maon-lt溶液、4.2ml 过氧化氢酶(novozym,750000ciu/ml)和0.4g消泡剂,加入3n氢氧化钠溶液将ph调至7.4,并向反应体系中通入纯氧(压力4.0psi或207mmhg);同时在另一个反应瓶中依次加入126ml水和35.0g亚硫酸氢钠,搅拌溶解后加入24.0g化合物1搅拌溶解。将料液缓慢滴加至转化器的酶溶液中,约12小时左右滴加完毕,同时用3n氢氧化钠溶液控制ph 保持在7.4,通过气相色谱测定底物的残留,在底物低于总加入量的1%时,结束反应。
[0089]
反应液垫硅藻土过滤,用自来水淋洗,滤液加入5g活性炭,搅拌1小时后过滤,自来水淋洗,滤液在45℃以下减压浓缩至大量固体析出,再降温至0℃左右,过滤,产物45℃下真空烘干得类白色固体54g。固体检测结果为:
[0090]
lc-ms(esi-)m/z=190.1。
[0091]1h nmr(400mhz,deuterium oxide)δ3.93(s,1h),3.07(dd,j=11.1,5.1hz,1h),2.85 (d,j=11.1hz,1h),1.50(d,j=7.0hz,1h),1.38(t,j=6.0hz,1h),0.98(d,j=
4.0hz,1h), 0.91(d,j=2.5hz,3h),0.85(s,3h)。
[0092]
波谱分析证明得到的白色固体为(1r,2s,5s)-6,6-二甲基-3-氮杂双环[3.1.0]己烷-2-磺酸钠,即化合物3。核磁共振氢谱见图1。
[0093]
上述实验结果表明,本发明筛选出的单胺氧化酶seq id no:1酶活力高,具有出色的热稳定性,并且具有高度立体选择性,能够有效催化底物1生成高光学纯度的化合物2,进而一锅法合成得到高光学纯度的化合物3,具有开发应用潜力。
[0094]
实施例7:单胺氧化酶催化合成化合物3
[0095]
将115ml磷酸盐缓冲液(ph 7.0,20mm)加入到转化器(氧气通过底部通入并分散),控制温度在25℃左右,搅拌下依次加入30ml纯化后的单胺氧化酶maon-lt溶液、4.2ml 过氧化氢酶(novozym,750000ciu/ml)和0.4g消泡剂,加入3n氢氧化钠溶液将ph调至7.4,并向反应体系中通入纯氧(压力4.0psi或207mmhg);同时在另一个反应瓶中依次加入126ml水和35.0g亚硫酸氢钠,搅拌溶解后加入24.0g化合物1搅拌溶解。将料液通过蠕动泵匀速地滴加至转化器的酶溶液中,控制在3小时滴加完毕,同时用3n氢氧化钠溶液控制ph保持在7.4,3.5小时取样,通过气相色谱测定底物的残留,底物低于总加入量的1%,结束反应。
[0096]
该实验结果表明,单胺氧化酶maon-lt由于比酶活较高,且不存在底物/产物抑制性和无机盐化学环境抑制性,因此底物和化学反应原料亚硫酸氢钠能够快速加入,因此该酶可以更快速地催化反应,大大缩短化合物3的合成反应时间,仅需几个小时即可完成反应,非常有利于工业化生产化合物3的批次控制并降低生产成本。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。