1.本发明涉及中药提取物技术领域,具体涉及赶黄草乙酸乙酯提取物在制备防治糖尿病的药物中的用途。
背景技术:
2.糖尿病是一种世界范围的流行性疾病,其中2型糖尿病(t2dm)约占所有糖尿病病例的90%。t2dm的病理生理学特征是胰岛素抵抗,β细胞功能障碍和慢性炎症引起的糖脂和蛋白质代谢紊乱,这些特征会缓慢且持续地阻碍血糖水平的控制,最终导致糖尿病并发症的发展。有研究证明肥胖会大大增加患t2dm的几率,并且会随着体重指数的增加而线性增加,然而全球有超过三分之一的人口超重或肥胖,这将极大地增加t2dm的潜在患病概率。如何有效防治糖尿病,成为世界关注的问题。
3.治疗糖尿病的药物种类很多,包括磺酰脲类药物(如格列本脲、格列齐特、格列喹酮)、双胍类药物(如二甲双胍)、α-葡萄糖苷酶抑制剂(如阿卡波糖)等。但这些药物均有不同程度的毒副作用,如最常使用的二甲双胍可能引起胃肠道反应,出现恶心、呕吐、腹泻。寻找到一种安全有效的防治糖尿病的药物具有重要意义,不仅减轻患者负担,也会减轻社会负担。目前,治疗糖尿病药物的研发标准已经提高,要以患者为中心,侧重于实现个体化血糖目标、优化安全性和预防并发症,甚至可以治疗糖尿病并发症。中医从整体出发,通过辨证论治,从根本上治疗疾病,因此具有很大优势。
4.四川省古蔺县的赶黄草(penthorum chinense pursh.,pcp)是一味中药,全草均可入药,具有清热解毒、退黄健脾、利水消肿、活血化瘀、保肝护肝的功效。目前对于赶黄草降血糖、治疗糖尿病的研究较少,仅有文献《赶黄草水提物对高脂饮食联合stz诱导的ⅱ型糖尿病大鼠的降血糖作用》(胡吉蕾等,现代食品科技,2020,36(2):25-30)研究表明赶黄草水提物具有明显的降血糖作用,专利cn103638073b公开了赶黄草乙醇提取物可治疗高血糖。由于赶黄草不同提取物的有效成分差异较大,对于赶黄草的其他提取物是否具有降血糖、治疗糖尿病的作用,目前尚不清楚。如果能研究更多用于降血糖、治疗糖尿病的赶黄草提取物,对于赶黄草应用以及临床防治糖尿病的用药选择具有重要意义。
技术实现要素:
5.本发明的目是提供赶黄草乙酸乙酯提取物在制备防治糖尿病的药物中的用途。
6.本发明提供了赶黄草乙酸乙酯提取物在制备防治糖尿病和/或糖尿病并发症的药物中的用途。
7.进一步地,所述药物为防治2型糖尿病和/或2型糖尿病并发症的药物。
8.进一步地,所述药物为改善胰岛素抵抗的药物。
9.进一步地,所述药物为促进糖吸收、和/或提高糖原合成能力、和/或促进glut4蛋白移位的药物。
10.进一步地,所述药物为降脂、减肥的药物;优选地,所述药物为促进脂肪氧化,抑制
g2细胞中糖原相对含量,实验结果用平均数
±
标准差(mean
±
sd)来表示,n=3,ns:no significant,*p《0.05,**p《0.01,***p《0.001与model组比较。
35.图5为pse促进glut4移向细胞膜的结果。
36.图6为pse通过激活pi3k-akt信号通路改善胰岛素抵抗的研究结果:a为pi3k/akt通路蛋白表达及磷酸化结果;b为mapk通路蛋白及foxo1a蛋白磷酸化结果;c为p-pi3k/pi3k结果量化图;d为p-akt/akt结果量化图;e为p-gsk-3β/gsk-3β结果量化图;f为glut4蛋白量化图,实验结果用平均数
±
标准差(mean
±
sd)来表示,n=3,*p《0.05,**p《0.01,***p《0.001与model组比较。
37.图7为过表达以及rna干扰gsk3b不影响pse对hep g2细胞的糖吸收能力的改善作用的结果:a为过表达及rna干扰gsk-3β结果;b为过表达及rna干扰gsk-3β结果量化图;c为过表达及rna干扰gsk-3β后hep g2细胞的糖吸收情况,实验结果用平均数
±
标准差(mean
±
sd)来表示,n=3,ns:no significant,*p《0.05,**p《0.01。
38.图8为3t3-l1细胞诱导分化模型评估结果:a为诱导分化步骤;b为油红o染色;c为尼罗红荧光染色;d为western blot检测fas表达;e为甘油三酯和总胆固醇含量测定。
39.图9为pse对3t3-l1细胞活力的影响,实验结果用平均数
±
标准差(mean
±
sd)来表示,n=3,ns:no significant,*p《0.05,**p《0.01,***p《0.001与control组比较。
40.图10为pse可以降低3t3-l1脂肪细胞中的脂质积累:a为油红o染色;b为尼罗红荧光染。
41.图11为不同浓度的pfe、pse和ple对brl-3a细胞活力的影响,##p《0.01与###p《0.001均表示与正常对照组相比差异极显著。
具体实施方式
42.本发明具体实施方式中使用的原料、设备均为已知产品,通过购买市售产品获得。
43.本发明使用的赶黄草茎的干燥材料购买于四川省古蔺县桂花乡臣相赶黄草种植专业合作社,经四川大学生命科学学院白洁副教授鉴定为赶黄草,材料经粉碎机粉碎后于-20℃密封保存。
44.实施例1、赶黄草乙酸乙酯提取物的制备
45.称取100g赶黄草茎粉末,加入25倍体积的70%乙醇(料液比1:25,g/ml),于55℃,59khz条件下超声提取,重复两次,每次40min。抽滤所得滤液合并后经旋转蒸发仪减压浓缩,然后加入200ml超纯水重悬,按照体积比1:1用乙酸乙酯进行萃取,萃取重复10次。将萃取液减压浓缩,获得赶黄草茎的乙酸乙酯提取物,命名为pse。
46.实施例2、赶黄草乙酸乙酯提取物改善胰岛素抵抗的研究
47.取实施例1制备的赶黄草茎的乙酸乙酯提取物(pse)进行实验。
48.细胞培养材料:人肝癌细胞hep g2和小鼠胚胎成纤维细胞3t3-l1均由中国科学院干细胞库提供。hyclone新生小牛血清购自依科赛生物;96孔板、24孔板、12孔板、6孔板、6cm培养皿、10cm培养皿购自洁特生物;细胞刮刀和冻存管购自无锡耐思生命科技股份有限公司。
49.实验材料:地塞米松和ibmx购自阿拉丁生物;无水葡萄糖、油红o染色液(细胞专用)、牛胰岛素和罗格列酮(rosiglitazone,rosi)购自solarbio;棕榈酸(palmitic acid,
pa)购自源叶生物;葡萄糖(glu)测试盒、糖原试剂盒、甘油三酯和胆固醇检测试剂盒购自南京建成;cell counting kit-8(cck-8)细胞增殖检测试剂盒购自上海陶术生物;尼罗红和2-nbdg葡萄糖摄取荧光探针购自上海懋康生物;gsk3b过表达基因质粒(ch833460)和penter(pd88001)购自山东维真生物;gsk3b-homo sirna购自上海吉玛制药;transintro tm el转染试剂盒购自transgen biotech;ly294002(pi3k抑制剂)、mk2206(akt抑制剂)、chir-99021(gsk-3抑制剂)购自碧云天生物;p-gsk3β(ser9)、gsk3β、pgc1α、fas、acc、p-acc(ser80)、pi3k p85α、p-pi3k(tyr607)、akt1/2/3、p-akt(ser473)、cd36、srebp1c、pparα、cpt1α、mapk通路抗体、gapdh、β-actin和β-tubulin购自上海艾博威斯生物;glut 4、foxo1a、p-foxo1a(ser329)和goat anti-rabbit igg(h l)hrp购自江苏亲科生物。
50.1、实验方法
51.1.1hep g2细胞实验
52.1.1.1细胞毒性实验
53.为探究pse对细胞的毒性大小,将处于生长对数期的细胞经消化后转移至细胞加样槽中使细胞密度为5
×
104个/ml,使用移液枪将细胞接种于96孔板中,每孔100μl,周围添加pbs防止培养基挥发,过夜使细胞贴壁。设置培养基组、细胞组(control组,只有细胞,不加药物)和加药组(使用pse处理细胞),每组5个重复。待细胞汇合至80%时,将control组细胞用无血清培养基培养,加药组添加不同浓度的pse培养(pse用无血清培养基分别稀释至终浓度为10、20、30、40、50、60、70和80μg/ml),培养24h。最后使用cck-8试剂测量450nm的光吸收值。
54.1.1.2胰岛素抵抗细胞模型建立
55.将细胞接种于96孔板中,待细胞汇合至70%时,添加含不同浓度葡萄糖(hg,葡萄糖的浓度为20、40、60和80mm)和浓度为250μm的棕榈酸(pa)的无血清培养基培养24h。培养结束后,收集细胞上清,在505nm波长下测定吸光度值。根据说明书计算具体糖吸收,所得值为培养基中剩余葡萄糖含量,用该孔中总的葡萄糖含量减去剩余量即为细胞对葡萄糖的吸收值。只用无血清培养基培养的细胞作为对照组(control)
56.1.1.3pse对细胞糖吸收的影响
57.将细胞接种于96孔板中,待细胞汇合至70%时,更换无血清培养。对照组(control)不加任何药物,模型组(model)、阳性对照组和加药组添加250μm棕榈酸和60mm葡萄糖诱导,同时阳性对照组加入10μm罗格列酮,加药组分别加入10、20和30μg/ml pse,孵育24h。培养结束后,收集细胞上清,在505nm波长下测定吸光度值。根据说明书计算具体糖吸收,所得值为培养基中剩余葡萄糖含量,用该孔中总的葡萄糖含量减去剩余量即为细胞对葡萄糖的吸收值。
58.1.1.4 2-nbdg葡萄糖摄取荧光探针检测
59.细胞接种于6孔板中,待细胞汇合至70%时,按照1.1.3所述方法分组并加药处理24h。然后,吸走培养液,加入含有2-nbdg(终浓度100μm)的无葡萄糖无酚红无血清培养基,培养箱中孵育2h。收集细胞,800rpm离心5min,弃上清,上机检测。
60.1.1.5糖原染色
61.用12孔板接种细胞,待细胞汇合至70%时,按照1.1.3所述方法分组并加药处理24h后,pbs清洗细胞表面。利用糖原染液对培养板中的糖原进行染色,冲洗15s左右,选择合
适的视野观察,摄取图像。
62.1.1.6免疫荧光
63.细胞接种于24孔板中,培养结束后利用免疫荧光来监测glut4葡萄糖转运蛋白4的膜移位情况,用dapi标记细胞核作为参照,判断目的蛋白的具体位置。具体操作方法如下:
64.(1)细胞固定:24孔板中细胞按照1.1.3中所述方法分组并加药处理24h后(pse浓度仅用30μg/ml),pbs清洗一次,加4%多聚甲醛在37℃环境下固定20min。
65.(2)通透:该方法是为了让抗体容易进入细胞,吸去多聚甲醛,pbs清洗3次,加0.5%triton x-100,室温通透20min。如果目的蛋白为膜蛋白则应省略这一步,因为triton x-100会破坏细胞膜。
66.(3)封闭:通透后用pbs清理3次,使用5%bsa室温封闭1h。从该步骤开始至结束,应避免样品干燥,否则会出现很高的背景。
67.(4)一抗孵育:一抗加入培养板中4℃孵育过夜。次日,回收一抗,用pbst清洗培养板,摇床缓慢摇动,洗涤3次。
68.(5)荧光二抗孵育:将稀释好的fitc标记的荧光二抗加入培养板中,室温避光孵育1h。pbst洗涤3次。
69.(6)复染核:在培养板中加入dapi染液,避光孵育20min。pbst洗涤3次,洗去多余的dapi染液。
70.(7)观察:加入抗荧光淬灭剂,可以使荧光效果保持很久;荧光显微镜光源预热30min。首先,在倒置荧光显微镜白光下找到合适的拍照位置和倍数。调节滤光片选择合适光波长。dapi和fitc荧光拍摄要保证是同一视野,随后将两张照片merge即可。
71.1.1.7western blot
72.按照1.1.3所述方法分组并加药处理后进行免疫印迹(western blot,wb)检测,具体实验操作步骤如下:
73.(1)收集裂解细胞提取蛋白:待100mm2培养皿里的hep g2细胞生长至90%汇合度时,将培养液吸走,清洗细胞,加入1ml胰酶,37℃消化5min后,终止胰酶消化;将贴壁细胞轻轻吹打下来并收集,于4℃下800rpm离心5min,吸走上清。向离心管中加入300μl ripa细胞裂解液和3μl蛋白酶抑制剂混合物,用枪头将细胞重悬并混匀;超声破碎(300w功率,3-5s/次,间隔10s,重复3次)细胞后,于4℃下15000rpm离心30min,上清即为蛋白提取物。
74.(2)蛋白浓度测定:在595nm吸光度下测定含量并调平,加入四分之一的sds-page上样缓冲液(5x)于100℃下煮沸5min变性,-80℃保存备用。
75.(3)电泳;分离胶配置好之后加入已经固定好的玻璃夹板中,缓慢加入蒸馏水压平分离胶液面,待其凝固后用滤纸将蒸馏水吸干,加入浓缩胶,轻轻插入梳子;凝固后组装到小型垂直电泳槽中,点样(蛋白样品和蛋白marker),插上电极。在电压90v下,待蛋白条带电泳至分离胶界面后,将电压调到120v至电泳结束。
76.(4)转模及封闭:活化pvdf膜后,按顺序放置并装到转印槽中,加入转膜液,100v恒压进行转模,蛋白分子量比较大的话可适当延长转膜的时间。结束后,tbst清洗pvdf膜一次转移至5%脱脂牛奶中室温封闭1h。
77.(5)一抗及二抗孵育:封闭结束后,tbst清洗pvdf膜10min,重复三次。孵育目标蛋白的一抗4℃下孵育过夜,再次清洗。室温孵育与一抗相对应的二抗1h。
78.(6)显影:清洗后,滴加ecl显影液于成像仪中显影,拍照后用image j软件分析定量。
79.1.1.8过表达gsk3b基因
80.lb培养基(含卡那霉素)中,将gsk3b质粒和空载质粒转化到大肠杆菌在里面,在37℃培养箱中以200rpm的转速摇动过夜。然后,将大肠杆菌裂解提取质粒,结果利用琼脂糖凝胶电泳检测,并测量所提质粒浓度。
81.将hep g2细胞以5
×
104个/ml的密度接种于60mm培养皿中,待细胞达到70%汇合度后,使用非脂质体转染试剂将合适浓度的质粒加入细胞中于37℃培养箱中转染5h。
82.收集细胞,使用western blot实验验证转染结果。
83.将细胞接种于96孔板中,待细胞达到70%汇合度后,使用非脂质体转染试剂将合适浓度的质粒加入细胞中于37℃培养箱中转染5h。对照组不加任何药物,模型组和加药组添加250μm棕榈酸和60mm葡萄糖诱导,过表达组、rna干扰组和加药组分别加入30μg/ml pse孵育24h。收集细胞上清,在505nm波长下测定吸光度值。根据说明书计算具体糖吸收,所得值为培养基中剩余葡萄糖含量,用该孔中总的葡萄糖含量减去剩余量即为细胞对葡萄糖的吸收值。
84.1.1.9 sirna转染
85.具体操作同1.1.8,将质粒更换为sirna,筛选具有干扰或沉默作用的序列,进行后续实验。
86.1.2 3t3-l1细胞实验
87.1.2.1 3t3-l1细胞诱导分化模型建立
88.(1)前脂肪细胞的培养与传代:将3t3-l1前脂肪细胞铺在100mm培养皿中加有新生牛血清的dmem高糖培养基37℃的10%co2中培养。若以后继续培养和传代,则应保证细胞汇合度不超过70%。
89.(2)mdi诱导:细胞融合2d后(即接触抑制后换液,再培养2d),用mdi诱导培养基:dmem高糖培养基中加入胎牛血清,另添加3-异丁基-1-甲基黄嘌呤(ibmx)至终浓度为0.5mm,地塞米松(终浓度为1μm)和胰岛素(insulin)(终浓度为1μg/ml)。培养2d后(诱导时间最少为48h,也可适当延长),会发现细胞形态有明显的变化(变得更加细长且细胞较为密集)。
90.(3)insulin诱导:mdi培养基诱导后,用pbs清洗细胞一次。然后,将培养基换为含有insulin(终浓度1μg/ml)的培养基继续培养4d,2d更换一次培养液。随着时间的延长,游离脂肪酸会由细胞产生并分泌到培养基里,使其变粘稠。
91.(4)dmem高糖培养基诱导:胰岛素培养基诱导后,再次用pbs冲洗一次。随后更换为dmem高糖培养基培养2d,可见细胞内脂滴变大。至此,3t3-l1前脂肪细胞已经诱导分化为脂肪细胞。
92.1.2.2 3t3-l1细胞毒性实验
93.具体操作同1.1.1细胞毒性实验。
94.1.2.3脂肪细胞甘油三酯(tg)和总胆固醇(t-cho)测定
95.将细胞接种于6孔板中诱导分化,待细胞分化为脂肪细胞时收集细胞到1.5ml离心管中,800rpm离心5min,弃上清。加入pbs进行超声破碎细胞。不离心,直接采用甘油三酯
(tg)和总胆固醇(t-cho)试剂盒在510nm波长下测量,根据说明书计算含量。
96.1.2.4油红o脂质染色
97.(1)工作液配置:将饱和油红o原液按3:2体积比加入蒸馏水混匀,室温放置5-10min,过滤后备用。
98.(2)染色:加入油红o工作液,室温染色10min左右,对6孔板中诱导分化后的脂肪细胞进行脂质染色。
99.(3)脱色:吸去染液,加入75%酒精或60%异丙醇,除去未结合的染料,蒸馏水冲洗3次。
100.(4)观察:倒置显微镜观察并拍照。
101.1.2.5尼罗红荧光染色
102.(1)工作液配置:称取适量尼罗红粉末于丙酮中,配置1mg/ml的母液,-20℃储存。
103.(2)染色:pbs冲洗诱导分化后的脂肪细胞3次,4%多聚甲醛固定30min,然后用60%异丙醇洗涤10min,6孔板干燥后加入终浓度为5μg/ml的尼罗红荧光染料,避光孵育15min。
104.(3)观察:pbs除去未与脂质结合的染料,观察并摄取图像。
105.1.3数据处理及统计方法
106.graphpad prism 8.0软件用来分析数据和作图。所有实验结果用平均数
±
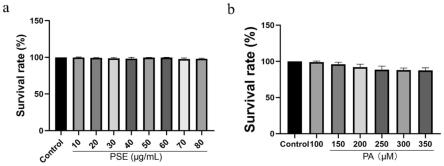
标准差(mean
±
sd)来表示,p《0.05时认为具有显著性差异。
107.2、实验结果
108.2.1 hep g2细胞实验结果
109.2.1.1 hep g2细胞毒性
110.通过cck-8来评估pse对细胞的毒性作用。用不同浓度的pse处理hep g2细胞24h之后可以发现(如图1a):pse浓度从10到80μg/ml,细胞存活率几乎接近于control组(无药物处理组),没有显著性差异,说明低剂量的pse对hep g2细胞几乎没有毒性作用。
111.用棕榈酸(pa)按照同样方法去处理细胞,浓度稀释至终浓度为100、150、200、250、300、350μm,结果图1b表明:pa浓度在250μm内对细胞几乎没有毒性,考虑到后续模型稳定性和重复性,选取pa浓度250μm作为后续细胞造模的浓度。
112.2.1.2胰岛素抵抗模型的建立
113.在加入250μm棕榈酸的基础上添加不同浓度的葡萄糖,根据细胞的糖吸收能力确定最佳造模条件。通过检测细胞培养基里的葡萄糖水平,随后用总的葡萄糖浓度减去培养基中葡萄糖浓度即得每组细胞的糖吸收水平。结果如下图2所示:在葡萄糖(hg)浓度为20、40mm时,细胞糖吸收与对照组相比没有显著性差异;当hg浓度到60、80mm时,细胞糖吸收能力有极显著(**p《0.01)的下降,60mm和80mm这两个浓度无显著性差异。所以,采取pa(250μm)和hg(60mm)联合加药处理24h的方式造模,从而模拟糖尿病病人机体内细胞对葡萄糖摄取降低的症状。
114.2.1.3 pse改善hep g2细胞糖吸收能力
115.在pa和hg联合诱导后,为探究pse能否提高hep g2细胞对糖吸收的能力,用两种方法来进行评估。如图3a所示:以10μm的罗格列酮(rosi)作为阳性对照,结果证明rosi可以显著提高细胞的糖吸收能力,同时,pse 10μg/ml也可以明显改善hep g2细胞的糖吸收能力
(**p《0.01),而当pse浓度达到20、30μg/ml时,糖吸收水平进一步提高(***p《0.001)。为提高实验结果的可靠性,又采用2-nbdg葡萄糖荧光探针来探究pse对细胞糖吸收的能力,结果如图3b所示:rosi可以明显提高细胞的糖吸收,pse 10μg/ml与模型组相比没有明显升高,pse 20μg/ml有显著升高(*p《0.05),pse 30μg/ml有极显著升高(**p《0.01)。综上所述,pse具有改善糖尿病细胞模型糖吸收的能力。
116.2.1.4 pse促进糖原积累
117.细胞在吸收额外的葡萄糖之后,除了正常氧化分解提供能量外,剩余葡萄糖会合成糖原。所以想探究pse促进细胞吸收葡萄糖之后,是否会有糖原的合成。
118.从图4a可以清楚地看到control组细胞内紫红色的糖原颗粒特别明显,而pa和hg联合加药(model组)后糖原合成特别少,当分别添加rosi和pse时,都可以显著地逆转pa和hg对细胞糖原合成的影响,且pse可以剂量依赖性地提高细胞的糖原合成能力。
119.2.1.5 pse促进葡萄糖转运蛋白glut4向细胞膜转移
120.前面的实验已经证明了pse可以提高胰岛素受损的细胞对葡萄糖的吸收能力,以及促进细胞糖原的合成来储存多余的糖。而葡萄糖作为亲水化合物是无法自由通过疏水性的细胞膜,这时便需要一个载体来转运葡萄糖即葡萄糖转运蛋白4(glut4)。静息状态下,glut4蛋白一般储藏于细胞内的囊泡中,当受到外界干扰时便会移位至细胞膜来进行葡萄糖的转运。因此,借助免疫荧光实验,以dapi染料标记的细胞核为基准,研究pse是否会促进glut4蛋白的移位来提高细胞对葡萄糖的吸收能力。
121.用fitc标记的二抗来对glut4进行标记,结果如图5所示,正常状态下(control组)的位于蓝色细胞核外面的绿色glut4蛋白要比hg和pa(model组)处理之后的要多一些,在加入阳性药物rosi(10μm)和pse(30μg/ml)之后,glut4的膜移位较model组有很明显的增多,证明pse可以促进glut4蛋白的移位从而促进细胞对葡萄糖的吸收。
122.2.1.6 pse通过激活pi3k-akt/gsk-3β信号通路改善糖尿病
123.wb研究表明,pa和hg的联合诱导使细胞pi3k-akt通路相关蛋白表达(p-pi3k/pi3k、p-akt/akt、p-gsk-3β/gsk-3β的比例和glut4蛋白的表达)和foxo1a蛋白磷酸化水平(p-foxo1a/foxo1a)下调,mapk通路相关蛋白磷酸化表达(p-jnk/jnk、p-erk/erk和p-p38/p38的比例)上调。而pse的加入可以逆转上述通路及相关蛋白的改变。由图6c~f的量化指标可以看出pse可以剂量依赖性地使pi3k、akt、gsk-3β的磷酸化和glut4的表达升高,进而对糖尿病起到改善、治疗作用。
124.2.1.7过表达以及干扰gsk3b不影响pse对hep g2细胞的糖吸收能力的改善作用
125.如图7a和图7b所示:将gsk3b质粒及sirna转染到细胞后,发现过表达gsk3b基因可以使gsk-3β蛋白表达显著升高(*p《0.05);sigsk-3β#1、#2、#3都可以使gsk-3β蛋白表达下降,但sirna#3的干扰效果最佳(**p《0.01),干扰效果在60%左右,所以采用sirna#3来进行糖吸收研究。
126.在将gsk3b基因分别过表达和干扰之后,检测各组细胞的糖吸收能力,图7c结果表明对gsk-3β蛋白水平的调节并不影响细胞对葡萄糖的吸收,即加入pse组和加入pse同时过表达或干扰gsk3b基因的组,三组之间对于葡萄糖的吸收能力没有显著的差别。
127.2.2 3t3-l1细胞实验结果
128.2.2.1 3t3-l1细胞诱导分化模型评估
129.因为肥胖与糖尿病之间有着密切的联系,因此想建立脂肪细胞模型来探究pse对脂肪细胞的影响。3t3-l1前脂肪细胞经过图8a的诱导分化过程后,细胞内几乎都会有脂滴出现,这时3t3-l1已经分化为脂肪细胞。故先对脂肪细胞的一些指标进行检测。首先,采用油红o(图8b)脂质染色和尼罗红荧光(图8c)观察脂肪细胞内的脂滴,可以发现在诱导分化后的脂肪细胞内的脂滴比正常组前脂肪细胞有着显著地增加。接着便利用wb来验证脂肪酸合成关键酶fas的表达情况,图8d结果表明脂肪细胞内的fas表达明显上调。最后,利用试剂盒检测了脂肪细胞内甘油三酯(tg)和总胆固醇(t-cho)的含量,和预期一致,tg和t-cho的合成显著升高。总而言之,所有指标都符合脂肪细胞的特定,说明3t3-l1细胞成功诱导分化成脂肪细胞。
130.2.2.2 pse对3t3-l1细胞活力的影响
131.采用上述诱导分化方法,当细胞变为脂肪细胞后,评估pse对其的毒性大小。由图9可知,pse浓度在10到30μg/ml时,对细胞基本没有毒性(不具有显著性),40μg/ml之后细胞毒性显著增加。故选用10、20和30μg/ml的浓度进行后续实验。
132.2.2.3 pse可以降低3t3-l1脂肪细胞中的脂质积累
133.同样采用油红o和尼罗红两种脂滴染色方式来观察脂肪细胞内的脂滴情况,结果如图10所示,两种染色结果都表明pse可以剂量依赖性地降低脂肪细胞中脂滴的积累,有研究报道机体过多的脂肪堆积会诱发胰岛素抵抗。因此,pse的降脂作用为胰岛素抵抗的治疗提供可行性。
134.研究还发现pse可促进脂肪氧化,抑制脂肪合成。
135.上述实验表明赶黄草茎的乙酸乙酯提取物(pse)在使用剂量下对细胞几乎没有毒性,安全性好。从功效上看pse可以促进glut4蛋白的移位,改善糖尿病患者的糖吸收,提高糖原合成能力,进而改善胰岛素抵抗;同时,pse具有良好的降脂、减肥效果,通过降脂、减肥也可以有效防治糖尿病。可见本发明研究发现pse可防治胰岛素抵抗甚至糖尿病及糖尿病并发症的发生。
136.以下通过具体试验例证明本发明的有益效果。
137.实验例1、赶黄草不同部位乙酸乙酯提取物的研究
138.1、实验方法
139.试验例:实施例1制备的赶黄草茎乙酸乙酯提取物(pse)。
140.对比例1:按照实施例1所述方法,将赶黄草茎粉末替换为赶黄草花粉末,制备得到的赶黄草花乙酸乙酯提取物(pfe)。
141.对比例2:按照实施例1所述方法,将赶黄草茎粉末替换为赶黄草叶粉末,制备得到的赶黄草叶乙酸乙酯提取物(ple)。
142.将上述pse、pfe、ple溶于磷酸盐缓冲液(pbs)用于体外细胞毒性测定。采用cck-8细胞增殖与毒性检测法分别测定pfe、pse与ple的细胞毒性。取对数生长期的brl-3a细胞,经不含edta的胰酶消化后,离心弃上清,用dmem培养液重悬为单细胞悬液,以6
×
104细胞/ml接种于96孔板,每孔100μl,设立对照组和实验组(实验组包括试验例、对比例1和对比例2),每组5个平行。过夜培养12h后弃除培养液,对照组加入100μl新鲜培养液(含0.1%的dmso),实验组加入不同浓度(20-200μg/ml)的pfe、pse与ple分别处理24h,然后吸走上清,每孔加入100μl无血清培养液(含有10μl cck-8)于37℃孵育1h,用酶标仪测定450nm处的吸
光值,存活率用实验组/对照组表示。
143.数据分析采用spss(19.0)与graphpad prism软件。实验结果表示为平均值
±
标准差(mean
±
sd),用单因素方差分析(anova)进行组间的差异分析,p《0.05代表差异显著,p《0.01与p《0.001均代表差异极显著。
144.2、实验结果
145.由图11可知:相同浓度的pfe、pse与ple处理brl-3a细胞24h后,pfe与ple处理组的细胞活力相比于正常对照组明显降低,且细胞活力随着浓度的增加而逐渐降低。pse对细胞基本没有毒性,仅在200μg/ml时对细胞有微弱毒性(存活率为81.38%,p《0.01),所以本发明实验选用的pse的浓度小于200μg/ml。
146.综上,本发明研究发现pse可以促进glut4蛋白的移位,改善糖尿病患者的糖吸收,提高糖原合成能力;同时,pse具有良好的降脂、减肥效果。因此pse具有防治胰岛素抵抗甚至糖尿病及糖尿病并发症的效果。此外,pse安全性好,具有良好的应用前景。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。