1.本发明属于体外生物组织培养和分析技术领域,具体涉及涉体外细胞、组织、器官培养及分析的微流控装置。
背景技术:
2.传统的细胞培养技术以单一种类的原代细胞或增殖细胞系作为细胞来源进行体外培养,通常在固-液界面形成单层的细胞,会丧失细胞在自然生长环境中的许多生物学特性。为了更好地在体外重建细胞的器官型结构,可以采用膜支撑细胞培养的方式,将不同种类的细胞在微流控构建的差别基质中共培养,并通过膜介质,以不同生物样本为来源,构建液-液或气-液界面支撑多种体外组织和器官培养。之后,对培养的细胞、组织或器官进行通量化、免疫组化分析等形式的检测。旨在构建特定的生理或病理模型以及疾病关联模型,供药物筛选/活性评价、疾病机制研究等方面的应用。
3.transwell滤膜小皿插件是目前商用化最广泛的细胞共培养系统,滤膜多用半透明或透明材料(聚碳酸酯、聚乙烯对苯二甲酸三酯和聚四氟乙烯),插件可嵌入市售的24孔、12孔、6孔等不同规格的细胞培养板中。kang等(kang yb, rawat s, cirillo j, bouchard m, noh hm. layered long-term co-culture of hepatocytes and endothelial cells on a transwell membrane: toward engineering the liver sinusoid. biofabrication 2013, 5(4): 045008.)成功地在体外模拟了大鼠肝窦模型,分别在transwell滤膜的两侧共培养了大鼠原代肝窦内皮细胞和大鼠原代肝细胞:在57天内细胞都能保持活力和正常形态;长时间培养下,内皮细胞仍具备分化特性,肝细胞能够保持特异性功能,可进一步地用作肝病研究、毒理学研究和药物筛选的模型。此外,这种transwell滤膜小皿插件还成功应用于体外生理屏障的建立(chang sh, ko pl, liao wh, peng cc, tung yc. transwell insert-embedded microfluidic devices for time-lapse monitoring of alveolar epithelium barrier function under various stimulations. micromachines (basel) 2021, 12(4);zakharova m, tibbe mp, koch ls, le
‐
the h, leferink am, den berg a, et al. transwell
‐
integrated 2
ꢀµ
m thick transparent polydimethylsiloxane membranes with controlled pore sizes and distribution to model the blood
‐
brain barrier. advanced materials technologies 2021, 6(12).)。
4.但是,需要指出,市售transwell的培养系统通常是静止的。研究表明,流体剪切力等物理因素对细胞/组织/器官的生长至关重要(choe a, ha sk, choi i, choi n, sung jh. microfluidic gut-liver chip for reproducing the first pass metabolism. biomed microdevices 2017, 19(1): 4.)。donald等(huh d, matthews bd, mammoto a, montoya-zavala m, hsin hy, ingber de. reconstituting organ-level lung functions on a chip. science 2010, 328(5986): 1662-1668.)建立了第一个模拟人肺泡-血管功能的微流控芯片,在pdms(聚二甲基硅氧烷)多孔膜两侧共培养人肺泡上皮细胞
和人微血管内皮细胞,其中,上皮细胞通道暴露在气体环境中,内皮细胞通道内的培养基为流动状态,该仿生芯片被用于炎症反应研究和纳米毒理学研究。吴欣童等人(吴欣童,丁东,韩壮等,一种差异共培养两种细胞的双层细胞培养装置[p]. cn113234593 a,2021-03-26.)发明了一种细胞共培养装置,利用流剪腔形成的剪切力对细胞加载应力刺激从而促使细胞的体外培养。wang等(wang y, wang h, deng p, tao t, liu h, wu s, et al. modeling human nonalcoholic fatty liver disease (nafld) with an organoids-on-a-chip system. acs biomaterials science & engineering 2020, 6(10): 5734-5743.)在自制的pdms微流控芯片上,完成了人肝脏类器官的培养,并建立了非酒精性脂肪肝疾病的模型,研究者对该模型进行了形态观察、基因、功能化以及代谢组学分析,探索其作为疾病模型用于疾病机制研究和药物筛选的可能性。可以发现,上述基于芯片设计的细胞/组织/器官培养装置均具备流动的培养体系,尽可能还原了各自的生长状态,与静态培养体系相比更接近实际生理状态,更适于仿生模型的建立。但是,值得关注的是,芯片的设计与制造也存在费时、成本较高等问题,难以达到通量化、标准化的培养与分析目的,存在一定的不足。因此,本发明旨在建立一种能够实现通量化的细胞/组织/器官培养及分析的微流控装置。
技术实现要素:
[0005]
鉴于上述分析,本发明旨在提供一种通量化体外细胞、组织、器官培养及分析的微流控装置,用于解决现有细胞共培养设备不能实现通量化、流动式培养及分析的问题。
[0006]
本发明提供的体外通量化细胞、组织、器官培养和分析的微流控装置,包括自上而下排布的盖板、标准化孔板、滤膜、密封垫、培养液流通板或检测液流通板;其中:所述标准化孔板,用于支撑滤膜,所述滤膜用于细胞等生物组织或器官的培养;所述培养液流通板,板内设有多排通道,每个通道外接培养液储存池,并通过软管与蠕动泵相连,用于营造动态的培养体系;每列通道设有入口管道与出口管道,以形成能够使培养液从入口处进入培养通道内、从出口处流出,由蠕动泵循环的液体流动路径;所述检测液流通板,板内设有多排通道,该通道与培养液流通板内的通道呈垂直设计,用于生物培养后的细胞免疫组化染色等的分析检测的;通道设置有入口管道与出口管道,以使检测液能够从入口处注入通道内潴留或从出口处排出或吸出。
[0007]
所述密封垫设置与所述标准化孔板与所述培养液流通板或所述检测液流通板之间;所述盖板,避免细菌等对培养板内细胞等的污染。
[0008]
由标准化孔板、滤膜、密封垫与培养液流通板组合一起,用于通量化体外细胞、组织、器官的培养;由标准化孔板、滤膜、密封垫与检测液流通板组合一起,用于通量化体外细胞、组织、器官的分析检测。
[0009]
进一步地:所述标准化孔板与市售的6孔、12孔、24孔、48孔、96孔、384孔或其他规格培养板的孔径及相对位置保持一致;相应地,培养液流通板内每列的通道尺寸及相对位置与标准化孔板尺寸基本保持一致;检测液流通板内每列的通道尺寸及相对位置与标准化孔板尺寸基
本保持一致,并与培养液通道板内的通道做垂直设计。
[0010]
所述盖板规格与市售的6孔、12孔、24孔、48孔、96孔、384孔或其他规格培养板的孔径及相对位置保持一致。
[0011]
所述培养液流通板上,每个通道的直径范围为0.1
ꢀ–ꢀ
5.0 cm,优选为0.1
ꢀ–ꢀ
2.0 cm。
[0012]
所述检测液流通板上,每个通道的直径范围为0.1
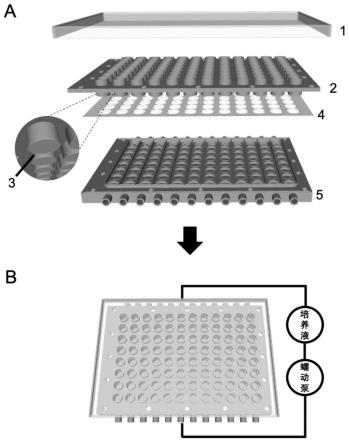
ꢀ–ꢀ
5.0 cm,优选为0.1
ꢀ–ꢀ
2.0 cm。
[0013]
所述滤膜,其孔径范围为0.2
–
100.0
ꢀµ
m,优选为0.2
–ꢀ
20
µ
m。
[0014]
所述滤膜,用于细胞共培养时,优选0.4
–
3.0
ꢀµ
m的径迹轨道刻蚀滤膜。
[0015]
所述滤膜,材料为聚碳酸酯、聚乙烯对苯二甲酸三酯或聚四氟乙烯滤膜。
[0016]
所述标准化孔板的孔隙之间以无毒、有弹性的材料填充,材料可为固化的聚二甲基硅氧烷(pdms)、橡胶、硅胶等。
[0017]
所述标准化孔板、培养液流通板、检测液流通板的四周相同位置均做穿孔设计;用作后续检测分析时,标准化孔板与培养液流通板分离,和检测液流通板叠合,并用螺丝穿过四周孔内,用于固定和密封。
[0018]
所述盖板、标准化孔板、培养液流通板、检测液流通板均为无毒材料(生物相容性树脂、聚苯乙烯、聚甲基丙烯酸甲酯等),可用3d打印技术或筑模浇铸等方式制造。
[0019]
在培养使用状态下,将标准化孔板、滤膜、密封垫、培养液流通板组合一起,用螺丝穿过标准化孔板、培养液流通板四周孔内,用于固定和密封,根据不同的培养需求,滤膜上可选择性涂布细胞外基质、明胶等,将培养物接种于膜上后,用软管将装有培养液的容器通过蠕动泵或注射泵与培养流通板入口连接,出口处以软管连接回培养液中,实现培养液在通道内的动态循环。
[0020]
培养后,检测使用状态下,将标准孔板、滤膜、密封垫的整体与培养液流通板分离,再和检测液流通板叠合,并用螺丝穿过四周孔内,用于固定和密封,将用于检测不同细胞功能的检测或标记试剂,分别添加于上层孔内或通入下层通道内,按照检测试剂操作规程进行染色或标记后,可置于酶标仪等通量化分析仪器中测定。
[0021]
所述通量化体外细胞、组织、器官培养和分析的微流控装置,可用于构建气-血屏障、血-脑屏障、肠道屏障等生物屏障功能结构、多器官共培养、类器官培养等生理和病理模型,可用于模型评价的分析检测。
[0022]
作细胞共培养使用时,粘有滤膜的标准化孔板孔隙之间做无毒弹性材料填充,然后将标准化孔板与培养液流通板叠合,并用螺丝穿过四周孔内,用于固定和密封。将上述整体翻转,每列通道内注入含一定数量的下层细胞培养液,盖上盖板,置于细胞培养箱内,静待下层细胞贴膜后取出,再将上述整体翻转,每孔内接种含一定数量的上层细胞培养液,盖上盖板,置于细胞培养箱内,静待上层细胞贴膜后取出。吸干培养液以去除未贴膜细胞,每孔内加入新鲜培养基,滋养上层细胞,可选地,用作气-液界面培养时,无需为上层细胞添加新鲜培养液。培养液流通板的每列通道以软管连通培养液储存池,采用蠕动泵实现培养液在通道内的动态循环,为该层细胞提供动态培养环境,流速范围为:0.0025
ꢀ–ꢀ
1 ml/min。可选地,根据不同的培养需求,滤膜上可选择性涂布细胞外基质、明胶等。
[0023]
细胞培养结束后,作后续检测分析使用时,停止蠕动泵,吸干板内残存培养液,将
标准孔板与培养液流通板分离,再和检测液流通板叠合,并用螺丝穿过四周孔内,用于固定和密封。可选地,将用于检测不同细胞功能的检测试剂,分别添加于上层孔内或下层通道内,按照检测试剂操作规程,完成分析检测步骤;根据检测目的不同,为了防止检测液串扰和污染,检测液流通板可设计为连通模式或独立检测孔模式。
[0024]
作生物组织或器官培养或分析时,滤膜材质、滤膜尺寸、流速范围及检测试液等可根据实验目的作调整,微流控装置工作模式与前述基本一致。
[0025]
本发明微流控装置解决现有细胞共培养设备不能实现通量化、流动式培养及分析的问题,可用于构建气-血屏障、血-脑屏障、肠道屏障等生物屏障功能结构、多器官共培养、类器官培养等生理和病理模型,用于模型评价的分析检测。
附图说明
[0026]
图1 为本发明的微流控装置,用于细胞、组织、器官培养时的装置组成及工作方式。其中,(a)为培养装置的组成;(b)为装置工作方式简易图。
[0027]
图2为本发明的微流控装置,用于培养后分析检测的装置组成及工作方式。其中,(a)分析装置的组成;(b)装置工作方式简易图。
[0028]
图3为本发明的微流控装置用于气-血屏障及细菌合并病毒共感染的肺炎模型建立。
[0029]
图4为本发明的微流控装置用于血-脑屏障的建立。
[0030]
图5为本发明的微流控装置用于肠道屏障和细菌与宿主共生模型的建立。
[0031]
图6为本发明的微流控装置用于多器官共培养模型的建立。
[0032]
图7为本发明的微流控装置用于肺类器官模型的建立。
[0033]
图中标号:1为盖板,2为标准化孔板,3为滤膜,4为密封垫,5为培养液流通板,6为检测液流通板。
具体实施方式
[0034]
下面结合附图对本发明进行详细说明,其中,附图构成本技术的一部分,并与本发明的实施例一起用于阐释本发明的原理,并非用于限定本发明的范围。
[0035]
首先,结合附图对本发明装置的基本构造及工作方式进行说明。
[0036]
1.一种通量化细胞/组织/器官培养和分析的微流控装置,其用于细胞、组织或器官培养时的构造及工作方式如附图1所示:装置构造如附图1(a)所示:自上而下包括盖板1、标准化孔板2、滤膜3、密封垫4、培养液流通板5。
[0037]
所述标准化孔板2的规格与市售的6孔、12孔、24孔、48孔、96孔、384孔或其他规格培养板的孔径及相对位置保持一致,附图1a所示为标准96孔板。
[0038]
所述滤膜3的材质可以为径迹轨道刻蚀的聚碳酸酯、聚乙烯对苯二甲酸三酯或聚四氟乙烯滤膜等,根据实验需求,孔径范围为0.2
ꢀ–ꢀ
100.0
ꢀµ
m。
[0039]
所述密封垫4的材料可为固化的聚二甲基硅氧烷(pdms)、橡胶、硅胶等,为无毒、有一定弹性的材料。
[0040]
所述盖板1、标准化孔板2、培养液流通板5的材质均为无毒材料(生物相容性树脂、
聚苯乙烯、聚甲基丙烯酸甲酯等),可用3d打印技术、筑模浇铸等方式制造。
[0041]
所述标准化孔板2、滤膜3、密封垫4、培养液流通板5组合一起,用螺丝穿过标准化孔板2、培养液流通板5四周孔内,用于固定和密封,可作细胞/组织/器官培养使用。其基本工作方式如附图1b所示:装置组装完毕后,在滤膜两侧接种细胞、组织或器官样本后,培养液流通板的每列通道分别以软管连通培养液储存池,采用蠕动泵实现培养液在通道内的动态循环,为膜一侧的生物样本提供动态培养环境。盖板1用于防止细菌等病原体对细胞、组织或器官的污染,盖板1也可换为培养液流通板5,倒扣并紧固密封于标准孔板2上,同样地,以软管接通培养储存池,并用蠕动泵实现培养液在通道内的动态循环,为膜另一侧的生物样本提供动态培养环境。每列可构建一种生理或病理模型,以96孔板为例,共12列,则为12种生理或病理模型。
[0042]
2. 一种通量化细胞、组织、器官培养和分析的微流控装置,其用于细胞、组织或器官培养后分析检测时的构造及工作方式如附图2所示:所述标准孔板2、滤膜3、密封垫4的整体与培养液流通板5分离,再和检测液流通板6叠合,并用螺丝穿过四周孔内,用于固定和密封(附图2a)。将用于检测不同细胞功能的检测试剂(试液1-8,共8种),分别添加于上层孔内或下层通道内,按照检测试剂操作规程,可置于酶标仪等通量化分析仪器中测定,以96孔板为例,12种生理或病理模型将分别得到8种不同指标的数据结果(附图2b)。根据检测目的的不同,为了防止检测串扰或污染,检测液流通板可设计为连通模式或独立检测孔模式。
[0043]
下面,将结合具体实施例及附图,对本发明装置的具体应用作说明。
[0044]
实施例1:气-血屏障和相关病理模型的建立以及后续分析检测应用一种通量化细胞、组织、器官培养和分析的微流控装置用于气-血屏障的建立时,如附图3所示:将所述标准化孔板2、滤膜3、密封垫4、培养液流通板5的整体组合翻转,每列通道内注入含一定数量的内皮细胞(huvec细胞、原代肺微血管内皮细胞等)培养液,盖上盖板1,置于细胞培养箱内,静待内皮细胞贴膜后取出,再将上述整体翻转,每孔内接种含一定数量的上皮细胞(a549细胞、nci-h411细胞、原代肺泡上皮细胞等)培养液,盖上盖板,置于细胞培养箱内,静待上皮细胞贴膜后取出。吸干上皮细胞层培养液,采用气-液界面方式继续培养,更换内皮细胞层的培养液,将每列通道以软管连通培养液储存池,采用蠕动泵实现培养液在通道内的动态循环,为内皮细胞提供动态培养环境,流速范围为:0.0025
–
1 ml/min,建立气-血屏障模型。
[0045]
基于上述气-血屏障模型,可进一步构建相关病理模型,以细菌(金黄色葡萄球菌等)合并病毒(流感病毒iv)感染构建肺炎模型为例:在所建气-血屏障基础上,停止动态培养条件,在上皮层先后引入流感病毒iv和金黄色葡萄球菌,共感染0~120 min后,更换新鲜培养液并去除多余感染物,继续恢复内皮细胞的动态培养,建立细菌合并病毒共感染的肺炎模型。
[0046]
评价气-血屏障模型、肺炎模型等效果,对相关指标可以进行测定:停止所述标准化孔板2、滤膜3、密封垫4、培养液流通板5整体培养装置的动态培养条件,吸除通道内的培养液,用预热的磷酸盐缓冲液(pbs)洗涤后将培养液流通板5取下,将检测液流通板6与标准化孔板2、滤膜3、密封垫4组装并密封紧固,根据检测目的,每一排上孔或下通道内可加入相应检测液,例如:评价上皮屏障完整性时采用zo-1、e-cadherin等免疫荧光染色试剂(通道
可作连通设计),评价细胞渗透率时可采用fitc-右旋糖苷试液(通道为独立孔设计),评价细胞活力时可采用cck8、mtt等试液(通道为独立孔设计)。
[0047]
实施例2:血-脑屏障的建立一种通量化细胞/组织/器官培养和分析的微流控装置用于血-脑屏障的建立时,如附图4所示:将所述标准化孔板2、滤膜3、密封垫4、培养液流通板5的整体组合翻转,每列通道内注入含一定数量的内皮细胞(hcmec/d3细胞、原代脑微血管内皮细胞等)培养液,盖上盖板1,置于细胞培养箱内,静待内皮细胞贴膜后取出,再将上述整体翻转,每孔内接种含一定数量的上皮细胞(星型胶质细胞等)培养液,盖上盖板,置于细胞培养箱内,静待上皮细胞贴膜后取出。为上皮及下皮细胞层更换新鲜的培养液,将每列通道以软管连通培养液储存池,采用蠕动泵实现培养液在通道内的动态循环,为内皮细胞提供动态培养环境,流速范围为:0.0025
ꢀ–
1 ml/min,建立血-脑屏障模型。
[0048]
病理模型的根据实验需要构建,后续检测根据实验目的与实施例1所述基本一致。
[0049]
实施例3:肠道屏障和细菌与宿主共生模型的建立一种通量化细胞/组织/器官培养和分析的微流控装置用于肠道屏障的建立时,如附图5所示:将所述标准化孔板2、滤膜3、密封垫4、培养液流通板5的整体组合翻转,每列通道内注入含一定数量的内皮细胞(himec细胞、原代肠微血管内皮细胞等)培养液,盖上盖板1,置于细胞培养箱内,静待内皮细胞贴膜后取出,再将上述整体翻转,每孔内接种含一定数量的上皮细胞(caco-2细胞等)培养液,盖上盖板,置于细胞培养箱内,静待上皮细胞贴膜后取出。吸干上皮细胞层培养液,采用气-液界面方式继续培养,更换内皮细胞层的培养液,将每列通道以软管连通培养液储存池,采用蠕动泵实现培养液在通道内的动态循环,为内皮细胞提供动态培养环境,流速范围为:0.0025
–
1 ml/min,建立肠道屏障模型。
[0050]
基于上述建立的肠道屏障模型,可以进一步构建肠道菌群与宿主共生的模型:在所建肠道屏障基础上,停止动态培养条件,在上皮层引入不同种类的细菌,继续恢复内皮细胞的动态培养不同天数,建立肠道菌群与宿主共生的模型。
[0051]
后续检测根据实验目的与实施例1所述基本一致。
[0052]
实施例4:多器官共培养模型的建立一种通量化细胞/组织/器官培养和分析的微流控装置可用于多器官共培养模型的建立,如附图6所示:将所述标准化孔板2、滤膜3、密封垫4、培养液流通板5的整体组合翻转,每列通道内注入含一定数量的内皮细胞(huvec细胞、原代内皮细胞等)培养液,盖上盖板1,置于细胞培养箱内,静待内皮细胞贴膜后取出,再将上述整体翻转,在每列(a-l)的不同孔内分别接种含一定数量的代表不同器官的上皮细胞(肝:heprg细胞;肠:caco-2细胞;肺:a549细胞或相应的原代细胞)培养液,盖上盖板,置于细胞培养箱内,静待上皮细胞贴膜后取出。采用气-液界面方式培养的上皮细胞(肠、肺等)孔内,吸干培养液;不采用气-液界面培养方式的上皮细胞(肝等)孔内,更换新鲜培养液;内皮细胞层更换新鲜培养液,将每列通道以软管连通培养液储存池,采用蠕动泵实现培养液在通道内的动态循环,为内皮细胞提供动态培养环境,流速范围为:0.0025
–
1 ml/min,建立多器官共培养的模型。
[0053]
后续检测根据实验目的与实施例1所述基本一致。
[0054]
实施例5:肺类器官模型的建立一种通量化细胞/组织/器官培养和分析的微流控装置可用于肺类器官的培养,如
附图7所示:将所述标准化孔板2、滤膜3、密封垫4、培养液流通板5的整体组合翻转,每列通道内注入含一定数量的内皮细胞(huvec细胞、原代肺微血管内皮细胞等)培养液,盖上盖板1,置于细胞培养箱内,静待内皮细胞贴膜后取出,再将上述整体翻转,在每列(a-l)的不同孔内接种:含i型胶原的肺类器官球体溶液或含i型胶原的人肺诱导多功能前体干细胞溶液;待类器官球体较好地被包埋进细胞外基质并附着于滤膜上时,为上层肺类器官及下皮细胞层更换新鲜的培养液,将每列通道以软管连通培养液储存池,采用蠕动泵实现培养液在通道内的动态循环,为内皮细胞提供动态培养环境,流速范围为:0.0025
–
1 ml/min,盖上盖板,置于细胞培养箱内继续培养,以建立多器官共培养的模型。
[0055]
后续检测根据实验目的与实施例1所述基本一致。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。