一种植物乳杆菌sl1及其发酵方法
技术领域
1.本发明涉及微生物发酵技术领域,特别是涉及一种植物乳杆菌sl1及其发酵方法。
背景技术:
2.随着生活水平的不断提高,健康合理、营养均衡的理念已逐渐成为消费者的饮食标准,发酵肉制品具有极高的营养价值和独特的风味,因此其受到越来越多消费者的青睐,成为居民日常膳食中的重要组成部分。发酵肉制品是原料肉在自然或人工控制条件下,借助微生物发酵作用,产生的具有典型发酵风味、色泽和质地,且具有较长保存期的一类肉制品。
3.而乳酸菌作为目前在发酵肉制品中广泛应用的菌种,具有良好的发酵性能和促进风味形成能力。乳酸菌在不同发酵环境中(如发酵温度、时间、ph、接种量等)其产酶特性不同;而同种微生物蛋白酶在不同发酵条件下(如温度、ph)的性质亦存在一定差异。然而微生物蛋白酶活力直接影响产品特征风味的形成。因此发酵过程中如何通过控制和优化发酵条件来提升微生物特异蛋白酶活力是提升产品风味的关键。但是现有技术中发酵肉制品所使用的菌剂并未重点研究如何提高其微生物蛋白酶活力。因此筛选一株具有产蛋白酶能力的菌株并设计一种提高其蛋白酶活力的发酵方法是十分有必要的。
技术实现要素:
4.本发明的目的是提供一种植物乳杆菌sl1及其发酵方法,以解决上述现有技术存在的问题,该菌株具有产蛋白酶能力,其发酵液蛋白酶活力高,可减少后续发酵产品所使用的发酵菌剂的用量,缩短发酵时间,降低成本。
5.为实现上述目的,本发明提供了如下方案:
6.本发明提供一种植物乳杆菌sl1(lactobacillus plantarum sl1),其已在中国典型培养物保藏中心保藏,保藏编号为cctcc no:m 2022015,保藏地址为中国
·
武汉
·
武汉大学,保藏日期为2022年 01月05日。
7.本发明还提供一种根据上述植物乳杆菌sl1的发酵方法,包括将活化的植物乳杆菌sl1接种到以葡萄糖和乳糖为碳源,蛋白胨、酵母提取物和胰蛋白胨为氮源的发酵培养基中,在ph为5-6和温度为37℃条件下发酵36h获得其发酵液的步骤。
8.进一步地,所述发酵培养基包括蛋白胨10.0g,牛肉膏10.0g,酵母提取物5.0g,胰蛋白胨5.0g,葡萄糖20.0g,乳糖5.0g,乙酸钠5.0g,柠檬酸铵2.0g,吐温801.0 ml,磷酸氢二钾2.0g,七水合硫酸镁0.2g,硫酸锰0.05g和蒸馏水1000ml。
9.进一步地,所述活化的植物乳杆菌sl1的接种量为3%v/v。
10.进一步地,所述活化的植物乳杆菌sl1是将其菌种接种至mrs液体培养基中进行活化后获得的。
11.进一步地,所述活化具体为将所述菌种以1%v/v接种量接种至所述mrs液体培养基,在37℃和ph为6.5-6.8条件下活化培养24h。
12.本发明还提供一种用于发酵肉制品的发酵菌剂,所述发酵菌剂为上述发酵方法获得的菌液。
13.本发明还提供上述植物乳杆菌sl1或上述发酵菌剂在制备发酵肉制品中的应用。
14.本发明公开了以下技术效果:
15.本发明从哈尔滨风干肠中筛选获得一株具有产蛋白酶能力的植物乳杆菌sl1,通过对其产酶条件进行单因素优化,使得该菌株所产蛋白酶的活力得到极大的提升,并且该菌株以优化后的发酵条件进行发酵得到的发酵液中蛋白酶活力高达106u/ml,可减少后续发酵产品所使用的发酵菌剂的用量,缩短发酵时间,降低成本。同时采用本发明发酵菌剂制备的发酵肉制品风味和品质优于常规菌剂,为完善发酵肉制品的风味与品质提升提供新的思路。
附图说明
16.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
17.图1为植物乳杆菌sl1的生长曲线和产酸曲线;
18.图2为不同培养时间对植物乳杆菌sl1产蛋白酶活力的影响结果图;
19.图3为初始ph对植物乳杆菌sl1产蛋白酶活力的影响结果图;
20.图4为发酵温度对植物乳杆菌sl1产蛋白酶活力的影响结果图;
21.图5为接种量对植物乳杆菌sl1产蛋白酶活力的影响结果图。
具体实施方式
22.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
23.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
24.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
25.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
26.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即
意指包含但不限于。
27.实施例1菌株的分离纯化、鉴定和保藏
28.1.菌株的分离纯化
29.1.1样品的处理
30.取自然发酵的哈尔滨风干肠50g,在无菌环境下剥去肠衣并剪碎研磨,取5g加入 45ml的无菌生理盐水中,于4℃静置30min,此溶液称为菌悬液。
31.1.2菌株的分离纯化
32.将菌悬液用无菌生理盐水梯度稀释,得到10-1
~10-5
cfu/ml不同浓度梯度的稀释液,并适当选取2~3个稀释度进行涂布对菌株进行分离。取1ml稀释液置于无菌的 mrs-caco3固体培养基上,使用涂布棒将其涂布均匀,置于37℃培养箱中培养48h。取出培养基,筛选出四周有溶钙圈的菌株,通过观察菌株的菌落形态、颜色、凸起程度、湿润状态等特征初步选出形态有所差异的菌株。采用无菌接种环挑取颜色、菌落大小不同且有溶钙环的单个菌落在mrs固体培养基上划线纯化,于37℃培养箱培养 48h,重复此流程多于3次直至得到纯菌株。
33.1.3菌株sl1的鉴定
34.对纯化后的菌株进行革兰氏染色和镜检,在光学显微镜下观察菌体形态。菌株sl1 为观察细胞呈长杆状,无鞭毛,不产芽孢,不运动。另取纯菌株接种至mrs液体培养基中,于37℃培养箱中培养48h。取出培养液进行pcr鉴定。使用快速dna提取试剂盒提取所分离的菌种的基因组,方法参照试剂盒说明书。以提取的dna为模板,并以通用引物27f(5'-ag-agtttgatcctggctcag-3')和1492r (5'-ggttacctt-gttacgactt-3')进行pcr扩增鉴定种类。
35.其中引物序列如下:
36.27f序列:5'-ag-agtttgatcctggctcag-3';
37.1492r序列:5'-ggttacctt-gttacgactt-3'。
38.pcr扩增条件:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸90s,共 30个循环;72℃再延伸10min。
39.pcr扩增产物回收后进行测序。测序结果如下(seq id no.1):
40.acggacgacactctacggttaccttgttacgacttactgagccatgatcaaa ctctacggttacattgttacgacttagtgaggcagggtgtaactcgaccgggaac gtgttccccgcggcatgctgatccgcgattactagcgattccgacttcatgtaggc gagttgcagcctacaatccgaactgagaatggctttaagagattagcttactctc gcgagttcgcaactcgttgtaccatccattgtagcacgtgtgtagcccaggtcata aggggcatgatgatttgacgtcatccccaccttcctccggtttgtcaccggcagtc tcaccagagtgcccaacttaatgctggcaactgataataagggttgcgctcgttg cgggacttaacccaacatctcacgacacgagctgacgacaaccatgcaccacct gtatccatgtccccgaagggaacgtctaatctcttagatttgcatagtatgtcaag acctggtaaggttcttcgcgtagcttcgaattaaaccacatgctccaccgcttgtg cgggcccccgtcaattcctttgagtttcagccttgcggccgtactccccaggcgg aatgcttaatgcgttagctgcagcactgaagggcggaaaccctccaacacttagc attcatcgtttacggtatggactaccagggtatctaatcctgtttgctacccatact ttcgagcctcagcgtcagttacagaccagacagccgccttcgccactggtgttct tccatatatctacgcatttcaccgctacacatggagttccactgtcctcttctgcac tcaagtttcccagtttccgatgcacttcttcggttgagccgaaggctttcacatca gact
taaaaaaccggcctgcgctcgctttacgcccaataaatccggacacgcttg ccacctacgtattaccgcggctgctggcacgtagttagccgtggcctttctggtta aataccggtcaatacctgaacagttactctcag。
41.将测序结果在ncbi网站上进行blast(www.ncbi.nlm.nih.gov/)比对,结合形态学鉴定结果明确菌株sl1为植物乳杆菌(lactobacillusplantarum)。
42.1.4菌株sl1的保藏
43.菌株sl1的分类命名为植物乳杆菌(lactobacillusplantarum),已于2022年01月 05日保藏于中国典型培养物保藏中心(简称cctcc,地址为:中国,武汉,武汉大学),保藏编号:cctcc no:m 2022015。
44.实施例2植物乳杆菌sl1的发酵方法
45.2.试验方法
46.2.1乳酸菌的生长及产酶条件的优化
47.2.1.1菌株sl1的活化
48.将保存于甘油管的菌株以1%的接种量接种至mrs液体培养基中,并于37℃培养 24h,mrs液体培养基参考如下配方配制:按蛋白胨10.0g,牛肉膏10.0g,酵母提取物5.0g,葡萄糖20.0g,乙酸钠5.0g,柠檬酸铵2.0g,吐温801.0ml,磷酸氢二钾 2.0g,七水合硫酸镁0.2g,硫酸锰0.05g,蒸馏水1000ml,调整ph至6.5-6.8。菌株活化三次后可进行下一步的试验。
49.2.1.2菌株的生长曲线及ph曲线
50.每隔6h取mrs菌体发酵液并在600nm处测定其吸光值,以未接种菌株的mrs 培养基作为空白对照,绘制96h内乳酸菌菌株的生长曲线。每隔6h用ph计测定接种各乳酸菌菌株的mrs发酵液的ph值,绘制ph曲线。
51.2.1.3植物乳杆菌sl1粗酶液的提取
52.(1)少量制备
53.经活化的菌株接种至30ml的mrs液体培养基中,在一定条件下进行发酵培养。培养结束后取5ml发酵液至10ml干燥离心管中于4℃下10000
×
g离心10min,收集上清液即为粗酶液,于4℃保存并在12h内测定其酶活力。
54.(2)大量制备
55.按照培养基配方配制2l液体培养基,并将活化后的乳酸菌株接种至液体培养基中并在一定条件下进行发酵。培养结束后分别将发酵液分批装入500ml干燥离心桶中并于4℃下10000
×
g离心10min,收集上清液即为粗酶液,并将此粗酶液进一步应用于蛋白酶的分离纯化。
56.2.1.4粗酶活力的测定
57.(1)粗蛋白酶活力的测定
58.参照gb/t 23527-2009的方法并做适当修改,采用福林酚法(foline-phenol)对微生物蛋白酶活力进行测定。将1g酪蛋白溶于ph=7.0的100ml pbs缓冲液中,配制 1%的酪蛋白溶液。将适当倍数稀释的粗酶液与1%酪蛋白溶液于37℃预热10min,将 1ml粗酶液与1ml 1%酪蛋白溶液混合,37℃水浴20min,加入2ml 0.4mol/l三氯乙酸终止反应;空白对照组先加入三氯乙酸,再加入1%酪蛋白溶液。室温静置10min 后离心(5000
×
g,15min),取上清液1ml与5ml 0.4mol/l碳酸钠溶液、0.5ml福林酚试剂混合,40℃显色20min,用10mm比色
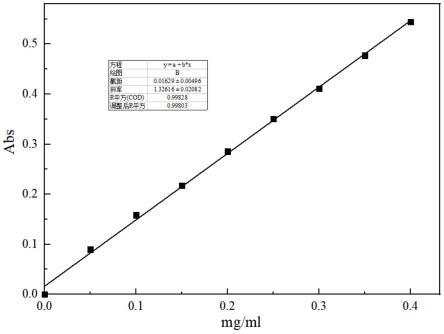
皿于600nm波长处测定吸光度。配制 20μg/ml、40μg/ml、60μg/ml、80μg/ml酪氨酸标准溶液,去离子水为空白,相同方法于600nm处测定吸光值,以酪氨酸浓度为横坐标,吸光值为纵坐标绘制标准曲线。
[0059][0060]
x:样品酶活力,u/g;a:由标准曲线得出的样品最终稀释液的活力,u/ml;v:待测酶液的体积(ml);4:反应试剂总体积(ml);n:样品稀释倍数;m:待测酶液的质量(g),表示反应时间为20min。
[0061]
2.1.5乳酸菌产酶条件的优化
[0062]
(1)发酵时间对乳酸菌产酶能力的影响
[0063]
将植物乳杆菌sl1和接种于装有30mlmrs液体培养基三角瓶中,分别发酵培养 0、12、24、36、48、60、72、84和96h,并在相应的发酵时间取样收集粗酶液,测定粗蛋白酶的活力,绘制产酶曲线,以此确定菌株的最适产酶时间。
[0064]
(2)发酵体系初始ph对菌株产酶能力的影响。
[0065]
分别调整各mrs液体培养基的ph值至2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、 6.0、6.5、7.0、7.5、8.0、8.5和9.0。将植物乳杆菌sl1接种至各初始ph体系中,发酵一定时间后取样收集粗酶液,分别测定不同初始ph体系下粗蛋白酶的活力,绘制产酶曲线,探究菌株产酶的最适初始ph。
[0066]
(3)发酵体系温度对菌株产酶能力的影响。
[0067]
接种菌株至mrs液体培养基,分别将其置于17、22、27、32、37、42、47和52℃的环境温度内进行发酵,在培养一定时间后收集粗酶液,测定不同发酵温度下菌株所产粗蛋白酶的粗酶活力并绘制产酶曲线,以此讨论菌株产酶的最适培养温度。
[0068]
(4)接种量对乳酸菌产酶能力的影响
[0069]
分别以1%、2%、3%、4%、5%和6%的接种量(v/v)将植物乳杆菌sl1接种至装有30ml的mrs液体培养基的锥形瓶中,培养一定时间后收集粗酶液并测定菌株所产粗蛋白酶的活力并绘制产酶曲线,讨论不同接种量对菌株产酶能力的影响。
[0070]
(5)不同碳源对乳酸菌产酶能力的影响
[0071]
分别以葡萄糖、乳糖、淀粉、蔗糖、半乳糖和麦芽糖作为碳源,接种植物乳杆菌 sl1并培养一定时间后收集粗酶液,测定粗蛋白酶的活力并绘制产酶曲线,探讨不同碳源对菌株产酶能力的影响。
[0072]
(6)不同氮源对菌株产酶能力的影响
[0073]
分别以酵母提取物、蛋白胨、大豆蛋白胨、蛋白胨、胰蛋白胨、(nh4)2so4、kno3和(nh4)3feso3作为氮源菌株发酵体系的氮源,接种植物乳杆菌sl1培养一段时间后收集粗酶液,测定粗蛋白酶的活力并绘制产酶曲线,讨论不同氮源对菌株sl1产酶能力的影响。
[0074]
2.2植物乳杆菌sl1产蛋白酶条件的探讨与优化
[0075]
2.2.1植物乳杆菌sl1的生长曲线及产酸曲线
[0076]
如图1所示,植物乳杆菌sl1在培养时间处于0-18h时菌株所对应的菌体密度分别上升至1.64,此阶段对应菌体的对数生长期。18h后菌密度逐渐趋向稳定并在24-30 h内达
到了对应菌体密度的最大值,处于稳定期;30h后进入衰亡期,菌株的菌体密度呈现出不同程度的下降趋势。
[0077]
植物乳杆菌sl1具有较佳的产酸能力。在培养12h后,体系的ph从最初的5.70 快速下降到3.90,随着培养时间的延长,ph的下降速率逐渐放缓,并最终稳定在3.82 左右。总体来体系ph的下降与菌体密度的变化趋势基本保持一致。ph值是衡量发酵肉制品风味和安全性的一个重要指标,因此在选取微生物发酵剂时,对其ph的动态变化进行测定便尤为必要。综上所述,植物乳杆菌sl1具有作为发酵剂应用于发酵肉制品中的潜力。
[0078]
2.2.2植物乳杆菌sl1产蛋白酶条件的探讨与优化
[0079]
2.2.2.1培养时间对菌株产蛋白酶活力的影响
[0080]
sl1在mrs培养基中培养96h后,发酵液中菌株粗蛋白酶的活力变化趋势如图2 所示。菌株产蛋白酶的活力随培养时间的延长呈现先增加后减小的趋势。sl1在发酵 36h时产蛋白酶活力达到最高的27.5u/ml,继而sl1产蛋白酶活力随培养时间的延长出现下降。这可能是由于当随着乳酸菌的繁殖,菌体浓度的增加,其产酶能力均有不同程度的提高,并在稳定期达到相对较高的蛋白酶活力水平;培养时间的延长会导致体系内蛋白酶失活,同时在乳酸菌进入衰亡期后,体系内营养成分的不足及酶自身的水解作用均可导致蛋白酶产量和活力的下降。
[0081]
2.2.2.2初始ph对菌株产蛋白酶活力的影响
[0082]
发酵体系中不同初始ph对菌株产蛋白酶的影响如图3所示。随着体系初始ph的逐渐升高,菌株产蛋白酶活力均呈现出先增大后减小的趋势,植物乳杆菌sl1在初始 ph为6时升至40u/ml。由此可见,发酵体系初始ph对乳酸菌产蛋白酶的活力具有一定影响,较低的初始ph(5-6)有利于产酶且酶活力维持在相对较高水平,而中性和偏碱性的初始ph(7-9)会导致乳酸菌的产酶能力迅速下降。
[0083]
2.2.2.3发酵温度对菌株产蛋白酶活力的影响
[0084]
在不同发酵温度下(17、22、27、32、37、42、47和52℃)对sl1进行培养,其所产蛋白酶的活力如图4所示。发酵温度在17-37℃之间,菌株的蛋白酶活力呈现稳定上升的趋势。在37℃时植物乳杆菌sl1达到最大酶活力42u/ml,随着温度继续升高,菌株所产蛋白酶的活力逐渐下降。
[0085]
2.2.2.4接种量对菌株产蛋白酶活力的影响
[0086]
接种量是影响菌株生长繁殖和产蛋白酶的重要因素之一。接种量过低,菌体数量相对减少进而使体系蛋白酶总量与活力降低;接种量过高,则会引起微生物繁殖的空间竞争,进而引起蛋白酶产量的下降。因此,适当的接种量对蛋白酶的产量与活力有着极为重要的意义。菌株sl1的接种量对蛋白酶活力的影响如图5所示。植物乳杆菌 sl1的蛋白酶活力随着接种量的增加而呈现出现升高后降低的趋势,且接种量介于 2%-4%(v/v)之间时,其对应蛋白酶的活力差异不显著(p>0.05),但与过低(1%,v/v)或过高(6%,v/v)的接种量相比差异显著(p<0.05);当sl1的接种量为3%(v/v) 时对应蛋白酶活力达到最高的49u/ml。
[0087]
2.2.2.5碳源对菌株产蛋白酶活力的影响
[0088]
在微生物生长代谢的过程中,碳源是必不可少的能源物质;而不同的微生物对碳源的需求往往不尽相同。在mrs培养基中分别加入浓度为2%的六种碳源于42℃培养 36h,
以此考察不同碳源对乳酸菌产蛋白酶活性的影响。由表1可知,菌株sl1对不同碳源的利用程度存在明显的不同。植物乳杆菌sl1以葡萄糖和乳糖作为碳源可达到相对较高蛋白酶活力且无显著差异(p>0.05),但与其余四种碳源相比仍差异显著。但是从生长代谢、蛋白酶活力及经济成本角度考虑,采用葡萄糖和乳糖作为菌株sl1生长的碳源。
[0089]
表1不同碳源对菌株产蛋白酶活力的影响
[0090][0091]
*注:同一行标注不同的字母(
a-e
)表示差异显著(p<0.05)
[0092]
2.2.2.6氮源对菌株产蛋白酶活力的影响
[0093]
微生物生长所需氮源有有机氮源与无机氮源之分,本研究分别选取酵母提取物等有机氮源和硫酸铵等无机氮源,探究其对乳酸菌产蛋白酶活力的影响。由表2可知,有机氮源和无机氮源对乳酸菌蛋白酶活力的影响存在显著差异(p<0.05),有机氮源对菌株蛋白酶的活力要远高于无机氮源(p<0.05),说明单一硫酸铵等无机氮源不能充分作为乳酸菌生长代谢的底物,进而直接影响到微生物蛋白酶的产出与活性。由此可知,蛋白胨、酵母提取物和胰蛋白胨可作为氮源可提升植物乳杆菌sl1产蛋白酶活力。
[0094]
表2不同氮源对菌株产蛋白酶活力的影响
[0095][0096]
2.3结论
[0097]
上述分别从培养时间、体系初始ph、培养温度、接种量、碳源氮源五个角度,对植物乳杆菌sl1的产酶条件进行单因素优化,发现菌株sl1具有产蛋白酶的能力,且优化后该菌株所产蛋白酶的活力有极大的提升。综合考虑,最终确定培养时间36h、体系初始ph为6、培养温度37℃、接种量3%、葡萄糖和乳糖作为碳源,蛋白胨、酵母提取物和胰蛋白胨作为氮源。在此培养条件下制备植物乳杆菌sl1菌株所产粗蛋白酶。
[0098]
优选后的发酵培养基配方为:白胨10.0g,牛肉膏10.0g,酵母提取物5.0g,胰蛋白胨5.0g,葡萄糖20.0g,乳糖5.0g,乙酸钠5.0g,柠檬酸铵2.0g,吐温801.0ml,磷酸氢二钾2.0g,七水合硫酸镁0.2g,硫酸锰0.05g,蒸馏水1000ml;
[0099]
按上述优选条件发酵植物乳杆菌sl1可使该菌发酵液中蛋白酶活力达到106u/ml。
[0100]
效果验证
[0101]
以不接种菌液的为空白组,以接种(弯曲乳杆菌lactobacillus.curvatus)菌液的为对照组,以接种植物乳杆菌sl1菌液的为实验组,统计各组发酵肉制品风味与品质。
[0102]
发酵肉制品的制备:
[0103]
(1)原辅料:
[0104]
瘦肉(猪臀肉,猪里脊)4.5kg,肥肉(猪背脂)0.5kg,1%麯酒(玉泉大麯),5%葡萄糖,0.3%味素,2.5%盐,0.01%亚硝酸钠,0.3%混合调料(混合调料包括:肉桂、花椒、大料、茴香、白芷,砂仁、胡椒、豆蔻和丁香)。
[0105]
(2)风干肠制作工艺流程
[0106]
向肉馅中添加菌株终浓度为107cfu/g的菌液。
[0107]
工艺流程:参考孔保华等的制作工艺制作风干肠。
[0108]
将活化好的弯曲乳杆菌和植物乳杆菌sl1分别接种至mrs液体培养基中进行发酵培养,37℃培养12h。发酵液于4℃条件下,10000
×
g离心10min后,收集菌泥并测定其活菌含量。首先取少量菌泥溶于无菌生理盐水中,并用该溶液稀释不同的梯度,适当选取2~3个稀释度进行涂布于mrs固体培养基中于37℃培养24h,进行菌落计数,从而计算出最初菌泥中的活菌含量。取1g弯曲乳杆菌的菌泥(2
×
10
10
cfu/g)和2 g植物乳杆菌sl1菌泥(10
10
cfu/g)溶分别充分溶于5ml的生理盐水中,分别称为弯曲乳杆菌菌液和植物乳杆菌sl1菌液,备用。
[0109]
将购买的新鲜原料肉置于冰上运送至食品学院畜产品中试加工车间,剔除淋巴,筋腱,血管等结缔组织后将猪瘦肉清理干净,用筛孔为1.5cm的绞肉机绞制,并将肥肉切成1cm3的立方块,取4.5kg猪瘦肉和0.5kg肥肉混合均匀后,再加入(1)中的其他原辅料进行拌馅,肉馅混合均匀后置于4℃发酵30min。然后将其分成均等的3 份,1份不接任何菌为空白组;1份添加上述5ml的弯曲乳杆菌菌液,边添加边搅拌,使菌株终浓度约为107cfu/g肉馅;另一份添加上述5ml的植物乳杆菌sl1菌液,边添加边搅拌,使菌株终浓度约为107cfu/g肉馅;将肉馅充分混均后用灌肠机将其灌入天然猪肠衣内,灌制不可太满,保证每根风干肠的直径约为2.5cm,重量约0.15kg。将灌制好的风干肠先置于相对湿度为30-50%,温度为25
±
2℃环境下风干12h,然后再移至相对湿度为75-80%,相对温度为25
±
2℃的恒温恒湿培养箱中发酵9天取样,对各组分进行相关指标的测定。
[0110]
(3)发酵肉制品风味测定:
[0111]
采用顶空固相微萃取-气质联用技术,对各组风干肠进行挥发性化合物的分析。准确量取5.0ml的提取物,加入15ml样品瓶中,将样品瓶放入60℃的水浴中平衡30min,将已老化好的萃取针头插入样品瓶中,用手柄将石英纤维头推出暴露到样品瓶顶空气体中,恒温60℃萃取30min,用手柄将纤维头推回针头内,将萃取针头拔出,插入 gc-ms进样器中解析。
[0112]
气相色谱条件:hp20m弹性石英毛细管柱,50m
×
0.25mm
×
0.25μm;进样口温度 250℃;载气he,流速0.9ml/min,不分流;程序升温:起始温度65℃,保持3min,然后以5℃/min的升温速度升温至135℃,再以12℃/min升温至250℃,保持10min。质谱条件:电离方式为e i;电子能量为70e v;发射电流为350μa;离子源温度为200℃;接口温度250℃;质量范围33-450amu。
[0113]
实验数据处理由xcalibur软件系统完成,未知化合物经计算机检索同时与nist谱库和wiley谱库相匹配,仅当正反匹配度均大于800(最大值为1000)的鉴定结果才予以报道。化合物相对含量确定:采用面积归一化法。
[0114]
表3各组发酵肉制品中挥发性化合物的含量(峰面积au
×
106)
[0115]
[0116]
[0117][0118]
(4)发酵肉制品感官评价:
[0119]
由10人组成感官评定小组,男女各半,将待检测风干肠样品蒸制20min后,切成0.5cm厚度进行感官评定。每次评定由每个评定成员单独进行,相互不接触交流,样品评定之间用清水漱口。评定指标包括颜色、气味、滋味、酸味、口感和总体可接受性。对于颜色,7分为颜色红润,有光泽,1分为颜色暗黑无光泽;气味,7分为具有发酵肉制品特有的风味,1分风味较差;对于滋味,7分为发酵肉制品浓郁的香味,1 分为滋味很差;对于酸味,7分为酸
味很重,无法接受,1分为没有酸味;对于口感, 7分为肉质非常硬,1分为肉嫩;对于总体可接受性,7分为可接受性高,1分为可接受性低。实验组、对照组和空白组具体结果见表4:
[0120]
表4各组发酵肉制品感官评价结果
[0121][0122]
感官评定是对发酵风干肠产品品质最为直观的体现。我们分别从产品的颜色、气味、滋味、酸味、口感和总体可接受性六个方面对产品的感官特性进行评定。由表4 可知,自然发酵的空白样品中,除酸味之外,其各感官评定得分相对较低,而接种了弯曲乳杆菌的风干肠中,其颜色、气味、滋味、口感和总体可接受性的感官评定得分有了明显的提升,这与我们之前的研究结果较为一致。接种了植物乳杆菌sl1的样品,各感官评价指标的得分均有所提升,其中产品的颜色、气味、滋味和口感的得分相比接种弯曲乳杆菌的产品,提升尤为明显。这说明此处理组的产品最受消费者的欢迎,其肠体色泽饱满红润,发酵风味浓郁,酸度得当,口感宜人。因此,植物乳杆菌sl1 发酵,可作为一种改善哈尔滨风干肠品质特性、加速成熟、完善特征风味形成的肉品发酵剂。
[0123]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。