1.本公开属于医药领域,涉及一种细胞周期蛋白-依赖性激酶抑制剂及其制备方法、组合物和医药用途。
背景技术:
2.细胞周期蛋白-依赖性激酶(cdk)是重要的细胞酶,其在调节真核细胞分裂和增殖中发挥重要作用。细胞周期蛋白-依赖性激酶催化单元被称为细胞周期蛋白的调节亚基激活。已经鉴定出至少16种哺乳动物细胞周期蛋白(annu.rev.pharmacol.toxicol.(1999)39:295-312)。细胞周期蛋白b/cdk1、细胞周期蛋白a/cdk2、细胞周期蛋白e/cdk2、细胞周期蛋白d/cdk4、细胞周期蛋白d/cdk6和可能的其他heterodynes是细胞周期进展的重要调节因子。细胞周期蛋白/cdk heterodynes的其他功能包括转录调节、dna修复、分化和凋亡(annu.rev.cell.dev.biol.(1997)13:261-291)。
3.近年来,乳腺癌治疗领域最大的进展无疑是cdk4/6单用或联合内分泌治疗在激素受体阳性晚期乳腺癌,如帕博西尼(palbociclib)、瑞博西尼(ribociclib)和玻玛西尼(abemaciclib)已被批准与芳香酶抑制剂组合用于治疗绝经后妇女的激素受体(hr)-阳性、人类表皮生长因子受体2(her2)-阴性晚期或转移性乳腺癌,并且帕博西尼和玻玛西尼(abemaciclib)已被批准与氟维司群组合用于在内分泌疗法后疾病进展后治疗绝经后妇女的激素受体(hr)-阳性、人类表皮生长因子受体2(her2)-阴性晚期或转移性乳腺癌(nature reviews(2016)13:417-430、j clin oncol 2017,35,2875-2884)。尽管cdk4/6抑制剂在雌激素受体er阳性转移性乳腺癌中显示出显著的临床功效,但与其他激酶一样,它们的作用可能随着时间的推移被原发性或获得性抗性的发展限制。
4.用cdk4/6抑制剂治疗已在临床中被证明会导致不良反应,例如胃肠道和/或血液学毒性,并且随着时间的流逝可能会产生获得性耐药。新兴数据表明,细胞周期蛋白d3-cdk6可能与所观察到的血液学毒性有关。(malumbres等人,哺乳动物细胞循环而没有d型细胞周期蛋白依赖性激酶cdk4和cdk6,(2004)cell1 18(4):493-504;sicinska等人.cyclin d3在粒细胞集落刺激中的重要作用中性粒细胞粒细胞的因子驱动的扩增(2006),mol。cell biol 26(21):8052-8060;cooper等.cyclin d3在早期b细胞发育中的独特功能,(2006),nat.immunol.5(7):489-497)。cdk4已被确定为许多乳腺癌中的单一致癌驱动因子。因此,由于与双重cdk4/6抑制剂相比潜在的更高和/或连续的剂量,cdk4选择性抑制剂可提供改善的安全性或增强的总体功效,故开发cdk4选择性高的分子,在临床上有实际应用价值。
技术实现要素:
5.本公开提供一种式i所示的化合物或其药学上可接受的盐,
[0006][0007]
其中,r1选自h、c
1-6
烷基、c
1-6
卤代烷基、c
3-7
环烷基,所述c
1-6
烷基、c
1-6
卤代烷基、c
3-7
环烷基任选被一个或多个ra取代;
[0008]
所述为所述r6选自h、oh、nh2,所述nh2任选被1或2个选自r
a’或r
a”取代;
[0009]
r7选自卤素、cn、nh2、c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
1-6
卤代烷氧基、c
3-8
环烷基,3-12元杂环烷基;所述c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
3-8
环烷基,3-12元杂环烷基任选进一步被一个或多个rb取代;
[0010]
q选自nr8或o;
[0011]
或者q为cr9r
10
,其中r9、r
10
与其连接的c原子形成3-12元的含有nr8中的n或o作为环原子的杂环基,所述杂环基任选被一个或多个r7取代;
[0012]
r8选自h、c
1-6
烷基,c
1-6
卤代烷基、so2rc、so2nrdre、corf、coorf或者conrgrh,所述的c
1-6
烷基,c
1-6
卤代烷基进一步任选被ra、rb、so2rc、so2nrdre、corf、coorf或者conrgrh取代;
[0013]
r3选自h或者卤素;
[0014]
x选ch或n;
[0015]
y选自c或者n,
[0016]
w选自s或cr
11
,
[0017]
y与z之间、z与w之间任选为单键或者双键;
[0018]r11
选自h、卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-8
环烷基、3-12元杂环烷基、5-12元芳基、5-12元杂芳基
[0019]
r5选自h、c
1-6
烷基,c
1-6
卤代烷基、c
3-8
单环环烷基,3-12元杂环烷基,所述c
1-6
烷基,c
1-6
卤代烷基、c
3-8
单环环烷基,3-12元杂环烷基任选进一步被一个或多个ra或rb取代;
[0020]
所述r4选自a-b;
[0021]
所述a选自连接键、-ch2-或者-nh-;
[0022]
b选自so2rc、so2nrdre、corf、coorf、conrgrh、c
1-6
烷基、c
1-6
烷氧基、c
3-8
环烷基、3-12元杂环烷基,所述c
3-8
环烷基、3-12元杂环烷基任选被氧代取代;
[0023]
m选自0、1或2;
[0024]
n选自0、1、2、3或4;
[0025]
p选自1、2或3;
[0026]
所述ra、rb各自独立的选自h、oh、cn、卤素(氟、氯、溴、碘)、c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
1-6
卤代烷氧基、c
3-8
环烷基,3-12元杂环烷基、nr
a’r
a”取代;
[0027]
所述c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
3-8
环烷基,3-12元杂环烷基任选进一步
被一个或多个nh2、nhch3或n(ch3)2、卤素、oh、c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
3-8
环烷基,3-12元杂环烷基取代;
[0028]
所述r
a’或r
a”各自独立的选自h、c
1-6
烷基、c
1-6
卤代烷基、c
3-8
环烷基,3-12元杂环烷基;所述c
1-6
烷基、c
1-6
卤代烷基、c
3-8
环烷基,3-12元杂环烷基任选进一步被一个或多个nh2、nhch3、n(ch3)2、卤素、oh、c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
1-6
卤代烷氧基、c
3-8
环烷基,3-12元杂环烷基取代;
[0029]
或者r
a’、r
a”与它们连接的n原子形成3-12元杂环烷基,所述3-12元杂环烷基任选进一步被选自一个或多个卤素、oh、c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
1-6
卤代烷氧基、c
3-8
环烷基,3-12元杂环烷基取代;
[0030]
rc、rd和re各自独立的选自h、c
1-6
烷基、c
1-6
烷氧基、c
3-8
环烷基或c
1-6
卤代烷基;
[0031]
rf选自h、c
1-6
烷基、c
1-6
卤代烷基、c
3-8
环烷基,3-12元杂环烷基,所述c
1-6
烷基、c
1-6
卤代烷基、c
3-8
环烷基,3-12元杂环烷基任选进一步被一个或多个nh2、nhch3或n(ch3)2、卤素、oh、c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
3-8
环烷基,3-12元杂环烷基取代;
[0032]
rg、rh各自独立的选自h、c
1-6
烷氧基、c
1-6
卤代烷基或c
3-8
环烷基;所述c
1-6
烷氧基、c
1-6
卤代烷基或c
3-8
环烷基任选进一步被一个或多个ra或者rb取代。
[0033]
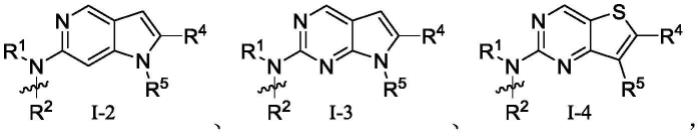
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中r3选自h,式i所示的化合物为i-1,其中r1、r2、r4、r5、x、y、z、w分别如式i所示的化合物中定义,
[0034][0035]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中r3选自h;
[0036]
x为ch;
[0037]
y选自n;
[0038]
w为ch;
[0039]
式i所示的化合物为i-2所示的化合物或其药学上可接受的盐,其中r1、r2、r4、r5分别如式i所示的化合物中定义,
[0040][0041]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中r3选自h;
[0042]
x为n;
[0043]
y选自n;
[0044]
w为ch;
[0045]
式i所示的化合物为i-3所示的化合物或其药学上可接受的盐,其中r1、r2、r4、r5分
别如式i所示的化合物中定义,
[0046][0047]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中r3选自h;
[0048]
x为n;
[0049]
y选自c;
[0050]
w为s;
[0051]
式i所示的化合物为i-4所示的化合物或其药学上可接受的盐,其中r1、r2、r4、r5分别如式i所示的化合物中定义,
[0052][0053]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中r1为h,r2、r3、r4、r5、x、y、z分别如式i所示的化合物中定义。
[0054]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其选自
[0055]
所示的化合物或其药学上可接受的盐,其中h,r2、r3、r4、r5、x、y、z分别如式i所示的化合物中定义。
[0056]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,所述r4选自a-b,所述a选自连接键,b选自conrgrh,所述rg、rh分别如式i所示的化合物中定义。
[0057]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,所述r4选自a-b,所述a选自-ch2-或者-nh-,b选自conrgrh,所述rg、rh分别如式i所示的化合物中定义。
[0058]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,所述r4选自a-b,所述a选自连接键、-ch2-或者-nh-,b选自conrgrh,所述rg、rh选自c
1-3
烷氧基或c
3-6
环烷基。
[0059]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,所述r4选自a-b,所述a选自连接键、-ch2-或者-nh-,b选自conrgrh,所述rg、rh选自甲基、乙基、异丙基、环丙基或环丁基。
[0060]
可选的实施方案中本公开提供的式i所示的化合物或其药学上可接受的盐,其中,所述r4选自a-b,所述a选自连接键、-ch2-或者-nh-,b选自conrgrh,所述rg、rh选自甲基、乙
基、异丙基、环丙基或环丁基,所述甲基、乙基、异丙基、环丙基或环丁基进一步被氘原子取代。
[0061]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,所述r4选自a-b,所述a选自连接键,b选自3-12元杂环烷基,具体可以选自3元杂环烷基、4元杂环烷基、5元杂环烷基,6元杂环烷基、7元杂环烷基,8元杂环烷基、9元杂环烷基,10元杂环烷基、11元杂环烷基,12元杂环烷基,所述3-12元杂环烷基任选被氧代取代,所述3-12元杂环烷基含有1或2个n原子。
[0062]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,所述r4选自a-b,所述a选自连接键,b选自5元杂环烷基,所述5元杂环烷基被氧代取代,所述5元杂环烷基含有1个n原子。
[0063]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,所述r4选自a-b,所述a选自连接键,b选自
[0064][0065]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r5选自c
3-8
单环环烷基,c
3-12
杂环烷基,任选进一步被ra或rb取代,所述ra或rb分别如式i所示的化合物定义。
[0066]
可选的实施方案中,式i所示的化合物或其药学上可接受的盐,其中,r5选自c
3-8
单环环烷基。
[0067]
可选的实施方案中,式i所示的化合物或其药学上可接受的盐,其中,r5选自c
4-6
单环环烷基。
[0068]
可选的实施方案中,式i所示的化合物或其药学上可接受的盐,其中,r5选自环丁基、环戊基或环己基。
[0069]
可选的实施方案中,本公开提供一种式i所示的化合物或其药学上可接受的盐,其为iii-1至iii-51所示的化合物或其药学上可接受的盐,
[0070][0071]
r2如式i所示的化合物中定义。
[0072]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r2选自
[0073][0074]
其中r6、r7、m及q分别如式i所示的化合物中定义。
[0075]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r2选自
[0076][0077]
其中r6、r7、m及q分别如式i所示的化合物中定义。
[0078]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r2选自
[0079][0080]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r6选自oh、nh2,所述nh2任选被1或2个选自r
a’或r
a”取代;所述r
a’或r
a”各自独立的选自h、c
1-6
烷基。
[0081]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r6选自oh、nh2。
[0082]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r6选自oh。
[0083]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中r7选自h、卤素、cn、nh2、c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
1-6
卤代烷氧基、c
3-8
环烷基,c
3-12
杂环烷基。
[0084]
可选的实施方案中本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r7选自h。
[0085]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r8选自so2rc、so2nrdre、corf、coorf或者conrgrh,其中rc、rd、re、rf、rg、rh分别如式i所示的化合物中定义。
[0086]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r8选自so2rc,所述rc选自c
1-6
烷氧基、c
3-8
环烷基或c
1-6
卤代烷基。
[0087]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r8选自so2rc,所述rc选自c
1-3
烷氧基或c
3-6
环烷基。
[0088]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其中,r8选自so2rc,所述rc选自甲基、乙基、异丙基、环丙基或环丁基。
[0089]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其为
[0090]
所述r2选自
[0091]
其中r6选自oh、nh2;
[0092]
r7选自h、卤素、cn、nh2、c
1-6
烷基,c
1-6
烷氧基、c
1-6
卤代烷基、c
1-6
卤代烷氧基、c
3-8
环烷基,c
3-12
杂环烷基;
[0093]
r8选自so2rc、so2nrdre、corf、coorf或者conrgrh,其中rc、rd、re、rf、rg、rh分别如上定义;
[0094]
m为0。
[0095]
在一些实施方案中,r6选自oh;m为0;r8选自so2rc,所述rc选自c
1-6
烷基、c
1-6
烷氧基、c
3-8
环烷基或c
1-6
卤代烷基。
[0096]
在一些实施方案中,r6选自oh;m为0;r8选自so2rc,所述rc选自c
1-4
烷基、c
1-3
烷氧基或c
3-6
环烷基。
[0097]
在一些实施方案中,r6选自oh;m为0;r8选自so2rc,所述rc选自甲基、乙基、异丙基、环丙基或环丁基。
[0098]
在可选的实施方案中,本公开提供的式i所述的化合物或其药学上可接受的盐,进一步被选自1-20的整数个的氘原子取代。
[0099]
在可选的实施方案中,本公开提供的式i所述的化合物或其药学上可接受的盐,进一步被选自1-10的整数个的氘原子取代。
[0100]
可选的实施方案中,本公开提供的式i所示的化合物或其药学上可接受的盐,其为
[0101][0102]
可选的实施方案中,式i所示的化合物或其药学上可接受的盐,所述氘原子的丰度大于20%。
[0103]
可选的实施方案中,式i所示的化合物或其药学上可接受的盐,所述氘原子的丰度大于50%。
[0104]
可选的实施方案中,式i所示的化合物或其药学上可接受的盐,所述氘原子的丰度
大于90%。
[0105]
可选的实施方案中,式i所示的化合物或其药学上可接受的盐,所述氘原子的丰度大于95%。
[0106]
本公开还提供制备式i所示化合物的方法,包括式i-b所示化合物与式i-c所示化合物反应以形成式i化合物的步骤,
[0107][0108]
其中,lg1选自离去基团,所述离去基团优选卤素、磺酸酯、硼酸、硼酸酯;
[0109]
所述r3、r4、r5、x、y、z如上所述。
[0110]
在一些实施方案中,所述反应在催化剂条件下进行,所述催化剂选自金属钯、金属镍。
[0111]
在一些实施方案中,所述催化剂选自钯/碳、雷尼镍、四-三苯基膦钯、二氯化钯、醋酸钯、[1,1'-双(二苯基膦基)二茂铁]二氯化钯、1,1
’‑
[1,1'-双(二叔丁基膦基)二茂铁]二氯化钯、三(二亚苄基丙酮)二钯或2-双环己基膦-2',6'-二甲氧基联苯,优选[1,1'-双(二苯基膦基)二茂铁]二氯化钯和2-双环己基膦-2',6'-二甲氧基联苯。
[0112]
本公开中还提供了一种药物组合物,包括至少前述式i所示化合物或其药学上可接受的盐或其立体异构体、旋转异构体或互变异构体以及药学上可接受的赋形剂。
[0113]
在一些实施方案中,所述的药物组合物的单位剂量为0.001mg-1000mg。
[0114]
在某些实施方案中,基于组合物的总重量,所述的药物组合物含有0.01-99.99%的前述式i所示化合物或其药学上可接受的盐。
[0115]
在某些实施方案中,所述的药物组合物含有0.1-99.9%的前述式i所示化合物或其药学上可接受的盐。
[0116]
在某些实施方案中,所述的药物组合物含有0.5%-99.5%的前述式i所示化合物或其药学上可接受的盐。
[0117]
在某些实施方案中,所述的药物组合物含有1%-99%的前述前述式i所示化合物或其药学上可接受的盐。
[0118]
在某些实施方案中,所述的药物组合物含有2%-98%的前述式前述式i所示化合物或其药学上可接受的盐。
[0119]
在某些实施方案中,基于组合物的总重量,所述的药物组合物含有0.01%-99.99%的药学上可接受的赋形剂。
[0120]
在某些实施方案中,所述的药物组合物含有0.1%-99.9%的药学上可接受的赋形剂。
[0121]
在某些实施方案中,所述的药物组合物含有0.5%-99.5%的药学上可接受的赋形剂。
[0122]
在某些实施方案中,所述的药物组合物含有1%-99%的药学上可接受的赋形剂。在某些实施方案中,所述的药物组合物含有2%-98%的药学上可接受的赋形剂。
[0123]
本公开还提供一种预防和/或治疗患有与细胞周期蛋白-依赖性激酶相关疾病的患者的方法,其包括向所述患者施用治疗有效量的如前述式i所示化合物或其药学上可接受的盐或前述药物组合物。
[0124]
本公开还提供一种预防和/或治疗预防和/或治疗癌症的方法,其包括向所述患者施用治疗有效量的如前述式i所示化合物或其药学上可接受的盐或前述药物组合物。
[0125]
本公开还提供了如前述式i所示化合物或其药学上可接受的盐或前述药物组合物在制备用于预防和/或治疗与细胞周期蛋白-依赖性激酶相关疾病的药物中的用途。
[0126]
本公开还提供了如前述式i所示化合物或其药学上可接受的盐或前述药物组合物在制备用于预防和/或治疗癌症的的药物中的用途。
[0127]
本公开中所述的所述癌症选自乳腺癌、卵巢癌、膀胱癌、子宫癌、前列腺癌、肺癌(包括nsclc,sclc,鳞状细胞癌或腺癌)、食道癌、头颈癌,肠癌、肾癌(包括rcc)、肝癌(包括hcc)、胰腺癌、胃癌和甲状腺癌。
[0128]
本公开中所述的细胞周期蛋白-依赖性激酶为cdk4。
[0129]
本公开提供的式i所示化合物或其药学上可接受的盐或前述药物组合物,降低了胃肠道和/或血液学毒性。
[0130]
另一方面,本公开中所述化合物可药用盐选自无机盐或有机盐。
[0131]
本公开化合物可以存在特定的几何或立体异构体形式。本公开设想所有的这类化合物,包括顺式和反式异构体、(-)-和( )-对对映体、(r)-和(s)-对映体、非对映异构体、(d)-异构体、(l)-异构体,及其外消旋混合物和其他混合物,例如对映异构体或非对映体富集的混合物,所有这些混合物都属于本公开的范围之内。烷基等取代基中可存在另外的不对称碳原子。所有这些异构体以及它们的混合物,均包括在本公开的范围之内。本公开的含有不对称碳原子的化合物可以以光学活性纯的形式或外消旋形式被分离出来。光学活性纯的形式可以从外消旋混合物拆分,或通过使用手性原料或手性试剂合成。
[0132]
可以通过的手性合成或手性试剂或者其他常规技术制备光学活性的(r)-和(s)-异构体以及d和l异构体。如果想得到本公开某化合物的一种对映体,可以通过不对称合成或者具有手性助剂的衍生作用来制备,其中将所得非对映体混合物分离,并且辅助基团裂开以提供纯的所需对映异构体。或者,当分子中含有碱性官能团(如氨基)或酸性官能团(如羧基)时,与适当的光学活性的酸或碱形成非对映异构体的盐,然后通过本领域所公知的常规方法进行非对映异构体拆分,然后回收得到纯的对映体。此外,对映异构体和非对映异构体的分离通常是通过使用色谱法完成的,所述色谱法采用手性固定相,并任选地与化学衍生法相结合(例如由胺生成氨基甲酸盐)。
[0133]
本公开所述化合物的化学结构中,键表示未指定构型,即如果化学结构中存在手性异构体,键可以为或或者同时包含和两种构型。键表示未指定构型,包括顺式(e)或反式(z)构型。
[0134]
本公开的化合物和中间体还可以以不同的互变异构体形式存在,并且所有这样的形式包含于本公开的范围内。术语“互变异构体”或“互变异构体形式”是指可经由低能垒互变的不同能量的结构异构体。例如,质子互变异构体(也称为质子转移互变异构体)包括经由质子迁移的互变,如酮-烯醇及亚胺-烯胺、内酰胺-内酰亚胺异构化。内酰胺-内酰亚胺平衡实例是在如下所示的a和b之间。
[0135][0136]
本公开中的所有化合物可以被画成a型或b型。所有的互变异构形式在本公开的范围内。化合物的命名不排除任何互变异构体。
[0137]
本公开还包括一些与本文中记载的那些相同的,但一个或多个原子被原子量或质量数不同于自然中通常发现的原子量或质量数的原子置换的同位素标记的本公开化合物。可结合到本公开化合物的同位素的实例包括氢、碳、氮、氧、磷、硫、氟、碘和氯的同位素,诸如分别为2h、3h、
11
c、
13
c、
14
c、
13
n、
15
n、
15
o、
17
o、
18
o、
31
p、
32
p、
35
s、
18
f、
123
i、
125
i和
36
cl等。
[0138]
除另有说明,当一个位置被特别地指定为氘(d)时,该位置应理解为具有大于氘的天然丰度(其为0.015%)至少1000倍的丰度的氘(即,至少10%的氘掺入)。示例中化合物的具有大于氘的天然丰度可以是至少1000倍的丰度的氘、至少2000倍的丰度的氘、至少3000倍的丰度的氘、至少4000倍的丰度的氘、至少5000倍的丰度的氘、至少6000倍的丰度的氘或更高丰度的氘。本公开还包括各种氘化形式的式(i)化合物。与碳原子连接的各个可用的氢原子可独立地被氘原子替换。本领域技术人员能够参考相关文献合成氘化形式的式(i)化合物。在制备氘代形式的式(i)化合物时可使用市售的氘代起始物质,或它们可使用常规技术采用氘代试剂合成,氘代试剂包括但不限于氘代硼烷、三氘代硼烷四氢呋喃溶液、氘代氢化锂铝、氘代碘乙烷和氘代碘甲烷等。
[0139]
术语解释:
[0140]“药学上可接受的赋形剂”包括但不限于任何已经被美国食品和药物管理局批准对于人类或家畜动物使用可接受的任何助剂、载体、赋形剂、助流剂、甜味剂、稀释剂、防腐剂、染料/着色剂、增香剂、表面活性剂、润湿剂、分散剂、助悬剂、稳定剂、等渗剂、溶剂或乳化剂。
[0141]“烷基”指饱和的脂族烃基团,包括1至20个碳原子的直链和支链基团。优选含有1至12个碳原子的烷基,更优选含有1至6个碳原子的烷基。非限制性实施例包括甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、仲丁基、正戊基、1,1-二甲基丙基、1,2-二甲基丙基、2,2-二甲基丙基、1-乙基丙基、2-甲基丁基、3-甲基丁基,及其各种支链异构体等。烷基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选一个或多个以下基团,独立地选自卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-7
环烷基、3-12元杂环基等。
[0142]“烯基”包括具有2至12个碳原子的支链和直链烯烃或含有脂族烃基团的烯烃。例如“c
2-6
烯基”表示具有2、3、4、5或6个碳原子的烯基。烯基的实例包括但不限于,乙烯基、烯丙基、1-丙烯基、1-丁烯基、2-丁烯基、3-丁烯基、2-甲基丁-2-烯基、3-甲基丁-1-烯基、1-戊烯基、3-戊烯基及4-己烯基。烯基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选一个或多个以下基团,独立地选自卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-7
环烷基、3-12元杂环基等。
[0143]“炔基”包括具有2至12个碳原子的支链和直链炔基或含有脂族烃基的烯烃,或若
规定指定碳原子数,则意指该特定数目。例如乙炔基、丙炔基(例如1-丙炔基、2-丙炔基)、3-丁炔基、戊炔基、己炔基及1-甲基戊-2-炔基。炔基可以是取代的或未取代的,当被取代时,取代基可以在任何可使用的连接点上被取代,优选一个或多个以下基团,独立地选自卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-7
环烷基、3-12元杂环基等。
[0144]
术语“环烷基”指饱和或部分不饱和单环或多环环状烃取代基,环烷基环包含3至20个碳原子,优选包含3至12个碳原子,更优选包含3至6个碳原子。单环环烷基的非限制性实例包括环丙基、环丁基、环戊基、环戊烯基、环己基、环己烯基、环己二烯基、环庚基、环庚三烯基、环辛基等;多环环烷基包括螺环、稠环和桥环的环烷基。
[0145]
所述环烷基环可以稠合于芳基、杂芳基或杂环烷基环上,其中与母体结构连接在一起的环为环烷基,非限制性实例包括茚满基、四氢萘基、苯并环庚烷基等。环烷基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-7
环烷基、3-12元杂环基等。
[0146]
术语“杂环基”指饱和或部分不饱和单环或多环环状烃取代基,其包含3至20个环原子,其中一个或多个环原子为选自氮、氧或s(o)m(其中m是整数0至2)的杂原子,但不包括-o-o-、-o-s-或-s-s-的环部分,其余环原子为碳。优选包含3至12个环原子,其中1~4个是杂原子;更优选包含3至8个环原子。单环杂环基的非限制性实例包括吡咯烷基、咪唑烷基、四氢呋喃基、四氢噻吩基、二氢咪唑基、二氢呋喃基、二氢吡唑基、二氢吡咯基、哌啶基、哌嗪基、吗啉基、硫代吗啉基、高哌嗪基等。多环杂环基包括螺环、稠环和桥环的杂环基。“杂环基”非限制性实例包括:
[0147][0148]
等等。
[0149]
所述杂环基环可以稠合于芳基、杂芳基或环烷基环上,其中与母体结构连接在一起的环为杂环基,其非限制性实例包括:
[0150]
等。
[0151]
杂环基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以
下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-7
环烷基、3-12元杂环基等。
[0152]
术语“芳基”指具有共轭的π电子体系的6至14元全碳单环或稠合多环(也就是共享毗邻碳原子对的环)基团,优选为6至12元,例如苯基和萘基。所述芳基环可以稠合于杂芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为芳基环,其非限制性实例包括:
[0153][0154]
芳基可以是取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-7
环烷基、3-12元杂环基等,优选苯基。
[0155]
术语“杂芳基”指包含1至4个杂原子、5至14个环原子的杂芳族体系,其中杂原子选自氧、硫和氮。杂芳基优选为6至12元,更优选为5元或6元。例如。其非限制性实例包括:咪唑基、呋喃基、噻吩基、噻唑基、吡唑基、噁唑基、吡咯基、四唑基、吡啶基、嘧啶基、噻二唑、吡嗪,等等。
[0156]
所述杂芳基环可以稠合于芳基、杂环基或环烷基环上,其中与母体结构连接在一起的环为杂芳基环,其非限制性实例包括:
[0157][0158]
杂芳基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-7
环烷基、3-12元杂环基等。
[0159]
术语“烷氧基”指-o-(烷基)和-o-(非取代的环烷基),其中烷基的定义如上所述。烷氧基的非限制性实例包括:甲氧基、乙氧基、丙氧基、丁氧基、环丙氧基、环丁氧基、环戊氧基、环己氧基。烷氧基可以是任选取代的或非取代的,当被取代时,取代基优选为一个或多个以下基团,其独立地选自卤素、羟基、氧代、硝基、氰基、c
1-6
烷基、c
1-6
烷氧基、c
3-7
环烷基、3-12元杂环基等。
[0160]
术语“羟基”指-oh基团。
amylose-1(250mm*30mm,5um)。
[0178]
combiflash快速制备仪使用combiflash rf150(teledyne isco)。
[0179]
激酶平均抑制率及ic
50
值的测定用novostar酶标仪(德国bmg公司)。
[0180]
本公开的已知的起始原料可以采用或按照本领域已知的方法来合成,或可购买自abcr gmbh&co.kg,acros organics,aldrich chemical company,韶远化学科技(accela chembio inc)、达瑞化学品等公司。
[0181]
实施例中无特殊说明,反应能够均在氩气氛或氮气氛下进行。
[0182]
氩气氛或氮气氛是指反应瓶连接一个约1l容积的氩气或氮气气球。
[0183]
氢气氛是指反应瓶连接一个约1l容积的氢气气球。
[0184]
加压氢化反应使用parr 3916ekx型氢化仪和清蓝ql-500型氢气发生器或hc2-ss型氢化仪。
[0185]
氢化反应通常抽真空,充入氢气,反复操作3次。
[0186]
微波反应使用cem discover-s 908860型微波反应器。
[0187]
实施例中无特殊说明,溶液是指水溶液。
[0188]
实施例中无特殊说明,反应的温度为室温,为20℃~30℃。
[0189]
实施例中的反应进程的监测采用薄层色谱法(tlc),
[0190]
反应所使用的展开剂,纯化化合物采用的柱层析的洗脱剂的体系和薄层色谱法的展开剂体系,溶剂的体积比根据化合物的极性不同而进行调节,也可以加入少量的三乙胺和醋酸等碱性或酸性试剂进行调节。
[0191]
实施例1
[0192]
7-环戊基-2-(((3s,4r)-3-羟基四氢-2h-吡喃-4-基)氨基)-n,n-二甲基-7h-吡咯并[2,3-d]嘧啶-6-甲酰胺
[0193][0194]
第一步
[0195]
7-溴-2,4,4-三甲基-3,4-二氢异喹啉-1(2h)-酮
[0196]
在室温下,将2-氯-7-环戊基-n,n-二甲基-7h-吡咯并[2,3-d]嘧啶-6-甲酰胺1a(40mg,0.137mmol)溶于2ml二氧六环中,加入(3s,4r)-4-氨基四氢-2h-吡喃-3-醇1b(24mg,0.205mmol),1,1'-联萘-2,2'-双二苯膦(17mg,0.027mmol),碳酸铯(89mg,0.273mmol)和醋酸钯(6mg,0.027mmol),将反应液升温至110℃氩气下微波搅拌反应1小时。反应结束后将反应液倒入20ml水中,用乙酸乙酯萃取,合并有机相,用饱和氯化钠溶液洗涤,无水硫酸钠干燥,过滤,收集滤液,滤液减压浓缩,残留物用硅胶色谱法纯化,得到标题化合物1(12mg,产率:23%)。
[0197]
ms(esi)m/z 374.4[m h]
[0198]1h nmr(400mhz,dmso-d6)δ=8.55(s,1h),6.84-6.70(m,1h),6.46(s,1h),4.98(br d,j=4.0hz,1h),4.77-4.62(m,1h),4.68(quin,j=8.4hz,1h),3.88-3.78(m,2h),3.73(br s,1h),3.59-3.49(m,1h),3.11-2.95(m,8h),2.42-2.24(m,2h),2.08(br d,j=12.1hz,1h),1.94(br d,j=4.5hz,4h),1.60(br d,j=6.9hz,2h),1.51-1.35(m,1h).
[0199]
实施例2
[0200]
7-环戊基-2-(((3r,4r)-3-羟基-1-(甲磺酰)哌啶-4-基)氨基)-n,n-二甲基-7h-吡咯并[2,3-d]嘧啶-6-甲酰胺2
[0201][0202]
第一步
[0203]
7-环戊基-2-(((3r,4r)-3-羟基-1-(甲磺酰)哌啶-4-基)氨基)-n,n-二甲基-7h-吡咯并[2,3-d]嘧啶-6-甲酰胺2
[0204]
在室温下,将(r)-1-(6-(4-氯-1,3,5-三嗪-2-基)-4-氟-1-异丙基-1h-苯并[d]咪唑-2-基)乙烷-1-醇1a(40mg,0.137mmol)溶于2ml二氧六环中,加入(3r,4r)-4-氨基-1-(甲磺酰)哌啶-3-醇2a(40mg,0.205mmol),1,1'-联萘-2,2'-双二苯膦(17mg,0.027mmol),碳酸铯(89mg,0.273mmol)和醋酸钯(6mg,0.027mmol),将反应液升温至110℃氩气下微波搅拌反应1小时。反应结束后将反应液倒入20ml水中,用乙酸乙酯萃取(10ml
×
3),合并有机相,用饱和氯化钠溶液洗涤(5ml),无水硫酸钠干燥,过滤,收集滤液,滤液减压浓缩,残留物用硅胶色谱法以石油醚、乙酸乙酯洗脱纯化,得到标题化合物2(12mg,产率:23%)。
[0205]
ms(esi)m/z 451.4[m h]
[0206]1h nmr(400mhz,dmso-d6)δ=8.55(s,1h),6.86-6.73(m,1h),6.47(s,1h),5.22(d,j=4.0hz,1h),4.69(br t,j=8.5hz,1h),3.74-3.61(m,2h),3.50(br d,j=12.1hz,2h),3.04(br s,6h),2.91(s,3h),2.88-2.77(m,2h),2.16(br d,j=12.1hz,1h),1.94(br s,5h),1.74-1.26(m,4h).
[0207]
实施例3
[0208]
(3s,4r)-4-((5-氟-4-((s)-8-氟-2,3-二甲基-3,4-二氢-5-氧杂-1,2a-二氮杂苊烯-6-基)嘧啶-2-基)氨基)四氢-2h-吡喃-3-醇3
[0209][0210]
第一步
[0211]
2-氯-7-环戊基-n,n-二(甲基-d3)-7h-吡咯并[2,3-d]嘧啶-6-甲酰胺3b
[0212]
氮气氛下,依次将化合物2-氯-7-环戊基-7h-吡咯并[2,3-d]嘧啶-6-羧酸3a(120mg,0.45mmol)、二甲基-d6-胺盐酸盐(59mg,0.68mmol)、o-(7-氮杂苯并三唑-1-基)-n,n,n
′
,n
′‑
四甲基脲六氟磷酸酯(34mg,0.09mmol)和n,n-二异丙基乙胺(145mg,1.12mmol)溶于2ml n,n-二甲基甲酰胺中。室温下反应2小时。反应液直接用c-18反相色谱法纯化得到标题化合物3b(80mg,产率:59%)。
[0213]
ms(esi)m/z 299.2[m h]
[0214]
第二步(3s,4r)-4-((5-氟-4-((s)-8-氟-2,3-二甲基-3,4-二氢-5-氧杂-1,2a-二氮杂苊烯-6-基)嘧啶-2-基)氨基)四氢-2h-吡喃-3-醇3
[0215]
氮气氛下,依次将化合物3b(25mg,0.08mmol)、(3r,4r)-4-氨基-1-(甲磺酰)哌啶-3-醇(15.5mg,0.08mmol)、(s)-(-)-2,2
”‑
双(二苯膦基)-1,1
”‑
联萘(10mg,0.02mmol)、醋酸钯(4.5mg,0.02mmol)溶于2ml四氢呋喃中。加入碳酸铯(52mg,0.16mmol),80℃条件下反应1小时。反应液冷却至室温,过滤,收集滤液,减压浓缩后残余物用c-18反相色谱法纯化得到标题化合物3(4.8mg,产率:13%)
[0216]
ms(esi)m/z 457.4[m h]
[0217]1h nmr(400mhz,dmso-d6)δ8.55(s,1h),6.81(s,1h),6.47(s,1h),5.23(s,1h),4.71(q,j=8.7hz,1h),3.74
–
3.57(m,3h),3.50(d,j=12.2hz,1h),2.91(s,3h),2.82(t,j=11.1hz,1h),2.33(s,2h),2.16(d,j=12.9hz,1h),1.94(s,4h),1.67
–
1.55(m,2h),1.50(d,j=10.8hz,1h).
[0218]
测试例1、本公开化合物对细胞周期蛋白-依赖性激酶活性检测
[0219]
表1.实验仪器信息
[0220][0221]
表2.试剂信息
[0222]
试剂名称厂商货号adp-glo kinase assaypromegav9102cdk1/cyclin bproqinase0134-0135-1cdk2/cyclin a2invitrogenpv3267cdk2/cyclin ecarna04-165cdk4/cyclin d3carna04-165cdk6/cyclin d3carna04-107histone h1 proteinsignalchemh10-54natppromegav910bdmsosigmad841896-well platenunc249944384-well plategreiner784075palbociclibmcehy-50767
[0223]
1、实验步骤
[0224]
使用echo 550将化合物稀释液转移到测定板的每个孔中(784075,greiner)。密封测定板,以1000g离心测定板1分钟;在1x激酶缓冲液(由1体积的5x激酶缓冲液和4体积的蒸馏水及50um dtt制备得到)中准备2x酶,将2.5μl 2x酶加入384孔测定板,将板在1000g下离心30s,在室温放置10分钟。在1x激酶缓冲液中制备2x底物和atp混合物,加入2.5μl 2x底物和atp混合物开始反应。将板以1000g离心30秒,密封测定板,室温反应1小时。加入4μl adp-glo试剂,在室温下孵育40分钟,再加入8μl激酶检测试剂,在室温下孵育40分钟。
[0225]
在envision 2104读板器上读取每个孔发光信号。
[0226]
抑制百分率计算如下:抑制百分率=100-(cmpd信号-ave_pc信号)/(ave_vc信号-ave_pc信号)
×
100。
[0227]
使用graphpad 8.0通过将抑制百分率值和化合物浓度的对数拟合为非线性回归(剂量响应
–
可变斜率)来计算ic
50
。
[0228]
y=bottom (top-bottom)/(1 10^((logic50-x)*hillslope))
[0229]
x:抑制剂浓度的对数;y:%抑制。
[0230]
测得的ic
50
值见表31。
[0231]
表31.本公开化合物对细胞周期蛋白-依赖性激酶活性
[0232]
编号cdk4/d3cdk6/d3
palbociclib6.57.2化合物116.7397.5化合物24.155.2化合物33.7/
[0233]
注:/表示未检测。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。